BAB II
TINJAUAN PUSTAKA 2.1 Epidemiologi
Globocan 2012, versi baru dari Badan Internasional untuk Penelitian Kanker (IARC), merupakan badan khusus kanker dari Organisasi Kesehatan Dunia (WHO), merilis data terbaru tentang kejadian kanker, kematian akibat kanker diseluruh dunia. Untuk 28 jenis kanker di 184 negara di seluruh dunia. Angka kejadian kanker payudara telah meningkatdi sebagian besar wilayah dunia, tetapi ada kesenjangan besar antara negara kaya dan miskin.Tingkat insiden tetap tertinggi didaerah yang lebih maju, namun kematian relatif jauh lebih tinggi di negara kurang berkembang karena pergeseran gaya hidup khas negara-negara industri menyebabkan meningkatnya kanker yang berhubungan dengan reproduksi, diet, dan faktor resiko hormon serta kurangnya deteksi dini dan akses fasilitas pengobatan. (Globocan 2012).
Di Indonesia diperkirakan 133,52 kasus kanker per 100.000 orang dewasa pada tahun 2012, dan diperkirakan 299.673 kasus secara total. Kanker payudara menyumbang sekitar 9% penyebab kematian pada wanita di kawasan Asia-Pasifik secara keseluruhan, peringkat keempat setelah paru-paru, hati dan lambung. Di Indonesia diperkirakan sekitar 22% wanita meninggal akibat kanker payudara. Beberapa negara lainnya di Asia–Pasifik lainnya diantaranya Fiji, Kepulauan Solomon (27% ), Malaysia (25%), Filipina (23%), Kaledonia Baru, Vanuatu (21%), Singapura (20%) dan Samoa (13%) dan yang kedua yang paling sering di Guam (19%), Polinesia Prancis (18%), Brunei
(17%), Australia, Selandia Baru (keduanya16%), Papua Nugini, Timor Leste (15%) dan Korea Utara (
2.2. Sistem Imun Tubuh
12%). (Globocan, 2012).
Telah diketahui bahwa proliferasi dan maturasi atau diferensiasi sel normal diatur secara ketat oleh sejumlah proto-onkogen yang merangsang pertumbuhan dan berbagai anti-onkogen atau gen supresor tumor yang menghambat pertumbuhan. Aktivasi proto-onkogen secara berlebihan dapat terjadi melalui perubahan struktur gen, translokasi kromosom, peningkatan ekspresi gen atau mutasi pada elemen-elemen yang mengontrol ekspresi gen bersangkutan. Mutasi demikian sering tampak pada sel-sel yang berproliferasi secara aktif. Proliferasi berlebihan dapat dicegah oleh gen supresor yang menghambat pertumbuhan, namun inaktivasi dan/atau mutasi gen supresor menyebabkan hilangnya fungsi supresi pertumbuhan. Amplifikasi onkogen dan/atau inaktivasi gen supresor yang terlibat dalam regulasi pertumbuhan sel mengakibatkan hilangnya kontrol pertumbuhan dengan risiko terjadinya transformasi ganas. Perubahan genetik ini menghasilkan populasi sel dengan sifat-sifat pertumbuhan tidak terkendali, yang merupakan ciri-ciri sel kanker dan memiliki kemampuan menginvasi jaringan normal di sekitarnya serta kemampuan bermetastasis dan tumbuh di tempat yang letaknya jauh dari jaringan asal. ( Hornychova, 2008).
Di samping mengekspresikan molekul-molekul yang menentukan sifat ganas, sel-sel kanker juga menunjukkan disregulasi gen yang produknya tidak secara langsung berhubungan dengan sifat pertumbuhan dan sifat invasif sel. Disregulasi genetik itu di antaranya menyebabkan perubahan ekspresi berbagai molekul permukaan, gangguan transkripsi dan translasi berbagai molekul protein
intraseluler maupun berbagai substansi yang disekresikan, sehingga sel atau jaringan tumor yang pada dasarnya berasal dari jaringan sendiri, menjadi asing atau imunogenik. Karena itu, sebenarnya sistem imun yang normal harus mampu mengenali sel-sel abnormal tersebut dan memusnahkannya. Fungsi sistem imun adalah fungsi protektif dengan mengenal dan menghancurkan sel-sel abnormal itu sebelum berkembang menjadi tumor atau membunuhnya jika tumor itu sudah tumbuh. Peran sistem imun ini disebut immune surveillance. Beberapa bukti yang mendukung bahwa ada peran sistem imun dalam melawan tumor ganas diperoleh dari beberapa penelitian, di antaranya yang mendukung teori itu adalah: (1) banyak tumor mengandung infiltrasi sel-sel mononuklear yang terdiri dari sel T, sel NK, dan makrofag; (2) tumor dapat mengalami regresi secara spontan; (3) tumor lebih sering berkembang pada individu dengan imunodefisiensi atau bila fungsi sistem imun tidak efektif, bahkan imunosupresi seringkali mendahului pertumbuhan tumor; (4) di lain pihak, tumor seringkali menyebabkan imunosupresi pada penderita. Bukti lain yang juga mendukung bahwa tumor dapat merangsang sistem imun adalah ditemukannya limfosit berproliferasi dalam kelenjar getah bening yang merupakan draining sites dari pertumbuhan tumor disertai peningkatan ekspresi MHC (major histocompatibility complex) dan ICAM (intercellular adhesion molecule) yang mengindikasikan sistem imun yang aktif. Walaupun diyakini bahwa sistem imun dapat memberikan respon terhadap pertumbuhan tumor ganas, pada kenyataannya banyak tumor ganas yang tetap bisa tumbuh karena immune surveillance terhadap tumor ganas ini relatif tidak efektif. Pengetahuan tentang peran sistem imun spesifik maupun non spesifik dalam mencegah pertumbuhan tumor spontan dan bagaimana memodulasinya
diduga akan memegang peran penting di kemudian hari dalam meningkatkan surveillance terhadap tumor, menginduksi resistensi terhadap sisa sel ganas dan kekambuhan tumor, menghambat perkembangan tumor selanjutnya, dan dalam menentukan jenis pengobatan. (Nyoman B, 2010).
Sistem imun adalah semua mekanisme yang digunakan untuk mempertahankan keutuhan tubuh sebagai perlindungan terhadap bahaya yang dapat ditimbulkan oleh berbagai bahan dalam lingkungan kita. Pertahanan tersebut terdiri atas sistem imun spesifik (adaptive/acquired) dan non-spesifik (natural/innate). Respon imun spesifik tergantung pada adanya pemaparan benda asing, pengenalan, kemudian reaksi terhadapnya. Sebaliknya, respon imun non-spesifik terjadi sesudah pemaparan insial dan pemaparan lanjutan terhadap benda asing. Kemudian terjadi diferensiasi selektif self dan self di mana respon non-spesifik ini tidak tergantung pada pengenalan non-spesifik. Respon imunologik menjalankan tiga fungsi yaitu pertahanan, homeostasis, dan pengawasan. (Herbermen, 1993).
Fungsi pertama sistem imun adalah pertahanan melawan invasi mikroorganisme yang telah mengisi renungan ahli imunologi lebih dari 100 tahun yang lalu. Jika elemen pertahanan seluler berhasil menyebar, maka hospes akan muncul sebagai pemenang dalam perjuangan melawan mikroorganisme. Akan tetapi, apabila elemen-elemen ini hiperaktif, tanda-tanda tertentu yang tidak diinginkan seperti alergi dan hipersensitifitas akan muncul. Sebaliknya, apabila elemen-elemen ini hipoaktif, kerentanan terhadap infeksi ulang akan bertambah seperti terlihat pada penyakit defisiensi imun. (Nyoman, 2001).
Fungsi kedua sistem imun adalah homeostasis. Homeostasis ini mempertahankan fungsi degenerasi dan katabolik normal dari isi tubuh dengan pembersihan elemen-elemen sel yang rusak seperti eritrosit dan lekosit dalam sirkulasi. Elemen-elemen sel ini mungkin rusak selama perjalanan hidup normal atau sebagai akibat yang merugikan. Contoh penyimpangan homeostasis adalah penyakit autoimun di mana mekanisme homeostasis pada penyakit ini terlalu ditingkatkan.
Fungsi ketiga dari sistem imun adalah fungsi pengawasan diri (surveillance). Fungsi pengawasan ini memonitor pengenalan jenis-jenis sel abnormal yang secara tetap selalu timbul dalam tubuh. Sel-sel mutant ini dapat terjadi secara spontan atau disebabkan oleh pengaruh virus-virus tertentu atau zat-zat kimia. Sistem imun diberi tugas pengenalan dan pembuangan benda-benda baru yang didapat, yang sebagian besar dari tugas ini terjadi di permukaan sel. Kegagalan mekanisme ini ditetapkan sebagai penyebab utama perkembangan penyakit-penyakit neoplasma. (Nyoman. 2001).
2.3.Immune Survelence
Konsep immune surveillance dikembangkan pertama kali oleh Paul Ehrlich pada awal abad ke-20 dan dikembangkan lebih lanjut oleh Burnet dan Thomas pada tahun 1950 dan 1960-an. Konsep itu menyatakan bahwa sistem imun mempunyai peran mencegah dan membatasi pertumbuhan tumor. Bila konsep immune surveillance itu benar, maka sel-sel efektor seperti limfosit B, helper, T-sitotoksik, dan sel NK harus mampu mengenal antigen tumor dan memperantarai kematian sel-sel tumor. Walaupun hanya ada sedikit bukti langsung bahwa
immune surveillance dapat melindungi seseorang terhadap pertumbuhan tumor, beberapa hasil penelitian mendukung teori tersebut. Seperti telah diuraikan di atas, individu dengan immunodefisiensi lebih peka terhadap pertumbuhan tumor, adanya infiltrasi limfosit dalam jaringan tumor dan tumor dapat membangkitkan respon imun seluler. Selanjutnya, telah terbukti bahwa tumor dapat membangkitkan respon imun seluler spesifik, dan bahwa antigen tumor yang dapat dikenal oleh sel T-sitotoksik melalui MHC kelas I diidentifikasi sebagai protein seluler yang diekspresikan secara abnormal atau protein mutant. Penemuan ini mendukung dugaan bahwa fungsi sel T-sitotoksik adalah surveillance dan menghancurkan sel yang mengandung gen mutant yang dapat menyebabkan atau diasosiasikan dengan tumor ganas. (Formentti, 2010).
Dari berbagai indikasi di atas, disusun hipotesis yang menyatakan bahwa: (1) sel-sel tumor mempunyai struktur permukaan yang dapat dikenal oleh satu atau lebih efektor sistem imun; (2) sel-sel tumor peka terhadap lisis atau hambatan pertumbuhan oleh satu atau lebih mekanisme efektor; (3) satu atau lebih efektor yang relevan harus mampu masuk ke daerah di mana tumor itu tumbuh; (4) peningkatan kemampuan mekanisme efektor yang relevan akan menurunkan insiden tumor atau metastasis; (5) penekanan mekanisme efektor yang relevan baik oleh karsinogen atau tindakan imunosupresif akan meningkatkan insiden tumor atau metastasis; (6) perbaikan aktivitas efektor yang tertekan akan mengurangi insiden tumor dan metastasis. Walaupun demikian, immune surveillance ternyata tidak selalu efektif. Hal itu dibuktikan dengan seringnya dijumpai tumor lethal pada individu-individu yang imunokompeten. Karena itu,
timbul dugaan bahwa respon imun terhadap tumor lemah atau mungkin juga imunogenitas tumor yang lemah. (Formentti, 2010).
2.4 Imunogenitas Tumor
Beberapa karakteristik antigen tumor dan respon imun terhadap tumor yang penting diketahui untuk dapat mengerti tentang imunologi tumor dan mengatur strategi terapi imun untuk kanker, yaitu: (Heberman, 1993).
1. Tumor mengekspresikan antigen yang dikenal sebagai benda asing oleh sistem imun pejamu. Sebagai contoh, secara histologik tumor dikelilingi oleh sel-sel mononuklear yang terdiri atas limfosit T, sel NK, dan makrofag, serta limfosit dan makrofag yang teraktivasi dalam sistem kelenjar getah bening. Adanya infiltrasi limfosit di sekitar sel tumor pada melanoma maligna dan kanker serviks merupakan faktor prediktif untuk prognosis yang lebih baik.
2. Respon imun sering gagal dalam mencegah pertumbuhan tumor. Beberapa sebab mengapa imunitas anti tumor tidak dapat mengeradikasi sel-sel yang mengalami transformasi adalah:
a. Sel-sel tumor berasal dari pejamu, maka dalam beberapa hal menyerupai sel-sel normal, sehingga hanya sebagian kecil antigen tumor yang dikenal sistem imun sebagai non-self, sehingga bersifat imunogenik lemah. Secara umum tumor yang menimbulkan respon imun kuat adalah tumor yang mengekspresikan antigen asing atau protein yang mengalami mutasi, atau tumor akibat induksi oleh karsinogen poten pada binatang percobaan sehingga menyebabkan mutasi gen normal.
b. Pertumbuhan cepat dan penyebaran tumor melebihi kapasitas sistem imun untuk mengeradikasi tumor.
c. Berbagai tumor mempunyai mekanisme khusus untuk menghindar dari respon imun.
d. Sistem imun dapat distimulasi untuk membunuh sel-sel tumor secara efektif sehingga dapat mengeradikasi tumor. Kemampuan ini yang digunakan pada terapi imun terhadap tumor.
Walaupun tumor berasal dari jaringan sendiri, tumor pada umumnya mengekspresikan antigen yang dikenal oleh sistem imun sebagai antigen asing. Ekspresi antigen tumor pada umumnya menggambarkan perubahan material genetik akibat transformasi sel, tetapi mekanisme molekuler yang menghasilkan antigen tumor itu bermacam-macam. Seperti telah disinggung dalam uraian di atas, keasingan antigen tumor disebabkan adanya mutasi dan disregulasi gen yang menyebabkan diproduksinya protein baru (neoantigen) yang tidak pernah diekspresikan dalam keadaan normal, atau pada tumor yang disebabkan virus onkogenik, biasanya diekspresikan protein virus. Produk gen yang mutasi atau yang mengalami disregulasi, maupun produk gen virus dikenal oleh sel T dan sel B sebagai benda asing, karena produk-produk itu tidak pernah dijumpai oleh sel-sel limfosit tersebut pada jaringan sendiri sebelum tumor tumbuh. Mungkin juga produk gen mutant itu diekspresikan dengan kadar yang sangat rendah sehingga tidak dapat menginduksi self-tolerance. Molekul-molekul protein itu dapat merangsang respon imun spesifik atau berfungsi sebagai sasaran bagi sel-sel efektor respon imun non-spesifik, misalnya sel NK. (Abbas AK, 1994).
Namun demikian, imunogenitas tumor sangat tergantung pada bagaimana tumor itu terbentuk. Berbagai percobaan pada hewan menunjukkan bahwa tumor yang terbentuk akibat karsinogen pada umumnya imunogenik. Spesifisitas dan
sifat imunogenitasnya juga tergantung pada potensi karsinogen penyebab transformasi sel dan interaksi karsinogen dengan sel sasarannya, dan tidak tergantung pada sel dari mana tumor itu berasal. Di samping imunogenik, jumlah idiotip antigen pada permukaan tumor ini banyak sekali, walaupun tumor itu terdiri atas satu jenis sel. Di lain pihak, apabila karsinogen yang sama menimbulkan dua jenis tumor primer yang berbeda pada hewan percobaan yang sama, kedua jenis antigen pada permukaan tumor tidak menunjukkan spesifisitas yang sama dan tidak bereaksi silang. Tumor yang terbentuk akibat infeksi retrovirus juga bersifat imunogenik, karena sel yang mengalami transformasi akan memunculkan antigen baru pada permukaannya, yang terbentuk dari antigen virion dan antigen produk gen virus yang berintegrasi dengan gen pejamu. Berbeda dengan tumor yang diinduksi oleh karsinogen kimia, tumor yang diinduksi oleh virus yang sama akan menampilkan antigen permukaan yang sama dan bereaksi silang apapun asal selnya, sedangkan imunogenitas tumor jaringan yang sama akan berbeda apabila masing-masing diinduksi oleh virus yang berbeda. Kanker spontan, yaitu kanker yang timbul akibat mutasi atau transformasi genetik tanpa diketahui penyebab eksternalnya umumnya tidak imunogenik. Kalaupun ada, sifat imunogenitasnya sangat rendah. (Abbas AK. 1994).
2.5. Antigen Tumor
Berbagai jenis antigen tumor pada manusia maupun hewan yang dapat dikenali oleh limfosit B dan limfosit T telah banyak teridentifikasi. Pada percobaan mencit digunakan methylcholanthrene (MCA) untuk menginduksi sarkoma dan ternyata
ditemukan adanya respon imun pada mencit tersebut. Pada manusia juga telah ditemukan antigen tumor, walaupun tidak terbukti dapat memberikan efek imun protektif. Walaupun demikian hasil identifikasi antigen tumor penting untuk dipakai sebagai komponen vaksin. (Nyoman Budiono, 2010).
Klasifikasi antigen tumor didasarkan pada ekspresinya, yaitu:
1. Tumor-spcific antigen (TSA) yaitu antigen yang mengalami over-ekspresi pada sel-sel tumor, tetapi tidak pada sel-sel normal. Beberapa antigen ini spesifik atau unik untuk jenis tumor tertentu.
2. Tumor-associated antigen (TAA) yaitu antigen tumor yang selain diekspresikan oleh sel-sel tumor juga diekspresikan oleh sel-sel tumor.
2.5.1. Produk Gen Yang Mengalami Mutasi
Berbagai antigen tumor diproduksi oleh onkogen mutant dari gen sel-sel normal. Tumor mengekspresikan produk yang diperlukan untuk transformasi ganas atau untuk memelihara fenotif ganas. Produk ini biasanya dihasilkan akibat mutasi titik atau delesi gen, translokasi kromosom atau insersi gen virus pada proto-onkogen atau gen supresor tumor sehingga membentuk onkogen. Produk mereka disintesis dalam sitoplasma sel-sel tumor dan dapat mengikuti jalur kelas I antigen processing dalam antigen presenting cells (APC) yang telah memfagositosis sel-sel tumor mati. Karena produk ini tidak ada dalam sel-sel-sel-sel normal, maka tidak menginduksi self-tolerance, dan peptida yang terbentuk dapat menstimulasi respon sel T pada pejamu. (Gallon C, 2013).
Penderita kanker mempunyai CD4+ dan CD8+ yang dapat merespon produk onkogen yang mengalami mutasi seperti Ras, p53, dan Bcr-Abl. Selanjutnya imunisasi dengan protein Ras atau p53 yang mutasi akan
menginduksi CTL (cytotoxic T-lymphocyte) dan respon penolakan terhadap tumor yang mengekspresikan mutant. Walaupun demikian, pada beberapa tumor protein ini tidak merupakan target mayor CTL yang spesifik pada pasien. (Gallon .C, 2013).
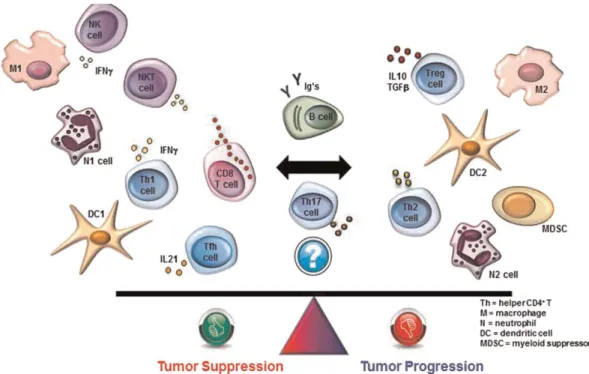
2.6. Komposisi dan Peranan Imunitas Menginfiltrasi Kanker Payudara sel imun infiltrasi tumor sering diamati, namun komposisi dari sel imun innate maupun adaptive yang terlibat bervariasi anatara jenis tumor atau tempat organ. (Dankert 2010). Data kumulatif dari penelitian Murin dan Human mengenai subset leukosit yang predominan berkontribusi dalam aktivitas pro atau antitumor (gambar 1). Model murine mengidentifikasi myeloid yang merupakan turunan dari leukosit, termasuk makrofag, sel dendrite dan supressor myeloid derived merupakan sel sel yang berperan dalam membentuk lingkungan mikro melalui factor yang diproduksi baik menstimulasi sistem imun anti tumor maupun lingkungan mikro yang mempromosikan penyembuhan luka anti tumor (wound healing tumor-promoting microenvironment) pada saat tersebut T sel anti tumor bisa menjadi aktif ataupun mensuprei. (Damaria, 2010).
Dalam perubahannya depolarisasi makrofag menjadi protumorigenic M2 atau fungsi fenotipe anti tumor M1 hal ini di atur oleh Limfosit T. Studi pada manusia telah menunjukkan hubungan yang signifikan antara keberadaan subset spesifik sel imun dan respon klinis pada pasien dengan berbagai tumor padat. Berdasarkan evidence menduga bahwa adaptive imunity yang dimediasi sel limfosit T atau B mendukung fondasi inti dalam efektifitas dan respon anti tumor. Pada kanker payudaara infiltrasi tumor yang luas oleh sitotoksik sel
CD8+ sel T berkaitan erat dengan kelangsungan hidup pasien dan respon terapi. Kehadiran CD4+ sel T regulator (Treg) telah dikaitkan dengan baik dan buruk terhadap respon tumor. Diantara sel CD 4- dan sub populasi dari sel T lainnya, sel Th 1 (sumber sel imun dari interferon –γ), memiliki hubungan yang yang menguntungkan dalam clinical outcome. sedangkan sel Th2 telah dilaporkan terkait dengan peredam dari respon antitumor. Sel Th17, merupakan produsen proinflamasi interleukin 17 family sitokin, tampaknya memiliki efek variable tergantung pada lingkungan sitokin sekitarnya, yang mungkin dihubungkan dengan situs organ dan jenis tumor. Adanya sel follicular helper, sub bagian terbaru dari CD4+, memberikan hubungan yang positif terhadap hasil pada pemberian kemoterapi adjuvant maupun neoadjuvant. Peranaan sel limfosit B saat ini tidak didefinisikan dengan baik dan masih kontroversial. Mengingat heterogenitas fungsiona llimfosit intra tumoral itu adalah menarik bahwa tingkat infiltrasi limfositik dinilai dengan evaluasi sederhana melalui preparat tumor dengan pewarnanaan hematoxylin dan eosin (H & E), merupakan faktor prediksi dan prognosis pada tripel negatif dan HER2 positif, penjelasan yang memungkinkan mengenai regulasi imun negatif adalah adanya bagian dari normal umpan balik untuk respon aktifasi anti tumor dan berkelanjutan, oleh karena itu berpotensi mendefenisikan tumor yang lebih imunogenik. Pertimbangan ini memiliki beberapa implikasi penting, pertama bahwa subset masing masing individu yang memiliki keterbatasan,misalnya imunitas terlalu rendah atau tidak adanya infiltrasi treg mencerminkan tumor yang diabaikan oleh sistem kekebalan tubuh sementara t-reg tinggi pada tumor mengakibatkan sinyal aktif, berhasil pada upaya penolakan tumor. Kedua, kaya til dan miskin til masing-masing
mencerminkan sifat biologi sel tumor yang sangat berbeda terhadap kerentanan imunoterapi, pada akhirnya, pada tils yang moderat hingga yang eksentif kehadiran peritumoral atau tumor limfosit stroma dapat dilihat pada beberapa pasien. (Mahmoud .BM 2010).
Meskipun ketidakmampuan sistem kekebalan tubuh untuk menolak tumor yang terdeteksi secara klinis, respon imun yang terorganisir pada tempat tumor menyebabkan kemungkinan adanya sinyal generasi memori imunologi dengan potensi untuk secara efektif mengendalikan penyakit sisa. (Almendro.V 2014). Variabilitas juga telah terdeteksi dalam individu tumor diduga bahwa sifat interaksi tumor-imun mungkin heterogenitas tumor paralel. Pemberian terapi sitotoxic seperti kemoterapi dan radioterapi bisa sebagai sistem pendongkrak awal. Anti respon immune anti tumor yang lebih kuat langsung mengarah ke jangkauan yang lebih luas dari antigen kanker payudara yang berpotensi tinggi dalam mengontrol heterogenitas populasi sel ganas yang ada pada tumor primer yang luas dan terdapat metastasis. Hipotesis ini didukung oleh penelitian yang menunjukkan bahwa tingkat limfosit infiltrasi adalah prediksi dari respon lokal yang lebih baik terhadap pengobatan neoadjuvant dan prognostik jangka panjang dalam pengendalian penyakit. (Damaria 2001).
Tampak seluler cross-talk subbagian yang berbeda dari leukosit dan kontribusi sel dominan terhadap aktivitas baik pro atau antitumor, termasuk myeloid lineage leukocytes, makrofag tumor terkait dengan baik protumorigenic (M2) atau antitumorigenic (M1), subset sel T helper, sitotoksik sel T, sel T regulator, sel B, sel dendritik dan sel supressor myeloid yang diturunkan. Sel-sel ini memainkan peran sentral dalam membentuk lingkungan mikro melalui faktor yang mereka hasilkan yang mengontrol baik sebagai mediator imun anti atau protumor. (Damaria 2010).
Gambar 2.1. Tumor Infiltrasi limfosit pada kanker
2.7. Sitotoksisitas Sel imun Terhadap Tumor a) Sitotoksitas melalui sel T
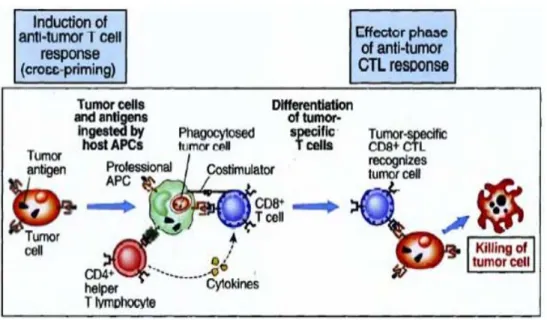
Subpopulasi limfosit T, limfosit T-helper dan T-sitotoksik sama-sama berperan dalam mengeliminasi antigen tumor. Sel yang mengandung antigen tumor akan
mengekspresikan antigennya bersama molekul MHC kelas I yang kemudian membentuk komplek melalui T-Cell Receptor (TCR) dari sel T- sitotoksik (CD8+), mengaktifasi sel T-sitotoksik untuk menghancurkan sel tumor tersebut. Sebagian kecil sel tumor juga mengekspresikan antigen tumor bersama molekul MHC kelas II, sehingga dapat dikenali dan membentuk komplek dengan limfosit T-helper (Sel T CD4+) dan mengaktivasi sel T-helper terutama subset Th1 untuk menseTNF sel tumor untuk lebih banyak lagi mengekspresikan molekul MHC kelas I, sehingga akan lebih mengoptimalkan sitotoksisitas dari sel T-sitotoksik (CD8+). Konsep ini diaplikasikan dalam pengobatan tumor menggunakan Tumor Infiltrating Lymphocytes (TIL), yaitu sel-sel mononuklear yang berinfiltrasi menuju ke sekitar jaringan tumor padat karena adannya reaksi inflamasi, sel tersebut diperbanyak secara kultur in vitro dengan penambahan IL-2.( Kresno 2011).
Gambar 2.2. Induksi respon sel T terhadap Tumor 19
b) Sel Natural Killer
Sel NK berukuran sedikit lebih besar dari pada sel limfosit kecil, berjumlah 10-15% limfosit darah perifer. Secara morfologi sel NK termasuk dalam populasi Large Granular Lympocyte (LGL). Granular Ini terdiri atas granula sitotoksik dari sitoplasma yang dikeluarkan saat aktivitas sitotoksik. Sel NK dapat berperan dalam respon imun spesifik maupun non spesifik. Sel NK merupakan sel efektor terhadap sitotoksisitas spontan berbagai jenis sasaran, tidak memiliki sifat klasik dari makrofag, granulosit maupun CTL dan sitotoksisitasnya tidak tergantung pada MHC. Mekanisme lisis yang digunakan sama dengan yang dilakukan oleh CTL yaitu dengan mengeluarkan perforin dan granzym yang menyebabkan sel kanker lisis, mengeluarkan IFN sehingga meningkatkan kerja fagositosis makrofag, melakukan recognition dengan sel kanker dengan perantara FAS Ligan terhadap sel kanker yang telah diopsonisasi sehingga sel kanker diprogram apoptosis. (Fin Oj. 2008, Kresno 2011)
Sel NK tidak mengeluarkan TCR dan merupakan CD3 negatif. Sebagai gantinya sel NK mengeluarkan 2 tipe reseptor yang memperkuat kemampuannya membunuh sel kanker dan sel yang terinfeksi virus, yaitu reseptor pengaktivasi yang masih mengenali molekul yang dilingkupi oleh penyakit pada sel target dan Killer Inhibitor Receptor (KIR) yang menghambat sitolisis NK melalui pengenalan terhadap molekul MHC I-nya sendiri. Sel NK tidak melisiskan sel berinti yang sehat karena semuanya mengeluarkan MHC I. Jika infeksi virus dan atau perubahan neoplastik mengurangi pengeluaran MHC I normal, sinyal KIR akan terganggu dan terjadilah lisis. Disisi lain sel NK juga mengekspresikan
CD56 yaitu suatu molekul yang mampu mempromosikan adhesi intraseluler. Sel NK mempunyai reseptor untuk bagian tetap dari IgG yang menjadikannya sitotoksisitas tergantung antibody dependent sellular cytotoxicity (ADCC). Antigen yang diopsonisasi oleh IgG akan dikenali oleh sel NK untuk dilisiskan. Aktivitas ADCC ini penting untuk efek terapeutik optimal dari antibodi monoklonal tumor spesifik. Pada penelitian-penelitian terakhir mengungkapkan bahwa pengikatan sel NK terhadap sel sasaran dapat terjadi melalui sel reseptor khusus yang berbeda dengan Fc yaitu reseptor NKRPI, yang mengikat molekul semacam lektin. Kemampuan sel ditingkatkan oleh IFN , IL-2, IL-12, sehingga peran anti tumor sel NK bergantung pada rangsangan yang terjadi secara bersamaan pada sel T dan makrofag yang memproduksi sitokin tersebut. IFN mengubah sel pre-NK menjadi sel NK. Aktivitas sel NK sering dihubungkan dengan prognosis karena sel NK mempunyai peran penting dalam mencegah metastasis dengan mengeliminasi sel tumor dalam sirkulasi. Hal ini dibuktikan dengan adanya penelitian yang mengungkapkan bahwa 90%-99% sel tumor yang dimasukkkan intravena akan hilang dalam 24 jam. (Fin. 2008; Kresno 2011)
c) Sitotoksisitas melalui makrofag
Makrofag dapat berperan dalam melawan sel tumor dengan berperan sebagai Antigen Presenting Cell (APC) menghasilkan sitokin yang mengaktifkan sel imunitas lain dan bertindak langsung sebagai efektor dengan melisiskan sel tumor apabila sudah diaktivasi oleh Macrofage Activating Factor (MAF). (Fin. 2008; Kresno 2011)
Kemampuannya berikatan dengan sel tumor karena makrofag juga mempunyai reseptor Fc yang mampu bekerjasama dengan IgG. Penyebab sel tumor lisis akibat reaksi enzim lisosom, metabolit reaktif terhadap oksigen dan NO. Makrofag juga aktif mensekresi TNF, IL-12 yang berperan memacu proliferasi dan aktivasi Sel T CD4+, CTL serta sel NK. TNF sesuai dengan namanya mampu melisiskan sel tumor dengan berikatan pada reseptor permukaan sel tumor dan menyebabkan nekrosis dari sel tumor dengan cara memobilisasi berbagai respon imun tubuh. Diakhir peristiwa imunitas dihasilkan debris-debris sisa penghancuran sel, selanjutnya peran makrofag yang membersihkan debris tersebut. Opsonisasi komplemen dan antibodi terhadap debris-debris tersebut membantu proses fungsi pembersihan makrofag. Akumulasi makrofag dalam tumor mungkin menggambarkan interaksi makrofag kompleks dari beberapa faktor dan juga kinetik produksi monosit oleh sumsum tulang. Jadi status fungsional makrofag dalam tumor juga berperan selain jumlahnya. (Fin, 2008).
2.8 Metode untuk penilaian TILs pada Kanker Payudara yang di Rekomendasi
Rekomendasi penilaian TILs dalam kanker payudara berdasarkan hasil rapat diskusi para peneliti TILs pada kanker payudara fase III, tahun 2013, untuk menyeragamkan standar penilaian TILs pada kanker payudara untuk yang dapat sebagai penuntun praktek klinis, penelitian ataupun clinical trial. Pewarnaan penuh dengan Hematoksilin eosin (HES) pada slide tumor primer dievaluasi sebagai persentase dari intratumoral (It) dan stromal (str) Tils sesuai dengan criteria yang direkomendasikan, kriteria terbaru yang
digunakan adalah TILs yang tinggi jika TIL intratumoral (It) dan Str-TIL ≥ 50% dan TILs yang Tinggi bila It TIL dan Str TIL < 50% nilai tersebut telah divalidasi sebagai cutoff (Dieci dkk 2015; Lois dkk 2013; Salgado 2014).
Standarisasi dan pedoman untuk penilaian tils (Gambar 2.3). TILs harus dilaporkan sebagai persentase. Jika persentase tils meragukan, diskusikan kasus dengan ahli patologi kedua. Dalam keheterogenan tumor, penilaan dalam region yang berbeda dilaporkaan dalam rata-rata. Untuk grafis standar ini, gambar dipilih yang dapat mewakili tingkat tils yang berbeda-beda, berdasarkan hasil dari tiga ahli patologi serta analisis gambar.
ing tumor-infiltrating lymph
2.9 TILs sebagai Faktor Prediksi dan Prognosis terhadap Respon Terapi Kemoterapi Neoadjuvant Pada kanker Payudara
Pemberian neoadjuvant kemoterapi secara sistemik memberikan kesempatan untuk penilaian yang relatif cepat dalam keberhasilan terapi dari rejimen yang diberikan. Pengaturan ini tidak hanya untuk mengevaluasi peran prediksi biomarker, termasuk tils, tetapi juga memungkinkan penilaian dari dinamika perubahan biomarker sebelum dan sesudah terapi. Pemberian kemoterapi sistemik pasien kanker payudara terkait dengan perubahan parameter laboratorium menunjukkan kekebalan sistemik. Parameter laboratorium menunjukkan aktivasi kekebalan sistemik, termasuk peningkatan konsentrasi neopterin, atau peningkatan jumlah T-limfosit. (Hornychova, 2008).
Dalam sebuah studi kohort pasien ukuran terbatas, jumlah intra-epitel CD3 + tils yang signifikan tinggi pada pasien dengan terapi neoadjuvant memiliki respon lengkap patologis. Pasien yang memiliki respon lengkap patologis juga memiliki sel dendritik secara signifikan lebih tinggi (CD83 +) pada sampel pre treatment. Peran potensial tils sebagai biomarker memprediksi respons lengkap patologis itu selanjutnya dikonfirmasi pada kohort yang jauh lebih besar sampelnya. (Melichar , Loi.S 2013; Loi.S 2014).
Hampir 1000 pasien pada penelitian persentase dari sarang tumor epitelial terdiri dari intratumoral limfosit yang merupakan faktor prediksi independen dalam pengaruhnya terhadap respon komplit patologis pada penelitian analisis multivariat pada respon patologis komplit dijumpai 40% pada pasien dengan tumor ditandai oleh infiltrasi limfositik yang tinggi, namun hanya 7,2% pasien tanpa infiltrat limfositik. Baru-baru ini, laporan lain telah
mengkonfirmasi peran prediksi tils pada pasien dengan kanker payudara yang menjalani kemoterapi neodjuvan. Dalam sebuah penelitian pada 68 pasien yang diobati dengan regimen anthracycline dan taxanebased. (Dankert, 2010).
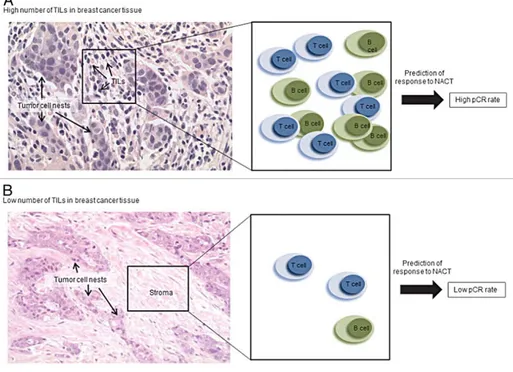
Yamaguchi dkk 2012, menemukan jumlah tils menjadi faktor prediktor yang signifikan terhadap respon lengkap patologis baik analisis secara univariat dan multivariat. Seperti disebutkan di atas, kehadiran tils berbeda menurut subtipe kanker payudara. meningkatnya kehadiran dari tils telah dilaporkan berhubungan dengan histologi duktal , high grade, tidak adanya ekspresi reseptor hormon dan ekspresi tinggi dari antigen proliferasi Ki67. Infiltrasi limfositik memiliki korelasi yang signifikan pada pasien dengan triple-negative dimana tingginya TILs semakin tingi rata-rata respon komplit patologinya. (Yamaguci, 2012).
Gambar 2.4 nilai prediktif TILs pada kanker payudara; , (A)
tingginya angka respon komplit patologi. (B) Sangat kontras pada tumor dengan TILs rendah menunjukan respon patologi komplit yang rendah.
( Yasmin, 2014).
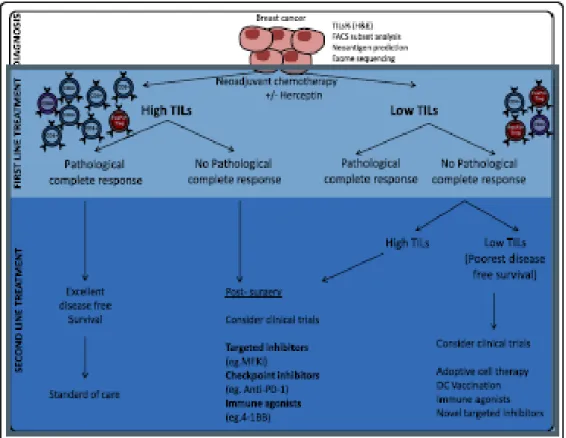
Penggunaan TILs dan respon terhadap kemoterapi neoadjuvant juga menjadi garis depan pedoman dalam mengambil keputusan mengenai penanganan kanker payudara. Adanya infiltrasi limfosit tumor dan respon kemoterapi neoadjuvant juga dapat digunakan pedoman dalam pemilihan terapi lini ke dua, pasien dengan TILs yang tinggi dan respon patologi komplit terhadap pemberian kemoterapi neoadjuvan memiliki prognosis yang baik. Dan tidak memerlukan intervensi lanjut selain dari pada penangan standar. Pasien dengan TILs yang tinggi namun respon patologisnya tidak komplit atau pasien dengan TILs yang rendah namun TILS yang meningkat setelah kemoterapi neoadjuvant mungkin menguntungkan dalam pemberian imunoterapi. Namun pasien dengan sedikit TILs sebelum dan sesudah kemoterapi neoadjuvan mendapatkan terapi tambahan atau stategi perbedaan strategi untuk menginduksi terhadap respon imun, seperti terapi seluler adoptive atau strategi vaksinasi. Inhibitor target harus dipertimbangkan untuk semua pasien yang sesuai. Namun dampak inhibitor target pada respon imun harus pertimbangan terapeutik. (Gunter 2012; Loi.S 2013).
Gambar 2.5 TIL dan respon terhadap terapi sebagai pedoman. penatalaksanaan kanker payudara.