commit to user
PENGGUNAAN Mg-Al/HIDROTALSIT-KF YANG DISINTESIS
DARI
BRINE WATER
TIRUAN SEBAGAI KATALIS
TRANSESTERIFIKASI MINYAK KELAPA SAWIT MENJADI
BIODIESEL
Disusun Oleh :
EVA ROMIYANI
M0306030
SKRIPSI
Diajukan untuk memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
HALAMAN PENGESAHAN
Jurusan Kimia Fakultas Matematika dan Ilmu pengetahuan Alam Universitas Sebelas
Maret telah mengesahkan skripsi mahasiswa :
Eva Romiyani NIM M0306030, dengan judul ” Penggunaan Mg-Al/Hidrotalsit-KF
yang disintesis dari Brine Water Tiruan sebagai Katalis Transesterifikasi Minyak Kelapa Sawit menjadi Biodiesel”.
Skripsi ini dibimbing oleh :
Pembimbing I Pembimbing II
I.F. Nurcahyo, MSi Prof. Dr. Karna Wijaya, M.Eng.
NIP. 19780617 200501 1001 NIP. 19631207 198803 1001
Dipertahankan di depan Tim Penguji Skripsi pada :
Hari : Senin
Tanggal : 18 Juli 2011
Anggota Tim Penguji :
1. Drs. Patiha, MS 1.
NIP. 19490103 198103 1001
2. Dr.rer.nat. Atmanto Heru Wibowo, M.Si 2.
NIP.19740813 200003 1001
Ketua Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sebelas Maret Surakarta
Dr. Eddy Heraldy, M.Si.
NIP. 19640305 200003 1002
commit to user
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “
PENGGUNAAN Mg-Al/HIDROTALSIT-KF YANG DISINTESIS DARI BRINE
WATER TIRUAN SEBAGAI KATALIS TRANSESTERIFIKASI MINYAK KELAPA SAWIT MENJADI BIODIESEL” belum pernah diajukan untuk
memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan
saya juga belum pernah ditulis atau dipublikasikan oleh orang lain, kecuali yang
secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Juli 2011
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
PENGGUNAAN Mg-Al/HIDROTALSIT-KF YANG DISINTESIS DARI
BRINE WATER TIRUAN SEBAGAI KATALIS TRANSESTERIFIKASI MINYAK KELAPA SAWIT MENJADI BIODIESEL
EVA ROMIYANI
Jurusan Kimia. Fakultas MIPA. Universitas Sebelas Maret
ABSTRAK
Telah dilakukan penelitian sintesis dan karakterisasi Mg-Al/hidrotalsit-KF dari brine water tiruan sebagai katalis transesterifikasi minyak kelapa sawit menjadi biodiesel. Penelitian ini bertujuan untuk mengetahui pengaruh variasi berat katalis dan waktu reaksi terhadap hasil transesterifikasi minyak sawit menjadi biodiesel. Al/Hidrotalsit disintesis dengan perbandingan mol Mg/Al 2:1. Katalis Mg-Al/Hidrotalsit digrinding dengan KF dengan perbandingan KF : Mg-Al/Hidrotalsit adalah 8/10. Transesterifikasi dilakukan dengan mereaksikan minyak kelapa sawit dengan metanol (1:12) dan katalis Mg-Al/Hidrotalsit-KF pada suhu 65 ºC. Reaksi dilakukan dengan memvariasi berat katalis 1, 2, 3, 4, dan 5 % (b/b minyak) dan variasi waktu reaksi 5, 15, 30, 60, dan 180 menit. Material hasil sintesis selanjutnya dikarakterisasi dengan XRD, TG-DTA, FT-IR, 1HNMR, and GC-MS. Analisis hasil transesterifikasi dari spektra 1HNMR diperoleh kondisi optimum pada berat katalis 1 % dan diperkirakan waktu reaksi optimumnya 150 menit dengan kandungan metil ester hampir 100 %.
Kata kunci : Mg-Al/Hidrotalsit-KF, brine water tiruan, transesterifikasi, biodiesel
commit to user
THE USE OF Mg-Al/HYDROTALCITE-KF SYNTHESIZED FROM ARTIFICIAL BRINE WATER AS TRANSESTERIFICATION CATALYST
OF PALM OIL INTO BIODIESEL
EVA ROMIYANI
Department of Chemistry. Mathematic and Science Faculty Sebelas Maret University
ABSTRACT
The research on the use of Mg-Al/Hydrotalcite-KF synthesized from artificial brine water as transesterification catalyst of palm oil into biodiesel has been done. The aims of research were to determine the variation influence of catalyst weight and reaction time on the transesterification of palm oil into biodiesel. Mg-Al/Hidrotalcite was synthesized with mole ratio of Mg / Al of 2:1. Mg-Al/Hidrotalcite catalyst was ground with KF by the ratio of KF: Mg-Al/Hidrotalcite 8/10. Transesterification was carried out being reacted between palm oil and methanol (1:12) with Mg-Al/Hidrotalcite-KF catalyst at 65 º C. Reaction was performed with variation of catalyst weight 1, 2, 3, 4, 5 % (wt/wt oil) and variation of reaction time 5, 15, 30, 60, 180 minutes. Product was characterized by XRD, TG-DTA, FT-IR, 1HNMR, and GC-MS. Analyzed transesterification product of 1HNMR spectra showed that optimum condition of reaction was reached when catalyst weight was 1 % (wt/wt oil) and optimum reaction time predicted was 150 minutes. In this condition methyl ester contain of almost 100%.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user MOTTO
¾ “Sesungguhnya hanya kepada Allah aku mengadukan kesusahan dan
kesedihanku.”
(Q.S. Yusuf: 86)
¾ “ Jagalah Allah, niscaya kamu akan dapati Dia dihadapanmu. Kenalilah Allah
ketika kamu dalam keadaan senang, niscaya Dia akan mengenalimu ketika kamu
dalam keadaan sulit. Dan ketahuilah, bahwa segala sesuatu yang luput darimu,
tidak akan pernah menimpamu dan segala sesuatu yang telah ditetapkan
menimpamu, tidak akan pernah luput darimu.”
(HR. Tirmidzi)
¾ “Tidaklah dunia itu dibanding dengan akhirat melainkan bagaikan salah seorang
kamu yang memasukkan jari tangannya ke dalam lautan, perhatikanlah yang
dibawa oleh jari itu?!”
(HR. Muslim)
commit to user PERSEMBAHAN
Karya ini kupersembahkan kepada:
Bapak & I bu yang tercinta
K akak-kakakku yang kusayang
K eponakan-keponakanku yang lucu ( I ffa, R eza,
N aufal, R aihan, R aisa, H asan, H usain, M aisa
dan Y ulva)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah Subhanahu Wa Ta’ala atas
segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan
judul “PENGGUNAAN Mg-Al/HIDROTALSIT-KF YANG DISINTESIS DARI
BRINE WATER TIRUAN SEBAGAI KATALIS TRANSESTERIFIKASI MINYAK KELAPA SAWIT MENJADI BIODIESEL”. Pada kesempatan ini penulis ingin
menyampaikan ucapan terima kasih kepada:
1. Bapak Ir. Ari Handono Ramelan, MSc., Ph.D. selaku Dekan FMIPA UNS.
2. Bapak Dr. Eddy Heraldy, M.Si. selaku Ketua Jurusan Kimia dan yang telah
membiayai penelitian ini.
3. Bapak I.F. Nurcahyo, M.Si. selaku pembimbing I sekaligus ketua Lab Dasar
Kimia FMIPA UNS.
4. Bapak Prof. Dr. Karna Wijaya, M.Eng. selaku pembimbing II.
5. Bapak Prof. Drs. Sentot Budi Raharjo, Ph.D selaku pembimbing akademik.
6. Bapak Dr. rer. nat. A. Heru Wibowo, MSi selaku Ketua Sub-Lab Kimia Pusat
UNS sekaligus sebagai pembimbing akademis
7. Ketua Lab Kimia Organik dan Lab Kimia Analitik FMIPA UGM.
8. Ketua Lab Akademi Teknologi Kulit (ATK).
9. Bapak-Ibu dosen Jurusan kimia FMIPA UNS.
10.Staf Laboratorium Kimia Dasar FMIPA UNS : Mbak Nanik dan Mas Anang.
11.Sahabat-sahabat tercinta FC club yang telah mengajarkan arti sebuah
persahabatan.
12.Adikku Anisya, terima kasih untuk kesabaran dan pengertiaannya.
13.Teman-teman Kimia FMIPA UNS angkatan 2006.
14.Semua pihak yang tidak bisa penulis sebutkan satu-persatu.
Semoga Allah SWT berkenan memberikan balasan yang lebih baik atas
pengorbanan yang diberikan. Amin.
commit to user
Penulis menyadari bahwa banyak kekurangan dalam penulisan skripsi ini.
Oleh karena itu, kritik dan saran yang membangun akan sangat membantu penulis
dalam memperbaikinya. Semoga karya kecil ini dapat memberikan manfaat bagi
perkembangan ilmu pengetahuan.
Surakarta, Juli 2011
perpustakaan.uns.ac.id digilib.uns.ac.id
BAB II. LANDASAN TEORI A. Tinjauan Pustaka 1. Pembuatan Air Laut Tiruan dan Komposisi Brine Water Tiruan… 5
2. Sintesis Hydrotalcite-Like (HTlc) ………... 6
3. Struktur dan Sifat Hydrotalcite ………... 6
4. Biodiesel ………. 9
5. Karakterisasi dan Analisis Hidrotalsit a. Spektroskopi Serapan Atom (SSA) ... 14
b. X-Ray Diffractometer (XRD) ... 15
c. Spektrofotometer IR (FTIR) ………. 17
commit to user
2. Sintesis Mg-Al/Hydrotalcite-Like (HTlc)... 26
3. KarakterisasiMg-Al/Hidrotalsit ... 26
4. Preparasi Katalis Mg-Al/Hidrotalsit-KF ... 27
5. Penentuan Bilangan Asam ... 27
6. Reaksi Transesterifikasi Minyak Sawit menjadi Biodiesel ... 27
7. Karakterisasi Biodiesel ... 28
E. Teknik Pengumpulan dan Analisis Data ... 28
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN A. Sintesis Mg-Al/Hidrotalsit dan Mg-Al/Hidrotalsit-KF ... 30
B. Karakterisasi Katalis ... 30
1. Identifikasi Senyawa Hasil Sintesis ... 30
2. Penentuan Kandungan Mg-Al/Hidrotalsit ... 35
C. Transesterifikasi Minyak Sawit ... 35
D. Analisis Hasil Biodiesel Menggunakan 1H NMR ... 36
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
2. Kemurnian Biodiesel dengan Variasi Berat Katalis ... 38
3. Penentuan Waktu Reaksi Optimum ... 39
E. Analisis Hasil Biodiesel Menggunakan FT-IR ... 39
F. Analisis Hasil Biodiesel Menggunakan GC-MS ... 40
BAB V. KESIMPULAN DAN SARAN A. Kesimpulan ... 42
B. Saran ... 42
DAFTAR PUSTAKA ... 43
LAMPIRAN-LAMPIRAN ………... 48
commit to user DAFTAR TABEL
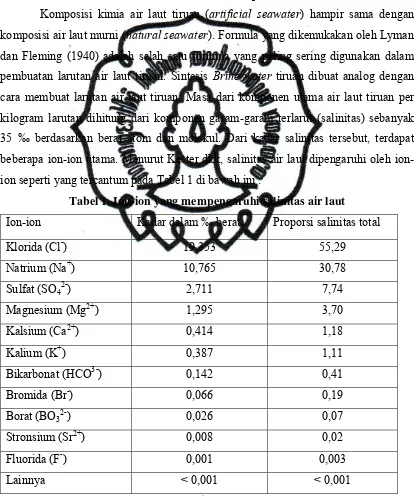
Tabel 1. Ion-ion yang Mempengaruhi Salinitas Air Laut ... 5
Tabel 2. Harga d Tiga Puncak Tertinggi Hasil Sintesis ... 31
Tabel 3. Perbandingan gugus fungsi Mg-Al/Hidrotalsit, Mg-Al/Hidrotalsit-KF,
KF dan referensi ... 33
Tabel 4. Perbandingan kemurnian biodiesel pada reaksi transesterifikasi
dengan katalis Mg-Al/Hidrotalsit-KF, Mg-Al/Hidrotalsit, dan KF ... 38
Tabel 5. Kandungan Senyawa dalam Biodiesel 5 % dengan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user DAFTAR GAMBAR
Gambar 1. Struktur Brucitedan Hidrotalsit ... 7
Gambar 2. Struktur Hidrotalsit dengan Anion Antar Lapisan ... 8
Gambar 3. Reaksi Esterifikasi dari Asam Lemak menjadi Metil Ester ... 11
Gambar 4. Reaksi Transesterifikasi dari Trigliserida menjadi Metil Ester Asam-Asam Lemak ... 11
Gambar 5. Mekanisme reaksi transesterifikasi pembentukan metil ester asam lemak dari triasilgliserol ... 12
Gambar 6. Difraktogram XRD Mg/Al-Hidrotalsit ... 17
Gambar 7. Spektrum 1H NMR Hasil Transesterifikasi Minyak Kedelai ... 21
Gambar 8. Difraktogram Difraktogram Mg-Al/Hidrotalsit dan Mg-Al/Hidrotalsit ... 31
Gambar 9. Spektra FT-IR Mg-Al/Hidrotalsit, Mg-Al/Hidrotalsit-KF dan KF ... 33
Gambar 10. Termogram Mg-Al/Hidrotalsit ... 34
Gambar 11. Spektra 1H NMR Biodiesel 1 % dengan Waktu Reaksi 3 Jam ... 37
Gambar 12. Pengaruh Berat Katalis terhadap Kemurnian Biodiesel ... 38
Gambar 13. Pengaruh Waktu Reaksi terhadap Kemurnian Biodiesel ... 39
Gambar 14. Spektra FT-IR Biodiesel 5 % dengan Waktu Reaksi 3 Jam ... 40
Gambar 15. Kromatogram Biodiesel 5 % b/b Minyak dengan Waktu Reaksi 3 Jam ... 41
commit to user DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Bilangan Asam ... 48
Lampiran 2. Data JCPDS Hidrotalsit ... 49
Lampiran 3. Difraktogram XRD dari Mg-Al/Hidrotalsit ... 50
Lampiran 4. Perbandingan Harga d Sampel Mg-Al/Hidrotalsit dengan Data JCPDS Hidrotalsit ... 51
Lampiran 5. Perhitungan Persentase Kandungan Mg-Al/Hidrotalsit ... 52
Lampiran 6. Difraktogram XRD dari Mg-Al/Hidrotalsit-KF ... 53
Lampiran 7. Spektra FTIR dari Mg-Al/Hidrotalsit ... 54
Lampiran 8. Spektra FTIR dari Mg-Al/Hidrotalsit-KF ... 55
Lampiran 9. Spektra FTIR dari KF ... 56
Lampiran 10. Termogram dan Kurva DTA Mg-Al/Hidrotalsit ... 57
Lampiran 11. Spektra 1H NMR ... 58
Lampiran 12. Spektra 1H NMR Biodiesel dengan Variasi Berat Katalis ... 61
Lampiran 13. Spektra FTIR biodiesel 5 % ... 63
Lampiran 14. Kondisi Alat Gas Spektrometer Massa (GC-MS) ... 64
Lampiran 15. Hasil kromatografi Gas Spektrometer Massa (GC-MS) dari Biodiesel 5 % dengan Waktu Reaksi 3 Jam ... 65
Lampiran 16. Fragmentasi senyawa 1 (metil ester tetradekanoat) ... 66
Lampiran 17. Fragmentasi senyawa 2 (metil ester heksadekanoat) ... 67
Lampiran 18. Fragmentasi senyawa 3 (metil ester 9-oktadekenoat) ... 69
Lampiran 19. Fragmentasi senyawa 4 (metil ester oktadekanoat) ... 71
Lampiran 20. Perhitungan ... 73
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Dalam proses desalinasi di PLTU, hanya 40 % air laut dapat diubah menjadi
air bersih, sedangkan 60 % sisanya yang disebut brine water yang mengandung kadar garam tinggi akan dibuang kembali ke laut sebagai limbah. Brine water tiruan mempunyai komposisi yang mirip dengan brine water asli yang berasal dari air laut (natural seawater). Sintesis Brine water tiruan dibuat analog dengan cara membuat larutan air laut tiruan yang formulanya dikemukakan oleh Lyman dan Fleming
(1940). Garam-garam utama yang terdapat dalam air laut tiruan dalam g/kg adalah
klorida (19,353), natrium (10,764), sulfat (2,701), magnesium (1,297), kalsium
(0,406), kalium (0,387) dan sisanya teridiri dari bikarbonat, bromida, asam borak,
stronsium dan florida. Kandungan Mg2+ dalam konsentrasi tinggi pada brine water
tiruan dapat dimanfaatkan untuk sintesis Mg-Al/Hidrotalsit.
Mg-Al/Hydrotalcite-like (HTlc) telah dikenal sebagai salah satu mineral yang menarik, prospektif dan menjanjikan karena dapat disintesis dengan mudah serta
berguna dalam berbagai aplikasi (Tong et. al., 2003). Dalam aplikasi HTlc sebagai
katalis dan atau prekusor lain, beberapa studi menunjukkan bahwa HTlc terkalsinasi
memiliki aktivitas moderat dalam reaksi transesterifikasi (Cantrell et. al., 2005; Xie
et. al., 2006). Shumaker et. al., (2007) menggunakan Li-Al/HTlc untuk mengkatalisis
minyak kedelai dengan metanol, dan Liu et. al., (2007) menggunakan Mg-Al/HTlc
terkalsinasi untuk mengkatalisis minyak poultry dengan metanol. Akan tetapi, dalam penelitiannya, katalis Mg-Al/HTlc dan juga oksida terkalsinasinya menunjukkan
aktivitas yang rendah selama reaksi antara minyak dan metanol pada temperatur
rendah (sekitar titik didih metanol) dibandingkan dengan Li-Al/HTlc. Untuk
memperbaiki keadaan ini, ke dalam Mg-Al/HTlc sering ditambahkan zat-zat aktif
agar aktivitas HTlc sebagai katalis akan semakin tinggi. Gao et. al., (2008) dalam
commit to user
reaksi transesterifikasi minyak sawit menjadi biodiesel telah mencampurkan KF pada
HTlc dan menghasilkan metil ester asam lemak mencapai 92 %.
Minyak sawit sebagai bahan baku pembuatan metil ester merupakan bahan
alternatif pengganti bahan bakar diesel dan termasuk sumber daya yang dapat
diperbaharui (renewable). Proses pengolahan dan pemanfaatan biodiselnya aman bagi manusia dan lingkungan karena minyak sawit dapat terbiodegradasi. Konversi
minyak sawit menjadi bentuk metil ester asam lemak atau biodiesel melalui reaksi
transesterifikasi minyak sawit dengan metanol serta penambahan katalis, baik katalis
basa maupun katalis asam.
Reaksi transesterifikasi dapat dikatalisis dengan katalis asam atau basa.
Katalis asam yang sering digunakan adalah asam sulfat dan asam klorida.
Penggunaan katalis asam membutuhkan waktu refluk yang sangat lama (48-96 jam),
perbandingan mol metanol yang dibutuhkan besar (30-150:1). Sedangkan katalis basa
yang sering digunakan adalah kalium hidroksida, natrium hidroksida dan
karbonatnya. Aktivitas katalis basa lebih cepat dibandingkan katalis asam, katalis
asam lebih korosif, katalis basa lebih disukai dan sering digunakan (Ilgen, 2007).
Mengingat belum adanya pemanfaatan brine water tiruan yang mengandung logam magnesium dalam konsentrasi yang tinggi serta potensi senyawa hydrotalcite-like yang cukup baik sebagai katalis, akan dilakukan penelitian sintesis dan karakterisasi Mg-Al/Hidrotalsit-KF dari brine water tiruan sebagai katalis transesterifikasi minyak kelapa sawit menjadi biodiesel.
B. Perumusan Masalah
1. Identifikasi Masalah
Rasio molar Mg/Al berpengaruh terhadap sifat kebasaan katalis. Semakin
basa suatu katalis maka semakin tinggi pula aktivitas katalisnya. Rasio molar Mg/Al
yang paling baik dalam katalis Mg-Al/Hidrotalsit adalah 2:1.
Katalis Mg-Al/Hidrotalsit menunjukkan aktivitas yang rendah selama reaksi
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
aktivitas Mg-Al/Hidrotalsit sebagai katalis adalah dengan menambahkan zat-zat aktif
seperti kalium fluorida (KF) ke dalam Mg-Al/Hidrotalsit. Rasio molar KF pada
katalis Mg-Al/Hidrotalsit-KF dapat berpengaruh pada perolehan hasil metil ester
dalam reaksi transesterifikasi. Rasio molar KF pada katalis Mg-Al/Hidrotalsit-KF
yang paling baik adalah 80 % berat/berat Mg-Al/Hidrotalsit .
Reaksi transesterifikasi dipengaruhi oleh beberapa faktor yaitu, berat katalis,
perbandingan mol metanol/minyak, waktu reaksi, dan temperatur reaksi. Kenaikan
persentase berat katalis akan menyebabkan kenaikan konversi metil ester. Kenaikan
persentase berat katalis Mg-Al/Hidrotalsit-KF akan meningkatkan laju reaksi
transesterifikasi pembentukan metil ester. Laju reaksi pembentukan metil ester akan
berbanding langsung dengan fungsi konsentrasi Mg-Al/Hidrotalsit-KF karena
reaktan dan Mg-Al/Hidrotalsit-KF terdistribusi secara homogen di dalam metanol.
Perbandingan mol metanol/minyak merupakan variabel penting yang mempengaruhi
hasil ester. Hasil ester meningkat dengan meningkatnya jumlah metanol pada rasio
molar metanol/minyak 12:1. Konversi metil ester akan meningkat dengan kenaikan
waktu. Semakin lama waktu reaksi akan menyebabkan tumbukan antara molekul tiap
reaktan semakin lama terjadi, sehingga produk yang dihasilkan juga semakin banyak.
Laju reaksi transesterifikasi juga sangat dipengaruhi oleh suhu reaksi. Reaksi
transesterifikasi dapat berlangsung sempurna pada suhu kamar dengan waktu reaksi
yang cukup lama. Suhu reaksi transesterifikasi umumnya mengikuti suhu didih
metanol yaitu 60-70 °C.
2. Batasan Masalah
Berdasarkan identifikasi masalah tersebut, maka dibuat batasan masalah
sebagai berikut :
a. Perbandingan Mg/Al yang digunakan dalam katalis adalah 2:1.
b. Katalis yang digunakan adalah Mg-Al/Hidrotalsi-KF dengan perbandingan KF 80
% berat/berat Mg-Al/Hidrotalsit.
c. Variasi kondisi dalam pembuatan biodiesel adalah sebagai berikut:
commit to user
1. Berat katalis yang digunakan 1, 2, 3, 4, dan 5 % berat/berat minyak dengan
waktu reaksi 3 jam.
2. Waktu reaksi yaitu 5, 15, 30, 60 dan 180 menit.
3. Perbandingan mol metanol dengan minyak 12:1.
4. Temperatur reaksi pada suhu 65°C.
3. Rumusan Masalah
a. Kapan kondisi optimum dapat tercapai dengan variasi berat katalis terhadap
terbentuknya metil ester pada reaksi transesterifikasi dengan katalis
Mg-Al/Hidrotalsit-KF?
b. Kapan kondisi optimum dapat tercapai dengan variasi waktu reaksi terhadap
terbentuknya metil ester pada reaksi transesterifikasi dengan katalis
Mg-Al/Hidrotalsit-KF?
C. Tujuan Penelitian
1. Mengetahui pengaruh variasi berat katalis terhadap hasil transesterifikasi minyak
sawit menjadi biodiesel.
2. Mengetahui pengaruh variasi waktu reaksi terhadap hasil transesterifikasi minyak
sawit menjadi biodiesel.
D. Manfaat Penelitian
1. Memberi alternatif pembuatan katalis Mg-Al/Hydrotalcite-like (HTlc) dari brine water tiruan.
2. Menambah informasi mengenai pengaruh variasi berat katalis dan waktu reaksi
terhadap hasil transesterifikasi minyak sawit menjadi biodiesel.
3. Menambah informasi mengenai katalis Mg-Al/Hidrotalsit-KF yang aktif dan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Pembuatan Air Laut Tiruan dan Komposisi Brine Water Tiruan
Komposisi kimia air laut tiruan (artificial seawater) hampir sama dengan komposisi air laut murni (natural seawater). Formula yang dikemukakan oleh Lyman dan Fleming (1940) adalah salah satu formula yang paling sering digunakan dalam
pembuatan larutan air laut tiruan. Sintesis Brine water tiruan dibuat analog dengan cara membuat larutan air laut tiruan. Masa dari komponen utama air laut tiruan per
kilogram larutan dihitung dari komponen garam-garam terlarut (salinitas) sebanyak
35 ‰ berdasarkan berat atom dan molekul. Dari kadar salinitas tersebut, terdapat
beberapa ion utama. Menurut Kester dkk, salinitas air laut dipengaruhi oleh
ion-ion seperti yang tercantum pada Tabel 1 di bawah ini :
Tabel 1. Ion-ion yang mempengaruhi salinitas air laut
Ion-ion Kadar dalam ‰ berat Proporsi salinitas total
commit to user
2. Sintesis Hydrotalcite-like (HTlc)
HTlc dalam bentuk naturalnya adalah suatu hidroksikarbonat dari magnesium
dan aluminium yang keberadaannya di alam sangat jarang dibandingkan dengan
lempung kationik yang melimpah (Bejoy, 2001). Sintesis HTlc merupakan subyek
riset yang diminati karena adanya kemudahan dalam mengontrol komposisi kimia,
kemungkinan peningkatan luas permukaan aktif serta volume interlayer dari anion terinterkalasi sehingga dapat diaplikasikan sebagai sorben dan katalis atau
pengemban katalis yang unggul.
Oleh karena itu, beberapa peneliti telah membuat dan mengembangkan HT
berbahan dasar Mg sebagai sorben atau katalis dengan berbagai kondisi, baik dari
bahan murni maupun bahan alam. Dari bahan murni, Orthman et. al., (2003) berhasil
membuat lempung anionik yang dapat menghilangkan senyawa berwarna organik
dari larutan cair; Shumaker et. al., (2008) dan Gao et. al., (2008) telah mensintesis
HTlc dari campuran magnesium nitrat dan aluminium nitrat melalui metode
kopresipitasi secara langsung sebagai katalis dan prekursor katalis transesterifikasi
untuk menghasilkan biodiesel. Kameda et. al., (2000) telah berhasil membuat
hydrotalcite-like dari magnesium yang berasal dari air laut. Dalam pembuatan HTIc tersebut, Kameda menggunakan air laut tiruan (artificial seawater) yang mengandung NaCl, Na2SO4, MgCl2 dan CaCl2.
3. Struktur dan Sifat Hydrotalcite
Hidrotalsit merupakan lempung anionik yang terdiri dari lapisan bermuatan
positif dengan anion interkalat dan molekul air dalam daerah interlayer (Rajamanthi et. al., 2001). Dalam bentuk naturalnya hidrotalsit merupakan suatu hidroksikarbonat
dari magnesium dan aluminium dengan formula [Mg6Al2(OH)16]2+CO32-.4H2O.
Rumus umum hydrotalcite-like adalah:
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dimana M II adalah kation logam divalen (bervalensi dua), seperti Mg2+, Fe2+, Ni2+,
Cu2+, Co2+, Mn2+, Zn2+ atau Cd2+ sedangkan M III adalah kation logam trivalen
(bervalensi tiga), seperti Al3+, Cr3+, Ga3+, atau Fe3+, An- adalah CO32-, SO42-, Cl-, NO3
-, atau anion organik dan m menunjukkan kandungan air dalam daerah interlayer
(Zhiqiang Yang et. al., 2007).
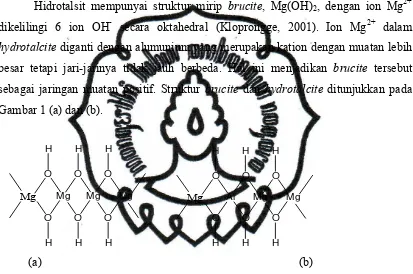
Hidrotalsit mempunyai struktur mirip brucite, Mg(OH)2, dengan ion Mg2+ dikelilingi 6 ion OH- secara oktahedral (Kloprongge, 2001). Ion Mg2+ dalam
hydrotalcite diganti dengan alumunium yang merupakan kation dengan muatan lebih besar tetapi jari-jarinya tidak jauh berbeda. Hal ini menjadikan brucite tersebut sebagai jaringan muatan positif. Struktur brucite dan hydrotalcite ditunjukkan pada Gambar 1 (a) dan (b).
Gambar 1. (a) Struktur brucite; (b) Struktur hidrotalsit (Hickey; 2001)
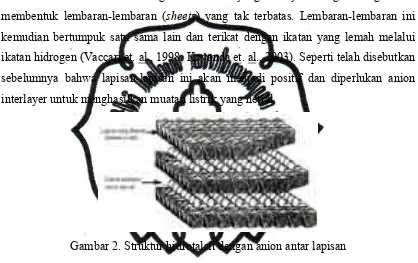
HTlc adalah salah satu jenis dari senyawa hidroksida ganda berlapis (Layered Double Hydroxides/LDH). LDH adalah lapisan berstruktur campuran hidroksida logam dengan muatan positif permanen akibat adanya substitusi isomorfi dengan
anion penyeimbang pada daerah antar-lapisnya. Dengan adanya anion dan molekul
air yang terinterkalasi di dalam daerah interlayer menyebabkan HTlc mempunyai kemampuan pertukaran anion yang signifikan. Struktur LDH terbentuk dengan
menggantikan sepertiga bagian dari kation divalen pada lapisan hidroksida logam
commit to user
lapisan hidroksida logam. Daerah antarlapisan hidroksida logam yang satu dengan
yang lain akan dipisahkan oleh suatu interlayer yang merupakan gabungan antara
anion dengan empat molekul H2O yang terikat lemah pada sisi muatan positif yang
berlebih (Arrhenius, 2003).
Struktur oktahedral Mg2+ dan Al3+ yang sisinya saling berbagi akan
membentuk lembaran-lembaran (sheets) yang tak terbatas. Lembaran-lembaran ini kemudian bertumpuk satu sama lain dan terikat dengan ikatan yang lemah melalui
ikatan hidrogen (Vaccari et. al., 1998; Kovanda et. al., 2003). Seperti telah disebutkan
sebelumnya bahwa lapisan-lapisan ini akan menjadi positif dan diperlukan anion
interlayer untuk menghasilkan muatan listrik yang netral.
Gambar 2. Struktur hidrotalsit dengan anion antar lapisan
Pada material hidrotalsit rasio Mg2+/Al3+ menentukan jumlah dan susunan
anion penyeimbang (Newman et. al., 1998). Rasio ini berkisar antara 1/1 sampai 4/1.
Senyawa hidrotalsit sekarang ini telah banyak dikembangkan karena potensi
yang dimilikinya baik untuk adsorben (Wright, 2002), penukar ion dan sebagai
katalis (Kishore and Kannan, 2002; 2004). Wright (2002) menyebutkan bahwa hidrotalsit memiliki sejumlah sifat yang membuatnya berpotensi seperti tersebut di
atas, diantaranya adalah:
1. Luas permukaan yang cukup besar (100-300 m2/gram).
2. Padatan pendukung yang dapat disisipi oleh logam katalis dengan dispersi logam
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
3. Memiliki efek sinergis antar lapisan.
4. Memiliki memory effect (dapat diregenerasi).
Hidrotalsit sebagai katalis mempunyai beberapa keuntungan diantaanya
proses penanganannya mudah, mudah dipisahkan dengan produk, ramah lingkungan
dan menghasilkan produk yang bagus (Kishore and Kannan, 2002). Perannya sebagai
katalis, senyawa hidrotalsit banyak digunakan dalam berbagai reaksi yang
berkataliskan basa seperti, kondensasi aldol, isomerisasi ikatan rangkap pada alkena,
dan dehidrogenasi 2-propanol (Kishore and Kannan, 2004). 4. Biodiesel
Biodiesel merupakan bahan bakar alternatif dari bahan mentah terbaharukan
(renewable) selain bahan bakar diesel dari minyak bumi. Biodiesel sebagai bahan bakar non-petroleum umumnya mengandung metil ester asam lemak atau etil ester
asam lemak yang dihasilkan dari transesterifikasi minyak, dimana komponen
utamanya adalah trigliserida dengan methanol atau etanol (Gao et. al., 2008).
Biodiesel tersusun dari berbagai macam ester asam lemak yang dapat diproduksi dari
minyak-minyak tumbuhan seperti minyak sawit (palm oil), minyak kelapa, minyak jarak pagar, minyak biji kapok randu, dan masih ada lebih dari 30 macam tumbuhan
Indonesia yang potensial untuk dijadikan sumber energi bentuk cair ini (Prakoso,
2003).
Biodiesel dikenal sebagai produk yang ramah lingkungan, tidak mencemari
udara, mudah terbiodegradasi, dan berasal dari bahan baku yang dapat diperbaharui.
Pada umumnya biodiesel disintesis dari ester asam lemak dengan rantai karbon antara
C6-C22. Biodiesel bisa digunakan dengan mudah karena dapat bercampur dengan
segala komposisi dengan minyak solar, mempunyai sifat-sifat fisik yang mirip
dengan solar biasa sehingga dapat diaplikasikan langsung untuk mesin-mesin diesel
yang ada hampir tanpa modifikasi (Prakoso, 2003)
Dibanding bahan bakar solar, biodiesel memiliki beberapa keunggulan, yaitu:
Biodiesel diproduksi dari bahan pertanian, sehingga dapat diperbaharui.
commit to user
Ramah lingkungan karena tidak ada emisi SOx.
Menurunkan keausan ruang piston karena sifat pelumasan bahan bakar yang
bagus (kemampuan untuk melumasi mesin dan sistem bahan bakar).
Aman dalam penyimpanan dan transportasi karena tidak mengandung racun.
Meningkatkan nilai produk pertanian.
Biodegradabel: jauh lebih mudah terurai oleh mikroorganisme dibandingkan
minyak mineral. Pencemaran akibat tumpahnya biodiesel pada tanah dan air
bisa teratasi secara alami (Park, 2008).
Oleh karena itu, pengembangan biodiesel di Indonesia dan dunia menjadi
sangat penting seiring dengan semakin menurunnya cadangan bahan bakar diesel
berbasis minyak bumi, isu pemanasan global, serta isu tentang polusi lingkungan.
Pengembangan biodiesel didunia sudah dilakukan sejak tahun 1980-an sehingga pada
saat ini beberapa bagian dunia telah dilakukan komersialisasi bahan bakar ramah
lingkungan ini.
Adapun pembuatan biodiesel dari minyak yang berasam lemak bebas tinggi
ini menggunakan reaksi transesterifikasi seperti pembuatan biodiesel pada umumnya
dengan pretreatment untuk menurunkan angka asam pada minyak tersebut. Biodiesel
dapat dibuat dari minyak berasam lemak bebas tinggi dengan proses konversi
trigliserida menjadi metil atau etil ester dengan proses yang disebut transesterifikasi.
Proses transesterifikasi mereaksikan alkohol dengan minyak untuk memutuskan tiga
rantai gugus ester dari setiap cabang trigliserida. Reaksi ini memerlukan panas dan
katalis basa untuk mencapai derajat konversi tinggi dari minyak menjadi produk yang
terdiri dari biodiesel dan gliserin. (Prakoso,2008). Tahapan reaksi dalam pembuatan
biodiesel adalah sebagai berikut:
a. Esterifikasi
Esterifikasi adalah tahap konversi dari asam lemak bebas menjadi ester.
Esterifikasi mereaksikan minyak lemak dengan alkohol. Katalis-katalis yang cocok
adalah zat berkarakter asam kuat seperti asam sulfat, asam sulfonat organik atau resin
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
praktek industrial (Soerawidjaja, 2006). Untuk mendorong agar reaksi bisa
berlangsung ke konversi yang sempurna pada temperatur rendah (misalnya paling
tinggi 120 °C), reaktan metanol harus ditambahkan dalam jumlah yang sangat
berlebih (biasanya lebih besar dari 10 kali nisbah stoikhiometrik) dan air produk
ikutan reaksi harus disingkirkan dari fasa reaksi, yaitu fasa minyak. Melalui
kombinasi-kombinasi yang tepat dari kondisi-kondisi reaksi dan metode penyingkiran
air, konversi sempurna asam-asam lemak ke ester metilnya dapat dituntaskan dalam
waktu 1 sampai beberapa jam. Reaksi esterifikasi dapat dilihat pada Gambar 3.
RCOOH + CH
3OH RCOOCH3 + H2O
Asam lemak methanol metil ester
Gambar 3.Reaksi esterifikasi dari asam lemak menjadi metil ester
Esterifikasi biasa dilakukan untuk membuat biodiesel dari minyak berkadar
asam lemak bebas tinggi (berangka-asam ≥ 5 mg-KOH/g). Pada tahap ini, asam
lemak bebas akan dikonversikan menjadi metil ester. Tahap esterifikasi biasa diikuti dengan tahap transesterfikasi. Namun sebelum produk esterifikasi diumpankan ke
tahap transesterifikasi, air dan bagian terbesar katalis asam yang dikandungnya harus
disingkirkan terlebih dahulu.
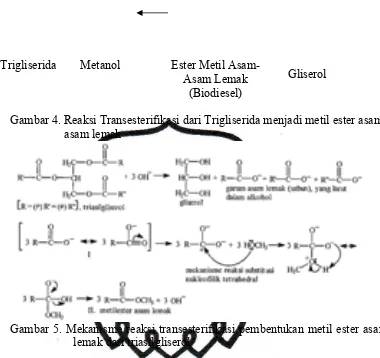
b. Transesterifikasi
Transesterifikasi adalah tahap konversi dari trigliserida menjadi alkil ester,
melalui reaksi dengan alkohol, dan menghasilkan produk samping yaitu gliserol. Di
antara alkohol-alkohol monohidrik yang menjadi kandidat sumber/pemasok gugus
alkil, metanol adalah yang paling umum digunakan, karena harganya murah dan
reaktifitasnya paling tinggi (sehingga reaksi disebut metanolisis). Reaksi
transesterifikasi trigliserida menjadi metil ester dapat dilihat pada Gambar 4.
commit to user
Gambar 4. Reaksi Transesterifikasi dari Trigliserida menjadi metil ester asam-asam lemak
Gambar 5. Mekanisme reaksi transesterifikasi pembentukan metil ester asam lemak dari triasilgliserol
Transesterifikasi juga menggunakan katalis dalam reaksinya. Tanpa adanya
katalis, konversi yang dihasilkan maksimum namun reaksi berjalan dengan lambat
(Mittlebatch, 2004). Katalis yang biasa digunakan pada reaksi transesterifikasi adalah
katalis basa, karena katalis ini dapat mempercepat reaksi.
Produk yang diinginkan dari reaksi transesterifikasi adalah ester metil
asam-asam lemak. Terdapat beberapa cara agar kesetimbangan lebih ke arah produk, yaitu:
a. Menambahkan metanol berlebih ke dalam reaksi
b. Memisahkan gliserol
c. Menurunkan temperatur reaksi (transesterifikasi merupakan reaksi eksoterm)
Hal-hal yang Mempengaruhi Reaksi Transesterifikasi
Trigliserida Metanol Ester Metil
Asam-Asam Lemak (Biodiesel)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Pada intinya, tahapan reaksi transesterifikasi pembuatan biodiesel selalu
menginginkan agar didapatkan produk biodiesel dengan jumlah yang maksimum.
Beberapa kondisi reaksi yang mempengaruhi konversi serta perolehan biodiesel
melalui transesterifikasi adalah sebagai berikut (Freedman, 1984):
a. Pengaruh air dan asam lemak bebas
Minyak nabati yang akan ditransesterifikasi harus memiliki angka asam yang
lebih kecil dari 1. Banyak peneliti yang menyarankan agar kandungan asam lemak
bebas lebih kecil dari 0.5 % (<0.5 %). Selain itu, semua bahan yang akan digunakan
harus bebas dari air. Karena air akan bereaksi dengan katalis, sehingga jumlah katalis
menjadi berkurang. Katalis harus terhindar dari kontak dengan udara agar tidak
mengalami reaksi dengan uap air dan karbon dioksida.
b. Pengaruh perbandingan molar alkohol dengan bahan mentah
Secara stoikiometri, jumlah alkohol yang dibutuhkan untuk reaksi adalah 3
mol untuk setiap 1 mol trigliserida untuk memperoleh 3 mol alkil ester dan 1 mol
gliserol. Perbandingan alkohol dengan minyak nabati 4,8:1 dapat menghasilkan
konversi 98 % (Bradshaw dan Meuly, 1944). Secara umum ditunjukkan bahwa
semakin banyak jumlah alkohol yang digunakan, maka konversi yang diperoleh juga
akan semakin bertambah. Pada rasio molar 6:1, setelah 1 jam konversi yang
dihasilkan adalah 98-99 %, sedangkan pada 3:1 adalah 74-89 %. Nilai perbandingan
yang terbaik adalah 6:1 karena dapat memberikan konversi yang maksimum.
c. Pengaruh jenis alkohol
Pada rasio 6:1, metanol akan memberikan perolehan ester yang tertinggi
dibandingkan dengaan menggunakan etanol atau butanol.
d. Pengaruh jenis katalis
Alkali katalis (katalis basa) akan mempercepat reaksi transesterifikasi bila
dibandingkan dengan katalis asam. Katalis basa yang paling populer untuk reaksi
transesterifikasi adalah natrium hidroksida (NaOH), kalium hidroksida (KOH),
natrium metoksida (NaOCH3), dan kalium metoksida (KOCH3). Katalis sejati bagi
commit to user
menghasilkan konversi yang maksimum dengan jumlah katalis 0,5-1,5%-b minyak
nabati. Jumlah katalis yang efektif untuk reaksi adalah 0,5%-b minyak nabati untuk
natrium metoksida dan 1%-b minyak nabati untuk natrium hidroksida.
e. Metanolisis Crude dan Refined Minyak Nabati
Perolehan metil ester akan lebih tinggi jika menggunakan minyak nabati
refined. Namun apabila produk metil ester akan digunakan sebagai bahan bakar
mesin diesel, cukup digunakan bahan baku berupa minyak yang telah dihilangkan
getahnya dan disaring.
f. Pengaruh temperatur
Reaksi transesterifikasi dapat dilakukan pada temperatur 30 – 65 °C (titik
didih metanol sekitar 65 °C). Semakin tinggi temperatur, konversi yang diperoleh
akan semakin tinggi untuk waktu yang lebih singkat.
5. Karakterisasi dan Analisis Hidrotalsit
a. Spektroskopi Serapan Atom (SSA)
Spektroskopi Serapan Atom (SSA) merupakan suatu metode analisis kimia
untuk menentukan unsur-unsur logam dan semi logam dalam jumlah renik (trace). Hasil perhitungan akan memberikan kadar total unsur logam atau semi logam dalam
sampel dan tidak tergantung pada bentuk molekul logam tersebut dalam sampel.
Hasil ini didasarkan pada pengukuran jumlah radiasi yang diserap oleh atom-atom
saat sejumlah radiasi dilewatkan melalui suatu sistem yang mengandung atom
tersebut.
Prinsip kerja SSA adalah adanya interaksi antara energi (sinar) dan materi
(atom). Ini dapat dilaksanakan dengan menghisap cuplikan melalui selang kapiler dan
menyemprotkan ke dalam nyala api yang memenuhi syarat tertentu sebagai kabut
yang halus (aerosol). Jumlah radiasi yang diserap tergantung pada jumlah atom-atom
bebas yang terlibat dan kemampuan atom itu untuk menyerap radiasi. Dasar
perpustakaan.uns.ac.id digilib.uns.ac.id
Cuplikan harus disiapkan dalam bentuk larutan untuk analisis kuantitatif
dengan menggunakan nyala. Cuplikan ini perlu perlakuan pendahuluan untuk
memperoleh bentuk larutan yang prosedurnya tergantung pada sifat dan jenis
cuplikan yang akan dianalisis. Ada beberapa cara untuk melarutkan cuplikan, yaitu:
(1) cuplikan langsung dilarutkan dalam pelarut yang sesuai, (2) cuplikan direaksikan
dengan asam, atau (3) cuplikan dilebur dulu dengan basa kemudian hasil leburan
dilarutkan dalam asam. Prosedur yang banyak digunakan adalah dengan melarutkan
sampel dengan asam murni seperti HNO3, H2SO4, dan HCl karena tidak menambah
kadar zat padat dalam larutan. Penentuan kadar logam dari suatu sampel dengan
metode SSA, dapat dilakukan dengan cara kurva kalibrasi maupun penambahan
standar (Skoog et. al., 1997).
b. X-Ray Diffractometer (XRD)
1) Identifikasi dan Kandungan Mineral
Metode yang digunakan untuk menganalisis zat padat berupa kristal secara
kualitatif dan kuantitatif adalah XRD atau difraksi sinar X. Analisis secara
kualitatif bertujuan untuk mengidentifikasi senyawa utama dalam sampel,
sedangkan analisis kuantitatif bertujuan untuk mengetahui persentase kandungan
senyawa utama tersebut dalam sampel.
Dasar penggunaan sinar X adalah pemantulan sinar X oleh susunan
sistematik atom-atom atau ion-ion dalam bidang kristal yang menghasilkan
pola-pola difraktogram khas bila direkam. Pola ini digunakan sebagai sidik jari dalam
identifikasi spesies mineral (Tan, 1982).
commit to user
Pola difraksi dapat diperoleh apabila sinar X yang dipantulkan mengalami
penguatan pada arah tertentu. Penguatan ini hanya terjadi apabila hukum Bragg
dipenuhi. Hukum Bragg didefinisikan sbb:
nλ = 2dsin θ (1)
d = jarak antar bidang atom dalam kristal n = tingkat difraksi
λ = panjang gelombang sinar X θ = sudut difraksi
Gambar skematik dari berkas sinar X yang dipantulkan bidang kristal
ditunjukkan oleh Gambar 5. Hukum Bragg mengasumsikan bahwa semua
bidang-bidang dalam suatu kristal memantulkan sinar X bila kristal dimiringkan
dengan sudut kemiringan (θ) tertentu terhadap sinar datang. Sudut tergantung
pada panjang gelombang sinar X dan harga d (Tan, 1982).
Penggunaan pola difraktogram untuk identifikasi memperhatikan
kesesuaian harga d dan kadang-kadang juga intensitasnya. Referensi harga d dan intensitas suatu senyawa dapat diperoleh dari data Joint Committee on Powder Diffraction Standars (JCPDS) yang bersumber dari International Centre for Difraction Data (West, 1992). Hidrotalsit dengan anion antar lapisan berupa CO32- dicirikan oleh harga d sekitar 7,80 Å. Pencirian ini disebutkan pula dalam
hasil penelitian yang dilakukan oleh Kloprogge, Wharton, Hickey, dan Frost
(2002).
Persentase kandungan senyawa dalam sampel diketahui dengan
membandingkan intensitas puncak difraksi karena intensitas tersebut sebanding
dengan fraksi senyawa dalam sampel (Willard et. al., 1988). Persentase
kandungan senyawa dalam sampel dihitung dengan rumus:
% kandungan =
(
)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
(I/I1)t : jumlah intensitas relatif total sampel.
2) Kristalinitas
Kristalinitas Material Mg/Al-hidrotalsit ditentukan atas dasar posisi
(berhubungan dengan nilai sudut difraksi atau 2θ) dan intensitas garis. Sudut
difraksi ditentukan oleh jarak antara bidang kristal (d). Harga d dihitung dengan menggunakan hukum Bragg, berdasarkan nilai panjang gelombang yang
diperoleh dari hasil pengukuran. Intensitas garis tergantung pada nomor dan jenis
fraksi atom pusat yang terdapat pada masing-masing bidang kristal.
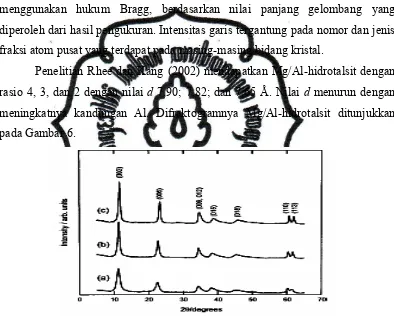
Penelitian Rhee dan Kang (2002) mendapatkan Mg/Al-hidrotalsit dengan
rasio 4, 3, dan 2 dengan nilai d 7,90; 7,82; dan 7,65 Å. Nilai d menurun dengan meningkatnya kandungan Al. Difraktogramnya Mg/Al-hidrotalsit ditunjukkan
pada Gambar 6.
Gambar 6. Difraktogram XRD Mg/Al-Hidrotalsit (a) rasio 2, (b) rasio 3, (c) rasio 4
Ukuran kristal Mg/Al-hidrotalsit dapat dihitung dari lebar garis puncak
dalam difraktogram hasil XRD, dengan menggunakan persamaan Scherrer
D = 0,9 λ / B cos θ (3)
D = ukuran kristal
λ = lambda radiasi
B = full width at half maximum (FWHM)
commit to user
c. Spektrofotometer IR (FTIR)
Spektrofotometer infra merah biasanya merupakan spektrofotometer berkas
ganda dan terdiri dari lima bagian utama yaitu, sumber radiasi, daerah cuplikan, kisi
difraksi (monokromator), dan detektor. Penggunaan spektrum infra merah untuk
penentuan struktur senyawa organik biasanya antara 650 – 4.000 cm-1. Daerah di
bawah frekuensi 650 cm-1 dinamakan infra merah jauh dan daerah diatas frekuensi
4.000 cm-1 dinamakan infra merah dekat (Sudjadi, 1985).
Jika suatu molekul menyerap sinar infra merah, maka di dalam molekul itu
terjadi perubahan energi vibrasi dan perubahan tingkat energi rotasi. Syarat molekul
dapat menyerap energi sinar infra merah adalah momen dwikutub harus tergetar
(sebab dari vibrasi molekul) berinteraksi dengan vektor listrik tergetar dari berkas
infra merah menyebabkan perubahan netto momen dwikutub dari gerakan vibrasi dan atau gerakan rotasi (Sudjadi, 1985).
Ada dua macam getaran molekul, yaitu getaran ulur dan getaran tekuk. Getaran
ulur adalah suatu gerakan berirama di sepanjang sumbu ikatan sehingga jarak antar
atom bertambah atau berkurang. Sedangkan getaran tekuk dapat terjadi karena
perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom atau karena
gerakan sebuah gugus atom terhadap sisa molekul tanpa gerakan nisbi atom-atom di
dalam gugus. Hanya getaran yang menghasilkan perubahan momen dwikutub secara
berirama saja yang teramati di dalam infra merah (Silverstein et. al., 1986).
Spektra FTIR Mg-Al/Hidrotalsit menunjukkan adanya pita lebar pada bilangan
gelombang (v) 3400-3500 cm-1 yang merupakan serapan uluran OH lapisan
hidroksida Mg-Al/Hidrotalsit dan serapan ion CO32- antar lapisan diindikasikan oleh
puncak pada v sekitar 1385 cm-1 yang merupakan serapan uluran O=C-O dan 650 cm
-1
yang merupakan serapan tekukan O=C-O. Puncak pada v ± 550 cm-1 merupakan
uluran Al-O sehingga v 416,6 cm-1 dimungkinkan merupakan uluran Mg-O
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
d. Thermogravimetric/Differential Thermal Analysis (TG/DTA)
Analisis termal adalah pengukuran sifat fisika dan kimia sebagai fungsi
temperatur. (Skoog et. al., 1997). Dalam prakteknya, analisis termal ini meliputi entalpi, kapasitas panas, massa, dan koefisien ekspansi termal. Ada dua teknik utama
dalam analisis yaitu Thermogravimetric Analyzer (TGA) yang secara otomatis mencatat perubahan berat sampel sebagai fungsi temperatur atau waktu dan
Differential Thermal Analyzer (DTA) yang mengukur perbedaan temperatur (T) antara sampel dan material pembanding inert sebagai fungsi temperatur. Oleh karena itu, DTA mendeteksi perubahan pada kandungan panasnya (Susilowati, 2002).
Pada DTA, panas yang diabsorpsi dan dipancarkan oleh sistem kimia
diselidiki dengan mengukur perbedaan temperatur antara sistem dan senyawa
pembanding inert (alumina, aluminium, silikon, karbida, gelas), jika temperatur
keduanya dinaikkan dengan kecepatan yang sama dan konstan (Susilowati, 2002).
Peristiwa yang terjadi dalam sampel yaitu eksotermis dan endotermis. Kedua
peristiwa ini ditampilkan dalam bentuk termogram differensial sebagai puncak
maksimum dan minimum. Puncak maksimum menunjukan peristiwa eksotermis
dimana panas akan dilepaskan oleh sampel. Puncak minimum menunjukan peristiwa
endotermis dimana terjadi penyerapan panas oleh sampel.
Luas area kurva DTA tergantung pada massa (m) sampel yang digunakan,
panas reaksi (perubahan entalpi, ∆H) faktor geometri sampel (G) dan konduktivitas
termal (k). Secara matematis dirumuskan sebagai :
A = (-G.m.∆H)/k = -k’.m.(∆H) (4)
Luas area tidak bisa dikonversi menjadi massa atau energi secara langsung,
tanpa mengetahui nilai dari k’ pada temperatur yang berkaitan. Nilai k’ diperoleh
melalui kalibrasi alat. Jika ∆H negatif berarti proses yang terjadi eksotermis dan ∆H
positif untuk proses endotermis (Susilowati, 2002).
commit to user
Termogram hidrotalsit mempunyai puncak endotermis pada temperatur 116
°C yang menunjukkan pelepasan molekul air pada antar lapisan dan temperatur 238
°C yang menunjukkan pelepasan gugus OH (Xie, An and Wang, 2003). Pelepasan
karbonat ditunjukkan oleh puncak endotermis pada temperatur 414 °C sedangkan
degradasi struktur hidrotalsit terjadi pada 498 °C (Frost et. al., 2005).
8. Karakterisasi Biodesel
a.Hydrogen Nuclear Magnetic Resonance (1H NMR)
Partikel dari atom (electron-elektron, proton-proton, neutron-neutron) dapat
berputar pada porosnya. Di beberapa atom seperti 12C, perputarannya saling
berpasangan dan berlawanan satu sama lain jadi inti dari atom tidak memiliki spin
pelindung. Akan tetapi di beberapa atom seperti 1H, dan 13C intinya hanya memiliki
sebuah pelindung. Saat inti berada dalam medan magnet, populasi terinisiasi dari
tingkatan energi ditentukan oleh termodinamikanya yang didiskripsikan oleh
distribusi Boltzman.
Sebuah inti dengan spin ½ dalam suatu medan magnet dimana inti ini berada
dalam tingkat energi yang lebih rendah. Inti tersebut akan berputar pada porosnya.
Ketika diberi medan magnet, maka pusat rotasi akan terpresisi mengelilingi medan
magnet. Jika energi magnet diserap oleh inti maka sudut presisi akan berubah dan
menyebabkan perputaran spin berlawanan arah.
Medan magnet pada inti tidaklah sama dengan medan magnet yang
digunakan, elektron-elektron disekeliling inti melindunginya dari medan yang ada.
Perbedaan antara medan magnet yang dipakai dengan medan magnet inti disebut
sebagai perisai inti. Medan magnet yang diberikan akan berpengaruh terhadap
pergeseran kimia (chemical shift) karena proton yang memiliki banyak perisai (shielding) akan semakin sedikit menerima medan magnet yang diberikan. Efek pergeseran kimia adalah perbedaan frekuensi absorbsi proton akibat perbedaan lokasi
letak atom terikat. Atom C yang semakin terlindung akan mengalami pergeseran
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
semakin mendekati TMS (Tetra metil silan) yang digunakan sebagai standar. Puncak
spektra 1H NMR akan mengalami pemecahan dipengaruhi oleh jumlah atom H
tetangga. Jika tidak terdapat atom H maka disebut singlet yang berarti tidak terjadi
pemecahan puncak. Satu atom H disebut duplet dengan pemecahan puncak sebanyak
2 puncak. Demikian juga untuk triplet dan kuartet menunjukkan pemecahan puncak
sebanyak 3 dan 4 (Skoog, 1997).
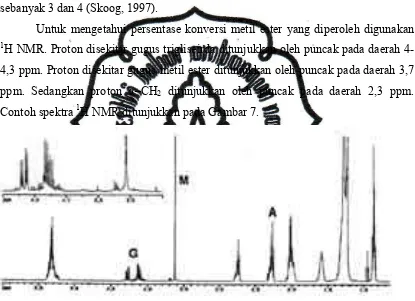
Untuk mengetahui persentase konversi metil ester yang diperoleh digunakan
1
H NMR. Proton disekitar gugus trigliseirda ditunjukkan oleh puncak pada daerah
4-4,3 ppm. Proton disekitar gugus metil ester ditunjukkan oleh puncak pada daerah 3,7
ppm. Sedangkan proton α–CH2 ditunjukkan oleh puncak pada daerah 2,3 ppm.
Contoh spektra 1H NMR ditunjukkan pada Gambar 7.
Gambar 7. Spektrum 1H NMR hasil transesterifikasi minyak kedelai. A,G, dan M merupakan proton dari α–CH2, gliserida, dan metil ester
Nilai konversi metil ester (yang dinyatakan sebagai konsentrasi metil ester)
ditentukan dengan rumus:
commit to user
IME = nilai integrasi puncak metil ester, %, dan
ITAG = nilai integrasi puncak triasilgliserol, %.
Faktor 5 dan 9 adalah jumlah proton yang terdapat pada gliseril dalam
molekul trigliserida mempunyai 5 proton dan tiga molekul metil ester yang dihasilkan
dari satu molekul trigliserida mempunyai 9 proton (Knothe, 2000).
b.Gas Chromatograph – Mass Spectroscopy (GC-MS)
Kromatografi gas – spektroskopi massa atau yang lebih dikenal dengan
GC-MS merupakan suatu instrumen gabungan dari kromatografi gas dan spektroskopi
massa. Instrumen GC memungkinkan untuk memisahkan molekul-molekul dari suatu
campuran, dimana hal ini tidak mungkin dipisahkan dengan cara-cara lain. Karena
sensitivitasnya yang tinggi maka hanya diperlukan sejumlah kecil cuplikan
(mikroliter). Pemisahan komponen-komponen dari cuplikan terjadi diantara gas
pengangkut dan fasa cair (Sastrohamidjojo, 2002).
Spektrometer massa merupakan alat analisis yang mempunyai kemampuan
aplikasi yang paling luas, yang dapat dipergunakan untuk memperoleh informasi
mengenai komposisi sampel dasar dari suatu bahan, struktur dari molekul anorganik,
organik dan biologi, komposisi kualitatif dan kuantitatif dari kompleks, struktur dan
komposisi dari permukaan padat dan perbandingan isotropik atom-atom di dalam
sampel (Skoog et. al., 1998).
Metode spektroskopi massa didasarkan pada pengubahan komponen cuplikan
menjadi ion-ion gas dan memisahkannya berdasarkan perbandingan massa terhadap
muatan (m/z). Bila suatu molekul berbentuk gas disinari oleh elektron berenergi
tinggi di dalam sistem hampa maka akan terjadi ionisasi, ion molekul akan terbentuk
dan ion molekul yang tidak stabil pecah menjadi ion-ion yang lebih kecil
(Hendayana, dkk., 1994). Lepasnya elektron dari molekul menghasilkan radikal
kation dan proses ini dapat dinyatakan sebagai berikut.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Ion molekular M+• biasanya terurai lagi menjadi sepasang pecahan atau fragmen yang
dapat berupa radikal dan ion atau molekul yang lebih kecil dan radikal kation.
M+• → M1+ + M2• atau M1+• + M2
Ion molekular, ion-ion pecahan dan ion-ion radikal pecahan dipisahkan oleh
pembelokkan dalam medan magnet yang dapat berubah sesuai dengan massa dan
muatan mereka dan menimbulkan arus ion pada kolektor yang sebanding dengan
limpahan relatif mereka (Peasock, 1976).
Spektrum massa yang diperoleh merupakan grafik perbandingan massa
terhadap muatan (m/z) dan intensitas. Di dalam spektrum massa dapat dilihat
spektrum-spektrum yang menunjukkan massa dari gugus molekul, puncak ion
molekul (M), puncak utama (base peak) dan puncak isotop. Puncak ion molekul (M) terjadi pada suatu massa yang sesuai dengan berat molekul dari molekul netralnya.
Sedangkan puncak dengan intensitas terbesar merupakan puncak utama (base peak), sering kali ditandai dengan tinggi 100 (Hendayana, dkk., 1994).
B. Kerangka Pemikiran
Kenaikan persentase berat katalis akan meningkatkan laju reaksi
transesterifikasi pembentukan metil ester. Persentase berat katalis yang semakin besar
tidak menyebabkan bergesernya reaksi ke kanan (ke arah pembentukan metil ester),
tetapi menyebabkan turunnya energi aktivasi. Dengan demikian akan meningkatkan
kualitas tumbukan antar molekul reaktan yang mengakibatkan kecepatan reaksi
transesterifikasi menjadi naik maka konversi biodiesel juga menjadi semakin tinggi.
Katalis yang berlebih tidak dapat menggeser kesetimbangan untuk menghasilkan
FAME yang lebih tinggi.
Bertambahnya waktu reaksi akan meningkatkan hasil FAME. Peningkatan
waktu reaksi memperpanjang waktu kontak reaktan dengan katalis. Waktu reaksi
yang lebih lama membuat reaksi transesterifikasi berpindah menjadi reaksi
keseimbangan dan lebih banyak trigliserida berubah menjadi asam lemak metil. Jika
commit to user
akan menguntungkan karena tidak memperbesar hasil dan karena reaksi yang terjadi
dalam proses transesterifikasi adalah reversible (bolak- balik), maka apabila sudah terjadi kesetimbangan, reaksi akan bergeser ke kiri, dan akan memperkecil produk
yang diperoleh.
C. Hipotesis
1. Meningkatnya persentase berat katalis Mg-Al/Hidrotalsit-KF akan meningkatkan
kemurnian biodiesel dan diperoleh kondisi optimum.
2. Menigkatnya waktu reaksi akan meningkatkan kemurnian biodiesel dan dapat
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Penelitian ini dilakukan dengan metode eksperimental laboratorium.
Penelitian meliputi dua tahapan. Tahapan pertama adalah sintesis katalis
Mg/Al-hidrotalsit yang dilakukan dengan metode pengendapan kemudian dikarakterisasi.
Tahapan kedua adalah aplikasi katalis dalam transesterifikasi minyak kelapa sawit
menjadi biodiesel.
B. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan selama tujuh bulan mulai dari bulan Mei 2010
sampai dengan November 2010 di Laboratorium Dasar Kimia FMIPA UNS,
Laboratorium Kimia FMIPA UGM dan laboratorium lain yang dianggap perlu sesuai
tahapan-tahapan penelitian yang telah disusun.
C. Alat dan Bahan yang Digunakan
1. Alat
a. Spektrofotometer serapan atom (SSA)
b. Spektrofotometer infra merah (FTIR)
c. X-Ray Diffraction (XRD)
d. Gas Chromatograph – Mass Spectroscopy (GC-MS), kolom : Rastek RXi-5MS, panjang kolom : 30 meter, t awal : 3 menit, t akhir : 50 menit, kecepatan alir : 80
mL/menit.
e. Hydrogen Nuclear Magnetic Resonance (1H NMR), 60 MHz. f. Neraca Analitik
g. pH-meter Corning 430 h. Hot plate
commit to user
i. Magnet stirer
j. Termometer
k. Alat gelas
l. Oven
m. Cawan Porselin
n. Mortir
o. Penjepit Kayu
p. Sentrifuge kecepatan 4000 rpm
q. Ayakan 150 mesh
r. Water pump
2. Bahan
a. Minyak kelapa sawit
b. Akuades
c. MgCl2.6H2O p.a (E. Merck)
d. AlCl3.6H2O p.a (E. Merck)
e. Na2CO3p.a (E. Merck)
f. NaHCO3 p.a (E. Merck)
g. NaCl p.a (E. Merck)
h. KCl p.a (E. Merk)
i. CaCl2.2H2O (E. Merk)
j. KOH (E. Merck)
k. Methanol (E. Merck)
l. Kalium Fluorida (KF) (E. Merck)
m. AgNO3 (E. Merck)
n. Natrium Sulfat Anhidrats (Na2SO4) (E. Merck)
o. Indikator PP
p. Kertas saring Whatman 42
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user D. Prosedur Penelitian
1. Pembuatan Larutan
a. Larutan tiruan brine water
Sebanyak 83,630 gram MgCl2.6H2O; 8,194 gram CaCl2.2H2O; 41,478 gram NaCl
dan 1,4 gram KCl dilarutkan ke dalam 1 liter akuades sambil diaduk.
b. Larutan awal
Sampel brine water tiruan ditambahkan campuran larutan Na2CO3 0,02 M dan NaHCO3 0,04 M dengan tetap diaduk selama 1 jam dan dipanaskan pada suhu 95
°C.
c. Larutan prekursor
Sejumlah senyawa AlCl3 ditambahkan ke dalam larutan awal di atas dengan
perbandingan rasio mol awal antara magnesium dan aluminium adalah 2:1.
Sebanyak 100 mL larutan awal membutuhkan 0,6155 gram AlCl3.6H2O.
2. Sintesis Mg-Al/Hidrotalcite-like (HTlc)
Sejumlah larutan Na2CO3 0,1 M ditambahkan ke dalam 3 liter larutan
prekursor hingga pH 10,3-10,5 dan kemudian larutan ini tetap diaduk selama 1 jam
pada suhu 70 ºC. Kemudian didinginkan pada suhu ruangan.
Endapan yang diperoleh dicuci dengan akuades sampai bebas dari ion Cl-.
Keberadaan ion Cl- diketahui dengan menguji filtrat pencucian dengan AgNO3 0,1 M.
Filtrat pencucian yang bebas ion Cl- tidak menghasilkan endapan atau menjadi keruh
apabila ditetesi dengan AgNO3 0,1 M.
Endapan yang bebas ion Cl- disentrifugasi dengan kecepatan 4000 rpm selama
10 menit, lalu dioven pada suhu 110 oC selama ± 6 jam. Endapan kering (padatan)
yang dihasilkan digerus sampai halus kemudian diayak dengan ayakan 150 mesh.
commit to user
3. Karakterisasi Mg-Al/Hidrotalsit
Metode yang digunakan untuk mengidentifikasi Mg-Al/Hidrotalsit secara
kualitatif dan kuantitatif adalah XRD, FT-IR dan TG-DTA. Difraktogram hasil
sintesis dibandingkan dengan difraktogram referensi. Data 3 puncak dengan intensitas
tertinggi dibandingkan dengan data puncak dari Mg-Al/Hidrotalsit standar dari Joint Committee on Powder Diffraction Standards (JCPDS).
4. Preparasi Katalis Mg-Al/Hidrotalsit-KF
Sebanyak 10 gram hidrotalsit dan 8 gram KF digerus dalam lumpang
porselen sampai halus kemudian ditambahkan beberapa tetes akuades sampai
membentuk pasta, lalu di oven pada suhu 65 °C selama satu malam. Padatan katalis
digerus sampai halus kemudian diayak dengan ayakan 150 mesh.
5. Penentuan Bilangan Asam
Sebanyak 1ml minyak sawit dalam erlenmeyer ditambah 2 tetes indikator
penolftalen, kemudian campuran dititrasi dengan KOH 0,5 N menghasilkan warna
merah jambu.
6. Reaksi Transesterifikasi Minyak Sawit menjadi Biodiesel
Metode yang dilakukan sesuai dengan Gao et al (2008) yang telah melakukan
transesterifikasi minyak sawit menjadi biodiesel menggunakan katalis hydrotalcite
dan campurannya. Transesterifikasi dilakukan dalam labu leher tiga yang dilengkapi
dengan thermostat dan stirrer mekanis. Ke dalam labu leher tiga yang telah berisi 5 gram minyak sawit, masing-masing ditambahkan metanol dan katalis dalam jumlah
yang berbeda, lalu dipanaskan dengan suhu 65 °C sambil terus diaduk. Komposisi
methanol dan katalis yang ditambahkan masing-masing adalah sebagai berikut : rasio
Mg-perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Al/Hidrotalsit 80 % berat/berat Mg-Al/Hidrotalsit. Reaksi dilakukan dengan variasi
waktu 5, 15, 30, 60, dan 180 menit. Optimasi berat katalis dilakukan dengan variasi 1,
2, 3, 4, dan 5 % berat dari berat minyak selama 3 jam. Setelah reaksi transesterifikasi
selesai, reaktor didinginkan sampai ke temperatur ruangan. Kemudian disaring
menggunakan corong pisah, lapisan atas merupakan biodiesel sedangkan lapisan
bawah merupakan campuran gliserol, sabun dan air. Lapisan atas diambil kemudian
diuapkan selama 1 jam, lalu ditambahkan Na2SO4 anhidrat untuk menghilangkan air.
Kemudian biodiesel diuapkan kembali pada suhu lebih dari 100 °C untuk
menghilangkan metanol. Biodiesel yang telah bersih siap untuk dikarakterisasi.
Transesterifikasi minyak sawit akan dilakukan dengan tiga jenis katalis, yaitu
Mg-Al/Hidrotalsit; KF dan Mg-Al/Hidrotalsit-KF. Transesterifikasi minyak sawit
dengan katalis Mg-Al/Hidrotalsit dan KF dilakukan sebagai pembanding saja.
7. Karakterisasi Biodiesel
Biodiesel yang diperoleh dilakukan uji karakteristik dengan mengguanakan:
a. 1H NMR
b. FT-IR
c. GC-MS
.
E. Teknik Pengumpulan dan Analisa Data
Pembuatan biodiesel dari minyak sawit dapat dianalisis sebagai berikut :
1. Identifikasi material hasil sintesis dengan XRD dianalisis dengan
membandingkan harga d sampel dengan standar Joint Committee on Powder Diffraction Standards ( JCPDS). Kesesuaian harga d sampel dengan standar dari JCPDS Mg-Al/Hidrotalsit menunjukkan sampel merupakan Mg-Al/Hidrotalsit.
commit to user
membandingkan jumlah intensitas relatif senyawa dalam sampel dengan jumlah
intensitas relatif total sampel.
2. Gugus-gugus fungsi yang ada di dalam Mg-Al/Hidrotalsit dan
Al/Hidrotalsit-KF diketahui dengan membandingkan puncak-puncak spektra FT-IR
Mg-Al/Hidrotalsit dan Mg-Mg-Al/Hidrotalsit-KF dengan referensi. Berdasarkan
strukturnya Mg-Al/Hidrotalsit memiliki gugus fungsi M-O, O=C-O, karbonat,
O-H dari lapisan hidroksida maupun interlayer.
3. Analisis termal dilakukan dengan Thermografimetric Analyzer (TGA) yamg mencatat perubahan berat sampel sebagai fungsi temperatur dan Differential Thermal Analyzer (DTA) untuk identifikasi adanya molekul H2O dalam Mg-Al/Hidrotalsit dengan mendeteksi perubahan pada kandungan panasnya. Analisis
ini dilakukan pada suhu 25-500 °C.
4. Analisa kemurnian metil ester dilakukan dengan 1HNMR.
5. Untuk membuktikan adanya metil ester pada produk transeterifikasi dilakukan
analisa dengan FT-IR. Adanya metil ester dapat dilihat dari serapan khas pada
gugus C=O dan C-O.
6. Identifikasi senyawa metil ester (biodiesel) menggunakan GC-MS. Berdasarkan
hasil kromatogram GC dan fragmen MS dari masing-masing senyawa, suatu
senyawa dikatakan mirip dengan standar jika memiliki berat molekul yang sama
dan memiliki pola fragmen yang mirip serta harga SI (indeks kemiripan) yang
tinggi. Untuk lebih memperkuat dugaan dapat dilihat base peak pada senyawa metil ester yang memiliki ciri khas pada m/z = 74. jika kandungan metil ester
pada senyawa biodiesel tinggi maka dimungkinkan tingginya konversi trigliserida
dalam minyak sawit menjadi metil ester. Sehingga semakin besar kandungan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Sintesis Mg-Al/Hidrotalsit dan Mg-Al/Hidrotalsit-KF
Padatan Mg-Al/Hidrotalsit disintesis berdasarkan metode pengendapan, yaitu
dengan mereaksikan larutan brine water tiruan dan AlCl3.6H2O dengan Na2CO3 dalam suasana basa. Anion antar lapisan CO32- dipilih karena dapat terikat dengan
segera dan kuat dengan lapisan mirip brucite yang bermuatan positif sehingga sintesisnya tidak perlu menghindarkan kontaminasi anion lain yang lebih sulit
dilakukan. Dipilihnya metode pengendapan dalam sintesis hidrotalsit selain karena
mudah, semua kation mengendap secara simultan dalam rasio mol sesuai dengan
rasio mol awalnya.Rasio mol Mg/Al yang disintesis adalah 2:1
Selama proses sintesis, kondisi pH larutan dijaga pada pH sekitar 10,3-10,5
untuk mendapatkan hidrotalsit yang optimum. Apabila pH jauh lebih besar dari pH
optimum, ion Al3+ akan terlarut sehingga tidak dapat membentuk endapan, sedangkan
apabila pH kurang dari pH optimum akan terjadi pengendapan senyawa-senyawa
selain hidrotalsit sehingga produk yang terbentuk tidak optimum.
Katalis Mg-Al/Hidrotalsit-KF dipreparasi dengan metode grinding dengan perbandingan berat KF banding Mg-Al/Hidrotalsit sama dengan 8/10. Senyawa hasil
sintesis mempunyai karakteristik fisik dengan bentuk bongkahan kecil dan berwarna
putih kekuningan. Senyawa hasil sintesis tersebut kemudian dikarakterisasi dengan
XRD, FT-IR dan TG-DTA.
B. Karakterisasi Katalis
1. Identifikasi Senyawa Hasil Sintesis
Identifikasi senyawa hasil sintesis dilakukan dengan X-Ray Diffragtometer
(XRD), FT-IR dan TG-DTA. Analisis ini bertujuan untuk memastikan bahwa
senyawa utama hasil sintesis adalah Mg-Al/Hidrotalsit dan Mg-Al/Hidrotalsit-KF.
Difraktogram Mg-Al/Hidrotalsit dan Mg-Al/Hidrotalsit-KF pada Gambar 8.
commit to user
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70
2 theta
Gambar 8. (a) Difraktogram Mg-Al/Hidrotalsit dan (b) Mg-Al/Hidrotalsit-KF
Identifikasi senyawa dilakukan dengan membandingkan harga d
puncak-puncak difraktogram dengan data Mg-Al/Hidrotalsit standar dari JCPDS (Joint Comittee on Powder Diffraction Standard) nomor 41-1428. Gambar tersebut memberikan informasi bahwa hidrotalsit sudah terbentuk.
Tiga puncak tertinggi sampel sebagai penciri senyawa mempunyai harga
d-spacing yang sesuai data Mg-Al/Hidrotalsit standar yaitu pada harga d = 7,35; 3,73; dan 2,80 Å. Hidrotalsit alam yang diteliti oleh Allmann et. al. (1969) mempunyai
harga d yaitu 7,69; 3,88; dan 2,58 Å. Adanya kesesuaian harga d tiga puncak tertinggi
dengan standar mengindikasikan bahwa senyawa utama hasil sintesis adalah
Mg-Al/Hidrotalsit. Data harga d-spacing tiga puncak tertinggi sampel disajikan pada Tabel 2. Perbandingan harga d puncak-puncak dari senyawa hasil sintesis dengan
data Mg-Al/Hidrotalsit standar dari JCPDS secara keseluruhan disajikan pada
Lampiran 2
.
Tabel 2. Harga d tiga puncak tertinggi hasil sintesis
Keterangan Harga d (Å)
Mg-Al/Hidrotalsit 7,359 3,730 2,806
Mg-Al/Hidrotalsit standar 7,844 3,914 2,6080
a
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Yang (2007) menyebutkan bahwa harga d-spacing sekitar 7,80 Å merupakan puncak karakteristik hidrotalsit dengan anion antar lapis berupa CO32-. Kesesuaian
harga d-spacing hasil sintesis dengan harga d-spacing untuk anion antar lapis CO32- menunjukkan bahwa anion penyeimbang muatan pada Mg-Al/Hidrotalsit sampel
adalah CO32-.
Gambar 8 (b) menunjukkan bahwa KF berpengaruh pada kristalinitas dari
komposit Al/Hidrotalsit-KF. Hilangnya puncak-puncak difraktogram
Mg-Al/Hidrotalsit seolah-olah komposit Mg-Mg-Al/Hidrotalsit-KF berubah menjadi amorf.
Bila data itu dibandingkan dengan penelitian yang dilakukan oleh Gao (2010),
hasilnya sangat berbeda. Gao (2010) juga mensintesis Mg-Al/Hidrotalsit-KF, akan
tetapi hasil difraktogramnya mempunyai puncak-puncak yang tajam. Hilangnya
puncak-puncak tersebut kemungkinana disebabkan oleh sifat Mg-Al/Hidrotalsit-KF
yang sangat higroskopis. Kemampuannya mengikat air yang kuat maka bila katalis
ini diinteraksikan dengan metanol dimungkinkan katalis ini sangat reaktif terhadap
metanol, karena air dan metanol sama-sama mempunyai gugus hidroksil. Situs aktif
yang dimiliki oleh Mg-Al/Hidrotalsit-KF yaitu terbentuknya kristal KMgF3 (Gao,
2010). Karena Mg-Al/Hidrotalsit disintesis dari brine water tiruan yang mengandung Ca+, dimungkinkan juga terbentuk situs aktif yang berupa CaAlF5, KCaF3, dan
KCaCO3F yang reaktivitasnya lebih tinggi dari KMgF3 (Gao, 2010).
Untuk mendukung pembuktian bahwa material yang terbentuk adalah
Mg-Al/Hidrotalsit, dilakukan pula identifikasi gugus-gugus fungsi yang terkandung
dalam senyawa Mg/Al-HTlc, seperti gugus fungsi ion hidroksi (OH-) dan ion
karbonat (CO32-) yang bila dideteksi dengan spetrofotometer FT-IR akan
menghasilkan puncak-puncak khas untuk ikatan O-H, C-O, Mg-O atau Al-O. Spektra
hasil pengukuran FT-IR pada sampel meterial sintesis Al/Hidrotalsit,
Mg-Al/Hidrotalsit-KF dan KF disajikan pada Gambar 9, sedangkan perbandingan gugus
fungsinya dengan referensi disajikan dalam Tabel 3. sebagai berikut :
commit to user
Gambar 9. Spektra FTIR, (a) Mg-Al/Hidrotalsit, (b) Mg-Al/Hidrotalsit-KF, (c) Kalium Fluorida
Tabel 3. Perbandingan gugus fungsi Mg-Al/Hidrotalsit, Mg-Al/Hidrotalsit-KF, KF dan referensi
Gugus fungsi Referensi Bilangan gelombang (υ) (cm-1)
Mg-Al/
Hidrotalsit
Mg-Al/
Hidrotalsit-KF
KF
Uluran O-H 3400-3500b 3425 3425 3467
Tekukan O-H 1650b 1629 1633 1629
Uluran simeris O=C-O 1385a 1357 1381 1369
Tekukan O=C-O 650b 678 671 663
Uluran Mg-O dan Al-O 400-600a
(2 puncak)
555 559 561
447 462 430
Uluran KF 1003 972
Sumber : aKannan (1995) dalam Johnson et. al. (2003), bBhaumik et. al.(2004)
Dari Tabel 3 tampak bahwa puncak yang lebar dan tajam antara bilangan
gelombang 3425-3467 cm-1 dapat dianggap berasal dari tumpang tindih vibrasi ulur c
b
a
4000 3500 3000 2500 2000 1500 1000 500