commit to user BAB 2
TINJAUAN PUSTAKA
2.1. Struktur Ginjal 2.1.1. Ginjal
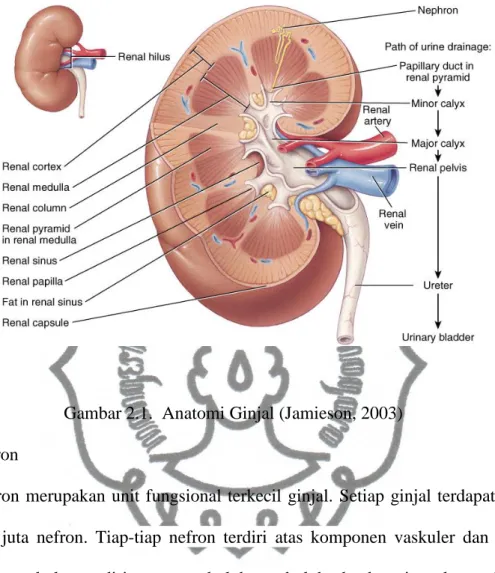
Sistem urinaria terdiri atas dua ginjal dan dua ureter yang bermuara pada satu vesika urinaria kemudian keluar dengan satu uretra. Ginjal merupakan organ berbentuk seperti kacang dengan panjang 10-12 cm dan tebal 3,5-5 cm, letaknya retroperitoneal dinding posterior cavum abdomen. Ginjal kanan terletak lebih ke bawah dibandingkan ginjal kiri. Di atas setiap ginjal terdapat kelenjar adrenal yang terbenam dalam jaringan ikat. Pada sisi medial terdapat cekungan, dikenal sebagai hilus, yang merupakan tempat keluar masuk pembuluh darah (arteri renalis, vena renalis) dan keluarnya ureter. Bagian ureter atas melebar dan mengisi hilus ginjal, dikenal sebagai pelvis renalis. Pelvis renalis akan terbagi lagi menjadi mangkuk besar dan kecil yang disebut kaliks mayor (2 buah) dan kaliks minor (8-12 buah). Setiap kaliks minor meliputi tonjolan jaringan ginjal berbentuk kerucut yang disebut papila renalis. Pada potongan vertikal ginjal tampak bahwa tiap papila renalis merupakan puncak daerah piramid yang meluas dari hilus menuju ke kapsula. Pada papila renalis ini bermuara 10-25 buah duktus koligens.
Satu piramid dengan bagian korteks yang melingkupinya dianggap sebagai satu lobus ginjal (Netter, 2006; Guyton, 2006; Scanlon dan Sanders, 2007; Purwanto,2010).
10
commit to user
Gambar 2.1. Anatomi Ginjal (Jamieson, 2003) 2.1.2. Nefron
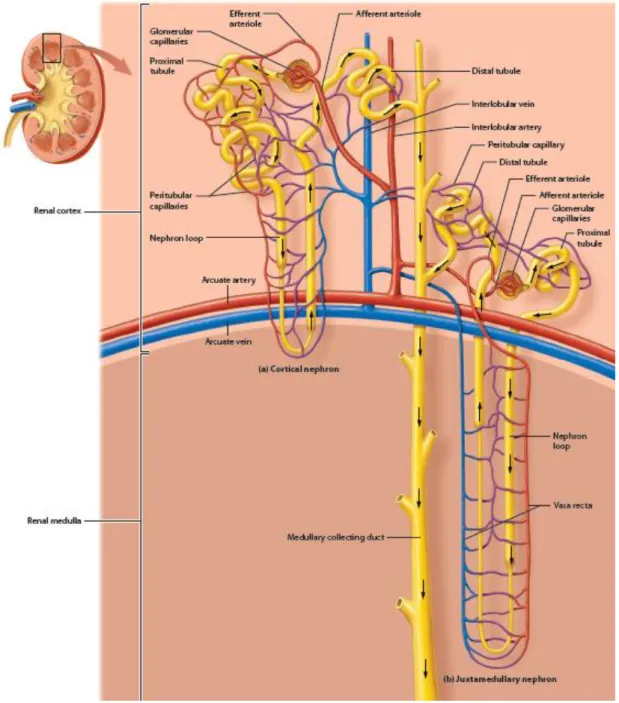
Nefron merupakan unit fungsional terkecil ginjal. Setiap ginjal terdapat kurang lebih satu juta nefron. Tiap-tiap nefron terdiri atas komponen vaskuler dan tubuler.
Komponen vaskuler terdiri atas pembuluh-pembuluh darah yaitu glomerulus dan kapiler peritubuler yang mengitari tubulus. Dalam komponen tubuler terdapat kapsula Bowman, serta tubulus-tubulus, yaitu tubulus kontortus proksimal, ansa henle dan tubulus kontortus distal. Kapsula Bowman terdiri atas lapisan parietal (luar) berbentuk gepeng dan lapis viseral (langsung membungkus kapiler glomerulus) yang bentuknya besar dengan banyak juluran mirip jari disebut podosit (Van de Graaf, 2001; Guyton 2006; Netter, 2006; Scanlon dan Sanders, 2007; Purwanto, 2010).
commit to user
Gambar 2.2. Nefron (Amerman, 2013)
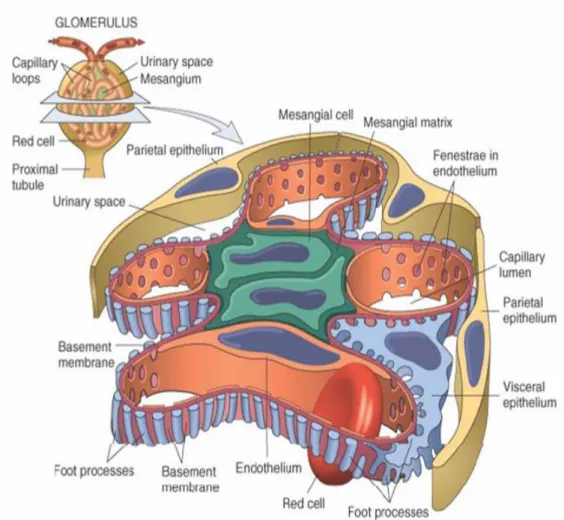
Pemotongan glomerulus secara melintang akan terlihat gambaran endotel pembuluh darah dengan fenestrae sebagai lubang untuk filtrasi, sel mesangial terletak di bagian sentral, sel visceral yang berbatasan langsung dengan endotel dibatasi oleh membran basalis. Bagian tepi dari sel visceral membentuk kaki podosit. Kaki podosit
commit to user
visceral terdapat sel parietal. Antara sel visceral dan sel parietal merupakan suatu ruangan untuk memproses terjadinya urin yang akan bermuara pada lumen tubulus proksimal (Robbins dan Cotran, 2005; Purwanto, 2010).
Gambar 2.3. Penampang Glomerulus (Robbins dan Cotran, 2005)
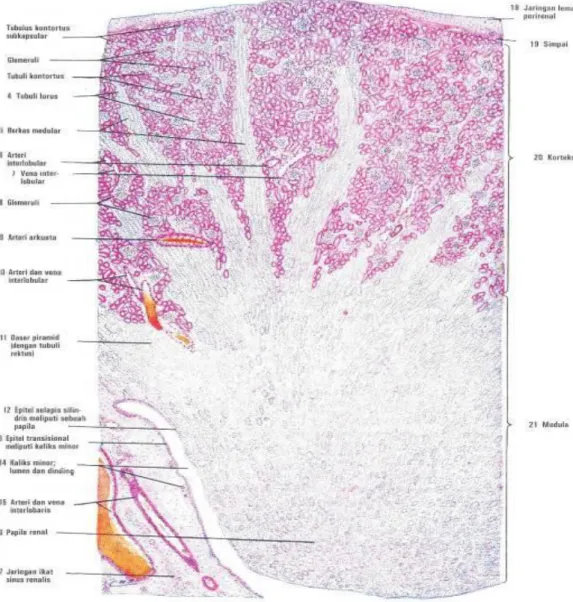
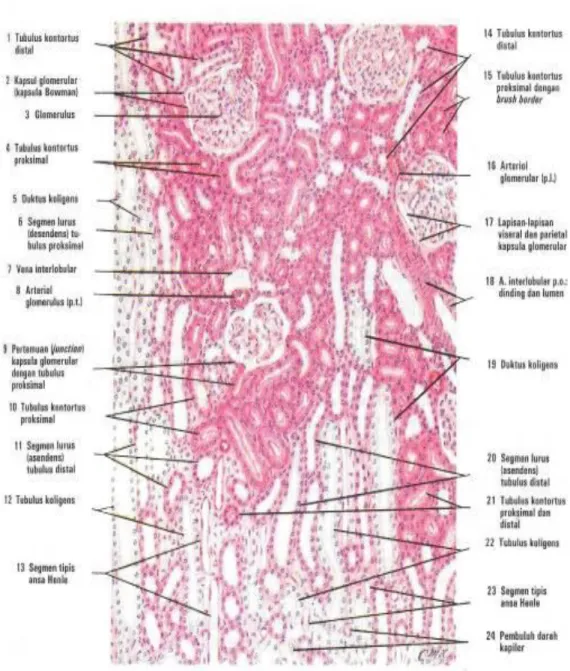
Gambaran histologi pada ginjal normal bagian korteks terdiri dari glomerulus, tubulus prosikmal, tubulus distal sedangkan bagian medula terdiri dari ansa henle dan tubulus koligens yang akan bermuara ke dalam pelvis ginjal. Pembuluh darah yang
commit to user
masuk kedalam glomerulus disebut vasa aferan bercabang cabang membentuk kapiler kemudian bersatu lagi membentuk vasa eferan yang akan mengelilingi tubulus prosikmal ansa henle, tubulus distal. Gambaran histologi dapat dilihat pada gambar 2.4.
dan 2.5 (Guyton dan Hall, 2006; Eroschenko, 2000; Purwanto, 2010).
Gambar 2.4. Histologi Ginjal 1 (Eroschenko, 2000)
commit to user
Gambar 2.5. Histologi Ginjal 2 (Eroschenko, 2000)
2.2. Penyakit Ginjal Kronik 2.2.1. Definisi
Penyakit ginjal kronik adalah suatu keadaan dimana terjadi kerusakan ginjal atau penurunan laju filtrasi glomerulus (LFG) < 60 mL/menit dalam waktu 3 bulan atau
commit to user
lebih. Penurunan fungsi ginjal terjadi secara berangsur-angsur dan irreversible yang akan berkembang terus dan berakhir menjadi gagal ginjal terminal serta memerlukan terapi pengganti ginjal yang tetap, baik berupa dialisis atau transplantasi ginjal (K/DOQI, 2002). Adanya kerusakan ginjal tersebut dapat dilihat dari kelainan yang terdapat dalam darah, urin, pencitraan, atau biopsi ginjal (Levey et al., 2003; National Kidney Foundation 2013).
Tabel 2.1. Kriteria Untuk Penyakit Ginjal Kronik(National Kidney Foundation 2013).
Kriteria untuk penyakit ginjal kronik (adanya kelainan yang mengikuti selama
> 3 bulan)
Marker kerusakan ginjal (satu atau lebih)
Albuminuria (AER ≥ 30 mg/24jam; ACR ≥ 30 mg/g [≥ 3 mg/mmol])
Abnormalitas sedimen urin
Abnormalitas elektrolit dan yang lain karena gangguan tubular
Abnormalitas yang terdeteksi secara histologis
Abnormalitas struktural yang terdeteksi secara imaging
Riwayat transplantasi ginjal
Penurunan GFR GFR ˂60 ml/min/1.73 m2 (Kategori GFR G3a- G5)
2.2.2. Klasifikasi
Penyakit ginjal kronik di bagi menjadi beberapa derajat dengan tujuan untuk pencegahan, identifikasi awal kerusakan ginjal dan penatalaksanaan, serta untuk pencegahan komplikasi (Levey et al., 2003, National Kidney Foundation 2013).
commit to user Kidney Foundation 2013).
Kategori LFG (ml/min/1,73 m 2) Keterangan
G1 ≥90 Normal atau tinggi
G2 60-89 Menurun ringan
G3a 45-59 Menurun ringan sampai sedang
G3b 30-44 Menurun sedang sampai berat
G4 15-29 Menurun berat
G5 15 Gagal ginjal
2.2.3. Etiologi
Ada beberapa penyebab penyakit ginjal kronik diantaranya adalah penyakit infeksi tubulointerstisial, penyakit peradangan, penyakit vaskuler dan hipertensi, penyakit metabolik, nefropati obsruktif. Beberapa contoh dari golongan penyakit tersebut adalah (Price, 2006; Nogueira A et al., 2017) :
a. Penyakit infeksi tubulointerstisial seperti pielonefritis kronik dan refluks nefropati.
b. Penyakit peradangan seperti glomerulonefritis.
c. Penyakit vaskular seperti hipertensi, nefrosklerosis benigna, nefrosklerosis maligna, dan stenosis arteria renalis.
d. Penyakit metabolik seperti diabetes melitus, gout, hiperparatiroidisme, dan amiloidosis.
e. Nefropati obstruktif seperti obstruksi traktus urinarius bagian atas karena batu, neoplasma, fibrosis retroperitoneal. Obstruksi traktus urinarius bagian bawah karena
commit to user
hipertropi prostat, striktur uretra, anomali kongenital leher vesika urinaria dan uretra.
2.2.4. Patogenesis penyakit ginjal kronik
Patogenisis PGK melibatkan dua mekanisme kerusakan : (1) Mekanisme pencentus spesifik sebagai penyakit yang mendasari kerusakan selanjutnya seperti kompleks imun dan mediator inflamasi pada glomerulonephritis atau paparan toksin pada penyakit tertentu di tubulus renal dan interstisium. (2) Mekanisme kerusakan progresif ditandai adanya hiperfiltrasi dan hipertrofi dari nefron yang tersisa, yang merupakan konsekuensi umum dari reduksi jangka panjang masa ginjal. Respon reduksi jumlah nefron dimediasi oleh hormon vasoaktif, sitokin, dan growth factor (Bargman dan Skorecki, 2015).
2.3. Propolis Lebah
Lebah menghasilkan beberapa produk seperti madu, royal jeli, polen dan propolis. Propolis sebagai kompleks resin dikumpulkan lebah madu dari berbagai sumber tanaman untuk kemudian dicampur dengan air liurnya, sehingga menghasilkan produk lebah yang bermanfaat (Marcucci et al., 2001; Salatino et al., 2005). Secara penampakan fisik (warna), aroma dan komposisi kimiawi propolis terlihat bervariasi tergantung dari berbagai faktor. Warnanya mungkin putih kekuningan (krem), kuning, hijau, coklat terang atau gelap. Beberapa sampel memiliki tekstur, rapuh keras, sedangkan sampel lainnya mungkin elastis dan kenyal. Propolis berasal dari bahasa Yunani, pro yang berarti pertahanan dan polis berarti kota. Dengan demikian menyiratkan bahwa propolis sebagai produk yang terlibat dalam pertahanan dari
commit to user
pemeliharaan, perlindungan dan mensterilkan sarang lebah (Marcucci et al., 2001).
Faktor-faktor biologi, zona geografi dan lingkungan dapat mempengaruhi jumlah dan kualitas produksi propolis (Pereira et al., 2009). Beberapa penelitian melaporkan bahwa komposisi propolis dipengaruhi oleh banyak faktor, seperti sumber bunga (jenis tanaman) untuk madu, musim dan faktor-faktor lingkungan (seperti jenis tanah dan iklim, faktor genetik, dan metode pengolahan). Dengan kata lain, kemungkinan efek-efek yang berhubungan dengan kesehatan sangat tergantung asal- usulnya (Baltrusaityte et al., 2007).
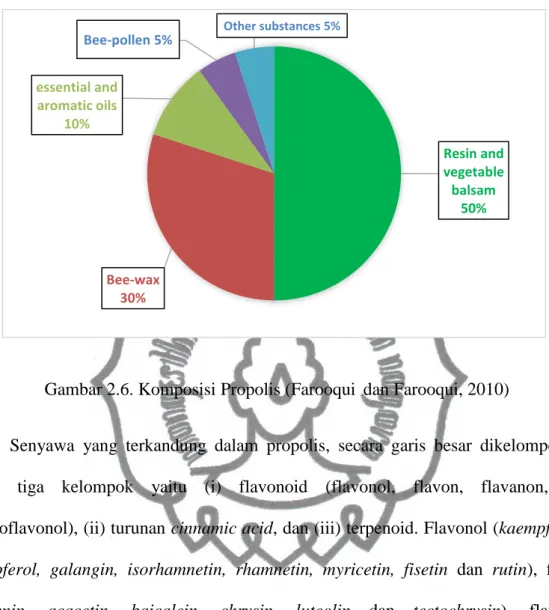
Komposisi propolis sangat kompleks. Unsur utamanya adalah lilin lebah, resin dan senyawa volatil. Lebah mensekresikan lilin lebah, sedangkan resin dan senyawa volatil berasal dari tanaman. Aktivitas biologis propolis ditentukan oleh zat tanaman ini berasal. Oleh karena itu, meskipun propolis jelas merupakan produk binatang, proporsi yang cukup besar dari komponen-komponennya yang berperan dalam menentukan aktivitas biologis berasal dari tanaman. Resin merupakan kandungan yang kebanyakan ditemukan dalam ekstrak alkohol dikonsumsi oleh orang dari berbagai negara sebagai makanan pelengkap atau obat alternatif (Salatino et al., 2005). Beberapa senyawa telah diidentifikasi dalam propolis, terutama resin (50%), lilin (30%), minyak esensial (10%), serbuk sari (5%) dan senyawa organik lainnya (5%) (Sivasubramaniam dan Seshadri, 2005; G´omez-Caravaca et al., 2006; Viuda-Martos et al., 2008; Farooqui dan Farooqui, 2010).
commit to user
Gambar 2.6. Komposisi Propolis (Farooqui dan Farooqui, 2010)
Senyawa yang terkandung dalam propolis, secara garis besar dikelompokkan dalam tiga kelompok yaitu (i) flavonoid (flavonol, flavon, flavanon, dan dihidroflavonol), (ii) turunan cinnamic acid, dan (iii) terpenoid. Flavonol (kaempferide, kaempferol, galangin, isorhamnetin, rhamnetin, myricetin, fisetin dan rutin), flavon (apigenin, acacetin, baicalein, chrysin, luteolin dan tectochrysin), flavanon (pinocembrin, sakuranetin dan isosakura-netin), turunan cinnamic acid (ferulic acid, p- coumaric acid dan caffeic acid) dan terpenoid (tt-farnesol,-caryophyllene,
terpineoldan syringaldehyde) (Sivasubramaniam dan Seshadri, 2005; Lotfy, 2006).
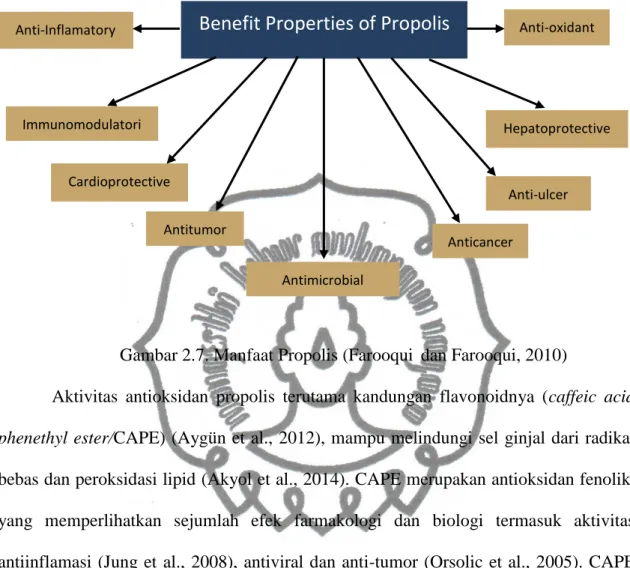
Senyawa-senyawa tersebut memiliki peran penting dalam aktivitas biologis propolis, antara lain sebagai imunomodulator, antimikrobial, antioksidan, antiinflamasi, antifungal, antiprotozoa, antiparasit dan antiproliferatif (Banskota et al., 2001; Koo et al., 2002; Ahn et al., 2004; Lotfy, 2006; El-Bassuony dan Abouzid, 2010; Farooqui dan Farooqui, 2010; Akyol et al., 2015)
Resin and vegetable balsam
50%
Bee-wax 30%
essential and aromatic oils
10%
Bee-pollen 5% Other substances 5%
commit to user
Gambar 2.7. Manfaat Propolis (Farooqui dan Farooqui, 2010)
Aktivitas antioksidan propolis terutama kandungan flavonoidnya (caffeic acid phenethyl ester/CAPE) (Aygün et al., 2012), mampu melindungi sel ginjal dari radikal bebas dan peroksidasi lipid (Akyol et al., 2014). CAPE merupakan antioksidan fenolik, yang memperlihatkan sejumlah efek farmakologi dan biologi termasuk aktivitas antiinflamasi (Jung et al., 2008), antiviral dan anti-tumor (Orsolic et al., 2005). CAPE merupakan penghambat yang poten dan spesifik terhadap aktivasi NFB (Fitzpatrick et al., 2001). Peningkatan ROS maupun aktifitas NFB pada pemberian OVA inhalasi, mampu diminimalkan dengan pemberian CAPE (Jung et al., 2008). CAPE sepenuhnya menghalangi produksi ROS pada neutrofil manusia dan dalam sistem xanthine / xanthine oxidase pada konsentrasi 10mol/L (Iraz et al., 2006). Bagaimanapun, CAPE menginduksi efek modulasi stres oksidatif dan sistem redoks antioksidan. Efek menguntungkan dari CAPE pada sistem antioksidan adalah mengatur peroksidasi lipid, NO, CAT, GSH-Px, dan SOD (Aygün et al., 2012). Zat aktif utama lainnya dari
Benefit Properties of Propolis
Anti-Inflamatory Anti-oxidant
Immunomodulatori
Cardioprotective
Antitumor
Antimicrobial
Anticancer
Anti-ulcer Hepatoprotective
commit to user
propolis adalah kuersetin. Kuersetin dapat mengurangi produksi nitric oxide (NO) yang di induksi lipopolisakarida, ekspresi inducible nitric oxide synthase (iNOS), dan pelepasan TNF-α serta IL-6. Kuersetin sangat mengurangi aktivasi mitogen-activated protein kinases (MAPK) dan NFκB, suatu kompleks faktor transkripsi yang sangat berperan dalam ekspresi gen-gen pro-inflamasi (Cho et al., 2003; Liu et al., 2012).
Hasil identifikasi kandungan zat aktif biologik utama dalam ekstrak etanol isolat propolis gunung Lawu didapatkan CAPE 30,24 ± 3,53 x 10-6 gram dan kuersetin 4,42 ± 0,50 x 10-6 gram sebagai dasar dalam penentuan dosis (Sarsono et al., 2012). Sebagai anti inflamasi ditunjukkan hasil penelitian lain yang didapatkan ekstrak etanol isolat propolis gunung Lawu menurunkan HMGB-1 mencit model infertilitas jantan (Indrayanto et al.,2013), sedangkan sebagai antioksidan isolat propolis gunung Lawu didapatkan hasil dosis 200mg/kgBB/hari selama 30 hari, menurunkan kadar MDA, meningkatkan kadar sRAGE, dan memperbaiki luka pada mencit Balb/C model kaki diabetik yang induksi STZ (Diding et al., 2013a,b).
commit to user
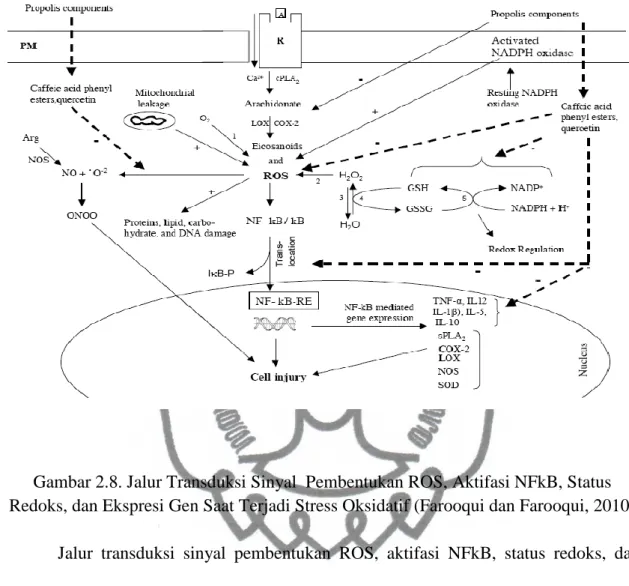
Gambar 2.8. Jalur Transduksi Sinyal Pembentukan ROS, Aktifasi NFkB, Status Redoks, dan Ekspresi Gen Saat Terjadi Stress Oksidatif (Farooqui dan Farooqui, 2010)
Jalur transduksi sinyal pembentukan ROS, aktifasi NFkB, status redoks, dan ekspresi gen saat terjadi stress oksidatif terjadi sebagai berikut :
1. NADPH Oksidase, Superoksida dismutase (NADPH + 2O2 ↔ NADP + 2O2− + H+). NADPH oxidase akan memproduksi superoksida dengan mentransfer elektron dari NADPH yang berada di dalam sel melewati membran dan menggabungkannya dengan oksigen molekuler yang kemudian akan membentuk anion superoksida (Kuwabara et al., 2015; Panday et al., 2015). Superoksida dapat diproduksi di dalam fagosom atau di luar sel. Di dalam fagosome, superoksida dapat secara langsung membentuk hidrogen peroksida yang akan mengalami reaksi lebih lanjut dan berakhir pada terbentuknya ROS (Mantegazza et al., 2008).
commit to user 2. Catalase (2 H2O2 → 2 H2O + O2).
Catalase merupakan enzim yang berperan sebagai katalis dalam proses dekomposisi hidrogen peroksida menjadi molekul air dan oksigen yang tidak terlalu reaktif (Klingelhoeffer, 2012).
3. Gluthatione peroxidase (2GSH + H2O2 → GS–SG + 2H2O) dan Gluthatione reductase: GS–SG + NADPH + H+ → 2 GSH + NADP+. Gluthatione peroksidase adalah salah satu enzim yang berperan dalam menurunkan kadar oksidan hidrogen peroksida (H2O2). Mekanisme kerjanya melalui oksidasi selenol oleh H2O2.
Proses tersebut akan menghasilkan derivat dari gugus selenenic acid (RSeOH) yang akan dirubah kembali menjadi selenol melalui proses dua tingkat yang dimulai dengan reaksi pada GSH yang membentuk GS-SeR dan H2O. Molekul GSH yang kedua memecah GS-SeR menjadi selenol, melepaskan GS-SG sebagai produk sampingan (Pavarino et al., 2013).
Glutathione reductase berfungsi sebagai katalis proses perubahan glutation disulfide (GS-SG) menjadi glutathione (GSH), yang merupakan molekul penting dalam mencegah stres oksidatif. Glutathione reductase menggunakan FAD prosthetic group dan NADPH untuk mengurangi satu molar GSSG menjadi dua molar GSH. Kadar Glutation yang berkurang akan menurunkan kadar enzim glutathione peroxidase yang teroksidasi, yang kemudian menurunkan H2O2 (Tandogan, 2006) .
commit to user
4. Cytocolic phospholipase A2 (cPLA2) adalah enzim yang melepaskan asam lemak dari gliserol. Enzim ini akan menghidrolisis ikatan fosfolipid dan melepaskan asam arakidonat dan asam lisofosfatidik (Burke, 2009). Dalam proses modifikasi oleh siklooksigenase, asam arakidonat akan dirubah menjadi senyawa aktif bernama eikosanoid. Yang termasuk di dalam keluarga eikosanoid adalah prostaglandin dan leukotrien, yang merupakan mediator antiinflamasi dan inflamasi (Han et al., 2003).
5. Propolis mengandung berbagai senyawa flavonoid yang mempunyai efek antioksidan dan antiinflamasi. Pada proses pembentukan ROS seperti yang dijelaskan di atas, senyawa-senyawa tersebut mempunyai efek penghambatan produksi ROS dan inflamasi di beberapa jalur tranduksi. Kandungan propolis seperti CAPE dan kuersetin dapat menetralisir superoksida dan mencegah terbentuknya peroksi nitrit dengan transfer hidrogen melalui gugus katekol yang menjadikannya scavenger radikal bebas yang efektif (Wu et al., 2007). CAPE juga dapat menghambat produksi ROS dengan menghambat interaksi antara 5- lipoksigenase dengan substrat-substratnya (Sud’ina et al., 1993).
commit to user
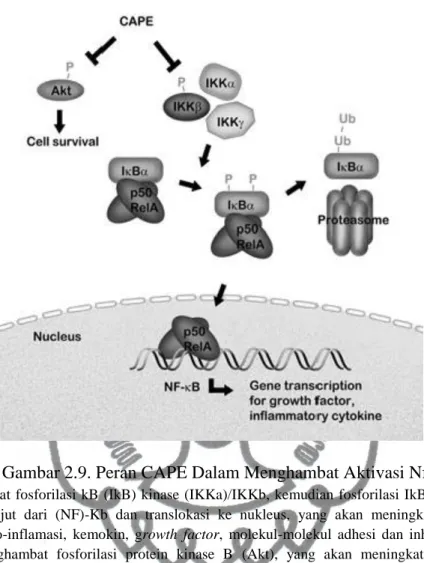
Gambar 2.9. Peran CAPE Dalam Menghambat Aktivasi NfKB.
CAPE menghambat fosforilasi kB (IkB) kinase (IKKa)/IKKb, kemudian fosforilasi IkBa, degradasi dan aktivasi lebih lanjut dari (NF)-Kb dan translokasi ke nukleus, yang akan meningkatkan transkripsi sitokin-sitokin pro-inflamasi, kemokin, growth factor, molekul-molekul adhesi dan inhibitor apoptosis.
CAPE juga menghambat fosforilasi protein kinase B (Akt), yang akan meningkatkan kemampuan
“Survival” dan pertumbuhan dari sel. Efek penghambatan CAPE akan berakibat pada penurunan produksi sitokin pro inflamasi dan proliferasi sel T CD4 (Wang et al., 2010 ).
Propolis mempunyai efek antiinflamasi dengan menghambat aktifasi NFkB dengan mengganggu proses fosforilasi (IkB) kinase (IKKa)/IKKb, fosforilasi IkBa, aktivasi lebih lanjut dari NFkB dan translokasi ke nukleus (Wang et al., 2010). Di studi lain, kuersetin dapat menurunkan sinyal yang diregulasi kinase, c-Jun N-terminal kinase, p38,Akt, Src, Janus kinase-1, Tyk2, transduser sinyal dan aktifator transcription- 1,serta NFkB (Kao et al., 2010).
commit to user
Dalam keadaan normal, ginjal menghasilkan ROS, termasuk anion superoksida, hidrogen peroksida, radikal hidroksil dan peroksi nitrit, yang efisien dieliminasi secara enzimatik oleh superoxide dismutase (SOD), katalase, glutathione peroxidase (GPX) dan non sistem enzimatik (glutation, Vitamin C dan E). Stres oksidatif terjadi ketika produksi ROS meningkat melebihi kapasitas metabolisme dari sistem pertahanan antioksidan dan sering mengakibatkan kerusakan jaringan (Bae et al., 2007).
Stres oksidatif dan ROS dapat memodifikasi lipid, protein, karbohidrat dan asam nukleat, serta menginduksi transisi permeabilitas mitokondria, memberikan sinyal yang mengarah ke induksi autofagi, apoptosis, dan nekrosis. Protein HMGB-1 merupakan protein nukleus yang mengikat kromatin dan molekul damage-associated molecular pattern (DAMP) dan merupakan bagian integral dari stres oksidatif dan apoptosis atau kesintasan. Sebagai protein sensitif redoks, HMGB-1 berisi tiga sistein (Cys23, 45, dan 106). Dalam pengaturan stres oksidatif, HMGB-1 dapat membentuk ikatan disulfida Cys23-Cys45; homo atau heterodimerisasi oksidatif melalui Cys106 yang berperan dalam aktivitas biologisnya. HMGB-1 menyebabkan aktivasi nicotinamide adenine dinucleotide phosphate oxidase (NADPH oxidase) dan peningkatan produksi ROS dalam neutrofil. HMGB-1 yang tereduksi dan teroksidasi memiliki peran yang berbeda dalam sinyal ekstraseluler dan regulasi respon imun serta dimediasi oleh sinyal melalui receptor for advanced glycation end products (RAGE) dan / atau TLR. Antioksidan seperti etil piruvat, kuersetin, teh hijau, N-asetilsistein, serta kurkumin memiliki efek protektif dalam pengaturan infeksi / sepsis dan jejas termasuk reperfusi iskemia,
commit to user
sebagian melalui pengurangan pelepasan dan akumulasi sistemik dari HMGB-1 (Tang et al., 2011).
Respons inflamasi setelah cedera steril sangat menyerupai seperti yang terlihat selama infeksi, dengan pola produksi sitokin dan kemokin yang sama. Pathogen- associated molecular patterns (PAMP) merupakan istilah terbatas untuk pola molekul eksogen pada patogen, analognya untuk endogen disebut alarmin. PAMP eksogen dan alarmin endogen merupakan sub kelompok dari sinyal berbahaya yang disebut damage associated molecular patterns (DAMPs). Alarmin berperan baik dalam infeksi maupun inflamasi steril, hadir baik secara lokal atau sistemik pada sepsis berat, luka bakar, infeksi, artritis dan kanker. Alarmin ditemukan dalam berbagai organel semua jenis sel dan berguna untuk mempertahankan fungsi homeostasis dalam sel normal. Alarmin ditemukan dalam nukleus sebagai faktor transkripsi (HMGB-1), dalam sitoplasma sebagai regulator kalsium (S100s), di eksosome sebagai pendamping (heat shock protein/HSPs), asam urat, DNA atau sebagai komponen dari matriks sel (hialuronan).
Meskipun lokasinya beragam, selama kondisi homeostatis alarmin memiliki banyak karakteristik fungsional umum. Selain aktivasi imunitas, alarmin dilepaskan cepat selama nekrosis, skuester apoptosis, sekresi aktif oleh sel imunitas tubuh, dan akhirnya mempromosikan homeostasis (Klune, 2008).
Cedera reperfusi iskemia merupakan proses patofisiologi dimana terjadi kerusakan organ hipoksia setelah kembalinya aliran darah dan pengiriman oksigen.
Tidak adanya oksigen dan nutrisi dari darah membuat kondisi pada pemulihan sirkulasi terjadi peradangan dan kerusakan oksidatif melalui induksi stres oksidatif. Episode transien iskemia yang dihadapi selama transplantasi organ padat, trauma, syok
commit to user
total digunakan untuk meminimalkan kehilangan darah. Kadar HMGB-1 meningkat selama mencit mengalami reperfusi iskemia hati 1 jam setelah reperfusi dan kemudian meningkat tergantung waktu hingga 24 jam. Penghambatan aktivitas HMGB-1 dengan antibodi secara signifikan menurunkan kerusakan hati setelah reperfusi iskemia, sedangkan pemberian rekombinan HMGB-1 terjadi perburukan cedera reperfusi iskemia. Selain itu, HMGB-1 merupakan mediator awal dari cedera dan peradangan pada reperfusi iskemia hati dan ginjal, serta berimplikasi pada TLR-4, TLR-9, RAGE sebagai reseptor yang terlibat dalam proses ini (Tang et al., 2011).
HMGB-1 merupakan penanda cedera pada hati manusia dan transplantasi ginjal.
Selanjutnya, pelepasan HMGB-1 yang disebabkan oleh iskemia hati melibatkan produksi ROS tergantung TLR-4 dan sinyal yang dimediasi kalsium. Pelepasan HMGB- 1 yang disebabkan oleh stres oksidatif dapat dikurangi dengan penghambatan kinase yang tergantung kalsium / kalmodulin. Penghambatan aktivitas HMGB-1 dengan injeksi antibodi penetral sebagian mengurangi peningkatan SOD hati yaitu suatu enzim antioksidan utama mitokondria, setelah reperfusi iskemia. Pretreatment mencit dengan penghambat HMGB-1 secara signifikan menurunkan kerusakan hati setelah reperfusi iskemia. Perlindungan diamati pada mencit pra-perawatan dengan HMGB-1 dikaitkan dengan tingginya ekspresi kinase-M terkait IL-1R, sebagai regulator negatif sinyal TLR-4, dibandingkan dengan kontrol. Selain itu, jalur HMGB-1-TLR-4 juga berperan penting dalam inisiasi inflamasi sistemik dan cedera end-organ setelah cedera jaringan perifer yang terisolasi (Kruger et al., 2009; Yun et al., 2010; Tang et al., 2011).
commit to user
Gambar 2.10. Jalur Sinyal Cedera Reperfusi Iskemia Yang Dimediasi HMGB-1.
HMGB1 adalah mediator awal dari cedera dan inflamasi di liver, ginjal, jantung dan cedera reperfusi iskemia otak dan melibatkan TLR-4, TLR-9, dan RAGE sebagai reseptor yang terlibat dalam proses ini.
Fungsi ekstraseluler HMGB-1 sebagian melalui aktivasi jalur MAPK dan NFκB (Tang et al., 2011).
2.5. Peran Caspase-1 Dalam Penyakit Ginjal Kronik
Caspase-1 merupakan enzim yang terlibat dalam pembelahan protein prekursor dari sitokin inflamasi IL-1β dan IL-18, menjadi peptida dewasa aktif dan berperan sebagai mediator inflamasi utama yang mendorong respon host terhadap infeksi, cedera, dan penyakit (Denes et al., 2012). Caspase-1 diproduksi sebagai zymogen (pro-enzim), merupakan protein heterodimer sebagai subunit enzim aktif yang terdiri dari protein 20 kDa (P20) dan 10 kDa (p10). Caspase-1 akan berinteraksi dengan protein lain yang mengandung domain CARD sebagai PYCARD (atau ASC) dan terlibat dalam pembentukan inflamasom serta aktivasi proses inflamasi (Denes et al., 2012; Doitsh et al., 2014; Monroe et al., 2014).
commit to user
terjadi hampir di semua penyakit ginjal. Inflamasi ginjal selalu melibatkan sistem imunitas bawaan, sedangkan imunitas adaptif bisa terlibat atau tidak dilibatkan. Sistem imunitas bawaan melibatkan beberapa keluarga dari reseptor baik terlarut dan seluler yang mengaktifkan jalur sinyal proinflamasi. Inflamasom berperan dalam penyakit ginjal kronik dan sitokin yang diatur inflamasom seperti IL-1β dan IL-18 terlibat dalam model hewan atau manusia dengan penyakit ginjal kronik. IL-1β dan IL-18 mendorong penanda mesenkhim di sel epitel tubulus yang tergantung pada dosis. Pada manusia, IL- 18 dan caspase-1 diekspresikan dalam epitel tubulus ginjal dan pasien dengan penyakit ginjal kronik atau sindrom nefrotik menunjukkan peningkatan kadar IL-18. Demikian pula, netralisasi IL-18 dapat mencegah cedera ginjal dan fibrosis setelah unilateral ureteric obstruction (UUO) pada tikus (Hans-Joachim dan Muruve, 2011).
Cedera sel tubulus ginjal yang terjadi sebagai akibat dari berbagai induksi, termasuk iskemia, obstruksi, dan mekanisme sistem imun akan menyebabkan pelepasan komponen seluler endogen dan mampu mengaktifkan inflamasom NLRP3. Sejumlah DAMP akan dilepaskan selama cedera ginjal serta mampu mengaktifkan inflamasom NLRP3, termasuk potassium efflux, ROS, ATP ekstraseluler, stres mitokondria, stres retikulum endoplasma, pembengkakan sel, asam urat, asam nukleat, dan komponen matriks ekstraseluler seperti hialuronan dan biglikan (Hans-Joachim dan Muruve, 2011;
Chang et al., 2014).
commit to user
Gambar 2.11. Pola Pengenalan Reseptor Dalam Menginduksi Imunitas Bawaan (Hans-Joachim dan Muruve, 2011).
Reseptor seluler termasuk Toll-like receptors (TLRs), retinoic acid-induced gene-like receptors, nucleotide-binding domain-leucine-rich repeat (or NOD-like receptors; NLRs), reseptor scavenger, dan C-type lectins diaktivasi oleh sejumlah pathogen-associated molecular patterns (PAMPs) bakteri dan virus, mengakibatkan aktivasi nuclear factor-κB (NF-κB), factor pengatur IFN, dan jalur sinyal mitogen- activated protein kinase(MAPK) untuk memodulasi gen proinflamasi dan IFN tipe-1.
Inflamasom merupakan kompleks protein sitosolik yang biasanya terdiri dari tiga komponen: 1) sensor (NOD-like receptor (NLR) atau non-NLR); 2) protein adapter;
dan 3) caspase-1. Keluarga NLR merupakan molekul sensor yang terdiri dari NOD-, LRR- dan PYD yang mengandung protein, meliputi NLRP1, NLRP3, NLRP6, NLRP7, dan NLRP12 (Chang et al., 2014).
commit to user
Gambar 2.12. Aktivasi Inflamasom NLRP3 (Chang et al., 2014)
Berbagai PAMP dan DAMP dapat mengaktifkan inflamasom NLRP3 secara tidak langsung melalui mekanisme perantara yang berbeda termasuk efflux K + melalui reseptor 2X7 purinergik, pecahnya lisozim, dan produksi ROS. Perakitan kompleks inflamasom NLRP3 akan mengaktivasi caspase-1 yang pada gilirannya membelah pro-IL-1β dan pro-IL-18 menjadi IL-1β dan IL-18 yang aktif. PAMP dan DAMP juga mengaktifkan inflamasom NLRP3 melalui TLR yang menyebabkan peningkatan transkripsi melalui NF-kB. PAMPs = pattern-associated molecular patterns, DAMPs = damage-associated molecular patterns, NBD = nucleotide-binding domain, LRR = leucine-rich repeat, PYD = pyrin domain, CARD = caspase activation and recruitment domain, NLRP3 = NOD-, LRR- and PYD-containing 3, ROS = reactive oxygen species, TLR = toll-like receptor
2.6. Peran E-Selektin Pada Penyakit Ginjal Kronik
Selektin merupakan famili molekul adesi sel. Seluruh selektin merupakan glikprotein transmembran rantai tunggal yang serupa dengan C-type lectine karena berhubungan dengan ikatan calcium dependent dan amino terminus. Terdapat tiga subset selektin, yaitu E-selektin (dalam sel endotelial), L-selektin (dalam leukosit), P- selektin (dalam trombosit dan sel endotelial) (Purwanto, 2010).
Nama selektin berasal dari kata “selected” dan “lectine” yang merupakan tipe karbohidrat untuk mengenali protein. Bila ada stimulus inflamasi seperti histamin dan trombin menyebabkan sel endotelial mengekspresikan E-selektin dari penyimpanan di dalam sel ke permukaan sel. Selain itu, sitokin seperti TNF-α menstimulasi ekspresi E-
commit to user
selektin dan P-selektin setelah beberapa jam (Purwanto, 2010). TNF – α selain bersifat proteolitik merusak glikoprotein pada permukaan podosit juga dapat menyebabkan kematian sel. TNF – α dapat memacu endotel, sehingga endotel akan mengekspresikan e-selektin, e-selektin akan mengikat sel sel leukosit PMN, PMN akan mengekspresikan lisosim. Lisosim merupakan proteolitik yang kuat sehingga dapat menyebabkan nekrosis sel (Purwanto, 2012).
Selama inflamasi, E-selektin memiliki peran penting dalam mengikat PMN ke lokasi cedera. Pelepasan IL-1 dan TNF– α pada lokasi kerusakan sel menstimulasi ekspresi E-selektin dari endotel pembuluh darah. Leukosit dalam darah mengekspresikan ligand yang tepat kemudian berikatan dengan E-selektin, menyebabkan leukosit “bergerak” di sepanjang dinding dalam pembuluh darah.
Terjadinya disfungsi endotel pada pembuluh darah, juga akan terjadi disfungsi endotel kapiler glomerulus yang akan mengurangi negatifitas sehingga terjadi mikroalbuminuria (Purwanto, 2012).
E-selektin, juga dikenal sebagai CD62E, endothelial-leukocyte adhesion molecule 1 (ELAM-1), atau leukocyte-endothelial cell adhesion molecule 2 (LECAM2) merupakan molekul adhesi sel yang diekspresikan hanya pada sel endotel yang diaktifkan oleh sitokin. Seperti selektin lainnya, E-selektin berperan penting dalam inflamasi. Struktur E-selektin terdiri dari ujung terminal N, domain lectin tipe-C, EGF (epidermal-growth-factor)-like domain, 6 Complement control protein domain (SCR repeat) units, transmembrane domain (TM) dan ujung sitoplasmik intraseluler (cyto). Polimorfonuklear (PMN) akan bergulir perlahan di E-selektin pada mikrovaskuler yang mengalami inflamasi. Hal ini penting untuk fungsi imunitas tubuh
commit to user
seperti sICAM-1, sVCAM-1, dan sE-selektin akan memicu homing leukosit, adhesi, dan migrasi ke dalam ruang subendotel, sebagai proses mendasar untuk pembentukan lesi aterosklerosis. Peningkatan kadar sICAM-1, sVCAM-1 dan sE-selectin ditemukan pada pasien penyakit ginjal kronik yang menjalani hemodialisis. Penelitian lain menunjukkan kadar serum sVCAM-1 dan sE-selektin meningkat secara bermakna pada pasien penyakit ginjal kronik (Chen et al., 2015).
2.7. Peran Stres Oksidatif Pada Penyakit Ginjal Kronik
Mekanisme patologi utama yang menghubungkan stres oksidatif, inflamasi, dan perkembangan penyakit ginjal kronik ditandai dengan cedera awal dalam ginjal akibat aktivitas unsur-unsur radikal turunan oksigen baik intra dan ekstraseluler serta respons inflamasi yang dihasilkan. Radikal seperti superoksida dan radikal hidroksil mudah berinteraksi dengan komponen molekul dari nefron. Interaksi molekul radikal, termasuk oksidasi asam amino yang mengakibatkan hilangnya sifat fungsionalnya, peroksidasi lipid dari membran sel yang mengakibatkan kelangsungan membran menurun, dan pembelahan serta reaksi silang dari DNA ginjal mengakibatkan mutasi yang berbahaya.
Interaksi radikal semacam ini mengakibatkan kerusakan langsung ke nefron dan produksi radikal sekunder. Misalnya, superoksida dapat dikonversi menjadi hidrogen peroksida melalui superoksida dismutase, yang selanjutnya dapat diubah menjadi hipoklorit, melalui mieloperoksidase, atau radikal hidroksil, melalui ion Ferrous.
Radikal superoksida juga dapat berinteraksi dengan oksida nitrat untuk membentuk peroksinitrit. Radikal sekunder memiliki potensi destruktif sama dengan radikal yang memulainya, keadaan ini mengarah ke reaksi berantai yang merusak dan ditandai
commit to user
dengan kerusakan nefron tingkat sel / molekul serta produksi radikal berkelanjutan (Tucker et al., 2015). Suatu penanda biologis yang menunjukkan stres oksidatif yang berhubungan dengan peroksidasi lipid dalam cairan tubuh atau sel adalah Malondialdehid (MDA), karena MDA plasma merupakan produk peroksidasi lipid stabil (Najafi et al., 2012).
Malondialdehid yang dihasilkan in vivo melalui peroksidasi dari asam lemak tak jenuh ganda, akan berinteraksi dengan protein dan berpotensi aterogenik. MDA biasanya diukur dari sampel plasma dengan metode yang paling populer dengan alat tes kolorimetri berdasarkan reaksi antara MDA dan thiobarbituric acid (TBA). Namun, meskipun sensitivitasnya tinggi, uji TBA reacting substances (TBARS) tidak memiliki spesifisitas untuk MDA, karena aldehida selain MDA dapat bereaksi dengan TBA untuk menghasilkan senyawa yang menyerap dalam kisaran sama dengan MDA (Meagher dan FitzGerald, 2000). Beberapa kit ELISA untuk mendeteksi MDA juga tersedia secara komersial. Pengujian berbasis antibodi ini biasanya divalidasi terhadap pengukuran MDA dengan high-performance liquid chromatography (HPLC) dan menunjukkan kinerja yang baik dengan peningkatan spesifisitas (Bevan et al., 2003).
Beberapa penulis telah melaporkan bahwa pasien dengan penyakit ginjal kronik, bahkan dalam tahap awal, ada produksi ROS berlimpah terutama disebabkan oleh hiperaktivasi dari NADPH oksidase, peningkatan sintesis penanda stres oksidatif [misalnya, F2-isoprostanes, MDA, advanced oxidation protein products (AOPP) dan pelepasan toksin uremik. Semua faktor ini berbanding terbalik dengan laju filtrasi glomerulus (GFR). Meskipun diperlukan untuk menjamin kelangsungan hidup pasien, hemodialisis (HD) dan peritoneal dialisis (PD) memperburuk stres oksidatif akibat
commit to user
HD, kontak sel mononuklear darah perifer dengan plastifican dan filter serta kontaminasi mikroba bersama-sama dengan pelepasan pirogen di dialisat menginduksi sintesis ROS sebagai bagian dari respons imun. Selain itu, pasien dengan penyakit ginjal kronik yang menjalani HD menunjukkan peningkatan peroksidasi lipid arakhidonoil yang dikatalisasi radikal bebas dengan produksi tinggi dari produk peroksidasi lipid (Kuchta et al., 2011; Granata et al., 2015).
Gambar 2.13. Mekanisme Stres Oksidatif Pada Penyakit Ginjal Kronik (Granata et al., 2015)
Skema representasi dari keterlibatan mitokondria pada penyakit ginjal kronik. Dalam kondisi patologis ini, penurunan mitokondria (terutama ditandai dengan penurunan biogenesis mitokondria, hilangnya potensial membran mitokondria, dan penurunan produksi ATP) menyebabkan pelepasan besar ROS yang dapat berkontribusi terhadap mikroinflamasi kronik melalui aktivasi inflammasome NLRP3. Pada saat yang sama, selama penyakit ginjal kronik, nuclear factor erythroid 2-related factor 2(NRF-2) dan salah satu gen sasaran superoxide dismutase 2 (SOD2) terkait stres oksidatif meningkat, dalam upaya untuk menetralisir produksi ROS.
commit to user
Mitokondria berperan dalam sejumlah fungsi sel termasuk homeostasis ion, heme dan sintesis steroid, signaling kalsium dan apoptosis. Peran menonjol dari organel ini adalah menghasilkan energi untuk metabolisme sel oleh oxidative phosphorylation system (OXPHOS). Mitokondria bisa menjadi target farmakologi di masa depan yang berharga untuk pasien dengan gangguan ginjal, dikombinasikan dengan terapi konvensional dan gaya hidup yang tepat, menargetkan stres oksidatif mitokondria yang diturunkan, bisa mencegah dan memperlambat perkembangan penyakit ginjal kronik serta meminimalkan perkembangan komplikasi sistemik yang berat. Saat ini, agen bertarget mitokondria dan antioksidan yang tersedia adalah antioksidan endogen dan yang berasal dari makanan, ekstrak tanaman alami, obat konvensional dengan efek samping antioksidan yang menguntungkan, molekul dengan target mitokondria (Granata et al., 2015).
Gambar 2.14. Tempat Target Agen Antioksidan Utama (Granata et al., 2015).
commit to user
2.8. Peran TGF-β1 Dalam Perkembangan Fibrosis Pada Penyakit Ginjal Kronik Fibrosis ginjal, ditandai dengan deposisi berlebihan ECM (matriks ekstraselular), yang dikenal sebagai fitur patologis umum dari penyakit ginjal kronik dan mengarah ke pengembangan ESRD (penyakit ginjal stadium akhir), disertai dengan perkembangan kerusakan ginjal. Meskipun terapi yang efektif untuk fibrosis ginjal masih kurang, sejumlah studi menunjukkan bahwa TGF-β1 merupakan mediator kunci dalam penyakit ginjal kronik yang dikaitkan dengan fibrosis ginjal progresif. TGF-β1 memiliki beberapa sifat biologis termasuk proliferasi sel, diferensiasi, apoptosis, autofagi, produksi ECM, dll. Kolagen merupakan komponen utama dari ECM di ginjal, dan kolagen tipe I merupakan jenis kolagen utama yang berhubungan dengan derajat penyakit. Fibrosis ginjal ditandai dengan akumulasi fibroblas dan protein matriks yang berlebihan yang di ikuti dengan hilangnya fungsi nefron yang merupakan ciri patologis utama dari penyakit ginjal progresif. Banyak penelitian menunjukkan bahwa fibrosis ginjal progresif dimediasi oleh beberapa mediator termasuk faktor pertumbuhan, sitokin, toksin metabolisme, dan molekul stres melalui beberapa mekanisme dan jalur.
Di antara jalur tersebut, TGF-β1 telah diakui sebagai mediator kunci dalam patogenesis fibrosis ginjal (Meng et al., 2015).
Transforming growth factor-beta (TGF-β) merupakan regulator multifungsi yang memodulasi proliferasi sel, diferensiasi, apoptosis, adhesi dan migrasi berbagai jenis sel dan menginduksi produksi protein ECM. TGF-β superfamili, ditandai dengan 6 residu sistein, dikodekan oleh 42 kerangka terbuka dan terdiri dari >30 anggota pada mamalia, termasuk 3 TGF-β, 4 activin dan lebih dari 20 bone morphogenetic protein (BMP). Tiga isoform mamalia dari subfamili TGF-β (TGF-β1, TGF-β2, TGF-β3)
commit to user
disusun oleh 70-82% asam amino homolog dan melakukan aktivitas kualitatif serupa dalam sistem yang berbeda. Bentuk aktif dari sitokin TGF-β adalah dalam bentuk dimer yang distabilkan oleh interaksi hidrofobik, yang diperkuat oleh jembatan disulfida intersubunit. TGFβ-1 merupakan peptida dari 112 residu asam amino yang diperoleh melalui pembelahan proteolitik dari C-terminal protein prekursor. Protein ini berinteraksi dengan reseptor permukaan sel golongan kinase protein serin / treonin, dan menghasilkan sinyal intraseluler menggunakan Smads. Mereka berperan penting dalam regulasi proses biologis dasar seperti pertumbuhan, perkembangan, homeostasis jaringan dan regulasi sistem imunitas tubuh (Loeffler dan Wolf, 2013).
TGF-β1 disintesis oleh berbagai sel, termasuk sel haematopoietik imatur, sel T dan B aktif, makrofag, neutrofil dan sel dendrit, serta semua jenis sel ginjal dan dikeluarkan sebagai kompleks prekursor laten (latent TGF-β1) dengan latent TGF-β binding proteins (LTBP). TGF-β1 menjadi aktif ketika TGF-β1 dibebaskan dari latency- associated peptide (LAP) dan dipisahkan dari LTBP melalui pembelahan proteolitik oleh plasmin, ROS, thrombospondin-1, dan asam. TGF-β1 aktif kemudian terikat pada reseptornya dan berfungsi sebagai autokrin dan parakrin untuk mengerahkan aktivitas biologis dan patologis melalui jalur sinyal yang tergantung dan tidak tergantung Smad.
Namun, mekanisme Smad-dependent dianggap sebagai jalur utama dalam banyak proses patofisiologi penyakit ginjal (Lan, 2011; Loeffler dan Wolf, 2013).
TGF-β1 memainkan peran penting dalam memodulasi respon inflamasi dan proses biologis lainnya seperti remodelling jaringan dan perkembangan kanker melalui pengaturan produksi MMP, yang produksinya diatur melalui lintas jalur antara Smad dan Nf-B (Purwanto, 2010; Lan, 2011).
commit to user
Gambar 2.15. Mekanisme Fibrosis (Robbins dan Cotran, 2005)
Pengikatan TGF-β1 ke reseptor TGF-β tipe II (TβRII) dapat mengaktifkan reseptor TGF-β tipe I (TβRI)-kinase, sehingga terjadi fosforilasi Smad2 dan Smad3.
Selanjutnya, Smad2 dan Smad3 yang terfosforilasi berikatan dengan Smad4 dan membentuk kompleks Smad, yang bertranslokasi ke inti untuk mengatur transkripsi gen sasaran, termasuk Smad7 (Gambar 2.16). Smad7 adalah penghambat Smad sebagai regulator negatif aktivasi dan fungsi Smad2 serta Smad3 dengan sasaran untuk degradasi TβRI dan Smads melalui mekanisme degradasi proteasome eubiquitin (Lan, 2011).
Selain itu, angiotensin II juga merangsang penyerapan protein yang di ultrafilter ke dalam sel tubular dan meningkatkan produksi sitokin proinflamasi dalam sel. Terjadi migrasi makrofag dan sel inflamasi lainnya ke tubulo-interstisial. Peningkatan sintesis dan penurunan protein matriks ekstraselular dalam sel-sel tubular dan fibroblas interstisial berkontribusi pada fibrosis interstisial. Selain itu, konsentrasi angiotensin II dan TGF-1 yang tinggi menyebabkan sel-sel tubular dapat mengubah fenotipenya dan
commit to user
menjadi fibroblas melalui suatu proses yang disebut EMT yang berkontribusi pada fibrosis interstisial dan atrofi tubular karena sel-sel epitel menghilang (Ziyadeh dan Wolf, 2008).
Perkembangan penelitian terbaru, didapatkan bahwa bone morphogenic protein- 7 (BMP-7) yang diekspresikan pada sel-sel tubulus distal ginjal yang merupakan superfamili dari TGF- memiliki efek berlawanan (antagonis). Dari hasil berbagai penelitian pemberian BMP-7 akan mengurangi aktivitas TGF-1 sehingga mencegah terjadinya glomerulosklerosis dan fibrosis interstisial (Motazed et al., 2008; Zeisberg dan Kalluri, 2008).
Gambar 2.16. Jalur Crosstalk TGF-β/Smads Pada Fibrosis dan Inflamasi Ginjal.
Setelah mengikat TβRII, TGF-β1 mengaktifkan TβRI-kinase yang memfosforilasi Smad2 dan Smad3. Smad2 dan Smad3 yang terfosforilasi kemudian mengikat Smad4 dan membentuk kompleks Smad, yang translokasi ke dalam inti dan mengatur transkripsi gen sasaran, termasuk Smad7. Smad7 adalah penghambat Smad yang berfungsi untuk memblokir aktivasi Smad 2/3 dengan mendegradasi TβRI dan Smads serta menghambat respons inflamasi yang digerakkan NF-kB dengan menginduksi IκBα (penghambat NF-kB). Angiotensin II dan AGEs dapat mengaktifkan Smads yang tidak tergantung TGF-β1 melalui jalur crosstalk ERK/p38/MAPK.
Garis biru (simbol) menunjukkan jalur regulasi negatif atau pelindung, sedangkan panah merah (simbol) merupakan jalur regulasi positif atau patogenik (Lan, 2011).
commit to user
dalam patogenesis fibrosis ginjal karena TGF-β1 sangat meningkat pada penyakit ginjal dengan fibrosis ginjal berat. TGF-β1 menjadi perantara fibrosis ginjal progresif dengan merangsang produksi sekaligus menghambat degradasi ECM. Selain itu, TGF-β1 juga menjadi perantara fibrosis ginjal dengan menginduksi transformasi sel epitel tubular menjadi miofibroblas melalui EMT. Peran fungsional TGF-β1 dalam EMT dan fibrosis ginjal ditunjukkan oleh kemampuan pemblokiran TGF-β1 dengan antibodi TGF-β untuk mencegah atau memperbaiki fibrosis ginjal baik secara in vivo dan in vitro. Bukti langsung peran TGF-β1 pada fibrosis ginjal berasal dari penelitian bahwa tikus yang mengekspresikan bentuk aktif TGF-β1 dalam hati akan berkembang menjadi fibrosis hati dan ginjal yang progresif (Huang et al., 2008; Lan, 2011).
Gambar 2.17. Inflamasi dan TGF-β Mendorong Transisi Mesensimal.
Epithelial-mesenchymal transition (EMT) berlangsung selama perkembangan, dan berperan dalam invasi kanker dan pembentukan miofibroblas yang berkontribusi terhadap fibrosis.
Sebagai respons terhadap cedera, sel-sel inflamasi dan fibroblas aktif menghasilkan faktor pertumbuhan seperti TGF-β dan FGF-2, serta MMP dan kemokin. TGF-β dan faktor-faktor lain memicu kaskade sinyal pada sel epitel yang menyebabkan perubahan dari epitel ke fenotipe mesensimal (Lopez-Novoa dan Nieto, 2009).
commit to user 2.9. Hipertensi Pada Penyakit Ginjal Kronik
Hipertensi pada pasien PGK merupakan suatu hal yang umum. Sebagian besar pasien PGK akan juga menderita tekanan darah tinggi, bahkan tekanan darah tinggi menjadi salah satu ciri-ciri yang paling sering dijumpai pada klinis pasien PGK.
Hipertensi bisa merupakan sebab dan konsekuensi dari PGK. Tekanan darah sistemik yang terus menerus tinggi lama-kelamaan akan mengganggu sistem autoregulasi ginjal dan pada akhirnya akan menyebabkan diteruskannya tekanan tersebut ke dalam ginjal.
Hal ini akan mencederai ginjal dan lama-kelamaan akan menjadi penyakit ginjal kronis (Bidani et al., 2013).
Bagaimana hipertensi menyebabkan kerusakan pada ginjal masih belum sepenuhnya diketahui. Terdapat beberapa teori yang berujung pada kerusakan dan fibrosis ginjal. Teori pertama mengajukan adanya perubahan sistemik yang mengakibatkan perubahan pada sistem pembuluh darah makro dan mikro ginjal yang akan mengganggu kemampuan auto-regulasi ginjal dan berakibat akan meningkatkan tekanan kapiler intra-glomerulus. Hal ini kemudian akan memicu kerusakan yang diperantarai oleh hiperfiltrasi ginjal. Hiperfiltarsi ginjal akan menyebabkan ekskresi protein berlebihan dari glomerulus yang kemudian akan memicu produksi dari sitokin- sitokin pro inflamasi dan growth factors oleh sel-sel mesangial dan sel-sel epitel tubulus bagian bawah (Blumenfeld et al., 2012).
Teori kedua menyebutkan peranan dari disfungsi endotel dan hilangnya atau berkurangnya faktor-faktor vasodilator endogen. Hal tersebut diikuti dengan aktifasi dari sistem Renin-Angiotensin (RAS) intrarenal dan pelepasan sitokin pro-inflamasi dan growth factors, menyebabkan apoptosis dari sel-sel ginjal dan meningkatkan
commit to user
Neves, 2012; Bidani et al., 2013). ROS juga merupakan media penting untuk terjadinya hipertensi yang disebabkan oleh paparan angiotensin II (Idris-Khodja et al., 2014).
Peningkatan volume ekstraseluler. Akibat menurunnya fungsi ekskresi ginjal, maka retensi air dan hipervolemia merupakan kondisi yang sering terjadi pada pasien dengan PGK. Peningkatan volume ekstraseluler juga merupakan penyebab tersering hipertensi pada PGK. Target ultrafiltrasi dan restriksi garam adalah berat badan kering.
Berat badan kering adalah berat badan tanpa edema di mana tekanan darah tetap normal baik sebelum atau sesudah dialisis tanpa penggunaan obat-obatan anti hipertensi. Pada pasien dengan peritoneal dialisis, kejadian hipervolemia diderita oleh paling tidak 25%
dari penderita. Diketahui bahwa kesimbangan natrium dan air memegang peran utama.
Hipervolemia juga dihubungkan dengan hilangnya fungsi ginjal tersisa, kegagalan membran ultrafiltrasi dan kepatuhan berobat yang lebih buruk (Blumenfeld et al., 2012).
Nitric Oxide atau NOS adalah vasodilator alami. Berkurangnya produksi NOS telah dihubungkan dengan hipertensi dan kejadian kardiovaskular. Dikarenakan NOS adalah sebuah vasodilator, maka efeknya pada pembuluh darah aferen ginjal adalah mengganggu autoregulasi ginjal, maka seharusnya dengan berkurangnya NOS akan menjadikan sebuah efek proteksi pada ginjal. Namun dari hasil penelitian-penelitian, ditemukan hal sebaliknya. Penurunan kadar NOS telah diasosiasikan dengan kejadian dan progresifitas PGK (Palm and Nordquist, 2011; Blumenfeld et al., 2012).
Diduga hal tersebut dikarenakan adanya efek sistemik yang mempengaruhi hemodinamik dan akan berakhir pada kelainan di ginjal. NOS selain mempunyai efek vasodilatasi juga mempunyai efek meingkatkan kelenturan dinding arteri, menurunkan
commit to user
resistensi perifer, menghambat proliferasi sel-sel otot polos pembuluh darah, menurunkan agregasi tombosit dan menurunkan adhesi monosit di pembuluh darah sehingga menurunkan resiko aterosklerosis (Blumenfeld et al., 2012).
Namun, beberapa ahli membuat hipotesa berdasarkan penelitian pada tikus, adanya efek NOS yang kurang diperhatikan, yaitu efek vasodilatasi pembuluh darah eferen ginjal. Dengan vasodilatasi pembuluh darah eferen maka akan mencegah peningkatan tekanan intraglomerulus. Dengan ditemukan sejumlah besar NOS synthase 1 dan 3 di sel-sel endotel pembuluh darah eferen, memperkuat teori tersebut (Bidani et al., 2013).
Penurunan NOS dihubungkan dengan retensi natrium. Retensi Na akan memicu enzin NADPH oksidase yang mana akan menyebabkan stres oksidatif. Apabila stress oksidatif terlalu banyak, maka akan merusak NO yang ada dan menghambat produksinya (Palm and Nordquist, 2011; Blumenfeld et al., 2012).
Gambar 2.18. Skema Mekanisme Yang Diketahui Mengakibatkan Hipoksia Jaringan Ginjal dan Kerusakan Ginjal Pada Hipertensi (Palm and Nordquist, 2011).
commit to user
Imunohistokimia merupakan suatu teknik penentuan keberadaan antigen (protein target) dalam jaringan atau sel dengan menggunakan antibodi berlabel sebagai reagen spesifik melalui interaksi antigen-antibodi yang divisualisasikan dengan penanda seperti pewarna berpendar, enzim, unsur radioaktif atau koloid emas untuk mendeteksi. Teknik ini diawali dengan prosedur histoteknik yaitu prosedur pembuatan irisan jaringan (histologi) untuk diamati di bawah mikroskop. Irisan jaringan yang didapat kemudian memasuki prosedur imunohistokimia (IHC World, 2007). Reaksi antigen-antibodi (Ag- Ab) pada imunohistokimia (IHC) biasanya terjadi antara dua protein makromolekul yaitu : antigen (termasuk glikoprotein, lipoprotein, atau hanya protein), dan antibodi yang merupakan glikoprotein. Namun harus ditekankan bahwa dalam kasus ini salah satu makromolekul (antigen), terletak pada bagian jaringan yang akan difiksasi formaldehid dan dilekatkan pada parafin. Proses ini akan menyebabkan perubahan bentuk dan konformasi dari jaringannya. Perubahan konformasi struktur protein setelah fiksasi, akan menyebabkan presentasi epitope modifikasi yang berbeda, hal ini mungkin menghalangi akses ke antibodi spesifik. Heat-based antigen retrieval methods merupakan cara yang di gunakan untuk membalikkan perubahan konformasi yang dihasilkan akibat fiksasi. Selain itu pada proses fiksasi dengan alkohol, alkohol akan berinteraksi dengan protein hidrofobik dan menghasilkan modifikasi struktur protein tersier (Ramos-Vara, 2005).
Interaksi antara antigen dan antibodi merupakan reaksi yang tidak kasat mata. Oleh karena itu, diperlukan visualisasi adanya ikatan tersebut dengan melabel antibodi yang digunakan dengan enzim atau fluorokrom. Enzim (yang dipakai untuk
commit to user
melabel) selanjutnya direaksikan dengan substrat kromogen (yaitu substrat yang menghasilkan produk akhir berwarna dan tidak larut) yang dapat diamati dengan mikroskop cahaya. Imunohistokimia yang menggunakan fluorokrom untuk melabel antibodi, dapat langsung diamati (tanpa direaksikan lagi dengan kemikalia yang menghasilkan warna) di bawah mikroskop fluoresense (IHC World, 2007).
Albert H. Coons dan rekan-rekannya pada tahun 1941 adalah yang pertama kali melabel antibodi dengan pewarna berpendar, dan menggunakannya untuk mengidentifikasi bagian antigen dalam jaringan. Dengan pengembangan dan penyempurnaan teknik imunohistokimia, label enzim telah diperkenalkan seperti peroksidase dan alkalin fosfatase. Pada tahun 1971 label koloid emas juga telah ditemukan dan digunakan untuk mengidentifikasi reaksi imunohistokimia pada mikroskop cahaya dan elektron. Menurut Wasito, sebagai saran diagnosis, beberapa keuntungan yang dapat diperoleh dari pemeriksaan imunohistokimia adalah dengan teknik monoklonal antibodi dan teknik hibridoma dapat ditingkatkan sensitifitas dan spesifisitasnya, dan pemeriksaan ini dapat dilakukan dengan berbagai teknik pewarnaan, antara lain metode peroksidase-biotin antiperoksidase, alkali fosfatase anti alkali fosfatase, kompleks avidin biotin, dan streptavidin (Susilo, 2006; IHC World, 2007).
Sejak imunohistokimia melibatkan reaksi antigen-antibodi secara spesifik, dengan menggunakan teknik pewarnaan enzim khusus yang hanya mengidentifikasi sejumlah protein, enzim dan struktur jaringan, jelas lebih menguntungkan dibandingkan menggunakan cara yang tradisional. Oleh karena itu, imunohistokimia telah menjadi teknik penting dan banyak digunakan di banyak laboratorium penelitian medis juga diagnosis klinis (IHC World, 2007). Tujuan dari pemeriksaan ini adalah untuk
commit to user
Sedangkan manfaat pemeriksaan metode imunohistokimia adalah mempertajam diagnostik patologi, membantu meramalkan perangai biologik dan prognosis suatu tumor, menentukan pilihan pengobatan dan mengenali jenis mikroorganisme atau jenis infeksi (Alsagaf, 1998). Banyak metode imunohistokimia yang dapat digunakan untuk penentuan keberadaan antigen. Pemilihan metode yang sesuai harus didasarkan pada parameter-parameter seperti jenis spesimen dalam penyelidikan dan tingkat sensitivitas yang diperlukan (IHC World, 2007).
2.11. SSistem Deteksi
Reaksi Ag-Ab tidak dapat dilihat dengan mikroskop cahaya kecuali diberi label.
Oleh karena itu, label yang melekat pada antibodi primer, sekunder, atau tersier dari sebuah sistem deteksi memungkinkan visualisasi dari reaksi imun. Berbagai label telah digunakan, termasuk fluoresen, enzim, dan logam-logam (Taylor et al., 2002). Label- label yang paling sering digunakan adalah enzim-enzim (misalnya, peroksidase, alkali fosfatase, glukosa oksidase). Kehadiran enzim dalam substrat tertentu dan kromogen akan menghasilkan endapan berwarna di lokasi reaksi Ag-Ab. Pemilihan sistem deteksi sangat penting, mengingat bahwa sensitifitas reaksi imun akan tergantung sebagian besar pada sistem deteksi yang digunakan. Sistem deteksi diklasifikasikan sebagai metode langsung atau tidak langsung (Ramos-Vara, 2005).
2.11.1. Metode langsung
Metode ini merupakan metode imunositokimia yang sederhana. Reaksinya adalah proses satu langkah dengan Ab primer yang dikonjugasikan dengan label, seperti
commit to user
fluorokrom, enzim, koloid emas, dan biotin. Metode ini cukup cepat tetapi tidak memiliki kepekaan untuk deteksi Ag secara rutin dalam jaringan (Ramos-Vara, 2005).
2.11.2. Metode tidak langsung
Deteksi antigen yang lebih sensitif dikembangkan Coons et al., dengan mengembangkan metode dua langkah. Lapisan pertama antibodi tidak dilabel, tetapi lapisan kedua, digunakan antibodi primer yang berlabel. Sensitivitas dari metode ini lebih tinggi daripada metode langsung karena (i) Ab primer tidak berlabel, sehingga mampu menahan aktivitas dan menghasilkan sinyal yang kuat dan (ii) jumlah label (misalnya, peroksidase) per molekul Ab primer lebih tinggi, hal ini akan meningkatkan intensitas reaksi. Hasilnya adalah kemampuan untuk mendeteksi Ag dalam jumlah yang lebih kecil atau untuk meningkatkan pengenceran Ab primer karena setidaknya dua immunoglobulin yang berlabel dapat mengikat masing-masing molekul Ab primer.
(Ramos-Vara, 2005).
Gambar 2.19. Metode Imunoperoksidase Langsung dan Tidak Langsung (Ramos-Vara, 2005).
2.11.3. Metode kompleks avidin-biotin
Avidin adalah glikoprotein besar dengan berat molekul (BM) 68 kDa, diekstrak dari putih telur yang memiliki empat sisi tempat mengikat per molekul dan afinitas tinggi terhadap biotin. Biotin merupakan suatu vitamin yang larut dalam air dengan BM yang
antibodi tidak berlabel
antibodi primer berlabel
antibodi sekunder berlabel antigen
commit to user
bergabung dengan berbagai protein, termasuk reseptor antibodi, atau makromolekul lain, seperti enzim, fluorokrom, atau label lainnya. Setelah reaksi antigen dengan unlabeled antibody, maka ditambahkan biotin-labeled second antibody. Meningkatnya sensitivitas metode avidin-biotin merupakan hasil dari banyaknya molekul biotin yang bergabung dengan avidin, sehingga penambahan fluochrome labeled avidin akan menghasilkan ikatan kuat dengan membentuk warna yang jelas. Metode kompleks avidin-biotin (avidin-biotin complex/ABC) mempunyai ikatan dengan afinitas lebih kuat bila dibandingkan dengan PAP (peroksidase anti peroksidase) (Susilo, 2006; Ramos- Vara, 2005).
Gambar 2.20. Metode Imunohistokimia ABC (Ramos-Vara, 2005).
2.11.4. Metode streptavidin biotin
Metode avidin-biotin lain yang umum digunakan adalah metode labeled avidin–
biotin (LAB) atau labeled streptavidin–biotin (LSAB), yang menggunakan biotinylated Ab sekunder dan reagen ketiga dari peroksidase (atau alkalin fosfatase) - berlabel avidin. Sensitivitas dari metode ini adalah lebih tinggi dari ABC standar. Salah satu
Antibodi pertama
Biotinylated-Ab Avidin
Biotin-Peroksidase antigen
commit to user
kelemahan utama dari setiap sistem avidin-biotin adalah kemungkinan menghasilkan latar belakang yang tinggi. Avidin dapat menghasilkan latar belakang dengan cara mengikat lektin dalam jaringan melalui kelompok karbohidrat dan juga melalui ikatan elektrostatik karena potensial isoelektrik (pI)-nya adalah 10. Latar belakang ini dapat sangat dikurangi dengan menggantikan avidin dengan streptavidin. Streptavidin, diproduksi oleh bakteri Streptomyces avidinii, memiliki pI yang netral, sehingga mengakibatkan pengurangan interaksi elektrostatik dengan elemen jaringan. Selain itu, karena tidak mengikat lektin, latar belakang cenderung kurang noda. Namun, latar belakang dari biotin endogen masih dimungkinkan dengan metode streptavidin, terutama ketika menggunakan metode-metode pemulihan antigen. Hal ini sangat umum terjadi pada jaringan-jaringan yang kaya biotin seperti hati dan ginjal (Polak dan Van Noorden, 2003).
Gambar 2.21. Metode Labeled Streptavidin (LSAB)-Peroxidase (Ramos-Vara, 2005).
2.11.5. Metode peroxidase - antiperoxidase (PAP)
Metode ini merupakan metode tidak langsung jenis lain yang terdiri dari tiga lapisan. PAP memiliki lapisan ketiga berupa Ab primer kelinci (antiperoksidase kelinci) yang digabungkan dengan peroksidase, dalam proporsi yang sedemikian rupa sehingga membentuk kompleks yang stabil (peroksidase-antiperoxidase) yang terdiri dari dua
commit to user
mereka berbagi (Polak dan Van Noorden, 2003). Lapisan pertama dan ketiga terikat oleh lapisan antibodi kedua (jembatan) (dalam contoh ini, anti-kelinci). Kuncinya adalah dengan menambahkan Ab sekunder yang berlebih, sehingga mengikat baik Ab primer melalui salah satu sisi pengikatan Ab dan kompleks PAP melalui sisi pengikatan Ab lainnya. Metode ini menghasilkan sensitivitas 100-1.000 kali lebih tinggi daripada metode tidak langsung dua-langkah (Taylor et al., 2002). Namun, PAP lebih melelahkan / sulit dibandingkan metode tidak langsung dua-langkah. Meskipun metode ini sangat populer sebelum munculnya metode avidin-biotin, sensitivitasnya rendah sehingga sekarang penggunaannya terbatas (Ramos-Vara, 2005).
Gambar 2.22. Metode Peroxidase-Antiperoxidase (PAP) (Ramos-Vara, 2005).
2.11.6. Imunohistokimia pada jaringan mencit
Penggunaan Ab monoklonal mencit untuk IHC pada jaringan mencit penuh tantangan. Hal ini disebabkan karena dengan mengikuti prosedur IHC standar, maka akan mengembangkan latar belakang dari pengikatan Ab sekunder (antibodi anti- mencit) dengan antibodi endogen dalam jaringan mencit. Masalah ini menghambat atau bahkan menghalangi penggunaan IHC dengan Ab monoklonal mencit dalam jaringan
commit to user
mencit. Saat ini, banyak produsen memiliki sistem deteksi khusus jaringan mencit, untuk menghilangkan masalah ini. Salah satu metode ini dengan menggunakan langkah- langkah pemblokiran sebelum dan sesudah penambahan Ab primer, metode lain yang bisa digunakan adalah pre-inkubasi Ab primer dengan komplek Fab biotinylated anti- mouse (digunakan sebagai Ab sekunder), memblokir sisi-sisi pengikatan pada kompleks Ab sekunder yang bebas dengan serum mencit normal sebelum menambahkan campuran Ab ke bagian jaringan (Martin et al., 2001).
Imunohistokimia dengan antibodi monoklonal mencit pada jaringan mencit, diperlukan modifikasi dari sistem deteksi untuk mengurangi latar belakang. Dalam kasus ini, antibodi primer (antibodi mencit) dan antibodi sekunder biotinylated Fab (antibodi anti- mencit) di pre-inkubasi secara in vitro. Antibodi mencit normal kemudian ditambahkan untuk memblokir antibodi anti-mencit biotinylated yang bebas.
Campuran ini, yang mengandung antibodi primer terikat antibodi sekunder biotinylated, kemudian diterapkan pada bagian jaringan pada slide kaca (Ramos-Vara, 2005).
Gambar 2.23. Imunohistokimia Dengan Antibodi Monoklonal Mencit Pada Jaringan Mencit (Ramos-Vara, 2005).
+ +
Ab primer Ab skunder Fab biotinylated
Ab primer + skunder
Ab serum mencit normal
+
Siap pakai +
Jaringan pada slide kaca