8. BIOAKTIVITAS NEPENTHES GRACILIS KORTH. DI HUTAN KERANGAS
A. Pendahuluan
Nepenthes gracilis merupakan jenis kantong semar yang mempunyai kemampuan memangsa serangga (insectivorous species/pitcher plan). N.gracilis mampu tumbuh secara dominan di tanah kerangas baik dibawah tegakan maupun tempat terbuka. Kehadiran tumbuhan ini merupakan indikator dari rendahnya unsur hara yang terkandung dalam tanah (Adam et al. 1992; Kissinger 2002; Onrizal et al. 2005).
Distribusi alamiah dari N.gracilis termasuk Thailand, Sumatera, Peninsular Malaysia, Singapura, Kalimantan dan Sulawesi. Jenis ini kerap berasosiasi dengan semak Gleichenia linearis dan Baeckea frutescens. N.gracilis dapat ditemukan di dataran rendah berupa hutan rawa gambut, hutan kerangas baik yang masih baik dan terbuka, serta rawa terbuka sampai ketinggian di bawah 100 m dan dapat mencapai 800 m dpl serta jarang ditemukan di ketinggian di atas 1000 m. Tumbuhan ini termasuk dalam terrestrial climber dengan tinggi dapat mencapai 5 m. Batangnya segita dengan diameter dari 1.5-5 mm dan panjang antar ruas batang 2.5-9 cm. Daunnya tipis dengan panjang antara10-25 cm dan lebar 2 cm. Kantongnya berwarna hijau, merah atau hijau bebercak merah. Bunganya dapat berwarna putih, hijau, merah muda atau coklat (Cheek and Jebb 2001).
Beberapa jenis kantong semar termasuk N.gracilis dikenal sebagai bahan pengobatan tradisional seperti untuk pengobatan penyakit kanker, asma, diabetes dan untuk kesehatan mata (Kumar et al. 1980; Kissinger 2006; Mansur 2006). Pengetahuan masyarakat lokal tentang etnobotani dalam pemanfaatan kantong semar sudah berlangsung lama dan tersebar di berbagai etnis. Sehingga perlu dikembangkan dan ditingkatkan dengan pendekatan teknologi modern agar kekayaan pengetahuan tradisional tentang pemanfaatan N.gracilis dapat bertahan atau lestari.
Langkah awal dalam aksi konservasi yang berbasis pada pemanfaatan N.gracilis di antaranya adalah bagaimana membuktikan dengan pendekatan teknologi modern bioaktivitas dari tumbuhan N.gracilis. Penelitian ini dilakukan untuk menguji bioaktivitas dari N.gracilis sebagai antibakteri dan antidiabetes. Screening fitokimia dan uji toksisitas dilakukan sebagai penunjang dalam menjelaskan bioaktivitas yang dimiliki oleh tumbuhan N.gracilis.
B. Metode Penelitian
1) Bahan dan Peralatan Penelitian
Bahan tumbuhan N.gracilis diperoleh dari hutan kerangas yang merupakan hutan lindung Blok II Desa Guntung Ujung Kecamatan Gambut Kabupaten Banjar Kalimantan Selatan. Identifikasi tumbuhan telah dilakukan di Herbarium Bogoriense (Kissinger 2002). Bahan tumbuhan N.gracilis diperoleh dari hutan kerangas dengan jumlah sampel tumbuhan sebanyak 32 individu. Pengambilan sampel dilakukan secara purposive sampling. Bahan kimia yang digunakan dalam penelitian laboratorium adalah kloroform, etil asetat, methanol, ethanol, almil alkohol, dietil eter, serbuk Mg, reagent Dragendorf, Meyer, Wagner, NH3, H2SO4, NaOH 10%, Mg-HCl, L-B, FeCl3, silika gel, glass wall. Sedangkan peralatan yang digunakan adalah neraca analitik, vortex, blender, tube, labu erlemeyer, gelas ukur, kertas saring, rotary evaporator, oven elektrik, mikro pipet, mikro plate, lampu UV, dan spektrometer UV-Vis.
2) Uji Fitokimia
Uji fitokimia dilakukan untuk mengetahui senyawa metabolit sekunder dari bagian tumbuhan N.gracilis. Bagian tumbuhan yang diujikan adalah bagian batang, daun, kantong, akar dan cairan dari dalam kantong N.gracilis. Uji fitokimia yang dilakukan meliputi identifikasi senyawa alkaloid, triterpenoid, steroid dan flavonoid, Pengujian dilakukan dengan langkah berikut:
Uji Alkaloid
Sampel dimasukkan sebanyak satu ujung spatula kemudian ditambahkan dengan NH3 sebanyak 3 tetes, dan kloroform sebanyak 5 mL ke dalam tabung reaksi. Sampel tersebut kemudian dihomogenkan dengan menggunakan vortex, setelah itu ditambahkan H2SO4 2 M sebanyak 3 mL dan dihomogenkan kembali sehingga terbentuk lapisan asam. Lapisan asam tersebut kemudian diuji dengan penambahan perekasi Dragendroff, Mayern, dan Wagner yang berturut-turut akan membentuk endapan jingga, putih, dan cokelat jika sample positif mengandung senyawa alkaloid.
Uji Triterpenoid dan Steroid
Uji triterpenoid dan steroid dilakukan dengan memasukkan sebanyak satu ujung spatula sample ke dalam tabung reaksi. Sampel kemudian ditambahkan etanol 96% sebanyak 5 mL kemudian dipanaskan selama 2 menit dan disaring. Filtrat hasil penyaringan kemudian dipanaskan kembali sampai kering. Sample kering kemudian ditambahkan 1 mL dietil eter sampai larut dan
dipindahkan ke dalam cawan porselen.Cawan yang berisi sample tersebut kemudian ditambahkan dengan satu tetes H2SO4 pekat dan satu tetes asam asetat anhidrat. Sampel yang positif mengandung senyawa triterpenoid akan memberikan warna merah. Sampel yang positif mengandung senyawa triterpenoid akan memberikan warna hijau atau biru. Sample yang positif mengandung senyawa triterpenoid dan steroid akan memberikan warna ungu. Uji Flavonoid
Satu ujung spatula sample dimasukkan ke dalam tabung reaksi. Sampel kemudian ditambahkan dengan 5 mL aquades kemudian dikocok hingga homogen.Sampel tersebut kemudian dipanaskan selama 2 menit dan disaring.Filtrat hasil penyaringan ditambahkan serbuk Mg sebanyak satu ujung spatula, kemudian diteteskan dengan HCl pekat sebanyak 2-3 tetes, setelah itu ditambahkan dengan 1 mL amil alkohol. Campuran tersebut kemudian dikocok sampai homogen. Sampel yang positif akan menunjukkan warna jingga atau kuning pada lapisan amil alkohol.
Analisis data dilakukan secara kualitatif. Kandungan senyawa fitokimia yang terdapat dalam contoh uji dinyatakan dengan nilai positif (terdapat senyawa) dan negatif (tidak terdapat senyawa). Hasil ini kemudian dianalis secara deskriptif menggunakan matriks tabulasi.
3) Uji Toksisitas
Uji toksisitas dilakukan dengan metode Brine Shrimp Lethality Test (BSLT) menggunakan Artemia salina L. (Kelana 2007). Uji toksisitas dilakukan terhadap sampel ekstrak methanol batang, daun, kantong dan akar N.gracilis. Langkah-langkah yang dilakukan dalam pengujian toksisitas adalah sebagai berikut:
Pembuatan Ekstrak Uji
Sampel batang, daun, kantong dan akar N.gracilis dikering anginkan kemudian dihaluskan. Serbuk sampel dimaserasi dengan methanol berulangkali sampai air rendaman bening kemudian dipekatkan dengan rotary evaporator hingga diperoleh ekstrak kasar.
Larutan induk dibuat dengan konsentrasi 2.000 ppm dengan cara melarutkan 20 mg sampel dengan air laut sampai volumenya 10 mL. Pengujian dilakukan pada sampel dengan konsentrasi1.000 ppm; 500 ppm; 100 ppm; 10 ppm yang dibuat dari pengenceran larutan induk.
Menetaskan Larva Udang
Sebanyak 10 mg telur udang A. salina ditambah 100 mL air laut yang telah disaring. Pencahayaan lampu TL dilakukan selama 48 jam sampai telur udang A. salina menetas sempurna dan siap diujicobakan.
Uji Toksisitas terhadap Larva A. salina
Masing-masing sampel kemudian dipipet sebanyak 100 μL dan diletakkan dalam mikroplate, kemudian ditambah 100 μL air laut yang berisi 10 larva udang pada setiap sampel sehingga volume sampel menjadi setengahnya. Jumlah larva udang yang mati dan hidup dihitung setelah 24 jam. Kontrol dikerjakan sama dengan perlakuan sampel, tetapi tanpa penambahan ekstrak. Ekstrak sampel yang sukar larut dapat ditambahkan DMSO 1% satu sampai tiga tetes. Setiap sampel dilakukan ulangan sebanyak tiga kali. Pengujian menggunakan menur udang yang pelaksanaannya dilakukan selama 3 hari pengamatan.
Analisis Data
Analisis data dilakukan dengan mengukur Lethal concentration 50% (LC50). LC50 adalah suatu nilai yang menunjukkan konsentrasi zat toksik yang dapat mengakibatkan kematian organisme sampai 50%. Nilai kematian 50% per hari (LC50 dalam unit waktu) ditentukan dengan menggunakan persamaan regresi antara log konsentrasi dan mortalitas (%).
4) Uji Antibakteri
Metode yang digunakan dalam pengujian antibakteri adalah dilusi menggunakan microplate. Beberapa langkah dalam uji aktifitas anti bakteri adalah sebagai berikut:
1) Menyiapkan bahan uji dari hasil ekstrak dari cair-cair larutan, bahan larutan asli dan ekstrak methanol dari bagian tumbuhan N.gracilis
2) Masing-masing bahan tersebut dibuat dengan berbagai konsentrasi atau pengenceran
3) Menyiapkan media dan bakteri
Media yang digunakan yaitu Nutrient Broth (NB). Sebanyak 95 µl medium steril, 100 µl sampel dilarutkan dalam DMSO 20% atau kontrol dan 5 µl inokulum bakteri dimasukkan ke dalam masing-masing sumur (96-well plate). Inokulum telah disiapkan pada konsentrasi 10-5 CFU/ml.
Bakteri yang digunakan dalam uji aktivitas ini adalah Staphylococcus aureus (S. aureus), S. epidermis dan Escherichia coli.
4) Pengukuran Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM)
Metode yang digunakan adalah dilusi dengan menggunakan microplate. Bakteri diinkubasi dalam media selama 24 jam . Konsentrasi ekstrak yang tidak menunjukkan pertumbuhan bakteri (bening) secara visual dideskripsikan sebagai KHM (Konsentrasi hambat minimum). Sebanyak 100 µl dari media yang tidak menunjukkan pertumbuhan bakteri diinokulasikan pada 100 µl media baru. Konsentrasi yang tidak menunjukkan pertumbuhan bakteri setelah inokulasi kedua dideskripsikan sebagai KBM (Konsentrasi bunuh minimal). Kontrol negatif yang digunakan yaitu DMSO dan kontrol positifnya yaitu kloramfenikol.
Analisis data dilakukan dengan matrik tabulasi terhadap konsentrasi sampel yang menunjukkan Konsentrasi Hambat Minimum dan Konsentrasi Bunuh Minimum.
5. Uji Antidiabetes
Penemuan bioaktivitas dari kantong semar juga diarahkan sebagai antidiabetes melalui pengujian bioaktivitas dari ekstrak methanol akar N.gracilis terhadap daya hambat dari enzim glukosidase. Konsentrasi ekstrak methanol akar N.gracilis yang dibuat adalah 5 ppm, 2,5 ppm, 1,25 ppm, 0,625 ppm, 0,3125 ppm, 0,15625 ppm dan 0,078125 ppm
Analisis data dilakukan dengan menghitung IC 50. Tingkat inhibisi (%) dihitung menggunakan metode yang digunakan oleh Pujiyanto dan Ferniah (2010). Persen inhibisi (% inhibisi) dihitung menggunakan rumus berikut:
Keterangan:
A kontrol = Absorbansi tidak mengandung sample A sampel = Absorbansi sampel
Hasil perhitungan yang didapat selanjutnya dimasukkan ke dalam persamaan regresi dengan konsentrasi ekstrak (ppm) sebagai absis (sumbu X) dan nilai % inhibisi (antidiabetes) sebagai ordinatnya (sumbu Y). Nilai IC50 dari perhitungan pada saat % inhibisi sebesar 50%.
C. Hasil dan Pembahasan
1) Senyawa Fitokimia dan Toksisitas Bahan
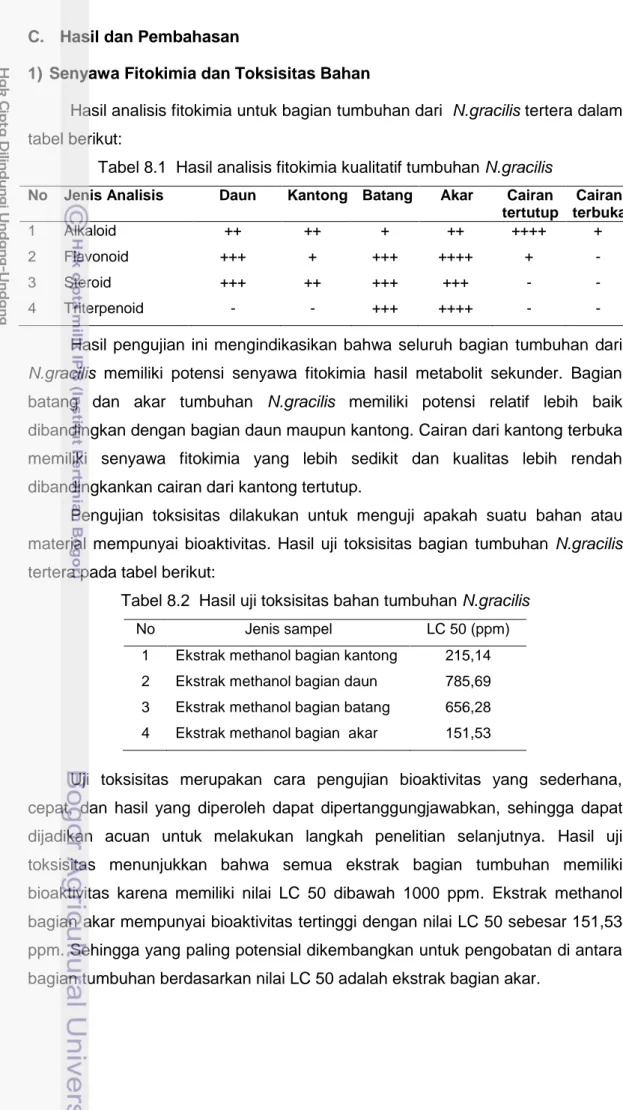
Hasil analisis fitokimia untuk bagian tumbuhan dari N.gracilis tertera dalam tabel berikut:
Tabel 8.1 Hasil analisis fitokimia kualitatif tumbuhan N.gracilis
No Jenis Analisis Daun Kantong Batang Akar Cairan
tertutup Cairan terbuka 1 Alkaloid ++ ++ + ++ ++++ + 2 Flavonoid +++ + +++ ++++ + - 3 Steroid +++ ++ +++ +++ - - 4 Triterpenoid - - +++ ++++ - -
Hasil pengujian ini mengindikasikan bahwa seluruh bagian tumbuhan dari N.gracilis memiliki potensi senyawa fitokimia hasil metabolit sekunder. Bagian batang dan akar tumbuhan N.gracilis memiliki potensi relatif lebih baik dibandingkan dengan bagian daun maupun kantong. Cairan dari kantong terbuka memiliki senyawa fitokimia yang lebih sedikit dan kualitas lebih rendah dibandingkankan cairan dari kantong tertutup.
Pengujian toksisitas dilakukan untuk menguji apakah suatu bahan atau material mempunyai bioaktivitas. Hasil uji toksisitas bagian tumbuhan N.gracilis tertera pada tabel berikut:
Tabel 8.2 Hasil uji toksisitas bahan tumbuhan N.gracilis
No Jenis sampel LC 50 (ppm)
1 Ekstrak methanol bagian kantong 215,14
2 Ekstrak methanol bagian daun 785,69
3 Ekstrak methanol bagian batang 656,28
4 Ekstrak methanol bagian akar 151,53
Uji toksisitas merupakan cara pengujian bioaktivitas yang sederhana, cepat, dan hasil yang diperoleh dapat dipertanggungjawabkan, sehingga dapat dijadikan acuan untuk melakukan langkah penelitian selanjutnya. Hasil uji toksisitas menunjukkan bahwa semua ekstrak bagian tumbuhan memiliki bioaktivitas karena memiliki nilai LC 50 dibawah 1000 ppm. Ekstrak methanol bagian akar mempunyai bioaktivitas tertinggi dengan nilai LC 50 sebesar 151,53 ppm. Sehingga yang paling potensial dikembangkan untuk pengobatan di antara bagian tumbuhan berdasarkan nilai LC 50 adalah ekstrak bagian akar.
2) Aktivitas Antibakteri
Aktivitas antibakteri diujikan pada beberapa tumbuhan yang tumbuh di komunitas tumbuhan spesifik kerangas yaitu: bagian akar, batang, daun, kantong dan cairan kantong N.gracilis. Hasil analisis antibakteri untuk N.gracilis terhadap E.coli tertera pada tabel berikut:
Tabel 8.3 MIC dan MBC N.gracilis untuk jenis bakteri E.coli
No Nama Sampel MIC (ppm) MBC (ppm)
1 Ekstrak methanol kantong 1000 >2000
2 Ekstrak methanol daun >2000 >2000
3 Ekstrak methanol batang 125 1000
4 Ekstrak methanol akar 15,63 500
5 Amoxilin 62,5 62,5
6 Chloramfenicol 15,63 15,63
Bakteri E.coli merupakan bakteri gram negatif. Antibakteri ekstrak bagian tumbuhan N.gracilis menunjukkan bahwa ekstrak methanol bagian batang dan akar memiliki nilai MIC paling bagus dengan konsentrasi rendah. Nilai MIC dari ekstrak akar lebih besar dari kontrol positif dari Amoxilin, hal ini menunjukan bahwa N.gracilis dari ekstrak methanol akar sangat potensial dikembangkan sebagai bahan untuk pengobatan khususnya antibakteri. Walaupun ekstrak kantong dan ekstrak batang mempunyai daya hambat pada konsentrasi yang lebih tinggi dari ekstrak akar, akan tetapi masih relatif potensial untuk digunakan sebagai antibakteri. Daya bunuh bakteri untuk E.coli diukur setelah selang waktu 18 jam, hasilnya adalah ekstrak methanol akar mampu membunuh bakteri pada konsentrasi 500 ppm dan diikuti oleh ekstrak batang pada konsentrasi 1000 ppm. Hasil ini memberikan gambaran positif tentang potensi tumbuhan terutama bagian akar N.gracilis yang dapat digunakan sebagai antibakteri dari jenis bakteri gram negatif. Beberapa ektrak methanol bagian tanaman lain dari N.gracilis teridentifikasikan masih belum efektif berperan sebagai antibakteri dengan konsentrasi MBC > 1000 ppm.
Aktivitas antibakteri juga ditunjukkan oleh beberapa bagian tumbuhan N.gracilis terhadap bakteri S.aureus seperti tertera pada Tabel 8.4
Tabel 8.4 MIC dan MBC N.gracilis untuk jenis bakteri S. Aureus
No Nama Sampel MIC (ppm) MBC (ppm)
1 Ekstrak methanol kantong 2000 >2000
2 Ekstrak methanol daun 125 1000
3 Ekstrak methanol batang 125 500
4 Ekstrak methanol akar 62,5 500
5 Amoxilin 31,25 31,25
6 Chloramfenicol 15,63 15,63
Bakteri S.aureus merupakan bakteri gram positif. Pada kasus antibakteri gram positif, ekstrak methanol akar N.gracilis memberikan aktivitas MIC tertinggi pada konsentrasi 62,5 ppm atau setara dengan 0,0625 mg/L. Selain ekstrak methanol bagian batang, ekstrak methanol bagian batang dan daun N.gracilis juga potensial sebagai antibakteri. Nilai MBC pada bakteri gram positif S.aureus menunjukan konsentrasi 500 ppm untuk ekstrak akar dan ekstrak batang, sedangkan daun pada konsentrasi 1000 ppm.
Hasil pengujian antibakteri bagian tumbuhan terhadap ke dua jenis bakteri gram positif dan negatif mengindikasikan bahwa ekstrak methanol bagian batang dan akar tumbuhan N.gracilis sangat potensial dikembangkan sebagai antibakteri dibandingkankan ekstrak methanol daun dan kantong. Ekstrak methanol daun N.gracilis masih mempunyai peluang untuk dikembangkan sebagai antibakteri E.coli (MIC= 125 ppm) dan ekstrak methanol bagian kantong terhadap S.aureus (MIC= 1000 ppm). Kedua bagian tanaman ini masih potensial digunakan sebagai antibakteri melalui proses pemurnian dan isolasi dari ekstrak methanol yang telah didapatkan. Fenomena yang harus menjadi perhatian utama adalah dosis penggunaan ekstrak methanol akar N.gracilis, hal ini terkait dengan margin of savety penggunaan ekstrak methanol akar sebagai antibakteri dan nilai LC50 pada hasil toksisitas pada Tabel 8.2.
Ekstrak kasar (crude extract) masih dapat dikatakan efektif sebagai antibakteri jika aktivitas penghambatannya berada pada konsentrasi 1000 ppm. Ekstrak dikatakan berpotensi jika pada kadar pemberian ≤ 1000 μg/mL mampu menghambat pertumbuhan bakteri (Mitscher et al. 1972). Daya hambat ekstrak kasar tumbuhan terhadap bakteri umumnya menunjukkan nilai konsentrasi 1000 ppm. ekstrak kloroform Mimba (Azadirachta indica A. Juss.) dengan konsentrasi 1000 μg/mL menunjukkan adanya penghambatan pertumbuhan bakteri S. aureus tetapi tidak terhadap E. coli (Apriastiani dan Astuti 2005).
Potensi pengembangan keseluruhan bagian tumbuhan N.gracilis juga didasari oleh kandungan senyawa metabolit sekunder yang dimiliki setiap bagian tumbuhan (Tabel 8.1). Temuan ini juga menjadi mediasi bagi pembuktian empiris bagi pengetahuan tradisional tentang penggunaan bagian tumbuhan N.gracilis sebagai bahan pengobatan.
Selain ekstrak batang, pengujian antibakteri juga dilakukan terhadap cairan dari dalam kantong N.gracilis. Pengujian antibakteri cairan dari dalam kantong N.gracilis dilakukan terhadap cairan murni atau hasil ekstrak cair-cair bertingkat menggunakan hexan, ethyl asetat dan kloroform.
Hasil pengujian menunjukkan bahwa cairan murni dari kantong tertutup dapat menghambat pertumbuhan bakteri S.aureus dan pada konsentrasi 3000 ppm dan dan S.epidermis pada konsentrasi 1500 ppm. ekstrak heksan cairan N.gracilis kantong tertutup hanya dapat menghambat bakteri S.aureus pada konsentrasi 1500 ppm dan ekstrak etyl asetat cairan N.gracilis kantong tertutup hanya dapat menghambat bakteri S.aureus pada konsentrasi 1500 ppm. Sedangkan untuk MBC terhadap kedua jenis bakteri yang diujikan ditunjukkan oleh cairan N.gracilis dari kantong tertutup pada konsentrasi 6000 ppm.
Hasil ini mengindikasikan bahwa cairan tertutup dari N.gracilis memiliki aktivitas yang lebih baik dibandingkankan dengan cairan dari kantong terbuka. Konsentrasi penggunaan bahan yang tinggi dari cairan tertutup sesuai dengan pemanfaatan yang dilakukan masyarakat secara langsung untuk pengobatan batuk dan infeksi mata yang ringan, serta pengobatan yang sifatnya preventif. Penggunaan cairan tertutup juga didukung dengan sterilnya larutan (angka kuman=0). Aktivitas antibakteri dari cairan kantong tertutup diduga dalam penelitian ini sebagai aktivitas dari senyawa alkaloid yang terdapat dalam kantong N.gracilis yang tertutup. Penggunaan cairan N.gracilis dari kantong tertutup oleh masyarakat selama ini baik sebagai bahan pengobatan maupun sebagai pengganti air sewaktu berada di hutan juga didukung oleh hasil analisis kandungan kuman yang mendapatkan kadar kuman= 0.
Beberapa penelitian lain juga mengemukakan potensi bioaktivitas dari berbagai jenis Nepenthes. Kelenjar dalam kantong muda (tertutup) mengeluarkan cairan pencernaan yang mengandung berbagai enzim termasuk protease, peptidase, phosphatase, esterase, ribonuklease dan chitinase (Thornhill et.al. 2008; Plachno et al. 2006; An et al. 2002, Athauda et al. 2004; Takahashi et al. 2005; Eilenberg et al. 2006; Stephenson et al. 2006; Hatano and
Hamada 2008). Chia et al. 2004 mengungkapkan bahwa kelenjar dalam kantong Nepenthes memproduksi radikal bebas untuk membantu dalam mendegradasi jaringan dari mangsa seperti thaumatin-like protein (TLP). TLP memiliki sifat antibakteri dan antijamur. Saat kantong telah terbuka (dewasa), kelenjar berubah fungsinya dari mengeluarkan enzim menjadi mengabsorbsi produk/nutrisi hasil olahan dari bantuan kerja enzim (Owen et al. 1999).
Hatano and Hamada (2008) mengungkapkan bahwa cairan N.alata mengandung protein berupa homolog-homolog dari beta-D-xylosidase, beta-1,3-glucanase, chitinase dan thaumatin-like protein. Semua homolog merupakan protein yang bersifat pathogen. Protein-protein tersebut memiliki kemampuan menghambat pertumbuhan bakteri.
Aung et al. 2002 berhasil mengisolasi Beberapa senyawa phenol seperti plumbagin, isoshinanolone, epishinanolone, shinanolone, quercetin dan kaempferol telah berhasil diisolasi dari daun N.gracilis. Terdapat plumbagin (golongan naphthoquinones) menempel pada permukaan lilin dari N.khasiana. Plumbagin yang bersifat racun dapat berfungsi sebagai insektisida dan menghambat perkembangan bakteri.
3) Aktivitas Antidiabetes
Hasil pengujian antidiabetes yang dilakukan terhadap daya hambat enzim α glukosidase tertera dalam Tabel 8.5.
Tabel 8.5 Hasil pengujian antidiabetes dari akar N.gracilis
Konsentrasi (ppm)
glukobay Akar N.gracilis
1 2 1 2 5 89,632 87,658 94,845 95,288 2,5 86,835 85,573 96,951 96,674 1,25 79,759 81,788 94,678 95,122 0,625 77,126 75,864 90,466 91,962 0,3125 72,244 70,598 76,552 79,989 0,15625 63,083 62,918 60,366 58,537 0,078125 52,057 58,475 36,419 31,984
Pengujian daya hambat terhadap enzim α glukosidase menunjukkan bahwa ekstrak methanol akar N.gracils pada dua kali pengulangan dengan konsentrasi 5-0,3125 ppm menunjukkan daya hambat yang lebih baik dari kontrol positif (glukobay). Ketika konsentrasi diturunkan menjadi 0,15625 ppm daya hambatnya lebih kecil dari glukobay, akan tetapi ekstrak methanol akar N.gracilis masih potensial menghambat enzim α glukosidase. Aktivitas hambat ekstrak
methanol relatif tidak potensial pada konsentrasi 0,078125, sedangkan glukobay masih menunjukkan daya hambat di atas 50%.
Nilai IC 50 dari persamaan regresi yang didapat menggunakan data pada tabel 17 menunjukkan nilai 0,08264 ppm untuk ekstrak methanol dan 0,02983 ppm untuk glukobay. Walaupun hasil IC 50 yang ditunjukkan oleh ekstrak akar N.gracilis lebih besar konsentrasinya dibandingkankan glukobay, ekstrak akar N.gracilis sangat potensial dimanfaatkan sebagai antidiabetes. Kelebihan yang dimiliki oleh ekstrak methanol akar N.gracilis yang telah dibuktikan dalam penelitian ini kemampuan sebagai antibakteri (bakteri gram positif dan negative) sekaligus kemampuan sebagai antidiabetes.
Hasil analisis antidiabetes dari ekstrak methanol akar N.gracilis lebih baik bila dibandingkankan dengan ekstrak tumbuhan lainya yang biasa digunakan dalam pengobatan tradisional. Ekstrak etil asetat daun pandan wangi (Pandanus amaryllifolius Roxb.) memiliki IC 50 pada konsentrasi 94,23 ppm. Esktrak methanol Syzygium malaccense menghambat α-glukosidase dengan nilai IC50 sebesar 5,7 ppm (Jung et al. 2006).
D. Simpulan
Hasil pengujian bioaktivitas N.gracilis yang teridentifikasikan melalui kandungan senyawa fitokimia kualitatif, toksisitas (LC 50 < 1000 ppm), dan daya hambat terhadap bakteri S.aureus dan E.coli dengan konsentrasi di bawah 2000 ppm, mengindikasikan bahwa sebagian besar bagian tumbuhan N.gracilis dapat dipergunakan sebagai bahan alam untuk pengobatan. Bioaktivitas antidiabetes ditunjukkan oleh ekstrak metanol akar N.gracilis dengan nilai IC 50 pada konsentrasi 0,08264 ppm. Hasil pengujian bioaktivitas merupakan media pembuktian pengetahuan masyarakat akan pemanfaatan N.gracilis sebagai bahan obat. Bioaktivitas yang didapat merupakan base data bagi penyusunan strategi bioprospeksi di hutan kerangas
Pengujian bioaktivitas N.gracilis merupakan upaya pembuktian nilai manfaat dari biodiversitas. Nilai manfaat ini diharapkan akan berkembang menjadi stimulus untuk sikap dan aksi konservasi para pihak dalam pengelolaan hutan kerangas melalui bioprospeksi lestari N.gracilis. Fraksinasi dan uji lanjutan ekstrak tumbuhan N.gracilis dapat dilakukan untuk meningkatkan bioaktivitas yang akan semakin mendorong terbentuknya stimulus manfaat kuat bagi pemanfaatan lebih lanjut N.gracilis.