LAPORAN PRAKTIKUM KIMIA FISIK II
ANALISIS DAN PENENTUAN KONSTANTA DISOSIASI ASAM DENGAN TITRASI pH YANG DIKONTROL DENGAN KOMPUTER
Nama : Rizka Fithriani Safira Sukma
NIM : 131810301049
Kelompok : 5
Asisten : Qorry Dinia Fatma Fakultas/ jurusan : MIPA / Kimia
LABORATORIUM KIMIA FISIKA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Asam basa adalah suatu hal sangat berperan penting bukan hanya dalam kimia namun juga dalam kehidupan sehari-hari. Hampir semua reaksi kimia melibatkan reaksi asam basa, dari reaksi sederhana sampai reaksi yang rumit kebanyakan menggunakan konsep asam basa. Selain dalam kimia, asam basa juga berperan penting dalam konsep kehidupan mahluk hidup. Konsep metabolisme adalah salah satu aplikasi konsep asam basa pada kehidupan sehari-hari. Oleh karena itu, kesetimbangan asam basa merupakan topik yang penting dalam seluruh ilmu kimia dan bidang lainnya. Titrasi yang melibatkan asam dan basa dipergunakan secara meluas dalam pengawasan analisis banyak produk dalam perdagangan dan disosiasi asam basa menunjukkan pengaruh yang penting terhadap metabolisme sel hidup. Percobaan ini jelas sekali erat kaitannya dan sesuai dengan penerapan dari kesetimbangan asam basa tersebut. Penerapan dari titrasi potensiometri dapat digunakan untuk titrasi pengendapan, pembentukan kompleks, netralisasi, dan redoks.
Asam basa dalam konsepnya akan dihadapkan kepada kekuatan asam basa tersebut. Asam kuat dan basa kuat akan berbeda dengan asam atau basa lemah. Asam kuat akan mengalami penguraian atau disosiasi secara hampir keseluruhan (disosiasi sempurna), sedangkan untuk asam lemah hanya sebagian kecil molekul yang terurai. Penguraian asam lemah yang sangat sedikit menyebabkan setiap asam lemah memiliki Ka atau konstanta disosiasi yang khas. Setiap asam lemah akan memiliki nilai Ka yang berbeda-beda. Selain dari teori, nilai Ka juga dapat ditentukan dengan menggunakan hasil titrasi. Percobaan ini bertujuan untuk memperoleh pemahaman yang lebih banyak mengenai konstanta disosiasi dan penentuannya..
1.2 Tujuan
BAB 2. TINJAUAN PUSTAKA
2.1 Material Safety Data Sheet (MSDS) 2.1.1 NaOH
Natrium hidroksida adalah bahan yang bersifat korosif terhadap jaringan tubuh seperti kulit, mata dan mulut. NaOH memiliki titik didih sebesar 1388oC dan titik leleh sebesar 323oC. NaOH biasanya berwujud cair, tidak berwarna dan tidak tidak berbau. NaOH merupakan basa kuat yang pH-nya dapat mencapai 14. NaOH bersifat berlawanan dengan asam, senyawa organik dan logam. Pertolongan pertama pada kecelakaan menggunakan NaOH sama dengan asam oksalat. NaOH sebaiknya disimpan ditempat khusus bahan korosif. Tempat penyimpanan seharusnya kering, dingin dan berventilasi baik. Selain itu, diusahakan tempat selalu tertutup rapat dan terhindar dari bahan yang tidak cocok dengn NaOH (Anonim, 2015).
2.1.2 Asam Asetat
Asam asetat atau C2H4O2 atau biasanya CH3COOH. Bahan ini bersifat iritan, permeator (meresap dan menyebar ke seluruh bagian) dan korosif terhadap kulit dan mata pada konsentrasi yang tinggi. Bahan ini juga berbahaya jika terkena kulit dan mata secara terus-menerus. Bahan ini tidak bersifat mutagenik atau karsinogenik. Asam asetat biasanya berwujud cair, berbau dan berasa cuka sangat kuat dan tajam serta tidak berwarna. Massa molekul relatifnya adalah 60,05 g/mol dengan titik didih 181,1oC dan titik leleh 16,6oC. Penyimpanan ditempat yang sejuk dan jauh dari api (Anonim, 2015).
O
OH
C
H
3
Gambar 2.1. Struktur Asam Asetat 2.1.3 Asam Fosfat
sangat korosif terhadap logam besi dan persenyawaanya, serta larut dalam air dan alkohol. Asam fosfat memiliki massa molekul 97,995 g/ mol, wujud berupa cairan, titik leleh 42,4°C, titik didih 407°C, kelarutan kualitatif pada etanol, kelarutan 548 x 1020g/100g H2O. Kontak kulit bisa menyebabkan luka bakar dan radang kulit yang ditandai dengan gatal, kemerahan. Uap dari senyawa ini bisa menghasilkan kerusakan jaringan terutama pada selaput lendir mata, mulut dan saluran pernapasan. Penghirupan uap dapat menghasilkan iritasi parah dari saluran pernapasan, yang ditandai dengan batuk, tersedak, atau sesak napas. Pemaparan yang berlebihan dapat menyebabkan kematian. Peradangan mata ditandai dengan mata merah, mengeluarkan air mata, dan gatal (Anonim, 2014). 2.1.4 Akuades
Akuades atau air mempunyai rumus kimia H2O. Air tidak bersifat korosif, iritasi, permeator atupun sensitif untuk mata, kulit atau menelan. Akuades juga tidak berbahaya jika terhirup. Akuades tidak memiliki efek karsinogenik dan mutagenik. Bahan ini tidak mudah terbakar ataupun meledak. Akuades merupakan senyawa netral yang memiliki pH 7, tidak berbau dan tidak berwarna serta tidak berasa. Air mempunyai titik didih 100oC dan merupakan senyawa yang stabil (Anonim, 2015).
O
H H
water
2.2. struktur H2O 2.2 Landasan Teori
Konsep asam basa yang sangat terkenal terdiri dari tiga macam yaitu menurut Arrhenius, Bronsted-Lowry dan asam basa menurut Lewis. Arrhenius menyatakan bahwa asam adalah senyawa hidrogen, di mana jika senyawa tersebut dilarutkan dalam air akan mengalami disosiasi elektrolit dan menghasilkan ion H+. Kemampuan suatu asam untuk menghasilkan ion H+ dinilai sebagai kekuatan asam. Besar ion H+ yang dihasilkan berbanding lurus dengan kekuatan asam. Semakin besar H+ maka asam semakin kuat. Semakin besar ion H+ maka nilai Ka juga akan semakin besar. Oleh karena itu, Ka pada asam atau Kb pada basa digunakan sebagai ukuran penentuan kekuatan suatu asam (Khopkar, 1990).
kekuatan asam atau basa. Namun, nilai kesetimbangan disosiasi, tidak bergantung pada konsentrasi tetapi bergantung pada keaktifan asam sehingga dapat dijadikan ukuran kuantitatif untuk kekuatan asam atau basa itu (Svehla, 1990).
Asam yang memiliki konstanta H+ hanya satu seperti HCl, HNO3 dan HC2H3O2, disebut asam monoprotik. Pendonoran proton adalah suatu reaksi yang dapat beregerak ke kiri dan ke kanan, jadi setiap asam akan membentuk basa dengan menyumbangkan proton tersebut. Selain itu, setiap basa menerima proton untuk membentuk suatu asam (Keenan, 1990).
Asam lemah monoprotik (HA) dan ion-ionnya di dalam suatu larutan selalu berada dalam kesetimbangan (H3O+ dan A-)
atau jika dinyatakan dalam –log Ka = pKa −¿
Potensiometri adalah istilah yang digunakan untuk menjelaskan pengukuran potensial atau voltase dari suatu sel elektrokimia yang terdiri dari elektroda dan larutan. Larutan biasanya berisi komponen utama yang mempunyai kemampuan menghasilkan ion. Dasar metode potensiometri adalah membuat sel elektrik dari analit suatu larutan sehingga perbedaan potensial sel tersebut terhubung dengan konsentrasi larutan. Metode potensiometri memerlukan minimal dua macam elektroda, yaitu elektroda referensi eksternal yang memiliki potensial konstan dan elektroda selektif ion atau biasa disebut juga elektroda referensi internal yang digunakan untuk pengukuran dan dipisahkan dari larutan oleh suatu membran (Khopkar, 1990).
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Kurva titrasi dapat diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Akhir titrasi dapar diperkirakan dari grafik tersebut. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Kennedy, 1990).
Keuntungan melakukan pengukuran secara potensiometri untuk mendeteksi titik akhir yaitu pengukuran dapat dilakukan dalam larutan yang berwarna, tidak seperti deteksi titik akhir berdasarkan indikator, dan memberikan titik akhir yang tidak ambigu ketika perubahan warna indikator tidak jelas atau tiba-tiba. Kelemahan titrasi potensiometri adalah umumnya berlangsung lambat, karena dibutuhkan waktu agar pembacaan stabil, terutama di dekat titik akhirtitrasi (Watson, 1801).
Kelebihan lain cara analisis dengan titrasi potensiometri adalah penentuan titik akhir titrasi yang lebih akurat dibandingkan dengan cara titrasi lain. Disamping itu titrasi biasa sulit dikerjakan untuk larutan yang berwarna dan larutan yang keruh. Sedangkan dengan cara titrasi potensiometri masalah larutan berwarna atau keruh tidak menjadi masalah (Mulia, 1995)
volume titran. Sedangkan fungsi linear pH larutan adalah elektroda selektif ion hidrogen, elektroda gelas, potensial sel yang diukur (Skoog, 1994).
E sel = K - 0,059 pH
Identifikasi asam lemah, digunakan nilai Ka atau pKa, dan untuk asam lemah monoprotik, tetapan disosiasi (Ka) adalah
H3O
pKa2 untuk asam lemah poliprotik adalah pKa2 = 2pH ekv – pKa1. Nilai Ka atau pKa dapat digunakan untuk mengidentifikasi sebuah asam lemah. Asam poliprotik tidak hanya memiliki satu kesetimbangan namun beberapa, hal ini membuatnya memiliki beberapa konstanta disosiasi. Massa molekul relative (Mr) asam lemah juga harus diketahui dalam identifikasi. Cara menentukan Mr tersebeut adalah dengan menghitung volume titran dari titik ekuivalen (Skoog, 1994).
Program LabVIEW adalah sebuah software pemrograman keluaran National Instruments dengan konsep khusus. LabVIEW juga mempunyai fungsi yang sama seperti software pemrograman lainnya misalnya C++, matlab atau Visual Basic, hanya saja terdapat perbedaan diantara kedua jenis software tersebut. LabVIEW menggunakan bahasa pemrograman berbasis grafis atau block diagram sedangkan software
pemrograman lainnya menggunakan basis text. Hal pertama yang dilakukan untuk menjalankan LabVIEW, user pertama-tama membuat user interface atau front panel
dengan menggunakan kontrol dan indikator, yang dimaksud dengan kontrol adalah knobs,
push button, dials dan peralatan input lainnya sedangkan yang dimaksud dengan indikator adalah graphs, LEDs, dan peralatan display lainnya. Program labview dikenal sebagai
Virtual Instrument karena penampilan dan operasinya dapat meniru sebuah instrumen.
Software LabView terdiri dari tiga komponen utama, yaitu: front panel, blok diagram Vi,
BAB 3. METODE PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat
- Gelas beaker 250 mL
- Pompa peristaltic (selang dan botol infus) - Pipet volume
- Elektroda - Gelas ukur
- Labu ukur 100 mL - Laptop / PC
3.1.2 Bahan
- Larutan Asam Asetat 0,1 M - Larutan NaOH 0,1 M - Larutan asam fosfat 0,1 M - Software labview
3.2 Prosedur Kerja 3.2.1 pK suatu asam asetat
- dimasukkan kedalam beaker glass kursng lebih 50 mL - dicelupkan elektroda-elektrodanya
- dititrasi dengan larutan hidroksida standart (duplo) - dialurkan data sebagai pH lawan volume NaOH - ditetapkan volume kesetaraan
- dilaporkan nilai pada asisten Asam Asetat
3.2.2 Titrasi asam fosfat
- dimasukkan dalam 2 beaker glass masing-masing 50 mL - dicelupkan elektroda-elektrodanya
- dititrasi dengan larutan hidroksida standart (duplo)
- dialurkan kurva titrasi itu sebagai pH lawan volume NaOH - ditetapkan molaritas larutan asam
- ditetapkan nilai pKa1 dan pKa2 asam fosfat Asam Fosfat
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil
Sampel Titik Ekuivalen Ka Ka literatur
Asam asetat 1 14,27 mL 7,178 x 10-6 1,8.10-5
Asam asetat 2 4,80 mL 4,529 x 10-5 1,8.10-5
Asam fosfat (Ka1)
14 mL 3,68 x 10-3
7,5.10-3 29,5 mL 7,063 x 10-7
Asam fosfat (Ka2) 8,4 mL 9,8 x 10
-3
6,2.10-8 40,3mL 2,046 x 10-7
4.2 Pembahasan
Percobaan ini bertujuan untuk mengukur konstanta ionisasi dua asam dengan menggunakan teknik titrasi potensiometrik. Disosiasi merupakan peristiwa terjadinya suatu senyawa menjadi zat-zat yang lebih kecil atau sederhana, sedangkan ionisasi adalah peristiwa terurainya senyawa menjadi ion-ionnya. Praktikum ini melibatkan titrasi potensiometrik, di mana titrasi dilakukan dengan mencelupkan elektroda yang telah tersambung pada komputer yang telah siap menghitung pH dari bahan yang dititrasi. Bahan yang dipakai pada praktikum ini adalah asam monoprotik dan poliprotik. Asam monoprotik adalah asam yang dapat melepaskan 1 H sedangkan asam poliprotik merupakan asam yang dapat melepaskan lebih dri 2 H. Asam monoprotik yang digunakan disini adalah asam asetat dan untuk asam poliprotik menggunakan asam fosfat.
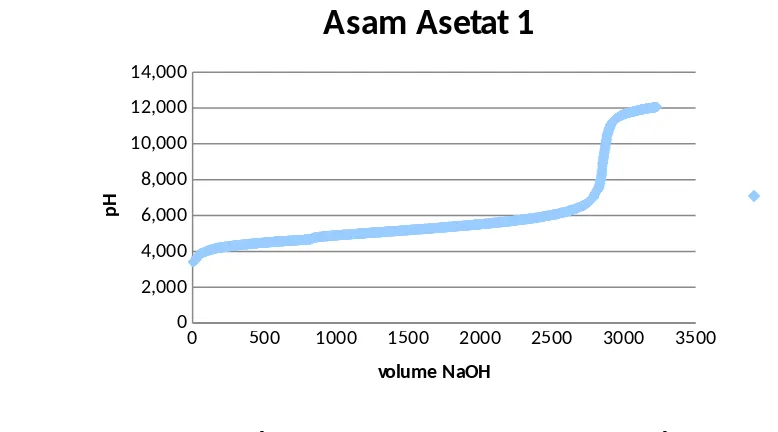
gelas beaker agar tidak mempengaruhi hasil. Elektroda tersebut dibilas terlebih dahulu dengan akuades untuk kalibrasi. Elektroda harus selalu dibilas setiap akan dicelupkan ke dalam cairan. Gelas beaker diletakkan diatas stirrer untuk pengadukan. Asam tersebut kemudian dititrasi dengan NaOH. Komputer akan menggambarkan kurva titrasi dengan sumbu x volume dari NaOH yang ditambahkan dan sumbu y adalah pH. Titrasi dilakukan sampai terbentuk kurva titrasi dari asam tersebut. Berikut adalah gambar titrasi asam asetat yang pertama.
0 500 1000 1500 2000 2500 3000 3500 0
2,000 4,000 6,000 8,000 10,000 12,000 14,000
Asam Asetat 1
volume NaOH
pH
Gambar 4.2.1. Kurva titrasi Asam Asetat percobaan 1
0 2 4 6 8 10 12
Gambar 4.2.2. Kurva Titrasi Asam Asetat 2
Gambar di atas merupakan kurva titrasi Asam Asetat pada percobaan kedua. Secara sekilas kurva tersebut mirip dengan kurva sebelumnya karena masih dengan bahan yang sama yaitu asama asetta yang merupakan asam monoprotik sehingga hanya ada 1 titik ekuivalen. Walaupun terlihat mirip namun kurva ini memiliki titik ekuivalen yang berbeda dengan yang sebelumnya yaitu 4,80 mL sehingga setelah dihitung didapatkan Ka sebesar 4,529 x 10-5. Reaksi yang berlangsung pada titrasi asam monoprotik adalah sebagai berikut :
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(aq)
0 2 4 6 8 10 12
Gambar yang terlihat di atas adalah kurva titrasi asam fosfat dengan NaOH. Langkah yang dilakukan untuk mentitrasi sama dengan perlakuan untuk asam asetat. Perbedaan dari asam monoprotik dan poliprotik terlihat dalam kurva yang terbentuk. Asam monoprotik seperti CH3COOH hanya akan melepas 1 Hidrogen sedangkan untuk asam poliprotik seperti H3PO4 akan melepas beberapa hydrogen seperti pada reaksi berikut.
H3PO4(aq) + H2O(l) ⇌ H2PO4-(aq) + H3O+
Kurva ini akan digunakan untuk menghitung Ka1 dari asam fosfat. Ka1 terjadi pada titik ekuivalen 14 mL. Ka1 yang diperoleh setelah perhitungan adalah 3,68 x 10-3 sedangkan yang ada di literatur sebesar 7,5.10-3.
0 2 4 6 8 10 12
Gambar 4.2.4. Kurva Titrasi Asam Fosfat 2
BAB 5. PENUTUP
5.1
Kesimpulan
Percobaan yang telah dilakukan tentang analisis dan penentuan konstanta disosiasi asam dengan titrasi pH yang dikontrol dengan komputer yang telah dilakukan, maka dapat disimpulkan bahwa:
1. Penentuan konstanta disosiasi asam, baik asam monoprotik maupun asam poliprotik dapat dilakukan dengan menggunakan metode titrasi potensiometri.
2. Ka dari hasil percobaan ini tidak terlalu sesuai dengan yang ada di literatur.
5.2 Saran
DAFTAR PUSTAKA
Anonim. 2015. MSDS Akuades. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9924923. Diakses tanggal 20 Maret 2015.
Anonim. 2015. MSDS Asam Asetat. [Serial Online].
http://www.sciencelab.com/msds.php?msdsId=9927321. Diakses tanggal 1 April 2015.
Anonim. 2014. Asam Fosfat. [Serial Online]. http://www.sciencelab.com/msds/php? msdsld= 4728267. Diakses 12 September 2015.
Anonim. 2015. MSDS NaOH. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9924359. Diakses tanggal 20 Maret 2015.
Keenan. 1990. Kimia Untuk Universitas. Erlangga: Jakarta .
Kennedy, J.H. 1990. Analytical Chemistry Principles, 2nd ed. New York: Saunders College Publishing.
Khopkar. 1990. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia. Mulia, M. 1995. Potensiometri.
Rachman, alif. 2012. Lab View Software [serial online].
http://rakhman.net/2012/08/labview-software.html. Diakses 12 September 2015. Skoog, D dan West, A. 1994. Principles of Chemistry. Kanada : The University of Ottawa. Svehla, G. 1990. Vogel Buku Teks Analisis Anorganik kualitatif Makro dan Semimikro.
Jakarta : Kalman Media Pustaka.
Tim Kimia Fisik. 2014. Penuntun Praktikum Kimia fisik II. Jember : FMIPA-Kimia. Watson, David G. 1801. Analisis Farmasi : BA untuk Mahasiswa Farmasi dan Praktisi
LAMPIRAN
LAMPIRAN
Menghitung Ka
Kurva Titrasi Asam Asetat dengan NaOH
0 500 1000 1500 2000 2500 3000 3500 0
2,000 4,000 6,000 8,000 10,000 12,000 14,000
Asam Asetat 1
volume NaOH
pH
Keadaan ekivalen menunjukkan informasi bahwa:
pH=pKa dan pH=1
2×Vekivalen
Volume NaOH pada saat ekivalen yaitu 28,540 mL. Titik ekivalen terdapat 1
1
2×VNaOH ekivalen=
1
2× 28,540 mL=14.270mL
pH=¿ 5,144
Saat ekivalen : pKa=pH
pKa=5,144 Ka=10−5,144
Kurva Titrasi Asam Asetat dengan NaOH Pengulangan Kedua
0 2 4 6 8 10 12
0 2 4 6 8 10 12
Asam Asetat 2
volume NaOH
pH
Volume NaOH pada saat ekivalen yaitu 96,0 mL. Titik ekivalen hanya 1
1
2×VNaOH ekivalen=
1
2× 96,0 mL = 48,0 mL mL=4,80mL
pH=¿ 4.344
Saat ekivalen : pKa=pH
pKa=4.344
Ka=10−4,344
Asam Fosfat
Kurva Titrasi Asam Fosfat dengan NaOH Pengulangan Pertama
0 2 4 6 8 10 12
Asam fosfat merupakan asam poliprotik sehingga akan diperoleh dua titik ekivalen: Terdapat 2 titik ekivalen
Ka=10−6.119
=7,603x10−7
Asam Fosfat
Kurva Titrasi Asam Fosfat dengan NaOH Pengulangan Pertama
0 2 4 6 8 10 12
Asam fosfat merupakan asam poliprotik sehingga akan diperoleh dua titik ekivalen: Terdapat 2 titik ekivalen