BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
Tabel 2.1. Diagram Alur Proses Oleokimia dari Bahan Dasar Minyak atau Lemak menjadi Oleokimia dan Turunan Oleokimia
Bahan Dasar Bahan Dasar Oleokimia Turunan
Oleokimia
Minyak / Lemak
Asam Lemak Diikuti reaksi-reaksi
seperti : Aminasi Klorinasi Dimerisasi Epoksidasi Etoksidasi Hidrogenasi Kuarternisasi Sulfasi
Transesterifikasi Esterifikasi Saponifikasi Amina Asam Lemak
Alkohol Asam Lemak
Amina Asam Lemak
Metil Ester Asam Lemak
Propilen, Parafin dan Etilen
Sumber : Richtler and Knaut, 1984 : Alami
: Sintesis
Gliserol
2.2.Asam lemak
Asam lemak merupakan asam karboksilat alifatis berantai panjang (Sastrohamidjojo, 2005). Jenis asam lemak menjadi penentu perbedaan sifat dari trigliserida namun komponen gliserol bersifat identik untuk setiap trigliserida. Beberapa aspek yang membedakan jenis asam lemak yaitu:
d. Konfigurasi dari atom hidrogen yang berikatan dengan karbon berikatan rangkap, posisi cis atau trans dan
e. Posisi dari ikatan asam lemak dengan gliserol
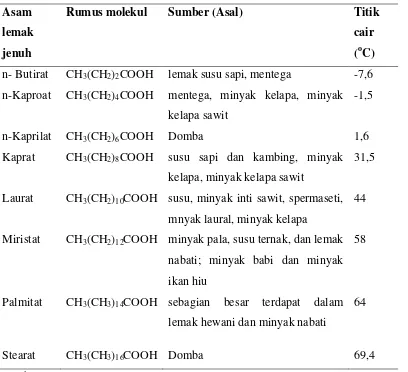
Asam lemak ditemukan dalam lemak makanan pada panjang rantai karbon 4-24 atom karbon (O’brien, 2009). Asam lemak sebagai penyusun lemak ini dapat dibedakan antara asam lemak jenuh dan tak jenuh. Asam lemak disebut jenuh bila semua atom karbon dalam rantainya diikat tidak kurang daripada dua atom hidrogen, sehingga dengan demikian tidak ada ikatan rangkap. Asam-asam lemak jenuh yang telah dapat diidentifikasi sebagai bagian dari lemak mempunyai atom C4 hingga C26. Jenis-jenis asam lemak jenuh dijelaskan pada tabel 2.2.
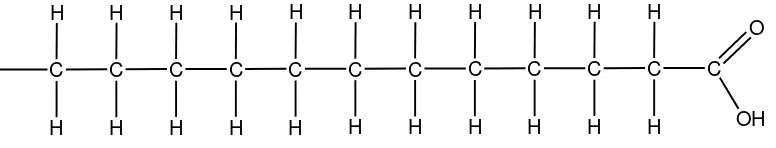
Adapun struktur umum rantai karbon dari asam lemak jenuh adalah sebagai berikut:
Gambar 2.1. Struktur asam lemak jenuh
Asam-asam lemak yang didalam rantai karbonnya mengandung ikatan rangkap dinamakan sebagai asam lemak tak jenuh. Derajat ketidakjenuhan dari minyak tergantung pada jumlah rata-rata dari ikatan rangkap didalam asam lemak. Jenis-jenis asam lemak tak jenuh dijelaskan pada tabel 2.3.
H2
C (CH2)4 C
H CH (CH2)7 C OH
O
Gambar 2.2. Struktur asam lemak tak jenuh
Rantai karbon dari asam lemak tak jenuh (Sastrohamidjojo, 2005).
alkohol daripada garam dari asam lemak yang mempunyai berat molekul tinggi dan jenuh (Winarno, 1984). Asam oleat mempunyai rantai karbon yang sangat panjang dengan asam stearat, tetapi pada suhu kamar, asam oleat berupa bentuk cairan. Disamping itu, makin banyak jumlah ikatan rangkap pada suatu asam lemak maka makin rendah titik leburnya (Poedjiadi, 1994).
Tabel 2.2. Asam Lemak Jenuh yang Terdapat dalam Lemak dan Minyak
Sumber : Ketaren, 2008 Asam
lemak jenuh
Rumus molekul Sumber (Asal) Titik
cair (oC) n- Butirat CH3(CH2)2COOH lemak susu sapi, mentega -7,6 n-Kaproat CH3(CH2)4COOH mentega, minyak kelapa, minyak
kelapa sawit
-1,5
n-Kaprilat CH3(CH2)6COOH Domba 1,6
Kaprat CH3(CH2)8COOH susu sapi dan kambing, minyak kelapa, minyak kelapa sawit
31,5
Laurat CH3(CH2)10COOH susu, minyak inti sawit, spermaseti, mnyak laural, minyak kelapa
44
Miristat CH3(CH2)12COOH minyak pala, susu ternak, dan lemak nabati; minyak babi dan minyak ikan hiu
58
Palmitat CH3(CH3)14COOH sebagian besar terdapat dalam lemak hewani dan minyak nabati
64
Tabel 2.3. Asam Lemak Tidak Jenuh yang Terdapat dalam Lemak dan Minyak
Sumber: Ketaren, 2008
Hampir semua asam lemak yang terdapat dalam alam mempunyai jumlah atom karbon yang genap karena asam ini dibiosintesis dari gugus asetil berkarbon dua dalam asetil koenzim A (Fessenden dan Fessenden, 1992).
2.3.Asam Oleat
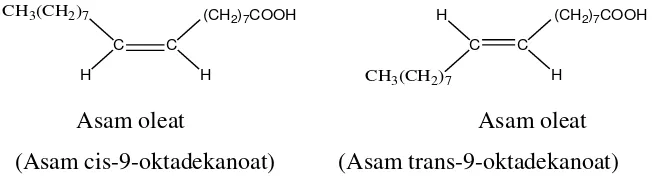
Asam oleat merupakan penyusun dari lemak-lemak tanaman atau hewan. Asam oleat dapat dipisahkan dari zat tersebut dengan cara hidrolisis, sebagian asam oleat berada bersama-sama dengan asam stearat dan asam palmitat. Struktur asam oleat adalah CH3(CH2)7CH=CH(CH2)7COOH. Asam lemak yang tidak jenuh ini masing-masing mempunyai bentuk cis yaitu asam oleat dan trans dari asam oleat sering juga disebut asam allooleat. Asam oleat membentuk cis karena mempunyai titik lebur yang rendah dan pembakaran yang tinggi.
Asam
lemak tak
jenuh
Rumus molekul Sumber (asal) Titik
cair(o
C)
Palmitoleat CH3(CH2)5CH=CH(CH2)7COOH minyak kacang dan jagung
33
Oleat CH3(CH2)7CH=CH(CH2)7COOH disebagian besar
minyak dan lemak 14
Linoleat CH3(CH2)4CH=CHCH2CH=CH(CH2)7
COOH
Minyak biji kapas, biji lin, biji poppy
-3
Linolenat CH3CH2CH=CHCH2CH=CHCH2CH=
CH(CH2)7COOH
Minyak perilla, biji lin
Bentuk struktur asam oleat dalam bentuk cis dan trans yakni sebagai berikut:
C C
H
(CH2)7COOH
H CH3(CH2)7
C C
H (CH2)7COOH
H CH3(CH2)7
Asam oleat Asam oleat (Asam cis-9-oktadekanoat) (Asam trans-9-oktadekanoat)
Gambar 2.3. Struktur cis dan trans asam oleat.
(Sastrohamidjojo, 2005).
Asam oleat, asam linoleat dan asam linolenat biasanya terdapat bersama dengan asam lemak lain seperti asam laurat, asam miristat, asam palmitat, asam stearat dan asam lemak lainnya. Asam lemak tidak jenuh tersebut dapat diubah ke berbagai bentuk turunannya antara lain dalam pembentukan ester asam lemak dengan poliol seperti sorbitol, manitol dan sebagainya untuk membentuk surfaktan. Ester asam lemak dengan poliol tersebut memiliki sifat surfaktan karena disamping memiliki gugus ester juga masih memiliki gugus hidroksil sehingga terjadi keseimbangan antara gugus yang bersifat lipofil dengan gugus yang bersifat hidrofil (Tarigan, 2005). Penelitian tentang asam oleat telah banyak dikembangkan, misalnya dalam pembuatan bahan bakar alternatif (biodiesel). Asam oleat dikonversi menjadi produk biodiesel di unit reaksi dengan penambahan alkohol dan katalis, kemudian dimurnikan di unit pemisahan (Kusmiyati, 2008)
2.4.Ester Asam Lemak
dibentuk melalui reaksi langsung antara suatu asam karboksilat dengan alkohol yang disebut dengan reaksi esterifikasi (Shreve, 1 956). Yang dikelompokkan sebagai ester asam lemak meliputi:
a. Ester karboksilat tunggal dengan panjang rantai karbon mulai dari C6 sampai C20.
b. Ester asam lemak yang hanya mengandung karbon, hidrogen dan oksigen c. Ester alkohol dari asam lemak tersebut diatas termasuk juga dalam
kelompok ester asam lemak
Ester yang paling sederhana adalah metil ester asam lemak yang dapat dihasilkan melalui reaksi esterifikasi antara asam lemak dengan metanol. Ester asam lemak sering dimodifikasi untuk digunakan sebagai bahan makanan, surfaktan, polimer, sintesis, zat aditif, bahan kosmetik, dan kebutuhan lain (Meffert,1984). Metil ester asam lemak yang merupakan bagian dari pada ester asam lemak mono alkohol merupakan zat antara dalam industri oleokimia disamping dapat digunakan sebagai bahan bakar diesel (Ozgul, l993).
Ester asam lemak terdapat dalam bentuk ester antara gliserol dengan asam lemak ataupun dengan phospat seperti phospolipid. Disamping itu ada juga ester antara asam lemak dengan alkoholnya yang membentuk monoester terdapat pada minyak jojoba. Ester asam lemak sering dimodifikasi baik untuk bahan makanan maupun untuk bahan surfaktan, aditif, detergen dan lain sebagainya (Endo et al, 1997).
Esterifikasi adalah suatu reaksi ionik yang merupakan gabungan dari reaksi adisi dan reaksi penataan ulang eliminasi (Davidek, 1990). Esterifikasi juga dapat didefenisikan sebagai reaksi antara asam karboksilat dan alkohol (Gandhi, 1997). Esterifikasi dapat dilakukan dengan menggunakan katalis enzim (lipase) dan asam anorganik (asam sulfat dan asam klorida), dengan berbagai variasi alkohol biasanya metanol, etanol, l-propanol, 1-butanol, amyl alkohol, dan lain-lain (Ozgulsun, 2008). Asam anorganik yang digunakan sebagai katalis akan menyebabkan asam karboksilat mengalami konjugasi sehingga asam konjugat dari asam karboksilat tersebutlah yang akan berperan sebagai substrat.
Cara lain dalam pembentukan ester adalah dengan melewatkan HCI kedalam campuran reaksi tersebut dan direfluks. Cara ini dikenal dengan nama metode Fischer-Spieser. Esterifikasi tanpa katalis dapat juga dilakukan dengan satu molekul asam karboksilat dan satu pereaksi secara berlebih. Pertambahan hasil juga dipengaruhi oleh dehidrasi yang artinya menarik air yang terbentuk sebagai hasil samping reaksi. Air dapat dipisahkan dengan cara menambahkan pelarut yang bersifat non polar seperti misalnya benzena dan kloroform sehingga air yang terbentuk akan segera terikat pada pelarut yang digunakan atau dengan manambahkan molekular sieves (Yan, 2001).
2.5. Ozonolisis
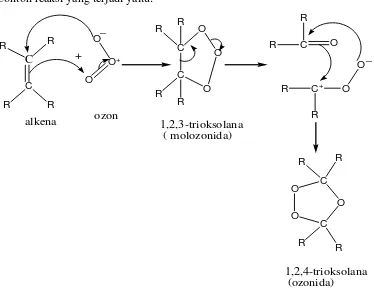
Ozonolisis (pemaksapisahan oleh ozon) telah banyak digunakan untuk menetapkan struktur senyawa tak jenuh karena reaksi ini menyebabkan degradasi molekul besar menjadi molekul yang lebih kecil yang dapat diidentifikasi. Ozonolisis terdiri dari dua reaksi yang terpisah :
Oksidasi alkena oleh ozon menjadi ozonida, dimana dengan mengalirkan ozon
kedalam larutan alkena akan ikatan π untuk menghasilkan zat antara tak stabil yang disebut 1,2,3-triosolana (ozonida) yang jarang diisolasi (Fessenden dan Fessenden, 1986).
Contoh reaksi yang terjadi yaitu:
C
Gambar 2.4. Reaksi Oksidasi Alkena oleh Ozon (Tedder,J.M. 1987)
O O
1,2,4- trioksolana aldehid keton
Gambar 2.5. Reaksi Reduksi Ozonida menjadi Aldehida.
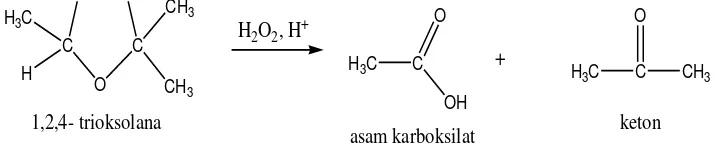
Jika diikuti penyelesaian oksidatif, maka karbon monosubstitusi akan menghasilkan asam karboksilat. Dalam kasus kedua ini, karbon disubstitusi alkena kan menghasilkan keton.
O O
Gambar 2.6. Reaksi Oksidasi Ozonida menjadi Aldehida
( Fessenden dan Fessenden, 1986).
2.6.Aldehida
Aldehida mempunyai paling sedikit satu atom hidrogen pada gugus karbonilnya. Sedangkan gugus lainnya boleh berupa atom hidrogen, gugus alkil ataupun gugus aril.
R C
O
H
Gambar 2.7. struktur aldehida
Aldehida bereaksi dengan beberapa zat pengoksidasi yaitu pereaksi Tollens (Ag+ dalam larutan NH3), pereaksi Benedict (Cu2+ dalam larutan natrium sitrat) dan pereaksi Fehling (Cu2+ dalam larutan kalium natrium tartrat). Pereaksi ini mengoksidasi aldehida menjadi asam karboksilat dan ditandai dengan perubahan warna. Aldehida akan mereduksi pereaksi Fehling dan Benedict sedangkan ia sendiri akan teroksidasi dan ditandai dengan terbentuknya endapan merah bata Cu2O (Sarker andLutfun, 2007).
Adanya gugus karbonil menyebabkan aldehida bersifat polar dan mempunyai gaya intermolekul dan titik didih yang lebih besar daripada alkana yang bersesuaian. Atom oksigen pada senyawa karbonil dapat membentuk ikatan hidrogen yang cukup kuat dengan molekul air. Senyawa karbonil dengan berat molekul yang rendah dapat larut di dalam air, sedangkan aseton dan asetaldehida larut dalam air dalam segala perbandingan (Riswiyanto, 2009).
Adapun metode-metode pembuatan aldehida adalah sebagai berikut: 1. Oksidasi alkohol primer
Alkohol primer memiliki dua hidrogen alfa yang salah satu atau keduanya dilepas, sehingga alkohol primer berubah menjadi aldehida atau asam karboksilat tetapi dalam oksidasinya harus memperhatikan pemilihan pereaksi dan kondisi reaksinya.
(Riswiyanto, 2009) 2. Oksidasi metilbenzena
RCH2OH R CH
O K2Cr2O7 / H+
1o alkohol aldehida
ArCH3
Cl2, panas
CrO3, anidrida asetat
ArCHCl2
ArCH(OOCCH3)2
ArCHO H2O
Jika turunan toluena direaksikan dengan CrO3 dalam anhidrida asetat diikuti dengan hidrolisis akan dihasilkan senyawa aldehida.
3. Reduksi asil klorida
(Morrison, 2002). Jika asam karboksilat direaksikan dengan SOCl2 dan asil klorida yang dihasilkan direaksikan dengan tri-t-bubutoksialuminium hidrida pada suhu -78oC akan terbentuk senyawa aldehida.
4. Ozonolisis alkena
Alkena yang mempunyai paling tidak satu hidrogen vinilik akan mengalami pemecahan reaksi oksidasi dengan ozon menghasilkan aldehida. Jika ozonolisis dilakukan pada alkena siklik, maka dihasilkan senyawa dikarbonil. Metode yang paling baik dan telah lama diketahui untuk mensintesis senyawa aldehida adalah oksidasi alkohol primer dan oksidasi pemutusan alkena seperti ozonolisis senyawa alkena (Riswiyanto, 2009).
Aldehida dapat dioksidasi dengan permanganat dan dikromat, namun dapat juga dioksidasi dengan zat pengoksidasi yang sangat lembut, seperti Ag+ dan Cu2+. Reagen Tollens digunakan sebagai reagensia uji untuk aldehida dimana uji positif ditandai dengan terbentuknya cermin perak pada dinding dalam tabung reaksi. Tetapi dengan meluasnya penggunaan spektroskopi , uji ini tidak dipilih lagi untuk identifikasi aldehida, namun kadang-kadang cermin tersebut masih dibuat (Fessenden dan Fessenden, 1992).
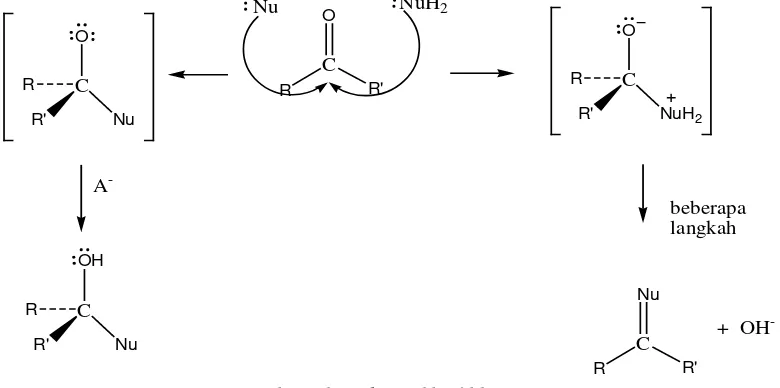
Reaksi dari senyawa aldehida paling banyak yang terjadi adalah reaksi adisi nukleofilik. Dimana pada adisi nukleofilik dapat menghasilkan dua kemungkinan hasil reaksi , yaitu:
i. Intermediet tetrahedral yang dapat diprotonasi dengan asam atau air menghasilkan alkohol.
ii. Atom oksigen karbonil dapat dieliminasi sebagai OH atau H2O menghasilkan ikatan C=Nu.
Adapun mekanisme reaksinya adalah sebagai berikut (Riswiyanto, 2009):
Gambar 2.8. Mekanisme Reaksi Adisi Nukleofilik pada Aldehida atau Keton Contoh-contoh reaksi aldehida dengan senyawa lain :
a. Oksidasi dengan Reagen Tollens
b. Reduksi menjadi alkohol
C
Dua pola reaksi adisi nukleofilik yang dapat terjadi pada senyawa aldehida atau keton
c. Adisi Nukleofilik pereaksi Grignard
(Morrison, 2002). d. Adisi turunan ammonia
(Riswiyanto, 2009).
(Patrick, 2003). Salah satu jalan untuk membuat aldehida adalah dengan jalan ozonolisis alkena. Atom karbon yang terlibat dengan ikatan rangkap yang mempunyai atom hidrogen akan membentuk aldehida (Siregar, 1988).
2.7.Etilendiamina
Etilendiamina (1,2- diamino etana) dibuat dari etilen diklorida dan amonia, sifatnya adalah tidak berwarna,jernih, mempunyai bau amonia, densitasnya 0,898 g/cm-3, titik didihnya 116-117°C, titik lebur 8,5, sedikit larut dalam eter, tidak larut dalam benzena, bersifat sangat basa sehingga mudah mengadsorbsi CO2 dari udara membentuk karbonat yang tak mudah menguap. Etilendiamina digunakan sebagai pelarut untuk kasein, albumin dan sulfur, juga digunakan sebagai emulsifier, penstabil lateks serta sebagai penghambat atau inhibitor dalam larutan anti beku (Anonimous, 1976).
H2N C C NH2
H H
H H
Gambar 2.9. Struktur Kimia Etilendiamina
Etilendiamina merupakan poliamina primer yang larut dalam air dan sangat higroskopis. Etilendiamina harus dilindungi dari kelembaban atmosfer dan CO2 selama pemurnian dan pemakaiannya karena akan menyebabkan banyak kesalahan dalam hasil yang diperoleh.(Roberts, 1982).
2.8.Anilina
Anilina memiliki bentuk cairan berminyak berwarna jernih sampai kecoklatan dan berbau amis. Berat molekul anilina yaitu 93,13, dengan rumus molekul C6H5NH2. Anilina memiliki nama lain aminobenzena atau benzenamin.
Adapun sifat-sifat anilina yaitu: Titik didih : 184o C
Titik beku : -6o C Titik nyala : 228o C Berat jenis : 1,0217 gr/ml
Kelarutan : larut dalam air sebesar 3,5%, larut dalam metanol, eter, aseton, benzena, kloroform, pelarut organik, air dingin dan air panas.
Anilina banyak digunakan sebagai bahan antioksidan, akselerator, dan vulkanisir dalam industri karet,digunakan dalam pembuatan analgin, isopropil antipirin, obat sulfa, oksifen butazon, dan vitamin B2 dalam industri farmasi, digunakan dalam industri pembuatan pestisida, digunakan dalam industri pembuatan bahan peledak, digunakan sebagai zat antara dalam industri pembuatan bahan kimia dan bahan pewarna sintetis, digunakan dalam pembuatan parfum, digunakan dalam industri resin dan pernis. (sumber bahan BPOM RI)
2.9. Basa Schiff
Seperti pada persamaan dibawah ini:
R-NH2 + R-CHO R-N=CH-R + H2O
Dimana R dapat dimisalkan sebagai senyawa alifatik maupun senyawa aromatik. Basa Schiff yang berasal dari senyawa aldehida aromatik memiliki keefektifan sistem konjugasi yang lebih stabil. (Munir,C., 1985).
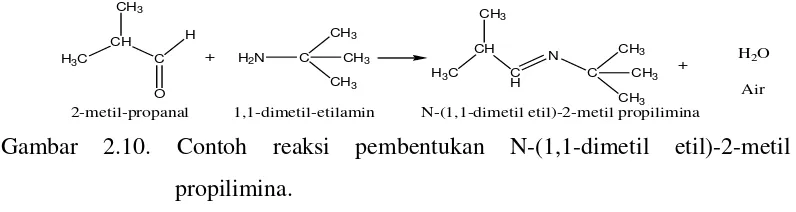
Contoh reaksi pembentukan Basa Schiff yaitu pembuatan N-(1,1-dimetil etil)-2-metil propilimina.
2-metil-propanal 1,1-dimetil-etilamin N-(1,1-dimetil etil)-2-metil propilimina
+ H2O Air
Gambar 2.10. Contoh reaksi pembentukan N-(1,1-dimetil etil)-2-metil propilimina.
(Vogel, 1989)
Sesuatu yang menarik dari Basa Schiff bahwa penggunaannya sebagai suatu inhibitor korosi yang efektif, dimana didasarkan pada kemampuan secara spontan membentuk suatu lapisan pada permukaan agar terlindungi. Banyak inhibitor komersial termasuk aldehida atau amina, tetapi adanya ikatan C=N pada Basa Schiff lebih effisien didalam banyak kasus. Prinsip interaksi antara inhibitor dengan permukaan logam adalah adsorpsi kimia (Ashraf, dkk, 2011).
Penelitian terlebih dahulu telah menunjukkan progres penggunaan dari kompleks logam sebagai obat-obatan untuk penyembuhan beberapa penyakit manusia seperti karsinoma, limphoma, kontrol infeksi, anti inflamasi, diabeter dan neurologi (Rafique et al, 2010). Salah satu penelitian terhadap kegunaan Basa Schiff yaitu penelitian yang dilakukan oleh Kusmin et al. Kusmin et al pada tahun 2000 telah melakukan penelitian hubungan pada aktivitas anti kanker dari Basa Schiff makrosiklik dari 2,6-bis (formilariloksimetil) piridin dengan metode topologi. Persamaan korelasi menjelaskan hubungan antara aktivitas anti kanker dan parameter struktural dari molekul yang dipelajari dan karakteristik deskripsi struktur senyawa tersebut yang mengandung dasar dari in vitro data skrining. Pada tahun 2005, dilakukan penelitian pada aktivitas anti kanker dari makrosiklik Basa Schiff yang didasarkan pada representasi simpleks dari struktur molekular. Pada penelitian ini dijelaskan bahwa kenaikan dan penurunan jumlah fragmen molekul mengindikasikan aktivitas antikanker dapat dilihat pada perubahan panjang fragmen molekul .
Chaviara et al pada tahun 2005 mensintesis jenis baru dari senyawa kompleks tipe [Cu(dien)(2a-2tzn)Y(2)] and [Cu(dienXX)(2a-2tzn)Y(2)] dan struktur senyawa tersebut diidentifikasi dengan IR dan elektronik spektra, magnetik suspensibiliti, dan konduktivitas molar. Atom bromin yang kedua berlaku sebagai suatu anion diskret dan bersifat responsif terhadap kation alam dari senyawa kompleks. Penelitian ini mengindikasikan bahwa senyawa tersebut dapat bekerja sebagai anti tumor.
2.10. Logam Seng
seng adalah bersifat lunak dan sangat reaktif misalnya bereaksi dengan asam encer menghasilkan ion dipositif, seperti pada reaksi berikut ini:
Zn (s) + 2 H3O+ (aq) Zn2+ (aq) + H2 (g) + 2 H2O (l)
Dan jika dipanaskan secara perlahan dalam gas klorin akan menghasilkan ZnCl2. Sumber utama logam seng adalah bijih seng sulfida, ZnS, namun cara memperoleh logam ini tidaklah mudah dimana menggunakan pemanggangan pada suhu 800oC kemudian mereduksi oksidanya dengan kokas berlebih pada suhu 1400oC. Reaksi pembuatan Zink murni yaitu:
ZnS(s) + 3O2(g) 2ZnO(s) + 2SO2(g)
ZnO(s) + C(s) Zn
(l) + CO(g) (Atkins, 1989)
Salah satu penggunaan logam seng adalah untuk perlindungan logam besi terhadap korosi. Besi dicelupkan kedalam seng cair atau dengan proses pelapisan elektrolisis. Meskipun begitu, seng akan tetap bereaksi dengan air. Dimana reaksi yang terjadi yaitu seng melindungi logam dari ion karbonat dan oksida.
Zn + H2O ZnO + H2
Secara komersial serbuk seng memiliki kemurnian 90% dan penambahan asam untuk menghilangkan oksida dipermukaan yang mengurangi keaktifannya. Seng ini diaktifkan dengan pengadukan dengan asam klorida selama 2 menit, disaring dan dicuci dengan air dan diikuti aseton (Vogel, 1989).
2.11. Korosi
Korosi adalah proses kerusakan/degradasi pada material akibat berinteraksi dengan lingkungannya. Terkorosinya suatu logam dalam lingkungan elektrolit (air) adalah suatu proses elektrokimia. Proses ini terjadi bila ada reaksi setengah sel yang melepaskan elektron (reaksi oksidasi pada anodik) dan reaksi setengah sel yang menerima elektron tersebut (reaksi reduksi pada katodik). Kedua reaksi ini akan terus berlangsung sampai terjadi kesetimbangan dinamis dimana jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima. Suatu logam yang dicelupkan pada suatu larutan elektrolit, maka akan terbentuk dua lokasi yang disebut anoda dan katoda. Pada anoda terjadi reaksi oksidasi dan pada katoda terjadi reaksi reduksi seperti dinyatakan dalam persamaan di bawah ini. Pada anoda, tempat terjadinya reaksi oksidasi dan biasanya terkorosi
M → Mz+ + ze- (1)
Pada katoda, tempat terjadinya reaksi reduksi dan tidak mengalami korosi. Dua reaksi penting yang umum terjadi pada katoda, tergantung pH larutan bersangkutan, adalah:
pH < 7 : 2H+ + 2e-→H2 (2)
Salah satu logam yang sering mengalami korosi yaitu logam besi (Fe). Reaksi yang terjadi yaitu :
Anoda :
Katoda : Fe(s)
O2(g) + 4 H+
(aq) + 4 e
-Fe2+(aq) + 2e
-2 H2O (l)
2 Fe + O2(g) + 4 H+(aq) 2 H
2O(l) + 2 Fe2+(aq)
x 2
Ion Fe2+ umumnya membentuk FeO kemudian mengalami oksidasi lanjut menjadi Fe2O3 dan menyerap air menjadi Fe2O3.xH2O (Adriana et al, 2000 dan Firmansyah, 2011)
Faktor-faktor yang menyebabkan korosi dibagi menjadi 2 jenis yaitu: a. Faktor internal
Faktor yang menyebabkan korosi berasal dari struktur bahan itu sendiri. Faktor dari bahan meliputi kemurnian bahan, struktur bahan, bentuk kristal, unsur-unsur yang ada dalam bahan, teknik pencampuran bahan dan sebagainya.
b. Faktor eksternal
Faktor yang menyebabkan korosi berasal dari lingkungan. Faktor ini meliputi pencemaran udara, suhu, kelembaban, keberadaan zat kimia bersifat korosif dan sebagainya (Akhadi, 2000)
2.11.1.Pencegahan Korosi
Pencegahan korosi dapat dilakukan dengan beberapa cara, yaitu: 1. Pelapisan/Coating
2. Aliasi logam
Aliasi logam dibuat dengan cara mencampurkan suatu logam dengan logam yang lain. Unsur yang biasa ditambahkan dalam pencampuran logam adalah krom (Cr). Aliasi logam ini bertujuan agar mutu suatu logam akan meningkat (Djaprie, 1995).
3. Proteksi katodik
Proteksi katodik dilakukan dengan membuat suatu sel elektrokimia yang bersifat katodik dengan cara menghubungkan logam yang mempunyai potensial tinggi sebagai katoda (logam yang ingin diproteksi) ke struktur logam yang berpotensial rendah sebagai anoda (terkorosi) (Fahrurrozie, 2009).
4. Penambahan inhibitor
Inhibitor adalah senyawa tertentu yang ditambahkan pada larutan elektrolit untuk mengurangi korosi logam. Inhibitor terdiri dari anion atom-ganda yang dapat masuk ke permukaan logam, dengan demikian dapat menghasilkan selaput lapisan tunggal yang kaya oksigen (Djaprie, 1995).
2.11.2. Inhibitor korosi
Cara inhibitor mereduksi laju korosi adalah sebagai berikut: a) Memodifikasi polarisasi katodik dan anodik (Slope Tafel) b) Mengurangi pergerakan ion ke permukaan logam
c) Menambah hambatan listrik dipermukaan logam
d) Menangkap atau menjebak zat korosif dalam larutan melalui pembentukan senyawa yang tidak agresif.
Mekanisme kerja inhibitor dapat dibedakan sebagai berikut :
1. Inhibitor teradsorpsi pada permukaan logam, dan membentuk suatu lapisan tipis dengan ketebalan beberapa molekul inhibitor. Lapisan ini tidak dapat dilihat oleh mata biasa, namun dapat menghambat penyerangan lingkungan terhadap logamnya.
2. Melalui pengaruh lingkungan (misal pH) menyebabkan inhibitor dapat mengendap dan selanjutnya teradsopsi pada permukaan logam serta melidunginya terhadap korosi. Endapan yang terjadi cukup banyak, sehingga lapisan yang terjadi dapat teramati oleh mata.
3. Inhibitor lebih dulu mengkorosi logamnya, dan menghasilkan suatu zat kimia yang kemudian melalui peristiwa adsorpsi dari produk korosi tersebut membentuk suatu lapisan pasif pada permukaan logam.
4. Inhibitor menghilangkan konstituen yang agresif dari lingkungannya (Tredhwey, Chamberlain,1991).
2.11.3.Teknik Penentuan Efisiensi Inhibitor
Ada beberapa cara untuk menguji atau mengevaluasi efisiensi suatu
inhibitor adalah dengan teknik kehilangan berat, teknik gasometrik, teknik elektrokimia, spektroskopi impedansi elektrokimia, dan pengukuran polarisasi.
1. Teknik Kehilangan Berat
Keterangan:
EI = efisiensi inhibitor
W0 = berat kehilangan tanpa inhibitor
W1 = berat kehilangan menggunakan inhibitor
2. Teknik Gasometri
Untuk penentuan efisiensi inhibitor dengan teknik ini didasarkan pada volume gas hidrogen yang dibebaskan, dimana dihitung dengan cara berikut ini.
Keterangan:
VB = volume gas hidrogen yang bertambah didalam tidak adanya inhibitor
VI = volume gas hidrogen yang bertambah didalam adanya inhibitor
3. Teknik elektrokimia
Pengukuran efisiensi inhibitor dengan teknik ini menggunakan suatu anoda dan katoda pada permukaan suatu logam, dimana pengaruh inhibitor akan mereduksi arus.
4. Spektroskopi impedansi elektrokimia
Pada teknik ini dilakukan dengan bantuan komputer dengan mengukur perpindahan muatan resistansi pada logam.
Keterangan:
Rt(inh) = perpindahan muatan resistansi dengan adanya inhibitor
Rt(blank) = perpindahan muatan resistansi tanpa adanya inhibitor (Chitra et al, 2010)
EI (%) =
W0 - W1
W0
x 100 %
EI (%) =
VB - VI VB
x 100
EI (%) = Rt(inh) - Rt(blank) Rt(inh)