BAB 2. TINJAUAN PUSTAKA
2.1 MENINGIOMA
Pada abad 18 dan 19 meningioma hanya dapat terdiagnosa pada pasien bila pasien tersebut mengalami perubahan pada tulang tengkorak yang didekatnya, sehingga tampak pada inspeksi maupun palpasi. Hanya sedikit usaha pembedahan yang dilakukan untuk mengangkat lesi ini, dan hanya sedikit saja yang menguntungkan pasien. Dari 13 operasi yang dilakukan antara 1743 da 1896, 9 pasien mengalami kematian.
Pada 1894 John Cleland, seorang profesor anatomy di Glasgow menemukan bahwa dua tumor meningioma yang ditemukannya di ruang diseksi, berasal dari arachnoid dan bukan duramater. Pada 1915 pendapat ini kembali ditegaskan oleh Cushing dan Weed.
Tumor ini kemudian telah mendapatkan berbagai penamaan termasuk fungoid tumor, sarcoma, cylindroma, endothelioma, dan fibroma. Cushing mengajukan nama mengiothelioma sebagai usaha untuk menjelaskan tumor ini berdasarkan jaringan yang terlibat. Cushing berusaha untuk menghindarkan nama histologis karena pada saat tersebut komposisi tumor masih belum jelas, dia juga berusahan menghindarkan penggunaan nama berdasar letak anatomis karena tumor ini dapat terdapat pada daerah yang sangat bervariasi. Kemudian Cushing lebih memilih untuk menggunakan nama meningioma.
EPIDEMIOLOGI
PATOLOGI
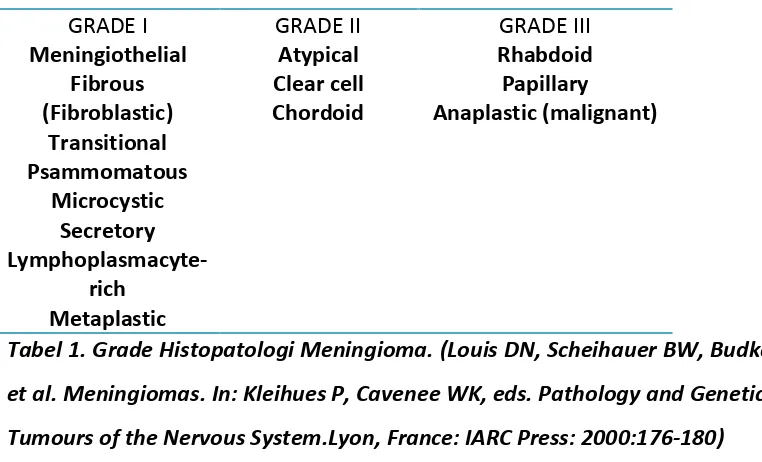
Pada tahun 2000 klasifikasi WHO dari tumor susunan saraf pusat (SSP) mengelompokkan meningioma ke dalam kelompok ‘tumours of the meninges’ dan lebih lanjut menyebutkannya sebagai ‘tumours of meningothelial cells’. WHO mengelompokkan meningioma menjadi 3 derajat histologi berdasarkan risiko rekurensi dan agresifitas pertumbuhan.
Meningioma biasanya berbentuk bulat, berkapsul. Tumor ini melekat pada duramater dan menekan otak dibawahnya tanpa menginvasinya. Walaupun meningioma sering menginvasi dura dan sinus, tumor ini biasanya dapat dengan mudah dipisahkan dari pia mater. Meningioma juga dapat berbentuk datar, membentuk seperti tulang yang mendasarinya. Tumor ini disebut sebagai en-plaque meningioma, yang lebih sering ditemuak pada tulang sphenoid. Meningioma jarang terjadi pada daerah dimana perlekatan dura tidak tampak, seperti intraventrikular atau intra parenkim.
Distribusi meningioma intrakranial adalah sebagai berikut: convexity (35%), para sagittal (20%), sphenoid ridge (20%), intraventricular (5%), tuberculum sellae (3%), infratentorial (13%), dan lain-lain (4%).
Pada gambaran struktur ultra yang tampak pada mikroskop elektron, meningioma memiliki gambaran yang menyerupai vili arachnoid normal: interdigitasi yang prominen dari membran plasma, filamen intermediate sitoplasma yang sangat banyak dan secara imunohistokimia konsisten dengan vimentin, dijumpainya hemidesmosome, dan deposit interselular fokal yang terdiri dari material granular yang kaya elektron. Arachnoid dan sel meningioma terhubung oleh epithelial cadhenrins (E-cadherins), yang merupakan molekul adhesi yang tergantung Ca2+, dan keduanya mengekspresikan gluotathione-independent prostaglandin D2 synthase.
GRADE MENINGIOMA
GRADE I GRADE II GRADE III
Meningiothelial Fibrous (Fibroblastic) Transitional Psammomatous Microcystic Secretory Lymphoplasmacyte-rich Metaplastic Atypical Clear cell Chordoid Rhabdoid Papillary Anaplastic (malignant)
Tabel 1. Grade Histopatologi Meningioma. (Louis DN, Scheihauer BW, Budka H, et al. Meningiomas. In: Kleihues P, Cavenee WK, eds. Pathology and Genetics of Tumours of the Nervous System.Lyon, France: IARC Press: 2000:176-180)
Secara mikroskopis, tumor ini menyerupai sel arachnoid normal. Dapat dijumpai whorls (bentuk kumparan), tetapi tidak prominen. Whorls yang termineralisasi, mengandung calcium apatite dan kolagen, disebut sebagai psammoma bodies (Psammos dalam bahasa Yunani memiliki pengertian ‘pasir’). Gambaran yang berbeda dari meningioma termasuk sisa sitoplasma yang menempati bagian dalam nukleus dan mengantikan chromatin inti. Ciri lain yang berguna adalah keberadaan Orphan Annie’s eye nuclei, yaitu nukleus yang berbentuk seperti target dengan inti yang jernih dan pada tepinya dibatasi oleh chromatin.
Secara mikroskopis, meningioma fibroblastic menunjukkan gambaran sel spindel yang memanjang dan tersusun berlapis-lapis. Stroma terdiri dari serat reticulin dan kolagen. Meningioma transitional merupakan kombinasi tipe meningothelial dan fibroblastic. Tipe ini memiliki ciri kumparan selular, yang dipisahkan oleh sel spindel yang memanjang. Variasi pada histologi meningioma dapat menunjukkan mutasi pada lokus genetik yang berbeda, dimana loss of heterozytosity pada kromosom 22 lebih umum dijumpai pada tipe fibroblastic dibanding varian meningothelial.
myxoid (myxomatous), osteoblastic, chondroblastic, secretory, melanotic, lymphofollicular, chordoid, hemangiopericytic, oncocytic, dan papillary. Tidak semua istilah untuk varian ini digunakan pada saat ini.
Meningioma atypical berhubungan dengan angka rekurensi yang lebih tinggi dan pertumbuhan yang lebih agresif. Kriteria yang digunakan untuk mendiagnosa meningioma atipikal tidak tergantung pada subtipe meningioma. Meningioma atipikal menunjukkan gambaran peningkatan aktifitas mitosis atau tiga atau lebih gambaran berikut: peningkatan selularitas, sel kecil dengan rasio nukleus dan sitoplasma yang tinggi, nukleoli yang prominen, pertumbuhan yang tak berpola atau sheetlike growth, dan fokus nekrosis. Untuk varian ini, peningkatan aktifitas mitosis telah dideskripsikan sebagai empat atau lebih mitosis per 10 kali pembesaran kuat (high power field).
Definisi pasti dari meningioma maligna dan anaplastik masih menjadi perdebatan. Satu ciri khusus yang tidak diragukan lagi menjadi ciri meningioma maligna adalah: metastasis ekstraneural jauh. Tempat tersering yang menjadi metastase meningioma adalah liver, paru, pleura, dan lymph nodes.
Pemeriksaan epithelial membrane antigen (EMA) adalah positif pada 80% meningioma. Hasil pewarnaan S-100 adalah cukup bervariasi. Meningioma juga mengekspresikan marker untuk fibroblasts (vimentin) dan sel epitel (EMA dan cytokeratins). Antileu7, merupakan antibody yang ditemuaka pada schwannoma, tidak ditemukan pada meningioma. Glial fibrillary acidic protein (GFAP) juga negatif pada meningioma. Meningioma meningothelial dan syncytial mengekspresikan E-cadherin.
RADIOLOGI
struktur tulang atau pun dura. Manifestasi perubahan tulang yang sering dijumpai adalah hyperostosis. Sekitar 15% meningioma benigna memiliki gambaran yang tidak khas, termasuk nekrosis sentral atau dijumpainya kavitasi kista (cystic meningioma). Edema peritumoral yang mengelilingi meningioma bervariasi. Dura mater yang melekat dapat menunjukkan penyangatan kontras, temuan ini dikenal sebagai dural tail.
Pada T1WI MRI, 60% meningioma adalah isointense dan 30% lainnya sedikit hypointense dibandingkan dengan gray matter. Pada T2WI, tumor menunjukkan gambaran isointense (50%) atau sedikit hyperintentse (40%). Gambaran hyperintense pada T2WI mengindikasikan tingginya kandungan air,
sering dijumpai pada meningioma meningothelial, vaskular, atau yang agresif.
TERAPI PEMBEDAHAN DAN REKURENSI TUMOR
Terapi definitif satu-satunya untuk meningioma adalah reseksi bedah total. Semakin sedikit tumor yang tersisa, akan memberikan kesempatan rekurensi tumor yang lebih kecil. Pada 1957 Simpson memperkenalkan lima tingkatan klasifikasi untuk reseksi bedah pada meningioma.
Simpson Grading System
GRADE DESCRIPTION 10 Years
Recurrence I Macroscopically complete tumor remofal with excision of the
tumor’s dural attachment and any abnormal bone
9 %
II Macroscopically complete tumor removal with coagulation of its dural attachment
19%
III Macroscopicallay complete removal of the intradural tumor without resection of coagulation of its dural attachment or extradural extension
29%
IV Subtotal removal of the tumor 40%
V Simple decompression of the tumor
Rekurensi untuk grade I adalah sekitar 10%; tumor dengan grade II memiliki angka rekurensi dua kali lebih tinggi. Angka rekurensi tumor jauh lebih tinggi sesuai dengan Simpson grade. Reseksi tumor yang menyertakan reseksi tambahan pada dura mater sejauh 2 cm dikenal sebagai grade 0. Pada satu studi disebutkan bahwa tidak dijumpai rekurensi pada pasien yang mendapatkan reseksi dengan Simpson grade 0.
THE P53 NETWORK– APOPTOSIS
Paparan terhadap stress selular dapat memicu protein tumor supressor p53 untuk menginduksi fase istirahat siklus sel atau apoptosis. Respon yang terjadi dipengaruhi oleh banyak faktor, termasuk jenis sel dan stress selular, dan pengaruh co-activator dari p53. p53 menstimulasi sinyal selular yang secara luas bertindak melalui dua pathway apoptosis utama. Pada extrinsic pathway, death receptor memicu aktivasi cascade caspase. Intrinsic pathway, melibatkan mitokondria dan perubahan keseimbangan famili Bcl-2 menjadi pro apoptosis, sehingga memicu pembentukan apoptosome, dan sebagai akibatnya apoptosis yang diperantarai oleh caspase.Dampak dari kedua pathway apoptosis ini dapat diperkuat pada saat kedua pathway bertemu melalui Bid, yang merupakan target p53. Kebanyakan efek apoptosis diperantari oleh induksi dari gen target apoptosis spesifik. Walau demikian, p53 dapat juga memicu apoptosis dengan mekanisme yang diperantarai oleh transkripsi pada keadaan tertentu. (Haupt, 2003).
Pencegahan pembentukan kanker melibatkan mekanisme yang tergantung protein tumor supressor p53. Kemampuan p53 untuk mengeliminasi dampak yang berlebih dari sel yang rusak atau terinfeksi sangat vital terhadap regulasi proliferasi sel yang baik pada organisme multiselular. (Huang dan Strasser,2000).
fungsi supresi tumor. Kemampuan menginhibisi pertumbuhan sel akan mencegah proliferasi sel yang mengalami kerusakan DNA dengan potensi transformasi neoplastik. Sebagai tambahan, p53 berperan dalam berbagai proses selular seperti diferensiasi, perbaikan DNA dan angiogenesis, yang juga penting untuk supresi tumor (Vogt dan Haupt,1999).
Sebagai protein kunci dalam respon selular terhadap stress, p53 berperan sebagai penghambat utama tumorigenesis. Fungsi p53 harus dihilangkan untuk memungkinkan pertumbuhan tumor. Hampir 50% kanker pada manusia mengalami mutasi pada gen p53; dan pada sisanya terjadi modifikasi aktifitas p53 melalui mekanisme alternatif (Vogelstein et al.,2000)
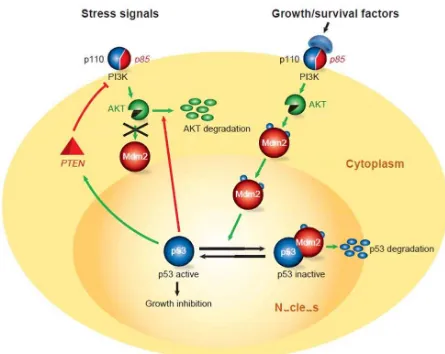
Mekanisme ini antara lain melibatkan peningkatan ekspresi kadar inhibitor p53 seperti Mdm2 atau protein E6 dari HPV, atau inhibisi terhadap co-activator kunci p53, seperti ARF (Vogelstein et al.,2000; Vogt Sionov et al., 2001). Dalam keadaan normal, p53 merupakan protein yang memiliki masa aktif singkat. Inhibitor p53 Mdm2 (Hdm2 pada manusia) secara umum memiliki peran untuk mengakibatkan p53 menjadi kembali inaktif. Mdm2 menghambat aktifitas transkripsi p53, dan lebih penting lagi, memicu degradasi p53 dengan proteasome. Walau demikian status p53 secara drastis berubah pada saat sel terpapar terhadap stress, termasuk kerusakan DNA, ekspresi onkogen, hipoksia, dan deplesi nukleotida (Giaccia dan Kastan,1998).
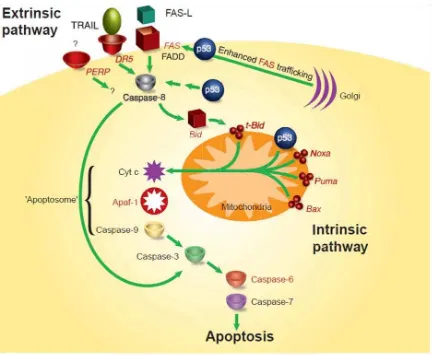
Gambar 1. Sebuah model apoptosis yang diperantarai oleh p53. Model ini mewakili keterlibataan p53 dalam pathway apoptosis intrinsik dan ekstrinsik. Gen target p53 ditunjukkan dalam warna merah. Pertemuan kedua pathway melalui Bid nampak pada gambar. (Haupt S, Berger M, Goldberg Z, Haupt Y. Apoptosis – the p53 network. Journal of Cell Science 2003:116, 4077-4085)
Extrinsic pathway dan Intrinsic pathway dari apoptosis.
Intrinsic pathway dipicu sebagai respon terhadap kerusakan DNA dan berhubungan dengan depolarisasi mitokondria dan pelepasan sitokrom c dari intermembrane space dari mitokondria ke dalam sitoplasma. Sitokrom c, apoptotic protease-activating factor 1 (APAF-1) dan procaspase-9 dan kemudian membentuk kompleks yang disebut apoptosisem, dimana caspase-9 diaktivasi dan memicu aktivasi caspase-3, caspase-6 dan caspase-7 (Nicholson dan Thornberry,2003).
Studi terbaru menyebutkan bahwa intrinsic pathway dan extrinsic pathway merupakan jalur yang berhubungan (Gross et al.,1999; Li et al., 1998).
The extrinsic pathway
p53 dapat mengaktifasi extrinsic pathway dari apoptosis melalui induksi gen yang mengkode tiga protein transmembran: Fas, DR5 dan PERP. Reseptor permukaan sel Fas (CD95/Apo-1), anggota dari keluarga reseptor TNF-R, merupakan komponen kunci kematian sel pada extrinsic pathway (Nagata dan Golstein,1995). Fas diaktifkan oleh ikatannya dengan ligan Fas, FasL, yang secara predominan diekspresikan oleh sel T (Muzio,1998).
P53 menginduksi mRNA Fas dengan berikatan pada elemen yang ditemukan pada promoter dan intron pertama dan gen Fas (Muller et al.,1998). Induksi Fas mRNA yang tergantung p53 telah dijumpai pada limpa, timus, ginjal dan paru, tetapi tidak dijumpai pada jantung dan liver (Bouvard et al., 2000). Walau demikian, paling tidak pada limfosit, Fas tampaknya dapat digantikan pada apoptosis yang tergantung p53 (Fuchs et al., 1997; O’Connor et al.,2000). Peranan Fas sebgai target p53 pada tipe sel lain masih sedang diteliti.
Gen apoptosis lain, PERP, diinduksi dalam MEF (Mouse Embryo Fibroblast) sebagai respon terhadap kerusakan DNA pada sel yang ditransduksi oleh baik E2F-1 ataupun dengan protein E1A adenovirus. Bagaimana mekanisme kontribusi PERP belum diketahui dengan jelas, namun diduga PERP mungkin bersama dengan E2F-1 menginduksi apoptosis (Attardi et al., 2000)
The intrinsic pathway
Intrinsic pathway dari apoptosis didominasi oleh keluarga protein Bcl-2, yang mengatur pelepasan sitokrom c dari mitokondria (Cory dan Adam,2002; Kuwana et al., 2002). Keluarga Bcl-2 terdiri dari kelompok anti-apoptotic (prosurvival) dan pro-apoptotic. Klasifikasi ini dibagi berdasarkan kemiripan struktur dengan domain homolog Bcl-2 (BH: Bcl-2 homology) yaitu BH1, BH2, BH3 dan BH4, dan domain transmembran. Domain BH3, yang dijumpai pada semua anggota keluarga Bcl-2 dan diperlukan untuk heterodimeriasis di antara keluarga Bcl-2, merupakan domain minimum yang dibutuhkan untuk fungsi proapoptosis (Kelekar dan Thompson,1998; Yu et al., 2001).
Keluarga Bcl-2 dapat dibagi menjadi tiga kelas: protein prosurvival, yang memiliki struktur paling mirip dengan Bcl-2, seperti Bcl-XL; protein pro-apoptosis, Bax dan Bak, yang secara struktur mirip dengan Bcl-2 tetapi memiliki fungsi antagonis terhadap fungsi pro-survival; dan ‘BH3-only’ protein (Bouillet dan Strasser, 2002).
Sebagai tambahan, pada epitel kolon, Bax nampaknya tidak esensial terhadap kejadian apoptosis yang dipicu oleh radiasi (Pritchard et al.,1999). Studi telah mengindikasikan bahwa Bax nampaknya tidak menentukan nasib sel. Penjelasan yang menarik mengenai peranan Bax pada induksi apoptosis mungkin dapat ditawarkan oleh konteks PUMA. Gen PUMA juga secara langsung diinduksi oleh p53 sebagai respon terhadap kerusakan DNA, melalui elemen respon p53 pada intron pertama dari PUMA. Pada manusia, PUMA mengkode protein yang mengandung domain BH3, PUMA-α dan PUMA-β (Nakano dan Vousden,2001; Yu et al., 2001).
Keseimbangan vital antara PUMA dan p21 telah diidentifikasi dapat menentukan onset berhentinya siklus sel atau kematian sel, sebagai respon terhadap ekspresi p53 eksogen dn juga hipoksia pada sel kanker kolorektal pada manusia. Penghentian pertumbuhan sel melalui aktivasi p21 merupakan respon normal terhadap ekspresi p53 pada sel. Jika p21 terganggu, sel akan mengalami kematian tanpa proses apoptosis; namun jika PUMA terganggu, maka apoptosis akan dicegah. Bax diperlukan secara mutlak untuk apoptosis yang diperantarai PUMA. Ekspresi PUMA memicu translokasi mitokondria dan multimerization dari Bax, dan terkumpul pada induksi apoptosis (Yu et al., 2003).
Survival signals: AKT pathway
Ikatan mitogen dan sitokin pada reseptor di permukaan sel mencakup reseptor insulin, epidermal growth factor receptor (EGFR) dan platelet derived growth factor receptor (PDGFR), dan onkogen seperti Ras dan Her2/neu, ditransduksi oleh sinyal pathway yang diaktifkan oleh phospoinositide 3-kinase (PI3K) yang memicu proliferasi sel dan daya tahannya. PI3K mempengaruhi subunit regulator p85, yang berinteraksi dengan reseptor eyrosine kines yang terfosforilasi.
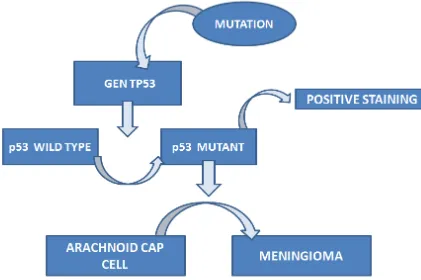
IMUNOHISTOKIMIA P53 PADA MENINGIOMA
Berbagai faktor memiliki peranan dalam progresifitas tumor dan salah satunya adalah mutasi tumor supressor gene. Produk gen p53 wild type berfungsi sebagai faktor transkripsi dan terlibat dalam regulasi perbaikan DNA dari siklus sel dan induksi apoptosis. p53 yang mengalami mutasi tidak lagi memiliki kemampuan tersebut sehingga menjadi sering menjadi target abnormalitas tumor pada kebanyakan tumor. Mutasi dari gen p53 mengakibatkan protein yang secara abnormal stabil dan akan berakumulasi dalam inti sel dan mencapai kadar dimana protein ini dapat dengan mudah dideteksi dengan pewarnaan immunohistokimia (Barbareschi et al.,1992). Oleh karena itu ekspresi dari protein p53 menjadi indikator kemungkinan terjadinya mutasi dari gen p53 itu sendiri. Studi-studi terkini dilakukan untuk menilai perilaku biologi meningioma dengan mengevaluasi indeks proliferasi dan ekspresi antigen p53 dan menghubungkannya dengan derajat histologi dan perjalanan klinis (Torp et al.,2009).
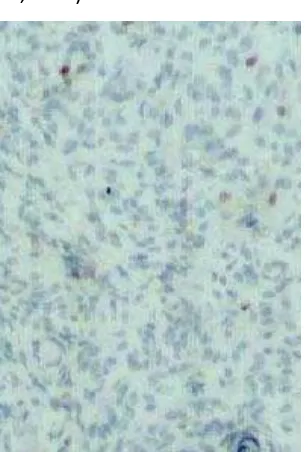
Gambar 3. Beberapa sel tumor meningioma yang menunjukkan pewarnaan p53 positif (p53 immunostain, 3100); (Rao S, Sadiya N, Doraiswami S, Prathiba D. Characterization of morphologically benign biologically aggressive
PERAN ‘P53 PATHWAY’ DALAM PATOLOGI MENINGIOMA
TP53, gen yang mengkode protein p53, memperantrai pathway tumor supression utama dari sel. Sejak dilaporkan pertama kali pada 1989 (Baker,1989), mutasi p53 telah ditemukan hampir pada setengah kasus keganasan pada manusia (Levine,1997; Hollstein,1994). Walaupun pathway p53 telah dikenal baik dalam patogenesis kanker, peranannya dalam meningioma masih kontroversial. Beberapa studi menunjukkan pathway p53 tidaklah penting dalam etiologi meningioma seperti tidak dijumpainya mutasi TP53 pada meningioma (Das,2005), kurangya ekspresi abnormal dari p53 atau Mdm2 pada sel meningioma (Pykett,1997), dan kemiripan ekspresi p53 pada meningioma orbita dari berbagai derajat histologi yang berbeda (Hei,2006).
Sementara studi lain menyimpulkan adanya keterlibatan pathway p53 dalam perkembangan meninigoma; dimana dijumpai korelasi antara protein p53 dengan derajat tumor pada meningioma dan rekurensi meningioma (Ohkoudo,1998), hilangnya protein Mdm2 yang dapat terdeteksi (Amatya,2004), dan terdapatnya gangguan respon p53 terhadap stress sinar gamma pada sel meningioma (Al-Khalaf,2007)
Sebagai tambahan, produk protein NF2 dilaporkan meningkatkan stabilitas p53 melalui proses downregulation level Mdm2 pada fibroblast tikus (Kim,2004). Hilangnya NF2 dapat meningkatkan kecenderungan supresi p53, dan oleh karena itu menurunkan aktifitas supresi tumor dan mungkin dapat menunjukkan mekanisme keterlibatan pathway p53 dalam meningioma. Chang menduga bahwa faktor genetik yang mempengaruhi aktifitas pathway p53 mungkin bertanggung jawab terhadap pathogenesis meningioma. (Chang,2009)
metastase (Laurie,2006; Ku,2007). Berbeda dengan p53, Mdm2 merupakan protein yang penting untuk fungsi supresi tumor dari p53. Monoubiquitylation yang diperantarai Mdm2 telah terbukti diperlukan untuk translokasi p53 dari inti sel ke mitokondria, dimana p53 menginduksi apoptosis pada sel yang mengalami stress (Erster,2004; Marchenko,2007).
Prolimorfisme p53 pada codon 72 menjadi proline mengubah potensi apoptosis sel melalui interaksi yang berbeda dengan Mdm2. Allele Arg72 ditemukan meningkatkan interaksi dengan Mdm2, sehingga meningkatkan shuttling pada mitokondria induksi apoptosis yang tergantung transkripsi