BAB 2
TINJAUAN PUSTAKA
2.1 Air Gambut
Tanah gambut adalah tanah-tanah jenuh air yang tersusun dari bahan tanah organik, yaitu sisa-sisa tanaman dan jaringan tanaman yang melapuk dengan ketebalan lebih dari 50 cm. Dalam sistem klasifikasi baru (taksonomi tanah) tanah gambut disebut histosols. Dalam sistem klasifikasi lama, tanah gambut disebut dengan organosols yaitu tanah yang tersusun dari bahan tanah organik. (Soil Survery Staff 1998).
Gambut adalah sisa timbunan tumbuhan yang telah mati dan kemudian diuraikan oleh bakteri anaerob dan aerob menjadi komponen yang lebih stabil. Selain zat organik yang membentuk gambut terdapat juga zat anorganik dalam jumlah yang kecil. Di lingkungan pengendapannya gambut ini selalu dalam keadaan jenuh air (lebih dari 90 %) (Sukandarrumidi,1995).
Air gambut adalah air permukaan yang banyak terdapat di daerah berawa atau dataran rendah terutama di Sumatera dan Kalimantan, yang mempunyai ciri-ciri sebagai berikut :
3. Kandungan zat organic yang tinggi Kekeruhan dan kandungan partikel tersuspensi yang rendah.Warna coklat kemerahan pada air gambut merupakan akibat dari
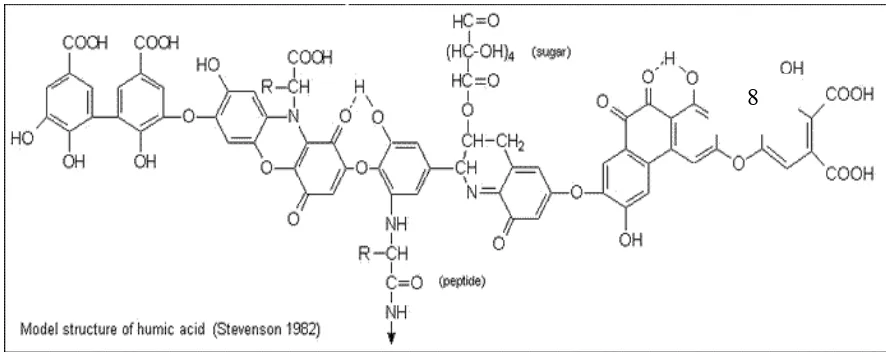
tingginya kandungan zat organik (bahan humus) terlarut terutama dalam bentuk asam humus dan turunannya. Asam humus tersebut berasal dari dekomposisi bahan organik seperti daun pohon atau kayu (Kusnaedi,2006).
8
Gambar 2.1 Model Struktur Asam Humus (Stevenson 1982)
Adanya ion besi menyebabkan air berwarna kemerahan, sedangkan oksida mangan menyebabkan air berwarna kecoklatan atau kehitaman.
Humus terdiri dari 2 senyawa utama yaitu substansi non humus (missal lipid, asam amino, karbohidrat) dan substansi humus (merupakan senyawa amorf dengan berat molekul tinggi, warna coklat sampai hitam). Substansi humus dibedakan menjadi :
asam seperti fenolik dan karboksilik, aktif dalam reaksi kimia, berat molekul ( BM 20.000-1.360.000).
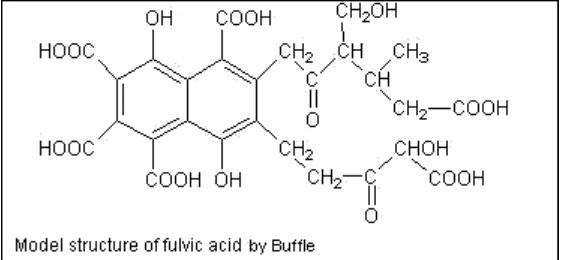
2. Fulvic acid (Asam Fulfat); dapat diekstraksi dengan basa kuat, gugus fungsional asam, larut juga dalam asam ,mengandung gugus fungsional basa, aktif dalam reaksi kimia BM 275-2110.
3. Humin; tidak larut asam dan basa, BM terbesar, tidak aktif, warna paling gelap.
Gambar 2.2. Model Struktur Asam Fulvat (Buffle 1977)
2.2 Warna
2.2.1 Pengertian Zat Warna
Warna merupakan akibat suatu bahan terlarut atau tersuspensi dalam air, disamping adanya bahan pewarna tertentu yang kemungkinan mengandung logam berat. Warna air limbah menunjukkan kualitasnya, air limbah yang baru akan berwarna abu-abu, dan air limbah yang sudah basi atau busuk akan berwarna gelap (Mahida, 1984). Warna tertentu dapat menunjukkan adanya logam berat yang terkandung dalam air buangan.
Yang dimaksud zat warna adalah senyawa yang dapat dipergunakan dalam bentuk larutan, sehingga penampanya berwarna. Warna air limbah dapat dibedakan menjadi dua, yaitu warna sejati dan warna semu. Warna yang disebabkan oleh warna organik yang mudah larut dan beberapa ion logam disebut warna sejati, jika air tersebut mengandung kekeruhan atau adanya bahan tersuspensi dan juga oleh penyebab warna sejati, maka warna tersebut dikatakan warna semu (Chatib, 1998). Dan juga karena adanya bahan-bahan yang tersuspensi yang termasuk bersifat koloid. Berdasarkan studi yang dilakukan oleh Black dan Cristman (1979) ditemukan bahwa organik di dalam air limbah adalah koloid yang bermuatan negatif.
senyawa aromatik yang berisi Crhomopore, yaitu zat pemberi warna yang berasal dari radikal kimia, seperti kelompok azo (N=N). Agar warna dapat masuk dengan baik ke kedalam bahan yang akan diberi warna, maka diperlukan bahan dari Auxochrome, yaitu radikal yang memudahkan terjadinya pelarutan, misalnya kelompok pembentuk garam –NH atau OH (Wardhana, 1995).
Kecerahan dipengaruhi oleh warna air, semakin dalam penetrasi sinar matahari dapat menembus lapisan air, semakin produktif pula perairan tersebut. Hal ini seiring dengan banyaknya fitoplankton di perairan tersebut. Kekeruhan ialah suatu istilah yang digunakan untuk menyatakan derajat kegelapan di dalam air yang disebabkan oleh bahan-bahan yang melayang. Kekeruhan sangat berhubungan erat dengan warna perairan, sedangkan konsentrasinya sangat mempengaruhi kecerahan dengan cara membatasi transmisi sinar matahari kedalamnya.
Akibat biologis dari kekeruhan adalah menurunnya aktifitas fotosintesa tumbuhan, karena, fotosintesis secara langsung tergantung pada cahaya. Kekeruhan merupakan salah satu faktor penting yang menyangkut produktifitas perairan, serta aliran energi.
lebih dari 10 warna. Hal ini penting mengingat zat-zat warna banyak mengandung logam-logam berat yang bersifat toksis.Dismping bersifat toksis, fotosintesis juga terhambat di perairan yang mengandung 50 warna.
2.2.2 Penggolongan Zat Warna Jenis zat warna ada dua, yaitu:
a. Zat Warna Alam
Zat warna alam adalah zat warna yang berasal dari alam, baik yang berasal dari
tanaman, hewan, maupun bahan metal. Tumbuhan-tumbuhan penghasil zat pewarna
alami yang tumbuh di Indonesia kurang lebih sebanyak 150 jenis tanaman, tetapi yang
paling efektif untuk dapat digunakan menjadi powder maupun dalam bentuk pasta hanya
beberapa jenis saja.
Zat warna dari tumbuhan yang biasanya digunakan antara lain: indigofer
(warnabiru), Sp Bixa orrellana (warna orange purple), Morinda citrifolia (warna kuning).
b. Zat warna yang berasal dari hewan
Jenis hewan yang biasa dijadikan zat warna antara lain: Kerang (Tyran purple),
Insekta (Ceochikal), dan Insekta warna merah .
Karena air gambut merupakan air berwarna alami maka salah satu proses
pengolahannya dapat dilakukan dengan adsorpsi atau penyerapan.Adsorpsi adalah proses
penyerapan pada permukaan partikel koloid oleh adanya gaya adhesi zat-zat lain.Daya
adsorpsi koloid sangat besar karena permukaan zat padat dengan jumlah yang
diadsorpsi tertarik pada permukaan fase padat yang bertindak sebagai adsorben.
Ditinjau dari segi derajat adsorpsi dari suatu jenis adsorban pada umumnya mengikuti
aturan sebagai berikut :
1. Adsorpsi berlangsung sedikit terhadap semua senyawa organic,kecuali senyawa
halogen.
2. Adsorpsi berlangsung baik terhadap semua senyawa halogen dan senyawa alifatik.
3. Adsorpsi berlangsung sangat baik terhadap semua senyawa aromatic.
4. Makin banyak kandungan inti benzennya semakin baik adsorpsinya.
Berdasarkan kriteria tersebut maka pengolahan air berwarna(air gambut) dapat
dilakukan dengan proses adsorpsi, karena asam humus merupakan senyawa yang
mengandung gugus aromatic. (Fitria, 2008).
2.3 Mangan (Mn)
Logam Mangan adalah unsur kimia dalam tabel periodik yang memilki lambang Mn dan nomor atom 25, berwarna silver metalik, keras dan sangat rapuh. Logam mangan memiliki energi ionisasi 7,21 g/cm3, titik leburnya sekitar 1) 1246 717, 3KJ/mol, 2)1509 KJ/mol, 3) 3248 KJ/mol. Logam mangan memiliki jari-jari atom 1,35 Ao,logam ini bersifat paramagnetik.
2.3.1 Fungsi Mangan.
Fun gsi utam a dalam tubuh : Kom pon en en zim
Pengambilan mangan oleh manusia terutama terjadi melalui makanan, seperti bayam, teh dan rempah-rempah. Bahan makanan yang mengandung konsentrasi tertinggi adalah biji-bijian dan beras, kacang kedelai, telur, kacang-kacangan, minyak zaitun, kacang hijau dan tiram. Setelah penyerapan dalam tubuh manusia mangan akan diangkut melalui darah ke hati, ginjal, pankreas dan kelenjar endokrin.
2.3.3 Kebutuhan dan sumber Mangan (Mn).
Sum ber m akan an utam a :Gan dum , buah-buahan yg dikerin gkan .
Kebutuhan H arian Dewasa :Dibutuhkan 3,5 m iligram
2.3.4 Akibat defisiensi Mangan .
Kekuran gan m an gan pada m an usia dapat m en yebabkan Pen urun an
berat badan , iritasi kulit, m ual & m un tah, perubahan warn a ram but ,
pertum buhan ram but yan g lam bat.
2.3.5 Akibat Kelebihan Mangan.
Mangan (Mn) mampu menimbulkan keracunan kronis pada manusia hingga berdampak menimbulkan lemah pada kaki, otot muka kusam, dan dampak lanjutan bagi manusia yang keracunan Mn, bicaranya lambat dan hyperrefleks.
elemen penting bagi kesehatan manusia kekurangan mangan juga dapat menyebabkan efek kesehatan. Ini adalah efek berikut: 1). Kegemukan , 2). Gula,3). Pembekuan Darah,4). Masalah kulit,5). Menurunkan kadar kolesterol,6). Gangguan Skeleton ,7). Kelahiran cacat,8). Perubahan warna rambut,9). Gejala Neurological.
Mangan kronis dapat mengakibatkan keracunan dari lama menghirup debu dan asap. Sistem saraf pusat adalah situs utama kerusakan dari penyakit, yang dapat mengakibatkan cacat permanen. Gejala termasuk kelembekan, kantuk, kelemahan, gangguan emosi, gaya berjalan spastik, berulang kram kaki, dan kelumpuhan. Insiden tinggi pneumonia dan infeksi saluran pernapasan atas lainnya telah ditemukan pada pekerja yang terkena debu atau asap dari senyawa mangan.
2.4 Zinkum (Zn)
Zinkum (seng) adalah unsur kimia dengan lambang kimia Zn, nomor atom 30, dan massa atom relatif 65,39. Seng tidak diperoleh dengan bebas di alam, melainkan dalam bentuk terikat. Mineral yang mengandung seng di alam bebas antara lain kalamin, franklinit, smithsonit, willenit dan zinkit.
televisi dan lampu pendar, 6). seng dalam bentuk klorida digunakan untuk pengawetan kayu.
Dalam bahasa sehari-hari, seng juga dimaksudkan sebagai plat seng yang digunakan sebagai bahan bangunan. Seng telah diketahui sejak tahun 1934 sebagai elemen penting bagi kehidupan hewan (tikus) dan defisiensi seng pada manusia baru diketahui sekitar tahun 1961. Pada waktu itu diketahui adanya keterkaitan antara kekurangan seng dalam konsumsi sehari-hari dengan gangguan pertumbuhan dan kematangan seksual. Gangguan lainnya yang berkaitan dengan defisiensi seng, adanya hambatan penyembuhan luka, gangguan fungsi pengecap dan gangguan nafsu makan. Gejala ini berangsur-angsur hilang bila dalam menu sehari-hari diberikan makanan yang mengandung seng.
atau tannin . Sehingga potensi kekurangan zat seng ( Zn ) ini pada masyarakat Indonesia cukup tinggi karena penyerapan zat seng ( Zn ) akan terganggu.
2.4.1 Fungsi Zinkum( Zn )
Zinkum adalah mikromineral yang ada di mana-mana dalam jaringan manusia/hewan dan terlibat dalam fungsi berbagai enzim dalam proses metabolisme. Tubuh manusia dewasa mengandung 2 - 2,5 gram seng. Tiga perempat dari jumlah tersebut berada dalam tulang dan mobilisasinya sangat lambat. Dalam konsentrasi tinggi seng ditemukan juga pada iris, retina, hepar, pankreas, ginjal, kulit, otot, testis dan rambut, sehingga kekurangan seng berpengaruh pada jaringan-jaringan tersebut. Di dalam darah seng terutama terdapat dalam sel darah merah, sedikit ditemukan dalam sel darah putih, trombosit dan serum. Kira-kira 1/3 seng serum berikatan dengan albumin atau asam amino histidin dan sistein. Dalam 100 ml darah terdapat 900 ml seng dan dalam 100 ml plasma terdapat 90 – 130 mg seng.
hubungannya dengan insulin, walaupun tidak memegang peranan secara langsung terhadap aktivitas insulin.
2.4.2 Absorbsi dan Metabolisme
Proses absorbsi seng menyerupai absorbsi besi dalam tubuh, dimana untuk absorbsi membutuhkan alat angkut, proses ini terjadi dalam usus halus (duodenum), seng diangkut oleh albumin dan transferin masuk kealiran darah dan dibawa ke hati. Kelebihan seng disimpan dalam hati dalam bentuk metalotionein, lainnya dibawa ke pankreas dan jaringan tubuh yang lain. Di dalam pankreas seng digunakan untuk membuat enzim pencernaan, yang pada waktu makan dikeluarkan ke dalam saluran cerna. Dengan demikian saluran cerna menerima seng dari dua sumber, yaitu dari makanan dan dari cairan pencernaan yang berasal dari pankreas.
2.4.3 Kebutuhan dan Sumber Seng ( Zn )
Kebutuhan seng sangat bervariasi tergantung fisiologik, patologik, dan menu sehari-hari. Pada orang dewasa sehat, jumlah seng yang hilang melalui urin, feses, kulit, semen, rambut dan kuku adalah 2,6 mg/hari. Dengan asumsi bahwa daya serap usus terhadap seng hanya sekitar 25% dan adanya variasi individual, maka jumlah kecukupan seng yang dianjurkan adalah 15 mg/hari. Widya Karya Pangan dan Gizi tahun 1998 menetapkan angka kecukupan seng untuk Indonesia sebagai berikut:
a. Bayi : 3 – 5 mg. b. 1 – 9 tahun : 8 – 10 mg.
c. 10 - > 60 tahun : 15 mg ( baik pria maupun wanita ) d. Ibu hamil : + 5 mg
e. Ibu menyusui : + 10 mg
Komposisi Bahan Makanan yang dikeluarkan oleh Direktorat Gizi Depkes RI, namun bila dilihat dari pola menu masyarakat pada umumnya , diperkirakan kandungan seng ( Zn ) dalam makanan sehari-hari juga rendah. Apabila masukan makanan rendah seng tersebut berkurang, maka masukan seng ( Zn ) makin berkurang dan ada kemungkinan tidak mencukupi kebutuhan.
2.4.4 Akibat Defisiensi Seng ( Zn )
Kekurangan seng pertama dilaporkan pada tahun 1960-an, yaitu pada anak dan remaja laki-laki di Mesir, Iran, dan Turki dengan karakteristik tubuh pendek, dan keterlambatan pematangan seksual. Diduga penyebabnya makanan penduduk sedikit mengandung daging, ayam dan ikan yang merupakan sumber utama seng dan tinggi konsumsi serat dan fitat. Mengingat banyaknya enzim yang mengandung seng, maka pada keadaan defisiensi seng reaksi biokimia dimana enzim - seng berperan akan terganggu. Defisiensi seng dapat terjadi pada golongan rentan, yaitu anak-anak, ibu hamil dan menyusui serta orang tua. Manifestasi klinis defisiensi seng pada manusia, dapat terlihat sebagai berikut :
1. Kecepatan pertumbuhan menurun,
2. Nafsu makan dan masukan makanan menurun, 3. Lesiepitel lain seperti glositis, kebotakan, 4. Gangguan sistem kekebalan tubuh,
8. Perubahan tingkah laku,
9. Gangguan perkembangan fetus.
2.4.5 Akibat Kelebihan Seng ( Zn )
Kelebihan seng ( Zn ) hingga dua sampai tiga kali AKG menurunkan absorbsi tembaga. Kelebihan sampai sepuluh kali AKG mempengaruhi metabolisme kolesterol, mengubah nilai lipoprotein, dan tampaknya dapat mempercepat timbulnya aterosklerosis. Dosis konsumsi seng ( Zn ) sebanyak 2 gram atau lebih dapat menyebabkan muntah, diare, demam, kelelahan yang sangat, anemia, dan gangguan reproduksi. Suplemen seng ( Zn ) bisa menyebabkan keracunan, begitupun makanan yang asam dan disimpan dalam kaleng yang dilapisi seng ( Zn ) ( Almatsier, 2001 ).
2.5 Magnesium (Mg)
bentuk: fraksi yang berikatan dengan protein (25% berikatan dengan albumin dan 8% dengan globulin), fraksi khelasi (12%), dan fraksi ion yang aktif metabolik (Mg++: 55%). Kadar Mg dalam plasma orang sehat sangat konstan, dengan kisaran kadar serum total 0,75–0,96 mmol/L, dan rata-rata 0,85 mmol/L.
2.5.1 Fungsi magnesium.
Magnesium berperan penting dalam system enzim dalam tubuh. Magnesium berperan sebagai katalisator dalam reaksi biologic termasuk metabolisme energi, karbohidrat, lipid, protein dan asam nukleat, serta dalam sintesis, degradasi, dan stabilitas bahan gen DNA di dalam semua sel jaringan lunak.Di dalam sel ekstraselular, magnesium berperan dalam transmisi saraf, kontraksi otot dan pembekuan darah. Dalam hal ini magnesium berlawanan dengan kalsium.kerusakan gigi dengan cara menahan kalsium dalam email gigi. 2.5.2 Absorbsi dan Metabolisme.
2.5.3 Kebutuhan dan sumber magnesium
Kebutuhan m in eral m agnesium sekitar 30 0 – 40 0 m g setiap hari,
dim an a tin gkatan n ya berbeda tergan tun g pada jen is kelam in dan usia.
Kebutuhan dari m agnesium m en in gkat sehubun gan den gan um ur dan tin gkat
tekan an hidup. Magn esium m en gen dalikan kon traksi otot, m etabolism e
protein , dian tara tugas vital lain n ya. Sumber utama magnesium adalah sayur hijau, serealia tumbuk, biji-bijian dan kacang-kacangan. Daging, susu dan hasilnya serta cokelat merupakan sumber magnesium yang baik.
2.5.4 Akibat defisiensi magnesium
Diabetes militus mungkin merupakan penyakit yang tersering berkaitan dengan defisiensi Mg. Sampai 39 persen penderita diabetes rawat jalan telah dilaporkan hipomagnesemia. Pada ketoasidosis berat, Mg bisa terbuang ke dalam urin selama asidosis. Kadar Mg mungkin normal atau tinggi akibat deplesi volume; namun, terapi cairan dan insulin menghasilkan penurunan ke kisaran subnormal. Insulin telah ditunjukkan menyebabkan perpindahan Mg ke dalam jaringan lunak. Kekurangan insulin pada diabetes tipe 1 bisa mengakibatkan penurunan Mgintrasel.
Walaupun disimpulkan bahwa hipomagnesemia disebabkan oleh diabetes dan bukan kebalikannya, defisiensi Mg juga bisa mempengaruhi onset penyakit ini. Defisit Mg mengganggu reaksi enzimatik yang menggunakan atau memproduksi adenosine triphosphate (ATP), yang memodifikasi kaskad enzimatik pada metabolisme karbohidrat, sehingga memicu DM. Defisiensi Mg dapat menghasilkan kelainan dalam aktivitas tirosin-kinase pada reseptor insulin. Kejadian ini terkait dengan timbulnya resistensi insulin dan penurunan utilisasi
Gambar 2.3.Deplesi Magnesium Pada Penyakit Saluran Cerna.
Kandungan Mg dalam cairan saluran cerna atas adalah kira-kira 1 mEq/L. Muntah-muntah dan sedot lambung dapat memperberat deplesi Mg. Kandungan Mg pada cairan diare dan drainase fistula jauh lebih tinggi ( sampai 15 mEq/L).
Akibatnya, deplesi Mg banyak dijumpai pada diare akut dan kronik, enteritis regional, kolitis ulseratif, fistula usus dan empedu. Sindrom absorpsi yang disebabkan
nontropical sprue, trauma radiasi akibat terapi untuk penyakit seperti karsinoma serviks, dan limfangiektasi usus bisa mengakibatkan defisiensi Mg. Kondisi-kondisi lain yang mengakibatkan deplesi magnesium meliputi steatorea, pankreatitis
hemoragik akut atau edematosa, dan reseksi usus halus.
dehidrasi dan gangguan elektrolit 2) mencegah defisiensi mikromineral 3) mencegah dan mengatasi ketoasidosis 4) meminimalkan degradasi protein dan 5) akhirnya, diindikasikan untuk mempercepat penyembuhan. ( iyan@ho.otsuka.co.id, Jakarta, 29 Nov 2009).
2.5.5 Akibat kelebihan magnesium.
Akibat kelebihan magnesium belum diketahui secara pasti. Kelebihan magnesium terjadi pada penyakit gagal ginjal.
2.6 Elektrokoagulasi
Elektrokoagulasi adalah proses penggumpalan dan pengendapan partikel-partikel halus dalam air menggunakan energi listrik. Proses elektrokoagulasi dilakukan pada bejana elektrolisis yang didalamnya terdapat dua penghantar arus listrik searah yang disebut elektroda, yang tercelup dalam larutan limbah sebagai elektrolit. Apabila dalam suatu larutan elektrolit ditempatkan dua elektroda dan dialiri arus listrik searah, maka akan terjadi peristiwa elektrokimia yaitu gejala dekomposisi elektrolit, yaitu ion positif (kation) bergerak ke katoda dan menerima elektron yang di reduksi dan ion negative (anion) bergerak ke anoda dan menyerahkan elektron yang dioksidasi. Sehingga membentuk flok yang mampu mengikat kontaminan dan partikel-partikel dalam limbah.
2.6.1 Flokulasi
dengan cara pengadukan lambat. Dalam hal ini proses koagulasi harus diikuti flokulasi yaitu penggumpalan koloid terkoagulasi sehingga membentuk flok yang mudah terendapkan atau transportasi partikel tidak stabil, sehingga kontak antar partikel dapat terjadi (Sutrisno,1987).
Proses Flokulasi
Terdapat 3 (tiga) tahapan penting yang diperlukan dalam proses koagulasi yaitu: tahap pembentukan inti endapan, tahap flokulasi dan tahap pemisahan flok dengan cairan.
1. Tahap pembentukan inti Endapan
Pada tahap ini diperlukan zat koagulan yang berfungsi untuk penggabungan antara koagulan dengan pollutan yang ada dalam air. Agar penggabungan dapat berlangsung diperlukan pengadukan dan pengaturan pH. Pengadukan dilakukan pada kecepatan 60 s/d 100 rpm selama 1 s/d 3 menit ; pengaturan pH tergantung dari jenis koagulan yang digunakan misalnya :
Tawas pH 6 s/d 8 Ferro Sulfat pH 8 s/d 11 Ferri Sulfat pH 5 s/d 9
2. Tahap Flokulasi
baik untuk pengolahan air proses maupun untuk pengolahan air limbah industry. Polielektrolit dapat dibagi menjadi tiga jenis yaitu non ionik, kationik dan anionik, biasanya bersifat larut dalam air.
Sifat yang menguntungkan dari penggunaan polielektrolit adalah volume lumpur yang terbentuk relative lebih kecil, mempunyai kemampuan untuk menghilangkan warna dan efisien untuk proses pemisahan air dari lumpur.
3. Tahap Pemisahan flok dengan Cairan
Flok yang terbentuk selanjutnya harus dipisahkan dari cairannya, yaitu dengan cara pengendapan atau pengapungan. Bila flok yang terbentuk dipisahkan dengan cara pengendapan, maka dapat digunakan alat klarifier, sedangkan Bila flok yang terjadi diapungkan dengan menggunakan gelembung udara, maka flok dapat diambil dengan menggunakan skimmer
Zat-zat kimia yang digunakan untuk mendestabilkan partikel koloid disebut dengan koagulan. Koagulan yang paling sering digunakan adalah alumunium sulfat. Jika senyawa ini dimasukkan ke dalam air akan terionisasi membentuk Al3+ dan SO4 2-yang dapat menetralkan muatan koloid.
Al2(SO4)3 → 2 Al3+ + 3SO4 2-H2O → H + + OH
-2Al3+ + 6 OH-→ 2 Al(OH)3 (Laing D.1973).
Mekanisme yang terjadi pada proses flokulasi dengan koagulannya adalah sebagai berikut :
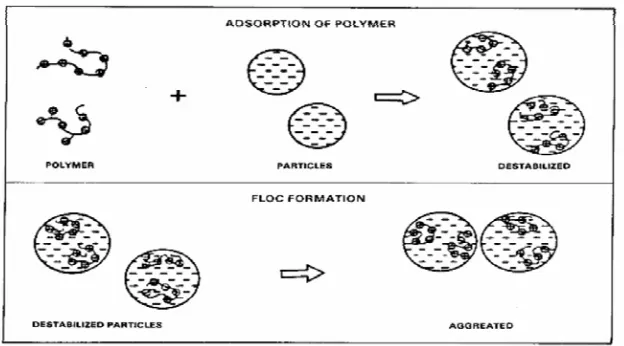
1. Adsorpsi flokulan (polimer) pada permukaan partikel koloid sehingga terbentuk lapisan flokulan. Dalam hal ini terjadi destabilisasi muatan elektron negatif partikel koloid oleh muatan positif hasil hidrolisa flokulan sehingga terjadi penggumpalan yang tidak stabil, proses ini disebut adsorpsi koagulasi.
2. Gumpalan (partikel-partikel) yang tidak stabil ini akan membentuk flok yang lebih besar, sehingga akibat dari tubrukan partikel-partikel dengan bantuan pengadukan, sehingga menjadi stabil dan mudah mengendap (terflokulasi). (Nainggolan,J.W.1997)
Al2(SO4)3.18 H2O + 3 Ca(HCO3)2 ==> 2 Al(OH)3 +3 Ca(SO4) + 6 CO2 + 18 H2O alkalinity
Al2(SO4)3.18 H2O + 3 Ca(OH)2 ==> 2 Al(OH)3 + 3 Ca(SO4) + 3 CO2 + 18 H2O mengendap
Pengendapan kotoran dapat terjadi karena pembentukan alumunium hidroksida, Al(OH)3 yang berupa partikel padat yang akan menarik partikel - partikel kotoran sehingga menggumpal bersama-sama, menjadi besar dan berat dan segera dapat mengendap.
Reaksi Pada Katoda
Reaksi pada katoda adalah reduksi terhadap kation. Jadi yang diperhatikan hanya kation saja.
1. Jika larutan mengandung ion-ion logam alkali, ion-ion logam alkali tanah, ion logam Al3+ dan ion Mg2+, maka ion-ion logam alkali ini tidak dapat direduksi dari larutan.Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas Hidrogen (H2) pada katoda.
2 H2O + 2e ==> 2 OH- + H2
2. Jika larutan mengandung asam, maka ion H+ dari asam akan direduksi menjadi gas hydrogen pada katoda.
2 H+ + 2e ==> H2
Fe2+ + 2e ==> Fe
Mn2+ + 2 e ==> Mn (Suaib,1994).
Reaksi pada Anoda
1. Elektroda pada anoda, elektrodanya dioksidasi menjadi ionnya. Contoh : Al ==> Al3+ + 3 e
Zn ==> Zn2+ + 2 e
2. Dalam system elektrokimia dengan anoda terbuat dari alumunium, beberapa kemungkinan reaksi elektroda dapat terjadi sebagai berikut; Anoda Al ==> Al3+ + 3e
Katoda : 2 H2O + 2 e ==> H2 + 2OH a. 2 H+ + 2e ==> H2
b. O2 + 4 H+ + 4e ==> 2 H2O
2.6.2 Proses Elektrokoagulasi
dari logam M menjadi kation (Mn+). Selanjutnya, air akan direduksi menjadi gas hidrogen dan ion hidroksil (OH). Elektrokoagulasi ini dikenal sebagai reaksi in situ kation logam.
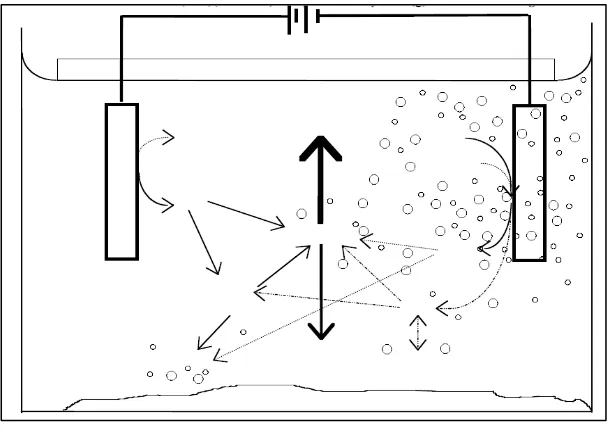
Gambar 2.5. Prinsif Kerja Elektrokoagulasi. Interaksi yang terjadi dalam larutan :
1. Migrasi menuju muatan elektroda yang berlawanan (elektroporesis) dan netralisasi muatan.
2. Kation atau ion hidroksil membentuk sebuah endapan dengan pengotor.
3. Interaksi kation logam dengan OH- membentuk sebuah hidroksida, dengan sifat adsorpsi yang tinggi selanjutnya berikatan dengan pollutan (bridge coagulation). 4. Senyawa hidroksida yang terbentuk membentuk gumpalan (flok) yang lebih besar
.
6. Sesudah flok terjadi,gas H2 membantu Flotasi dengan membawa pollutan kelapisan buih flok di permukaan cairan. (Holt,P.2006).
Gambar 2.6. Interaksi Dalam Proses Elektrokoagulasi
2.6.3 Keuntungan Elektrokoagulasi
2.6.4 Kerugian Elektrokoagulasi
Elektrodanya dapat terlarut sehingga dapat mengakibatkan terjadinya oksidasi. Penggunaan arus listrik yang mahal. Pada berbagai sistem elektrokoagulasi, lapisan oksida dapat membentuk katoda dan pengaturan unit elektrokoagulasi kurang efisien. (http://en.wikipedia.org./wiki/elektrocoagulation,2008).
Elektrodanya dapat terlarut sehingga dapat mengakibatkan terjadinya oksidasi. Penggunaan arus listrik yang mahal. Pada berbagai sistem elektrokoagulasi, lapisan oksida dapat membentuk katoda dan pengaturan unit elektrokoagulasi kurang efisien. kurang efisien. kurang kurang kurang .
(http://en.wikipedia.org./wiki/elektrocoagulation,2008).
2.7 Spektrofotometer Serapan Atom ( SSA )
menunjang misi laboratorium. Maka pemanfaatannya bergantung pada kemampuan sumber daya manusia, seperti kemampuan pemahaman teori dasar, spectrum aplikasi, ketertelusuran metoda analisis yang disyaratkan pada SNI 19 – 17025 – 2000 .
Spektrofotometer Serapan Atom adalah metoda analisis yang berdasarkan pada pengukuran radiasi cahaya yang diserap atom bebas . Analisis menggunakan Spektrofotometer Serapan Atom ini mempunyai keuntungan berupa analisisnya sangat peka, teliti dan cepat, pengerjaannya relative sederhana serta tidak perlu dilakukan pemisahan unsur logam dalam pelaksanaannya.
Analisis Spektrofotometer Serapan Atom yang didasarkan pada proses penyerapan energi radiasi dari sumber nyala atom – atom yang berada pada tingkat energi dasar. Komponen – komponen utama yang menyusun Spektrofotometer Serapan Atom adalah sumber cahaya, atomizer, monokromator, detector, dan penampilan data
2.7.1 Instrumentasi Spektrofotometer Serapan Atom
Prinsip utama untuk pengukuran penyerapan atom adalah pelemahan radiasi . latar belakang spesifik untuk elemen tertentu karena penyerapan yang dialami oleh sampel dalam atomisasi. Perbandingan antara radiasi awal dan dilemahkan satu memberikan informasi mengenai konsentrasi dari unsur dalam sampel dianalisis. Komponen utama spektrometer serapan atom adalah:
1. Sumber radiasi khusus untuk unsur-unsur tertentu (lampu dengan katoda yang kosong atau tanpa elektrode).
3. Monochromator 4. Photo-detektor
5. Komputer untuk kontrol peralatan dan analisis data.
Sumber radiasi spektrometer serapan atom harus berisi elemen yang diukur dalam sampel. Ada akan digunakan lampu dengan katoda kosong, membangun dari atau diisi dengan elemen tertentu atau lampu tanpa elektrodasilinder kaca yang berisi beberapa miligram dari unsur ini. Sumber radiasi memancarkan energi radiasi khusus untuk unsur tertentu, yang melintasi komponen sampel. Di sini radiasi dilemahkan karena penyerapan oleh atomisasi sampel. Sinyal yang diterima dari foto-detektor yang diperkuat dan diproses untuk penentuan nilai dan ditampilkan pada layar komputer atau, akhirnya,dicetak di atas kertas.