PENETAPAN KADAR FLOROTANIN DALAM FRAKSI ETIL ASETAT ALGA MERAH (Laurencia papillosa (Forskal)Graville) DENGAN
METODE KOLORIMETRI FOLIN CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Hendry Kurniawan NIM: 048114086
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PENETAPAN KADAR FLOROTANIN DALAM FRAKSI ETIL ASETAT ALGA MERAH (Laurencia papillosa (Forskal)Graville) DENGAN
METODE KOLORIMETRI FOLIN CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Hendry Kurniawan NIM: 048114086
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
Penelitian untuk Skripsi
PENETAPAN KADAR FLOROTANIN DALAM FRAKSI ETIL ASETAT ALGA MERAH (Laurencia papillosa (Forskal)Graville) DENGAN
METODE KOLORIMETRI FOLIN CIOCALTEAU
yang diajukan oleh : Hendry Kurniawan
NIM: 048114086
telah disetujui oleh :
Pembimbing
v
Roma 11:33 O, Alangkah dalamnya kekayaan, hikmat dan pengetahuan Allah! Sungguh tak terselidiki keputusan-keputusan-Nya dan sungguh tak terselami jalan-jalan-Nya!
Karya ini kupersembahkan
untuk :
Tuhan Yesus Kristus
Sahabat,
Penghibur yang tak pernah
membiarkan aku ‘down’...
Papa-Mama tercinta
Sebagai ungkapan rasa
hormat dan baktiku
Meimeiku tercinta
Sahabat-sahabatku
serta almamaterku
Segenap dosen dan
karyawan USD
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Hendry Kurniawan
Nomor Mahasiswa : 048114086
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“Penetapan Kadar Florotanin dalam Fraksi Etil Asetat Alga Merah (Laurencia papillosa (Forskal) Graville) dengan Metode Kolorimetri Folin Ciocalteau”
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 25 Februari 2008
Yang menyatakan
vii PRAKATA
Alleluia!! Terpujilah Tuhan Yang Maha Esa atas berkat kasih dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Penetapan Kadar Florotanin dalam Fraksi Etil Asetat Alga Merah (Laurencia papillosa (Forskal) Graville) dengan Metode Kolorimetri Folin Ciocalteau”. Penelitian ini barulah langkah awal perjalanan panjang penelitian tentang alga di bidang kosmetik dan farmasi. Skripsi ini disusun guna memenuhi salah satu syarat untuk mendapatkan gelar Sarjana Farmasi (S. Farm.)
pada Fakultas Farmasi Universitas Sanata Dharma. Dalam penulisan skripsi ini, penulis telah banyak mendapatkan bantuan
baik materiil, moral maupun spiritual dan dukungan yang berupa bimbingan, dorongan, sarana maupun fasilitas dari berbagai pihak. Pada kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada:
1. Rita Suhadi, M. Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ign.Y. Kristio Budiasmoro,M.Si. selaku dosen pembimbing yang telah meluangkan waktu dan tenaga untuk memberikan bimbingan dan saran mulai dari penyusunan proposal hingga diselesaikannya skripsi ini.
viii
4. Dra. A. Nora Iska H., M.Si., Apt. selaku dosen penanggungjawab proyek penelitian payung dan ikut menemani selama penelitian, Abdul Rohman, S.F., Apt. (UGM) dan Christine Patramurti, M.Si., Apt. atas segala masukan, kepedulian saat penelitian mengalami permasalahan.
5. Dr. Sabikis, Apt. yang telah membantu menerjemahkan reaksi Folin yang terbenam lama dalam sebuah buku tua Harry Auterhoff & Knabe.
6. Prof. Roman Przybylski (University Drive Lethbridge), Dr.
Jéssica de Matos Nunes (Universidade Federal do Rio Grande do Sul) yang mau berbagi pengalaman riset polifenol yang luar biasa. 7. Rekan tim peneliti, “Algae crew” (Elsa, Angel, Dewi, Andri, Fani, Dipta)
yang mendukung, menyemangati selama penelitian dan penyusunan skripsi ini.
8. Teman-teman tim peneliti Teh, Wortel, Jagung, Pulveres yang menambah keceriaan selama di laboratorium.
9. Teman-teman FST’04, kelas B, terutama kelompok D4 (Ratna-Rizky, Widya), “The Dream Team” (Boriz, Yusak, Peter, Rike, Fani) yang kompak habis, dan selalu mengalami hal aneh selama praktikum.
10. Segenap staf laboran terutama di lantai IV dan kepala gudang (mas Otok) atas masukan, bantuan, kebersamaan, dan kerjasamanya selama penelitian. 11. Teman Reef’ers, bapak gembalaku pdt. Drs. Yos Hartono, S.Th., teman
ix
12. Semua pihak yang tak dapat penulis sebutkan satu per satu yang telah membantu penulis dalam menyelesaikan skripsi ini.
Akhir kata, penulis menyadari bahwa penelitian dan penyusunan skripsi ini masih memiliki kekurangan mengingat keterbatasan penulis dalam penyusunan skripsi ini. Oleh sebab itu, penulis mengharapkan kritik dan saran atau mungkin ada pertanyaan dari pembaca sekalian, kirimkan ke alamat email a_thendryk@yahoo.com. Semoga skripsi ini memberikan manfaat bagi perkembangan ilmu pengetahuan di lingkungan akademis Universitas Sanata Dharma, syukur-syukur di tanah air. Selamat membaca...
x
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 4 Februari 2008 Penulis
xi DAFTAR ISI
Halaman
HALAMAN JUDUL………... ii
HALAMAN PERSETUJUAN PEMBIMBING………... iii
HALAMAN PENGESAHAN………...…. iv
HALAMAN PERSEMBAHAN………...v
PRAKATA... vii
PERNYATAAN KEASLIAN KARYA ... x
DAFTAR ISI... xi
DAFTAR GAMBAR ... xv
DAFTAR TABEL... xvi
DAFTAR LAMPIRAN... xvii
INTISARI... xix
ABSTRACT... xx
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 3
C. Keaslian Karya ... 3
D. Manfaat Penelitian ... 3
1. Manfaat teoritis ... 3
2. Manfaat metodologis... 4
3. Manfaat praktis ... 4
xii
1. Tujuan umum: ... 4
2. Tujuan khusus: ... 4
BAB II. PENELAAHAN PUSTAKA... 5
A. Alga atau Rumput Laut ... 5
B. Alga Merah ... 6
C. Kandungan kimia Laurencia sp. ... 6
D. Florotanin ... 7
E. Ekstraksi... 8
F. Spektrofotometri Visibel dan Kolorimetri ... 10
G. Metode Folin Ciocalteau ... 14
H. Validasi Metode Analisis ... 16
1. Akurasi ... 16
2. Presisi ... 16
3. Sensitivitas ... 17
4. Linearitas... 17
5. Range... 17
6. Spesifisitas ... 18
7. Detection Limit... 18
8. Quantitation Limit... 18
I. Kesalahan Dalam Metode Analisis ... 19
1. Kesalahan Sistematik (determinate errors) ... 19
2. Kesalahan Tidak Sistematik (indeterminate errors) ... 20
xiii
BAB III. METODOLOGI PENELITIAN ... 22
A. Jenis Rancangan Penelitian ... 22
B. Variabel dan Definisi Operasional ... 22
1. Variabel Penelitian ... 22
2. Definisi operasional ... 22
C. Bahan atau Materi Penelitian ... 23
D. Alat Penelitian... 23
E. Tata Cara Penelitian ... 24
1. Preparasi Sampel Alga Merah Laurenciapapillosa (Forskal) Graville.... 24
2. Penetapan Kadar Air Serbuk Alga ... 24
3. Uji Kualitatif Senyawa Fenolik... 25
4. Isolasi Florotanin Kasar ... 25
5. Optimasi Metode Kolorimetri dengan Folin-Ciocalteau... 26
a. Pembuatan larutan uji dan larutan standar ... 26
b. Penetapan Operating Time (OT)... 26
c. Penentuan Panjang Gelombang Maksimum ( maks) ... 27
6. Validasi Metode Analisis ... 27
7. Pengukuran Kadar Polifenol Total... 28
a. Perlakuan pada larutan standar floroglusinol... 28
b. Perlakuan fraksi etil asetat alga merah... 29
F. Analisis Hasil ... 30
1. Akurasi ... 30
xiv
BAB IV. HASIL DAN PEMBAHASAN ... 31
A. Pengambilan Sampel... 31
B. Preparasi Sampel Alga merah Laurenciapapillosa (Forskal) Graville ... 31
B. Hasil Uji Kualitatif... 36
1. Uji pendahuluan ... 36
2. Uji polifenol ... 37
3. Uji tanin (zat samak) ... 38
C. Isolasi Florotanin Kasar ... 38
D. Dasar Reaksi Kolorimetri dengan Folin-Ciocalteau ... 40
E. Optimasi Metode Kolorimetri dengan Folin-Ciocalteau... 44
1. Penetapan Operating Time (OT)... 44
2. Penentuan Panjang Gelombang Maksimum ( maks) ... 45
F. Hasil Validasi Metode Analisis... 48
G. Penetapan Kadar Florotanin Fraksi Etil Asetat Laurencia papillosa (Forskal) Graville ... 52
BAB V. KESIMPULAN DAN SARAN... 54
A. Kesimpulan ... 54
B. Saran... 54
DAFTAR PUSTAKA ... 55
LAMPIRAN... 59
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kimia beberapa polifenol alga ... 8
Gambar 2. Rangkaian alat sokhletasi... 10
Gambar 3. Instrumentasi spektrofotometer visisbel ... 11
Gambar 4. Diagram radiasi elektromagnetik ... 12
Gambar 5. Ionisasi senyawa fenol ... 13
Gambar 6. Proses oksidasi fenol oleh enzim polifenol oksidase (PPO) ... 34
Gambar 7. Reaksi saat penetapan kadar air dengan Karl Fischer... 35
Gambar 8. Reaksi uji pendahuluan senyawa floroglusinol dan KOH ... 36
Gambar 9. Reaksi pembentukan kompleks gugus fenolik dan FeCl3... 37
Gambar 10. Reaksi redoks dalam reaksi Folin-Ciocalteau ... 42
Gambar 11. Hasil pembacaan OT floroglusinol kadar 3,0 ppmdengan pereaksi Folin Ciocalteau... 45
Gambar 12. Hasil pembacaan maks floroglusinol 3 macam kadar floroglusinol: 1,0; 3,0 dan 6,0 ppm setelah direaksikan dengan Folin Ciocalteau... 47
xvi
DAFTAR TABEL
Halaman Tabel I. Hasil uji pendahuluan kandungan senyawa fenolik Laurencia
papillosa (Forskal) Graville ... 37 Tabel II. Hasil uji kandungan senyawa polifenol Laurencia papillosa
(Forskal) Graville ... 38 Tabel III. Data replikasi seri baku floroglusinol ... 48 Tabel IV. Hasil validasi metode Folin-Ciocalteau ... 49 Tabel V. Hasil penetapan kadar sampel florotanin kasarLaurencia
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat Keterangan hasil identifikasi spesies alga merah ... 59
Lampiran 2. Data perhitungan kadar air dengan Karl Fischer... 61
Lampiran 3. Data penimbangan replikasi seri baku floroglusinol... 62
Lampiran 4. Contoh perhitungan seri kadar baku floroglusinol... 63
Lampiran 5. Hasil scanning maks kadar floroglusinol 1,0 ppm setelah direaksikan dengan Folin-Ciocalteau... 63
Lampiran 6. Hasil scanning maks kadar floroglusinol 3,0 ppm setelah direaksikan dengan Folin-Ciocalteau... 64
Lampiran 7. Hasil scanning maks kadar floroglusinol 6,0 ppm setelah direaksikan dengan Folin-Ciocalteau... 64
Lampiran 8. Hasil pembacaan absorbansi seri baku floroglusinol pada ketiga maks... 65
Lampiran 9. Data recovery, kesalahan sistematik dan kesalahan acak dengan metode Folin-Ciocalteau ... 65
Lampiran 10. Hasil analisis statistik regresi linear seri baku floroglusinol replikasi I... 66
Lampiran 11. Hasil analisis statistik regresi linear seri baku floroglusinol replikasi II ... 67
Lampiran 12. Hasil analisis statistik regresi linear seri baku floroglusinol replikasi III ... 67
xviii
Lampiran 14. Parameter CV... 69 Lampiran 15. Data penimbangan sampel fraksi etil asetat
Laurencia papillosa (Forskal) Graville... 69 Lampiran 16. Data absorbansi sampel fraksi etil asetat Laurencia papillosa
(Forskal) Graville ... 70 Lampiran 17. Contoh perhitungan kadar sampel... 70 Lampiran 18. Foto hasil uji kualitatif kandungan florotanin serbuk
alga merah Laurencia papillosa (Forskal) Graville ... 71 Lampiran 19. Foto florotanin kasardari fraksi etil asetat alga merah
Laurencia papillosa (Forskal) Graville... 72 Lampiran 20. Foto instrumen spektrofotometer UV - VIS Perkin Elmer
xix INTISARI
Tanaman laut alga merupakan salah satu kekayaan laut Indonesia yang sangat potensial, namun belum dimanfaatkan secara maksimal baik sebagai nutrisi makanan maupun agen biomedis. Salah satunya, alga merah Laurencia yang cukup melimpah di perairan Indonesia. Alga merah mengandung mikronutrien polifenol alga yang dikenal sebagai florotanin. Senyawa ini berupa unit-unit floroglusinol (1,3,5-trihidoksibenzena) yang berbeda dari tumbuhan terestrial.
Tujuan penelitian ini adalah mendapatkan florotanin kasar dari alga merah Laurencia papillosa (Forskal) Graville serta menetapkan kadar florotanin dalam fraksi etil asetat alga tersebut. Isolasi dilakukan menggunakan metode sokhletasi dengan pelarut metanol. Ekstrak kental yang diperoleh kemudian difraksinasi dengan kloroform, akuades, dan etil asetat untuk mendapatkan florotanin kasar.
Konsentrasi polifenol total dalam florotanin kasar ditetapkan secara spektrofotometri dengan metode Folin-Ciocalteau, menggunakan standar floroglusinol yang dibuat seri konsentrasi baku 0,5 ; 1,0 ; 2,0 ; 3,0 ; 4,0 ; 5,0 ; dan 6,0 ppm dalam pelarut aseton 75 %. Standar floroglusinol dan sampel dibaca pada panjang gelombang maksimum 750,1 nm. Konsentrasi polifenol total dalam fraksi etil asetat alga merah yang didapat adalah 10,55-11,21 mg PGE (Phloroglucinol Equivalent)/g sampel.
xx ABSTRACT
Seaweed algae is one of Indonesian’s sea treasures that really potential, but still haven’t been used maximally as well yet, either as food nutrition or biomedical agents. One of them is red algae Laurencia that abundant enough in Indonesian waters. The Red algae contains algae polyphenols micronutrient called phlorotannins. This compound is derived from phloroglucinol units (1,3,5-trihydoxybenzene), that is differ from terrestrial plant polyphenols.
The goals of this study is for getting crude phlorotannin from red algae
Laurencia papillosa (Forskal) Graville and determining phlorotannin concentration in ethyl acetate fractional of alga that mentioned. Isolation have been done by soxhletation method with methanol solvent. The viscous extract that was gained, than was fractionated with chloroform, aquadest and ethyl acetate to gain crude phlorotannin.
Concentration of total polyphenols in crude phlorotannin was determined by spectrophotometric with Folin-Ciocalteau method. Using phloroglucinol standard that was made in calibration series 0.5 ; 1.0 ; 2.0 ; 3.0 ; 4.0 ; 5.0 and 6.0 ppm with acetone 75 % solvent. The phloroglucinol standard and sample was scanned at 750.1 nm the maxima wavelength. Concentration of total polyphenols in ethyl acetate fractional of red algae has been investigated was 10.55-11.21 mg PGE (Phloroglucinol Equivalent)/g sample.
1 BAB I PENGANTAR
A. Latar Belakang
Saat ini telah dikenal 8000 senyawa fenolik alam dengan struktur yang digambarkan sebagai suatu fenol (cincin aromatik yang berikatan sedikitnya dengan 1 gugus hidroksil) seperti asam kafeat, asam ferulat, kuersetin, apigenin, genistein, resveratrol, asam norhidroguaiaretat, asam karnosat, silimarin, polifenol teh, dan tanin (Svobodova et al., 2003).
Salah satu mikronutrien dari tumbuhan alga adalah polifenol yang dikenal sebagai florotanin, merupakan senyawa polifenol yang tidak ditemukan pada tumbuhan terestrial (Burtin, 2003). Beberapa aktivitas biologik florotanin yang telah diteliti adalah antiproliferasi dan antioksidan (Nakamura et al., 1996; Kang
et al., 2005a; Athukorala et al., 2006; Yuan & Walsh, 2006), antiinflamasi (Shin
et al., 2006), inhibitor matriks metalloproteinase (Kim et al., 2006), sitoprotektif terhadap stres oksidatif (Kang et al., 2005b), dan inhibitor HIV-1 reverse transcriptase dan protease (Ahn et al., 2004).
telah dieksplorasi belumlah sebanyak dari daratan yang memiliki keterbatasan lahan tanah yang semakin sempit untuk pemukiman dan fasilitas lainnya.
Diketahui pula, tanaman alga merah telah dikembangkan jadi beberapa produk kosmetika antioksidan karena merupakan agen pereduksi sebagaimana halnya dengan vitamin C, sehingga perlu dilakukan investigasi tentang kandungan aktif senyawa polifenolnya. Maka sebagai langkah awal untuk meneliti kandungan polifenol alga merah Laurencia papillosa (Forskal) Gravilledilakukan penelitian secara kualitatif dan kuantitatif polifenol totalnya agar dapat diketahui kandungan senyawa florotanin Laurencia papillosa (Forskal) Graville sebenarnya dan jika dilakukan uji penelitian lanjutan dapat diketahui besarnya potensi aktivitasnya sebagai bioaktif yang berguna menjaga kesehatan manusia.
B. Perumusan Masalah
Dari uraian di atas, maka permasalahan dalam penelitian ini difokuskan pada florotanin dalam fraksi etil asetat yang diisolasi dari alga merah Laurencia papillosa (Forskal) Graville yang tersebar di pantai selatan Yogyakarta. Rumusan masalah yang ada sebagai berikut :
1. Apakah florotanin berupa florotanin kasarpada fraksi etil asetat dapat diisolasi dari alga merah Laurencia papillosa (Forskal) Graville untuk diukur dengan metode Folin Ciocalteau?
2. Berapakah kadar florotanin dalam alga merah Laurencia papillosa (Forskal) Graville yang diukur dengan metode Folin Ciocalteau?
C. Keaslian Karya
Sepengetahuan peneliti, penelitian tentang penetapan kadar florotanin dalam fraksi etil asetat alga merah (Laurencia papillosa (Forskal) Graville) dengan metode Folin-Ciocalteau belum pernah dilakukan.
D. Manfaat Penelitian
1. Manfaat teoritis
2. Manfaat metodologis
Penelitian ini dapat menjadi acuan tentang penggunaan metode Folin Ciocalteau dalam penetapan kadar florotanin.
3. Manfaat praktis
Memberi informasi kepada masyarakat kandungan polifenol alga merah (Laurencia papillosa (Forskal) Graville) yang bermanfaat bagi kesehatan sebagai antioksidan, antikanker, sediaan kosmetik tabir surya dan manfaat lain yang belum diteliti.
E. Tujuan Penelitian
1. Tujuan umum:
Tujuan umum penelitian ini adalah menetapkan kadar florotanin alga merah
Laurencia papillosa (Forskal) Graville.
2. Tujuan khusus:
a. Dapat mengisolasi florotanin berupa florotanin kasarpada fraksi etil asetat alga merah Laurencia papillosa (Forskal) Graville untuk diukur dengan metode Folin Ciocalteau.
b. Mengetahui kadar florotanin dalam alga merah Laurencia papillosa
5 BAB II
PENELAAHAN PUSTAKA
A. Alga atau Rumput Laut
B. Alga Merah
Red algae (Rhodophyta, Yunani : (rhodon) = mawar +
(phyton) = tanaman, jadi tanaman merah) adalah kelompok besar sekitar 5000-6000 spesies dari kebanyakan marine algae adalah multiselular termasuk banyak dikenal sebagai ganggang laut (Thomas, 2002). Laurencia termasuk dalam ordo
Ceramiales dan famili Rhodomelaceae (Al Amin & Razali, 1997).
Kebanyakan coralline algae, mensekresikan kalsium karbonat dan memainkan peran membangun batu karang (Woelkerling, 1990). Alga merah seperti dulse (Palmaria palmata) dan nori sebagai masakan tradisional Eropa dan Asia dan digunakan untuk produk agar, karagenan dan bahan tambahan makanan lain (Thomas, 2002).
C. Kandungan kimia Laurencia sp.
Laurencia papillosa (Forskal) Graville mengandung polisakarida carrageenan dan agar, dinding sel alga merah mengandung minor polisakarida xylan (Burtin, 2003). Laurencia obtusa mengandung seskuiterpen teroksidasi
chamigrenelactone, asetogenin steroisomer neoisoprelaurefucin. Dua diterpen terhalogenasi 15-bromoparguer-9(11)-ene-16-ol dan 15-bromoparguer-7-ene-16-ol dielusidasi dari L. nipponica. L. intricata memiliki diterpen laurenditerpenol.
Rhodomela confervoides telah dikenal sebagai sumber derivat bromofenol (Blunt
bertolakbelakang, pada alga merah dan hijau memiliki kandungan fenol yang rendah dan protein yang tinggi. Lipid didapati hanya 1-5 % dari bobot kering alga menunjukkan suatu poli-asam lemak tak jenuh. Selain itu terdapat pula polifenol alga disebut florotanin (Burtin, 2003).
D. Florotanin
Polifenol alga disebut juga florotanin, berbeda dengan polifenol dari tanaman teresterial yang berasal dari turunan asam galat dan asam ellagat, sementara polifenol algal berasal dari unit-unit floroglusinol
(1,3,5-trihydroxybenzene) (Burtin, 2003).
Kandungan tertinggi florotanin ditemukan dalam ganggang coklat, berkisar 5-15 % dari berat kering (Nagayama et al., 2002). Florotanin terdiri dari molekul dengan struktur dan tingkat polimerisasi yang heterogen yaitu
phloroglucinol (2 %) dan oligomernya seperti eckol (trimer, 3 %),
phlorofucofuroeckol A (pentamer, 28 %), dieckol (heksamer, 7 %), 8,8’–bieckol
(hexamer, 7 %) dan lainnya (30 %). Florotanin dengan struktur dan tingkat polimerisasi yang heterogen memungkinkan senyawa ini mempunyai aktivitas biologik yang luas (Athukorala et al., 2006; Yuan & Walsh, 2006; Kang et al.,
Glombitza et al. menemukan floroglusinol bebas dalam Fucus vesiculosus
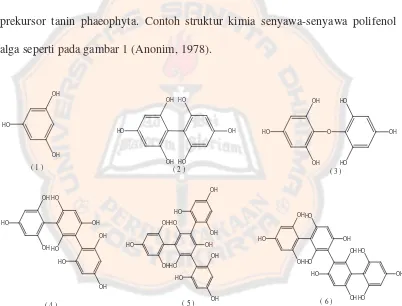
dan mendeskripsikan isolasi beberapa polifloroglusinol dan dinamakan difucol, trifucol, serta campuran dua isomerik tetrafucol. Senyawa-senyawa ini diisolasi dan dikaraktersisasikan sebagai paracetates, yang strukturnya didapat dari data spektrum. Dari ganggang coklat yang lain, Bifurcaria bifurcata, diisolasi sebuah difenil eter dan dikarakterisasikan sebagai paracetate. Data spektrum menunjukkan senyawa ini, bernama bifuhalol yang lebih lanjut diduga sebagai prekursor tanin phaeophyta. Contoh struktur kimia senyawa-senyawa polifenol alga seperti pada gambar 1 (Anonim, 1978).
OH
Gambar 1. Struktur kimia beberapa polifenol alga : (1) Floroglusinol, (2) Difucol, (3) Bifuhalol, (4) Trifucol, (5) Isomer I Tetrafucol, (6) Isomer II Tetrafucol
E. Ekstraksi
penyarian adalah kecepatan difusi zat yang larut melalui lapisan batas antara cairan penyari dengan bahan yang mengandung zat tersebut. Pada waktu pembuatan simplisia (serbuk), beberapa sel ada yang dindingnya pecah dan ada yang masih utuh. Proses penyarian pada sel yang dindingnya masih utuh, zat aktif yang terlarut pada cairan penyari untuk keluar dari sel harus melewati dinding sel (Anonim, 1986). Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, diluar pengaruh cahaya matahari langsung (Anonim, 1979).
Maserasi merupakan cara penyarian yang sederhana dan digunakan untuk simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari. Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat mudah mengembang dalam cairan penyari, tidak mengandung benzoin, stirak, dan lain-lain. Keuntungan penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Kerugian maserasi adalah pengerjaan lama, penyariannya kurang sempurna (Anonim, 1986).
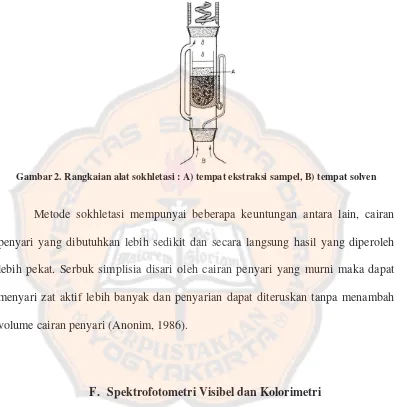
ke labu. Cairan akan menguap kembali berulang seperti proses sebelumnya (Anonim, 1986). Rangkaian alat sokhletasi seperti gambar 2 (Evans, 2002).
Gambar 2. Rangkaian alat sokhletasi : A) tempat ekstraksi sampel, B) tempat solven
Metode sokhletasi mempunyai beberapa keuntungan antara lain, cairan penyari yang dibutuhkan lebih sedikit dan secara langsung hasil yang diperoleh lebih pekat. Serbuk simplisia disari oleh cairan penyari yang murni maka dapat menyari zat aktif lebih banyak dan penyarian dapat diteruskan tanpa menambah volume cairan penyari (Anonim, 1986).
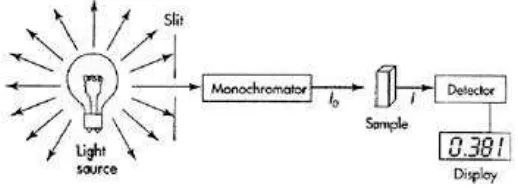
F. Spektrofotometri Visibel dan Kolorimetri
Gambar 3. Instrumentasi spektrofotometer visisbel
Sumber (source) untuk daerah tampak, adalah tungsten filament incandescent lamp. Sel sampel untuk visibel dari gelas atau kuarsa (Christian, 2004). Analisis spektroskopi adalah sains untuk menetapkan berapa banyak substansi yang ada di sampel secara akurat mengukur berapa besar cahaya yang diabsorpsi atau diemisikan oleh atom atau molekul di dalamnya (Cairns, 2005).
Senyawa yang dapat menyerap radiasi cahaya tampak adalah senyawa berwarna yang memiliki elektron lebih mudah dipromosikan. Spektrum serapan elektronik ini dapat digunakan untuk analisis kuantitatif karena jumlah radiasi elektromagnetik yang diserap ada hubungannya dengan jumlah molekul penyerap (Silverstein & Murrill, 1991; Skoog et al., 1998), digambarkan sebagai berikut:
Cahaya adalah bentukan radiasi elektromagnetik, disebut demikian karena terdiri atas komponen elektrik dan komponen magnetis yang bergelombang bersamaan dengan arah tegak lurus dan tegak lurus terhadap arah perjalanan radiasi melewati ruang seperti gambar 4 berikut (Cairns, 2005).
Gambar 4. Diagram radiasi elektromagnetik
Panjang gelombang saat mencapai absorbans (A) tertinggi disebut maks dan karakteristik dari bagian kromofor (Christian, 2004). Pergeseran maks menjadi panjang gelombang lebih panjang dikenal sebagai batokromik atau red shift
Gambar 5. Ionisasi senyawa fenol
Kolorimetri adalah suatu teknik pengukuran cahaya yang diabsorpsi oleh zat berwarna baik warna yang terbentuk dari asalnya maupun akibat reaksi dengan zat lain (Khopkar, 1990). Pemilihan prosedur kolorimetri untuk menentukan substansi tergantung pada pertimbangan sebagai berikut :
1. metode kolorimetri akan memberikan hasil yang lebih akurat pada konsentrasi rendah daripada titrimetri atau gravimetri.
2. metode kolorimetri sering digunakan pada kondisi di mana tidak ada titrimetri atau gravimetri.
3. metode kolorimetri memiliki beberapa keuntungan dalam hal spesifisitas (Vogel, 1978).
Kriteria untuk analisis kolorimetri yang baik adalah : 1. Menghasilkan reaksi warna yang khusus
Reaksi-reaksi yang ada sangat sedikit sekali untuk beberapa substansi tertentu, tetapi justru memberikan warna-warna yang banyak membentuk kelompok warna tersendiri yang hanya berhubungan dengan substansi khusus.
Untuk kolorimeter visual sangat penting bahwa intensitas warna harus meningkat secara linier dengan konsentrasi substansi yang ditentukan. 3. Stabilitas warna
Warna yang dihasilkan harus sama untuk mendapatkan hasil yang akurat. Hal ini menerapkan reaksi-reaksi warna yang akan dicapai secara maksimal. Waktu untuk mencapai warna yang maksimal harus cukup lama untuk mendapatkan pengukuran yang kurat.
4. Reprodusibel
Prosedur kolorimetri harus memberikan hasil yang reprodusibel dalam kondisi yang spesifik.
5. Kejernihan larutan
Larutan harus bebas dari pengotor jika pembanding yang dipakai dibuat dengan standar. Kekeruhan akan menyerap cahaya dengan baik (Vogel, 1978).
G. Metode Folin Ciocalteau
Reagen Folin-Ciocalteau tersusun atas: 100 g natrium tungstat, 25 g natrium molibdat P, 50 mL asam fosfat P, 100 mL HCl P, 150 g lithium sulfat P, dan beberapa tetes brom P (Anonim, 1995).
tidak menyediakan data senyawa fenolik tertentu dalam ekstrak. Metode Folin-Ciocalteau berdasar atas kemampuan mereduksi gugus hidroksil fenolik dan sangat tidak spesifik namun dapat mendeteksi semua fenol dengan sensitivitas berbeda. Reaksi redoks dari fenolat terjadi di bawah kondisi basa mereduksi kompleks fosfotungstat-fosfomolibdat dalam reagen menjadi suatu warna biru (Box, 1983).
Pengujian dengan kolorimetri oksidasi/reduksi ini mengukur semua molekul fenol tanpa ada diferensiasi antara asam gallat, monomer, dimer dan senyawa fenolik yang lebih besar (Anonim, 2001). Paper pertama tentang metode ini dipublikasikan pertama kali pada 1927. Singleton dan Rossi (1965) membuktikan reprodusibilitas uji ini. Ini adalah suatu metode kuantitatif dan sensitif, tergantung pada derajat polimerisasi: Fenolik + basa + reagen Folin-Ciocalteau (F-C) + panas = produk berwarna biru. Absorpsi hasil reaksi polifenol anggur dan reagen F-C pada 755 nm (Anonim, 2001).
H. Validasi Metode Analisis
Validasi suatu metode analisis adalah proses yang dibuat, dengan penelitian laboratorium agar karakteristik pelaksanaan metode memenuhi persyaratan aplikasi analisis yang diinginkan. Parameter-parameter validitas metode analisis antara lain akurasi, presisi, linearitas, spesifisitas, range, detection limit, dan quantitation limit (Anonim, 2005).
1. Akurasi
Akurasi adalah derajat kepercayaan antara nilai yang terukur dan nilai sebenarnya. Nilai sebenarnya yang mutlak sangat sukar diketahui. Definisi yang lebih mungkin mengenai akurasi adalah kesesuaian antara nilai terukur dan nilai sebenarnya yang dapat diterima (Christian, 2004).
Akurasi dihitung sebagai persentase recovery pengujian sejumlah analit yang diketahui jumlahnya atau sebagai perbedaan antara rata-rata dan nilai sebenarnya yang dapat diterima (Anonim, 2005). Menurut Mulja dan Hanwar (2003) akurasi untuk bahan baku 98-102 %, sedangkan untuk bioanalisis rentang akurasi 80-120 % masih bisa diterima.
2. Presisi
dinyatakan dengan nilai koefisien variasi (CV) yang < 2 % untuk kadar analit 98-102 %.
3. Sensitivitas
Sensitivitas suatu metode analisis merupakan kemampuan metode analisis untuk memisahkan perbedaan kecil konsentrasi analit. Faktor yang mempengaruhi sensitivitas adalah kemiringan (slope) kurva baku dan presisi. Jika ada 2 metode analisis memiliki presisi yang sama namun salah satunya memiliki kemiringan kurva baku yang lebih curam maka metode yang disebut terakhir lebih sensitif, dan sebaliknya (Skoog et al., 1998).
4. Linearitas
Linearitas suatu metode analisis merupakan kemampuan (pada rentang tertentu) untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel sehingga memberikan nilai koefisien korelasi yang lebih besar daripada nilai koefisien korelasi pada tabel statistik (Mulja & Suharman, 1995).
5. Range
6. Spesifisitas
Spesifisitas didefinisikan sebagai kemampuan untuk mengukur dengan baik komponen lain dalam analit yang mungkin ada seperti pengotor, produk degradasi, dan komponen matriks (Anonim, 2005). Spesifisitas merupakan karakterisitik terpenting dari suatu metode sebagai salah satu parameter validasi yang utama (Mulja & Hanwar, 2003)
7. Detection Limit
Detection limit adalah kadar terkecil analit yang masih dapat memberikan tanggap detektor yang tingginya 2-3 kali simpangan maksimum dari noise (derau) garis dasar (Mulja & Hanwar, 2003). Pada kasus prosedur analisis instrumental yang menghasilkan background noise. Menurut ICH (International Conference on Harmonization), rasio signal-to-noise yang dapat diterima adalah 2:1 atau 3:1 (Anonim, 2005).
8. Quantitation Limit
I. Kesalahan Dalam Metode Analisis
Kesalahan dalam metode analisis sangat sukar untuk dihilangkan namun sumber kesalahan tetap harus dibuat seminimal mungkin. Kesalahan dalam analisis kimia dapat dikategorikan menjadi 2 kelas utama, yaitu:
1. Kesalahan Sistematik (determinate errors)
Kesalahan sistematik adalah hasil analisis yang menyimpang secara tetap dari nilai kadar yang sebenarnya karena proses pelaksanaan prosedur analisis, sehingga kesalahan ini disebut juga kesalahan prosedur (Mulja & Suharman, 1995). Kesalahan sistematik dapat disebabkan oleh beberapa faktor, antara lain:
a. Kesalahan personil dan operasi
Kesalahan ini disebabkan oleh cara pelaksanaan analisis, bukan karena metode. Kesalahan operasi umumnya bersifat fisis (bukan khemis), misalnya kesalahan pengamatan visual pada titik akhir titrasi, kekeliruan cara pencucian endapan, dan sebagainya. Jadi kesalahan ini bersifat individual dan sangat dipengaruhi oleh keterampilan analis dalam melakukan pekerjaan analisis.
b. Kesalahan alat dan pereaksi
c. Kesalahan metode
Kesalahan ini dapat disebabkan oleh kesalahan pengambilan sampel, kesalahan akibat reaksi kimia yang tidak sempurna, atau ikut mengendapnya zat-zat yang tidak diinginkan (Day & Underwood, 1986). Kesalahan sistematik dapat dihindari atau diperkecil dengan:
1). Mengkalibrasi instrumen dan melakukan koreksi secara berkala (biasanya tiap 3 bulan atau disesuaikan dengan frekuensi pemakaian alat).
2). Memilih metode dan prosedur standar dari badan resmi. 3). Memakai bahan kimia dengan derajat untuk analisis. 4). Meningkatkan pengetahuan dan keterampilan analis.
5). Melakukan penetapan blangko atau kontrol dengan zat baku. 6). Melakukan penetapan paralel (in duplo atau in triplo).
2. Kesalahan Tidak Sistematik (indeterminate errors)
Kesalahan tidak sistematik adalah penyimpangan yang tidak tetap dari hasil penentuan kadar dengan instrumen yang disebabkan fluktuasi dari instrumen yang dipakai (derau). Penyebab kesalahan ini tidak dapat ditentukan dan tidak dapat dikontrol maka kesalahan ini disebut juga kesalahan acak (random error) (Mulja & Suharman, 1995).
J. Keterangan Empiris
floroglusinol. Florotanin yang ditetapkan kadarnya adalah fraksi etil asetat yang diuapkan pelarutnya dan dianggap sebagai florotanin kasar.
22 BAB III
METODOLOGI PENELITIAN
A. Jenis Rancangan Penelitian
Penelitian ini termasuk dalam penelitian deskriptif non-eksperimental karena tidak ada intervensi atau perlakuan terhadap fenomena yang diamati.
B. Variabel dan Definisi Operasional
1. Variabel Penelitian
a. Variabel pengacau terkendali dalam penelitian ini adalah volume cairan penyari untuk mengisolasi florotanin alga merah Laurencia papillosa
(Forskal) Graville, tempat panen alga di pantai Drini, masa panen pada bulan Mei, komposisi reagen saat analisis.
b. Varibel pengacau tak terkendali dalam penelitian ini adalah umur alga yang dipanen (bukan tanaman budidaya), suhu dan kelembaban ruangan saat percobaan.
2. Definisi operasional
a. Laurencia papillosa (Forskal) Graville adalah spesies alga merah yang diambil dari pantai Drini, Gunung Kidul, Yogyakarta pada bulan Mei. b. Ekstrak metanol adalah hasil ekstraksi serbuk alga dengan sokhlet
c. Florotanin kasar adalah ekstrak kasar florotanin dari fraksi etil asetat yang diuapkan pelarut (etil asetat) seluruhnya.
d. Kadar florotanin adalah konsentrasi polifenol total dihitung ekivalen dengan floroglusinol (mg PGE/g sampel) yang diukur pada panjang gelombang maksimum 750,1 nm mendekati teoritis hasil penelitian Zhang
et al. dengan metode Folin Ciocalteau.
C. Bahan atau Materi Penelitian
Bahan yang digunakan dalam penelitian adalah sebagai berikut: Alga merah (Laurencia sp.) dari pantai Drini, Gunung Kidul, Yogyakarta diambil tanggal 21 Mei 2007. Metanol, kloroform, etil asetat, natrium karbonat (p.a. E.
Merck, Germany), reagen Folin Ciocalteau (Sigma Chem, Co., USA.), akuades (Fakultas Farmasi Universitas Sanata Dharma).
D. Alat Penelitian
E. Tata Cara Penelitian
1. Preparasi Sampel Alga Merah Laurenciapapillosa (Forskal) Graville
Alga merah (Laurencia papillosa (Forskal) Graville) dikumpulkan, dicuci dengan air mengalir dan dimasukkan dalam autoklaf selama 30 menit pada suhu 100 0C. Selanjutnya dikeringkan dalam oven dengan suhu 80-100 0C selama 6 hari sampai dapat dihancurkan dengan kekuatan tangan, diserbuk dengan blender, diayak dan dipilih serbuk yang lolos dengan derajat halus 20/30.
2. Penetapan Kadar Air Serbuk Alga
Penetapan kadar air serbuk alga dilakukan dengan menggunakan metode Karl Fischer. Serbuk alga ditimbang dengan seksama 0,2 gram, kemudian ditambah 10 mL metanol, didiamkan selama 1 hari pada suhu kamar. Dilakukan pre-titrasi pada alat, lalu dilakukan uji kebocoran sesuai prosedur perintah pada alat, hingga didapat angka drift 10-50 pada alat. Standardisasi dilakukan dengan cara timbang
spuit berisi air, kemudian dimasukkan 1 tetes air ke dalam alat. Lalu ditimbang kembali untuk ditentukan berat air yang dimasukkan. Kemudian dihitung kesetaraan air. Sebanyak 1 mL metanol dimasukkan dan titrasi dengan alat (blangko). Kemudian 1 mL sampel dimasukkan, titrasi dengan alat, hitung kadar air dalam sampel. Kadar air dalam sampel dihitung dengan rumus:
x - blanko (10) berat yang ditimbang
x 100 % Kadar air =
3. Uji Kualitatif Senyawa Fenolik
a. Uji pendahuluan
Sebanyak 1 mL filtrat alga ditambah 10 mL air, dipanaskan selama 30 menit. Larutan disaring dengan kapas. Larutan berwarna kuning sampai merah menunjukkan adanya senyawa yang mengandung kromofor dengan gugus hidrofilik. Jika ditambah KOH, warna larutan kuning sampai merah menjadi lebih pekat.
b. Uji polifenol
Sebanyak 1 mL filtrat alga ditambah 3 tetes pereaksi besi (III) klorida. Jika terjadi warna hijau-biru menunjukkan adanya polifenol.
c. Uji tanin (zat samak)
Sebanyak 1 mL filtrat alga ditambah 1 mL NaCl 2 %. Bila terjadi suspensi (endapan) disaring melalui kertas saring. Filtrat alga ditambah 5 mL larutan gelatin 1 %. Terbentuknya endapan warna putih menunjukkan adanya tanin.
4. Isolasi Florotanin Kasar
yang kecil (1/10 dari volume mula-mula) dan ditambahkan kembali pelarut metanol hingga diperoleh 60 mL ekstrak metanol, kemudian ditambahkan 120 mL kloroform, dan 45 mL air dalam corong pisah. Corong pisah digojog perlahan dan didiamkan hingga memisah dan membentuk 2 lapisan. Lapisan atas dan lapisan bawah yang terbentuk dipisahkan, selanjutnya lapisan atas diekstraksi dalam corong pisah dengan etil asetat masing-masing sebanyak 75mL. Kumpulkan fraksi etil asetat, selanjutnya diuapkan, dan diperoleh ekstrak yang merupakan florotanin kasar.
5. Optimasi Metode Kolorimetri dengan Folin-Ciocalteau
a. Pembuatan larutan uji dan larutan standar i. Pembuatan larutan intermediet floroglusinol
Ditimbang dengan cara seksama 0,05 g standar floroglusinol, kemudian dilarutkan ke dalam aseton 75 % sampai volume 50,0 mL. Buat seri konsentrasi (0,005; 0,01; 0,02; 0,03; 0,04; 0,05; dan 0,06) ppm sebanyak 10,0 mL dengan pelarut aseton 75 %.
ii. Perlakuan fraksi etil asetat alga merah
Ditimbang dengan cara seksama 0,05 g fraksi polifenol, kemudian dilarutkan ke dalam aseton 75 % hingga volumenya 50,0 mL.
b. Penetapan Operating Time (OT)
yang telah diencerkan dengan akuades 1:1. Didiamkan selama 2 menit, kemudian ditambahkan 7,5 mL Na2CO3 1,9 M, dicampurkan sampai volume 50,0 mL dengan akuades. Operating time diukur dengan spektrofotometer visibel. Pengukuran dilakukan pada panjang gelombang teoritis hasil reaksi floroglusinol dengan Folin Ciocalteau (750 nm).
c. Penentuan Panjang Gelombang Maksimum ( maks)
Pipet 0,5 mL larutan intermediet (0,01; 0,03; dan 0,06) ppm dan masukkan ke dalam labu takar 50,0 mL yang mengandung 2,5 mL pereaksi fenol Folin-Ciocalteau yang telah diencerkan dengan akuades 1:1. Didiamkan selama 2 menit, kemudian ditambahkan 7,5 mL Na2CO3 1,9 M, dicampurkan sampai volume 50,0 mL dengan akuades. Campuran tersebut diinkubasi pada suhu kamar selama OT (pada 15 menit pertama dan 15 menit kedua, campuran tersebut divortex selama 30 detik). Kemudian campuran reaksi disentrifus dengan kecepatan 4000 rpm selama 5 menit. Kemudian ketiga larutan tersebut di-scanning pada rentang panjang gelombang 400-900 nm dengan spektrofotometer visibel untuk melihat panjang gelombang maksimumnya.
6. Validasi Metode Analisis
kemudian ditambahkan 7,5 mL Na2CO3 1,9 M, dicampurkan sampai volume 50,0 mL dengan akuades. Campuran tersebut diinkubasi pada suhu kamar selama OT untuk menyempurnakan reaksi sampai terbentuk warna biru (pada 15 menit pertama dan 15 menit kedua, campuran tersebut divortex selama 30 detik). Kemudian campuran reaksi disentrifus dengan kecepatan 4000 rpm selama 5 menit dan diukur absorbansinya pada panjang gelombang maksimum hasil
scanning ( maks) menggunakan spektrofotometer visibel. Ditentukan persamaan kurva baku plot antara kadar baku floroglusinol dan absorbansi. Replikasi dilakukan sebanyak 3 kali untuk dihitung recovery, kesalahan sistematik, kesalahan acak dengan rumus sebagai berikut:
Recovery =
Kesalahan sistematik = 100 % – recovery
Kesalahan acak =
7. Pengukuran Kadar Polifenol Total
a. Perlakuan pada larutan standar floroglusinol
pada suhu kamar selama OT untuk menyempurnakan reaksi sampai terbentuk warna biru (pada 15 menit pertama dan 15 menit kedua, campuran tersebut divortex selama 30 detik). Kemudian campuran reaksi disentrifus dengan kecepatan 4000 rpm selama 5 menit dan diukur absorbansinya pada panjang gelombang maksimum hasil scanning ( maks) menggunakan spektrofotometer visibel.
b. Perlakuan fraksi etil asetat alga merah
F. Analisis Hasil
Analisis hasil dilakukan untuk mengetahui validitas metode yang digunakan dalam penelitian. Validitas metode dilihat dari beberapa parameter dengan mengacu rentang nilai yang dipersyaratkan Harmita (2004), sebagai berikut:
1. Akurasi
Akurasi dinilai berdasarkan hasil perolehan kembali (recovery) dan kesalahan sistematik. Akurasi dikatakan baik jika nilai perolehan kembali rata-rata (mean recovery) berada dalam rentang 80-110 % jika konsentrasi analit yang diperiksa adalah 1 ppm (0,0001 %) dengan nilai kesalahan sistematik yang diterima <20 % (Harmita, 2004). Recovery dan kesalahan sistematik dihitung dengan rumus sebagai berikut:
Kesalahan sistematik = 100 % – recovery
2. Presisi
31 BAB IV
HASIL DAN PEMBAHASAN
A. Pengambilan Sampel
Sampel alga merah didapat dari hasil panen petani setempat pada tanggal 21 Mei 2007 dari perairan dangkal pantai Drini, Gunung Kidul, Yogyakarta. Secara geografis berada di wilayah samudera Indonesia, pantai selatan pulau Jawa. Suhu perairan habitat laut alga sekitar 27-30 0C. Umur alga merah yang dipanen tidak diketahui pasti karena bukan merupakan hasil budidaya melainkan merupakan hasil panen langsung dari alam, meski informasi tentang perbedaan umur, masa panen, kondisi geografis habitat alga tumbuh dan spesies alga ini penting untuk diperhatikan karena dapat memberikan variasi kandungan polifenol alga.
Selanjutnya jenis spesies alga merah yang didapat diidentifikasi dengan bantuan dari pihak laboratorium Sistematika Tumbuhan (Fakultas Biologi UGM, Yogyakarta). Hasil identifikasi, sampel alga merah termasuk dalam ordo Ceramiales, familia Rhodomelacaeae, genus Laurencia, spesies Laurencia papillosa (Forskal) Graville (lihat lampiran 1).
terbawa dan mengotori sampel alga merah. Langkah pencucian ini perlu dilakukan dengan cermat agar pengotor tidak mengotori sampel yang ingin diteliti.
Senyawa silikat juga dapat membentuk kompleks molibdat dari reagen Folin dalam suasana asam. Bentuk kompleks asam molibdat yang terbentuk H6[SiMo12O40].n H2O (Auterhoff & Knabe, 1978). Setelah itu, dilakukan langkah sortasi atau penyortiran terhadap alga yang dipanen agar materi dari jenis alga spesies lain atau bahan organik asing tidak tercampur dengan sampel alga merah karena alga tumbuh bersama-sama dalam satu habitat dengan alga atau rumput laut yang berbeda spesies juga, tidak hanya dalam bentukan populasi. Sampel yang didapat benar-benar merupakan alga merah Laurencia papillosa (Forskal) Graville dilihat dari ciri morfologisnya. Bagian akar alga dibuang dengan pisau atau gunting karena alga umumnya berakar pada suatu karang sehingga bagian akarnya dibuang agar materi asing dari batu karang tidak ikut dan mengganggu hasil analisis. Secara umum tujuan sortasi untuk meminimalkan keberadaan materi organik asing karena materi organik maupun organic dust ini dapat menggangu hasil analisis.
Selain itu, pada pengamatan saat dilakukan sortasi terdapat senyawa berupa kalsium seperti butiran kapur berwana putih yang melingkupi daerah sekitar thallus alga, kalsium ini merupakan produk alamiah alga yakni hasil kalsifikasi. Kalsium yang masih ada setelah dilakukan sortasi tidak akan mengganggu analisis. Senyawa Ca ini bukanlah reduktor sehingga praktis tidak mampu memiliki kemampuan mereduksi kompleks asam molibdat-fosfat pada reagen Folin-Ciocalteau yang digunakan.
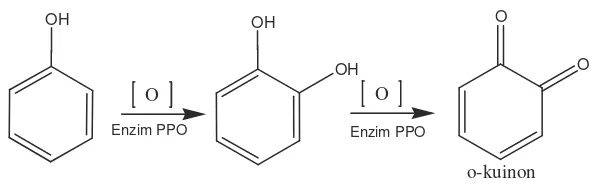
Setelah lolos proses sortasi maka ganggang merah diproses dalam autoklaf selama 30 menit pada suhu 100 0C untuk mendenaturasi protein yang ada dalam ganggang termasuk enzim polifenol oksidase atau Polyphenol Oxydase (PPO). Efek perlakuan panas terhadap aktivitas PPO menunjukkan pemberian suhu menyebabkan meningkatnya kecepatan reaksi antara enzim dan senyawa fenolik sebagai substratnya. Perlakuan pada 55 0C, membuat enzim inaktif secara parsial. PPO telah dilaporkan menjadi inaktif dengan direbus dalam air panas pada 100 0C selama 1,5 menit (Mustapha & Ghalem, 2007).
O
Gambar 6. Proses oksidasi fenol oleh enzim polifenol oksidase (PPO)
Hasil autoklaf dijadikan simplisia dengan cara dikeringkan dalam oven selama beberapa hari pada suhu 90 0C, agar menjadi simplisia alga merah kering dengan tingkat kekeringan tertentu sehingga mudah untuk dihancurkan dengan tangan kemudian diserbuk dengan alat blender bermotor. Alga harus benar-benar kering agar didapat partikel yang serbuk yang cukup halus. Kadar air atau lembab yang semakin rendah maka sel-sel tanaman alga menjadi lebih rapuh terhadap kekuatan mekanis mesin blender sehingga lebih mudah untuk dihaluskan menjadi serbuk. Derajat kehalusan serbuk yang diambil 20/30 dengan cara pengayakan agar diperoleh ukuran partikel serbuk yang lebih homogen dan partikel yang tidak terlalu besar atau kecil.
Ekstraksi akan bertambah baik bila luas permukaan area spesifik serbuk simplisia yang kontak dengan cairan penyari semakin luas sehingga meningkatkan efisiensi ekstraksi serbuk simplisia alga. Sementara partikel serbuk yang terlalu halus juga tidak menguntungkan karena dapat menyebabkan
dan sensitif untuk mengukur sampel dalam jumlah yang sedikit serta akurat. Kadar air dari serbuk alga merah yang terukur dengan metode ini:
• Replikasi I : 8,53%
• Replikasi II : 6,00 %
• Replikasi III : 5,97 %
Hasil penetapan kadar air adalah 6,83 ± 1,469 %, masih memenuhi syarat atau masih di bawah 10 % sehingga dapat diterima sebagai simplisia kering untuk selanjutnya diekstraksi dengan cara sokhletasi. Hasil penetapan kadar air pada replikasi I berbeda jauh dari kadar yang didapat pada replikasi II dan III dimungkinkan oleh sampel yang menyerap lembab sebelum dilakukan analisis dengan Karl Fischer. Penetapan kadar air dengan metode Karl Fischer berdasar atas reaksi redoks antara SO2 dan I2 menghasilkan garam asam hidroiodat dan garam alkil sulfat. Reaksi redoks ini hanya berlangsung dengan adanya air seperti gambar 7, reaksi di bawah ini (Evans, 2002).
Gambar 7. Reaksi saat penetapan kadar air dengan Karl Fischer
ganggang sebagaimana yang disyaratkan dalam MMI (Materia Medika Indonesia) untuk simplisia tanaman umumnya.
B. Hasil Uji Kualitatif
1. Uji pendahuluan
Pada prosedur pengujian ini filtrat alga ditambah air, dipanaskan selama 30 menit untuk menarik semua senyawa yang cukup polar termasuk polifenol yang larut air. Larutan disaring dengan kapas agar bagian yang tak larut air tidak mengotori analit. Hasil berwarna kuning sampai merah menunjukkan adanya senyawa yang mengandung kromofor (flavonoida, antrakuinon, senyawa fenolik lainnya) dengan gugus hidrofilik (gula, asam, fenolat, dan sebagainya).
Hasil diperkuat dengan penambahan KOH, warna larutan menjadi lebih intensif. Karena senyawa fenolik mudah sekali teroksidasi dalam basa yang membuat warna lebih intensif seperti reaksi pada gambar 8 di bawah (Krumholz & Bryant, 1988).
OH
OH
HO KOH
OH
OH HO
HO
Gambar 8. Reaksi uji pendahuluan senyawa floroglusinol dan KOH
memiliki banyak gugus-gugus fenolik dengan floroglusinol sebagai monomer. Hasil pengamatan sampel serbuk Laurencia papillosa (Forskal) Graville menunjukkan hasil positif mengandung senyawa fenolik, seperti tabel I berikut.
Tabel I. Hasil uji pendahuluan kandungan senyawa fenolik
Laurencia papillosa (Forskal) Graville
Perlakuan Warna hasil reaksi Pemanasan 30 menit
+ KOH
kuning pucat (+) kuning lebih gelap (+)
2. Uji polifenol
Sebanyak 1 mL filtrat alga ditambah 3 tetes pereaksi besi (III) klorida. Jika terjadi warna hijau-biru menunjukkan adanya polifenol. Hal ini disebabkan oleh terbentuknya kompleks ion Fe3+ dan gugus-gugus fenol yang membentuk kompleks warna hijau-biru seperti pada gambar 9 (Krumholz & Bryant, 1988).
O
Gambar 9. Reaksi pembentukan kompleks gugus fenolik dan FeCl3
sampel serbuk Laurencia papillosa (Forskal) Graville menunjukkan hasil positif mengandung senyawa polifenol, seperti tabel II berikut.
Tabel II. Hasil uji kandungan senyawa polifenol Laurencia papillosa (Forskal) Graville
Warna sebelum reaksi
Warna sesudah reaksi Kuning pucat Biru gelap di bagian
tengah (+)
3. Uji tanin (zat samak)
Penambahan NaCl 2 % dimaksudkan untuk menghilangkan protein agar tidak terjadi reaksi positif palsu sehingga jika terjadi endapan protein maka disaring. Kemudian filtrat alga diberi gelatin jika hasil positif akan membentuk endapan karena tanin mampu menyamak kulit.
Terbentuknya endapan menunjukkan adanya tanin yang inkompatibel dengan gelatin dalam HCl atau NaCl. Tanin memiliki afinitas yang kuat terhadap gelatin sehingga gelatin mengalami presipitasi (Thomas & Frieden, 1923). Alasan dilakukan uji tanin karena secara kimia tanin dan florotanin mirip sehingga florotanin dapat memberikan hasil positif juga terhadap uji tanin. Hasil pengamatan sampel serbuk Laurencia papillosa (Forskal) Graville menunjukkan hasil positif mengandung senyawa tanin, ada sedikit endapan putih di dasar.
C. Isolasi Florotanin Kasar
dapat ditarik dalam ekstrak metanol. Total lama proses sokhletasi selesai dilakukan selama 34 jam dan 5 menit ditandai dengan jernihnya metanol yang menyari serbuk alga di tabung sokhlet. Setelah selesai, hasil sokhletasi diuapkan pelarutnya dengan menggunakan vacuum rotary evaporator sampai volume yang kecil (1/10 dari volume mula-mula) agar diperoleh ekstrak yang lebih pekat konsentrasinya. Ekstrak metanol pekat ditambahkan metanol hasil kondensasi
vacuum rotary evaporator hingga diperoleh 60 mL ekstrak metanol agar diperoleh proses fraksinasi dengan komposisi pelarut yang konstan.
Selanjutnya ekstrak metanol ditambah 120 mL kloroform, dan 45 mL air. Terjadi pemisahan 2 lapisan antara lapisan atas dengan berat molekul (BM) lebih ringan yakni fraksi metanol-air yang membentuk ikatan hidrogen dan lapisan bawah adalah kloroform. Metanol-air lebih mudah menarik fraksi relatif polar seperti florotanin sehingga yang diambil adalah lapisan atas.
Alasan pemilihan pelarut metanol karena metanol memiliki gugus hidroksil yang memungkinkan membentuk ikatan hidrogen intramolekuar dengan gugus hidroksil yang ada pada senyawa fenolik dan meningkatkan kelarutan polifenol dalam pelarut metanol. Sementara pelarut non polar seperti kloroform, digunakan untuk membuang lipid pada ekstrak metanol (Padda, 2006).
diperoleh florotanin kasar yang akan menjadi analit untuk ditetapkan kadar polifenol totalnya dengan menggunakan reagen fenolik Folin-Ciocalteau.
D. Dasar Reaksi Kolorimetri dengan Folin-Ciocalteau
Reagen yang digunakan adalah Folin-Ciocalteau (F-C) yang dalam kondisi stabil sebelum reaksi berwarna kuning dalam suasana asam. Reaksi F-C ini melibatkan reaksi antara ion fenolat dengan kompleks ion polimerik dari asam-asam fosfomolibdat dan fosfotungstat (Anonim, 2006).
Warna biru produk berasal dari oksidasi fenolat, dan asam heteropoli tereduksi secara parsial dari +6 menjadi campuran kondisi valensi +6 dan +5 menghasilkan produksi kompleks molibdenum-tungsten biru (Singleton & Rossi, 1965). Bagian reagen yang paling aktif dari reagen ini adalah molibdat sehingga kompleks warna yang terbentuk disebut molybdenum blue.
Dalam bentuk tunggal, molibdat akan menjadi sukar larut dan membentuk koloidal (Auterhoff & Knabe, 1978). Oleh karena itu, molibdat dicampur dalam bentuk garam NaMolibdat dan diberikan asam fosfat (H3PO4) membentuk kompleks asam fosfomolibdat. Selain kompleks dengan fosfat, diketahui bahwa senyawa seperti arsenat, wolframat, silikat juga mampu membentuk kompleks asam dengan molibdat. Misalnya, jika membentuk kompleks dengan arsen maka kompleks asam yang terbentuk disebut arsenomolibdat.
(Singleton & Rossi, 1965). Asam heteropoli yang ada pada reagen F-C adalah asam tungstat dan asam molibdat.
Kenyataanya reagen ini mengandung seri atau rangkaian polimerik yang memiliki bentukan umum dengan pusat atau sentral unit tetrahedral fosfat (PO43-) dikelilingi oleh beberapa unit oktahedral asam-oksi molibdenum. Struktur tungsten dapat dengan bebas bersubstitusi dengan molibdenum (Singleton & Rossi, 1965).
Florotanin berupa polimer dengan unit monomernya floroglusinol memiliki 3 gugus hidroksil. Gugus hidroksil ini cukup reaktif dan merupakan pengarah orto, para dalam proses sintesis. Ketiga gugus hidroksil floroglusinol berada pada posisi meta, sehingga posisi orto dan para masih kosong dan akan mudah dioksidasi sehingga posisi posisi para, orto terisi oleh gugus hidroksil juga. Florotanin dan polifenol lainnya sangat tidak stabil dalam kondisi basa karena akan teroksidasi membentuk ion fenolat (C6H6O-) dan berlanjut akan membentuk senyawa kuinoid yang dapat membuat warna pigmen semakin intens biasanya berwarna kecoklatan.
Susana basa saat reaksi diberikan oleh natrium karbonat, sehingga semua senyawa fenolik akan teroksidasi menjadi ion fenolat. Dan ion fenolat inilah yang akan mereduksi kompleks asam heteropoli dari fosfotungstat dan fosfomolibdat membentuk produk berwarna biru.
Reduksi yang sempurna dari reagen ke status valensi yang lebih rendah merusak warna asalnya. Sifat alamiah sesungguhnya dari complex blue pigments
ini digunakan dalam analisis sebagai metode kolorimetri yang sudah lama diketahui (Singleton & Rossi, 1965). Warna biru yang dihasilkan setara dengan konsentrasi fenolat yang terbentuk artinya semakin besar konsentrasi senyawa fenolik maka semakin banyak pula ion fenolat yang terbentuk dan reagen F-C semakin rusak oleh reduktor dan warna biru yang dihasilkan semakin pekat setara dengan konsentrasi ion fenolat sehingga dapat dianalisis dengan spektrofotometer. Kompleks asam dari reagen F-C ini akan tereduksi membentuk produk yang berwarna dengan adanya suatu reduktor. Reagen F-C sendiri dapat bertindak sebagai agen pengoksidasi (oksidator).
Reaksi Reduksi asam fosfomolibdat: Saat analisis terjadilah kesetimbangan reaksi redoks dari reagen F-C dan senyawa fenolik (gambar 10).
Gugus fenol teroksidasi dengan cepat dalam larutan cukup basa dan menghasilkan ion-ion fenolat dalam konsentrasi cukup. Reagen F-C dan pigmen biru yang terbentuk tidak stabil dalam larutan basa. Reaksi melibatkan pengrusakkan reagen kuning yang aktif. Kebanyakan senyawa fenolik terionisasi sekitar 50 % pada pH 9-10. Karena porsi yang terionisasi bereaksi dengan reagen folin kesetimbangan akan bergeser dan akan lebih banyak lagi fenolat yang dihasilkan. Dibutuhkan waktu untuk reaksi ini untuk dapat mendekati sempurna. Reagen F-C harus tetap bertahan dalam kondisi basa, agar dapat bereaksi dengan semua fenolat. Untuk pertimbangan ini dibutuhkan kondisi optimum untuk alasan produksi reaksi yang cepat dan retensi waktu yang panjang untuk warna maksimum akan mencakup pertimbangan reagen fosfo-molibdo-tungstat kadar tinggi dan alkalinitas yang sedang (Singleton & Rossi, 1965).
Terdapat banyak variasi dalam penggunaan metode Folin-Ciocalteau ini sendiri. Variasi yang ada mencakup perbedaan dalam pemilihan referensi standar, lama pemanasan reaksi, suhu, dan perbedaan hasil pengukuran panjang gelombang (Anonim, 2006). Referensi standar yang umum digunakan untuk analisis kandungan polifenol adalah asam galat, asam tanat, keursetin yang umum digunakan untuk sampel flavonoid dan floroglusinol.
gelombang 750 nm atau adanya kesamaan karakteristik antara florotanin dengan baku floroglusinol saat direaksikan dengan reagen F-C.
E. Optimasi Metode Kolorimetri dengan Folin-Ciocalteau
1. Penetapan Operating Time (OT)
Penentuan Operating Time (OT) sangat penting dalam pengukuran dengan metode analisis menggunakan prinsip kolorimetri karena warna hasil reaksi yang dihasilkan tidak selamanya stabil. Maka dari itu, perlu dicari rentang waktu setelah reaksi berlangsung agar hasil yang didapat memberikan absorbansi yang tetap stabil tidak menaik atau menurun nilainya agar data yang dihasil tetap reprodusibel dan valid.
ABSORBANCE
0,100 0,200 0,300 0,400 0,500 0,600
Gambar 11. Hasil pembacaan OT floroglusinol kadar 3,0 ppm dengan pereaksi Folin Ciocalteau
2. Penentuan Panjang Gelombang Maksimum ( maks)
panjang gelombang maksimum akan memberikan sensitivitas dan presisi analisis yang maksimal (Mulja & Suharman, 1995).
Zhang et al. (2006) telah melakukan penelitian tentang estimasi kandungan polifenol total pada sampel rumput laut dan ekstraknya berdasarkan reaksi Folin-Ciocalteau. Mereka mendapatkan panjang gelombang maksimum untuk standar floroglusinol dan sampel A. nodosum adalah 750 nm. Karena itu, penentuan maks dilakukan pembacaan absorbansinya pada rentang 400-900 nm agar dapat melihat puncak spektrum yang lebih jelas di sekitar 750 nm sebagai panjang gelombang teoritis.
Digunakan 3 macam kadar baku floroglusinol untuk mengetahui panjang gelombang maksimum yakni dengan membaca spektrum plot panjang gelombang dan absorbansi senyawa hasil reaksi antara reagen Folin-Ciocalteau dengan baku floroglusinol kadar kecil 0,1 ppm, kadar tengah 0,3 ppm, kadar terbesar 0,6 ppm. Hasil yang didapat menunjukkan 3 puncak absorbansi maksimum pada panjang gelombang yang berbeda, yakni pada 0,1 ppm didapat maks 758,7 nm; 0,3 ppm didapat maks 750,1 nm; dan 0,6 ppm didapat maks 743,4 nm.
Pada konsentrasi kecil, dengan suasana basa tetap dari Na2CO3 1,9 M maka lebih mudah mengoksidasi floroglusinol menghasilkan ion fenolat yang memiliki muatan negatif penuh pada oksigen (ion fenolat), yang dapat berinteraksi dengan cincin lebih efektif dari pasangan elektron bebas yang ada pada molekul tak terionkan sehingga meningkatkan intensitas absorpsi cahaya dan posisi maks berpindah ke panjang gelombang lebih panjang (Cairns, 2005).
λ (wavelength)
Gambar 12. Hasil pembacaan maks floroglusinol 3 macam kadar floroglusinol: 1,0;
3,0 dan 6,0 ppm setelah direaksikan dengan Folin Ciocalteau
karena paling mendekati maks teoritis 750 nm, hasil reaksi floroglusinol dengan reagen Folin-Ciocalteau (Zhang et al., 2006). Sesungguhnya tidak ada panjang gelombang maksimal teoritis yang pasti untuk mengukur sampel florotanin karena bukan merupakan senyawa tunggal tetapi merupakan campuran heterogen polimer polifenol dengan unit monomer berupa floroglusinol.
F. Hasil Validasi Metode Analisis
Untuk mengetahui validitas metode Folin-Ciocalteau, maka dilakukan penetapan terhadap baku floroglusinol dengan replikasi sebanyak 3 kali pada panjang gelombang yang dipilih 750,1 nm dan didapat 3 persamaan kurva baku yang berbeda sebagai berikut:
Tabel III. Data replikasi seri baku floroglusinol
Replikasi I Replikasi II Replikasi III
Kadar
(degrees of freedom) 5, yaitu 0,811 dan memenuhi persyaratan yaitu r hitung = 0,9996 (lebih besar dari 0,999). Hal ini berarti semua persamaan kurva baku tersebut mempunyai parameter linearitas yang baik dan dapat digunakan untuk menetapkan kadar florotanin dalam fraksi etil asetat Laurencia papillosa (Forskal) Graville.
Parameter yang digunakan untuk menentukan validitas metode dalam penelitian ini adalah recovery, kesalahan sistematik dan kesalahan acak baku floroglusinol. Recovery dan kesalahan sistematik adalah parameter akurasi sedangkan kesalahan acak adalah parameter presisi. Berikut hasil mean recovery
atau rata-rata recovery, rata-rata kesalahan sistematik, dan kesalahan acak atau CV yang didapat:
Tabel IV. Hasil validasi metode Folin-Ciocalteau
Kadar teoritis
Hasil perhitungan recovery dari tabel IV menunjukkan bahwa rata-rata
80 – 110% (Harmita, 2004). Berdasarkan hasil ini berarti semua seri kadar memenuhi kriteria recovery yang baik.
Kesalahan sistematik merupakan parameter lain untuk akurasi selain
recovery. Nilai kesalahan sistematik yang baik dapat ditentukan dari rentang
recovery dengan rumus: |P – 100%|, dengan P adalah nilai recovery. Rentang
recovery yang baik adalah 80 – 110% dan berdasarkan rumus di atas didapatkan nilai kesalahan sistematik yang baik adalah 20%. Perhitungannya adalah sebagai berikut : |80 % - 100 %| = 20 % dan |110 % - 100%| = 10 %.
Hasil perhitungan kesalahan sistematik pada tabel IV menunjukkan nilai rata-rata kesalahan sistematik untuk semua seri kadar < 20 % atau memenuhi kriteria kesalahan sistematik yang baik.
Hasil perhitungan kesalahan acak pada tabel IV menunjukkan bahwa seri kadar 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 ppm memiliki nilai CV < 4,1 % yang disyaratkan untuk analisis yang baik dengan rentang recovery 85-115 % menurut sistem RSD (Relative Standard Deviation) (Harmita, 2004). Hanya kadar 0,5 ppm yang tidak memenuhi syarat karena CV-nya cukup besar yakni 11,69 %. Sementara menurut Mulja dan Hanwar (2003) presisi yang baik dinyatakan dengan nilai CV < 2 %, sehingga hanya 1 seri kadar yang memenuhi kriteria presisi yang baik, yaitu seri kadar 0,2 ppm yang memenuhi syarat ini.
ini karena harus memipet volume yang cukup kecil 0,5 mL dari larutan stok baku sehingga risiko faktor kesalahannya paling besar.
Persamaan kurva baku yang dipilih berdasar hasil recovery, kesalahan sistematik, kesalahan acak terbaik untuk penetapan kadar sampel adalah persamaan kurva baku replikasi I, yang paling baik dibandingkan replikasi II dan III. Persamaan ini dipilih karena nilai r-nya paling mendekati 1 dan intersep yang paling kecil. Nilai r yang mendekati 1 berarti ada korelasi antara peningkatan konsentrasi hasil reaksi floroglusinol dengan Folin-Ciocalteau dan kenaikan nilai respon absorbansi.
Hubungan antara kadar floroglusinol dan nilai absorbansi dari persamaan baku yang dipilih (replikasi I) disajikan pada gambar 13 di bawah ini:
y = 1,265x + 0,0091