MAKALAH PADA SEMINAR NASIONAL KIMIA DAN PENDIDIKAN KIMIA 2012 Jurusan Kimia Universitas Jenderal Sudirman, 6 Oktober 2012
REAKSI BROMINASI ASETON SEBAGAI REAKSI MIRIP ENZIMATIS Patiha1, Tri Martini2, Edi Pramono3
E-mail: patiha31@yahoo.co.id
1,2,3
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret
ABSTRAK
Tujuan penelitian ini adalah untuk mempelajari kemungkinan penggunaan reaksi brominasi aseton sebagai model reaksi enzimatis Michaelis-Mentenis.
Percobaan dilakukan dengan mengikuti perubahan absorbansi Br2 (secara spektrofotometri pada panjang gelombang 400 nm) sebagai fungsi waktu pada kondisi konsentrasi awal aseton dan asam khlorida yang berlebihan dari bromium. Pada setiap lakuan, konsentrasi awal asam khlorida dibuat bervariasi sedang aseton dan bromium tetap. Pengamatan dilakukan hingga absorbansi bromium tersisa sekitar 10%. Data dibagi menjadi 2 bagian; masing-masing 7 di awal dan di akhir reaksi. Hukum laju, pada awal dan akhir reaksi, ditentukan dengan menggunakan persamaan integral untuk kemungkinan reaksi order ke nol, satu, satu setengah, dan dua. Hukum laju ditentukan dengan analisis regresi linear; hukum laju adalah yang memberikan koefiisien regresi yang paling mendekati ±1. Reaksi dikatakan mirip jika pada awal, reaksi mengikuti hukum laju order semu ke-nol dan pada akhir, ke-satu. Laju maksimum diperoleh dari lereng kurva hukum laju order ke-nol dan selanjutnya digunakan untuk menghitung tetapan Michaelis-Menten melalui substitusi pada lereng kurva hukum laju order ke-satu. Data juga dianalisis menggunakan persamaan (diferensial) Lineweaver-Burk dan Eadie-Hofste dan persamaan (integral) Espenson (1995) dan diperbandingkan.
Hasil percobaan menunjukkan bahwa pada konsentrasi awal asam khorida 0,005 dan 0,010 M, bromium 0,010 M, dan aseton 0,800 M, reaksi ini mirip reaksi enzimatis Michaelis-Mentenis. Diperoleh pula bahwa, tetapan Michaelis-Menten tidak dapat diperoleh dari satu eksperimen dan bahwa, ketiga persamaan tidak memberikan hasil yang konsisten.
ABSTRACT
The purpose of this research is to study of the possible use of bromination of acetone as a model of enzymatic reaction of Michaelis-Menten.
The experiments are performed by following the bromium absorbance changes (using a spectrophotometer at wavelength 400 nm) as a function of time under conditions of initial concentrations of acetone and hydrochloric acid are in excess of bromium. At each experiment, the concentration of hydrochloric acid is varied while acetone and bromium are constant. Observations are made until bromium absorbance about 10%. Data are divided into two parts, each 7 at the beginning and at the end of the reaction. Rate laws (at the beginning and end of the reaction) are determined using the integral equation for the possible reaction order of zero, first, one and a half, and second. Rate law is determined by linear regression analysis; the rate law is that gives regression coefficient closest to ± 1. Said to be similar if, at the beginning, reaction is of the zero order, and at the end, is of the first order. The maximum velocity is obtained from the slope of the zero order rate law and then used to determine the Michaelis-Menten constant by substituting it into the slope of the first order rate law. Data are also analyzed using the (differential) equations of Lineweaver-Burk and Eadie-Hofstee and (integral) equation of Espenson (1995) and compared.
The experimental results showed that at the initial concentration of hydro chloride acid 0,050 and 0,100 M, bromium 0,010 M, and acetone 0,800 M, this reaction is similar to enzymatic reaction of Michaelis-Menten. Also obtained that, Michaelis-Menten constant cannot be obtained from one experiment and all the three equations, do not give consistent result.
PENDAHULUAN
Enzim adalah katalis pada proses kimia mahluk hidup. Ada beberapa tipe mekanisme reaksi enzimatis; yang paling sederhana, yaitu yang dikenal sebagai reaksi enzimatik Michaelis-Mentenis, dipercayai berlangsung menuruti mekanisme reaksi
k1 k2
E + S ⇌ ES → E + P [1] [1]
k –1
Briggs-Haldane (1925) membuktikan bahwa, dengan menggunakan Pendekatan Keadaan Mantap pada [ES], hukum lajunya dapat dinyatakan sebagai
] [ / ) ( ] ][ [ 1 2 1 2 S k k k S E k v [2] Selanjutnya, jika (k-1 + k2)/k1= KM [3]
maka [2] akan menjadi
] [ ] ][ [ S K S E k v M kat [4]
KM adalah tetapan Michaelis-Menten.
Pola hubungan semacam [4] ini hiperbolik; reaksi belum mempunyai order reaksi yang pasti. Pada [S] yang cukup
besar (dari KM), hubungan ini berubah, dan
[4] akan menjadi ] [E k
v kat [5]
Pada kondisi ini, semua enzim yang ada, dianggap bereaksi dengan substrat, sehingga
v mencapai harga maksimum (yang
selanjutnya disebut vmax) dan reaksi
menuruti mekanisme reaksi order ke-nol atau
] [E k
vmaks kat [6]
Tetapi, pada konsentrasi substrat [S] yang cukup kecil (dari KM), reaksi akan
berlangsung menuruti mekanisme reaksi order ke-satu terhadap S dan [4] akan menjadi M kat K S E k v [ ][ ] [7]
Substitusi persamaan [6] ke dalam [7] akan menghasilkan M maks K S v v [ ] [8]
Fenomena di atas cukup menarik. Berbeda dengan reaksi yang biasanya diperkenalkan pada pemula, reaksi semacam ini mengikuti hukum laju yang berbeda pada awal dan akhir reaksi. Karena itu, adalah penting bagi mahasiswa untuk melakukan
percobaan kinetika reaksinya. Akan tetapi, karena harga enzim sangat mahal dan mudah rusak, tentulah agak sulit untuk mewujudkannya. Implikasinya, perlu untuk mencari reaksi yang mirip, dengan pereaksi yang murah, mudah diperoleh, dan relatif mudah percobaannya. Reaksi brominasi aseton diharapkan akan dapat memenuhi kriteria ini. Sebenarnya, studi kinetika reaksi ini telah dilakukan pada awal perkembangan ilmu kimia, dan sering kali digunakan sebagai model percobaan kinetika reaksi. Tetapi, hanya diperlakukan sebatas sebagai model reaksi sederhana.
Pada temperature kamar, reaksi brominasi aseton menuruti persamaan reaksi
P A H Br Br CH O C CH Br CH O C CH3 ( ) 3 2 3 ( ) 2 [9] dipercayai berlangsung melalui mekanisme reaksi k1 I k A CH OH C CH H CH O C CH 1 3 3 3 3 ( ) [ ( ) ] E k I O H CH OH C CH O H CH OH C CH k 2 3 3 2 3 3 2 ] ) ( [ ] ) ( [ [10] k3 P E Br H Br CH O C CH Br CH OH C CH3 ( ) ] 2 3 ( ) 2 [
Berdasarkan Pendekatan Keadaan Mantap, hukum lajunya adalah
] [ ] [ ] ][ ][ [ / ] [ 2 3 2 2 1 1 2 3 Br k H k Br H A k k k k dt P d [11]
Karena Br2 berwarna, studi kinetika
reaksinya pada umumnya dilakukan dengan mengikuti perubahan [Br2] sebagai fungsi
waktu pada kondisi [H+] dan [A] yang relatif berlebihan terhadap [Br2]. Penentuan hukum
lajunya biasanya menggunakan metode laju awal dan didapati bahwa, reaksi masing-masing order ke-satu terhadap [A] dan [H+] dan ke-nol terhadap [Br2]. Ini berarti, k3[Br2]
jauh lebih besar dari k-2[H+]. Dilaporkan
juga bahwa, pada kondisi [H+] yang sangat tinggi, reaksi tingkat ke-satu terhadap [Br2]
(Zucker and Hammet, dalam Patiha, 2011). Namun yang terakhir ini diduga sulit dilakukan karena, kenaikan [H+] dua kali, akan menyebabkan reaksi menjadi dua kali lebih cepat. Tetapi, adalah mungkin terjadi bahwa konsentrasi [H+] tertentu, reaksi ini akan berlangsung dengan mekanisme yang berbeda pada awal dan akhir reaksi.
] [ ] )[ / ( ] ][ ][ )[ / ( ] [ 2 3 2 2 1 1 2 Br H k k Br H A k k k dt P d [12] Selanjutnya, (karena [A] sangat berlebihan dan [H+] relatif tetap) maka jika
k2k1[A][H+]/ k-1 = k* [13]
dan
(k-2 / k3)[H+]= κ [14]
maka [12] akan menjadi
] [ ] [ ] [ 2 2 * Br Br k dt P d [15]
Jika k* dianggap sebagai υmaks dan κ sama
dengan KM, maka [15] menjadi mirip
dengan [4].
Pada prinsipnya harga KM dapat
ditentukan langsung dari [4], Tetapi yang paling umum adalah dengan mengunakan model linear. Lineweaver-Burk (1934; 658) membalik persamaan [4] dan memperoleh
] [ 1 1 S v K v v maks M maks [16]
Harga vmaks dapat dihitung dari intersep
sedang KMdari lereng kurva linear 1/v lawan
1/[S]. Untuk keperluan ini umumnya digunakan metode laju awal.
Cara yang lain adalah dengan menggunakan persamaan Eadie (1942) - Hofstee (1959) -yang juga merupakan modifikasi dari [4]- yaitu
] [S v K v v M maks [17]
Harga vmaks dapat dihitung dari intersep
sedang KM dari lereng kurva linear v lawan
v/[S]. Untuk keperluan ini juga umumnya digunakan metode laju awal. Dowed dan Riggs ((1965: 863) dan Atkins dan Nimmo (1975) menyatakan bahwa persamaan [17] lebih tepat dan superior dari yang [16].
Espenson (1995: 34-35) menyatakan bahwa kinetika reaksi enzimatis, dan secara umum, reaksi yang mempunyai hukum laju yang mirip dengannya ([15]), dapat dipelajari dengan menggunakan persamaan tenggang-tetap (time-lag) k A A A A t t t t ] [ ] [ ln ] [ ] [ [18]
Persamaan [18] diturunkan dengan mengintegralkan persamaan [15]. Dalam praktek, reaksi diamati pada tiap tenggang waktu tetap hingga reaksi berlangsung kira-kra 90%. Data kemudian dipasangkan dengan tenggang waktu σ yang sama. Harga κ dapat dihitung dari lereng kurva linier [At
Paling tidak, ada 5 hal yang berkaitan dengan ketiga persamaan di atas yang menarik untuk dikaji lebih lanjut. Pertama, ketiganya merupakan persamaan linier tetapi tidak mempersyaratkan uji linieritas. Kedua, laju maksimum hanya bisa tercapai jika [S]o (jauh) lebih besar dari KM, tetapi ketiganya
tidak mempersyaratkan kondisi awal reaksi. Patiha (2009) menyatakan bahwa persamaan
Lineweaver-Burk dan Eadie-Hofstee
sebenarnya tidak berlaku jika v = vmaks
karena pada kondisi ini harga KM akan sama
dengan 0. Selain dari itu, persamaan Lineweaver-Burk akan tampak bersanggah dengan persamaan Patiha (2009) -yang dikembangkan dari hasil membalik persamaan [8]. Persamaan ini menghasilkan harga yang pada dasarnya sama dengan yang diperoleh dari persamaan Lineweaver-Burk, tetapi tetap berlaku pada v = vmaks dan
menghasilkan harga yang sama dengan yang diperoleh dari persamaan integral. Ketiga, berdasarkan [5], reaksi order ke-satu terha-dap enzim, tetapi harga KM cukup ditentukan
dari 1 data. Keempat, Espenson mengklaim bahwa hasil yang diperoleh bila menggunakan persamaannya, relatif sama dengan yang mengunakan persamaan diferensial (1995) tetapi Patiha (2006) menyatakan bahwa, kecuali untuk reaksi order ke-nol, tetapan (laju) yang diperoleh
dari persamaan diferensial tidak akan sama dengan yang dari persamaan integral. Ke-lima, harga tetapan yang pasti adalah yang dari persamaan integral (Laidler, 1987).
Berangkat dari hal-hal yang telah dibicarakan di atas, rumusan penelitian ini adalah:
1.Apakah reaksi brominasi aseton dapat merupakan model bagi reaksi enzimatis Michaelis-Mentenis? 2.Tepatkah harga tetapan
Michaelis-Menten yang diperoleh dari satu percobaan?
3.Apakah ketiga persamaan yang ada selalu memberikan harga KM yang
konsisten?
METODE
Penelitian merupakan eksperimen laboratorium. Variabel penelitian adalah konsentrasi dan waktu. Percobaan dilakukan dengan mengikuti perubahan absorbansi Br2 secara spektrofotometri pada panjang gelombang 400 nm sebagai fungsi waktu.
Bahan
Larutan Br2 0,05 M., larutan HCl 0,100, 0,150, dan 0,200 M, Aseton 4,000 M
Spektrofotometer uv-visible; stop-watch; pengaduk magnit
Cara Kerja
1. Spektrofotometer dihidupkan dan kemudian ditentukan titik 0-nya dengan menggunakan aquades sebagai blanko.
2. Ke dalam labu 100 mL
dimasukkan secara berurutan, 10 mL Aseton 4 M, 2,5 ml HCl 0,100 M, 27,5 mL Akuades, dan 10 mL larutan Br2 0,05 M, serentak dengan menghidupkan stop-watch; digojog dan ditentukan absorban-sinya pada = 400 nm pada detik ke 10 dan setiap 10 detik berikutnya hingga tersisa 10% (Ingat: semua labu dan pereaksi harus ditempatkan dalam termostat pada temperatur pengukuran dan kuvet harus segera dikembalikan ke termostat segera setelah pengukuran.)
3. Dilakukan 2 kali ulangan.
4. Dilakukan hal yang sama untuk HCl dengan volum 5,0; 7,5; 10,0; dan 12,5 ml HCL 0,100 M dan air yang bersesuaian hingga volum total 50 mL.
5. Digunakan 7 data pada awal reaksi dan 7 pada akhir reaksi untuk menentukan kondisi dimana reaksi mirip reaksi enzimatis.
6. Ditentukan harga κ menggunakan persamaan.
7. Ditentukan harga κ menggunakan persamaan-persamaan [16], [17], dan [18],
8. Diperbandingkan hasil yang diperoleh.
9. Digunakan data pada awal reaksi pada setiap [HCl] 0,005, 0,010, 0,015, dan 0,020 M untuk menentukan harga κ menggunakan persamaan integral untuk order ke-nol, ke-nol, setengah, pertama, satu-setengah, dan dua dan persamaan [16], [17], dan [18].
Rerata hasil pengamatan, disajikan dalam Tabel 1A, Tabel IB., Tabel 1C., dan Tabel 1C.
Teknik Analisis Data dan Penyimpulan
Data yang diperoleh dibagi menjadi 2 bagian; masing-masing diambil 7 di awal dan akhir reaksi. Selanjutnya, masing-masing di analisis menggunakan persamaan integral untuk kemungkinan reaksi order ke-nol, setengah, pertama, satu-setengah, dan
dua. Order reaksi yang dipakai adalah yang memberikan koefisien regresi paling mendekati ± 1,0000. Reaksi disimpulkan mirip reaksi enzimatis Michaelis-Mentenis jika pada awal, reaksi order ke-nol dan akhir order pertama. Laju maksimum diperoleh dari lereng kurva hukum laju order ke-nol
dan selanjutnya digunakan untuk
menghitung tetapan Michaelis-Menten melalui substitusi pada lereng kurva hukum laju order ke-satu. Tetapan Michaelis-Menten disimpulkan dapat ditentukan dari satu ekserimen jika, pada setiap eksperimen diperoleh harga vmaks yang sama.
Data juga dianalisis dengan persamaan Espenson, dan persamaan Lineweaver-Burk, dan Eadie-Hofstee, menggunakan data pada awal dan akhir, secara terpisah maupun gabungan, baik yang memenuhi kriteria maupun tidak. Ketiga persamaan dinyatakan sahih jika memberikan tetapan Michaelis-Menten yang sama (dengan toleransi perbedaan maksimal 5%) dengan yang dari persamaan integral.
HASIL DAN PEMBAHASAN
Hasil
Tabel 1A. Rerata Absorbansi Br2 pada Reaksi
Brominasi Aseton: =400 nm, Rentang Waktu, t,
Tetap 10 Detik, dan Temperatur Kamar [10 mL Aseton 4,0 M, 2,5 mL HCl 1,0 M, 27,5 mL H2O, dan 10 mL Br2 0,015M], No. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 1. 0 0,493 0,103 330 1. 2. 10 0,483 0,091 340 2. 3. 20 0,473 0,081 350 3. 4. 30 0,464 0,072 360 4. 5. 40 0,454 0,064 370 5. 6. 50 0,445 0,057 380 6. 7. 60 0,436 0,051 390 7.
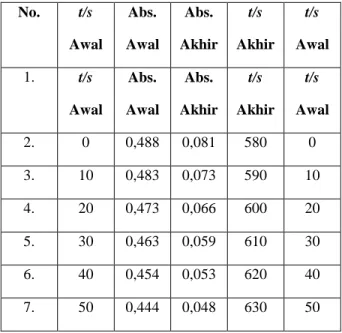
Tabel 1B. Rerata Absorbansi Br2 pada Reaksi
Brominasi Aseton: =400 nm, Rentang Waktu, t, Tetap 10 Detik, dan Temperatur Kamar [10 mL Aseton 4,0 M, 5,0 mL HCl 1,0 M, 25 mL H2O, dan 10 mL Br2 0,015M], No. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 1. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 2. 0 0,488 0,081 580 0 3. 10 0,483 0,073 590 10 4. 20 0,473 0,066 600 20 5. 30 0,463 0,059 610 30 6. 40 0,454 0,053 620 40 7. 50 0,444 0,048 630 50
Tabel 1C. Rerata Absorbansi Br2 pada Reaksi
Brominasi Aseton: =400 nm, Rentang Waktu, t, Tetap 10 Detik, dan Temperatur Kamar [10 mL Aseton 4,0 M, 7,5 mL HCl 1,0 M, 22,5 mL H2O, dan 10 mL Br2 0,015M], No. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 1. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 2. 0 0,493 0,103 330 0 3. 10 0,483 0,091 340 10 4. 20 0,473 0,081 350 20 5. 30 0,464 0,072 360 30 6. 40 0,454 0,064 370 40 7. 50 0,445 0,057 380 50
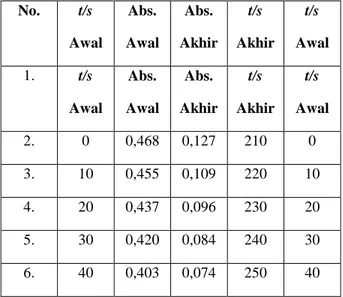
Tabel 1D. Rerata Absorbansi Br2 pada Reaksi
Brominasi Aseton: =400 nm, Rentang Waktu, t, Tetap 10 Detik, dan Temperatur Kamar [10 mL Aseton 4,0 M, , 10 mL HCl 1,0 M, 27,5 mL H2O, dan 10 mL Br2 0,015M], No. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 1. t/s Awal Abs. Awal Abs. Akhir t/s Akhir t/s Awal 2. 0 0,468 0,127 210 0 3. 10 0,455 0,109 220 10 4. 20 0,437 0,096 230 20 5. 30 0,420 0,084 240 30 6. 40 0,403 0,074 250 40 7. 50 0,387 0,065 260 50 Pembahasan
Seperti telah diutarakan, data dianalisis terhadap kemungkinan reaksi order ke-nol, setengah, pertama, -satu setengah, dan -dua. Ini karena percobaan dilakukan dengan metode isolasi pada kondisi [Aseton] berlebihan, HCl yang dibuat bervariasi, dan Br2 yang dibuat tetap relatif kecil. Data juga dianalisis terhadap order setengah dan satu setengah karena, berdasarkan mekanisme, terjadi pelepasan proton dari Aseton.
Seperti terlihat pada Tabel 2, pada saat [HCl]o 0,005 dan 0,010 M, pada awal, reaksi mengikuti mekanisme reaksi order (semu) ke-nol dan, pada akhir-akhir reaksi, ke-satu terhadap Br2 Pada [HCl] yang lebih besar, reaksi selalu order ke-satu Ini, sedikit sebanyak, sejalan dengan kajian pustaka. Pada saat [HCl] relatif kecil, k3[Br2] (pada
persamaan [11]) akan lebih besar dari k -2[H+] sehingga reaksi order ke-nol terhadap
Br2. Tetapi, karena selama reaksi konsentrasi Br2 terus berkurang, sedang [H+] tetap (karena adanya donasi dari aseton) maka pada akhir reaksi, justru k3[Br2] yang akan menjadi lebih kecil dari k -2[H+] dan reaksi menjadi order ke-satu
fakta bahwa, pada konsentrasi HCl yang lebih besar, reaksi selalu order ke-satu (semu) terhadap Br2, baik pada awal maupun pada awal reaksi.
Ada 2 hal yang penting berkaitan dengan uraian di atas. Pertama, ialah bahwa, pada saat konsntrasi awal HCl 0,005 dan 0,010 M, Aseton 0,800 M, dan Br2 0,010 M, reaksi brominasi aseton mirip dengan reaksi enzimatis. Kedua, ini sekaligus menjadi petunjuk bahwa metode laju awal hanya tepat digunakan jika, dari awal dan akhir, reaksi berlangsung dengan mekanisme reaksi yang sama.
Berdasarkan Tabel 3., perubahan konsentrasi HCl (yang dianggap bertindak sebagai enzim) cenderung memberikan harga vmaks yang berbeda pula. Fakta ini
sangat menarik karena hingga saat ini, diyakini bahwa harga KM dapat diperoleh
langsung dari satu percobaan, Kelihatannya tidak ada alasan untuk menyatakan bahwa hasil percobaan ini salah. Sesuai dengan teori, reaksi enzimatis adalah order ke-satu terhadap konsentrasi enzim. Artinya, bila konsentrasi enzim di dua-kalikan maka laju akan menjadi 2 kali lebih cepat (dan tentunya juga demikian dengan vmaks).
Masalahnya sekarang tinggal pada harga lereng dari kurva pada saat reaksi order ke-satu, yaitu yang akan digunakan untuk
menghitung KM. Secara teoritis, karena pada
kondisi ini reaksi tidak tergantung pada konsentrasi enzim (HCl), seharusnya lereng kurva tidak dipengaruhi oleh perubahan [HCl]. Pada saat reaksi order (semu) ke-satu, reaksi hanya dipengaruhi oleh konsen-trasi substrat Br2. Tetapi, fakta menunjukkan bahwa, lereng berubah dengan perubahan [HCl]. Ini mungkin disebabkan karena pengamatan dilakukan pada saat terjadi transisi dari reaksi order ke-nol ke ke-satu. Masalahnya, perubahannya tidak linear terhadap [HCl]. Implikasinya, harga KM
terhitung akan berbeda. Andaikatapun harga lereng tidak terpengaruh, harga KM tetap
akan berbeda karena harga vmaks berbeda.
Berdasar Tabel 4., kedua persamaan (diferensial) ternyata tidak selalu dapat memberikan harga KM (yang positif),
khususnya jika data yang dipakai masing-masing hanya data pada awal atau akhir reaksi. Kalaupun dapat, keduanya selalu memberikan harga yang berbeda pada [HCl]o yang berbeda.
Ada 3 hal yang menarik di sini. Pertama, berdasarkan keterangan di atas, kedua persamaan pada dasarnya hanya bisa dipakai jika data berasal dari kondisi reaksi yang mempunyai hukum laju yang berbeda di awal dan akhir reaksi. Tetapi, keduanya tidak mempersyaratkan hal tersebut. Kedua,
jika dipersyaratkan, masing-masing ada 2 harga yang memenuhi. Mestinya dipilih dari kurva yang lebih mendekati linier, tetapi keduanya juga tidak mempersyaratkan itu. Ketiga, harga yang diberikan oleh kedua persamaan pada penerapan pada data yang sama, ternyata selalu berbeda. Seharusnya harganya sama karena kedua persamaan diturunkan dari persamaan [4]. Memang ada pendapat bahwa salah satu lebih baik dari yang lain tetapi dirasa kurang meyakinkan. Lagi pula, keduanya merupa-kan persamaan diferensial. Menurut Patiha (2006) pada metode diferensial, harga tetapan yang diperoleh hanya akan sama jika laju v dihitung menggunakan fraksi bereaksi yang sama. Dan, harganya berbeda dengan yang dari integral; yang diyakini lebih pasti.
Bahasan selanjutnya adalah yang berkaitan dengan persamaan Espenson. Karena persamaan ini merupakan persamaan integral, untuk data yang sama, diharapkan harga KM yang diperoleh sama dengan yang
dari persamaan integral.
Masih berdasar Tabel 4., ternyata persamaan Espenson (1995) selalu memberikan harga KM, terlepas dari pada
apakah kondisi reaksi mengikuti mekanisme reaksi enzimatis atau tidak. Tetapi, harga-harga tersebut tidak sama. Ini tentu menimbulkan pertanyaan, hasil mana yang
seharusnya dipakai. Tentunya yang lebih tepat adalah yang mengikuti mekanisme reaksi enzimatis. Tetapi persamaan Espenson juga tidak mempersyaratkan hal itu. Andaikatapun itu dipakai, masih ada 2 harga. Tentunya harus dipilih yang koefisien regresinya paling mendekati ±1,000. Tetapi, sekali lagi, persamaan ini juga tidak mempersyaratkan uji linearitas.
Akhirnya, patut dikemukakan 2 hal yang merupakan implikasi penelitian ini. Pertama, bahwa harga vmaks dipengaruhi oleh
konsentrasi enzim. Karena itu, bagi pemperoleh harga KM, yang relatif konstan,
seharusnya konsentrasi enzim diperhitung-kan. Dan, karena pengaruhnya tidak berbanding lurus pada saat reaksi mengikuti mekanisme reaksi order kesatu, harga yang lebih baik hanya akan diperoleh dari beberapa percobaan. Kedua, kelemahan model ini adalah karena pereaksi Br2 relatif berbahaya. Reaksi hidrogen-peroksida dengan iom iodida memberikan hasil yang berbeda dalam suasana asam dan basa. Reaksi dalam suasana alam akan bisa menimbulkan kontroversi; dikatakan H+ bertindak sebagai katalis (Cooper dan Koubeck, 1998) tetapi tidak dihasilkan sebagai produk. Terlepas dari itu, semua pereaksinya relatif lebih aman; dan diduga,
pada kondisi tertentu, dapat mirip reaksi enzimatis.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hal-hal yang telah dibi-carakan dan sebatas kesalahan percobaan, dapat disimpulkan 3 hal berikut.
1. Reaksi brominasi Aseton mirip reaksi enzimatis pada kondisi konsentrasi awal HCl 0,005 dan 0,010 M, Aseton 0,800 M, dan Br2 0,010 M.
2. Tetapan Michaelis-Menten tidak dapat diperoleh dari satu ekspe-rimen.
3. Ketiga persamaan, Lineweaver-Burk, Eadie-Hofstee, dan Espen-son tidak memberikan hasil yang konsisten.
Saran
Sejalan dengan pembahasan dan kesimpulan, disarankan 2 hal berikut.
1. Penentuan KM sebaiknya tidak
dilakukan dari satu percobaan. 2. Perlu penelitian untuk
kemungki-nan penggunaan reaksi hidrogen-peroksida dengan iodide dalam suasana asam dan atau basa
sebagai suatu model untuk reaksi mirip enzimatis.
DAFTAR PUSTAKA
Atkins, G. L. and I. A. Nimmo. 1975. Biochem. J. 149, 775.
Briggs, G. E. and J. B. S. Haldane. 1925. Biochem. J. 19, 338.
Copper, C. L. And E. Koubek. 1998. J. Chem. Educ., 75. 87-89.
Dowd, J. E. and D. S. Riggs. 1965. Biochem. J. 249, 8635
Eadie, E. A. 1942. J. Biol. Chem. 146. 85.
Espenson, J. H. 1995. Chemical Kinetics and Reaction Mechanisms, 2nd Ed. New York: McGraw-Hill, Inc.
Hofstee, B. H. J. 1959. Nature, Lond. 184.
1926.
Laidler, K. J. 1987. Chemical Kinetics, 3rd Edition. New York: Harper Collins Publisher, Inc.
Lineweaver, H. and D. Burk. 1934. J. Am. Chem. Sos. 56. 658.
Patiha, 2006. Persamaan Kinetika Kimia Tunggal Hibrida Diferensial dan Integral dan Implementasinya. Laporan Penelitian Fundamental Tak Terpublikasi. Surakarta: FMIPA UNS Patiha, 2009. Persamaan Kinetika Kimia Terpadu untuk Reaksi Enzimatis Michaelis-Mentenis dan yang Mirip
Laporan Penelitian Fundamental Tak Terpublikasi. Surakarta: FMIPA UNS Patiha, 2011. Teknik dan Persamaan Baru
yang Efektif untuk penentuan Tetapan
Michaelis-Menten dan yang Mirip. Laporan Penelitian Fundamental Tak Terpublikasi. Surakarta: FMIPA UNS.