i
PENETAPAN KADAR BESI DALAM SUSU CAIR
UNTUK IBU HAMIL SECARA SPEKTROFOTOMETRI VISIBEL DENGAN PEREAKSI 1, 10-FENANTROLIN
HALAMAN SAMPUL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Diajukan oleh: Robby Eko Buntoro
NIM : 048114100
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PENETAPAN KADAR BESI DALAM SUSU CAIR
UNTUK IBU HAMIL SECARA SPEKTROFOTOMETRI VISIBEL DENGAN PEREAKSI 1, 10-FENANTROLIN
HALAMAN JUDUL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Diajukan oleh: Robby Eko Buntoro
NIM : 048114100
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
v
HALAMAN PERSEMBAHAN
!
"
!
!
"
"
!
"
# $
# $
# $
# $
%
%
%
%
&&&& $
$
$
$
$
$
$
$
!" # !" ! $ % & % !
vi PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Penetapan Kadar Besi dalam Susu Cair untuk Ibu Hamil secara Spektrofotometri Visibel dengan Pereaksi 1, 10-Fenantrolin” ini tepat pada waktunya. Skripsi ini disusun untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S.Farm.) Program Studi Ilmu Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis berhasil menyelesaikan penelitian dan penyusunan skripsi ini tak lepas dari bantuan dan dukungan baik berupa materiil, moral maupun spiritual dari banyak pihak. Pada kesempatan ini, penulis ingin mengucapkan terimakasih kepada : 1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
2. Lucia Wiwid W., M.Si. selaku dosen pembimbing yang dengan kesabarannya membimbing, memberi saran dan kritik sejak penyusunan proposal hingga selesainya skripsi ini.
3. Christine. Patramurti, M.Si., Apt. selaku dosen penguji yang telah meluangkan waktu untuk memberikan masukkan, saran dan kritik yang membangun selama penelitian.
vii
5. Papa, Mama, Robbert, dan Jessica atas segala kasih sayang, dukungan, perhatian, nasehat dan doa yang senantiasa menyertai penulis.
6. Mak Lien sekeluarga, Papi Hwie, Mami Lien, Indra dan Lina serta Saudara – saudara lain yang tidak dapat saya sebutkan satu-persatu atas segala kasih sayang, dukungan, perhatian, nasehat dan doa yang senantiasa menyertai penulis.
7. Friska sekeluarga atas segala kasih sayang, dukungan, perhatian, nasehat dan doa yang senantiasa menyertai penulis.
8. Ko Cikung, Ko Hari, dan Hendrawan serta teman-teman satu kos yang selalu membantu dan menyemangati penulis selama penelitian dan penyusunan skripsi ini.
9. C Vera, Mas Bodong, Oktaf, Marco, Peter, Budi, Adriyan, Selvi, Bob, Elvan, Edvan, Yusak, Fajar, Boris, Coco, Probo, Mia, Dewi, Lina, Feli dan Vita serta Teman-teman di fakultas farmasi khususnya angkatan 2004 yang selama ini telah membantu, menemani, mendukung, menghibur dan menyemangati penulis selama penelitian dan penyusunan skripsi ini.
10.Mas Parlan, Mas Bimo dan Mas Kunto serta segenap staf laboran yang telah memberikan masukkan, bantuan, kebersamaan dan kerjasamanya selama penelitian.
viii
Penulis menyadari bahwa penelitian dan penyusunan skripsi ini masih memiliki kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Semoga skripsi ini memberikan manfaat bagi orang lain yang membutuhkan.
ix
x INTISARI
Anemia merupakan masalah kesehatan yang dialami oleh wanita diseluruh dunia terutama dinegara berkembang. Badan kesehatan dunia (World Health Organization/WHO) melaporkan bahwa prevalensi ibu-ibu hamil yang mengalami defisiensi besi sekitar 35-75 % serta semakin meningkat seiring dengan bertambahnya usia kehamilan. Penelitian ini dilakukan untuk mengukur secara kuantitatif kadar besi dalam susu untuk ibu hamil dan untuk mengetahui validitas metode spektrofotometri visibel pada penetapan kadar besi dalam susu cair untuk ibu hamil. Parameter yang digunakan dalam menentukan validitas metode analisis adalah akurasi, presisi, linearitas, rentang, dan spesifisitas.
Penelitian ini merupakan penelitian non eksperimental deskriptif. Metode yang digunakan untuk mengukur kadar besi dalam susu cair untuk ibu hamil dengan menggunakan spektrofotometri visibel, pada panjang gelombang 510,4nm. Diukur berdasarkan warna merah-oranye dari kompleks [(C12H8N2)3Fe]2+, yang dihasilkan
oleh besi (II)(1, 10-fenantrolin)3.
Berdasarkan analisis hasil penelitian, metode spektrofotometri visibel pada penetapan kadar besi dalam susu cair untuk ibu hamil dengan pereaksi 1,10-fenantrolin telah memenuhi persyaratan validasi metode analisis, yaitu memiliki akurasi, presisi, linearitas, dan spesifisitas yang baik pada rentang kadar besi 1,28 hingga 3,84 ppm. Dan rata-rata kadar besi dalam susu cair untuk ibu hamil merk X sebesar 3,61 ± 0,13 mg/kemasan
xi
ABSTRACT
Anemia is a health problem experienced by women all around the world, especially in developing countries. World Health Organization reports that prevalence of pregnant women experiencing deficiency of iron sums up to around 35 to 75 % and is rising along with the period of pregnancy. This research is conducted to quantitatively measure the amount of iron contained in milk for pregnant women and to validate the visible spectrophotometer method in measuring the amount of iron contained in milk for pregnant women. Parameters used in deciding the validity of analysis method are accuracy, precision, linearity, length, and specificity.
This research is a descriptive non-experimental research. Method used to measure the amount of iron contained in milk for pregnant women is the visible spectrophotometer method, with wavelength of 510.4 nm and is measured based on red-oranye colour from [(C12H8N2)3Fe]2+ complex produced by iron (II) (1, 10-
phenanthroline)3.
Based on the result, visible spectrophotometer method on measuring the amount of iron contained in milk for pregnant women with 1, 10-phenanthroline reactor has fulfilled the valid requirements of analysis method, which include accuracy, precision, linearity, length, and specificity. with the range of iron amount from 1,28 ppm until 3,84 ppm. And the average of concentration of iron contained in milk for pregnant women is 3,61 ± 0,13 mg/container
xii
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... ix
A. Latar Belakang Masalah... 1
1. Permasalahan ... 4
2. Keaslian penelitian... 4
3. Manfaat penelitian ... 5
B. Tujuan Penelitian ... 5
BAB II. PENELAAHAN PUSTAKA ... 6
A. Besi ... 6
B. Anemia ... 7
C. Penetapan Kadar Besi ... 10
1. Metode tiosianat... 10
2. Metode 1, 10-fenantrolin ... 11
3. Metode tioglikolat ... 12
xiii
5. Metode dikromat ... 13
D. Spektrofotometri ... 13
1. Hukum dasar absorbsi... 15
2. Spektrofotometri visibel... 17
3. Instrument berkas ganda ... 22
4. Kalibrasi Spektrofotometri... 22
E. Validasi Metode ... 25
1. Kecermatan (accuracy) ... 25
2. Keseksamaan (precision) ... 26
3. Spesifisitas ... 27
4. Linearitas dan Rentang ... 27
5. Batas deteksi (Limit of Detection) dan Batas kuantitasi (Limit of Quantitation)... 27
F. Landasan Teori... 29
G. Hipotesis ... 30
BAB III. METODE PENELITIAN ... 31
A. Jenis dan Rancangan Penelitian ... 31
B. Definisi Operasional ... 31
C. Bahan Penelitian ... 31
D. Alat-Alat Penelitian ... 32
E. Jalannya penelitian... 32
1. Pengambilan sampel ... 32
2. Pembuatan larutan pereaksi ... 32
3. Optimasi metode ... 33
4. Pembuatan seri kurva baku ... 33
5. Pembuatan blangko ... 34
6. Uji kualitatif ... 34
7. Penetapan kadar besi... 34
8. Pembuatan baku untuk recovery... 35
xiv
F. Analisis Hasil ... 36
BAB IV. HASIL DAN PEMBAHASAN ... 38
BAB V. KESIMPULAN ... 55
DAFTAR PUSTAKA... 56
xv
DAFTAR TABEL
Tabel 1. Tabel kalibrasi panjang gelombang ... 24
Tabel 2. Toleransi maksimum pada kalibrasi serapan ... 25
Tabel 3. Rentang recovery yang diperbolehkan... 26
Tabel 4. Nilai KV yang dapat diterima ... 27
Tabel 5. Parameter analitik yang harus dipertimbangkan untuk tipe prosedur analitik yang berbeda ... 29
Tabel 6. Persamaan seri kurva baku Fe2+... 43
Tabel 7. Hasil penetapan kadar besi dalam sampel susu cair untuk ibu hamil ... 50
xvi
DAFTAR GAMBAR
Gambar 1. Kompleks Fe(1, 10-fenantrolin)32+... 11
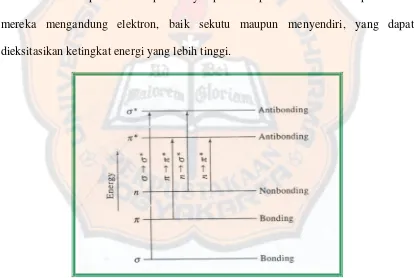
Gambar 2. Tingkat energi elektronik ... 18
Gambar 3. Instrument berkas ganda ... 22
Gambar 4. Redoks antara Fe3+ dan hidrokuinon... 40
Gambar 5. Spektra penetapan waktu operating time... 41
Gambar 6. Spektra panjang gelombang serapan maksimum ( max) tiga seri kadar larutan baku Fe2+ (a = 3,225 ppm; b= 2,58 ppm; c = 1,935 ppm) ... 42
Gambar 7. Serapan kompleks Fe2+ dengan 1, 10-fenantrolin vs konsentrasi Fe2+... 44
Gambar 8. Pembentukan kompleks antara Fe2+ dengan 1, 10-fenantrolin ... 47
Gambar 9. Spliting pada orbital d pada kompleks oktahedral ... 48
Gambar 10. Spliting orbital d pada Fe2+ dengan adanya ligan 1,10-fenantrolin ... 48
Gambar 11. Transisi elektron dari orbital d ke * ... 49
xvii
DAFTAR LAMPIRAN
Lampiran 1. Komposisi susu cair untuk ibu hamil merk X ... 59
Lampiran 2. Data pembuatan kurva baku ... 60
Lampiran 3. Contoh perhitungan Fe(NH4)2(SO4)2.6H2O dan konsentrasi Fe2+... 62
Lampiran 4. Contoh perhitungan konsentrasi besi dalam sampel ... 63
Lampiran 5. Contoh tabel recovery dan perhitungan recovery... 64
1 BAB I PENGANTAR
A. Latar Belakang Masalah
Anemia adalah suatu keadaan adanya penurunan kadar hemoglobin, hematokrit dan jumlah eritrosit di bawah nilai normal. Pada penderita anemia, lebih sering disebut kurang darah, kadar sel darah merah (hemoglobin atau Hb) berada di bawah nilai normal. Penyebabnya bisa karena kurangnya zat gizi untuk pembentukan darah, misalnya zat besi, asam folat, dan vitamin B12 (Amirudin, 2007). Tetapi yang sering terjadi adalah anemia karena kekurangan zat besi. Anemia defisiensi besi adalah anemia yang disebabkan oleh kurangnya zat besi dalam tubuh, sehingga kebutuhan zat besi (Fe) untuk eritropoesis tidak cukup (Amirudin, 2007).
Anemia yang terjadi saat ibu hamil Trimester I akan dapat mengakibatkan: abortus, missed abortus dan kelainan kongenital. Anemia pada kehamilan trimester II dapat menyebabkan: persalinan prematur, perdarahan antepartum, gangguan pertumbuhan janin dalam rahim, asfiksia aintrauterin sampai kematian, BBLR, gestosis dan mudah terkena infeksi, IQ rendah dan bahkan bisa mengakibatkan kematian (Sohimah, 2008).
Kebutuhan zat besi pada wanita hamil akan meningkat secara fisiologi yaitu sekitar 200 mg diperlukan untuk fetus dan plasenta membutuhkan sekitar 150 mg serta 500 mg lagi digunakan untuk meningkatkan massa haemoglobin maternal. Maka pada masa kehamilan dibutuhkan tambahan sekitar 800 mg besi (Mutschler, 1991).
Berbagai suplemen untuk ibu hamil sekarang ini beredar dipasaran dengan berbagai macam bentuk. Salah satunya bentuk dari suplemen ini adalah susu untuk ibu hamil, zat besi merupakan komponen utama dalam susu untuk ibu hamil.
titrasi dan kurang sensitif. Metode AAS memiliki kelebihan yaitu lebih sensitif dan cepat dibandingkan dengan metode spektrofotometri visibel tapi dalam penelitian ini kesensitifan dari metode spektofotometri visible cukup untuk menetapkan kadar besi dalam susu cair untuk ibu hamil. Kekurangan dari metode AAS adalah adanya gangguan dari logam lain yang ada dalam sampel (interferensi kimia). Sedangkan pada spektrofotometri visibel interferensi dapat dihilangkan dengan adanya pengaturan pH. Berdasarkan kelebihan dan kekurangan dari masing-masing metode maka dipilih metode spektrofotometri visibel dalam penetapan kadar besi dalam susu cair untuk ibu hamil.
1. Permasalahan
a. Apakah metode spektrofotometri visibel dengan pereaksi 1, 10-fenantrolin memiliki validitas yang baik dilihat dari akurasi, presisi, linearitas, rentang dan spesifisitasnya untuk menetapkan kadar besi dalam susu cair untuk ibu hamil?
b. Berapa kadar besi dalam susu cair untuk ibu hamil menggunakan spektofotometri visibel dengan pereaksi 1, 10-fenantrolin?
2. Keaslian penelitian
Sejauh pengetahuan penulis, penetapan kadar besi dalam susu cair untuk ibu hamil dengan agen pereduksi hidrokuinon, reagen natrium asetat dan pereaksi 1, 10-fenantrolin belum pernah dilakukan.
penetapan kadar besi dengan pereaksi 1, 10-fenantrolin telah dibukukan oleh Bassett et al (1994).
3. Manfaat penelitian
a. Manfaat teoritis. Hasil penelitian ini diharapkan dapat menambah informasi mengenai pengunaan metode spektrofotometri visibel dengan menggunakan pereaksi 1, 10-fenantrolin untuk menetapkan kadar besi dalam susu cair untuk ibu hamil.
b. Manfaat metodologis. Memberikan informasi mengenai akurasi, presisi, linearitas, rentang dan spesifisitas dari metode spektrofotometri visibel dengan menggunakan pereaksi 1, 10-fenantrolin untuk menetapkan kadar besi dalam susu cair untuk ibu hamil.
c. Manfaat praktis. Memberikan informasi kadar besi dalam susu cair untuk ibu hamil merk X.
B. Tujuan Penelitian
1. Mengetahui validitas metode spektrofotometri visibel dengan menggunakan pereaksi 1, 10-fenantrolin untuk menetapkan kadar besi dalam susu cair untuk ibu hamil dilihat dari akurasi, presisi, linearitas, rentang dan spesifisitas.
6 BAB II
PENELAAHAN PUSTAKA
A. Besi
Zat besi merupakan unsur terpenting bagi manusia. Besi penting untuk memproduksi hemoglobin, difisiensi besi menyebabkan sel darah merah kecil dengan hemoglobin yang tidak cukup (Neal, 2006). Besi dengan konsentrasi tinggi dalam tubuh terdapat pada sel darah merah. Sel darah merah mengandung protein yang bernama hemoglobin, dan setiap hemoglobin memiliki 4 atom zat besi. Zat besi dalam hemoglobin inilah yang mengikat oksigen dalam darah pada paru-paru untuk bisa disebarkan ke seluruh tubuh (Anonim, 2008a). Hemoglobin akan mengangkut oksigen ke sel–sel yang membutuhkannya untuk metabolisme glukosa, lemak dan protein menjadi energi (ATP). Setelah melepas oksigen, hemoglobin kemudian mengikat karbondioksida (CO2) untuk dilepaskan oleh paru-paru (Anonim, 2006a).
Besi juga merupakan bagian dari sistem enzim dan mioglobin, yaitu molekul yang mirip hemoglobin yang terdapat di dalam sel–sel otot. Mioglobin akan berkaitan dengan oksigen dan mengangkutnya melalui darah ke sel–sel otot (Anonim, 2008a).
makanan hewani antara lain daging, ikan, ayam, hati dan organ – organ lain (Anonim, 2004a). Sebagian besar zat besi tidak diserap oleh tubuh, dan tingkat absorbsi besi pada bahan makanan nabati lebih sedikit daripada makanan hewani (Beck, 1995).
Kebutuhan akan zat besi pada laki-laki adalah 9 sampai 15 mg perhari dan pada wanita membutuhkan sebanyak 9 sampai 28 mg tiap harinya, dan untuk wanita hamil, menyusui atau sedang mengalami menstruasi mebutuhkan tambahan 2 sampai 4 mg perhari (Beck, 1995). Kebutuhan zat besi pada wanita hamil akan meningkat secara fisiologi yaitu sekitar 200 mg diperlukan untuk festus dan plasenta membutuhkan sekitar 150 mg serta 500 mg lagi digunakan untuk meningkatkan massa haemoglobin maternal. Maka pada masa kehamilan dibutuhkan tambahan sekitar 800 mg besi (Mutschler, 1991).
B. Anemia
Anemia adalah suatu keadaan adanya penurunan kadar hemoglobin, hematokrit dan jumlah eritrosit di bawah nilai normal. Pada penderita anemia, lebih sering disebut kurang darah, kadar sel darah merah (hemoglobin atau Hb) di bawah nilai normal. Penyebabnya bisa karena kurangnya zat gizi untuk pembentukan darah, misalnya zat besi, asam folat, dan vitamin B12. Anemia dapat dibagi menjadi beberapa jenis, yaitu:
1. Anemia defisiensi besi
jumlah yang mencukupi. Wanita yang mengalami haid banyak dan individu dengan gangguan pencernaan, misalnya tukak, polip kolon, atau kangker kolon, beresiko mengalami jenis ini (Anonim, 2008e).
2. Anemia aplastik
Merupakan jemis anemia yang berbahaya, karena dapat mengancam jiwa. Disebabkan karena menurunnya kemampuan susum tulang untuk memproduksi sel-sel darah (eritrosit, leukosit, dan trombosit). Anemia aplastik diangap sebagai penyakit autoimun. Faktor-faktor yang berperan terhadap timbulnya anemia aplastik antara lain: kemoterapi, terapi radiasi, toksin yang terdapat di lingkungan, kehamilan, dan penyakit lupus (Anonim, 2008e).
3. Anemia megaloblastik
Merupakan anemia yang disebabkan karena kekurangan vitamin B12 atau asam folat. Kekurangan kedua vitamin ini mengakibatkan terganggunya perkembangan eritrosit akibat kekurangan vitamin B12 atau asam folat. Kedua vitamin ini berperan pada sintesis asam deoksiribonukleat dalam susum sel yang belum matang dan mempengaruhi pembelahan sel. Kekurangan zat ini dapat mengakibatkan perlambatan dalam pembelahan sel asal eritrosit (Mutschler, 1991). 4. Anemia hemolitik
penyakit autoimun (menyebabkan tubuh menghasilkan antibodi yang dapat menghancurkan selsel darah merah secara prematur), atau obat-obatan(misalnya antibiotik) yang dapat merusak sel-sel darah merah (Anonim, 2008e).
5. Anemia sel sabit (sickle cell anemia)
Anemia ini disebabkan karena kelainan hemoglobin sehingga mengakibatkan sel-sel darah merah berbentuk menyerupai bulan sabit. Sel-sel sabit ini hancur lebih cepat sehingga menyebabkan sel-sel darah merah berkurang. Anemia ini merupakan kelainan yang bersifat keturunan (Anonim, 2008e).
Tetapi yang sering terjadi adalah anemia karena kekurangan zat besi. Anemia defisiensi besi adalah anemia yang disebabkan oleh kurangnya zat besi dalam tubuh, sehingga kebutuhan zat besi (Fe) untuk eritropoesis tidak cukup (Amirudin, 2007).
Anemia pada ibu hamil bukan tanpa resiko. Menurut penelitian, tingginya angka kematian ibu berkaitan erat dengan anemia. Anemia juga menyebabkan rendahnya kemampuan jasmani karena sel-sel tubuh tidak cukup mendapat pasokan oksigen. Pada wanita hamil, anemia meningkatkan frekuensi komplikasi pada kehamilan dan persalinan. Resiko kematian maternal, angka prematuritas, berat badan bayi lahir rendah, dan angka kematian perinatal meningkat. Di samping itu, perdarahan antepartum dan postpartum lebih sering dijumpai pada wanita yang anemia dan lebih sering berakibat fatal, sebab wanita yang anemia tidak dapat mentolerir kehilangan darah. Soeprono menyebutkan bahwa dampak anemia pada kehamilan bervariasi dari keluhan yang sangat ringan hingga terjadinya gangguan kelangsungan kehamilan abortus, partus imatur/prematur), gangguan proses persalinan (inertia, atonia, partus lama, perdarahan atonis), gangguan pada masa nifas (subinvolusi rahim, daya tahan terhadap infeksi dan stress kurang, produksi ASI rendah), dan gangguan pada janin (Amirudin, 2007).
C. Penetapan Kadar Besi
1. Metode tiosianat
Fe3+ + 6 SCN- [Fe(SCN)6]-3
Asam-asam kuat seperti asam klorida maupun asam nitrat harus hadir untuk menekan hidrolisis, reaksinya sebagai berikut:
Fe3+ +3 H2O Fe(OH)3 + 3H+
Asam sulfat tidak disarankan karena dapat membentuk kompleks dengan ion besi(III) (Basset, 1994).
2. Metode 1, 10-fenantrolin
1, 10-fenantrolin atau o-fenantrolin dapat membentuk kompleks yang mantap dengan ion besi(II). Senyawa 1, 10-fenantrolin mempunyai sepasang atom nitrogen yang dapat berikatan secara kovalen dengan ion besi(II). Tiga molekul 1, 10-fenantrolin ini dapat membentuk kompleks dengan satu ion besi(II) (Rivai, 1995).
Gambar 1. Kompleks Fe(1, 10-fenantrolin)32+ (Anonim, 2008c)
jangka pH 2-9, dan stabil untuk waktu yang lama. Besi(III) dapat direduksi dengan hidroksilamonium klorida atau dengan hidrokuinon (Basset, 1994). Dan dapat diukur pada panjang gelombang serapan maksimum 510 nm.
3. Metode tioglikolat
Penggunaan asam tioglikolat (asam mekaptoasetat) untuk menetapkan kadar besi. Metode ini penting karena metode ini relatif bebas dari ganguan dalam memberikan warna unggu-merah dengan Fe3+ yang dapat diukur pada 535 nm (Basset, 1994).
4. Metode permanganat
Titrasi Fe2+ dengan permanganat merupakan metode yang sederhana. Larutan dapat diasamkan dengan asam sulfat dan dititrasi sampai titik akhir (Basset, 1994). Dua persamaan setengah-reaksinya adalah:
Fe2+ Fe3+ + e-
MnO4- + 8H+ + 5 e- Mn2+ + 4H2O
Penggabungan kedua reaksi tersebut memberikan persamaan reaksi sebagai berikut: MnO4- + 8H+ + 5 Fe2+ 5 Fe3+ + Mn2+ + 4H2O (Basset, 1994).
besi(III). Persamaan yang lengkap menunjukkan bahwa 1 mol ion permanganat bereaksi dengan 5 mol ion besi(II). Informasi tersebut dapat membantu dalam perhitungan kadar Fe dengan metode titrasi permanganat (Anonim, 2008b).
5. Metode dikromat
Penetapan kadar besi dalam sampel menggunakan metode dikromat dengan persamaan setengah reaksi sebagai berikut:
Fe2+ Fe3+ + e-
Cr2O72- + 14H+ + 6e- 2Cr3+ + 7 H2O
Penggabungan kedua reaksi tersebut memberikan persamaan reaksi sebagai berikut: Cr2O72- + 14H+ + 6Fe2+ 6Fe3+ + 2Cr3+ + 7 H2O (Basset, 1994).
Metode penelitian ini memiliki kelemahan dan keuntungan dibanding dengan kalium permanganat. Kelemahannya dibanding kalium permanganat, yaitu membutuhkan indikator untuk mengetahui titik akhir titrasi. Ada tiga indikator yang digunakan pada penetapan kadar Fe2+ dengan kalium dikromat, yaitu difenilamin, difenilbenzidin, dan difenilaminsulfonat. Titik akhir titrasi ditandai dengan perubahan warna dari hijau ke ungu. Untuk kelebihannya kalium dikromat digunakan sebagai standart primer (Anonim, 2006b).
D. Spektrofotometri
tingkat energi tertentu dan dapat menyebabkan transisi tingkat energi suatu atom atau molekul. Persamaan planck menunjukan bahwa E = hv, dimana E merupakan energi foton, v adalah frekuensi, sedangkan h merupakan tetapan Planck (Khopkar,1990).
Gelombang elektromagnetik (cahaya) dirambatkan dalam bentuk gelombang transfersal. Komponen listrik (E) dan medan magnet (M) merambat dengan kecepatan (3 x 1010 cm/det) dan frekuensi (v) gelombang konstan, maka jarak antara puncak maksimum adalah panjang gelombang. Panjang gelombang ini merupakan jarak yang ditempuh selama satu periode (1/v) sedangkan bilangan gelombang (V) merupakan banyaknya gelombang dalam suatu satuan panjang. Hubungan dari sifat-sifat tersebut adalah sebagai berikut:
λ
Sehingga rumusan energi foton dari persamaan planck dapat ditulis sebagai berikut:
E = h.v = h
λ
c
= h.c.V Keterangan:
E : energi foton dalam Joule
h : tetapan planck 6,624 x 10-34 Joule detik : panjang gelombang dalam cm
v : frekuensi dalam hertz
1. Hukum dasar absorbsi
Jika suatu berkas sinar melewati medium homogen maka sebagian dari intesitas cahaya yang datang (I0) diabsorbsi sebanyak (Ia) dan sebagian lagi
intensitasnya akan dipantulkan sebanyak (Ir) dan sisanya akan diteruskan (It)
I0 = Ia + Ir + It
Keterangan:
I0 = intesitas cahaya yang masuk
Ia = intensitas cahaya yang diabsorbsi
Ir = intensitas cahaya yang direfleksikan / dipantulkan
It = intensitas cahaya yang diteruskan
Tapi pada prakteknya intensitas cahaya yang dipantulkan sangat kecil (-4 %) biasanya akan terhapus dengan adanya kontrol atau pembanding sehingga persamaannya dapat ditulis sebagai berikut:
I0 = Ia + It
eksponensial oleh bertambahnya konsentrasi zat penyerap secara linear (Basset,
Serapan jenis yang diberi simbol A (1 %, 1 cm) adalah serapan dari larutan 1 % zat terlarut dalam sel dengan ketebalan 1 cm. Harga serapan jenis pada panjang gelombang tertentu dalam suatu pelarut merupakan sifat dari zat terlarut.
Kesalahan pada transmitan (T) akan menyebabkan kesalahan pada pengukuran kadar, kesalahan pengukuran kadar dapat dinyatakan sebagai berikut:
T merupakan harga rentang skala transmitan terkecil dari alat yang masih dapat terbaca pada analisis dengan metode spektrofotometri UV-Vis. Harga T untuk setiap spektrofotometri UV-Vis bervariasi yaitu 0,2 – 1 %. Dari rumus di atas dapat diperhitungkan kesalahan pembacaan A atau T pada analisis dengan metode spektrovotometri UV-Vis. Pembacaan A (0,2 – 0,8) atau %T (15 – 65 %) akan memberikan analisis yang dapat diterima (0,5 - 1 %) untuk T = 1 % (Mulja dan Suharman, 1995).
Hukum di atas dapat ditinjau sebagai berikut:
a. Jika suatu berkas radiasi monokromatik yang sejajar jatuh pada medium pengabsorbsi pada sudut tegak lurus setiap lapisan yang sangat kecilnya akan menurunkan intensitas berkas.
b. Jika suatu cahaya monokromatis mengenai suatu medium yang transparan, laju pengurangan intensitas dengan ketebalan medium sebanding dengan intensitas cahaya.
c. Intensitas berkas sinar monokromatis berkurang secara eksponensial bila konsentrasi zat pengabsorbsi bertambah.
Hal di atas adalah persamaan mendasar untuk spektroskopi absorbsi, dikenal sebagai hukum Beer’s Lambert atau hukum Beer Bougar (Khopkar, 1990).
2. Spektrofotometri visibel
atau tampak bergantung pada mudah atau tidaknya promosi elektron. Molekul yang membutuhkan energi yang lebih banyak untuk promosi elektron maka akan menyerap panjang gelombang yang lebih pendek, sedangkan molekul yang membutuhkan energi yang lebih sedikit untuk promosi elektronnya maka akan menyerap panjang gelombang yang lebih panjang (Fessenden dan Fessenden, 1986)
a. Absorbsi yang melibatkan transisi elektron , dan n
Spektra ultraviolet dan tampak berkaitan erat dengan transisi-transisi elekton antar ikatan. Setiap molekul dapat menyerap radiasi pada daerah UV-tampak karena mereka mengandung elektron, baik sekutu maupun menyendiri, yang dapat dieksitasikan ketingkat energi yang lebih tinggi.
Trasisi tersebut diklasifikasikan sebagai berikut: 1. Transisi *
Ini berarti bahwa suatu elektron dalam orbital ikatan (bonding) sigma dieksitasikan ke orbital (antibonding) sigma. Ikatan kovalen tunggal terikat dengan kuat, dan diperlukan energi yang lebih tinggi atau panjang gelombang pendek, untuk eksitasinya (Day and Underwood, 1996).
2. Transisi *
Elektron dalam ikatan rangkap dan ganda tiga lebih mudah dieksitasikan ke tingkat energi yang lebih tinggi. Dalam molekul terkonjugasi absorbsi bergeser ke panjang gelombang yang lebih panjang. Kebanyakan spektrofotometri ultraviolet-tampak didasarkan pada transisi ini (Day and Underwood, 1996).
3. Transisi n *
Transisi dari jenis ini meliputi transisi elektron-elektron hetero atom tak berikatan ke orbital antibonding *. Serapan ini terjadi pada panjang gelombang yang panjang dan intensitas yang rendah (Sastrohamidjojo, 1991).
4. Transisi n *
bonding sigma (Day and Underwood, 1996). Dan memiliki panjang gelombang antara 150-250 nm (Skoog et al, 1998)
b. Absorbsi yang melibatkan transisi elektron d pada logam transisi
Kebanyakan pada logam transisi akan menyerap pada daerah ultraviolet atau visibel. Untuk unsur logam transisi pertama dan kedua elektron yang bertanggung jawab pada absorbsi adalah elektron pada 3d dan 4d. Logam transisi yang memiliki orbital d yang sebagian sudah ditempati (3d dan 4d), yang masing-masing setidaknya harus memiliki sepasang elektron tak terbagi yang tersedia untuk berikatan dan membentuk kompleks serta menghasilkan spektra tertentu (Skoog et al, 1994).
Contoh pada pembentukan kompleks tembaga (II) dengan amonia. Ion tembaga (II) sebagai donor elektron dan amonia sebagai aseptor elektron. Ion Cu2+ berwarna biru pucat pada larutan. Ketika terbentuk kompleks dengan amonia warnanya akan berubah menjadi biru tua (Christian, 2004).
c. Absorbsi yang melibatkan charge-transfer
Kompleks charge transfer terdiri dari gugus elektron donor yang berikatan dengan elektron aseptor. Dan ketika mengabsorbsi radiasi, elektron dari donor berpindah ke orbital aseptor. Contoh dari kompleks charge-transfer ini antara lain adalah kompleks antara 1, 10-fenantrolin dengan heksasianoferat (II) dan heksasianoferat (III) yang bertanggung jawab atas warna biru(Skoog et al, 1998).
karena logam pada kompleks ini merupakan donor elektron dan ligannya sebagai aseptor elektron(Skoog et al, 1998).
Kriteria-kriteria untuk analisis kolorimetri dan spektrofotometri visibel yang memuaskan, adalah sebagai berikut:
1. Kespesifikan reaksi warna, sangat sedikit reaksi yang khas untuk suatu zat tertentu, tetapi banyak reaksi yang menghasilkan warna untuk sekelompok zat yang berhubungan, artinya reaksi-reaksi tersebut selektif. Dengan cara menambahkan senyawa pembentuk kompleks lain dan dengan perubahan kondisi seperti pH, seringkali dapat mendekati kespesifikan tersebut (Basset, 1994). 2. Kesebandingan antara warna dengan konsentrasi, untuk kolorimetri perubahan
intesitas warna meningkat dengan naiknya konsentrasi zat secara linear (Basset, 1994).
3. Kestabilan warna, warna dari pembentukan kompleks hendaknya stabil untuk memungkinkan pengambilan pembacaan yang tepat, ini berlaku untuk reaksi dalam mana warna itu akan mencapai stabil pada suatu periode tertentu. Periode warna yang stabil ini harus cukup panjang atau lama untuk memungkinkan pengukuran yang cermat (Basset, 1994).
4. Kedapatulangan (reprodusibilitas), metode kolorimetri harus dapat memberikan hasil yang dapat diulang pada kondisi yang khas (Basset, 1994).
analisis hendaknya mempunyai kepekaan yang tinggi untuk mengukur zat berkuantitas sangat kecil (Basset, 1994).
3. Instrument berkas ganda
Pada instrument berkas ganda, dipakai dua jalan cahaya yang dipisahkan oleh ruang dan mempunyai dua pemegang sel yang dilewati cahaya. Satu pemegang untuk bahan pembanding dan pemegang yang lainnya untuk sampel. Cahaya dari monokromator dipecah menjadi dua jalan cahaya. Cahaya pembanding dilewatkan pada larutan pembanding dalam sel pembanding dan cahaya sampel dilewatkan pada larutan sampel dalam sel pengukur (Muson,1991).
Gambar 3. Instrument berkas ganda (Day and Underwood, 1996)
1. Sumber radiasi
energi, yang merupakan perbedaan tenaga antara tingkat eksitasi dan tingkat dasar (Sastrohamidjojo, 1991).
2. Monokromator
Dalam spektrofotometer radiasi yang polikromatik ini harus dirubah menjadi monokromatik. Ada dua jenis alat yang digunakan untuk mengurai radiasi polikromatik menjadi monokromatik yaitu penyaring dan monokromator (Sastrohamidjojo, 1991). Monokromator suatu alat optis untuk memperkecil berkas sumber radiasi dari suatu sumber yang berkesinambungan. Kemurnian spektral dari radiasi yang keluar dari dalam monokromator itu bergantung pada daya dispersi dari prisma dan lebar celah keluar (Day and Underwood, 1996). Monokromator menguraikan radiasi polikromatik menjadi jalur-jalur yang effektif/panjang gelombang-gelombang tunggalnya dan memisahkan panjang gelombang-gelombang tersebut menjadi jalur yang sangat sempit (Sastrohamidjojo, 1991).
3. Tempat cuplikan
4. Detektor
Setiap detektor menyerap tenaga foton yang mengenainya dan mengubah tenaga tersebut untuk dapat diukur secara kuantitatif sebagai arus listrik atau perubahan panas.
4. Kalibrasi Spektrofotometri
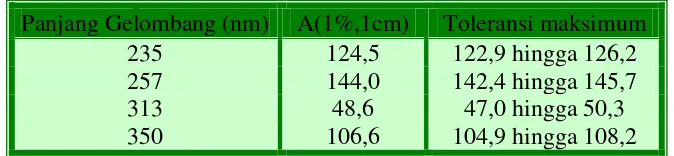
Kalibrasi panjang gelombang, skala panjang gelombang dikalibrasi dengan mengunakan serapan maksimum kalium perklorat LP, spektrum garis lampu hidrogen dan deuterium atau serapan atau spektrum lampu busur uap raksa yang ditunjukan dibawah ini. Toleransi yang diperkenankan kurang lebih 1nm untuk jangkauan 200 nm hingga 400 nm dan lebih kurang 3 nm untuk jangkauan 400 nm hingga 600 nm.
241,15 nm (Ho) 404,66 nm (Hg)
253,70 nm (Hg) 435,83 nm (Hg)
287,15 nm (Hg) 486,00 nm (Dg)
302,25 nm (Hg) 486,10 nm (Hg)
313,16 nm (Hg) 536,30 nm (Ho)
334,15 nm (Hg) 546,07 nm (Hg)
361,50 nm (Ho) 576,96 nm (Hg)
365,48 nm (Hg) 579,07 nm (Hg)
Tabel 1. Tabel kalibrasi panjang gelombang
Panjang Gelombang (nm) A(1%,1cm) Toleransi maksimum
235 124,5 122,9 hingga 126,2
257 144,0 142,4 hingga 145,7
313 48,6 47,0 hingga 50,3
350 106,6 104,9 hingga 108,2
Tabel 2. Toleransi maksimum pada kalibrasi serapan
E. Validasi Metode
Validasi metode analisis merupakan suatu tindakan penilaian terhadap parameter tertentu, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaanya (Harmita, 2004). Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis diuraikan sebagai berikut:
1. Kecermatan (accuracy)
Kecermatan adalah ukuran yang menunjukan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan ini dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Anonim, 2007). Persen perolehan kembali dapat dihitung dengan cara:
Recovery =
CA = konsentrasi besi dalam susu cair untuk ibu hamil
C*A = konsentrasi besi dari Fe(NH4)2(SO4)2.6H2O yang ditambahkan (Harmita,
Analit pada matrik sampel( %) Recovery yang diperoleh ( %)
Tabel 3. Rentang recovery yang diperbolehkan (Harmita, 2004)
2. Keseksamaan (precision)
Keseksamaan merupakan ukuran yang menunjukan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur ditetapkan secara berulang pada sampel-sampel yang diambil dari campuran homogen. Keseksamaan diukur sebagai simpangan baku (Standar deviasi) atau simpangan baku relatif (koefisien variasi) (Harmita, 2004). Keseksamaaan dapat dihitung sebagai berikut:
Standar deviasi (s)
Kadar analit Koefisien variasi (KV)
1 % 0,1 % 1 ppm 1 ppb
2,5 % 5 % 16 % 32 %
Tabel 4. Nilai KV yang dapat diterima (Harmita, 2004)
3. Spesifisitas
Selektifitas atau spesifitas suatu metode merupakan suatu kemampuan metode untuk hanya mengukur zat tertentu saja secara cermat dan seksama (Harmita, 2004).
4. Linearitas dan Rentang
Linearitas adalah kemampuan metode analisis untuk memberikan respon secara langsung atau dengan bantuan matematik terhadap konsentrasi analit dalam sampel. Sebagai parameter adanya hubungan linier digunakan koefisien korelasi r pada analisis regresi linier Y = bX + a. Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukan dapat ditetapkan dengan kecermatan, keseksamaan dan linearitas yang dapat diterima (Harmita, 2004).
5. Batas deteksi (Limit of Detection) dan Batas kuantitasi (Limit of Quantitation)
Batas kuantifikasi dapat diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
Limit Of Detection = b Sy/x
. 3
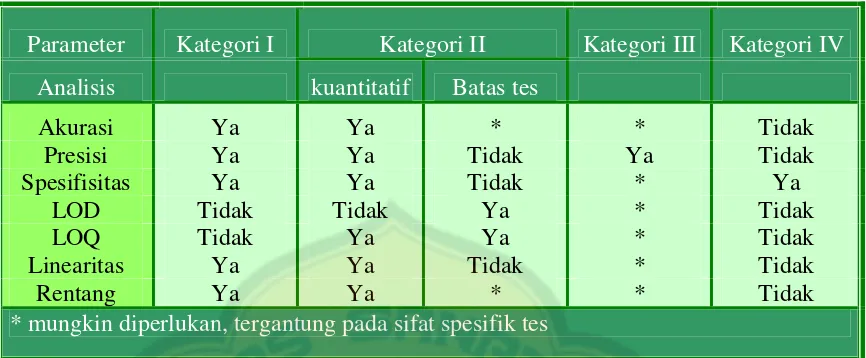
Limit Of Quantitation = b tahun 2007, metode/prosedur analisis dapat dibedakan menjadi 4 kategori, yaitu: a. Kategori I, Mencakup prosedur analisis kuantitatif, untuk menetapkan kadar komponen utama bahan obat atau zat aktif (termasuk pengawet) dalam sediaan farmasi.
b. Kategori II, Mencakup prosedur analisis kualitatif dan kuantitatif yang digunakan untuk menganalisis impurities ataupun degradation compounds dalam sediaan farmasi Metode ini termasuk perhitungan kembali secara kuantitatif dan batas tes. c. Kategori III, Mencakup prosedur analisis yang digunakan untuk menentukan performa karakteristik, misalnya disolusi dan pelepasan obat.
Parameter Kategori I Kategori II Kategori III Kategori IV
Analisis kuantitatif Batas tes
Akurasi Ya Ya * * Tidak
Presisi Ya Ya Tidak Ya Tidak
Spesifisitas Ya Ya Tidak * Ya
LOD Tidak Tidak Ya * Tidak
LOQ Tidak Ya Ya * Tidak
Linearitas Ya Ya Tidak * Tidak
Rentang Ya Ya * * Tidak
* mungkin diperlukan, tergantung pada sifat spesifik tes
Tabel 5. Parameter analitik yang harus dipertimbangkan untuk tipe prosedur analitik yang berbeda (Anonim, 2007)
F. Landasan Teori
Penetapan kadar besi dapat dilakukan dengan pembentukan kompleks Fe(1, 10-fenantrolin)32+ antara ligan dan atom pusatnya yaitu antara ion Fe2+ dengan 1,
10-fenantrolin. Tiga molekul 1, 10-fenantrolin berikatan dengan satu molekul Fe2+ membentuk kompeks berwarna merah-oranye.
Besi dalam bentuk Fe3+ dapat ditetapkan kadarnya menggunakan 1, 10-fenantrolin dengan cara mereduksinya menjadi Fe2+ menggunakan hidrokuinon kemudian direaksikan dengan 1, 10-fenantrolin pada pH 2-9 sehingga membentuk kompleks warna merah yang stabil.
Metode yang digunakan dalam penelitian ini adalah spektrofotometri visibel karena kompleks warna Fe(1, 10-fenantrolin)32+ menyerap pada daerah tampak yaitu
G. Hipotesis
31 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non eksperimental deskriptif karena tidak ada perlakuan terhadap subyek uji dan hanya mengambarkan fenomena yang terjadi.
B. Definisi Operasional
1. Susu yang diteliti adalah susu cair siap saji merk X yang mengandung 8,75 mg zat besi dan ditujukan pengunaanya untuk ibu hamil.
2. Kadar besi dalam sampel dinyatakan dalam miligram dan dihitung secara spektrofotometri visible.
3. Parameter validitas metode analisis yang digunakan dalam penelitian ini adalah akurasi, presisi, linearitas dan rentang, spesifisitas, LOD, dan LOQ
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah 1 macam merk susu cair untuk ibu hamil dari pabrik tertentu, Fe(NH4)2(SO4)2.6H2O (p.a Merck
D. Alat-Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah spektrofotometer UV-tampak Perkin Elmer Lambda 20 part number 0993-5055, neraca analitik (Scaltek), mikropipet (Accura 821) dan seperangkat alat gelas yang biasa digunakan untuk analisis.
E. Jalannya penelitian
1. Pengambilan sampel
Sampel yang digunakan dalam penelitian ini adalah sampel susu cair untuk ibu hamil merk X. Pengambilan 1 merk sampel ini didasarkan persyaratan minimal pengambilan sampel dengan populasi kecil yaitu minimal 20 % dari sampel yang beredar dipasaran. Sejauh sepengetahuan peneliti hanya ada 1 merk sampel susu cair untuk ibu hamil yang beredar dipasaran, sehingga digunakan 1 merk susu cair untuk ibu hamil.
2. Pembuatan larutan pereaksi
a. Larutan hidrokuinon 2 % b/v. Timbang 0,5 g hidrokuinon, masukkan dalam labu ukur 25 ml dan tambahkan akuades sampai tanda (harus dibuat selalu baru).
c. Larutan natrium asetat 5 % b/v. Timbang 5 g natrium asetat, masukkan dalam labu ukur 100 ml dan tambahkan akuades sampai tanda
d. Larutan stok Fe2+. Timbang kurang lebih seksama 30,0 mg Fe(NH4)2(SO4)2.6H2O, masukkan dalam labu ukur 100 ml, tambahkan 0,1 ml H2SO4
dan tambahkan akuades sampai tanda.
3. Optimasi metode
a. Penetapan operating time. Masukkan salah satu dari seri kurva baku dalam kurvet setelah 5 menit pengenceran, baca serapannya pada panjang gelombang serapan maksimum teoritis 510 nm.
b. Penetapan panjang gelombang serapan maksimum. Ambil dari seri kurva baku yang berisi larutan stok 0,450; 0,600; 0,750 ml larutan stok Fe2+. Baca serapannya pada panjang gelombang 400-600 nm. Panjang gelombang serapan maksimum ditandai dari nilai serapan yang paling besar.
4. Pembuatan seri kurva baku
Masukkan kedalam labu 10 ml sebanyak 0,300; 0,450; 0,600; 0,750 dan 0,900 ml larutan stok Fe2+. Tambahkan larutan yang berisi 0,1 ml H2SO4 p dalam 100
5. Pembuatan blangko
Masukkan kedalam labu 10 ml sebanyak 1 ml larutan berisi 0,1 ml H2SO4 p
dalam 100 ml akuades. Tambahkan natrium asetat sampai pH 3-4. Tambahkan 1 ml larutan hidrokuinon dan 1 ml larutan 1, 10-fenantrolin, tambahkan akuades hingga tanda.
6. Uji kualitatif
Pipet sebanyak 10,0 ml susu, masukkan dalam cawan porselen kemudian difurnis sampai menjadi abu (2 jam). Tambahkan HCl 6 M dalam cawan porselen, panaskan selama kurang lebih 15 menit. Saring dengan kertas saring dan masukkan dalam labu 10 ml. Tambahkan akuades sampai tanda. Dari larutan di atas pipet sebanyak 1 ml masukkan dalam tabung reaksi dan lakukan uji kualitatif dengan pereaksi Kalium ferrosianida, Kalium ferrisianida, Kalium tiosianat (KSCN), dan 1, 10-Fenantrolin dan hidrokuinon sebagai pereduksi, tetes demi tetes.
7. Penetapan kadar besi
labu ukur 10 ml. Tambahkan natrium asetat sampai pH 3-4, kemudian tambahkan 2 ml larutan hidrokuinon dan 1 ml larutan 1, 10-fenantrolin, tambahkan akuades hingga tanda. Baca serapannya setelah operating time ( 10 menit setelah pengenceran ) pada panjang gelombang 510,4 nm.
8. Pembuatan baku untuk recovery
Timbang kurang lebih seksama 30,0 mg Fe(NH4)2(SO4)2.6H2O, masukkan
dalam labu ukur 100 ml, tambahkan 0,1 ml H2SO4 dan tambahkan akuades sampai
tanda.
9. Perolehan kembali (recovery)
Pipet sebanyak 10,0 ml susu masukkan dalam cawan porselen, tambahkan 2,0 ml larutan Fe(NH4)2(SO4)2.6H2O untuk recovery di atas kemudian panaskan pada
F. Analisis Hasil
Analisis hasil yang digunakan dalam penelitian ini meliputi analisis kualitatif dan analisis kuantitatif. Analisis kualitatif dilakukan dengan reaksi warna. Analisis kuantitatif dilakukan untuk mengukur kadar besi dalam susu ibu hamil dan validasi metode yang digunakan dalam penelitian. Analisis validasi metode dilakukan dengan menguji parameter akurasi, presisi, linearitas, rentang, detection limit dan quantitation limit.
1. Akurasi
Akurasi ini dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Persen perolehan kembali dapat dihitung dengan cara:
Recovery =
CF = konsentrasi total sampel yang diperoleh dari pengukuran
CA = konsentrasi sampel sebenarnya
C*A = konsentrasi analit yang ditambahkan
Menurut Harmita metode memiliki akurasi yang baik bila nilai recovery berada dalam rentang 90-107 %.
2. Presisi
Presisi dapat dinyatakan sebagai koefisien variasi (KV). Koefisien variasi dapat dihitung dengan cara sebagai berikut:
Metode ini dikatakan baik jika memiliki nilai KV kurang dari 8 %. 3. Linearitas
Koefisien korelasi (r) menunjukkan linearitas metode. Bila nilai r hitung > r tabel, pada derajad bebas = n-2, dan taraf kepercayaan 99,9 % (De Muth, 1999), maka linearitas metode analisis dapat diterima yaitu sebesar 0,991.
4. Spesifisitas
Spesifisitas dapat dilihat dengan cara membandingkan larutan baku dengan sampel. Metode ini memiliki spesifitas yang baik jika memiliki bentuk spektra yang mirip antara larutan baku dan sampel.
5. Batas deteksi (Limit of Detection) dan Batas kuantitasi (Limit of Quantitation) Limit of Detection dan Limit of Quantitation dapat dihitung dengan rumus
sebagai berikut:
Limit Of Detection = b Sy/x
. 3
Limit Of Quantitation = b Sy/x . 10
(Harmita, 2004).
38 BAB IV
HASIL DAN PEMBAHASAN
Uji kualitatif dalam penelitian ini bertujuan untuk melihat apakah ada zat besi dalam sampel. Uji kualitatif untuk besi Fe2+ dilakukan dengan menggunakan kalium heksasianoferat (II), kalium heksasianoferat (III), KSCN dan dengan pereaksi 1, 10-fenantrolin. Ada banyak lagi uji kualitatif, seperti menggunakan hidrogen peroksida, amonia, ammonium sulfate dan reagensia 2,2 bipiridil tidak dilakukan karena uji kualitatif di atas sudah dapat mewakili untuk uji kualitatif besi dalam sampel. Maka untuk uji kualitatifnya hanya dibatasi seperti yang ditulis di atas saja.
1. kalium heksasianoferat (II)
Terjadi pemecahan garam Fe yang disebabkan oleh adanya HCl 6 M, Fe2+ yang terbentuk akan teroksidasi oleh udara menjadi Fe3+. Hasil yang terbentuk adalah endapan bewarna biru muda (hasil positif), jadi dalam sampel terdapat Fe. Reaksinya sebagai berikut:
4Fe3+ +3(Fe(CN)6)4- Fe4(Fe(CN)6)3
(endapan biru muda)
2. kalium heksasianoferat (III)
Fe2+ akan teroksidasi oleh udara menjadi Fe3+. Dan kalium heksasianoferat (III) direduksi menjadi kalium heksasianoferat (II). Reaksi antara Fe3+ dengan heksasianoferat (II) akan membentuk endapan berwarna biru tua (hasil positif), jadi dalam sampel terdapat Fe.
Reaksinya sebagai berikut:
Oksidasi : Fe2+ Fe3+ + e-
reduksi : (Fe(CN)6)3- + e- (Fe(CN)6)4-
(Fe(CN)6)3- + Fe2+ (Fe(CN)6)4- + Fe3+
(Fe(CN)6)4- + Fe3+ Fe4(Fe(CN)6)3
(endapan biru tua)
(Svehla, 1990) 3. kalium tiosianat (III)
Dalam larutan dengan tingkat keasaman rendah, dihasilkan warna merah gelap (berbeda dengan ion besi (II)), yang disebabkan oleh susunan dari campuran besi (III) tiosianat, reaksinya dapat digambarkan sebagai berikut:
Fe3+ + 6 SCN- [Fe(SCN)6]-3
Pembuatan larutan stok dibuat dengan cara menimbang kurang lebih seksama 30,0 mg Fe(NH4)2(SO4)2.6H2O dengan menggunakan neraca semimikro.
Kemudian dilarutkan dalam air dan ditambah 0,1 ml H2SO4 98 % untuk membentuk
Penambahan natrium asetat bertujuan untuk meningkatkan pH dan menjaga kondisi pH supaya tetap stabil. Prisipnya adalah natrium asetat yang ditambahkan dalam air akan terdisosiasi menjadi ion natrium dan ion asetat, ion asetat yang hasil dari disosiasi natrium asetat yang ditambahkan akan mengikat kelebihan ion H+ yang disebabkan dari penambahan asam dan membentuk asam asetat, sehingga pH akan menjadi menigkat,reaksinya sebagai berikut:
CH3COONa Na+ + CH3COO
-CH3COO- + H+ CH3COOH
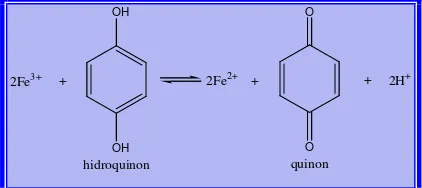
Kompleks warna yang terbentuk dari besi dengan 1, 10-fenantrolin dapat terjadi pada kondisi pH 2-9 dan stabil untuk jangka waktu yang lama (Basset, 1994). Keasaman yang diharapkan pada penelitian ini adalah 3,5 pada pH ini terbentuk kompleks Fe2+ dengan 1,10-fenantrolin yang optimal.dan mencegah pengendapan garam besi (skoog et al,1994). Pengunaan hidrokuinon yang berfungsi sebagai reduktor yang akan mengalami oksidasi sebagai kuinon sehingga mereduksi ion Fe3+ menjadi Fe2+ dan menjaganya tetap dalam bentuk Fe2+. Pembentukan kompleks dari 1,10 fenantrolin dapat terbentuk dengan adanya ion Fe2+. Reaksi reduksi-oksidasi antara Fe3+ dan hidrokuinon dapat digambarkan sebagai berikut:
OH OH
O O
2Fe3+ + 2Fe2+ + + 2H+
hidroquinon quinon
Operating time adalah waktu yang diperlukan untuk semua analit bereaksi
dengan pereaksi dan membentuk kompleks yang stabil. Penentuan operating time dilakukan dengan cara mengukur salah satu kadar dari seri kurva baku, yaitu menggunakan kadar tengah dari seri kurva baku (2,58ppm). Penetapan waktu operating time ini dilakukan selama 30 menit dan pengukurannya dilakukan 5 menit
setelah pencampuran Fe2+ dengan 1, 10-fenantrolin pada panjang gelombang teoritis yaitu 510 nm. Kurva operating time dapat dilihat sebagai berikut:
Gambar 5. Spektra penetapan waktu operating time
Pada penelitian ini dilakukan optimasi panjang gelombang serapan maksimum sebelum pembuatan kurva baku dan pengukuran sampel. Karena pada panjang gelombang serapan maksimum perubahan konsentrasi dari analit akan memberikan perbandingan respon yang paling besar, sehingga akan diperoleh kepekaan dalam analisis yang maksimum. Hal ini dapat menyebabkan kesalahan yang terjadi akan semakin kecil dalam pengulangan. Penetapan panjang gelombang serapan maksimum ini dilakukan terhadap tiga seri kurva baku, yaitu pemipetan 0,450; 0,600 dan 0,750 ml, dengan konsentrasi 1,935; 2,58 dan 3.225 ppm, dan rentang panjang gelombang pembacaan adalah 400-600 nm.
Gambar 6. Spektra panjang gelombang serapan maksimum ( max) tiga seri kadar larutan baku
Fe2+ (a = 3,225 ppm; b= 2,58 ppm; c = 1,935 ppm)
a
b
Berdasarkan ketiga spektra di atas menunjukan bahwa panjang gelombang yang memberikan serapan maksimum diperoleh pada panjang gelombang 510,4 nm, mendekati dengan literatur yaitu 510 nm (Singh et al, 2004), Dari hasil penelitian ini memenuhi persyaratan dari Farmakope Indonesia edisi IV tahun 1995, karena hasil penelitian ini berbeda 0,4nm dengan panjang gelombang serapan maksimum teoritis yang ada diliteratur. Berdasarkan farmakope indonesia edisi IV tahun 1995, perbedaan panjang gelombang serapan maksimum antara teoritis dan percobaan tidak boleh lebih dari 2 nm.
Pembuatan kurva baku dilakukan dengan cara memipet 0,300; 0,450; 0,600; 0,750 dan 0,900, dengan konsentrasi 1,28 ppm; 1,92 ppm; 2,56 ppm; 3,20 ppm dan 3,84 ppm. persamaan kurva baku yang didapat akan dipakai untuk mengukur kadar besi dalam sampel. Pada penelitian ini diperoleh 3 persamaan kuva baku, yaitu sebagai berikut:
Replikasi I Replikasi II Replikasi III
Konsentrasi
Dari ketiga replikasi di atas dapat disimpulkan bahwa ada korelasi yang baik antara serapan dan seri kadar Fe2+, hal ini dapat dilihat dari nilai koefisien korelasi (r) dari penelitian lebih besar dari nilai r tabel, Dari ketiga persamaan di atas dipilih persamaan yang paling linear (nilai koefisien korelasi (r) mendekati 1), yaitu pada replikasi ke-3 yaitu y = 0,212 x – 0,048, sehingga hubungan antara kadar dan serapan mendekati linier dan sesuai dengan hukum Lambert-Beer. Persamaan di atas dapat disajikan pada gambar di bawah ini:
Kurva Baku
0.0000 0.5000 1.0000 1.5000 2.0000 2.5000 3.0000 3.5000 4.0000 4.5000
Kadar Besi (ppm)
Gambar 7. Serapan kompleksFe2+ dengan 1, 10-fenantrolin vs konsentrasi Fe2+
Dilihat dari koefisien korelasi persamaan kurva baku ini baik karena nilai r hasil yaitu 0,9974 lebih besar dari r tabel dengan taraf kepercayaan 99,9 % dengan df = 3 yaitu sebesar 0,991 (De Muth, 1999), sehingga dapat disimpulkan bahwa ada korelasi yang baik antara serapan dan seri kadar Fe2+.
dahulu dengan tujuan untuk menghilangkan air dalam sampel, karena jika air tidak dihilangkan terlebih dahulu pada saat sampel dipijarkan dalam funis akan memercik keluar dan menggangu dalam penetapan kadar, karena adanya kemungkinan untuk besi yang keluar bersama air. Kemudian dipanaskan dalam furnis pada suhu 300 oC selama 30 menit untuk memastikan semua sampel sudah menjadi arang, karena jika masih ada lemak dalam sampel yang belum diarangkan sampel tersebut dapat memercikan api dan menyebabkan keluarnya besi bersama percikan api, sehingga dapat menggangu penetapan kadarnya. Dipijarkan pada suhu 600-700 oC dengan mengunakan furnis selama 4 jam, sehingga yang tertinggal hanya senyawa anorganik saja dan senyawa organik sudah berubah menjadi CO2, H2O dan gas-gas lainnya,
reaksinya adalah sebagai berikut:
M n+ + CuHvOwNxPySz + ½(2u + ½v + 2x + 2z + ¼y - w)O2 M(s) + u CO2(g) + ½v H2O(g) + x NO2(g)+ z SO2(g)+ ¼y P4O10(g) 600o-700oC
Fe + 2HCl Fe2+ + 2Cl- + H2(g)
Fe + 3HCl Fe3+ + 3Cl- + 1 2 1
H2(g)
pemanasan di atas waterbath selama 15 menit bertujuan untuk menghilangkan gangguan dari pirophosphate. Penyaringan larutan bertujuan untuk menghilangkan kotoran yang dapat menggangu pengamatan sebab larutan dalam spektroskopi haruslah jernih, jika ada ganguan dari partikel asing maka dapat menyebabkan kesalahan pada pembacaan. Kemudian diambil 1,0 ml larutan sampel masukkan dalam labu 10 ml dan ditambahkan natrium asetat sampai pH antara 3-4, kondisi pH dibuat antara 3-4 disebabkan karena dalam pH ini terbentuk kompleks Fe dengan 1, 10-fenantrolin yang stabil dengan pembentukan warna yang cepat dan mencegah pengendapan garam besi (Fe3+) karena terlalu basa (Skoog et al, 1994)
Fe3+ + OH- Fe(OH)3(s)
sehingga dimungkinkan untuk pengukuran. Selain itu pada kondisi 3-4 kita dapat mengeliminasi gangguan dari tembaga (Harry dan Tracy, 2007). Penambahan hidrokuinon berfungsi untuk mereduksi besi yang berada dalam bentuk Fe3+ menjadi Fe2+ dan menjaganya tetap menjadi Fe2+.
1, 10 fenantrolin
kompleks Fe(1, 10-fenantrolin)32+
Gambar 8. Pembentukan kompleks antara Fe2+ dengan 1, 10-fenantrolin (Anonim, 2004b)
Penambahan 1,10-fenantrolin dilakukan paling akhir setelah Fe3+ menjadi Fe2+ dikarenakan intensitas warna yang baik dibentuk oleh Fe2+ yakni berwarna merah-oranye.
Ion logam Fe2+ atau atom pusat bertindak sebagai donor elektron (basa lewis) sedangkan 1, 10-fenantrolin atau bertindak ligan sebagai aseptor elektron (asam lewis), Pembentukan kompleks ini merupakan perkecualian dari kompleks-kompleks ion logam dan ligan lainnya (Skoog et al, 1998).
Gambar 9. Spliting pada orbital d pada kompleks oktahedral
1,10-fenantroline merupakan ligan kuat maka perbedaan energinya (hv) menjadi besar, sehingga gaya tolak elektron tidak mampu mendorong elektron menempati orbital dz2 dan dx2-y2
Gambar 10. Spliting orbital d pada Fe2+ dengan adanya ligan 1,10-fenantrolin
Transisi elektron yang terjadi pada kompleks ini adalah d *, elektron dari t2g pada orbital d yang memiliki energi yang lebih rendah akan bertransisi ke orbital
*
kecil sehingga akan mengeser senyawa komplek ke panjang gelombang yang lebih panjang sehingga akan menimbulkan warna merah-oranye. Transisi elektron dari d
*
dapat digambarkan sebagai berikut:
Gambar 11. Transisi elektron dari orbital d ke *
Pembentukan ikatan koordinasi dari Fe2+ dengan 1, 10- fenantrolin dapat dijelaskan sebagai berikut:
Orbital Fe2+
Orbital Fe2+ karena adanya pengaruh ligan kuat
Orbital Fe2+ dalam [(C12H8N2)3Fe]2+
3d 4s 4p
3d 4s 4p
3d Hibridisasi d2sp3
Gambar 12. pembentukan ikatan koordinasi pada kompleks [(C12H8N2)3Fe]2+
4p, sehingga 6 pasang PEB ( pasangan elektron bebas )dari 1, 10- fenantroline akan masuk dalam orbital d2sp3 sehingga dapat terbentuk ikatan koordinasi dengan Fe2+.
Hasil penetapan kadar besi dalam susu cair untuk ibu hamil dengan pereaksi 1,10-fenantrolin dapat dilihat sebagai berikut:
Volume sampel (ml) Serapan Kadar dalam 200ml
sampel (mg)
10,0 0,358 3,83
10,0 0,330 3,57
10,0 0,316 3,43
10,0 0,337 3,63
10,0 0,334 3,60
10,0 0,336 3,62
Tabel 7. Hasil penetapan kadar besi dalam sampel susu cair untuk ibu hamil
Contoh perhitungan kadar besi dalam sampel dapat dilihat pada lampiran 6. Kadar Fe rata-rata dalam sampel susu cair untuk ibu hamil yang diperoleh pada metode ini adalah sebesar 3,61 ± 0,13 mg, dengan KV 3,56 %. Hasil dari perhitungan ini berbeda dengan hasil yang dicantumkan pada label kemasan susu cair untuk ibu hamil yaitu sebesar 8,75 mg, hal ini disebabkan karena ada kemungkinan berat zat besi yang tercantum dalam kemasan merupakan berat dari garam besi. Tetapi peneliti tidak mengetahui jenis dari garam besi yang digunakan pada susu cair untuk ibu hamil ini.
validasi yang digunakan adalah akurasi, presisi, linearitas, rentang, LOD, LOQ dan spesifisitas.
Akurasi metode analisis dapat digambarkan melalui % recovery. Penetapan % recovery dilakukan dengan cara menambahkan sejumlah tertentu baku Fe2+ ke dalam sampel susu cair untuk ibu hamil, kemudian dibaca serapannya dan dibandingkan dengan kadar perhitungan yang ditambahkan.
Akurasi menggambarkan kedekatan hasil yang diukur melalui metode dengan kadar sebenarnya. Menurut Harmita, akurasi yang baik untuk suatu sampel pada kadar antara 10 ppm sampai 100 ppm memiliki % recovery sebesar 90-107 %. Dari hasil 6 replikasi didapatkan hasil sebagai berikut:
Serapan Kadar terukur (ppm) Kadar terukur yang ditambahkan (ppm)
Tabel 8. Data persen perolehan kembali (recovery)
Rentang recovery yang diperoleh adalah 97,53-101,12 %, berarti metode ini memiliki akurasi yang baik karena masih dalam rentang 90-107 % (Harmita, 2004).
menurunnya konsentrasi pada analit. Semakin kecil nilai koefisien variasi yang diperoleh, maka semakin baik presisi metode yang digunakan.
Berdasarkan hasil pengukuran pada keenam replikasi didapatkan nilai KV sebesar 2,52 %. Menurut Harmita suatu metode memiliki presisi yang baik jika metode tersebut memiliki koefisien variasi sebesar 8 %. Hasil dari penelitian ini menunjukkan bahwa presisi pada metode ini sudah memenuhi persyaratan.
Lineraritas dapat kita lihat berdasarkan nilai koefisien korelasi (r). Linearitas menggambarkan hubungan antara kadar dengan serapan. Semakin koefisien korelasi (r) mendekati 1 maka semakin baik korelasinya dan hubungan antara kadar dengan serapan akan semakin baik, sehingga peningkatan kadar dan serapan akan berbanding lurus. Dari hasil pengukuran diperoleh nilai r masing-masing 0,9944; 0,964; dan 0,9974. nilai r dari hasil pengukuran ini sudah melebih persyaratan dari r tabel dengan taraf kepercayaan 99,9 % dengan df = 3 yaitu sebesar 0,991 (De Muth, 1999), dan diperoleh rentang sebesar 1,28 sampai 3,84 ppm. Dengan demikian metode penetapan kadar besi dalam susu cair untuk ibu hamil ini memiliki kolerasi yang baik pada rentang kadar 1,28 sampai 3,84 ppm.
ini memiliki spesifisitas yang baik. Dari hasil scaning dapat dilihat perbandingan spektra sampel dan baku:
Gambar 13. Spektra scaning panjang gelombang dari baku (a) dan sampel (b)
Berdasarkan spektra tersebut maka dapat disimpulkan bahwa metode ini memiliki spesifitas yang baik, karena kedua spektra di atas menunjukan kemiripan. Jadi yang diukur merupakan senyawa yang sama yaitu kompleks antara Fe2+ dengan 1,10- fenantrolin.
Detection limit menunjukan respon terkecil dari analit yang menghasilkan
2-3 kali respon blangko, sedangkan quantification limit menunjukkan respon terkecil analit yang mampu memberikan sinyal 10 kali dari respon blangko dan masih memiliki akurasi dan presisi yang baik.
a
55 BAB V
KESIMPULAN
1. Metode spektrofotometer visibel pada penetapan kadar besi dalam susu cair untuk ibu hamil dengan menggunakan pereaksi 1, 10-fenantrolin memiliki validitas yang baik dilihat dari perolehan kembali sebesar 97,53-101,12 %, koefisien variasi sebesar 2,52 %, koefisien korelasi sebesar 0,997, dan spesifitas pada rentang kadar besi antara 1,28 ppm sampai 3,84 ppm.
56 diakses pada tanggal 21 juli 2008.
Anonim, 2004a, http://72.14.235.104/search?q=cache:c7VmGXFVLbAJ:library.usu. ac.id/download/fk/fkarlinda%2520sari2.pdf+besi+SNI+fe+susu&hl=id&ct= clnk&cd=4&gl=id&client=firefox-a. Diakses pada tanggal 21 Juli 2008
Anonim, 2004b, Determination of Iron with 1,10-Phenanthroline, http://www.chem.utk.edu/~chem319/Experiments/exp10.pdf. diakses pada tanggal 11 Agustus 2008.
Anonim, 2006a, http://www.fitnessindonesia.com/info/mineral %20pembangun % 20tubuh.htm. Diakses pada tanggal 21 Juli 2008
Anonim, 2006b, Determination of Iron using Potassium Dichromate: Redox Indicator,http://wwwchem.uwimona.edu.jm:1104/lab_manuals/c10expt31.h tml, Diakses tanggal 14 Mei 2008.
Anonim, 2007, The United States Pharmacopeia 30th The National Formulary 25th, United States Pharmacopeal Convention, inc., New York.
Anonim, 2008a, http://72.14.235.104/search?q=cache:3G9snbTau3YJ:rac.uii.ac.id/
server/document/Public/20080128023102ANALISIS %2520
%2520KANDUNGAN
%2520Sn.doc+besi+SNI+fe+susu&hl=id&ct=clnk&cd=8&gl=id&client=fir efox-a. Diakses pada tanggal 21 Juli 2008
Anonim, 2008b, http://www.chem-is-try.org/?sect=belajar&ext=anorganik08_05. Diakses pada tanggal 21 Juli 2008
Anonim, 2008c, Spectrophotometric Determination of Iron in a Vitamin Tablet, : http://www.bc.edu/schools/cas/chemistry/undergrad/gen/fall/Iron.pdf, Diakses pada tanggal 6 Agustus 2008
Anonim, 2008d, Colorimetric Determination of Iron in Vitamin Tablets, http://www.apsu.edu/chem_page/General %20Chemistry %20labs/Chem
%20posting/Colorimetric %20Determination %20of %20Iron %20in %20Vitamin %20Tablets %20_2.pdf, Diakses pada tanggal 11 Agustus 2008
Anonim, 2008e, MIMS Petunjuk Konsultasi, edisi 7, A18, Penerbit PT InfoMaster, Jakarta.
Bassett, J., Denney, R.C., Jeffery, G.H., Mendham, J., 1994, Vogel’s Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis, edisi 4, 406-409, 420, 863-866, diterjemahkan oleh Pudjaatmaka, A.H., Penerbit Buku Kedokteran EGC, Jakarta.
Beck, M. E., 1995, Ilmu Gizi dan Diet Hubungannya dengan Penyakit-Penyakit Untuk Perawat dan Dokter, diterjemahkan oleh Hartono, A., 37-38, Yayasan Essentia Medica, Yogyakarta
Cristian, G.D., 2004, Analitical chemistry, 6th Ed, 750, 751, 752, 765, 766, John Wiley & Sons Inc. U.S.America.
Day, R.A. and Underwood,A.L.,1996, analisi kimia kuantitatif , diterjemahkan oleh Iis Sopyan, edisi 5, 382-421, Erlangga, Jakarta.
De Muth, J,E., 1999, Basic Statistics and Pharmaceutical Statistical Application, 585, Marcel Dekker, Inc, New York.
Fessenden, R.J. dan Fessenden, J.S., 1986, Kimia Organik, Edisi Ketiga, Jilid 2, dialihbahasakan oleh Pudjaatmaka A. H, 436-447, Penerbit Erlangga, Indonesia
Harmita, 2004, Petunjuk Pelaksanaan Validasi dan Cara Perhitungannya, http://jurnal.farmasi.ui.ac.id/pdf/2004/v01n03/Harmita010301.pdf, diakses pada tanggal 28 Juli 2008.
Harris, D.C., 1999, Quantitative Chemical Analysis, 5th Ed., 863-864, W.H. Freeman and Company, New York
Mulja, H.M. dan Suharman, 1995, Analisis Instrumental, 32, Airlangga University Press, Surabaya.
Muson, J.W., 1991, Analisis Farmasi, diterjemahkan oleh Drs. Harjana M. Sc, Airlangga University Press, Surabaya
Mutschler, E.,1991, Dinamika Obat, diterjemahkan oleh Widianto, M.B, Ranti, A.S, 407-409, Penerbit ITB, Bandung
Prabowo, Y., 2006, Penetapan Kadar Besi dalam Kapsul Anemia secara Spektrofotometri Visbel dengan Pereaksi O-Fenantroline, Skripsi, Universitas Sanata Dharma, Yogyakarta.
Pyenson. H dan Tracy., P.H., 2008, 1,10-Phenanthroline Method For The Determination Of Iron In Powdered Milk, http://jds.fass.org/cgi/reprint/28/5/401.pdf, diakses tanggal 12 Februari 2008.
Rivai, H., 1995, Asas Pemeriksaaan Kimia, 333-344,UI Press, Jakarta.
Sastrohamidjojo, H.,1991, Spektroskopi, Edisi II, 23-26, 39-41, Penerbit Liberty, Yogyakarta.
Singh, D.K., Srivastava, B., Sahu, A., 2004, Spectrophotometric Determination of Rauwolfia Alkaloids: Estimation of Reserpine in Pharmaceuticals. http://www.jstage.jst.go.jp/article/analsci/20/3/571/_pdf. Diakses pada tanggal 7 september 200b
Skoog, D.A., Holler, F.J., Nieman, T.A., 1998, Principles of Instrumental Analysis, 5th Ed., 330-340, Saunders College Publishing, Philadelphia
Skoog, D.A., West, D.M., Holler, F.J., 1994, Analytical Chemistry, An Introduction, 6th Ed., 416-418, Saunders College Publishing, Philadelphia
Sohimah, 2008, Anemia pada ibu hamil. http://ahmadrofiq.com/?p=19#more-19 Diakses pada tanggal 10 Mei 2008
Svehla, G., 1990, Textbook of Macro and Semimicro Qualitative Inorganic Analysis, diterjemahkan oleh L. Setiono, Pudjatmaka, A.H., 256-260, Universitas Indonesia Press, Jakarta.
Lampiran 1. Komposisi susu cair untuk ibu hamil merk X
Asam pantotenat 1,505 mg
Lampiran 2. Data pembuatan kurva baku Data penimbangan kurva baku
Replikasi 1 Replikasi 2 Replikasi 3
Bobot kertas (mg) 215,9 226,9 222,2
Persamaan garis regresi linear yang diperoleh:
Konsentrasi Fe vs Serapan
A = - 0,0584 B = 0,2113 r = 0,9964
Persamaan garis regresi linear yang diperoleh:
y = 0,2113x - 0,0584 c. Replikasi 3
Bobot baku (mg)
Volume Pemipetan
(ml)
Konsentrasi Fe(NH4)2(SO4)2.6H2O
(ppm)
Konsentrasi Fe2+ (ppm)
Serapan
0,3 9,48 1,3500 0,24
0,45 14,22 2,0250 0,362
29,36 0,6 18,96 2,7000 0,544
0,75 23,7 3,3750 0,679
0,9 28,44 4,0500 0,797
Konsentrasi Fe vs Serapan
A = - 0,048 B = 0,212 r = 0,9974