UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK MINT VIETNAM (Persicaria odorata (Lour.) Soják) SECARA KUALITATIF DAN
KUANTITATIF DENGAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Diajukan oleh: Martina Sipayung NIM : 098114011
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
iii
iv
PERSEMBAHAN
Kupersembahkan karya ini untuk:
H ati Kudus Tuhan Yesus H ati Tersuci Bunda M aria
v
vi
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat-Nya sehingga penulis berhasil menyelesaikan karya tulis “uji aktivitas antioksidan ekstrak etanolik mint vietnam (Persicaria odorata (Lour.) Soják) secara kualitatif dan kuantitatif dengan metode DPPH”.
Dalam penulisan skripsi ini penulis banyak mendapatkan bantuan dan semangat dari berbagai pihak, maka pada kesempatan ini penulis menyampaikan rasa terima kasih kepada:
1. Bapak Ipang Djunarko, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Yohanes Dwiatmaka selaku Dosen Pembimbing yang setia dan sabar dalam membimbing dan mengarahkan serta memberi masukan yang berguna bagi penulis.
3. Bapak Prof. Dr. C. J. Soegihardjo, Apt. selaku Dosen Penguji yang selalu memberikan perhatian, arahan, bimbingan dan masukan yang sangat berguna
4. Bapak Enade Perdana Istyastono, Ph.D., Apt. selaku Dosen Penguji yang selalu memberikan perhatian, arahan, bimbingan dan masukan yang berguna.
viii
6. Teman penelitian saya yang istimewa, Indah Kertawati yang membantu dan memberi semangat hingga selesainya penulisan skripsi ini.
7. Kepala dan Staff Laboratorium Farmakognosi Fitokimia serta Staff Laboratorium Kimia Analisis Instrumental Universitas Sanata Dharma, Mas Wagiran, Mas Sigit, Mas Bimo, Mas Parjiman, Mas Andri, dan Mas Parlan, Mas kunto, yang selalu membantu peneliti dengan sabar.
8. Sahabatku Sr.M.Faustina Korbafo FCJM, Sr.M.Eufrasia FCJM, Sr.Isabella FSE, Maya Nuswantari, Defi Krishartanti, Meita Eryanti, Mayke Prasastia, Filbert Hita Kumaro, Paulus Halek, yang selalu mendengarkan keluh kesah dan memberikan semangat.
9. Seluruh para suster kongregasi FCJM, seluruh anggota Kekanta, seluruh anggota Cor Unum, seluruh anggota FBB yogyakarta.
10.Teman-teman angkatan 2009, khususnya kelas FSM A dan FKK A atas segala kebersamaan selama masa perkuliahan.
11.Semua pihak yang penulis tidak dapat sebutkan satu per satu dalam memberikan bantuan, baik bantuan secara langsung maupun tidak langsung dalam menyelesaikan penulisan skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun. Semoga skripsi ini dapat berguna dan bermanfaat bagi penulis khususnya dan pembaca pada umumnya.
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN SKRIPSI BERJUDUL ... iii
PERSEMBAHAN ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
x
2. Keaslian penelitian ... 4
3. Manfaat penelitian ... 4
B. Tujuan Penelitian ... 5
1. Tujuan umum ... 5
2. Tujuan khusus ... 5
BAB II. PENELAAHAN PUSTAKA ... 6
A. Mint vietnam ... 6
1. Uraian tanaman ... 6
2. Morfologi ... 6
3. Kandungan fitokimia... 7
4. Khasiat dan kegunaan ... 7
B. Senyawa Fenolik ... 8
C. Antioksidan ... 9
1. Radikal bebas ... 9
2. Antioksidan... 10
3. Manfaat antioksidan ... 11
D. Metode pengujian aktivitas antioksidan ... 11
1. metode pengujian aktivtas antioksidan secara umum ... 11
2. metode DPPH ... 11
xi
4. spektrofotometri ultraviolet (UV) dan sinar tampak (Visibel) ... 16
E. Ekstraksi ... 19
F. Skrining Fitokimia ... 21
1. Alkaloid ... 21
2. Flavonoid ... 22
3. Saponin ... 24
4. Tanin ... 25
5. Triterpenoid dan steroid ... 26
G. Validasi Metode Analisis ... 27
1. Akurasi ... 27
2. Presisi ... 27
3. Linearitas ... 27
4. Spesifisitas ... 28
H. Landasan Teori ... 29
I. Hipotesis ... 30
BAB III. METODE PENELITIAN ... 31
A. Jenis dan Rancangan Penelitian ... 31
B. Variabel Penelitian ... 31
C. Bahan penelitian ... 32
xii
E. Tata Cara Penelitian ... 32
1. Determinasi tanaman mint vietnam ... 32
2. Skrining fitokimia ... 33
3. Pembuatan ekstrak etanolik mint vietnam ... 36
4. Pembuatan larutan DPPH, pembanding, dan larutan uji ... 37
5. Uji kualitatif DPPH dengan Kromatografi Lapis Tipis ... 37
6. Uji kuantitatif DPPH dengan spektrofotometri visibel ... 39
7. Validasi metode DPPH ... 40
8. Estimasi aktivitas antioksidan ... 40
BAB IV. HASIL DAN PEMBAHASAN ... 41
A. Hasil Determinasi Tanaman ... 41
B. Hasil Pengumpulan Sampel ... 41
C. Hasil Preparasi Sampel ... 42
D. Hasil Skrining Fitokimia ... 45
E. Hasil Uji Kualitatif DPPH dengan KLT ... 53
1. Hasil identifikasi golongan flavonoid ... 54
2. Hasil identifikasi golongan tanin ... 55
F. Hasil Uji Kuantitatif Aktivitas Antioksidan Ekstrak Etanolik Mint vietnam ... 57
xiii
H. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 67
BAB V KESIMPULAN DAN SARAN... 73
A. Kesimpulan ... 73
B. Saran ... 73
DAFTAR PUSTAKA ... 74
LAMPIRAN ... 79
xiv
DAFTAR TABEL
Halaman
Tabel I. Tingkat kekuatan antioksidan dengan metode DPPH ... 13
Tabel II. Hasil %recovery dan %CV uji aktivitas antioksidan rutin ... 65
Tabel III. Hasil %recovery dan %CV uji aktivitas antioksidan ekstrak etanolik. . 65
Tabel IV. Hasil %IC rutin menggunakan radikal bebas DPPH... 68
Tabel V. Hasil %IC ekstrak etanolik menggunakan radikal bebas DPPH ... 69
Tabel VI. Hasil nilai IC50 ekstrak etanolik mint vietnam dan rutin ... 70
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Perubahan warna larutan pada reaksi radikal DPPH ... 12
Gambar 2. Reaksi uji Mayer... 46
Gambar 3. Hasil uji alkaloid... 46
Gambar 4. Reaksi hidrolisis saponin ... 47
Gambar 5. Hasil uji saponin ... 48
Gambar 6. Hasil uji tanin ... 49
Gambar 7. Hasil uji triterpenoid dan steroid ... 52
Gambar 8. Hasil uji flavonid ... 53
Gambar 9. Peredaman warna DPPH oleh senyawa antioksidan . ... 54
Gambar 10. Hasil KLT identifikasi senyawa flavonoid. ... 55
Gambar 11. Hasil KLT identifikasi senyawa tanin dengan fase gerak n-butanol : acetic acid glasial: water ... 56
Gambar 12. Hasil KLT identifikasi senyawa tanin dengan fase gerak metanol: asam asetat ... 56
Gambar 13. Hasil KLT identifikasi senyawa tanin dengan fase gerak etil asetat: metanol : asam asetat ... 57
Gambar 14. Hasil uji pendahuluan aktivitas antioksidan ... 59
Gambar 15. Grafik hasil penentuan OT rutin ... 60
Gambar 16. Grafik hasil penentuan OT ekstrak mint vietnam ... 60
Gambar 17. Gugus kromofor dan auksokrom DPPH ... 61
xvi
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Tanaman mint vietnam (Persicaria odorata (Lour.) Soják ... 79
Lampiran 2. Surat determinasi tanaman mint vietnam (Persicaria odorata (Lour.) Soják ... 80
Lampiran 3. Perhitungan rendemen ... 81
Lampiran 4. Data penimbangan uji kualitatif aktivitas antioksidan ... 81
Lampiran 5. Data penimbangan perekasi semprot ... 81
Lampiran 6. Data penimbangan bahan untuk uji antioksidan ... 82
Lampiran 7. Data Perhitungan konsentrasi larutan DPPH, larutan uji, dan larutan pembanding ... 82
Lampiran 8. Scanning pengoreksi ... 87
Lampiran 9. Optimasi metode uji aktivitas antioksidan ... 89
Lampiran 10. Uji aktivitas antioksidan menggunakan radikal DPPH ... 91
Lampiran 11. Perhitungan nilai IC50 ekstrak mint vietnam ... 93
xviii INTISARI
Tanaman mint vietnam (Persicaria odorata (Lour.) Soják) digunakan sebagai campuran dalam berbagai masakan serta diyakini sebagai antipiretik, antidiabetes, antiinflamasi, antitumor, dan antioksidan. Mint vietnam mengandung minyak atsiri yang tersusun atas beragam senyawa organik diantaranya senyawa golongan fenol seperti eugenol dan kavikol. Senyawa fenolik ini diketahui memiliki aktivitas menangkal radikal bebas dengan mendonorkan satu elektronnya. Dengan demikian senyawa fenolik dapat bertindak sebagai antioksidan alami yang aman untuk di konsumsi.
Penelitian ini merupakan penelitian eksperimental karena subjek uji diberi perlakuan. Metode penangkapan radikal hidroksil yang digunakan adalah metode 1,1-difenil-2-pikrilhidrazil (DPPH). Prinsip metode ini adalah penurunan intensitas warna atau absorbansi larutan DPPH yang sebanding dengan kenaikan konsentrasi senyawa antioksidan. Analisis fitokimia dilakukan secara kualitatif untuk mengetahui keberadaan senyawa metabolit sekunder mint vietnam berupa alkaloid, saponin, tanin, flavonoid, triterpenoid dan steroid. Dari hasil penelitian diperoleh bahwa mint vietnam mengandung senyawa saponin, tanin dan flavonoid. Pengujian aktivitas antioksidan dilakukan secara kualitatif (kromatografi lapis tipis (KLT)) maupun secara kuantitatif (spektroskopi). Yang digunakan Sebagai pembanding adalah rutin sebagai bahan p.a., uji kualitatif dengan KLT menunjukkan bercak berwarna kuning dengan latar belakang ungu, hal ini dikarenakan ekstrak etanolik mint vietnam memiliki aktivitas antioksidan dengan cara meredam radikal DPPH. Aktivitas antioksidan ditetapkan dengan nilai IC50
yang menunjukkan konsentrasi suatu senyawa antioksidan yang menghasilkan penangkapan 50% radikal DPPH. Uji kuantitatif menunjukkan bahwa ekstrak etanolik mint vietnam memiliki aktivitas antioksidan yang sangat kuat dengan IC50
sebesar 42,3 ± 0,7 μg/mL.
xix
ABSTRACT
Mint vietnam plants (Persicaria odorata (Lour.) Soják) is used to mixe with any kind of food. People believe that it could be used as antipyretic, antidiabetes, antiinflamasi, antitumor, and antioxidant. Mint vietnam has atsiri oil which consist of various organic chem, for example : fenol class (eugenol and kavikol). Fenolik chem has the activity to avoid radical by donor one of its electron. So that, fenolik chem could be used as natural antioxidant which is safety to be consumed.
This reserch is the experimental reserch because the experimental subjec is given action. Resercher ususes methode 1,1-difenil-2-pikrihideazil (DPPH) as the methode of catching radical hydroxil. The prinsip of this methode is the reduction of color intensity or absorbancy chem DPPH comparable with increment of concentration of antioxidant chem. The analizes of fitokimia is done qualitative to know about the existence secunder metabolit chem in mint vietnam, for example : alkaloid, saponin, tanin, flavonoid, triterpenoid and steroid. The result of this reserch showed that mint vietnam has saponin, tanin and flavonoid chem. The test of antioxide activity is done both qualitative (TLC) and quantitative (spectroscopy). Qualitative test with TLC show the yellow spotted with the background purple. It caused by etanolic extract of mint vietnam has activity of antioxide muffle DPPH radical. Antoxidant activity is setteled by the value IC50 . This value show that the concentration of one antioxide chem produce
arrest 50% DPPH radical. Quantitative test show that mint vietnam’s etanolic axtract has the strongest antioxidant activity by IC50 as big as 42,3 ± 0,7 μg/mL.
1 BAB I PENGANTAR
A. Latar Belakang
Perkembangan zamanmenyebabkan semakin tingginya tuntutan terhadap aktivitas dunia kerja. Kondisi ini akan memicu masyarakat untuk bertindak lebih cepat agar tidak ketinggalan dalam persaingan dan akhirnya berpindah kepada hal-hal yang bersifat instant termasuk pola makannya. Makanan instant dapat mengandung xenobiotik (pengawet, zat warna, penyedap rasa, pestisida, logam berat, dan zat kimia lain) yang beresiko akumulasi jangka panjang. Akumulasi jangka panjang di dalam tubuh menyebabkan xenobiotika dapat menjadi radikal bebas di dalam tubuh manusia karena zat-zat ini kemudian akan mengalami reaksi yang dinamakan reaksi oksidasi (Apriandi, 2011).
Senyawa antioksidan memegang peranan penting dalam pertahanan tubuh terhadap pengaruh radikal bebas (Kikuzaki dan Nakatani, 1993). Antioksidan dalam arti biologis adalah senyawa yang mampu untuk menangkal atau meredam dampak negatif oksidan dalam tubuh, yang dapat menunda oksidasi lipid atau molekul lain dengan menghambat awal dan propagasi reaksi berantai oksidatif (Winarsi, 2007). Antioksidan bekerja dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut bisa dihambat. Keseimbangan oksidan dan antioksidan sangat penting karena berkaitan dengan berfungsinya sistem imunitas tubuh. Kondisi tersebut terutama untuk menjaga integritas dan berfungsinya membran lipid, protein sel, dan asam nukleat serta mengontrol transduksi signal dan ekspresi gen dalam sel imun (Damayanthi, Farizal, Khalid, dan Kustiyah, 2010).
Sumber antioksidan dapat berasal dari alam maupun sintesis. Antioksidan alami seperti vitamin C, vitamin E, dan flavonoid terbukti aman dikonsumsi oleh manusia. Sedangkan antioksidan sintesis seperti butyl hydroxy anisol (BHA), propel galat (PG), tert-butyl hydroquinone (tBHQ) mempunyai efektivitas yang lebih tinggi tetapi dapat menyebabkan kanker melalui mutasi pada DNA. Hal inilah yang menyebabkan adanya penelitian eksplorasi sumber antioksidan alam yang berasal dari tumbuhan (Gulcin, Uguz, Oktay, Beydemir, and Kufrevioglu, 2004).
Mint Vietnam (Persicaria odorata (Lour.) Soják) merupakan tanaman
dalam bidang kesehatan sebagai penurun demam, antiinflamasi, sakit perut, antidiabetes, antimikroba, antitumor, dan antioksidan (Shavandi, Hadadian, and Ismail, 2012).
Kandungan senyawa fenolik mint vietnam berupa eugenol, kavikol, 4vinylphenol (Shavandi, Hadadian, and Ismail 2012), dan tanin (Bown, 2001). Menurut penelitian Sambada (2011), senyawa yang menyebabkan aktivitas antioksidan berupa senyawa fenolik. Oleh karena mint vietnam mengandung senyawa fenolik, maka penelitian ini bertujuan untuk mengetahui aktivitas antioksidan mint vietnam.
1. Permasalahan
a. Golongan senyawa apakah yang terdapat dalam ekstrak etanolik mint vietnam? b. Golongan senyawa apakah yang dalam ekstrak etanolik mint vietnam yang
berperan dalam aktivitas antioksidan?
c. Berapakah nilai IC50 ekstrak etanolik mint vietnam yang terhitung melalui
metode DPPH? 2. Keaslian penelitian
Sejauh penelusuran yang telah dilakukan peneliti, uji aktivitas antioksidan mint vietnam secara kualitatif dan kuantitatif dengan metode DPPH belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat teoretis. Memberikan informasi mengenai aktivitas antioksidan ekstrak etanolik mint vietnam.
b. Manfaat metodologi. Memberikan pengetahuan mengenai tata cara pengujian aktivitas antioksidan ekstrak etanolik mint vietnam secara kualitatif dan kuantitatif dengan metode DPPH.
B. Tujuan Penelitian 1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui potensi dan aktivitas antioksidan ekstrak etanolik mint vietnam.
2. Tujuan khusus
a. Mengetahui golongan senyawa yang terdapat dalam ekstrak etanolik mint vietnam.
b. Mengetahui golongan senyawa dalam ekstrak etanolik mint vietnam yang berperan sebagai antioksidan.
6 BAB II
PENELAAHAN PUSTAKA
A. Mint vietnam
1. Uraian tanaman
Mint vietnam (Persicaria odorata (Lour.) Soják) merupakan tanaman
herba yang termasuk dalam keluarga Polygonaceae (Katzer, 2006). Tanaman ini dikenal dengan nama yang berbeda di negara yang berbeda. Di Inggris dikenal dengan nama “Vietnamese coriander, cambodian mint, hot mint, Vietnamese mint dan Vietnamese cilantro”. Di Vietnam disebut Rau Rdm atau zow zam, di Malaysia dikenal dengan kesum atau daun kesom yang banyak digunakan sebagai bahan penyedap pada masakan; di Singapura dikenal dengan tanaman laksa, nama-nama ini mencerminkan penggunaan mint vietnam yang terkenal di Cina-Malaysia yaitu mie kari laksa dan di Hindi adalah lakh. Di Amerika Serikat tanaman ini banyak dijual dengan nama “Vietnamese coriander” (Katzer, 2006).
Mint vietnam berasal dari daerah semenanjung Asia Tenggara (Indocina).
Merupakan ramuan kuliner Asia selatan tropis (Katzer, 2006). Tanaman ini dapat tumbuh di daerah dingin sebagai tanaman pot, dapat juga ditanam selama musim panas, dengan suhu minimum 7oC (45oF) (Bown, 2001).
2. Morfologi
Mint vietnam berupa tanaman herba dengan tinggi batang mencapai
Eropa utara dan barat Asia. Mint vietnam dalam penampilan, mirip dengan gulma Eropa yang umum dikenal sebagai redshank (P.vulgaris). Baunya hampir sama dengan ketumbar, batang bersendi dan sempit, daun runcing dengan panjang sekitar 10cm (4in) yang memiliki tanda agak kehitaman berbentuk V didekat basis daun. Tanaman dapat menyebar dan akar melebar dibagian manapun ketika batang menyentuh tanah. Bunga berwarna merah muda yang dihasilkan dari waktu ke waktu, tetapi tidak umum, setidaknya tidak dalam budidaya (Katzer, 2006).
3. Kandungan fitokimia
Mint vietnam memiliki bau ketumbar yang sangat kuat. Seluruh bagian
tanaman mengandung aldehid seperti dodecanal, decanal, (Z)-3-heksanal, (E) -2 - heksanal dan (Z)-3-Hexen-1-ol, B-caryophyllene, dan seskuiterpen seperti α -humulene. Selain itu minyak esensial yang terkandung dalam mint vietnam tersusun oleh beragam senyawa organik diantaranya beberapa senyawa turunan fenol seperti eugenol, kavikol, 4vinylphenol, 3,5-di-tert-butylphenol (Shavandi, Hadadian, and Ismail, 2012), dan tanin (Bown, 2001).
4. Khasiat dan kegunaan
Mint vietnam diyakini memiliki berbagai khasiat yang bermanfaat dalam
vietnam bisa dimakan setelah perendaman dalam air untuk menghilangkan
beberapa tanin yang terkandung didalamnya (Bown, 2001).
B. Senyawa Fenolik
Menurut Fessenden dan Fessenden (1982) fenol adalah senyawa yang memiliki gugus OH yang terikat pada cincin aromatik. Fenolik merupakan metabolit sekunder yang terdapat dan tersebar diseluruh bagian tumbuhan. Pembentukan senyawa fenolik melalui jalur asam sikimat dan fenil propanoid dengan struktur cincin aromatik yang terikat dengan salah satu atau lebih subbstituen gugus hidroksil. Senyawa fenolik dalam tumbuhan dapat berupa fenol sederhana, antrakuinon, asam fenolat, flavonoid, lignin, tanin, dan kumarin (Widodo, 2011).
Salah satu sumber senyawa antioksidan alami adalah senyawa fenolik yang diakui aman digunakan sehingga menjadi senyawa bioaktif dari suatu tumbuhan. Hal ini menjadi perhatian bagi para peneliti akhir-akhir ini, sehingga banyak dilakukan penelitian untuk mengidentifikasi tumbuhan yang memiliki aktivitas antioksidan yang dapat dikonsumsi manusia sehari-hari (Widodo, 2011).
fenolik dapat menstabilkan dan mendelokalisasikan elektron tidak berpasangan (Rice-Evan, Miller, dan Panganga, 1997).
C. Antioksidan 1. Radikal bebas
Radikal bebas adalah suatu senyawa yang mempunyai elektron bebas. Adanya elektron bebas menyebabkan senyawa sangat reaktif untuk mencari pasangan dengan menyerang dan mengikat elektron senyawa lain yang ada di sekitarnya. Target utama radikal bebas termasuk protein, asam lemak tak jenuh dan lipoprotein, serta unsur DNA termasuk karbohidrat. Namun, yang paling rentan menjadi target utama radikal bebas adalah asam lemak tak jenuh. Terjadinya kerusakan pada ikatan rangkapnya di membran sel membuat dinding sel rapuh. Radikal bebas berpotensi merusak bagian dalam pembuluh darah dan menyebabkan aterosklerosis, merusak basa DNA dan membentuk sel kanker, serta merusak jaringan lipid dan terbentuk peroksida yang memicu berbagai penyakit degeneratif. Radikal bebas dianggap sebagai salah satu oksidan karena terjadi penarikan elektron senyawa lain (Winarsi, 2007).
Tubuh manusia dapat menetralisir radikal bebas, hanya saja bila jumlahnya berlebihan, maka kemampuan menetralisirnya akan semakin berkurang. Antioksidan endogen yang diproduksi didalam tubuh adalah enzim superoksida dismutase (SOD), glutation peroksidase (GSH Px), katalase, serta senyawa non enzim, yaitu senyawa protein kecil glutation. Ketiga enzim dan senyawa glutation tersebut bekerja menetralkan radikal bebas. Reaksi tersebut dapat dibantu oleh asupan antioksidan dari luar (eksogen) yang berasal dari bahan makanan. Misalnya vitamin E, C, betakaroten dan senyawa flavonoid yang diperoleh dari tumbuhan (Syukur, Alam, Mufidah, Rahim, Tayeb, 2011).
2. Antioksidan
Menurut Winarsi (2007) antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan yang dapat memerangi aktivitas oksidan dalam tubuh. Antioksidan dianggap sebagai dasar kesehatan dan digunakan selama bertahun-tahun dalam menanggulangi efek berbahaya dari proses oksidatif (Sing, 2007).
3. Manfaat antioksidan
Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang disebabkan oleh radikal bebas. Antioksidan dapat digunakan dalam pencegahan berbagai macam penyakit seperti penyakit kardiovaskuler, kanker, katarak, degenerasi makula, penurunan fungsi saraf, dan penuaan dini (Mbata, 2010).
D. Metode Pengujian Aktivitas Antioksidan 1. Metode pengujian aktivitas antioksidan secara umum
Pengujian aktivitas antioksidan dapat dilakukan dengan berbagai macam cara, baik secara kualitatif maupun kuantitatif. Salah satu pengujian secara kualitatif adalah dengan menggunakan metode DPPH pada kromatografi lapis tipis (Masoko and Eloff, 2007).
Shivaprasad et al. (2005) melaporkan bahwa uji kuantitatif antioksidan dapat dilakukan dengan menggunakan spektrofotometri secara invitro. Salah satu metode yang digunakan adalah metode DPPH.
2. Metode DPPH
Prinsip metode DPPH adalah reduksi larutan metanolik radikal bebas berwarna (DPPH) dengan cara penangkapan radikal bebas (Shivaprasad et al., 2005). DPPH merupakan senyawa radikal bebas stabil yang dapat berubah warna dari ungu ke kuning dengan adanya reduksi melalui proses pemberian (donor) hidrogen atau elektron. Oleh karena itu, senyawa yang dapat mereduksi DPPH disebut sebagai antioksidan atau penangkap radikal bebas (Dehpour, Ebrahimzadeh, Fazel, and Mohammad, 2009).
Untuk pengujian secara kualitatif, pengujian antioksidan dengan metode DPPH dilakukan secara kromatografi lapis tipis. Zat yang telah terelusi disemprot dengan reagen DPPH 0,2% dalam metanol (Masoko and Eloff, 2007).
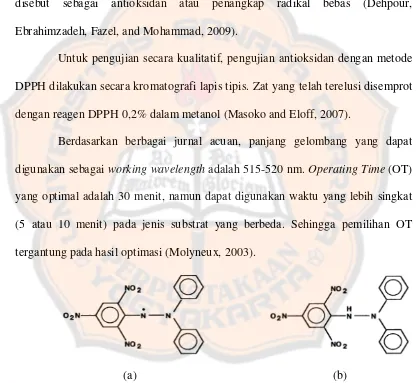
Berdasarkan berbagai jurnal acuan, panjang gelombang yang dapat digunakan sebagai working wavelength adalah 515-520 nm. Operating Time (OT) yang optimal adalah 30 menit, namun dapat digunakan waktu yang lebih singkat (5 atau 10 menit) pada jenis substrat yang berbeda. Sehingga pemilihan OT tergantung pada hasil optimasi (Molyneux, 2003).
(a) (b)
Gambar 1. (a) DPPH (radikal), berwarna ungu; (b) DPPH (non-radikal), berwarna kuning (Molyneux, 2003).
Concentration” EC50 (juga disebut “Inhibitory Concentration” IC50) yang
didefinisikan sebagai kadar penyebab hilangnya aktivitas DPPH sebanyak 50% (Molyneux, 2003). Nilai itu dapat diketahui dengan memplotkan nilai serapan terhadap kadar ekstrak pada kurva atau dengan menghitung kemiringan kurva menggunakan regresi linier (Marxen et al., 2007). Nilai EC50 berbanding terbalik
dengan aktivitas antioksidan (Molyneux, 2003). Menurut Ariyanto (2006) tingkat kekuatan antioksidan menggunakan metode DPPH dapat digolongkan berdasarkan nilai IC50 (tabel 1).
Tabel 1. Tingkat Kekuatan Antioksidan Dengan Metode DPPH (Ariyanto, 2006).
Intensitas Sangat kuat Kuat Sedang Lemah
Nilai IC50 < 50 µg/mL 50 – 100 µg/mL 101 – 150 µg/mL > 150 µg/mL
3. Kromatografi Lapis Tipis (KLT)
Dalam kromatografi lapis tipis bahan penyalut yang beraneka macam, meskipun gel silika digunakan lebih sering daripada bahan lain. Namun pemisahan kation pada gel silika tak selalu memuaskan karena banyak kation yang mempunyai nilai Rf yang hampir sama dan tetap terkelompok pada adsorben ini. Bubuk selulosa disarankan sebagai adsorben untuk pemisahan kation dengan KLT meskipun pemisahan mungkin lebih lambat dibandingkan dengan yang diperoleh dengan gel silika. Penggunaan bubuk selulosa dapat diangggap sebagai pengganti untuk kromatografi kertas anorganik dan data untuk kromatografi kertas umumnya dapat diterapkan pada KLT anorganik pada selulosa (Basset, et al, 1994).
Lapisan-lapisan tipis selulosa dapat dibuat dengan menebarkan bubur bubuk selulosa dalam air dengan menggunakan salah satu aplikator yang tersedia di pasar. Larutan contoh yang akan diaplikasikan hendaknya berisi antara 0,1 dan 10 mg kation per cm3 dan dapat bersifat netral dan asam encer; sekitar 1 µg larutan ditotolkan dengan sebuah spuit mikro atau mikropipet didekat salah satu ujung lempeng kromatografi (sekitar 1,5-2,0 cm dari pinggir lempeng) dan kemudian dibiarkan kering diudara (Basset et al, 1994).
Bejana kromatografi harus tertutup rapat dan sedapat mungkin volume fase gerak sedikit mungkin (akan tetapi harus mampu mengelusi lempeng sampai yang telah ditentukan). Untuk melakukan penjenuhan fase gerak, biasanya bejana dilapisi dengan kertas saring. Setelah fase gerak mencapai ujung kertas saring, maka dapat dikatakan bahwa fase gerak telah jenuh. Selama proses elusi, bejana kromatografi harus ditutup rapat, misalnya dengan lembar aluminium dan sebagainya (Gandjar dan Rohman, 2007).
Biasanya kromatografi itu dikembangkan dengan teknik menaik dalam mana lempang dicelupkan ke dalam pelarut pengembang sedalam 0,5 cm. Pengembangan dibiarkan berlangsung sampai garis depan pelarut menjalani jarak yang diinginkan (biasanya 10-15 cm), lempeng kemudian diambil dari dalam bilik dan garis depan pelarut segera ditandai dengan garis pensil (Gandjar dan Rohman, 2007).
4. Spektrofotometri ultraviolet (UV) dan sinar tampak (visibel)
Spektrofotometri UV-Vis merupakan bagian dari teknik analisis spektroskopik yang menggunakan sumber radiasi elektromagnetik ultraviolet dekat (190-380 nm) dan sinar tampak (380-780 nm) dengan instrument spektrofotometri (Mulja dan Suharman, 1995).
Serapan cahaya oleh molekul dalam daerah spektrum ultraviolet dan terlihat tergantung pada struktur elektronik dari molekul. Spektrum ultraviolet dan terlihat dari senyawa-senyawa organik berkaitan erat dengan transisi-transisi diantara tingkatan-tingkatan tenaga elektronik. Maka dari itu, serapan radiasi UV-Vis sering dikenal sebagai spektroskopi elektronik. Dalam praktek, spektrometri ultraviolet digunakan terbatas pada sistem-sistem terkonjugasi (Sastrohamidjojo, 2001).
Absorbsi cahaya UV-Vis mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi yang berenergi lebih tinggi. Transisi ini memerlukan 40-300 kkal/mol (Fessenden dan Fessenden, 1994). Jenis-jenis transsisi ini antara lain:
1. Transisi σ σ*
2. Transisi n σ*
Jenis transisi ini terjadi pada senyawa organik jenuh yang mengandung atom-atom yang memiliki elektron bukan ikatan (elektron n). Energi yang diperlukan untuk transisi jenis ini lebih kecil dibanding transisi sigma-sigma star sehingga sinar yang diserappun mempunyai panjang gelombang lebih panjang, yakni sekitar 150-250 nm. Kebanyakan transisi ini terjadi pada panjang gelombang kurang dari 200 nm (Gandjar dan Rohman, 2007).
Nilai absorbtivitas molar yang menimbulkan transisi ini besarnya antara 100-3000 liter.cm-1.mol-1. Pengaruh pelarut pada transisi jenis ini adalah pergeseran puncak serapan ke panjang gelombang yang lebih pendek dalam pelarut yang lebih polar. Pergeseran ke panjang gelombang yang lebih pendek ini disebut dengan pergeseran biru (Hypsochromic Shift) (Gandjar dan Rohman, 2007).
3. Transisi π π* dan transisi n π*
Untuk memungkinkan terjadinya jenis transisi ini, maka molekul organik harus mempunyai gugus fungsional yang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan. Jenis transisi ini merupakan transisi yang paling cocok untuk analisis sebab sesuai dengan panjang gelombang antara 200-700 nm, dan panjang gelombang ini secara teknis dapat diaplikasikan pada spektrofotometer (Ganjar dan Rohman, 2007).
Beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri UV-Vis adalah:
Pembentukan molekul perlu dilakukan jika senyawa yang dianalisis tidak menyerap pada daerah UV-Vis. Hal ini dilakukan dengan merubah menjadi senyawa lain atau direaksikan dengan pereaksi tertentu. Pereaksi yang digunakan harus memenuhi beberapa persyaratan yaitu: reaksinya selektif dan sensitive; reaksinya cepat, kuantitatif, dan reprodusibel; hasil reaksi stabil dalam jangka waktu lama. Keselektifan dapat dinaikkan dengan mengatur PH, pemakaian masking agent, atau penggunaan teknik ekstraksi.
b) Waktu operasional (operating time)
Tujuan dari hal ini adalah untuk mengetahui waktu pengukuran yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan.
Pada saat awal terjadi reaksi, absorbansi senyawa yang berwarna akan meningkat sampai waktu tertentu hingga diperoleh absorbansi yang stabil. Semakin lama waktu pengukuran, maka ada kemungkinan senyawa yang berwarna tersebut menjadi rusak atau terurai sehingga intensitas warnanya turun akibatnya absorbansinya juga turun. Karena alasan inilah, maka untuk pengukuran senyawa berwarna harus dilakukan pada saat waktu operasional.
c) Pemilihan panjang gelombang
d) Pembuatan kurva baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi. Bila hukum Lambert-Beer terpenuhi, maka kurva baku berupa garis lurus. Penyimpangan dari garis lurus biasanya dapat disebabkan oleh kekuatan ion yang tinggi, perubahan suhu, dan reaksi ikutan yang terjadi.
e) Pembacaan absorbansi sampel atau cuplikan
Dalam spektrofotometri, absorbansi yang terbaca hendaknya antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitans. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5% (kesalahan fotometrik) (Gandjar dan Rohman, 2007).
E. Ekstraksi
pendahuluan karena dapat menarik semua senyawa berbobot molekul rendah baik polar maupun non-polar (Harborne, 1987).
Teknik-teknik ekstraksi yang dapat dilakukan digolongkan menjadi ekstraksi panas dan ekstraksi dingin. Ekstraksi dingin termasuk:
1. Maserasi
Maserasi merupakan proses ekstraksi simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada suhu ruang. Maserasi termasuk ekstraksi dengan prinsip pencapaian kesetimbangan konsentrasi (Depkes, 2000).
2. Perkolasi
Perkolasi merupakan proses ekstraksi dengan pelarut yang selalu baru hingga ekstraksi sempurna pada suhu ruang. Proses perkolasi terdiri atas tahapan pengembangan bahan, tahapan maserasi antara, tahapan perkolasi sebenarnya (penetesan atau penampungan ekstrak), dan terus-menurus hingga terbentuk perkolat (Depkes, 2000).
Teknik-teknik ekstraksi panas termasuk: 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada suhu titik didih zat selama waktu tertentu dan dalam jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (Depkes, 2000).
2. Digesti
3. Infundasi
Infundasi merupakan teknik ekstraksi menggunakan pelarut air pada penangas air mendidih selama 15 menit (Depkes, 2000).
4. Dekoksi
Dekoksi merupakan teknik ekstraksi yang memiliki prinsip yang sama dengan infundasi dalam waktu 30 menit (Depkes, 2000).
5. Sokletasi
Sokletasi adalah ekstraksi dengan pelarut yang selalu baru yang dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes, 2000).
F. Skrining Fitokimia
Skrining fitokimia merupakan suatu tahap pemeriksaan awal yang digunakan untuk mendeteksi kandungan kimia suatu bahan alam. Uji ini antara lain dilakukan pada golongan alkaloid, flavonoid, saponin, tanin, steroid dan triterpenoid. Pengujian tersebut dilakukan dengan metode pereaksi warna (Mustikasari dan Ariyani, 2010; Susmiati, 2010).
1. Alkaloid
memiliki efek dalam bidang kesehatan berupa pemicu sistem saraf, menaikkan tekanan darah, mengurangi rasa sakit, antimikroba, obat penenang, obat penyakit jantung, dan lain-lain (Simbala, 2009).
Alkaloid merupakan senyawa kimia bersifat basa yang mengandung satu atau lebih atom nitrogen, umumnya tidak berwarna, dan berwarna jika mempunyai struktur kompleks dan bercin-cin aromatik. Alkaloid seringkali beracun bagi manusia dan banyak mempunyai kegiatan fisiologis yang menonjol, sehingga banyak digunakan dalam pengobatan. Dapat bersifat optis aktif dan dalam proses ekstraksi dapat mengakibatkan isomerasi sehingga alkaloid yang diperoleh berupa campuran rasemik (campuran dua enansiomer dengan jumlah yang sama tidak akan memiliki putaran neto Karena besarnya sudut perputaran adalah sama tetapi berlawanan arah maka akan saling meniadakan) (Simbala, 2009).
Alkaloid merupakan golongan terbesar senyawa metabolit sekunder pada tumbuhan. Telah diketahui sekitar 5.500 senyawa alkaloid yang terbesar di berbagai famili. Alkaloid dapat ditemukan dalam berbagai bagian tumbuhan seperti biji, daun, ranting dan kulit kayu. Alkaloid ditemukan pada tumbuhan tingkat tinggi maupu tingkat rendah, bahkan pada hewan (Simbala, 2009).
2. Flavonoid
sifat kelarutan dan reaksi warna meliputi antosianin, proantosianin, flavonol, flavon, glikoflavon, biflavonol, kalkon dan auron, flavonon, dan isoflavon. Flavonoid alam ditemukan dalam bentuk glikosida, yaitu suatu bentuk kombinasi antara gula dan alkohol (Umar, 2008).
Flavonoid merupakan kandungan kelas tumbuhan hijau. Flavonoid terdapat pada semua bagian tumbuhan termasuk daun, akar, kulit kayu, tepung sari, nektar, bunga, buah dan biji. Flavonoid juga terkandung pada hewan, misalnya dalam kelenjar bau berang-berang, propolis (sekresi lebah), dan didalam sayap kupu-kupu, dengan anggapan bahwa flavonoid tersebut tidak dibiosintesis dalam tubuh mereka (Umar, 2008).
Flavonoid merupakan golongan terbesar dari senyawa fenolik disamping fenol sederhana, fenilpropanoid, dan kuinon fenolik. Sebanyak 2 % dari seluruh karbon yang difotosintesis oleh tanaman diubah menjadi flavonoid atau senyawa yang berhubungan erat dengannya. Dalam tumbuhan aglikon flavonoid terdapat dalam berbagai bentuk struktur, semuanya mengandung 15 atom C dan inti dasarnya yang tersusun dalam konfigurasi C6-C3-C6 yaitu dalam cincin aromatik yang dihubungkan oleh 3 karbon yang dapat atau tidak dapat membentuk cincin ketiga (Umar, 2008).
Pada umumnya ada dua bentuk flavonoid, yaitu flavonoid yang terikat pada gula sebagai glikosida dan flavonoid bebas (aglikon). Bentuk – bentuk itu dapat berada pada satu tumbuhan dalam beberapa bentuk kombinasi glikosida (Umar, 2008). 3. Saponin
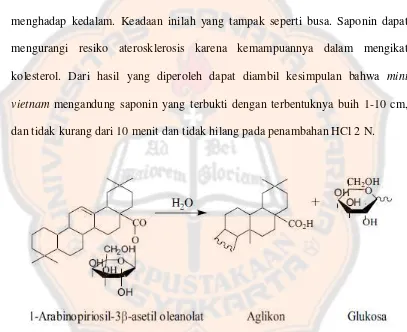
Saponin adalah suatu glikosida yang mungkin ada pada banyak macam tumbuhan. Saponin ada pada seluruh tumbuhan dengan konsentrasi tinggi pada bagian-bagian tertentu, dan dipengaruhi oleh varietas tumbuhan dan tahap pertumbuhan. Fungsi dalam tumbuh-tumbuhan tidak diketahui, mungkin sebagai bentuk penyimpaan karbohidrat atau merupakan waste product dari metabolisme tumbuh-tumbuhan. Kemungkinan lain adalah sebagai pelindung terhadap serangga (Jaya, 2010).
Glikosida saponin adalah glikosida yang aglikonnya berupa sapogenin. Glikosida saponin bisa berupa saponin steroid atau saponin triterpenoid. Saponin tersebar luas antara tumbuhan tingkat tinggi. Keberadaan saponin sangat mudah ditandai dengan pembentukan larutan koloidal dengan air yang apabila digojog menimbulkan buih yang stabil (Jaya, 2010).
(tridesmosida) rantai glukosa dan aglikonnya yang mengikat gugus fungsi –OH, -COOH dan –CH. Saponin juga bersifat bisa menghancurkan butir darah merah lewat hemolisis, bersifat racun bagi hewan berdarah dingin, sehingga banyak di antaranya digunakan sebagai racun ikan (Jaya, 2010).
Saponin bila terhidrolisis akan menghasilkan aglikon yang disebut sapogenin. Ini merupakan suatu senyawa yang mudah dikristalkan lewat asetilasi sehingga dapat dimurnikan dan dipelajari lebih lanjut. Saponin yang berpotensi keras atau beracun seringkali disebut sapotoksin (Jaya, 2010).
Saponin memiliki berat molekul tinggi sehingga menjadikan upaya isolasi untuk mendapatkan saponin yang murni menemui banyak kesulitan. Berdasarkan aglikonnya (sapogeninnya), saponin dapat dibagi dua macam, yaitu tipe steroid dan tipe triterpenoid. Kedua senyawa ini memiliki hubungan glikosidik pada atom C3 dan memiliki asal usul biogenetika yang sama lewat asam mevalonat dan satuan-satuan isoprenoid (Jaya, 2010).
4. Tanin
5. Triterpenoid dan steroid
Triterpenoid adalah senyawa metabolit sekunder yang kerangka karbonnya berasal dari enam satuan isoprena dan diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berbentuk siklik atau asiklik dan sering memiliki gugus alkohol, aldehida, atau asam karboksilat. Sebagian besar senyawa triterpenoid mempunyai kegiatan fisiologi yang menonjol sehingga dalam kehidupan sehari-hari banyak dipergunakan sebagai obat seperti untuk pengobatan penyakit diabetes, gangguan menstruasi, patukan ular, gangguan kulit, kerusakan hati, dan malaria. Sedang bagi tumbuhan yang mengandung senyawa triterpenoid terdapat nilai ekologi karena senyawa ini bekerja sebagai anti fungus, insektisida, anti pemangsa, anti bakteri, dan anti virus (Widiyati, 2006).
G. Validasi Metode Analisis 1. Akurasi
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya, atau nilai rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran dengan melakukan spiking pada suatu sampel (Gandjar dan Rohman, 2007).
2. Presisi
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik. Sesuai dengan ICH (International Conference on Harmanization), presisi harus dilakukan pada 3 tingkatan yang berbeda yaitu:
keterulangan, presisi antara, dan ketertiruan. Keterulangan yaitu ketepatan pada kondisi percobaan yang sama (berulang) baik orangnya, peralatannya, tempatnya, maupun waktunya. Presisi antara yaitu ketepatan pada kondisi percobaan yang berbeda, baik orangnya, peralatannya, tempatnya maupun waktunya (Gandjar dan Rohman, 2007).
3. Linearitas
yang berbeda-beda. Data yang diperoleh selanjutnya diproses dengan metode kuadrat terkecil, untuk selanjutnya dapat ditentukan nilai kemiringan (slope), intersep, koefisien korelasi (Gandjar dan Rohman, 2007).
4. Spesifisitas
Spesifisitas adalah kemampuan untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen-komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradasi, dan komponen matriks (Gandjar dan Rohman, 2007).
ICH membagi spesifisitas dalam dua kategori, yakni uji identifikasi dan uji kemurnian atau pengukuran. Untuk tujuan identifikasi, spesifisitas ditunjukkan dengan kemampuan suatu metode analisis untuk membedakan antar senyawa yang mempunyai struktur molekul yang hampir sama. Untuk tujuan kemurnian dan tujuan pengukuran kadar, spesifisitas ditunjukkan oleh daya pisah dua senyawa yang berdekatan. Senyawa - senyawa tersebut biasanya adalah komponen utama atau komponen aktif dan atau suatu pengotor. Jika dalam suatu uji terdapat suatu pengotor (impurities) maka metode uji harus tidak terpengaruh dengan adanya pengotor ini (Gandjar dan Rohman, 2007).
untuk melakukan pengukuran selektifitas. Deteksi analit secara selektif dengan detektor UV dapat ditingkatkan dengan menggunakan teknik derivatisasi dan dilanjutkan dengan menggunakan pengukuran pada panjang gelombang tertentu yang spesifik terhadap derivat yang dihasilkan (Gandjar dan Rohman, 2007).
H. Landasan Teori
Radikal bebas adalah suatu senyawa yang mempunyai elektron bebas. Adanya elektron bebas menyebabkan senyawa sangat reaktif untuk mencari pasangan dengan menyerang dan mengikat elektron senyawa lain yang ada di sekitarnya. Radikal bebas secara normal diproduksi terus-menerus dalam jumlah banyak untuk metabolisme dalam tubuh. Radikal bebas dibutuhkan untuk melawan agen infeksi seperti bakteri, fungi, dan parasit. Walaupun berguna bagi tubuh, namun dapat menjadi masalah pada jumlah tertentu. Ketika jumlah radikal bebas lebih banyak dibanding antioksidan, maka terjadi kerusakan membran sel yang menimbulkan penyakit degeneratif. Oleh sebab itu dibutuhkan senyawa antioksidan untuk menghambat reaksi oksidasi radikal bebas. Antioksidan dapat diperoleh dari hasil sintesis maupun alam. Antioksidan hasil sintesis seperti tBHQ, BHA, BHT dan PG mempunyai afektivitas yang tinggi tetapi dapat menyebabkan
kanker melalui mutasi pada DNA. Hal ini menjadi dasar dilakukannya eksplorasi sumber antioksidan alami yang berasal dari tumbuhan.
Mint vietnam digunakan sebagai bumbu masak dan untuk pengobatan
esensial mint vietnam adalah eugenol, kavikol, 4vinylphenol, 3,5-di-tert-butylphenol dan tanin. Senyawa fenolik merupakan senyawa organik yang terdiri
dari senyawa aromatik yang mengikat gugus hidroksil. Aktivitas antioksidan dari senyawa fenolik diperoleh dengan mereduksi radikal bebas untuk tidak terjadinya reaksi samping yang merugikan.
Aktivitas antioksidan dapat diuji dengan metode menggunakan radikal DPPH baik secara kualitatif (KLT) maupun kuantitatif (spektrofotometri). Karena adanya elektron yang tidak berpasangan, DPPH memberikan serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh keberadaan penangkap radikal bebas, maka absorbansinya menurun secara stokiometri sesuai dengan jumlah elektron yang diambil. Keberadaan senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning.
I. Hipotesis
1. Didalam ekstrak etanolik mint vietnam terdapat senyawa metabolit sekunder yang berperan sebagai antioksidan.
31 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental dengan rancangan acak lengkap pola searah.
B. Variabel Penelitian 1. Variabel
a. Variabel bebas berupa konsentrasi ekstrak etanolik mint vietnam. b. Variabel tergantung berupa aktivitas antioksidan ekstrak etanolik mint vietnam.
c. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu pemanenan, umur tanaman, dan cara panen.
d. Variabel pengacau tidak terkendali berupa cahaya matahari dan cuaca. 2. Definisi operasional
a. Ekstrak etanolik mint vietnam merupakan sari hasil proses maserasi mint vietnam dengan pelarut etanol.
b. IC50 (Inhibitory Concentration 50) adalah konsentrasi ekstrak etanolik
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah mint vietnam (Persicaria odorata (Lour.) Soják) yang diperoleh dari budidaya sendiri di kebun obat Fakultas Farmasi Sanata Dharma; kertas saring, akuades, reagen Mayer, ammonia pekat, reagen Bouchardat, serbuk magnesium, dan zinc (Laboratorium Farmakognosi Fitokimia Universitas Sanata Dharma), bahan kualitas p.a. E. Merck yaitu: metanol, kloroform, butanol, acetic acid (glacial), celulosa, silica gel 60 GF254, Aluminium klorida, besi (III) klorida, asam klorida, dan H2SO4; bahan
kualitas p.a. Sigma Chem. Co. USA, yaitu: 1,1-difenil-2- pikrilhidrazil (DPPH), rutin, tannin; bahan kualitas teknis Brataco Chemica, yaitu: eter, eter minyak tanah, asam asetat, etil asetat, dan etanol: bahan kualitas Asia laboratory, yaitu: formalin; bahan kualitas CV. General Labora, yaitu: aluminium foil.
D. Alat Penelitian
Alat yang digunakan adalah alat-alat gelas (Pyrex - Germany dan Iwaki), neraca analitik, corong Buchner, vacuum rotary evaporator, waterbath, oven, blender, alat pendingin balik, pelat dan chamber KLT, Vortex, almari asam, spectrofotometer UV-Vis (Perkin Elmer Lamda 20).
E. Tata Cara Penelitian 1. Determinasi tanaman mint vietnam
Mint vietnam yang diperoleh dari hasil budidaya sendiri di kebun obat
diidentifikasi di Laboratorium Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Skrining fitokimia
a. Pembuatan serbuk simplisia. Mint vietnam dicuci dengan air mengalir, diangin-anginkan, dikeringkan dengan oven pada suhu 40°C hingga kering (mudah dihancurkan), dan dihaluskan dengan blender. Serbuk yang telah dihaluskan kemudian diayak dengan ayakan nomor 65 mesh.
b. Uji alkaloid (Depkes RI, 1989). Serbuk simplisia ditimbang sebanyak 0,5 g ditambah 1 mL HCl 2 N dan 9 mL akuades, dipanaskan di atas waterbath selama 2 menit. Campuran didinginkan dan disaring. Filtrat kemudian dibagi menjadi tiga:
1) Filtrat sebanyak tiga tetes ditambah dua tetes pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning yang larut dalam metanol.
2) Filtrat sebanyak tiga tetes ditambah pereaksi Bouchardat, akan terbentuk endapan berwarna coklat hingga hitam.
3) Jika terjadi endapan pada kedua percobaan, maka simplisia kemungkinan mengandung alkaloid. Sebaliknya, jika tidak terjadi endapan pada kedua percobaan, maka simplisia tidak mengandung alkaloid. Filtrat ke-3 digunakan untuk prosedur berikutnya.
disaring. Filtrat diuapkan di atas waterbath dan residu yang diperoleh dilarutkan dengan sedikit HCl 2 N. Larutan diuji dengan:
1) asam silikowolframat atau asam fosfomolibdat atau asam foswolframat
2) Bouchardat atau Wagner
3) Mayer atau Dragendorff atau Marme 4) Hager
Jika pada pengujian terdapat paling sedikit dua golongan, maka simplisia positif mengandung alkaloid.
c. Uji saponin (Depkes RI, 1989). Sebanyak 0,5 g serbuk simplisia dimasukkan dalam tabung reaksi, ditambah 10 mL akuades panas. Campuran didinginkan dan dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk buih 1 – 10 cm, tidak kurang dari 10 menit dan tidak hilang pada penambahan HCl 2 N.
d. Uji tanin (zat samak) (Sutrisno, 1986). Larutan besi (III) ammonium sulfat 0,5 N diencerkan dengan air lima kali volume awal. Larutan tersebut diteteskan pada cuplikan simplisia. Tanin positif ditandai dengan warna hijau atau biru sampai hitam.
f. Uji flavonoid (Depkes RI, 1989). Serbuk sebanyak 0,5 g diekstraksi dengan metanol sebanyak 10 mL, dengan menggunakan alat pendingin balik selama 10 menit. Kemudian cairan panas yang didapatkan disaring menggunkan kertas saring berlipat, filtrat kemudian diencerkan dengan akuades sebanyak 10 mL. larutan yang sudah dingin kemudian ditambah dengan eter minyak tanah sebanyak 5 mL, kemudian dikocok dengan hati-hati, lalu didiamkan. Lapisan metanol kemudian diambil lalu diuapkan pada suhu 400C di bawah tekanan. Residu yang merupakan hasil evaporasi dilarutkan dalam 5 mL etil asetat kemudian disaring untuk mendapatkan larutan percobaan. Larutan percobaan kemudian dibagi tiga bagian:
a) Sebanyak 1 mL larutan percobaan diuapkan hingga kering, residu sisa penguapan dilarutkan dalam 1-2 mL etanol 95%, kemudian ditambahkan 0,5 g serbuk seng (Zn) p, dan 2 mL asam klorida 2N, kemudian diamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida pekat, amati, jika dalam waktu 2-5 menit terjadi warna merah intensif maka menunjukkan adanya flavonoid (glikosida-3-flavonoid)
c) Sebanyak 1 mL larutan percobaan diupakan hingga kering, residu yang diperoleh kemudian dibasahi dengan aseton p, kemudian ditambahkan sedikit serbuk halus asam borat P, dan serbuk halus asam oksalat P, campuran kemudian dipanaskan diatas waterbath dengan hati-hati dan hindari pemanasan yang berlebihan. Campurkan sisa yang diperoleh dengan 10 mL eter P. Amati dibawah sinar UV 366 nm, jika larutan berfluorosensi kuning intensif, maka menunjukkan adanya flavonoid. 3. Pembuatan ekstrak etanolik mint vietnam
4. Pembuatan larutan DPPH, larutan pembanding rutin, dan larutan Uji a. Pembuatan larutan DPPH. Sebanyak 15,8 mg DPPH dilarutkan dalam metanol hingga diperoleh kadar 0,4 mM. Larutan ditutup dengan alumunium foil dan harus dibuat baru. vietnam ditimbang dan ditambah metanol hingga 25,0 mL. Larutan tersebut diambil sebanyak 2,0; 2,5; 3,0; 3,5; dan 4,0 mL dan ditambah metanol hingga 10 mL, sehingga diperoleh larutan uji 200,0; 250,0; 300,0; 350,0; dan 400,0 µg/mL. 5. Uji kualitatif DPPH dengan kromatografi lapis tipis
a. Pembuatan lempeng KLT. Sebanyak 1,5 g serbuk selulosa/plate. Dilarutkan kedalam 3,5 mL aquades/1 g serbuk selulosa. Kemudian dilakukan pengadukan dengan bantuan stirrer hingga larut sepenuhnya. Larutan selulosa yang telah siap dimasukkan kedalam penggeser plate, kemudian dilakukan penggeseran plate pada lempeng kaca. Lempeng yang sudah dilapisi selulosa dimasukkan kedalam oven hingga kering dan siap digunakan.
menggunakan fase gerak n-butanol:asam asetat glasial:akuades (5:1:4 (v/v)) setinggi 10 cm. Setelah elusi selesai, plate diangkat dan dibiarkan mengering. Untuk validasi, dilakukan replikasi sebanyak dua kali.
Kedua plate KLT diperiksa dengan lampu UV 254 nm dan 365 nm untuk ditandai bercaknya dan dicatat warnanya. Plate disemprot dengan larutan DPPH pada almari asam. Latar belakang plate akan berwarna ungu dan warna kuning pada bercak mencerminkan adanya aktivitas antioksidan. Lama tinggal warna kuning menandakan besarnya aktivitas antioksidan.
c. Identifikasi senyawa flavonoid. Ekstrak etanolik mint vietanam 1% dalam etanol, ditotolkan pada plate KLT menggunakan pipa kapiler. Selain itu, larutan pembanding rutin juga dibuat dan ditotolkan pada plate KLT. Kemudian, zat yang telah ditotolkan dielusi dalam chamber KLT menggunakan fase gerak n-butanol:asam asetat glasial:akuades (5:1:4 (v/v)) setinggi 10 cm. Setelah elusi selesai, plate diangkat dan dibiarkan mengering. Untuk validasi, dilakukan replikasi sebanyak dua kali.
Kedua plate KLT diperiksa dengan lampu UV 254 nm dan 365 nm untuk ditandai bercaknya dan dicatat warnanya. Plate disemprot dengan larutan AlCl3
1% pada almari asam. Adanya flavonoid ditandai dengan bercak berwarana kuning dengan latar belakang plate akan berwarna putih.
zat yang telah ditotolkan dielusi dalam chamber KLT setinggi 10 cm menggunakan tiga fase gerak, yaitu:
1) n-butanol:asam asetat glasial:akuades (5:1:4 (v/v)) 2) metanol: etil asetat (4:1)
3) etil asetat: metanol: asam asetat (16:14:1)
Setelah elusi sampai pada titik akhir elusi, plate diangkat dan dibiarkan mengering. Plate KLT kemudian diperiksa dengan lampu UV 254 nm dan 365 nm untuk ditandai bercaknya dan dicatat warnanya. Plate disemprot dengan larutan FeCl3 1% pada fase gerak yang pertama, untuk fase gerak yang kedua
menggunakan pereaksi AlCl3 1%, dan untuk fase gerak yang ketiga menggunakan
larutan AlCl3 5%, perlakuan ini dilakukan pada almari asam. Adanya flavonoid
ditandai dengan bercak berwarna coklat kehitaman.
6. Uji kuantitatif DPPH dengan spektrofotometri visibel
a. Penentuan operating time (OT). Masing-masing sebanyak 1 mL larutan DPPH dimasukkan dalam 10 labu ukur 5 mL dan ditambah 1 mL rutin 37,5 µg/mL. Larutan kemudian ditambah metanol hingga tanda batas. Larutan divortex selama 30 detik dan didiamkan selama 5; 10; 15; 20; 25; 30; 35; 40; 45; 50; 55; 60 menit. Kemudian dibaca absorbansinya pada spektrofotometer visibel pada panjang gelombang 517 nm.
b. Penentuan panjang gelombang absorbansi maksimum (λmaks).
Kemudian dilakukan scanning panjang gelombang maksimum (λmaks) dari 400 –
600 nm.
c. Pengukuran absorbansi kontrol. Sebanyak 1 mL larutan DPPH dimasukkan dalam labu ukur 5 mL dan ditambah metanol hingga tanda batas. Larutan dibaca absorbansinya pada OT dan λmaks. Dilakukan replikasi sebanyak 3
kali. Pengukuran ini digunakan sebagai kontrol terhadap pengukuran absorbansi larutan pembanding rutin dan larutan uji.
d. Pengukuran larutan, pembanding rutin, dan larutan uji. Masing-masing sebanyak 1 mL larutan DPPH dimasukkan dalam 5 labu ukur 5 mL, kemudian ditambah 1 mL rutin 37,5 µg/mL dan 1 mL larutan uji yang telah dibuat. Larutan kemudian ditambah metanol hingga tanda batas. Larutan divortex selama 30 detik dan didiamkan selama OT. Kemudian dibaca absorbansinya pada spektrofotometer visibel pada λmaks. Dilakukan replikasi sebanyak tiga kali.
7. Validasi metode DPPH
Hasil prosedur 6 a dan 6 b, divalidasi akurasi (% recovery), presisi (% CV), spesifisitas (spektra kontrol), dan linearitasnya (nilai r).
8. Estimasi aktivitas antioksidan
41 BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Penelitian ini dimulai dengan determinasi tanaman mint vietnam. Adapun tujuan dari determinasi tanaman ini adalah untuk mengetahui kebenaran identitas tanaman yang digunakan dalam penelitian. Kebenaran identitas tanaman ini digunakan untuk menghindari adanya kemungkinan kesalahan dalam pengambilan sampel pada analisis fitokimia (Harbone, 1987). Determinasi tanaman mint vietnam dilakukan dilaboratorium Farmakognosi-Fitokimia Fakultas Farmasi
Universitas Sanata Dharma. Hasil determinasi tanaman mint vietnam dapat dilihat di (lampiran 2) yang menyatakan kebenaran tanaman yaitu Persicaria odorata (Lour.) Soják.
B. Hasil Pengumpulan Bahan
Mint vietnam dipanen dari tempat budidaya sendiri pada Januari 2013 di
kebun obat Fakultas Farmasi Universitas Sanata Dharma, Dusun Paingan, Kelurahan Maguwoharjo, Yogyakarta.
Mint vietnam tersebut dipanen dengan kriteria-kriteria berikut ini, pada
saat mint vietnam berumur 1 bulan dan disaat pagi hari. Hal ini dilakukan karena diduga pada saat kriteria-kriteria tersebut, jumlah metabolit sekunder dalam daun mint vietnam maksimal. Pemanenan pada saat pagi hari dilakukan dengan tujuan
fotosintesis menjadi metabolit sekunder lainnya dan agar mempertahankan kesegaran tanaman saat transport menuju laboratorium. Menurut Sambada (2011) usaha pemanenan dengan kriteria-kriteria tanaman diatas bertujuan unutuk memaksimalkan kandungan metabolit sekunder tanaman yang dapat diekstraksi oleh peneliti.
Hasil pengumpulan mint vietnam yang diperoleh langsung dibawa ke laboratorium untuk secepatnya dipreparasi. Hal ini dilakukan agar menghindari peristiwa browning atau blackening yang disebabkan karena adanya polifenol oksidase tumbuhan yang menanggapi rangsang berupa luka pada jaringan tumbuhan. Polifenol oksidase merupakan enzyme ekstraseluler tumbuhan. Jika senyawa fenolik transport menuju permukaan sel tumbuhan akibat adanya luka sewaktu pemanenan, maka enzim tersebut dengan adanya oksigen akan mengubah senyawa fenolik menjadi bentuk radikal dan akhirnya terjadi reaksi oksidasi multi step yang membuat senyawa tersebut menjadi bentuk polimer (Evans dan Hedger, 2001). Bentuk polimer tersebut berfungsi untuk menutup luka pada jaringan tanaman. Adanya peristiwa tersebut, mengakibatkan senyawa fenolik dioksidasi menjadi senyawa yang kurang atau bahkan tidak memiliki aktivitas antioksidan.
C. Hasil Preparasi Sampel
Mint vietnam yang diperoleh harus dicuci dengan air mengalir untuk
mint vietnam yang kering dan siap di blender. Tujuan dari pengeringan secara
umum adalah untuk mengurangi kandungan air. Hal ini karena air yang tersisa dalam simplisia merupakan media pertumbuhan yang baik untuk jamur maupun mikroorganisme lainnya. Tujuan pengeringan selain untuk mengurangi kadar air, juga dapat menghentikan kerja enzim sehingga mutu dari simplisia dapat dipertahankan, terjamin keawetannya, selain itu memudahkan dalam pembuatan serbuk bahan.
Pembuatan serbuk bertujuan untuk meningkatkan luas permukaan simplisia sehingga permukaan simplisia yang bersentuhan dengan penyari semakin luas. Luas permukaan yang semakin besar akan mengoptimalkan pembasahan serbuk simplisia oleh cairan penyari sehingga hasil penyarian juga optimal (Harborne, 1987).
Kemudian dilakukan maserasi dengan penyari etanol 70 % dan dibantu dengan alat shaker. Penyarian dilakukan dengan cara maserasi karena peneliti menghindari cara preparasi sampel yang banyak membutuhkan perlakuan pemanasan terhadap sampel. Hal ini dilakukan untuk menjaga stabilitas dari senyawa fenolik yang diekstraksi (Bruneton, 1999).
waktu pembuatan ekstrak lebih lama (Arini, 2007). Efek farmakologis yang diharapkan bersifat umum, yaitu antioksidan sehingga pemilihan maserasi daripada perkolasi akan lebih menguntungkan. Cara maserasi yang dilakukan oleh peneliti menggunakan alat bantu shaker yang digunakan untuk membantu proses maserasi agar penyari lebih dapat kontak langsung dengan sel-sel dalam mint vietnam daripada hanya didiamkan saja. Hal ini membuat proses maserasi dapat
secara efektif mengekstraksi metabolit sekunder dalam mint vietnam. Dalam proses maserasi, dilakukan pula proses remaserasi yang bertujuan untuk memaksimalkan proses penyarian agar mendapatkan lebih banyak senyawa fenolik dibandingkan hanya digunakan maserasi saja.
Etanol 70% digunakan dalam proses ini karena peneliti ingin mengekstraksi senyawa fenolik dari mint vietnam. Menurut Hargono (1986) untuk mengekstraksi senyawa fenolik dalam bahan tumbuhan dapat dilakukan dengan pelarut polar seperti etanol, metanol, n-butanol, aseton, dimetilsulfoksida,
dimetilformamida, dan air tidak ditumbuhi kapang dan jamur, tidak beracun, netral dan absorbsinya baik. Maka etanol 70% digunakan dalam
penenlitian ini. Alasan tidak digunakan pelarut aseton, dimetilsulfoksida, dimetilformamida, dan air adalah senyawa fenolik lebih larut dalam campuran larutan alkohol dengan air daripada pelarut polar lainnya (Bruneton, 1999).
rotary evaporator. Alat tersebut dapat menguapkan pelarut filtrat dibawah titik didih (t.d.) pelarut filtrat, yaitu etanol. Etanol memiliki t.d sebesar 78,50C (O’neil, Smith, Heckelman, Obenchain Jr., Gallipeau, D’Arecca, et al., 2001). Hal ini dikarenakan alat tersebut memakai prinsip penurunan tekanan udara dalam sistim vacuum sehingga titik didih larutan dapat diturunkan (Dave, 2010).
Setelah didapatkan ekstrak etanolik mint vietnam selanjutnya dilakukan uji pendahuluan.
D. Hasil Uji Pendahuluan a. Uji alkaloid
Uji ini ditujukan untuk mengetahui apakah ekstrak etanolik mint vietnam mengandung alkaloid. Prinsip metode analisis ini adalah reaksi pengendapan yang terjadi karena adanya penggantian ligan. Atom Nitrogen yang mempunyai pasangan elektron bebas pada alkaloid dapat menggantikan ion iodo dalam pereaksi-pereaksi. Pereaksi Bouchardat mengandung iod dan kalium iodida. Sedangkan pereaksi Mayer mengandung kalium iodida dan merkuri klorida [Kalium tertaiodomerkurat (II)]. Pada uji dengan pereaksi Mayer, alkaloid positif apabila terbentuk endapan putih. Pereaksi Mayer bersifat elektrofilik (Hg2+), mengadisi atom C no 2, dimana terlebih dahulu K2HgI4 terlarut dalam air secara
Gambar 2. reaksi uji Mayer
Tetapi metode ini memiliki kelemahan yaitu pereaksi-pereaksi tersebut bukan hanya dapat mengendapkan alkaloid melainkan juga dapat mengendapkan beberapa jenis senyawa antara lain, protein, kumarin, R-piron, hidroksi flavon, dan tanin. Alkaloid memiliki efek dalam bidang kesehatan berupa antihipertensi dan antidiabetes mellitus. Dari hasil penelitian yang diperoleh dapat disimpulkan bahwa mint vietnam tidak mengandung alkaloid, karena tidak terjadi endapan disaat dilakukan percobaan (gambar 3).
b. Uji saponin
Hal ini bertujuan untuk mengetahui apakah mint vietnam mengandung saponin. Saponin memiliki glikosil yang berfungsi sebagai gugus polar dan gugus non polar. Senyawa yang memiliki gugus polar dan non polar bersifat aktif permukaan sehingga saat digojok dengan air saponin dapat membentuk misel. Pada struktur misel gugus polar menghadap keluar sedangkan gugus non polarnya menghadap kedalam. Keadaan inilah yang tampak seperti busa. Saponin dapat mengurangi resiko aterosklerosis karena kemampuannya dalam mengikat kolesterol. Dari hasil yang diperoleh dapat diambil kesimpulan bahwa mint vietnam mengandung saponin yang terbukti dengan terbentuknya buih 1-10 cm,
dan tidak kurang dari 10 menit dan tidak hilang pada penambahan HCl 2 N.
Gambar 5. Hasil uji pendahuluan untuk saponin c. Uji tanin
Gambar 6. Uji pendahuluan untuk tanin
Keterangan: (a= serbuk sampel uji + larutan besi (III) ammonium sulfat); (b= ekstrak sampel uji + FeCl3); (c= ekstrak sampel uji +
gelatin); (d= ekstrak sampel uji + formaldehid)
Uji fitokimia yang kedua untuk tanin menggunakan FeCl3, yang
bertujuan untuk mengetahui apakah sampel mengandung gugus fenol. Adanya gugus fenol ditunjukkan dengan warna hijau kehitaman atau biru tua setelah ditambahkan larutan FeCl3. Hasil uji menunjukkan warna hijau kehitaman yang
ekstrak etanolik mint vietnam setelah penambahan FeCl3 karena tanin akan
membentuk senyawa kompleks dengan ion Fe3+ .
Dalam penelitiannya, Sa’adah (2010) menyatakan bahwa senyawa kompleks adalah senyawa yang pembentukannya melibatkan pembentukan ikatan kovalen koordinasi antara ion logam atau atom logam dengan atom non logam. Dalam pembentukan senyawa kompleks ini, atom atau ion logam disebut sebagai pusat, sedangkan atom yang mendonorkan elektronnya ke atom pusat disebut atom donor. Atom donor terdapat pada suatu ion atau molekul netral. Ion atau molekul netral yang memiliki atom-atom donor yang dikoordinasikan pada atom pusat disebut ligan. Suatu molekul dikatakan sebagai ligan jika atomnya memiliki pasangan elektron bebas, memiliki elektron tak berpasangan, atau atom yang terikat melalui ikatan π.
Terbentuknya senyawa kompleks antara tanin dengan FeCl3 karena
adanya ion Fe3+ sebagai atom pusat dan tanin memiliki atom O yang mempunyai pasangan elektron bebas yang dapat mengkoordinasikan ke atom pusat sebagai ligannya. Ion Fe3+ mengikat tiga tanin yang memiliki dua atom donor yaitu atom O dihidroksi, sehingga ada enam pasangan elektron bebas yang bisa dikoordinasikan ke atom pusat. Atom O dihidroksi memiliki energi paling rendah pada pembentukan senyawa kompleks, sehingga memungkinkan menjadi sebuah ligan.
bahwa tanin menimbulkan endapan sedikit atau banyak jika ditambahkan dengan gelatin. Berdasarkan hasil penelitian ini didapatkan endapan yang menunjukkan bahwa ekstrak etanolik mint vietnam positif mengandung tannin.
Apabila suatu protein bereaksi dengan senyawa kimia maka akan terjadi perubahan konformasi protein. Perubahan konformasi alamiah menjadi konformasi yang tidak menentu merupakan suatu proses denaturasi yang berlangsung secara reversibel. Penggumpalan protein biasanya didahului oleh proses denaturasi yang berlangsung dengan baik pada titik isolistrik protein tersebut (Sa’adah 2010).
Uji fitokimia tanin selanjutnya dengan menggunakan larutan Formaldehid : asam klorida dan FeCl3 : natrium asetat yang bertujuan untuk
membedakan antara tanin katekol dan tanin galat. Tanin katekol ditunjukkan dengan adanya endapan merah muda jika ekstrak ditambah dengan larutan formalin 1% dan asam klorida 1 N, sedangkan tanin galat ditunjukkan dengan warna biru tinta atau hitam jika filtrat hasil uji tanin katekol direaksikan dengan natrium asetat dan FeCl3 1%. Dalam penelitian ini dihasilkan tanin galat karena
filtrat yang ditambahkan dengan natrium asetat dan FeCl3 menghasilkan warna
hitam. Hasil uji ini dapat dilihat pada (gambar 6d): d. Uji triterpen dan steroid
Uji ini bertujuan untuk mengetahui adanya metabolit sekunder berupa triterpenoid dan steroid pada mint vietnam. Analisis ini didasarkan pada kemampuan senyawa triterpenoid dan steroid membentuk warna oleh H2SO4 pekat
membentuk warna merah jingga untuk senyawa triterpenoid dan biru untuk untuk analisis steroid. Hasil positif dapat berbeda bila pelarut atau prosedur berbeda. Dalam penelitian ini tidak dihasilkan cincin yang berwarna ungu hingga biru atau merah jingga, sehingga dapat disimpulkan dalam mint vietnam tidak terdapat senyawa triterpenoid dan steroid. Hasil penelitian dapat dilihat pada gambar 7.
Gambar 7. Uji pendahuluan triterpen & steroid e. Uji flavonoid