PEMBUATAN DAN PENCIRIAN ELEKTRODE SELEKTIF
ION MAGNESIUM TIPE KAWAT TERLAPIS
INUNG NURHAYATI SUWARNO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
INUNG NURHAYATI SUWARNO. Pembuatan dan Pencirian Elektrode Selektif Ion Magnesium Tipe Kawat Terlapis. Dibimbing oleh DYAH ISWANTINI PRADONO dan DEDEN SAPRUDIN.
Magnesium adalah logam alkali tanah yang sangat penting bagi kelangsungan hidup hewan, tumbuhan, dan manusia. Konsentrasi magnesium dapat diukur dengan elektrode selektif ion magnesium kawat terlapis. Elektrode yang dibuat perlu ciri terlebih dahulu.
Berdasarkan hasil penelitian dari tiga ulangan elektrode didapatkan faktor Nernst yang beragam. Rentang konsentrasi megnesium yang memberikan respons Nernstian
terbaik adalah 10-1-10-4 M dengan limit deteksi 1,00 10-4 M (elektrode A), 1,76 10-5 M
(elektrode B), and 7,72 10-5 M (elektrode C). Waktu respons elektrode adalah 41-85 detik.
Saat konsentrasi magnesium seratus kali lebih kecil dari ion-ion lain, elektrode
magnesium mengalami gangguan dari ion Fe2+ dan Ca2+, sedangkan kehadiran ion Ba2+,
Na+, dan K+ dapat diabaikan. Elektrode magnesium bekerja baik pada pH 5-11. Elektrode
magnesium dapat digunakan pada rentang waktu 30-35 hari. Akan tetapi metode potensiometri dengan elektrode magnesium belum memberikan hasil yang sama dengan spektrofotometri serapan atom.
ABSTRACT
INUNG NURHAYATI SUWARNO. Preparation and Characterization of Coated Wire Magnesium Ion Selective Electrode. Supervised by DYAH ISWANTINI PRADONO and DEDEN SAPRUDIN.
Magnesium is an important alkaline earth metal for living of animals, plants, and man. Magnesium concentration can be measured by coated wire magnesium ion selective electrode. Preliminary characterization is required for the electrode.
The result of three repetitions of made electrodes exhibited different Nernstian factors. The Nernstian responses are found for magnesium concentration in the range of
10-1-10-4 M with the detection limit of 1,00 10-4 M (A electrode), 1,76 10-5 M (B
electrode), and 7,72 10-5 M (C electrode). The response time was between 41 and 85
seconds. In magnesium concentration containing one hundred times lower than other ions,
the magnesium electrode encountered interference from Fe2+ and Ca2+, while the
interference from Ba2+, Na+, and K+ could be neglected. The magnesium electrode can be
used in wide pH range from 5 to 11. The magnesium electrode can be used for 30 to 35 days. However, potentiometry method using the prepated magnesium electrode is not comparable to atomic absorption spectrophotometry.
PEMBUATAN DAN PENCIRIAN ELEKTRODE SELEKTIF
ION MAGNESIUM TIPE KAWAT TERLAPIS
INUNG NURHAYATI SUWARNO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul : Pembuatan dan Pencirian Elektrode Selektif Ion Magnesium Tipe Kawat Terlapis
Nama : Inung Nurhayati Suwarno
NIM : G44202027
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Dyah Iswantini Pradono, M.Agr NIP 131 956 706
Drs. Deden Saprudin, M.Si.
NIP 132 126 040
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
PRAKATA
Alhamdulillah. Segala puji syukur penulis panjatkan kepada Allah SWT atas segala rahmatnya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini mengambil judul Pembuatan dan Pencirian Elektrode Selektif Ion Magnesium Tipe Kawat Terlapis. Penelitian ini dilaksanakan di Laboratorium Kimia Analitik dan Kimia Fisik, Departemen Kimia, Institut Pertanian Bogor (IPB). Dana penelitian ini diperoleh dari Program Hibah Kompetisi A2 Departemen Kimia, IPB.
Terima kasih penulis ucapkan kepada Ibu Dr. Dyah Iswantini Pradono, M.Agr. dan Bapak Drs. Deden Saprudin, M.Si. selaku pembimbing yang telah memberi bimbingan dan pengarahan dalam penulisan karya ilmiah ini. Terima kasih juga penulis sampaikan kepada Om Eman, seluruh staf Laboratorium Kimia Analitik dan Kimia Fisik atas bantuannya. Ucapan terima kasih kepada Ibunda, Ayahanda, Mbak Nana, adikku Arifin, dan seluruh keluarga atas segala doa dan kasih sayangnya kepada penulis. Ungkapan terima kasih penulis ucapkan kepada rekan-rekan seperjuangan di team ESI 39 dan 40, Nana, Wati, Nita, saudara di liqoat, rekan-rekan Bintang Pelajar, teman-teman Al Muthmainah, teman-teman fusi 39, dan teman-teman Kimia 39 dan 40 atas kebersamaannya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Wonogiri (Jawa Tengah) pada tanggal 1 Maret 1983 dari ayah Suwarno dan ibu Tatik Musiati. Penulis merupakan anak kedua dari tiga bersaudara.
Penulis lulus SMU Negeri 1 Wonogiri pada tahun 2002 dan pada tahun yang sama penulis diterima di Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan penulis pernah menjadi asisten Kimia Fisik tahun ajaran 2004/2005, Kimia Dasar tahun ajaran 2005/2006, dan Kimia Analitik tahun ajaran 2006/2007. Selain itu penulis juga pernah aktif di Ikatan Mahasiswa Kimia (Imasika) sebagai staf Departemen Kewirausahaan (2004/2005), Dewan Kesejahteraan Masjid (DKM) Al Ghifari IPB sebagai staf Dana dan Usaha (2003/2004) dan staf Dompet Umat (2004/2005). Penulis pernah menjadi guru freelance di Bimbingan Belajar Nurul Ilmi dan Bimbingan Belajar Smart. Saat ini penulis aktif sebagai guru kontrak di Bimbingan Belajar dan Les Privat Bintang Pelajar. Pada tahun 2005 penulis melaksanakan pratik lapangan di PT Nalco Indonesia, Citeureup, Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Potensiometri ... 1
Prinsip Pengukuran dengan ESI ... 2
Waktu Respons ... 2
Koefisien Selektivitas ... 2
Pengaruh pH ... 3
Usia Pemakaian ... 3
BAHAN DAN METODE Bahan dan Alat ... 3
Prosedur ... 3
HASIL DAN PEMBAHASAN Faktor Nernst dan Trayek Pengukuran ... 5
Limit Deteksi... 5
Waktu Respons ... 5
Koefisien Selektivitas ... 5
Pengaruh pH ... 6
Usia Pemakaian ... 6
Penentuan Konsentrasi Magnesium pada Contoh Nutrisi Hidroponik ... 7
SIMPULAN DAN SARAN ... 7
DAFTAR PUSTAKA ... 8
DAFTAR TABEL
Halaman
1 Nilai faktor Nernst pada trayek pengukuran larutan magnesium 10-1-10-4 M ... 5
2 Limit deteksi dari ketiga elektrode ... 5
3 Waktu respons ESI magnesium ... 5
4 Koefisien selektivitas (KMg/x) ESI magnesium terhadap beberapa kation ... 6
5 Kadar magnesium nutrisi hidroponik ... 7
DAFTAR GAMBAR
Halaman 1 Rangkaian Pengukuran dengan ESI ... 22 Pengaruh pH pada nilai faktor Nernst ... 6
3 Pengaruh pH pada potensial larutan ... 6
4 Perubahan nilai faktor Nernst ESI magnesium selama 35 hari ... 7
5 Kurva hubungan – log [Mg2+] terhadap potensial (mV) menggunakan konsentrasi 10-6- 10-1 M (a) dibandingkan dengan menggunakan konsentrasi 10-4-10-1 M (b) pada ESI kode A ... 12
DAFTAR LAMPIRAN
Halaman
1 Bagan alir metode penelitian ... 11
2 Perbandingan kurva pengukuran menggunakan konsentrasi magnesium10-6-10-1 dan 10-4-10-1 M... ..12
3 Penentuan limit deteksi ... 13
4 Perubahan nilai faktor Nernst terhadap usia elektrode ... 14
5 Pengaruh pH terhadap nilai faktor Nernst ... 15
6 Penentuan kadar magnesium dengan spektrofotometri serapan atom (SSA) ... 16
7 Penentuan kadar magnesium dengan ESI ... 17
PENDAHULUAN
Magnesium adalah unsur logam alkali tanah yang banyak ditemukan di kerak bumi dan air laut. Magnesium sangat berperan penting bagi kehidupan manusia, hewan, dan tumbuhan. Magnesium merupakan gugus aktif enzim hewan dan manusia. Bagi tumbuhan magnesium adalah penyusun utama klorofil. Beberapa teknik analisis magnesium telah banyak dikembangkan, di antaranya adalah spektrofotometri serapan atom (SSA),
inductively coupled plasma (ICP), dan titrasi
kompleksometri (EPA 1999). Pada SSA magnesium diatomisasi. Cahaya yang diserap magnesium terbaca pada detektor (Day dan Underwood 1994). SSA mengukur konsentrasi magnesium pada kisaran 0,02-3,0 ppm. Prinsip ICP seperti pada metode emisi. Elektron terkeksitasi yang tidak stabil akan kembali ke keadaan dasar dengan melepaskan energi berupa cahaya. Cahaya dipancarkan ke spektrometer dan oleh kisi difraksi diubah menjadi spektrum garis. Pada titrasi kompleksometri magnesium dititrasi dengan ligan pengompleks EDTA (ethylenediamine
tetraacetid acid). Metode ini mampu
mengukur magnesium dengan kisaran konsentrasi 1-1000 ppm (EPA 1999).
Elektrode selektif ion (ESI) merupakan suatu sensor elektrokimia potensiometrik yang banyak digunakan karena preparasi mudah, peralatan sederhana, selektif, waktu respons cepat, dan biayanya murah (Mazloum et al. 2003). Pada saat ini telah banyak diteliti ESI untuk ion magnesium. ESI magnesium yang telah dikembangkan adalah ESI tipe membran cair diantaranya adalah penelitian yang dilakukan oleh Schaller et al. (1993), Katsu dan Nozomi (2000), Wei et al. (2000), Gupta
et al. (2002), dan Jun et al. (2004). Satu sisi
membran ini memiliki beberapa kelemahan, antara lain memerlukan teknik pembuatan dan penanganan khusus (Atikah 1994). ESI magnesium tipe kawat platina terlapis membran polimer yang dibuat terutama untuk menangani kelemahan ESI membran cair tersebut.
Penelitian ini dibuat ESI magnesium dengan tipe kawat platina terlapis membran polimer. Komposisi yang dipakai sesuai dengan Katsu dan Nozomi (2000) tetapi pemlastisnya diganti dengan o-NPOE (ortonitrofenil oktil eter). Penelitian ini juga mempelajari lebih lanjut faktor Nenrst, trayek konsentrasi, waktu respons, koefisien selektivitas, pengaruh pH, dan usia pemakaian. Selanjutnya ESI magnesium yang dibuat
digunakan untuk mengukur konsentrasi magnesium contoh.
TINJAUAN PUSTAKA
PotensiometriPotensiometri merupakan teknik analisis yang telah berkembang sejak awal abad ke-19. Potensiometri menjelaskan pengukuran komposisi ion analat berdasar perbedaan potensial elektrode. Komponen utama potensiometri adalah elektrode dan larutan. Larutan umumnya berisi komponen yang dapat mengion. Saat elektrode dicelupkan ke dalam larutan akan terjadi proses pembangkitan potensial yang besarnya ditentukan oleh konsentrasi ion tersebut. Potensial tersebut akan terukur dengan adanya elektrode.
Pengukuran potensiometri berlangsung bila sekurangnya terdapat dua tipe elektrode, yaitu elektrode kerja (indicator electrode) dan elektrode pembanding (reference elctrode). Elektrode pembanding harus mempunyai potensial yang bebas dari gangguan larutan analat dan potensialnya konstan pada arus rendah (Skoog et al. 1988). Elektrode yang umum digunakan adalah elektrode hidrogen standar, elektrode kalomel jenuh, dan perak-perak klorida. Elektrode kerja diklasifikasikan berdasarkan mekanisme bagaimana potensial elektrode dihasilkan. Contoh elektrode kerja antara lain elektrode kerja logam dan elektrode kerja membran. Elektrode kerja membran membangkitkan potensial yang ditentukan oleh perbedaan konsentrasi ion tertentu pada kedua sisi membran. Termasuk pada kelompok ini adalah elektrode selektif ion (ESI).
ESI membran terdiri atas membran yang memberikan respons secara selektif terhadap spesi ion tertentu dan bagian luarnya mengadakan kontak dengan ion yang akan ditentukan. Membran mempunyai pori yang sangat kecil, mekanisme reaksinya stabil, dan tidak mudah larut dalam air (Ruzicka 1997 dan Wang 1994). Membran yang digunakan berupa polimer dan suatu zat aktif yang bersifat sebagai pengekstrasi melalui mekanisme kelat atau pertukaran ion (Bailey 1983). Berdasarkan jenis membran yang digunakan, ESI dibedakan menjadi lima, yaitu elektrode gelas, elektrode membran cair, elektrode membran padat, elektrode penunjuk gas, dan elektrode enzim atau biosensor. Perkembangan ESI menggunakan membran
termasuk pesat karena kelebihan-kelebihan yang dimilikinya, seperti preparasi yang tidak rumit, peralatan sederhana, selektif, waktu respon cepat, dan murah (Mazloum et al. 2003).
Prinsip Pengukuran ESI
Potensial yang terukur merupakan selisih antara elektrode pembanding luar (Eref ext) dan elektrode pembanding dalam (Eref int) ditambah potensial membran (Ememb) dan potensial sambungan cair (Elj). Hubungan keempat potensial ini ditulis
Esel = Eref ext – Eref int + Ememb + Elj (1) Membran bersifat selektif terhadap ion tertentu (i) sehingga potensial membran tergantung pada aktivitas ion contoh (ai contoh) dan aktivitas ion dalam membran dalam (ai int) Ememb = RT/nF ln (ai contoh / ai int) (2) Jika persamaan (2) disubtitusikan ke dalam persamaan (1) maka diperoleh persamaan (3)
E a a E E E lj i contoh ref refext memb nF RT nF RT + ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ + + − = int int 1 ln ln
Eref ext dan Eref int besifat konstan. Kondisi larutan contoh dapat dikontrol sehingga Elj akan konstan pula, begitupun konsentrasi potensial di dalam larutan membran. Sehingga diperoleh persamaan (3) menjadi
a E sel icontoh nF RT K ± ln =
K adalah konstanta total dari elektrode, n adalah muatan ion, T adalah suhu mutlak larutan (K), R ialah tetapan gas (8,314 J/Kmol), dan ai adalah aktivitas larutan ion.
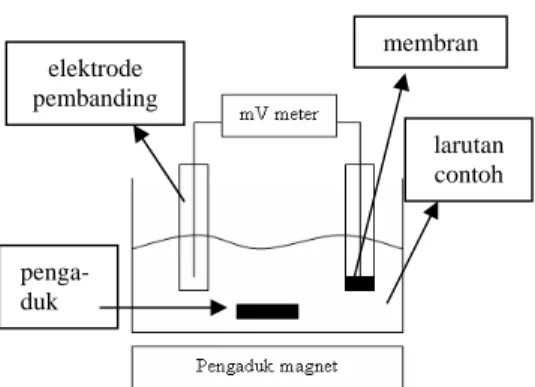
Dalam mengukur potensial larutan, ESI membutuhkan elektrode lain sebagai pembanding. Elektrode pembanding yang dapat dipakai antara lain elektrode kalomel jenuh (Hg/Hg2Cl2), elektrode perak/perak klorida (Ag/AgCl), dan elektrode gas hidrogen. Rangakaian pengukuran larutan dengan ESI dapat dilihat pada Gambar 1.
Gambar 1 Rangkaian pengukuran ESI.
Waktu Respons
Waktu respons adalah waktu yang diperlukan oleh elektrode untuk memberikan potensial yang konstan. Semakin cepat elektrode memberikan respons potensial yang konstan maka semakin bagus kualitas elektrode tersebut.
Koefisien Selektivitas
Parameter penting lain bagi pencirian ESI adalah kinerja ESI dengan adanya ion lain dalam larutan utama. Konstanta elektrode dengan adanya ion lain disebut dengan koefisien selektivitas (KMg/x).
Koefisien selektivitas ditentukan dengan dua metode, yaitu metode larutan terpisah dan metode larutan tercampur. Pada metode larutan terpisah, membandingkan perbedaan potensial antara larutan yang berisi larutan ion utama saja dan larutan yang berisi ion pengganggu saja. Kekurangan metode ini adalah koefisien selektivitas tidak mempunyai derajat keterulangan yang baik karena pengukuran potensial dilakukan pada kondisi larutan yang berbeda. Sedangkan pada metode larutan tercampur, membandingkan perbedaan potensial antara larutan yang mengandung ion utama dengan larutan yang mengandung campuran ion utama dan ion pengganggu (Fardiyah 2003 dan Umezewa et al. 2000).
ESI magnesium yang ditujukan untuk pengukuran larutan contoh, metode koefisien selektivitas yang dipilih adalah metode larutan tercampur. Ini dipilih karena dalam larutan contoh banyak mengandung ion-ion selain magnesium. Mula-mula adalah mengukur potensial larutan yang hanya mengandung ion magnesium (E1) kemudian mengukur potensial larutan yang mengandung ion magnesium dan ion pengganggu (E2). Perhitungannya adalah sebagai berikut
membran elektrode pembanding larutan contoh penga-duk
a
E
nF Mg RT log 3 , 2 1 = ( )[
+ ∑]
= n m x x Mg Mg K a a E2 nFRT log / / 3 , 2Hasil pengurangan E1 dan E2 adalah ( ) ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎣ ⎡ ∑ = − + a a E E Mg m n Mg K a nF RT Mg x x / 1 2 / log 3 , 2 nilai nF RT 3 , 2
= s, maka persamaan koefisien selektivitas menjadi sebagai berikut
(
)
( )
nm x Mg s E x Mg a a K / / / 1 10 − = Δx adalah ion pengganggu dan m adalah muatan ion pengganggu.
Pengaruh pH
Kinerja elektrode dipengaruhi oleh pH larutan sehingga perlu dilakukan pengukuran terhadap seri larutan dengan pH yang bervariasi. Semakin jauh dari nilai faktor Nernst teoritis maka menunjukkan bahwa larutan tidak diperbolehkan diukur pada nilai pH tersebut.
Usia Pemakaian
Elektrode yang dipakai terus menerus akan menurunkan stabilitas mekanik membran karena kehilangan ionofor, pemlastis, dan zat aditif yang kemungkinan larut dalam larutan contoh (Oesch et al. 1986). Pengukuran usia pemakaian elektrode menunjukkan berapa lama suatu elektrode masih layak digunakan. Elektrode layak digunakan jika nilai faktor Nernst tidak menyimpang jauh dari nilai teoritis dan koefisien korelasinya tinggi pada selang waktu tertentu.
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan adalah kawat platina (Pt), kabel koaksial, ionofor N,N’-diheptil-N,N’-dimetil-1,4-butanadiami- da, polivinil klorida (PVC), ortonitrofenil oktil eter (o-NPOE), kalium tetrakis(4-klorofenil)borat (KTpCIPB), tetrahidrofuran (THF), MgCl2, NaCl, CaCl2, NaOH, BaCl2, FeCl2, HCl, dan air deionisasi.
Alat-alat yang digunakan adalah pH meter (Eutech), elektrode pembanding
kalomel jenuh (Fisher), peralatan gelas, pengaduk magnet, dan alat pengukur waktu.
Prosedur Pembuatan Larutan Standar
Larutan MgCl2 yang digunakan sebagai induk memiliki konsentrasi 0,1 M. Larutan ini dibuat dengan melarutkan 1,02 gram MgCl2.6H2O dalam 100 ml air deionisasi. Kemudian dari larutan induk dibuat larutan standar (10-4-10-1 M) dengan cara mengencerkan larutan induk.
Pembuatan Badan Elektrode
Kawat tembaga dengan panjang 5 cm disambung dengan kawat platina ukuran panjang 2 cm, diameter 0,5 mm dengan cara dipateri menggunakan kawat timah. Tip mikropipet ukuran 1 ml digunakan sebagai badan elektrode. Pada dasar tip mikropipet, kawat platina sepanjang 1 cm dibiarkan terbuka sebagai tempat penempelan membran. Sedangkan pada ujung atas tip mikropipet kawat tembaga dibiarkan terbuka sebagai penghubung ke potensiometer (Wahab et al. 2005).
Pembuatan Membran dan Pelapisan Membran
Membran dibuat dengan melarutkan 0.0014 g N,N’-diheptil-N,N’-dimetil-1,4-butanadiamida, 0,0012 g KTpCIPB, 0,0648 g o-NPOE, dan 0,0353 g PVC dalam 10 ml THF. Larutan kemudian diaduk dengan pengaduk magnet hingga homogen (2 jam). Pada waktu pengadukan, larutan ditutup dengan gelas arloji agar pelarut tidak menguap.
Pelapisan membran dilakukan dengan mencelupkan ujung kawat platina ke dalam larutan membran dengan beberapa kali pencelupan sehingga diperoleh membran yang tipis dan merata. Elektrode kemudian dikeringkan pada suhu ruang selama 24 jam. Untuk meningkatkan ketahanan membran, elektrode dipanaskan dengan suhu 40°C selama 24 jam. Masing-masing elektrode selektif ion magnesium (ESI magnesium) yang telah jadi kemudian di direndam ke dalam larutan Mg2+ 10-6 M selama 24 jam (Modifikasi dari metode Buchari dan Irdhawati 2002).
Pengukuran Potensial
Sebelum digunakan untuk mengukur, ESI Mg direndam dalam larutan Mg2+ 10-6 M selama 6 jam. ESI magnesium dicelupkan
dalam larutan yang diukur hingga semua membran tercelup. Larutan diaduk dengan batang magnet dengan kecepatan tetap. Besarnya potensial ditentukan dengan membandingkan ESI magnesium dengan elektrode kalomel jenuh.
Faktor Nernst dan Trayek Pengukuran
Larutan magnesium yang diukur mempunyai konsentrasi 10-6, 10-5, 10-4, 10-3, 10-2, dan 10-1 M. Pembacaan dilakukan saat potensiometer menunjukan nilai yang konstan. Potensial hasil pengukuran kemudian ditulis ke dalam persamaan regresi linear sumbu xy. Sumbu x adalah –log [Mg2+] (M) dan sumbu y adalah potensial (mV). Garis linear yang diperoleh pada kisaran konsentrasi tertentu disebut trayek pengukuran. Kemiringan garis merupakan nilai faktor Nernst (Wahab et al. 2005).
Limit Deteksi
Limit deteksi ditentukan dengan membuat garis singgung pada fungsi garis linear dan garis melengkung pada grafik hubungan antara –log [Mg2+] dan potensial. Titik potong kedua garis itu kemudian diekstrapolasikan ke sumbu x. Konsentrasi yang diperoleh dari ekstrapolasi disebut limit deteksi (Rundle 2000).
Waktu Respons
Larutan Mg2+ yang diukur mempunyai konsentrasi 10-4, 10-3, 10-2, dan 10-1 M. Waktu respons ditulis saat potensial menunjukan nilai yang konstan.
Koefisien Selektivitas (KMg/x)
Koefisien selektivitas ditentukan dengan metode larutan tercampur. Larutan Mg2+ dengan konsentrasi 10-4 M diukur lebih dahulu potensialnya. Selanjutnya larutan Mg2+ 10-4 M dicampur dengan larutan pengganggu 10-2 M. Larutan campuran diukur potensialnya (Umezewa et al. 2000). Koefisien selektivitas dihitung dengan rumus
(
)
( )
nm x Mg s E x Mg a a K / / / 1 10 − = ΔLarutan pengganggu yang digunakan adalah Na+, K+, Ca2+, Ba2+, dan Fe2+.
Pengaruh pH
Dibuat seri larutan Mg2+ dengan konsentrasi 10-4, 10-3, 10-2, dan 10-1 M. Larutan ini kemudian diatur pH-nya dengan
penambahan NaOH atau HCl. Kisaran pH yang dibuat 3-11.
Umur Pakai
Umur elektrode ditentukan dengan melihat nilai faktor Nernst setiap selang 5 hari. Semakin jauh menyimpang dari nilai teoritis (29,6 mV/dekade, 25°C) maka kinerja elektrode semakin menurun.
Penentuan Kadar Magnesium Contoh
Larutan yang digunakan sebagai contoh adalah larutan nutrisi hidroponik. Larutan ini diukur dengan dua metode yang berbeda, yaitu spektrofotometri serapan atom (SSA) dan metode potensiometri dengan ESI magnesium. Metode SSA dipakai sebagai pembanding.
Sebanyak 2 gram pupuk hidroponik dicampur dengan 25 ml HCl 8 M. Campuran kemudian didihkan selama 10 menit. Selanjutnya disaring dan ditepatkan menjadi 50 ml dengan air deionisasi. Larutan ini disebut dengan larutan induk.
Sebanyak 1 ml larutan induk ditambah 10 ml HCl 8 M dan 10 ml La2O3 0,1 %. Kemudian ditepatkan menjadi 100 ml dengan air deionisasi. Larutan siap dianalisis dengan SSA (AOAC 1961).
Pengukuran dengan ESI magnesium dilakukan dengan melarutkan 0,18 g pupuk hidroponik menjadi 500 ml. 50 ml larutan nutrisi ini kemudian diukur potensialnya dengan ESI magnesium.
Hasil pengukuran dari metode SSA dan ESI kemudian dibandingkan dengan uji-t (Miller JC dan Miller JN 1991).
HASIL DAN PEMBAHASAN
ESI magnesium kawat terlapis dibuat dari platina (Pt) yang dilapisi membran tanpa adanya larutan internal. Kawat Pt dipilih karena bersifat inert, tahan terhadap pengaruh fisika dan kimia, tidak dipengaruhi oleh membran dan merupakan penghantar listrik yang baik. Membran elektrode adalah polimer yang bahan utamanya adalah PVC dengan ionofor N,N’-diheptil-N,N’-dimetil-1,4-butanadiamida yang berfungsi sebagai ligan pengompleks kation, KTpCIPB sebagai penyeimbang ion, dan zat pemlastis, o-NPOE.Pencirian elektrode selektif ion (ESI) magnesium bertujuan mengetahui mutu kinerja ESI magnesium. Pencirian ESI magnesium meliputi nilai faktor Nernst, trayek pengukuran, limit deteksi, waktu
respons, pengaruh adanya ion lain (selektivitas), pengaruh pH, dan usia pemakaian elektrode.
Pencirian ESI magnesium dilakukan pada tiga buah elektrode, yaitu ESI kode A, B, dan C. Pemberian kode bertujuan untuk membedakan keterulangan ESI yang dibuat .
Faktor Nernst dan Trayek Pengukuran
Nilai faktor Nernst dan trayek pengukuran suatu ESI sangat penting untuk menentukan kelayakan dan kinerja ESI. Suatu ESI untuk ion bervalensi dua dikatakan layak dipakai jika mempunyai faktor Nernst sebesar 25-30 mV/dekade (Wroblewski 2006). Trayek pengukuran adalah kisaran konsentrasi ion magnesium yang masuk dalam persamaan regresi linear.
Hasil penelitian menunjukkan kisaran konsentrasi magnesium yang terukur oleh ESI adalah 10-4-10-1 M (Lampiran 2). Dengan persamaan regresi linear diperoleh nilai faktor Nernst dan koefisien korelasi dari ESI A, B, dan C pada Tabel 1.
Tabel 1 Nilai faktor Nernst pada trayek pengukuran magnesium 10-4-10-1 M Karakter elektrode Elektrode A B C Faktor Nernst (mV/deka de) 16,3 14,0 10,2 Koefisien korelasi (r) 0,9969 0,9919 0,9983 Intersep (mV) 415,0 422,0 407.5
Tampak bahwa elektrode A, B, dan C menunjukkan nilai faktor Nernst yang berbeda-beda walaupun ketiga elektrode tersebut dibuat dengan perlakuan yang sama. Hal ini disebabkan oleh faktor yang berasal dari fisik elektrode itu sendiri, antara lain homogenitas ketebalan membran, sifat fisik membran, keadaan permukaan kawat platina, dan sifat antarmuka membran kawat platina (Buchari dan Irdhawati 2002). Jauhnya nilai faktor Nernst dari teoritis disebabkan oleh sifat kimia membran. Sifat kimia membran sangat berpengaruh sekali terhadap pembentukan kompleks magnesium dengan N,N’-diheptil- N,N’- dimetil- 1,4- butanadiamida. Kepolaran membran diduga tidak dapat mengimbangi energi hidrasi
magnesium sehingga kekuatan pengomplekskan magnesium menjadi kecil.
Limit Deteksi
Hasil pengukuran menunjukkan limit deteksi elektrode A, B, dan C mempunyai nilai yang berbeda. Berdasarkan Tabel 2 masing-masing elektrode A, B, dan C mempunyai limit deteksi 1,00 10-4 M, 1,76 10 -5 M, dan 7,72 10-5 M. Jika konsentrasi magnesium kurang dari limit deteksi maka nilai potensial yang terukur tidak masuk persamaan Nernst dan koefisien korelasinya rendah.
Tabel 2 Limit deteksi dari ketiga elektrode
Kode ESI A B C -log [Mg2+] 3,99 4,76 4,11 [Mg2+] 1,00 10-4 1,76 10-5 7,72 10-5 Waktu Respons
Waktu respons dipelajari berdasarkan pengamatan potensial elektrode larutan Mg2+ dengan konsentrasi 10-4-10-1 M. Tabel 3 adalah waktu respons elektrode A, B, dan C. Tabel 3 Waktu respons ESI magnesium
[Mg2+] (M) Waktu (detik) A B C 10-4 85 76 66 10-3 61 63 56 10-2 57 51 47 10-1 55 50 41 Berdasar penelitian dapat dikatakan bahwa semakin besar konsentrasi magnesium maka semakin singkat waktu respons elektrode. Pada konsentrasi tinggi, pergerakan ion juga semakin meningkat. Dengan semakin banyaknya jumlah ion maka akan semakin cepat untuk berdifusi ke dalam membran sehingga pembentukan kompleks dengan ionofor N,N’-diheptil-N,N’-dimetil-1,4-butanadiamida semakin cepat.
Koefisien Selektivitas
Selektivitas ESI magnesium dipengaruhi oleh sifat fisik dan kimia membran. Sifat fisik membran antara lain adalah homogenitas ketebalan permukaan membran, keadaan kawat platina, dan keseragaman ukuran pori-pori membran. Sedangkan sifat kimia membran diantaranya kekuatan pembentukan
kompleks, komposisi penyeimbang ion, dan pemlastis. Ionofor N,N’-diheptil-N,N’-dimetil-1,4-butanadiamida merupakan ligan netral yang mengikat magnesium dengan cara pengkelatan. Donor elektron untuk mengkelat magnesium berasal dari elektron bebas atom oksigen dan nitrogen ionofor (Wei et al. 2000). Selektivitas ESI magnesium diujikan terhadap Na+, K+, Ca2+, Ba2+, dan Fe2+. Pemilihan ion-ion tersebut adalah berdasarkan kesamaan muatan dan keberadaannya di dalam nutrisi hidroponik.
Tabel 4 menunjukkan keselektivan ESI magnesium terhadap beberapa ion dengan konsentrasi magnesium seratus kali lebih kecil dari ion-ion lain yang diuji. Fe2+ dan Ca2+ memberi pengaruh besar bagi pengukuran ESI magnesium. Konsentrasi Fe2+ sebesar 10-2 M dengan volume yang sama dengan volume Mg2+ 10-4 M telah menyebabkan Fe2+ melewati titik jenuh. Fe2+ membentuk endapan yang berwarna coklat kekuningan. Pada keadaan ini larutan menjadi lebih asam sehingga mempengaruhi ketahanan PVC, keasaman ionofor, dan polaritas membran. Keselektivan ESI magnesium terhadap Ca2+ karena tingkat kepolaran membran tidak dapat mengimbangi energi hidrasi magnesium yang lebih besar dari Ca2+.Ion-ion lain seperti Na+, K+, dan Ba2+ tidak mempengaruhi kinerja ESI magnesium karena koefisien selektivitasnya kurang dari 1.
Tabel 4 Koefisien selektivitas (KMg/x) ESI magnesium terhadap beberapa kation Ion peng- ganggu Koefisien selektivitas A B C Na+ -0,1571 0,4258 -0,9072 K+ -0,4224 0,9915 0,0098 Ba2+ 0,3519 0,8786 0,9774 Ca2+ 9,4768 2,4837 30,6992 Fe2+ 1,05 106 3,97 106 7,93 1010 Pengaruh pH
Kinerja ESI sangat dipengaruhi oleh pH larutan karena membran terdiri atas ionofor N,N’-diheptil-N,N’-dimetil-1,4-butanadiami- da dan PVC. N,N’-diheptil-N,N’-dimetil-1,4-butanadiamida adalah basa lemah yang kekuatan pengkelatannya dipengaruhi oleh pH. Membran PVC ketahanannya akan menurun pada medium pH yang terlalu asam ataupun terlalu basa.
ESI diuji kinerjanya pada beberapa larutan magnesium dengan pH yang bervariasi. Jika pada pH tertentu nilai faktor Nernst menyimpang jauh dari nilai teoritis maka pada pH tersebut tidak dianjurkan untuk mengukur potensial contoh. Jika larutan berada di luar kisaran pH maka pH larutan contoh harus disesuaikan dahulu dengan kisaran pH yang masuk.
ESI menunjukkan penyimpangan faktor Nernst yang sangat besar pada pH 3 dan 4 (Gambar 2). Pada pH ini konsentrasi ion H+ sangat tinggi. Ion H+ selanjutnya bersaing kuat dengan Mg2+ untuk berikatan dengan oksigen ionofor. Hal ini juga dikuatkan hasil pengukuran potensial pada pH 3 dan 4 yang sangat berbeda dengan pH 5-11 (Gambar 3). Ini menunjukkan bahwa potensial yang terukur bukan merupakan Mg2+ tetapi potensial H+ sehingga diduga ionofor lebih selektif terhadap H+. -25 -20 -15 -10 -5 0 5 10 15 20 25 0 1 2 3 4 5 6 7 8 91011121314 pH fakt o r N e rn s t (m v/ d ekad e) Elektrode A Elektrode B Elektrode C
Gambar 2 Pengaruh pH terhadap nilai faktor Nernst. 200 250 300 350 400 450 500 3 4 5 6 7 8 9 10 11 pH E ( m V) Elektrode A Eletrode B Elektrode C
Gambar 3 Pengaruh pH terhadap potensial larutan.
Usia Pemakaian
Faktor Nernst mula-mula mengalami kenaikan sampai hari ke-15. Faktor Nernst tertinggi yang diperoleh adalah 17,0 mV/dekade (ESI A) 15,6 mV/dekade (ESI B), 10,5 mV/dekade (ESI C). Setelah hari ke-15, faktor Nernst mengalami penurunan tetapi
koefisien korelasinya masih baik. Penurunan yang berarti terjadi pada hari ke-30 untuk ESI C, yaitu 4,9 mV/dekade. ESI A dan B mengalami penurunan yang berarti pada hari ke-35, yaitu 7,5 da 2,4 mV/dekade.
0 2 4 6 8 10 12 14 16 18 1 3 5 10 15 20 25 30 35 Hari ke-F akt o r N e rn st ( m V /d ekad e) Elektrode A Elektrode B Elektrode C
Gambar 4 Perubahan nilai faktor Nernst ESI magnesium selama 35 hari. Penurunan faktor Nernst karena adanya penggembungan membran. Adanya air yang memasuki membran menyebabkan semakin mobilnya ionofor dan semakin mudahnya mengalami disosiasi karena konsentrasi yang semakin menurun. Hal ini akan menyebabkan semakin banyaknya ion-ion hasil disosiasi ionofor yang meninggalkan membran menuju fase cair yang dipisahkan sehingga kinerja elektrode menurun.
Penentuan Kadar Magnesium Contoh Nutrisi Hidroponik
Kadar magnesium pada contoh nutrisi hidroponik ditentukan dengan dua metode. Hal ini untuk membandingkan perbedaan hasil analisis metode ESI dengan metode spektrofotometri serapan atom ( SSA) yang sudah umum dipakai dalam analisis magnesium.
Tabel 5 menunjukkan kadar magnesium yang dianalisis dengan ESI mempunyai nilai yang berbeda dengan hasil analisis SSA. Nilai rata-rata kadar magnesium yang diukur dengan ESI 0,75 %, sedangkan nilai rata-rata kadar magnesium dengan SSA sebesar 1,12 %. Tabel 5 Kadar megnesium nutrisi hidroponik
Ulangan Kadar magnesium (%) ESI SSA 1 0,93 1,12
2 0,66 1,12 3 0,66 1,12 Rerata 0,75 1,12 Kedua metode ini selanjutnya dibandingkan hasilnya dengan uji-t dengan
analisis perbandingan dua contoh berpasangan (Lampiran 8). Hasil uji-t menunjukkan bahwa nilai kadar magnesium dari kedua metode itu berbeda nyata, yaitu dengan ditolaknya H0 pada tingkat kepercayaan 95 %.
Perbedaan nilai kadar magnesium diantaranya karena faktor larutan contoh dan faktor ESI. Contoh adalah larutan hidroponik yang terdiri atas unsur makro dan unsur mikro yang dibutuhkan oleh tumbuhan. Na+, K+, Ca2+, dan Mg2+ adalah contoh unsur makro sedangkan Ba2+ dan Fe2+ adalah contoh unsur mikro. Konsentrasi Mg2+ dalam larutan hidroponik relatif lebih kecil dibanding konsentrasi Ca2+. Konsentrasi Fe2+ duaratus kali lebih kecil dibanding Mg2+. Berdasarkan data perbandingan konsentrasi dan uji selektivitas, gangguan kinerja ESI terutama disebabkan oleh selektivitas ESI magnesium terhadap kalsium lebih besar dibandingkan terhadap magnesium. Faktor dari ESI magnesium adalah keselektivan terhadap magnesium masih kurang karena faktor Nernstnya masih jauh dari nilai teoritis.
SIMPULAN DAN SARAN
SimpulanKetiga ESI magnesium menunjukkan nilai faktor Nernst yang berbeda walaupun dengan perlakuan yang sama. Trayek pengukuran larutan dapat dilakukan pada kisaran konsentrasi 10-4-10-1 M. Limit deteksi masing-masing ESI 1,00 10-4 M (ESI A), 1,76 10-5 M (ESI B), dan 7,72 10-5 M (ESI C). Waktu respon ESI 41 sampai 85 detik. ESI bekerja baik pada kisaran pH 5-11. Pada konsentrasi magnesium seratus kali lebih kecil dari ion-ion lain, urutan selektivitas ESI magnesium adalah Fe2+ >> Ca2+ > Mg2+ > Ba2+ > K+ > Na+. ESI magnesium dapat digunakan 30-35 hari.
Penentuan kadar magnesium larutan nutrisi hidroponik menggunakan metode ESI magnesium pada selang kepercayaan 95 % memberikan hasil yang berbeda nyata dengan spektrofotometri serapan atom.
Saran
Perlu adanya alat pencetak membran sehingga diperoleh ESI yang memiliki permukaan yang rata dan seragam. Perlu dicari perbandingan komposisi membran sehingga diperoleh ESI magnesium yang memiliki faktor Nernst yang mendekati nilai
teoritis. Uji selektivitas terhadap ion lain perlu disesuaikan perbandingan konsentrasinya dengan contoh yang akan diuji sehingga diketahui jelas ion-ion apa saja yang mengganggu dalam pengukuran magnesium. Saat pengukuran contoh, keberadaan ion pengganggu dan pH harus diperhatikan.
DAFTAR PUSTAKA
AOAC. 1961. Nutrients (Minor) in Fertilizer
@ AAS. Ed. ke-5 Vol. 6. Maryland:
Elwell and Gidley.
Atikah. 1994. Pembuatan dan Karakterisasi Elektrode Selektif Nitrat Tipe Kawat Terlapis [Tesis]. Bandung: Program Pascasarjana, Institut Teknologi Bandung.
Bailey PL. 1983. Analysis With Ion Selective
Electrodes. London: Heyden and Sons.
Buchari, Irdhawati. 2002. Pembuatan dan Karakterisasi Elektrode Selektif Ion Nitrat Tipe Kawat Terlapis Membran
PVC dengan Dopan Metiltrioktilamonium Nitrat Sebagai Ionofor. Prosiding Seminar Kimia
Bersama UKM-ITB ke-5, Selangor,
2002: 159-168.
Day RA, Underwood AL,. 1994. Analisa
Kimia Kuantitatif. Terjemahan R
Soendoro. Jakarta: Erlangga.
EPA. 1999. National Primary Drinking Water Regulations: Analytical Methods for Microbes, Lead, and Magnesium: Proposed Rule. Federal Register 64: 2538-2544.
Fardiyah Q. 2003. Aplikasi Elektrode Selektif Ion Nitrat Tipe Kawat Terlapis untuk Penentuan Secara Tak Langsung Gas NO. [Tesis]. Bandung: Program Pasacasarjana, Institut Teknologi Bandung.
Gupta, VK et al. 2002. Magnesium Selective Electrodes. Sensors and Actuators B
(Chemical) 86: 235-241.
Hulanicki A, Staniseuw Geab, Folke Ingman. 1991. Chemical Sensors Definitions and Classification. Pure Application
Chemistry 63: 1247-1250.
Hyejin Oh et al. 2003. Discrimination Among Octylamine Isomers by Polymeric Membrane Electrodes Based on Lipophilic Calyx[6]arene Tetraester Derivates. Bull Korean Chem Soc 24: 109-112.
Jun HS et al. 2003. Ion Selective Electrode Based on Molecular Tweezer-Type Neutral Carriers. Talanta 63: 61-71. Katsu T, Nazomi N. 2000. Organic
Ammonium Ion-Selective Electrodes Using Acyclic Neutral Carriers Developes Ion-Selective Electrodes.
Analytical Science 16: 523-525.
Mazloum MA et al. 2003. Silver(1)-Selective Coated-Wire Electrode Based on an Octahydroxycalix[4]arene Derivative.
Analytical Sciences 19: 1187-1190.
Miller JC & Miller JN. 1999. Statistika untuk
Kimia Analitik. Ed. ke-2. Terjemahan
Suroso,. Bandung: Penerbit ITB
Oesch Urs et al. 1986. Ion Selective Electrodes for Clinical Use. Clin. Chem.
32: 1448-1459.
Rundle C Chris. 2000. Beginners Guide to Ion Selective Electrode Measure-ment.[terhubung berkala]. http: //www.nico2000.net/index.html.[5 Ma-ret 2006].
Ruzicka J. 1997. The Seventies-Golden Age for Ion Selective Electrodes. Journal of
Chemical Education 74: 167-170.
Skoog DA, Wesr DM, Holler EI. 1988.
Fundamental of Analytical Chemistry.
New York: Saunders.
Schaller U et al. 1993. Novel Magnesium Ion-Selective Microelectrodes Based on Neutral Carrier. European Journal of
Physiology 423: 338-342.
Umezawa Y et al. 2000. Potentiometric Selectivity Coefficients of Ion-Selective Electrodes. Pure Application
Chemistry 72: 1851-1856.
Wang J. 1994. Analytical Electrochemistry. New York: VCH Publisher.
Wahab AW et al. 2005. Pengaruh Komposisi Membran Berpendukung PVC Terhadap Kinerja Elektrode Selektif Ion (ESI)-Hg(II) Menggunakan Ionofor DBA218C6. Seminar Nasional MIPA 2005, FMIPA, Universitas Indonesia Depok, 24-26 November 2005.
Wei Z et al. 2000. A Comparison of Neutral Mg2+ Selective Ionophores in Solvent Polymeric Membrane: Complex Stoichiometry and Liphophilicity.
Analytical Sciences 16: 11-16.
Wroblewski W. 2006. Ion Selective Electrodes [terhubung berkala]. http://chemical sensors research group. [23 Maret 2006].
Pembuatan badan elektrode
Pembuatan elektrode
Penentuan faktor Nerst dan trayek pengukuran
Pencirian ESI
Lampiran 1 Bagan alir penelitian
Pelapisan membran pada kawat Pt
Penentuan limit deteksi
Penentuan waktu respon
Penentuan Koefisien selektivitas
Penentuan pengaruh pH
Penentuan Umur Pakai
Pembuatan Larutan Untuk ESI
Penentuan Konsentrasi Magnesium Contoh Nutrisi Hidroponik
Lampiran 2 Perbandingan kurva pengukuran menggunakan konsentrasi 10-4-10-1 M dan 10-6-10-1 M
Kurva hubungan –log [Mg] terhadap potensial (mV) menggunakan konsentrasi 10-6 – 10-1 M (a) dibandingkan dengan menggunakan konsentrasi 10-4 – 10-1 M (b).
Kurva hubungan –log [Mg] terhadap potensial (mV) menggunakan konsentrasi 10-6 – 10 -1
M (a) dibandingkan dengan menggunakan konsentrasi 10-4 – 10-1 M (b).
Kurva hubungan –log [Mg] terhadap potensial (mV) menggunakan konsentrasi 10-6 – 10-1 M (a) dibandingkan dengan menggunakan konsentrasi 10-4 – 10-1 M (b).
y = -10.057x + 401.53 R= 0.9204 330 340 350 360 370 380 390 400 410 0 1 2 3 4 5 6 7 - l og [ M g] y = -16.3x + 415 R= 0.9969 340 350 360 370 380 390 400 410 0 1 2 3 4 5 - l og [ M g]
a
b
y = -14x + 422 R= 0.9919 360 370 380 390 400 410 420 0 1 2 3 4 5 - l og [ M g] y = -4.5714x + 401.67 R= 0.5794 360 370 380 390 400 410 420 0 1 2 3 4 5 6 7 - l og [ M g]a
b
y = -10.2x + 407.5 R= 0.9983 365 370 375 380 385 390 395 400 0 1 2 3 4 5 - l og [ M g] y = -6.0286x + 398.27 R= 0.8770 360 365 370 375 380 385 390 395 400 0 1 2 3 4 5 6 7 - l o g [ M g ]a
b
Lampiran 3 Penentuan limit deteksi y = -16.3x + 415 R= 0.9969 y = 0.5x + 347.83 R= 0.8660 340 350 360 370 380 390 400 410 0 2 4 6 8 -log [M g] E ( m V)
Kurva hubungan –log [Mg] terhadap potensial ESI A. Limit deteksi ESI A
-15x + 413,5 = -x + 356,33 x = 3,9982 -log [Mg] = -3,9982 [Mg] = 1,00 10-4 M y = 10.5x + 325.5 R= 0.9966 y = -14x + 422 R= 0.9919 360 370 380 390 400 410 420 0 2 4 6 8 -log[Mg] E ( m V )
Kurva hubungan –log [Mg] terhadap potensial ESI B. Limit deteksi ESI B
-14x + 422 = 10,5x + 325,5 x = 4,7551 -log [Mg] = 4,7551 [Mg] = 1,76 10-5 M y = 2x + 357.33 R= 0.5695 y = -10.2x + 407.5 R= 0.9983 360 370 380 390 400 0 2 4 6 8 -log[M g] E ( m V)
Kurva hubungan –log [Mg] terhadap potensial ESI C. Limit deteksi ESI C
-10x + 407,5 = 2x +357,33
x = 4,1123
-log [Mg] = 4,1123 [Mg] = 7,72 10-5 M
Lampiran 4 Perubahan nilai faktor Nernst terhadap usia elektrode
Nilai faktor Nernst terhadap usia pemakaian elektrode
Hari ke-
Elektrode Potensial pada konetrasi ke- (mV) Slope r
10-6 10-5 10-4 10-3 10-2 10-1 1 A 392 354 358 366 380 405 15,5 0,9707 B 388 381 372 381 394 417 14,8 0,9776 C 397 390 392 397 402 412 6,6 0,9827 3 A 356 360 360 371 384 407 15,4 0,9839 B 387 388 381 387 395 412 10,1 0,9694 C 383 386 375 382 383 394 5,8 0,9535 5 A 351 350 350 367 380 400 16,3 0,9969 B 389 377 368 378 392 410 14,0 0,9919 C 371 364 367 377 386 398 10,2 0,9950 10 A 360 378 386 401 13,1 0,9904 B 379 397 402 421 13,1 0,9793 C 380 393 398 404 7,7 0,9736 15 A 340 360 377 391 17,0 0,9969 B 356 373 388 403 15,6 0,9995 C 356 373 379 389 10,5 0,9793 20 A 316 331 343 358 13,8 0,9990 B 313 318 328 337 8,2 0,9915 C 329 337 347 350 7,3 0,9812 25 A 354 364 380 393 13,3 0,9964 B 343 354 366 373 10,2 0,9945 C 334 345 344 360 7,7 0,9273 30 A 343 353 360 378 11,2 0,9902 B 352 354 364 378 8,8 0,9556 C 355 359 363 370 4,9 0,9889 35 A 384 386 395 406 7,5 0,9638 B 392 395 386 403 2,4 0,4382 C - - - - - -
Lampiran 5 Pengaruh pH terhadap nilai faktor Nernst
Nilai faktor Nernst terhadap pengaruh pH Har
i ke-
Elektrode Potensial pada konsetrasi ke- (mV) Slope r 10-4 10-3 10-2 10-1 3 A 485 476 461 417 +21,9 0,9371 B 489 486 476 467 +7,6 0,9795 C 494 483 458 449 +16,0 0,9825 4 A 378 402 395 407 8,0 0,8156 B 396 413 404 415 4,8 0,7077 C 422 426 416 413 4,7 0,8162 5 A 336 349 365 386 16,1 0,9942 B 347 363 378 389 14,1 0,9966 C 357 365 374 388 10,2 0,9907 6 A 338 350 367 386 16,1 0,9951 B 332 345 352 371 12,4 0,9840 C 348 360 365 377 9,2 0,9886 7 A 344 357 368 381 12,2 0,9994 B 309 330 340 358 15,7 0,9919 C 347 359 364 369 7,1 0,9720 8 A 322 341 360 379 19,0 1.0000 B 339 350 366 370 10,9 0,9783 C 327 336 355 364 13,0 0,9884 9 A 306 322 340 360 18,0 0,9987 B 337 343 356 367 10,3 0,9904 C 327 334 354 363 12,8 0,9823 10 A 309 324 342 362 17,7 0,9800 B 281 299 316 337 18,5 0,9954 C 283 308 317 332 15,6 0,9804 11 A 288 307 329 338 17,2 0,9751 B 279 298 316 336 18,9 0,9998 C 260 276 297 305 15,6 0,9804
Lampiran 6 Penentuan kadar magnesium dengan spektrofotometri serapan atom (SSA)
Absorbans (A) standar magnesium dengan spektrofotometri serapan atom
Konsentrasi (ppm) Absorban 0,100 0,078 0,200 0,140 0,400 0,263 0,600 0,355 0,800 0,453 y = 0.5336x + 0.0337 R = 0.9979 0 0.1 0.2 0.3 0.4 0.5 0 0.2 0.4 0.6 0.8 1 Konsentrasi standar (ppm ) Ab so rb a n
Kurva kalibrasi standar magnesium menggunakan SSA.
Penentuan kadar magnesium nutrisi hidroponik menggunakan SSA
Ulangan Absorban Kadar (% b/b) 1 0,208 1,12 2 0,208 1,12 3 0,208 1,12 Rerata 1,12 Contoh perhitungan Vcontoh : 5 10-2 L fp : 1250 persamaan y = 0,5336x + 0,0337 0,208 = 0,5336x + 0,0337 x = 0,327 % 100 ) ( × × × = contoh analisis contoh m x fp V KadarMg 100% 1 1000 8263 , 1 / 327 , 0 1250 05 . 0 × × × × = g mg g L mg L = 1,12 % (b/b)
Lampiran 7 Penentuan kadar magnesium nutrisi hidroponik dengan ESI
Kadar magnesium dengan metode ESI
Ulangan Econtoh (mV) Econtoh + satndar(mV) Kadar Mg (% b/b)
1 403 411 0,93 2 404 411 0,66 3 408 415 0,66 Rerata 0,75
V
V
V
C
V
x s E E x s s s icontoh Konsentras − × ÷ × = −10
( 2 1)/ ) [( Keterangan :Cs : konsentarsi larutan standar (1 10-1 M) Vs: volume larutan standar (5ml) Vx : volume larutan contoh (50 ml)
E1 : potensial sel setelah penambahan larutan standar E1 : potensial sel sebelum penambahan larutan standar s : kemiringan kurva kalibrasi
Contoh perhitungan: ( )
[
ml ml ml]
M ml Mg 50 5 50 1026 , 0 5 ] [10
7/7,6− + × = [Mg] = 8,99 10-4 M[ ]
% 100 × × × =m
Ar
V
contoh Mg s Mg KadarMg 100% 1644 , 0 / 31 , 24 05 , 0 10 99 , 8 4 × × × × = − g mol g L M = 0,66 % (b/b)Lampiran 8 Uji-t metode ESI dan SSA
Hipotesis
Ho = nilai kadar magnesium kedua metode sama H1 = nilai kadar magneisum kedua metode tidak sama Paired T-Test and CI: C1, C2
Paired T for C1 - C2
N Mean StDev SE Mean C1 3 1.12000 0.00000 0.00000 C2 3 0.75000 0.15588 0.09000 Difference 3 0.370000 0.155885 0.090000
95% CI for mean difference: (-0.017239, 0.757239)
T-Test of mean difference = 0 (vs not = 0): T-Value = 4.11 P-Value = 0.054