HASIL DAN PEMBAHASAN
Seleksi Isolat
Kemampuan Degradasi Bulu Ayam Utuh dan Keratin Alami
Bakteri termofilik B. licheniformis MB-2 diisolasi dari sumber air panas Gn. Tompaso-Manado, Sulawesi Utara. B. licheniformis MB-2 telah teruji memiliki kemampuan menghasilkan enzim kitinase (Toharisman et al. 2005) dan kitosanase ekstraseluler (Chasanah et al. 2006). Bacillus sp. MTS adalah bakteri mesofilik yang diisolasi dari tanah belerang di sekitar Gn. Tangkuban Perahu-Bandung, Jawa Barat. Isolat ini telah teruji menghasilkan enzim-enzim ekstraseluler yang mampu menghidrolisis berbagai substrat protein (Ariesandi 2007).
Kemampuan kedua isolat dalam menghancurkan bulu ayam utuh diuji dengan menumbuhkan kedua isolat dalam medium cair dan diinkubasi pada kondisi optimumnya. Hasil pengamatan menunjukkan bahwa Bacillus sp. MTS lebih efektif dan efisien dalam mendegradasi bulu ayam utuh dibandingkan B.
licheniformis MB-2. Pada hari keenam inkubasi, terjadi pelepasan bagian barbs
bulu dari rachis bulu, namun degradasi lengkap bulu ayam utuh oleh B.
licheniformis MB-2 terjadi pada hari ke-12. Hasil ini tidak berbeda jauh dengan
kemampuan B. licheniformis PWD-1 yang dilaporkan mampu mendegradasi bulu ayam utuh pada hari ke-10 masa inkubasi (William et al. 1999). Sementara pada
Bacillus sp. MTS degradasi lengkap bulu ayam utuh terjadi lebih cepat yaitu pada
hari keempat inkubasi (Gambar 5).
(a)
(b)
(c)
(d)
Gambar 5 Degradasi lengkap bulu ayam utuh oleh B. licheniformis MB-2 pada hari ke-0 (a) dan ke-12 inkubasi (b) dan Bacillus sp. MTS (c-d) pada hari ke-0 (c) dan ke-4 inkubasi (d).
Bila dibandingkan dengan B. licheniformis MB-2 yang menghancurkan bulu ayam utuh pada hari ke-12 inkubasi, maka kemampuan Bacillus sp. MTS jauh lebih cepat. Hal ini mengindikasikan bahwa Bacillus sp. MTS mensekresikan enzim-enzim keratinolitik ekstraseluler. Beberapa jenis basilus dilaporkan menghasilkan keratinase dan memiliki kemampuan mendegradasi bulu ayam utuh dalam waktu yang berbeda-beda. Bacillus licheniformis RG-1 menghancurkan bulu ayam utuh dalam 24 jam dengan keterlibatan keratinase ekstraseluler dan sel yang melekat pada bagian barbule bulu (Ramnani et al. 2005), sementara B. licheniformis PWD-1 menghancurkan bulu ayam utuh dalam waktu sepuluh hari (William et al. 1999) dan Bacillus sp. kr16 lima hari inkubasi (Werlang & Brandelli 2005). Kemampuan Bacillus sp. MTS ini mirip dengan
Chryseobacterium sp. yang dilaporkan dapat mendegradasi bulu ayam utuh secara lengkap pada jam ke-48 inkubasi (Riffel et al. 2003a), sementara
Stenothropomonas sp. yang menghasilkan enzim keratinase dan disulfida
reduktase ekstraseluler menghancurkan bulu ayam utuh pada hari ke-2.5 inkubasi (Yamamura et al. 2002).
Aktivitas degradasi kedua bakteri pada berbagai substrat keratin alami menyebabkan perubahan fisik dan berat. Rambut manusia merupakan keratin alami yang paling sulit didegradasi, sedangkan sisik ikan paling mudah karena menghasilkan persen susut berat terbesar (Tabel 12).
Tabel 12 Penyusutan berat berbagai keratin alami setelah diinkubasi dengan B. licheniformis MB-2 dan Bacillus sp. MTS.
Jenis keratin B. licheniformis MB-2a Bacillus sp. MTS
Bulu ayam utuh 10.95 27.1
Kokon 29.68 15.6
Benang sutera 11.65 11.7
Rambut manusia 7.50 10.1
Sisik ikan 61.30 54.1
b Susut berat (%) Susut berat (%)
Keterangan : a) inkubasi 550C selama 12 hari
b) inkubasi 370
Media yang digunakan dalam tahap ini adalah media basal yang mengandung sumber N (nitrogen) dan C (karbon) anorganik dalam jumlah terbatas, sehingga bakteri akan berusaha mengurai substrat protein alami yang
tersedia di lingkungannya. Untuk memanfaatkan nutrien yang terdapat dalam protein alami tersebut bakteri akan mensekresikan protease ekstraseluler, sehingga protein alami dapat dihidrolisis menjadi molekul sederhana dan dimanfaatkan sebagai sumber C, N, sulfur (S), dan energi.
Rambut manusia tergolong hard keratin dengan struktur α-keratin, sedangkan bulu ayam, benang sutera, dan kokon termasuk hard keratin dengan struktur β-keratin. Laju hidrolisis hard keratin berkaitan erat dengan tingkat kekerasan keratin yang berhubungan dengan kandungan asam amino sistin. Kandungan sistin dalam keratin alami dilaporkan sangat bervariasi, rambut manusia sekitar 16.8-18.4%, wool 8.0-10.9% (Wilson & Lewis 2006), bulu unggas 7%, kuku manusia 5.2%, kuku kuda 3.2%, membran telur ayam dan tanduk sapi sebesar 6.8% (Goddard & Michaelis 2008).
Rambut manusia dan benang sutera adalah keratin alam yang paling sulit dihancurkan, hal ini tampak dari rendahnya nilai susut berat keduanya (Tabel 12). Menurut Kunert (2000), kehilangan berat hard keratin setelah diinkubasi dengan mikroba umumnya tidak lebih dari 10 persen. Kehilangan berat terkecil pada penelitian ini adalah rambut manusia (7.5% dan 10.1%) dan benang sutera (11.7%). Susut berat kokon akibat aktivitas degradasi B. licheniformis MB-2 cukup besar yaitu hampir 30%. Menurut Dash et al (2006), kokon mengandung protein fibroin sebesar 72-80% dan serisin sebesar 20-28%. Protein serisin merupakan protein kokon yang larut air dan mudah dihidrolisis, tampaknya protein serisin inilah yang menyebabkan kokon banyak kehilangan berat. Susut berat bulu ayam tampak lebih besar pada Bacillus sp. MTS dibandingkan dengan
B. licheniformis MB-2. Namun demikian kedua basilus tampak memiliki
kemampuan yang sama baik dalam mendegradasi sisik ikan. Komponen utama dalam sisik ikan adalah 70% air, 27% protein, 1% lemak dan 2% abu. Sebesar 40-90% komponen organik sisik ikan adalah kolagen dengan kandungan utama glisin, prolin, alanin dan kadar sistin hanya 0.1-0.2% (Nagai et al 2004).
Perbedaan susut berat keratin alami akibat degradasi kedua basilus mengindikasikan bahwa di dalam pertumbuhannya kedua isolat menghasilkan protein/enzim dengan spesifitas berbeda. Bacillus sp. P7 yang diidolasi dari lingkungan Amazonia dilaporkan menghasilkan dua jenis protease yang mampu mendegradasi bulu ayam utuh, tepung bulu ayam dan rambut manusia (Correa
Lokasi Seluler Keratinase
Aktivitas enzim-enzim keratinolitik Bacillus sp. MTS dalam cairan ekstraseluler tampak jauh lebih tinggi dibandingkan B. licheniformis MB-2 (Gambar 6). Namun aktivitas enzim-enzim keratinolitik dalam cairan intraseluler kedua basilus tampak hampir sama. Degradasi lengkap hard keratin hanya akan terjadi jika terjadi denaturasi pada ikatan disulfidanya (Lin et al. 1992, Kunert 2000). Cairan intraseluler bakteri mengandung disulfida reduktase (thioredoxin reduktase), suatu enzim ubikuitus utama yang berperan memelihara protein thioredoxin dalam kondisi tereduksi. Thioredoxin ini sangat efisien dalam transpor elektron dan digunakan dalam mekanisme enzim penting seperti ribonukleotida reduktase yang diperlukan untuk menyediakan deoksiribonukleotida bagi sintesis DNA (Arner & Holmgren 2000).
0 5 10 15 20 25 30 35 40 45 50 intraseluler ekstraseluler sumber enzim ker at in ase ( U /m g ) MTS MB-2
Gambar 6 Perbandingan aktivitas enzim-enzim keratinolitik dalam cairan intraseluler dan ekstraseluler B. licheniformis MB-2 dengan Bacillus sp. MTS (inkubasi 48 jam).
Keberadaan thioredoxin reduktase dalam cairan intraseluler ini tampaknya mampu meningkatkan aktivitas hidrolisis enzim keratinase intraseluler. Aktivitas enzim keratinolitik ekstraseluler Bacillus sp. MTS menghasilkan nilai aktivitas lebih tinggi dibandingkan B. licheniformis MB-2, hasil ini mendukung hasil pengamatan sebelumnya yaitu kemampuan mendegradasi bulu ayam utuh yang lebih cepat dibandingkan B. licheniformis MB-2. Kedua fakta tersebut mengindikasikan adanya disulfida reduktase ekstraseluler dalam cairan ekstraseluler Bacillus sp. MTS.
Kemampuan Produksi Keratinase Kedua Bacillus sp.
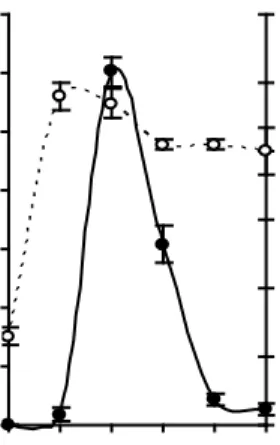
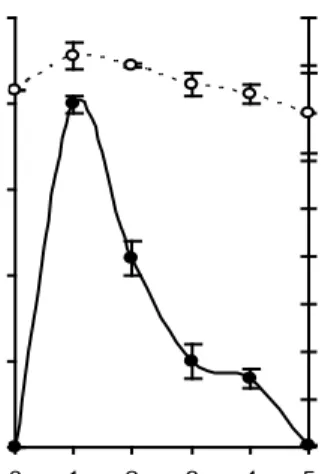
Untuk mengetahui kemampuan dan waktu optimum produksi keratinase ekstraseluler, maka kedua basilus dikulturkan dalam media produksi berisi 0.6% tepung bulu ayam. Selanjutnya kultur diinkubasi selama enam hari dan setiap hari dilakukan pengambilan cuplikan contoh untuk diukur kadar protein dan aktivitas keratinasenya. Hasil pengamatan menunjukkan bahwa aktivitas optimum keratinase B. licheniformis MB-2 ditemukan pada hari ketiga inkubasi sebesar 2.9 U/ml, sedangkan Bacillus sp. MTS hari kedua inkubasi sebesar 9.7 U/ml (Gambar 7). Keratinase beberapa bakteri dilaporkan mencapai aktivitas optimal pada jam ke-48 inkubasi yaitu Chryseobacteriumsp. (Riffel et al. 2003a),
Microbacterium sp. (Thys et al. 2004), Bacillus sp. kr16 (Werlang & Brandelli
2005). 0 2 4 6 8 10 0 1 2 3 4 5 6
w aktu inkubasi (hari)
ker at in ase ( U /m l) 0 0,01 0,02 0,03 0,04 0,05 0,06 p ro te in ( m g /m l)
0 2 4 6 8 10 12 14 0 1 2 3 4 5
w aktu inkubasi (hari)
ker at in ase ( U /m l) 0 0,01 0,02 0,03 0,04 0,05 0,06 p ro te in ( m g /m l) (a) (b)
Gambar 7 Kurva produksi keratinase ekstraseluler B. licheniformis MB-2 (a) dan Bacillus sp. MTS (b) dalam media basal
Pengaruh suplementasi sumber N dan C terhadap produksi keratinase B.
licheniformis MB-2 dan Bacillus sp. MTS diamati dengan menumbuhkan bakteri
dalam tiga jenis media yaitu media A, B, dan C (hal. 30). Aktivitas keratinase B. licheniformis MB-2 mencapai optimal pada hari ketiga inkubasi pada media A
(3.3 U/ml), media B (4.1 U/ml), dan media C (4.3 U/ml). Aktivitas keratinase tertinggi diperoleh dalam media C yang berisi garam mineral, ekstrak kamir dan tripton, serta glukosa (Gambar 8a). Aktivitas keratinase Bacillus sp. MTS mencapai optimal pada hari kedua inkubasi pada media A (7.6 U/ml), media B (10.8 U/ml), dan media C sebesar 3.5 U/ml (Gambar 8b).
0 1 2 3 4 5 6 7 8 9 10 11 0 1 2 3 4 5
w aktu inkubasi (hari)
K er at in ase ( U /m l) 0 0,01 0,02 0,03 0,04 0,05 P ro te in ( m g /m l)
0 1 2 3 4 5 6 7 8 9 10 11 0 1 2 3 4 5
waktu inkubasi (hari)
ker at in ase ( U /m l) 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 p ro te in ( m g /m l)
(a)
(b)
Gambar 8 Aktivitas keratinase ekstraseluler oleh B. licheniformis MB-2 (a) dan Bacillus sp. MTS (b) dalam berbagai media (-•- medium A -■- medium B -♦- medium C). Kadar protein (---), aktivitas keratinase (—).
Induksi substrat berperan penting dalam mekanisme pengaturan biosintesis enzim, namun biosintesis keratinase tidak secara total ditekan oleh suplementasi sumber C dan N (Ramnani & Gupta 2004, Yamamura et al. 2002b). Suplementasi 1% kasein atau 1% ekstrak kamir dilaporkan menekan produksi keratinase B. amyloliquefaciens (Cortezi et al. 2008), namun suplementasi 0.2% ekstrak kamir dapat meningkatkan produksi keratinase Stenothropomonas sp.D-1 (Yamamura et al. 2002b). Menurut Kunert (2000), penambahan sumber C dan N yang berlebihan mungkin akan memacu pertumbuhan pada fase awal, namun kondisi ini menyebabkan serangan/hidrolisis terhadap keratin melemah.
Suplementasi 0.02% tripton dan 0.02% ekstrak kamir ke dalam media produksi Bacillus sp. MTS (media B) mampu meningkatkan produksi keratinase sekitar 25% dibandingkan dalam media yang berisi garam mineral saja. Namun penambahan glukosa dalam media produksi (media C) memberikan efek yang berbeda pada kedua bakteri.
Penambahan glukosa ke dalam media B. licheniformis MB-2 tidak memengaruhi produksi keratinase (media C), hal ini mengindikasikan bahwa glukosa bukan merupakan repressor bagi sintesis keratinase. Ramnani dan Gupta (2004) melaporkan penambahan glukosa dan pepton dalam media produksi keratinase B. licheniformis RG-1 memberikan efek positif terhadap produksi keratinase. Produksi keratinase B. amyloliquefaciens dilaporkan
meningkat dengan penambahan satu persen glukosa (Cortezi et al. 2008). Hal sebaliknya terjadi pada Bacillus sp. MTS, penambahan glukosa mengakibatkan turunnya produksi keratinase hingga 70 persennya. Suplementasi glukosa sebesar satu persen merupakan inhibitor bagi sintesis keratinase pada B.
pumilis (Son et al. 2008) dan B. licheniformis (Lin et al. 2001).
Berdasarkan kemampuan mendegradasi bulu ayam utuh dan produksi keratinase ekstraselulernya, maka Bacillus sp. MTS dipilih sebagai produsen enzim keratinase untuk penelitian tahap selanjutnya.
Analisis Gen Penyandi 16S-rRNA Bacillus sp. MTS
Ciri-ciri mikroskopi Bacillus sp. MTS menunjukkan sel berbentuk batang, gram positif, dan menghasilkan spora (Ariesandi 2007). Identifikasi dilanjutkan dengan melakukan analisis sekuen gen penyandi rRNA. Molekul gen 16S-rRNA dipilih karena bersifat universal (ada di semua makhluk hidup), terdapat di ribosom yang memiliki fungsi sama di semua organisme, dan karena memiliki fungsi yang sama maka perubahan sekuennya sangat sedikit terjadi.
Hasil analisis gen penyandi 16S-rRNA dari Bacillus sp. MTS yang berhasil diamplifikasi dengan PCR menggunakan primer reverse (1385r) diperoleh 466 nukleotida (Lampiran 4). Dari jumlah tersebut, nukleotida G sebanyak 22,5%, C sebanyak 26,2%, T sebanyak 25,3%, A sebanyak 22,5%, dan tidak terdeteksi (N) sebanyak 1,3%.
Sekuen komplemen DNA penyandi 16S-rRNA dianalisis dengan program BLAST (Basic Local Allignment Search Tool) dari NCBI (National Center for
Biotechnology Information). Analisis DNA tersebut menunjukkan kemiripan
sebesar 97% dari 466 nukleotida yang overlapped (bertumpang tindih) dengan gen 16S-rRNA Bacillus YX-6 dan 96% dengan B. cereus strain AG1 (Lampiran 5). Namun ciri mikroskopi dan hasil analisis sekuen 16S-rRNA ini belum dapat digunakan untuk menentukan spesies bakteri Bacillus sp. MTS. Untuk dapat menentukan spesies dan kedudukan Bacillus sp. MTS pada pohon filogenetik diperlukan informasi ciri-ciri morfologi, fisiologi dan analisis sekuen 16S-RNA yang lebih lengkap.
Bacillus sp. dikenal sebagai bakteri kosmopolitan dan diketahui
mensekresikan sejumlah enzim-enzim hidrolitik termasuk keratinase yang mampu mendegradasi bulu ayam, bulu domba dan rambut manusia. Berbagai mikroorganisme pendegradasi keratin yang telah dilaporkan terutama dilakukan
oleh bakteri gram positif termasuk Bacillus, Lysobacter dan beberapa bakteri gram negatif yaitu Vibrio dan Xanthomonas (Gupta dan Ramnani 2006). Bacillus sp. yang dilaporkan terlibat dalam degradasi keratin bulu antara lain B. cereus (Nilegaonkar et al. 2007; Lateef et al. 2010), B. pumilis (Son et al. 2008), B.
amyloliquefaciens (Cortezi et al. 2008), dan B. licheniformis (Lin et al. 2001;
Ramnani et al. 2005).
Pemilihan media produksi disulfida reduktase Bacillus sp. MTS
Kemampuan Bacillus sp. MTS dalam menghasilkan disulfida reduktase ekstraseluler diamati dengan menumbuhkan bakteri dalam media A, B dan C. Komposisi media yang digunakan sama dengan media dalam pengujian produksi keratinase. Hasil pengamatan menunjukkan aktivitas disulfida reduktase tertinggi dihasilkan dalam media A pada hari pertama inkubasi sebesar 0.02 U/ml, disusul media C sebesar 0.009 U/ml dan media B 0.004 U/ml (Gambar 9).
0 0,005 0,01 0,015 0,02 0,025 0 1 2 3 4 5
waktu inkubasi (hari)
d isu lf id a r ed u kt ase ( U /m l) 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 p ro te in ( m g /m l)
Gambar 9 Aktivitas disulfida reduktase ekstraseluler oleh Bacillus sp. MTS dalam berbagai media (-•- medium A -■- medium B -♦- medium C). Kadar protein (---), aktivitas disulfida reduktase (—).
Di dalam media yang hanya berisi berbagai garam mineral dan tepung bulu (media A), Bacillus sp. MTS menghasilkan disulfida reduktase tertinggi pada hari pertama dan keratinase pada hari kedua inkubasi. Kondisi lingkungan terbatas (media A) memaksa sel bakteri untuk menggunakan tepung bulu ayam sebagai sumber nutrien. Degradasi lengkap bulu ayam diduga diawali oleh
hidrolisis pada ikatan disulfida yang memberi kekuatan pada struktur keratin (Kunert 2000, Yamamura et al. 2002a, Son et al. 2008). Banyaknya ikatan disulfida pada struktur keratin tampaknya menstimulasi sel untuk mensekresikan enzim disulfida reduktase sebagai proses awal membuka struktur keratin. Terbukanya struktur keratin menyebabkan keratinase lebih mudah mengakses peptida target pada molekul keratin, dan menyempurnakan proses degradasi sehingga nutrisi keratin dapat dimanfaatkan oleh sel untuk hidupnya. Didalam media B produksi keratinase dan disulfida reduktase Bacillus sp. MTS dicapai pada hari kedua inkubasi. Meski produksi keratinase dalam media B mencapai aktivitas tertinggi (10.8 U/ml) dibandingkan dalam media A (7.6 U/ml) dan C (3.5 U/ml) namun produksi disulfida reduktase media B menghasilkan aktivitas paling rendah (0.004 U/ml). Berdasar hasil pengamatan ini, maka media A dipilih sebagai media produksi keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS.
Produksi Keratinase dan Disulfida Reduktase Bacillus sp. MTS
Terakumulasinya produk-produk degradasi keratin dalam media cair menyebabkan peningkatan derajat keasaman media. Pada awal inkubasi, pH media produksi 7.5 selanjutnya pH media meningkat menjadi 8.2 dan 8.0 pada hari kedua dan ketiga inkubasi. Peningkatan pH media diiringi dengan peningkatan produksi disulfida reduktase pada hari pertama dan keratinase pada hari kedua inkubasi (Gambar 10). Alkalinisasi media merupakan salah satu faktor pendenaturasi ikatan disulfida. Namun demikian indikator terbaik terjadinya keratinolisis adalah peningkatan pH media yang merefleksikan penggunaan protein keratin, deaminasi dan produksi ammonia. Menurut Kunert (2000) semua mikroorganisme keratinolitik meningkatkan pH media menjadi sedikitnya 8.0.
Media produksi enzim mengandung garam NH4Cl dan KH2PO4, kedua garam tersebut di dalam air akan terdisosiasi membentuk ion-ion yang akan memengaruhi pH media. Berdasarkan data percobaan, kapasitas bufer media produksi enzim keratinolitik Bacillus sp. MTS berada pada kisaran pH 7.4-8.1 atau setara dengan 0.08 mmol NaOH per unit, yang berarti untuk meningkatkan nilai pH sebesar satu unit diperlukan 0.08 mmol (3.2 mg) NaOH. Nilai pH awal medium produksi adalah 7.5 dan produksi optimal kedua enzim dicapai pada pH
8.0 dan 8.2. Dengan demikian diperkirakan kapasitas bufer media tersebut mampu menjaga pH media produksi sehingga produksi keratinase tidak terganggu oleh perubahan pH akibat terbentuknya produk degradasi keratin.
0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5
waktu inkubasi (hari)
ker at in ase ( U /m l) 0 1 2 3 4 5 6 7 8 9 p H
0 0,005 0,01 0,015 0,02 0,025 0 1 2 3 4 5
waktu inkubasi (hari)
D .r ed u kt ase ( U /m l) 0 1 2 3 4 5 6 7 8 9 p H (a) (b)
Gambar 10 Aktivitas keratinase ekstraseluler (a) dan disulfida reduktase (b) serta perubahan pH media produksi enzim. Aktivitas enzim (—) dan pH (…).
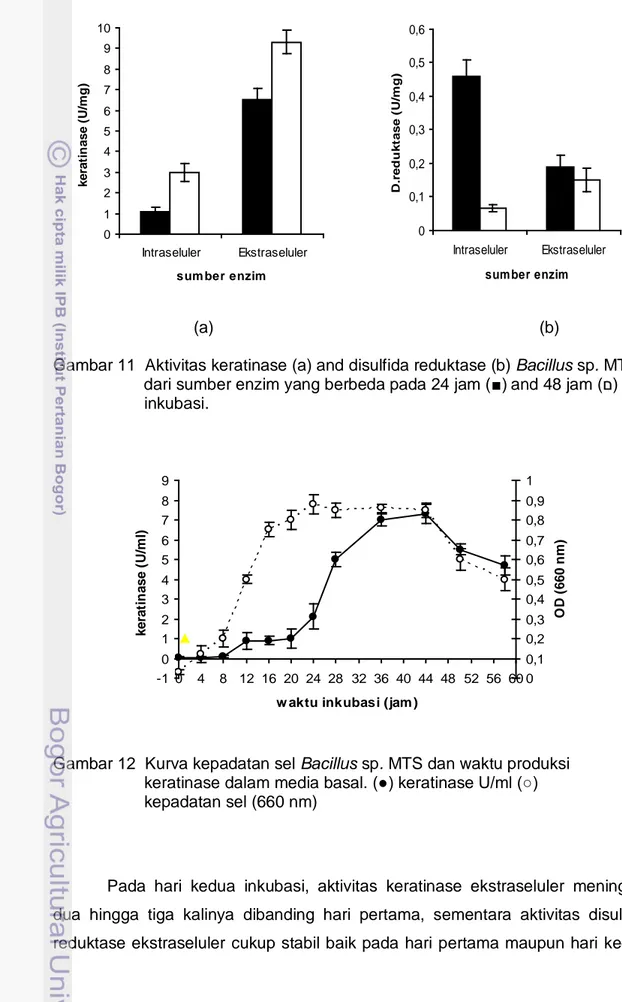
Aktivitas optimal keratinase Bacillus sp. MTS diperoleh dalam cairan ekstraseluler sebesar 9.4 U/mg pada hari kedua inkubasi (Gambar 11a), sedangkan disulfida reduktase dalam cairan intraseluler sebesar 0.46 U/mg pada hari pertama inkubasi (Gambar 11b). Kurva kepadatan sel Bacillus sp. MTS dalam media basal mengindikasikan bahwa produksi disulfida reduktase intraseluler terjadi pada awal fase stasioner sedangkan produksi keratinase ekstraseluler di akhir fase stasioner. Pada awal fase stasioner diperkirakan jumlah sel hidup masih cukup tinggi, kepadatan sel pada jam ke-24 sebesar 0,88 sedang jam ke-48 sebesar 0,58 (Gambar 12).
Cairan intraseluler adalah cairan yang diperoleh setelah melisis dinding sel bakteri dengan alat sonikator dan memisahkan cairan dari sel debris dengan sentrifugasi. Cairan intraseluler mengandung thioredoxin reduktase yang diperlukan untuk mempertahankan protein thioredoksin dalam kondisi tereduksi. Nilai kepadatan sel yang besar pada hari pertama inkubasi mengindikasikan jumlah sel yang tinggi, hal inilah yang menjadi penyebab tingginya aktivitas disulfida reduktase dalam cairan intraseluler.
0 1 2 3 4 5 6 7 8 9 10 Intraseluler Ekstraseluler
sum ber enzim
ker at in ase ( U /m g )
0 0,1 0,2 0,3 0,4 0,5 0,6 Intraseluler Ekstraseluler
sum ber enzim
D .r ed u kt ase ( U /m g ) (a) (b)
Gambar 11 Aktivitas keratinase (a) and disulfida reduktase (b) Bacillus sp. MTS dari sumber enzim yang berbeda pada 24 jam (■) and 48 jam (ם) inkubasi. -1 0 1 2 3 4 5 6 7 8 9 0 4 8 12 16 20 24 28 32 36 40 44 48 52 56 60
w aktu inkubasi (jam )
ker at in ase ( U /m l) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 O D ( 660 n m )
Gambar 12 Kurva kepadatan sel Bacillus sp. MTS dan waktu produksi keratinase dalam media basal. (●) keratinase U/ml (○)
kepadatan sel (660 nm)
Pada hari kedua inkubasi, aktivitas keratinase ekstraseluler meningkat dua hingga tiga kalinya dibanding hari pertama, sementara aktivitas disulfida reduktase ekstraseluler cukup stabil baik pada hari pertama maupun hari kedua
inkubasi (Gambar 11). Aktivitas optimum keratinase ekstraseluler dicapai pada hari ke dua inkubasi atau pada fase stasioner (Gambar 12). Fase stasioner merupakan saat terjadinya keseimbangan jumlah sel hidup dan mati, pada fase ini telah terjadi kematian sel akibat sel mengalami lisis. Cairan intraseluler akan dikeluarkan oleh sel yang mengalami lisis, adanya disulfida reduktase dan keratinase dalam cairan intraseluler tersebut membantu aktivitas keratinase ekstraseluler pada hari ke dua inkubasi. Meskipun Bacillus sp. MTS menghasilkan aktivitas disulfida reduktase intraseluler lebih tinggi dibanding ekstraselulernya, namun disulfida reduktase ekstraseluler dipilih sebagai sumber enzim dengan alasan efisiensi produksi dan novelty penelitian.
Karakterisasi Ekstrak Kasar
Penentuan Berat Molekul enzim ekstraseluler Bacillus sp. MTS
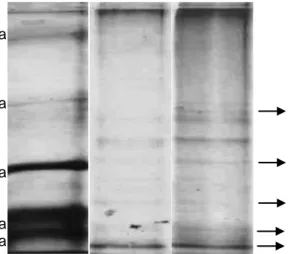
Untuk menduga berat molekul enzim-enzim keratinolitik yang terdapat dalam cairan ekstraseluler Bacillus sp. MTS, maka dilakukan elektroforesis SDS-PAGE dengan formula 4% gel penahan dan 8% gel pemisah. Cairan ekstraseluler hari kedua menghasilkan lebih banyak pita protein (11 pita) dibandingkan hari pertama inkubasi (7 pita). Hal ini mengindikasikan sel bakteri menghasilkan jumlah protein ekstraseluler lebih banyak pada hari kedua inkubasi. Terdapat satu pita yang baru muncul pada hari kedua inkubasi yaitu pita berukuran 53 kDa. Pita berukuran 25 dan 42 kDa muncul lebih tegas pada hari kedua, sedangkan pita berukuran 17 dan 29 kDa muncul jelas sejak hari pertama inkubasi (Gambar 13).
Didapatkan enam pita protein yang membentuk zona bening pada analisis zymografi yang menggunakan substrat 0.4% gelatin, yaitu pita berukuran > 97, 96, 53, 32, 25, dan 17 kDa (Gambar 14). Pita protein dihitung berdasar mobilitas relatif molekul terhadap standar protein. Zona bening terbentuk akibat molekul protein menghidrolisis gelatin pada gel pemisah, saat gel diwarnai maka zona tersebut menghasilkan warna lebih bening dibandingkan dengan daerah sekitar yang masih mengandung gelatin.
1 2 3
Gambar 13 Elektroforesis SDS-PAGE filtrat bebas sel Bacillus sp. MTS hari pertama dan kedua inkubasi. Lajur 1 Marker LMW (5 ul), 2 filtrat
bebas sel hari pertama, 3 filtrat bebas sel hari kedua. Protein sampel 0.6 μg/sumur.
1
1 2
Gambar 14 Analisis zymogram keratinase Bacillus sp. MTS. Lajur 1 Marker low
molecular weight (LMW), 2 Filtrat bebas sel yang telah diendapkan
dengan 65% (w/v) amonium sulfat dan didialisis.
Kolagen, elastin, dan keratin adalah protein serat yang banyak ditemukan di alam. Gelatin kaya akan asam amino glisin (ditemukan satu dalam tiga residu, teratur pada residu ketiga), prolin, dan hidroksiprolin, masing-masing sebesar 21.4%, 12.4%, dan 11.9%. Struktur asam amino gelatin adalah -Ala-Gly-Pro-Arg-Gly-Glu-4Hyp-Gly-Pro- (Creighton, 1993). Proporsi glisin dan prolin dalam protein keratin cukup tinggi yaitu 12% dan 10%, namun keratin lebih banyak mengandung asam amino hidrofobik dan sistein (8%) yang membentuk jembatan
53 kDa 42 kDa 29 kDa 25 kDa 17 kDa 97 kDa 66 kDa 45 kDa 30 kDa 20.1 kDa 97 kDa 66 kDa 45 kDa 30 kDa 20.1 kDa > 97 kDa 96 kDa 53 kDa 32 kDa 25 kDa 17 kDa
disulfida (Presland et al., 1989). Meski kedua protein tersebut kaya akan glisin, gelatin lebih mudah larut dibandingkan dengan keratin, sehingga untuk keperluan analisis zymografi, gelatin digunakan sebagai substrat sebesar 2% (Bressollier et
al. 1999) dan 0.1% (Friedrich & Antranikian 1996).
Bacillus sp. MTS menghasilkan enam keratinase dengan berat molekul
bervariasi dari 17 kDa hingga > 97 kDa. Berbagai mikroorganisme dilaporkan menghasilkan protease keratinolitik dengan berat molekul yang sangat beragam. Berat molekul protease keratinolitik Thermoanaerobacter keratinophilus adalah 135 kDa (Riessen & Antranikian 2001), Lysobacter adalah 148 kDa (Allpress et
al. 2002), dan Bacillus sp. adalah 134 kDa (Lee et al. 2002). Fervidobacterium islandicum AW-1 menghasilkan protease keratinolitik homomultimer dengan
berat molekul lebih dari 200 kDa (Nam et al. 2002). Beberapa bakteri dilaporkan menghasilkan protease keratinolitik berukuran kurang dari 40 kDa, yaitu
Xanthomonas maltophilia 36 kDa (Toni et al. 2002), dan B. pumilus 32 kDa
(Huang et al. 2003).
Didapatkan pita-pita protein berukuran 17-60 kDa pada analisis SDS-PAGE filtrat bebas sel Bacillus sp. MTS. Berat molekul
d
isulfida reduktase yang dihasilkan oleh bakteri pada umumnya berukuran di bawah 40 kDa.Streptomyces clavuligerus menghasilkan protein reduktan berukuran 12 kDa
(Aharonowitz et al. 1993). Thioredoksin reduktase B. acidocaldarius (Bartolucci et
al. 1997) berberat molekul 11.5 kDa dan Clostridium sticklandii 36 kDa (Harms et al. 1998). Stenotrophomonas sp. D-1 menghasilkan disulfida reduktase
ekstraseluler berukuran 15 kDa (Yamamura et al. 2002).
Penentuan Suhu Optimum & Ketahanan Panas Keratinase
Penentuan suhu optimum keratinase dilakukan dengan cara mereaksikan enzim kasar dengan substrat pada berbagai tingkatan suhu. Enzim kasar diperoleh dari filtrat bebas sel Bacillus sp. MTS. Hasilnya, aktivitas keratinase kasar mencapai optimum pada suhu 55oC sebesar 20 U/mg, selanjutnya pada suhu 65oC aktivitas keratinase menurun menjadi 19 U/mg , dan pada suhu 75oC aktivitasnya tersisa 8 U/mg (Gambar 15a). Beberapa peneliti melaporkan spesies basilus penghasil keratinase yang bekerja optimum pada suhu 55oC, yaitu keratinase Bacillus sp. kr10 (Riffel et al. 2003a), B. pumilus (Huang et al. 2003) dan Bacillus sp. strain kr16 suhu 45–65oC (Werlang & Brandelli 2005).
Keratinase Bacillus sp. MTS merupakan enzim yang labil terhadap panas. Pemanasan selama 15, 30, dan 45 menit pada suhu 55oC tidak memengaruhi aktivitasnya, namun pada suhu 70oC dan 80o
0 3 6 9 12 15 18 21 25 35 45 55 65 75 85 95
Tem peratur (oC)
K er at in ase ( U /m g )
C aktivitasnya turun tajam hingga 80%-nya (Gambar 15b).
0 0,001 0,002 0,003 0,004 0,005 0,006 0,007 0,008 10 15 20 25 30 35 40 45 50
w ak tu ink ubas i (m e nit)
K er at in ase ( U /m l) (a) (b)
Gambar 15 Pengaruh suhu terhadap aktivitas keratinase (a) dan ketahanan panas (b) keratinase kasar Bacillus sp. MTS.
●
suhu 55oC, ■ 70oC, ▲ 80oC,○
90oC).Struktur protein enzim memengaruhi aktivitas katalitiknya, aktivitas ini akan hilang bila terjadi denaturasi protein. Denaturasi adalah perubahan konformasi molekul protein dari bentuk berlipat menjadi bentuk tidak berlipat. Denaturasi mengakibatkan kehilangan aktivitas biologi, kelarutan, dan kemampuan untuk membentuk kristal, hal ini dapat disebabkan oleh kondisi pH ekstrem, suhu tinggi, dan pengaruh senyawa seperti: detergen ionik, pelarut organik, dan urea konsentrat (Ottaway & Apps 1984). Kemampuan katalitik keratinase menurun drastis pada suhu 70oC, hal ini mengindikasikan keratinase mulai mengalami denaturasi. Pada suhu 90o
Ketahanan keratinase pada berbagai suhu diamati pula dengan analisis zymogram menggunakan 0.4% gelatin. Filtrat bebas sel Bacillus sp. MTS yang telah diendapkan dan didialisis diinkubasi selama 15 menit pada suhu 55
C keratinase Bacillus sp. MTS secara total telah kehilangan seluruh aktivitasnya
oC, 70oC, 80oC, 90oC, dan 95oC sebelum dielektroforesis. Pemanasan selama 15 menit pada suhu 70oC mengakibatkan molekul enzim berukuran 17 kDa, 32 kDa,
dan 53 kDa kehilangan aktivitasnya, sementara molekul berukuran > 97 kDa dan 96 kDa masih beraktivitas yang ditunjukkan oleh munculnya pita bening. Pemanasan 80oC dan 90oC menyebabkan dua molekul berukuran > 97 kDa dan 96 kDa kehilangan aktivitasnya namun molekul berukuran 25 kDa masih mampu beraktivitas (Gambar 16).
1 2 3 4 5 6
Gambar 16 Zymogram ketahanan panas keratinase Bacillus sp. MTS. Lajur 1 Standar low molecular weight (LMW), 2 enzim diinkubasi pada suhu optimum(55oC), 3 suhu 70oC, 4 suhu 80oC, 5 suhu 90oC, 6 suhu 95oC
Penentuan pH Optimum & Ketahanan pH Keratinase
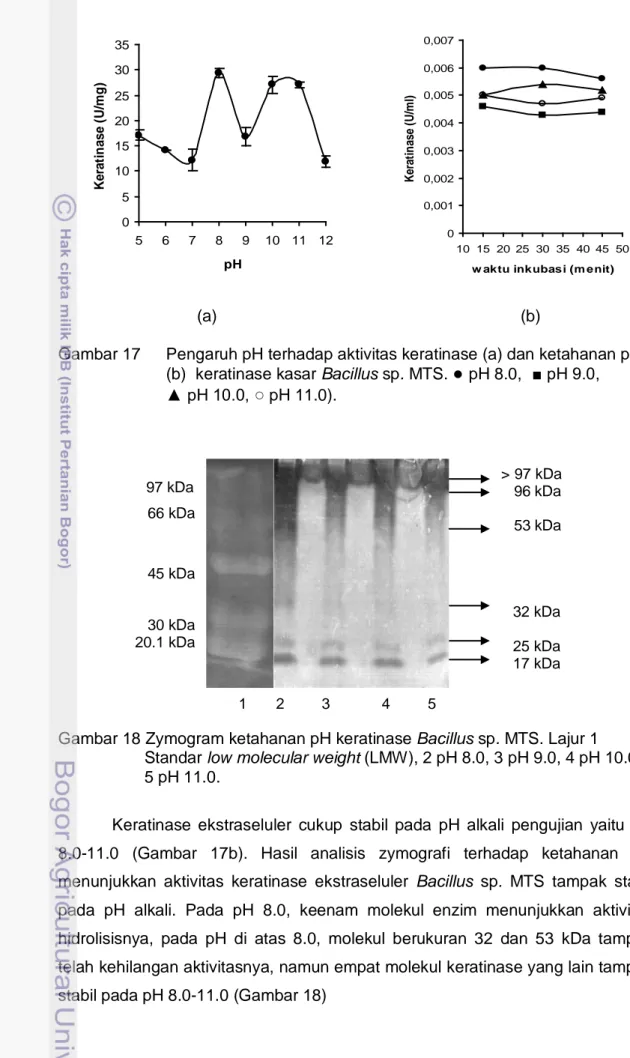
Sebagaimana telah diperlihatkan pada Gambar 10, ditemukan indikasi bahwa enzim keratinase yang disekresikan oleh Bacillus sp. MTS bersifat alkali, karena aktivitas tertinggi keratinase diperoleh pada saat medium produksi mencapai pH 8.0. Hasil penentuan pH optimum keratinase menunjukkan aktivitas tertinggi keratinase ditemukan pada kondisi alkali yaitu pH 8.0 sebesar 29 U/mg dan pH 10.0 sebesar 27 U/mg, pada pH 12.0 aktivitasnya tinggal 12 U/mg (Gambar 17a). Diperolehnya dua nilai pH optimum mengindikasikan bahwa di dalam filtrat bebas sel Bacillus sp. MTS terdapat lebih dari satu molekul keratinase. Hal ini diperkuat oleh hasil analisis zymogram yang menunjukkan terdapat enam molekul protein yang mampu menghidrolisis substrat gelatin (sebagaimana telah diperlihatkan pada Gambar 14).
> 97 kDa 96 kDa 53 kDa 32 kDa 25 kDa 17 kDa 97 kDa 66 kDa 45 kDa 30 kDa 20.1 kDa
0 5 10 15 20 25 30 35 5 6 7 8 9 10 11 12 pH K er at in ase ( U /m g ) 0 0,001 0,002 0,003 0,004 0,005 0,006 0,007 10 15 20 25 30 35 40 45 50
w ak tu ink ubas i (m e nit)
K er at in ase ( U /m l) (a) (b)
Gambar 17 Pengaruh pH terhadap aktivitas keratinase (a) dan ketahanan pH (b) keratinase kasar Bacillus sp. MTS.
●
pH 8.0, ■ pH 9.0, ▲ pH 10.0,○
pH 11.0).
1 2 3 4 5
Gambar 18 Zymogram ketahanan pH keratinase Bacillus sp. MTS. Lajur 1 Standar low molecular weight (LMW), 2 pH 8.0, 3 pH 9.0, 4 pH 10.0, 5 pH 11.0.
Keratinase ekstraseluler cukup stabil pada pH alkali pengujian yaitu pH 8.0-11.0 (Gambar 17b). Hasil analisis zymografi terhadap ketahanan pH menunjukkan aktivitas keratinase ekstraseluler Bacillus sp. MTS tampak stabil pada pH alkali. Pada pH 8.0, keenam molekul enzim menunjukkan aktivitas hidrolisisnya, pada pH di atas 8.0, molekul berukuran 32 dan 53 kDa tampak telah kehilangan aktivitasnya, namun empat molekul keratinase yang lain tampak stabil pada pH 8.0-11.0 (Gambar 18)
> 97 kDa 96 kDa 53 kDa 32 kDa 25 kDa 17 kDa
97 kDa 66 kDa 45 kDa 30 kDa 20.1 kDa
Jenis asam amino pada struktur primer enzim menentukan karakteristik enzim tersebut. Shirai et al. (1997) melaporkan strain alkalifilik Bacillus sp. penghasil protease serin yang disebut M-protease, protease ini memiliki aktivitas optimum pada pH 12.3. Mekanisme adaptasi M-protease pada kondisi alkali dianalisis dengan mengamati perubahan asam amino selama proses adaptasi dan membandingkannya terhadap protease subtilisin. Hasil analisis menunjukkan, terjadi penurunan jumlah asam amino bermuatan negatif (asam aspartat dan glutamat) dan residu lisin, serta peningkatan arginin dan asam amino netral hidrofilik (histidin, asparagin, glutamin).
Tabel 13 Kandungan asam amino arginin (R), histidin (H), asparagin (N),
glutamin (Q), aspartat (D), glutamat (E) dan lisin (K) keratinase, dan subtilisin dari beberapa spesies basilus.
Enzim Sumber Total Nisbah (%) Nisbah %) Asam Amino R, H, N, Q D, E, K Keratinase1 B.subtilis 354 11 9.4 Keratinase2 B. licheniformis 379 11 8.6 Keratinase3 B. pumilus 383 14.1 9.4 Subtilisin DY4 B. licheniformis 274 11.3 9.5 Subtilisin Carlsberg5 B. pumilus 356 14.3 12.1 Subtilisin BPN6
Keterangan nomer akses pada National Center for Biotechnology Information (NCBI) B. amyloliquefacien 382 11.8 13.3
1
ABY65723.1, 2AAY82467.1, 3ACM47735.1, 4SUBSD GI:67619, 5EDW22774.1,
6
McCaldon dan Argos meneliti jumlah dan jenis residu asam amino pada struktur primer 1021 protein dan diperoleh rerata nisbah asam amino D, E, dan K sebesar 17.2% dan R, H, N, Q sebesar 10% (Creighton 1993). Nisbah asam amino R, H, N, Q terhadap jumlah total asam amino keratinase basilus berkisar 11-14%, sedangkan nisbah asam amino D, E, K sebesar 8-9% (Tabel 13). Hal ini berarti keratinase basilus memiliki nisbah asam amino R, H, N, Q lebih besar dan nisbah asam amino D, E, K lebih kecil dari protein secara umum. Protease alkali subtilisin yang dihasilkan oleh basilus mempunyai nisbah asam amino R, H, N, Q yang mirip dengan keratinase dan enzim ini dikenal memiliki aktivitas optimal pada kisaran pH 8.0-11.0. Dengan demikian, diperkirakan asam amino R, H, N, dan Q merupakan asam-asam amino yang memelihara konformasi enzim tetap stabil pada kondisi alkali. Menurut Shirai et al. (1997), asam-asam amino H, N,
dan Q adalah asam amino dominan pada protease alkali yang bersifat polar dan tidak bermuatan pada pH alkali. Ketiga asam amino tersebut diduga membantu memelihara kelarutan protein enzim di dalam air.
Tabel 14 Stabilitas panas dan pH keratinase Bacillus sp. MTS.
Molekul suhu pH 55oC 70oC 80oC 90o > 97 kDa √ √ √ — √ √ √ √ 96 kDa √ √ — — √ √ √ √ 53 kDa √ — — — √ — — — 32 kDa √ — — — √ — — — 25 kDa √ √ √ √ √ √ √ √ C 8.0 9.0 10.0 11.0 17 kDa √ — — — √ √ √ √
Dari hasil zymogram ketahanan panas dan pH keratinase, dapat disimpulkan bahwa keratinase berukuran 25 kDa adalah molekul enzim yang paling stabil terhadap panas dan pH alkali, sementara keratinase berukuran 53 dan 32 kDa paling tidak stabil. Keratinase yang bersifat stabil pada pH alkali adalah molekul berukuran > 97, 96, 25, dan 17 kDa (Tabel 14).
Penentuan suhu & pH Optimum Disulfida Reduktase
Faktor suhu sangat memengaruhi aktivitas disulfida reduktase kasar, hal ini tampak dari aktivitasnya pada suhu 28oC dan 37oC. Aktivitas disulfida reduktase pada suhu 28oC menghasilkan nilai tertinggi (0.24 U/mg), pada suhu 37oC aktivitasnya menurun 50%, dan suhu 65oC aktivitasnya tinggal 20% (Gambar 19a). Motif pada sisi aktif Tiol disulfida oksidoreduktase adalah Cys-Xxx-Yyy-Cys dan dua residu sistein tersebut berperan dalam siklus disulfida teroksidasi dan diTiol tereduksi (Erlendsson et al 2003). Meningkatnya suhu lingkungan reaksi diduga menyebabkan autoredox residu sistein yang terdapat pada sisi aktif. Hal ini menyebabkan sisi aktif tidak dapat mengikat substrat sehingga aktivitas katalitiknya turun.
Disulfida reduktase Bacillus sp. MTS memiliki aktivitas tinggi pada kondisi alkali dan aktivitas optimum dicapai pada pH 9.0 sedang pada pH 12.0 aktivitasnya masih 70% (Gambar 19b).
0 0,05 0,1 0,15 0,2 0,25 0,3 25 35 45 55 65 75 85 95
Tem peratur (oC)
D . r ed u kt ase ( U /m g )
0 0,04 0,08 0,12 0,16 0,2 4 5 6 7 8 9 10 11 12 pH D . r ed u kt ase ( U /m g ) (a) (b)
Gambar 19 Pengaruh suhu (a) dan pH (b) terhadap aktivitas disulfida reduktase kasar Bacillus sp. MTS.
Glutation reduktase Cyanobacterium anabaena sp. memiliki pH optimum 9.0 (Serrano et al. 1984), disulfida reduktase Stenotrophomonas sp. pH 8.0–9.0 (Yamamura et al. 2002), disulfida reduktase Staphylococcus aureus sp. pH 7.5-8.0 (Cardayre et al. 1998). Sampai saat ini belum banyak informasi mengenai suhu optimum disulfida reduktase, namun berdasar metode pengujiannya, pengukuran aktivitas enzim-enzim reduktase banyak dilakukan pada suhu ruang 25oC (Serrano et al. 1984, Cardayre et al. 1998, Aharonowitz et al. 1993) dan 30oC (Yamamura et al. 2002).
Pengaruh Senyawa Pereduksi dan Urea terhadap Aktivitas Keratinase
Aktivitas keratinase ekstraseluler Bacillus sp. MTS dipengaruhi oleh senyawa pereduksi dithiothreitol (DTT) dan β-mercaptoetanol (BMT) serta urea. Penambahan DTT, BMT, dan urea pada konsentrasi 0.05 mM belum mampu meningkatkan aktivitas keratinase ekstraseluler Bacillus sp. MTS. Namun konsentrasi 0.1 mM DTT dan BMT mengakibatkan peningkatan aktivitas hampir tiga kali lipatnya bila dibandingkan kontrol. Konsentrasi optimal DTT dan BMT adalah 0.1 mM dan 0.2 mM. Penambahan 0.05 dan 0.1 mM urea memberikan efek peningkatan saat digunakan pada konsentrasi 0.2 dan 0.3 mM (Gambar 20).
0 2 4 6 8 10 12 14 0,05 0,1 0,2 0,3 Reduktan/denaturan (mM) K er at in ase ( U /m l) Kontrol DTT BMT Urea
Gambar 20 Pengaruh DTT, BMT dan urea terhadap aktivitas keratinase ekstraseluler Bacillus sp. MTS.
Keratin adalah protein struktural yang mengandung sekitar 11-12% sistein dan tidak dimiliki oleh jenis protein lain. Jembatan sistein merupakan struktur penting keratin yang menghambat kerja protease dalam memecah keratin (Lin et
al. 2001). Keratin bulu unggas tersusun dari 98 asam amino dan delapan di
antaranya adalah sistein yang berpotensi membentuk ikatan disulfida (Presland
et al. 1989). Senyawa pereduksi berfungsi memutus ikatan disulfida sedangkan
urea mendenaturasi ikatan peptida pada protein keratin, kedua senyawa tersebut menyebabkan keratin tereduksi/terdenaturasi sehingga akses keratinase untuk berikatan dengan keratin lebih terbuka sehingga proses hidrolisis keratin dapat disempurnakan.
Secara umum, keratinase yang dihasilkan oleh spesies basilus tersusun dari ratusan asam amino, namun demikian tidak ditemukan sistein (C) dalam sekuen asam aminonya (Tabel 3). Jembatan disulfida pada struktur tersier protein dibentuk oleh residu sistein yang menstabilkan konformasinya, putusnya ikatan disulfida akan mengganggu kestabilan protein (Nosoh & Sekiguchi 1991). Tidak ditemukannya residu sistein pada sekuen asam amino keratinase yang dihasilkan oleh genus basilus mengindikasikan bahwa keratinase Bacillus sp. MTS tidak memiliki residu sistein yang membentuk ikatan disulfida, sehingga diperkirakan keratinase yang dihasilkan tidak bereaksi dengan senyawa pereduksi. Hasil pengamatan menunjukkan pemakaian DTT, BMT, dan urea hingga 0.3 mM masih menghasilkan aktivitas yang lebih tinggi dibanding kontrol (Gambar 20).
Penggunaan seyawa pereduksi untuk meningkatkan aktivitas degradasi keratin telah dilaporkan oleh banyak peneliti. Senyawa pereduksi yang digunakan antara lain 2% sodium azide (Ramnani et al. 2005), 0.05% sodium azide, dan 10 mM EDTA (Bockle & Muller 1997). Konsentrasi 10 mM sodium sulfit dan DTT meningkatkan aktivitas keratinolitik Streptomyces sp. menjadi 2.7 dan 1.2 kali dibanding kontrol (Letourneau et al. 1998). Aktivitas protease keratinolitik
Stenotrophomonas sp. meningkat hampir 50 kalinya saat digunakan 1 mM DTT,
namun 1 mM BMT hanya mampu meningkatkan aktivitas sebesar dua kalinya (Yamamura et al. 2002).
Pemurnian
Pengendapan Amonium Sulfat
Proses mengendapkan protein enzim menggunakan garam adalah proses umum pada tahap awal isolasi protein, proses ini bertujuan memisahkan protein dari komponen terlarut lainnya.
0 0,002 0,004 0,006 0,008 0,01 0,012 0,014 0,016 0,018 30 40 50 60 70 80 am onium sulfat (b/v) K er at in ase ( U /m l) 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04 D .r ed u kt ase ( U /m l)
Gambar 21 Pengaruh pengendapan amonium sulfat terhadap aktivitas keratinase (■) dan disuldida reduktase (□).
Konsentrasi garam terbaik dalam mengendapkan protein keratinase dan disulfida reduktase Bacillus sp. MTS adalah 50% (b/v) atau 73% kejenuhan. Aktivitas keratinase kontrol adalah 0.005 U/ml sedangkan disulfida reduktase 0,017 U/ml. Pada konsentrasi amonium sulfat 50% (b/v) aktivitas keratinase dan
disulfida reduktase mencapai nilai optimal yaitu 0.015 U/ml dan 0.034 U/ml (Gambar 21), dengan demikian pada saat konsentrasi garam 50% (b/v) protein ekstraseluler dari Bacillus sp. MTS diperkirakan sudah mengendap (salting-out). Protein yang telah diendapkan tersebut selanjutnya didialisis dalam 50 mM bufer Tris-Cl pH 8.0 selama lebih kurang lima jam. Hal ini dilakukan untuk menghilangkan garam amonium sulfat, karena terjadi penurunan aktivitas keratinase sebesar 30% setelah protein diendapkan dengan amonium sulfat.
Berbagai jenis reduktase bakteria berhasil dimurnikan dengan perlakuan awal pengendapan amonium sulfat. Glutation reduktase Streptomyces
clavuligerus diendapkan menggunakan amonium sulfat 50-80% kejenuhan
(Aharonowits et al. 1993), Anabaena sp. Strain 7119 30% (Serrano et al. 1984),
Escherichia coli 40-80% (Scrutton et al. 1987), dan Bacillus megaterium 60-90%
(Swerdlow & Setlow 1983). Keratinase Streptomyces sp. strain 16 diendapkan dengan amonium sulfat sebesar 80% (Xie et al. 2010), keratinase
Chryseobacterium indologenes 70 % (Wang et al. 2008), keratinase Streptomyces sp. 0-50% (Tatineni et al. 2008), dan keratinase Streptomyces gulbargensis 30% dan 70% kejenuhan ( Syed et al. 2009).
Kromatografi Interaksi Hidrofobik
Kromatografi interaksi hidrofobik banyak digunakan untuk pemisahan protein dan peptida. Pada kekuatan ion yang tinggi protein terikat kuat pada matriks melalui interaksi hidrofobik. Selanjutnya protein yang terikat akan dilepaskan seiring dengan turunnya konsentrasi garam dalam larutan pengelusi. Matriks yang digunakan dalam penelitian ini adalah Butyl Sepharose 4 FF dengan bahan dasar 4% agarosa. Ligan alifatik diimobilisasikan pada matriks agarosa dengan ikatan eter, ligan tidak mengandung gugus bermuatan sehingga memungkinkan terjadinya interaksi hidrofobik tanpa efek gangguan ionik.
Profil elusi kolom Butyl Sepharose FF dari keratinase menunjukkan terdapat dua puncak protein yaitu fraksi 6-11 dan 47-56 (Gambar 22). Puncak pertama merupakan campuran protein yang tidak terikat pada matriks dalam kondisi hidrofobik, sedang puncak kedua adalah campuran protein yang terikat kuat pada matriks dan dilepaskan saat konsentrasi amonium sulfat nol persen. Hal ini mengindikasikan bahwa protein keratinase Bacillus sp. MTS mengandung banyak asam amino hidrofobik. Keratinase B. licheniformis PWD-1 yang
tergolong dalam protease serin alkali tersusun dari 379 asam amino dan sebesar 41 persennya merupakan asam amino hidrofobik (Lin et al. 1995), Fraksi 52 menghasilkan aktivitas spesifik keratinase terbesar yaitu 6.4 U/mg.
Gambar 22 Profil elusi Butyl Sepharose FF dari keratinase Bacillus sp.MTS. Aktivitas enzim (●) dan protein (○).
Pengukuran aktivitas disulfida reduktase fraksi-fraksi Butyl Sepharose menghasilkan dua puncak yaitu fraksi 26 dan 28 dengan aktivitas tertinggi ditemukan pada fraksi 28 sebesar 17.5 U/mg. Protein disulfida reduktase tampak dilepaskan dari matriks pada saat konsentrasi garam di dalam bufer mencapai 10% (b/v) (Gambar 23). 0 2 4 6 8 10 12 14 16 18 20 1 4 7 10 13 16 19 22 25 28 31 34 37 40 43 46 49 52 55 58 Nom er Fraksi (3 m l) D . R ed u kt ase ( U /m g ) 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 p ro tei n ( 280 n m )
Gambar 23 Profil elusi Butyl Sepharose FF dari disulfida reduktase Bacillus sp. MTS. Aktivitas enzim (●) dan protein (○).
0 5 10 15 20 25 30 a m o n iu m s u lf a t ( % b /v ) 0 1 2 3 4 5 6 7 1 6 11 16 21 26 31 36 41 46 51 56 nomor fraksi (3 ml) ker at in ase ( U /m g ) 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 p ro tei n ( 280 n m ) 0 5 10 15 20 25 30 a m o n iu m s u lf a t ( % b /v )
Kromatografi Gel Filtrasi
Sebanyak 6 ml larutan protein berasal dari fraksi 28 (disulfida reduktase) dan fraksi 52 (keratinase) dipekatkan menggunakan polyethylene glycol 6000 menjadi 2 ml, selanjutnya diaplikasikan ke dalam kolom berisi matriks Sephacryl S-200HR. Matriks Sephacryl S-200HR adalah matriks dengan kemampuan resolusi tinggi yang memisahkan campuran protein berdasar berat molekulnya (5-200 kDa). Hasil kromatografi kolom Sephacryl S-200HR menghasilkan enam puncak protein (Gambar 24) dengan aktivitas keratinase bervariasi dari 12 U/mg hingga 37 U/mg (Tabel 15). Dari profil elusi ini mengindikasikan terdapat enam jenis keratinase yang dihasilkan oleh Bacillus sp. MTS. Berdasar analisis zymografi yang telah diperlihatkan pada Gambar 15, diketahui bahwa dalam protein ekstraseluler Bacillus sp. MTS terdapat enam molekul protein berukuran 17, 25, 32, 53, 96, dan > 97 kDa yang mampu menghidrolisis gelatin dan menghasilkan pita bening.
0 5 10 15 20 25 30 35 40 1 7 13 19 25 31 37 43 49 55 61 67 73 79 85 91 97 nom er fraksi (3 m l) ker at in ase ( U /m g ) 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04 0,045 p ro tei n ( 280 n m )
Gambar 24 Profil elusi Sephacryl S-200HR dari keratinase Bacillus sp.MTS. Aktivitas enzim (●) dan protein (○).
Pemurnian keratinase Bacillus sp. MTS menggunakan metode pengendapan amonium sulfat, dialisis, kolom Butyl Sepharose, dan Sephacryl S-200HR tampaknya mampu meningkatkan kemurniannya. Kromatografi kolom
Butyl Sepharose meningkatkan kemurnian keratinase menjadi 72 kali, sedangkan
kolom Sephacryl S-200HR bervariasi dari 136 hingga 420 kali (Tabel 15). Hal ini menunjukkan bahwa kedua matriks tersebut efektif untuk memisahkan protein yang dihasilkan oleh Bacillus sp. MTS. Toni et al. (2002) yang memurnikan
protease keratinolitik Xanthomonas maltophilia strain POA-1 menggunakan alkyl superose dilanjutkan dengan HiTrap Q menghasilkan kemurnian dari 34 menjadi 177 kali. Beberapa peneliti melaporkan pemurnian memakai sephadex dan sephacryl, penggunaan matriks tersebut menghasilkan kemurnian lebih kecil yaitu 1.4 hingga 6 kali (Allpress et al. 2002, Thys et al. 2004, Huang et al. 2003).
Tabel 15 Pemurnian Keratinase Bacillus sp. MTS.
Total protein Total aktivitas Aktiv.sp Tingkat Perolehan
Tahap Pemurnian (mg) (Unit) (U/mg) kemurnian (%)
Ekstrak kasar 40 3,487 0,087 1 100 50% (NH4)2 SO4 0,51 0,118 0,23 2,6 3,4 Dialisis 0,56 0,115 0,21 2,4 3,3 Butyl Sepharose FF F52 0,005 33 x 10-3 6,6 72 0,95 Sephacryl S-200 HR F4 0,0006 12 x 10-3 20 216 0,3 F12 0,0021 24 x 10-3 12 136 0,7 F15 0,0015 36 x 10-3 25 284 1.0 F32 0,0015 15 x 10-3 10 119 0,4 F61 0,0006 24 x 10-3 37 420 0,7 F66 0,0006 18 x 10-3 27 307 0,5 1 2 3 4 5
Gambar 25 SDS-PAGE keratinase Bacillus sp. MTS (1 Marker protein, 2 ekstrak kasar, 3 fraksi amonium sulfat, 4 fraksi Butyl sepharose FF, 5 fraksi Sephacryl S-200HR). 116 kDa 66.2 kDa 45 kDa 35 kDa 25 kDa 18.4 kDa 14.4 kDa 53 kDa 32 kDa 17 kDa
Fraksi 61 adalah fraksi dengan aktivitas spesifik dan tingkat kemurnian keratinase tertinggi, fraksi ini selanjutnya dipilih dan digunakan untuk mempelajari keterlibatan disulfida reduktase dalam degradasi keratin alami. Hasil analisis SDS-PAGE terhadap fraksi 61 menampakkan tiga molekul protein berukuran 17, 32, dan 53 kDa (Gambar 25). Berdasarkan hasil zymogram, molekul berukuran 17, 32, dan 53 kDa adalah protein keratinase. Dengan demikian, di dalam fraksi 61 diduga terdapat lebih dari satu molekul keratinase dan hal ini diperkirakan menyebabkan fraksi 61 menghasilkan aktivitas keratinase tertinggi.
Hasil pengujian aktivitas keratinase secara kuantitatif menunjukkan bahwa fraksi-fraksi yang muncul di awal kromatografi dan diduga berisi molekul protein berukuran besar (> 97 dan 96 kDa), ternyata memiliki aktivitas lebih rendah dibandingkan dengan fraksi 61 dan 66 (Gambar 24). Namun analisis zymografi menunjukkan hasil yang berbeda, yaitu molekul protein berukuran > 97 dan 96 kDa memberikan zona bening paling tajam dibandingkan dengan molekul protein yang berukuran lebih kecil (Gambar 14). Diduga molekul berukuran > 97 dan 96 kDa diaktifkan oleh triton X-100 yang digunakan pada tahap renaturasi. Triton X-100 adalah detergen nonionik yang memiliki kemampuan menurunkan tegangan permukaan larutan, adanya triton X-100 membuat kedua molekul protein serta substrat lebih larut sehingga memudahkan keduanya untuk bereaksi. Fenomena yang sama ditunjukkan oleh protease yang dihasilkan isolat prokariot termofilik ekstrim dari Tangkuban Perahu, protease ini dilaporkan menghasilkan zona bening lebih tajam setelah direnaturasi dengan 2.5% Triton X-100 (Wahyuntari 2001). Konsentrasi 0.1% (b/v) triton X-100 juga dilaporkan meningkatkan aktivitas keratinase Chryseobacterium sp. (Riffel et al. 2003a) dan
B. Amyloliquefaciens (Cortezi et al. 2008).
Profil elusi Sephacryl S-200HR dari disulfida reduktase Bacillus sp. MTS menunjukkan terdapat tiga puncak utama yaitu fraksi bernomor 32, 65, dan 86 dengan aktivitas spesifik masing-masing 52, 59, dan 34 U/mg (Gambar 26). Fraksi 65 adalah fraksi dengan aktivitas disulfida reduktase tertinggi dan fraksi ini dipilih dan digunakan untuk mempelajari keterlibatan disulfida reduktase dalam degradasi keratin alami. Analisis SDS-PAGE menunjukkan bahwa dalam fraksi 65 ditemukan dua molekul protein berukuran 17 dan 29 kDa (Gambar 27). Dengan demikian, molekul berukuran 17 dan 29 kDa diduga merupakan protein disulfida reduktase ekstraseluler yang dihasilkan oleh Bacillus sp. MTS.
Yamamura et al. (2002) melaporkan disulfida reduktase ekstraseluler berukuran 15 kDa dihasilkan oleh Stenotrophomonas sp. sedangkan Lactobacillus
sanfranciscensis dilaporkan menghasilkan glutation reduktase ekstraseluler
berukuran 48 kDa (Jansch et al. 2007).
0 10 20 30 40 50 60 70 1 7 13 19 25 31 37 43 49 55 61 67 73 79 85 91 97 nomer fraksi (3 ml) D . r ed u kt ase ( U /m g ) 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04 0,045 p ro te in 2 8 0 n m
Gambar 26 Profil elusi Sephacryl S-200HR dari disulfida reduktase Bacillus sp. MTS. Aktivitas enzim (●) dan protein (○).
1 2 3 4 5
Gambar 27 SDS-PAGE disulfida reduktase Bacillus sp.MTS (1 Marker protein, 2 ekstrak kasar, 3 fraksi amonium sulfat, 4 fraksi Butyl Sepharose FF, 5 fraksi Sephacryl S-200HR).
Pemurnian menggunakan metode pengendapan amonium sulfat, kromatografi kolom Butyl Sepharose, dan Sephacryl S-200HR mampu
116 kDa 66.2 kDa 45 kDa 35 kDa 25 kDa 18.4 kDa 14.4 kDa 29 kDa 17 kDa
meningkatkan kemurnian disulfida reduktase. Matriks Butyl Sepharose meningkatkan kemurnian reduktase menjadi 38 kalinya, sedangkan Sephacryl S-200HR 76, 139 dan 65 kali (Tabel 16). Octyl sepharose digunakan oleh Swerdlow dan Setlow (1983) untuk memurnikan disulfida reduktase Bacillus
megaterium dan menghasilkan kemurnian 1290 kali. NADPH-dependent disulfida
reduktase Anabaena sp. Strain 7119 yang dimurnikan menggunakan Sephacryl S-300 mempunyai tingkat kemurnian 5795 kali (Serrano et al.1984).
Tabel 16 Pemurnian Disulfida reduktase Bacillus sp. MTS.
Total protein Total aktivitas Aktiv.sp Tingkat Perolehan
Tahap (mg) (Unit) (U/mg) kemurnian (%)
Ekstrak kasar 40 18,4 0,46 1 100 Fraksi 50% (NH4)2 SO4 0,51 0,17 0,33 0,7 0,9 Dialisis 0,56 0,13 0,23 0,5 0,7 Butyl Sepharose FF F28 0,005 0,087 17.5 38 0.5 Sephacryl S-200 HR F32 0.0015 0,052 35 76 0.3 F65 0.0006 0,041 64 139 0.2 F86 0.0022 0,067 30 65 0.4
Zymogram fraksi amonium sulfat menunjukkan bahwa Bacillus sp.MTS menghasilkan enam jenis keratinase ekstraseluler berukuran > 97, 96, 53, 32, 25, dan 17 kDa, namun pada analisis SDS-PAGE hanya ditemukan pita-pita protein berukuran dibawah 60 kDa. Dua pita besar berukuran > 97 dan 96 kDa tidak tampak pada semua fraksi (Tabel 18).
Prosedur analisis SDS-PAGE menggunakan pereaksi SDS dan β-merkaptoetanol serta perlakuan pemanasan. SDS adalah senyawa detergen ionik yang akan mendenaturasi protein sekunder dan ikatan nondisulfida struktur tersier serta memberi muatan negatif pada protein. Senyawa β-merkaptoetanol berfungsi mereduksi ikatan disulfida yang terdapat pada molekul protein. Perlakuan pemanasan dan penggunaan kedua senyawa tersebut mengakibatkan protein berukuran > 97 dan 96 kDa terfragmentasi menjadi beberapa protein berukuran lebih kecil sehingga kedua protein tersebut tidak muncul pada gel SDS-PAGE. Namun hasil analisis native-PAGE menampakkan kedua molekul protein berukuran > 97 dan 96 kDa (Gambar 28). Menurut Branden dan Tooze
Tabel 17 Perkiraan berat molekul pita-pita protein Bacillus sp. MTS dari sumber enzim yang berbeda
Sumber enzim Berat Molekul (kDa)
Filtrat bebas sel hari pertama 48, 45,41, 32, 29 27, 25, 17 Filtrat bebas sel hari kedua 61, 56, 53, 48, 45,41, 35, 32, 29, 27, 25, 17 50% amonium sulfat (b/v) 61, 56, 53, 48 35, 32, 29, 25, 23, 20, 17 Fraks 28 Butyl Sepharose 53, 32, 29, 25, 23, 20, 17 Fraksi 65 Sephacryl S-200HR 29 17 Fraksi 52 Butyl Sepharose 32 25, 23, 17 Fraksi 61 Sephacryl S-200HR 53, 32 17 Zymogram > 97, 96 53 32 25 17
(1999), protein dengan berat molekul besar mungkin memiliki struktur multidomain atau oligomer yang berkaitan dengan spesifisitas substratnya.
1 2
Gambar 28 Native-PAGE fraksi dialisis enzim ekstraselule Bacillus sp.MTS (1 Marker protein, 2 fraksi dialisis ).
Bacillus sp. MTS menghasilkan enam jenis keratinase, hasil ini mirip dengan keratinase yang diproduksi oleh Streptomyces strain 16. Isolat tersebut dilaporkan menghasilkan empat keratinase berukuran 50, 34, 25, dan 19 kDa; keempat keratinase aktif pada pH alkali (pH 8.0-10.0) dan memiliki aktivitas optimum pada pH 9.0 dan suhu 50o
Penentuan Suhu & pH Optimum Keratinase dan Disulfida Reduktase Murni C. Keratinase berukuran 25 kDa merupakan homo-oktamer dengan total berat molekul sebesar 203.2 kDa, keratinase 50 kDa homodimer sedangkan keratinase berukuran 34 dan 19 kDa monomer (Xie et al. 2010).
Penentuan suhu dan pH optimum keratinase dan disulfida reduktase dilakukan terhadap empat fraksi aktif gel filtrasi. Enzim keratinase murni mempunyai karakteristik suhu dan pH yang berbeda bila dibandingkan dengan keratinase kasarnya, namun secara umum keratinase dan disulfida reduktase murni bersifat aktif pada kondisi alkali (Tabel 18).
Tahapan pemurnian idealnya dapat menghilangkan protein kontaminan dan substansi lain yang menyebabkan enzim terganggu aktivitas katalitiknya. Molekul efektor (inhibitor/aktivator) biasanya berukuran lebih kecil dibanding
> 116 kDa 96 kDa 53 kDa 32 kDa 25 kDa 17 kDa 116 kD 66.2 kD 45 kD 35 kD 25 kD 18.4 kD 14.4 kD
molekul enzim sehingga dapat berikatan kuat dengan enzim, dan melalui tahapan pemurnian diharapkan molekul inhibitor dapat dihilangkan (Cornish-Bowden & Cardenas 1987). Hilangnya berbagai protein kontaminan, garam amonium sulfat atau substansi lain selama proses pemurnian membuat keratinase murni menampilkan karakteristik yang berbeda bila dibandingkan keratinase kasarnya. Protein kontaminan dan substansi lain dapat berikatan dengan rantai samping asam amino enzim dan memengaruhi konformasi enzim sehingga menghambat interaksi enzim dengan substrat.
Tabel 18 Suhu dan pH optimal keratinase dan disulfida reduktase (DR) fraksi amonium sulfat (50% b/v) dan fraksi gel filtrasi.
Fraksi Keratinase Keratinase Fraksi DR DR pH Suhu (oC) pH Suhu (o
C)
50% am sulfat 8.0 & 10.0 55 50% am sulfat 9.0 28 F4 9.0-12.0 40 & 80 F32 9.0 35 F15 9.0 & 11.0 70 F65 10.0 35 F61 8.0 & 12.0 50 & 70 F86 8.0 & 10.0 35 F66 10.0 50 0 0,5 1 1,5 2 2,5 30 40 50 60 70 80 90 100 Suhu (o C) ker at in ase ( U /m g ) F4 F15 F61 F66
0 0,5 1 1,5 2 2,5 3 7 8 9 10 11 12 pH K er at in ase ( U /m g ) F4 F15 F61 F66 (a) (b)
Gambar 29 Pengaruh suhu (a) dan pH (b) terhadap aktivitas keratinase fraksi murni.
Ditemukan dua nilai suhu optimum untuk keratinase fraksi 4 yaitu pada suhu 40oC dan 80oC, demikian halnya keratinase fraksi 61 yaitu suhu 50oC dan 70oC. Keratinase fraksi 66 menghasilkan aktivitas tertinggi dibanding fraksi-fraksi
yang lain yaitu 2,4 U/mg pada suhu 50o 0 3 6 9 12 15 18 21 25 30 35 40 Suhu (oC) D . r ed u kt ase ( U /m g ) F32 F86 F65
C (Gambar 29a). Keempat fraksi aktif keratinase murni tampak memiliki aktivitas optimum pada pH alkali. Keratinase fraksi 15 dan 61 mempunyai dua nilai pH optimum untuk aktivitasnya yaitu pH 9.0 & 11.0 serta pH 8.0 & 12.0. pH optimum aktivitas keratinase fraksi 66 adalah pH 10.0 sedangkan keratinase fraksi 4 mempunyai pH optimum cukup luas yaitu pH 9.0-12.0 (Gambar 29b). Ditemukannya dua nilai pH dan suhu optimum pada beberapa fraksi mengindikasikan fraksi-fraksi tersebut mengandung lebih dari satu molekul keratinase.
0 2 4 6 8 10 12 14 16 7 8 9 10 11 12 pH D . r ed u kt ase ( U /m g ) F32 F86 F65 (a) (b)
Gambar 30 Pengaruh suhu (a) dan pH (b) terhadap aktivitas disulfida reduktase murni.
Diperoleh tiga fraksi aktif disulfida reduktase murni, yaitu fraksi 32, 65, dan 86. Ketiga fraksi disulfida reduktase murni memiliki pH dan suhu optimum yang berbeda dengan enzim kasarnya (fraksi amonium sulfat). Perubahan aktivitas reduktase dapat terjadi karena setelah dimurnikan enzim terbebas dari berbagai senyawa kontaminan dan garam. Suhu optimum bagi aktivitas ketiga fraksi murni reduktase berubah dari 28oC menjadi 35oC dengan aktivitas tertinggi adalah fraksi 65 sebesar 20 U/mg (Gambar 30a). pH optimum aktivitas reduktase fraksi 32 adalah pada pH 9.0 sedangkan fraksi 65 dan fraksi 86 adalah pH 10.0 (Gambar 30b).
Fraksi hasil kolom Sephacryl S-200HR yang memiliki aktivitas keratinase dan disulfida reduktase tertinggi (fraksi 61 dan 65) digunakan pada pengujian substrat keratin yaitu tepung bulu ayam hasil prehidrolisis NaOH, tepung bulu ayam alami, dan tepung bulu domba alami. Aktivitas keratinase murni sebesar 0.008 U/ml dan kadar protein 0.2 μg/ml, sedangkan disulfida reduktase murni 0.014 U/ml dan kadar protein 0.2 μg/ml. Sebagai kontrol positif digunakan proteinase K dengan aktivitas 0.102 U/ml dan kadar protein 5 μg/ml.
Penambahan disulfida reduktase ke dalam campuran reaksi yang berisi tepung bulu ayam prehidrolisis NaOH mampu meningkatkan aktivitas keratinase murni Bacillus sp. MTS menjadi dua kali lipat dibandingkan dengan bila keratinase bekerja sendiri (Tabel 19). Aktivitas tersebut sebanding dengan aktivitas yang dihasilkan dari reaksi antara keratinase dengan 0.1 mM DTT. Namun pada proteinase K, penambahan disulfida reduktase (DR), senyawa pereduksi dan urea menurunkan aktivitas katalitiknya. Proteinase K adalah endopeptidase ekstraseluler yang disintesis oleh fungi Tritirachium album Limber, enzim ini tersusun dari 277 residu asam amino dengan dua ikatan disulfida yang terbentuk dari residu sistein pada urutan 34 dengan 124 dan 179 dengan 248 (Jany et al. 1986). Disulfida reduktase Bacillus sp. MTS dan senyawa pereduksi diperkirakan bereaksi dengan ikatan disulfida pada molekul proteinase K sehingga membuka struktur proteinase K. Perubahan tersebut menyebabkan konformasi enzim berubah dan menghambat substrat berikatan dengan sisi aktif enzim, hal ini mengakibatkan aktivitas katalitiknya turun.
Tabel 19 Perbandingan aktivitas keratinolitik Proteinase-K dengan keratinase Bacillus sp.MTS pada 1% tepung bulu ayam prehidrolisis NaOH dengan dan tanpa penambahan disulfida reduktase (DR), senyawa pereduksi dan urea.
Sumber enzim Ekstrak DR** Ker* Keratinase**
kasar murni +DR* +DTT1 +BMT2 +Urea U/mg 3 Bacillus sp.MTS 0.4 0.9 5.0 10.9 9.8 5.6 2.0 Proteinase-K 1.6 1.2 1.5 0.7 0.5 Keterangan 1
20 μl dithiotreitol 0.1 mM; 2 40 μl β-merkaptoetanol 0.2 mM; 3 60 μl urea 0.3 mM
*
keratinase murni ** disulfida reduktase murni
Preinkubasi DR, DTT, BMT, urea: 35oC-10’. Inkubasi keratinase 50oC-60’, dan proteinase K 37oC-60’.
Saat direaksikan dengan bulu ayam alami, aktivitas keratinase Bacillus sp.MTS ditingkatkan oleh DR menjadi lebih dari lima kalinya (Tabel 20), sedangkan pada bulu domba alami aktivitas keratinase meningkat tiga kali lipat (Tabel 21). Aktivitas keratinase pada bulu ayam dan domba alami tersebut lebih tinggi dibandingkan dengan aktivitas pada bulu ayam prehidrolisis NaOH, hal ini diduga karena adanya garam NaCl yang terdapat dalam larutan substrat. Garam NaCl terbentuk karena substrat tepung bulu yang digunakan diperoleh setelah direaksikan dengan NaOH dan dinetralkan dengan HCl. Menurut Cornish-Bowden dan Cardenas (1987), ion-ion inorganik dapat berikatan dengan ion rantai samping protein atau berinteraksi dengan sisi aktif, interaksi ini mungkin tidak memengaruhi strukturnya namun keadaan ini dapat mempermudah/mempersulit molekul substrat untuk berada atau berikatan dengan sisi aktif enzim. Dalam penelitian ini adanya garam NaCl dalam larutan substrat bulu ayam prehidrolisis menurunkan aktivitas katalitik keratinase.
Tabel 20 Perbandingan aktivitas keratinolitik Proteinase-K dengan keratinase
Bacillus sp.MTS pada 1% tepung bulu ayam alami dengan dan tanpa
penambahan disulfida reduktase (DR), senyawa pereduksi dan urea. Sumber enzim Ekstrak DR** Ker* Keratinase*
kasar murni +DR** +DTT1 +BMT2 +Urea U/mg 3 . Bacillus sp.MTS 0.1 1.3 4.5 27.5 12.8 10.8 4.6 Proteinase-K 0.5 0.6 0.7 0.5 0.0 Keterangan 1
20 μl dithiotreitol 0.1 mM; 2 40 μl β-merkaptoetanol 0.2 mM; 3 60 μl urea 0.3 mM
*
keratinase murni ** disulfida reduktase murni
Preinkubasi DR, DTT, BMT, urea: 35oC-10’. Inkubasi keratinase 50oC-60’ dan proteinase K 37o
Aktivitas keratinolitik Proteinase-K pada ketiga jenis keratin tersebut lebih rendah dibandingkan keratinase Bacillus sp. MTS. Proteinase K adalah endoprotease serin yang berasal dari fungi Tritirachium album. Enzim ini memiliki spesifisitas substrat yang luas termasuk mampu menghidrolisis keratin rambut, aktif dalam 1% Triton X-100 dan 0.5% SDS, serta dapat terdenaturasi oleh urea (Rao et al. 1998). Tampaknya penambahan DR tidak memengaruhi aktivitas proteinase K, bahkan penggunaan 0.3 mM urea mengakibatkan protease ini
kehilangan kemampuan katalitiknya. Menurut Sumathi dan Dasgupta (2006), beberapa denaturan seperti urea dan sodium dodecylsulphate (SDS) dapat memengaruhi struktur dan aktivitas enzim. Denaturan akan membuka lipatan protein dengan cara bermigrasi ke daerah interior molekul protein dan membentuk ikatan hidrogen pada tulang punggung protein atau rantai sampingnya. Penggunaan 0.3 mM urea dalam penelitian ini tampaknya telah mendenaturasi proteinase K sehingga kehilangan aktivitasnya.
Tabel 21 Perbandingan aktivitas keratinolitik Proteinase-K dengan keratinase
Bacillus sp.MTS pada 1% tepung bulu domba alami dengan dan tanpa penambahan disulfida reduktase (DR), senyawa pereduksi dan
urea.
Sumber enzim Ekstrak DR** Ker* Keratinase*
kasar murni +DR** +DTT1 +BMT2 +Urea U/mg 3 Bacillus sp.MTS 0.09 0.5 8.7 24.3 11.0 8.5 7.9 Proteinase-K 0.5 0.5 0.5 0.3 0.0 Keterangan 1
20 μl dithiotreitol 0.1 mM; 2 40 μl β-merkaptoetanol 0.2 mM; 3 60 μl urea 0.3 mM
*
keratinase murni ** disulfida reduktase murni
Preinkubasi DR, DTT, BMT, urea: 35oC-10’. Keratinase 50oC-60’, proteinase K 37o
Aktivitas keratinase dan disulfida reduktase pada bulu ayam prehidrolisis NaOH lebih rendah bila dibandingkan dengan bulu ayam dan domba alami. Hal ini berarti keratinase dan reduktase Bacillus sp. MTS akan memberi hasil lebih
C-60’
Beberapa hasil penelitian melaporkan keterlibatan faktor pereduksi ikatan disulfida pada mikroorganisme pengguna keratin. Stenotrophomonas sp. menghasilkan dua jenis protein yaitu protease serin dan protein pereduksi ikatan disulfida yang dapat mendegradasi keratin. Setelah kedua enzim dicampurkan, aktivitas keratinolitik meningkat drastis (lebih dari 50 kali) dibandingkan bila hanya protease saja yang bekerja (Yamamura et al. 2002). Ramnani et al. (2005) melaporkan bahwa aktivitas keratinolitik B. licheniformis RG-1 meningkat sinergis dengan penambahan disulfida reduktase intraseluler. Hasil penelitian ini semakin memperkuat hasil-hasil penelitian sebelumnya bahwa afinitas keratinase semakin tinggi bila substrat keratin telah direduksi sebelumnya baik oleh senyawa pereduksi maupun enzim disulfida reduktase.
baik bila diaplikasikan pada keratin bulu alami (tanpa melalui proses prehidrolisis dengan NaOH). Bahkan hasil penelitian ini menunjukkan disulfida reduktase
Bacillus sp. MTS lebih potensial dibandingkan penggunaan senyawa pereduksi
dan pendenaturasi. Hal ini memunculkan peluang bagi penggunaan enzim disulfida reduktase di bidang pangan, khususnya untuk tujuan aplikasi yang aman dan ramah lingkungan.
Tabel 22 Aktivitas keratinase kasar Bacillus sp. MTS pada 1% tepung bulu ayam prehidrolisis NaOH dengan dan tanpa penambahan senyawa pereduksi dan denaturan.
Sumber enzim Keratinase kasar
0 +DTT1 +BMT2 +Urea U/mg 3 . Bacillus sp.MTS 0.1 0.35 0.27 0.16 Proteinase-K 1.6 1.5 0.7 0.5 Keterangan 1
20 μl dithiotreitol 0.1 mM; 2 40 μl β-merkaptoetanol 0.2 mM; 3 60 μl urea 0.3 mM
Preinkubasi DR, DTT, BMT, urea: 35oC-10’. Inkubasi keratinase 50oC-60’ dan proteinase K 37o
Sumber enzim Enzim keratinase murni C-60’
Tabel 23 Aktivitas enzim murni Bacillus sp. MTS pada 1% tepung bulu ayam hasil hidrolisis NaOH dengan dan tanpa penambahan disulfida reduktase (DR), senyawa pereduksi, dan denaturan.
0 +DR* +DTT1 +BMT2 +Urea U/mg 3 . Bacillus sp.MTS 5 10.9 9.8 5.6 2.0 Proteinase-K 1.6 1.2 1.5 0.7 0.5 Keterangan
*DR disulfida reduktase murni
1
20 μl dithiotreitol 0.1 mM; 2 40 μl β-merkaptoetanol 0.2 mM; 3 60 μl urea 0.3 mM
Preinkubasi DR, DTT, BMT, urea: 35oC-10’. Inkubasi keratinase 50oC-60’ dan proteinase K 37o
Aktivitas keratinase kasar Bacillus sp. MTS pada bulu ayam prehidrolisis NaOH adalah 0.1 U/mg dan pengunaan DTT dan BMT maupun urea tampak