Bab IV Hasil dan Pembahasan
IV.1 Kultur Tanaman Jarak dan Pengambilan Cairan Floem
Pada tahap uji pendahuluan penelitian, dilakukan kultur tanaman dengan menggunakan metode aeroponik. Keunggulan kultur ini adalah terkontrolnya kuantitas unsur hara yang diberikan kepada tanaman dan penyerapan unsur hara tersebut lebih maksimal karena larutan nutrisi disemprotkan secara kontinyu ke akar tanaman yang tergantung. Namun karena kebutuhan sampel yang relatif besar (sekitar 40 - 50 pohon untuk sekali panen) sedangkan alat aeroponik yang ada hanya cukup untuk 12 pohon, maka kemudian dilakukan kultur pot dengan tanah. Tanah yang digunakan adalah tanah yang terkontrol kualitasnya sehingga secara statistik dianggap tidak berbeda secara signifikan kandungan unsur hara yang terkandung.
Untuk mendapatkan sampel cairan floem yang maksimal, pada tahap uji pendahuluan, dilakukan berbagai variasi pengambilan sampel. Variasi yang dilakukan adalah umur tanaman, waktu pengambilan, lama pengambilan, tempat pengambilan, dan proses pengambilan cairan floem. Optimasi pengambilan dilakukan hanya pada tanaman dengan kultur pot dengan tanah.
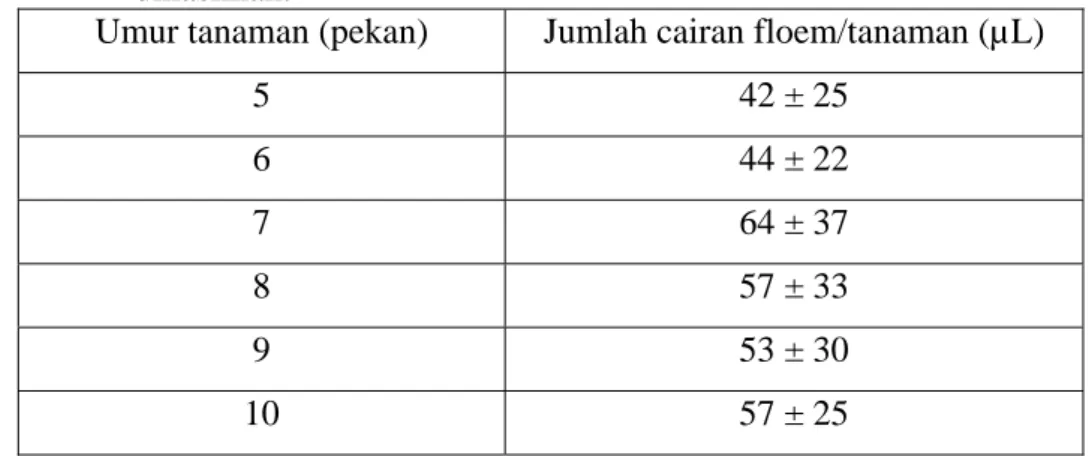
Pada Tabel IV. 1 dapat dilihat pengaruh umur tanaman terhadap volume sampel yang diperoleh per tanaman. Tanaman dengan umur 5 hingga 6 pekan masih relatif muda sehingga sulit untuk mendapatkan cairan floem dalam jumlah banyak. Hal ini kemungkinan disebabkan kanal floem masih relatif muda sehingga irisan pada kanal yang kurang hati-hati, dapat sampai menembus lapisan xilem. Pada tanaman dengan umur 7 – 8 pekan mulai dapat teridentifikasi dengan baik sehingga dapat diperoleh sampel dengan jumlah relatif lebih banyak.
Pada umur 9-10 pekan tidak ada pertambahan jumlah sampel yang signifikan dibandingkan dengan pada umur 7-8 pekan. Dengan demikian umur panen tanaman jarak yang optimal adalah 7-8 pekan.
Tabel IV. 1 Pengaruh umur tanaman terhadap volume cairan sampel yang dihasilkan.
Umur tanaman (pekan) Jumlah cairan floem/tanaman (µL)
5 42 ± 25 6 44 ± 22 7 64 ± 37 8 57 ± 33 9 53 ± 30 10 57 ± 25
Hal yang perlu dicermati adalah tingginya standar deviasi cairan yang dihasilkan untuk setiap tanaman. Dalam beberapa kasus terkadang satu tanaman hanya mengeluarkan sekali cairannya setelah itu laju eksudasi berkurang drastis, atau dengan kata lain tidak ada lagi cairan yang keluar. Hal ini disebabkan karena terbentuknya callose atau filamen protein yang menutup pori kanal floem yang dikenal sebagai hipotesis ´ blocked pore ` (Milburn, 1970). Sehingga ada tanaman yang hanya menghasilkan sekitar 20 µL cairan floem, namun ada juga yang dapat sampai 100 µL per tanaman.
Pengambilan cairan floem dilakukan pada saat proses transpirasi berlangsung. Berdasarkan pengamatan yang dilakukan, waktu optimal pengambilan adalah pukul 8 – pukul 12 siang hari. Lama pengambilan umumnya 2 jam untuk setiap tanaman. Untuk menghindari kontaminasi dan perubahan komposisi cairan floem, tanaman hanya digunakan hanya untuk sekali pengambilan.
Pengambilan cairan floem dilakukan di ruang pengambilan sampel dalam rumah kaca. Pernah dilakukan pengambilan cairan floem dalam laboratorium higienis dengan tujuan untuk meminimalisasi kemungkinan kontaminasi, namun cairan floem yang tereksudasi sangat sedikit. Hal ini kemungkinan disebabkan kondisi laboratorium higenis menimbulkan stress pada tanaman. Kemungkinan lain
adalah rendahnya laju transpirasi dalam laboratorium higenis sehingga aliran air dalam floem menurun. Pomper dan Grusak (2004) telah melakukan penelitian tentang total Ca dalam cairan xilem snap bean. Hasil penelitiannya menunjukkan kandungan Ca dalam tanaman lebih tinggi jika pengambilan xilem dilakukan dalam rumah kaca dibandingkan dalam ruang pertumbuhan (growth chamber). Hal ini disebabkan laju transpirasi tanaman dalam ruang pertumbuhan lebih besar dibandingkan dalam rumah kaca. Laju transpirasi yang tinggi menyebabkan penyerapan air yang tinggi sehingga menurunkan kadar Ca dalam xilem.
Proses pengambilan cairan floem merupakan salah satu langkah yang penting, karena diperlukan keahlian tertentu agar diperoleh sampel yang banyak. Selain itu, diperlukan teknik khusus untuk menjaga sampel dari kontaminan dan terjadinya perubahan komposisi misalnya akibat pengaruh suhu ruang. Beberapa peneliti sebelumnya (Milburn, 1970; Wiersum, 1979) mengambil cairan floem seperti teknik mengambil getah karet. Pipa kapiler dilekatkan pada irisan kanal floem yang diletakkan secara horisontal. Sehingga adanya tegangan permukaan cairan dalam kapiler dapat menarik cairan floem dari kanal floem menuju pipa kapiler. Ujung lain pipa kapiler dimasukkan dalam bejana untuk menampung cairan floem. Bejana tersebut terbuka dan pengambilan cairan floem berlangsung pada suhu kamar selama beberapa jam. Teknik ini tidak dilakukan karena waktu pengambilan selama 2 jam pada suhu 25-30 °C dapat menyebabkan perubahan komposisi cairan floem dan rentan kontaminasi karena bejana penampungan dalam posisi terbuka. Oleh karena itu, cairan floem dibiarkan alami tereksudasi setelah pengirisan kanal floem, lalu diambil dengan menggunakan pipet mikro Eppendorf 20 µL dan langsung dimasukkan dalam tabung polipropilen 1,5 mL yang diletakkan pada permukaan atas termos berisi nitrogen cair. Dengan cara ini cairan floem yang diperoleh langsung terbekukan pada suhu -80 °C. Sehingga kemungkinan kontaminan dari udara luar dan perubahan komposisi dapat diminimalkan. Konsekuensinya, waktu pengambilan sampel berlangsung lebih lama karena setiap tetes cairan floem yang keluar langsung dibekukan.
IV.2 Optimasi Alat ICP-QMS
Selama periode Oktober 2002 sampai dengan Juli 2005 telah dilakukan analisis pendeteksian selektif unsur Mg, Ca, Mn, Zn, Mo dan Cd dalam cairan ploem maupun dalam fraksi SEC dan PNC PAGE dengan menggunakan ICP-QMS sebanyak 113 kali. Setiap memulai suatu proses pendeteksian ICP-QMS diberi nomor analisis sehingga total nomor analisis adalah 113. Setiap hari pendeteksian dilakukan optimasi harian untuk mengecek kondisi alat, seperti yang telah dipaparkan pada Tabel III.4 tentang kriteria standar kondisi operasional ICP-QMS yang harus dipenuhi sebelum analisis sampel dilakukan. Jika kriteria tersebut tidak terpenuhi maka dilakukan pengecekan alat dan optimasi lengkap. Pengecekan alat meliputi kondisi pompa peristaltik, suhu pendingin, maupun kebersihan skimmer cone dan cone sampel. Jika sampel banyak mengandung senyawa organik, kedua cone akan cepat kotor karena endapan karbon pada cone. Hal ini sangat nampak pada sampel dengan matriks buffer MES. Umumnya setelah dua-tiga kali running sampel dengan matriks tersebut, kedua cone harus dibersihkan.
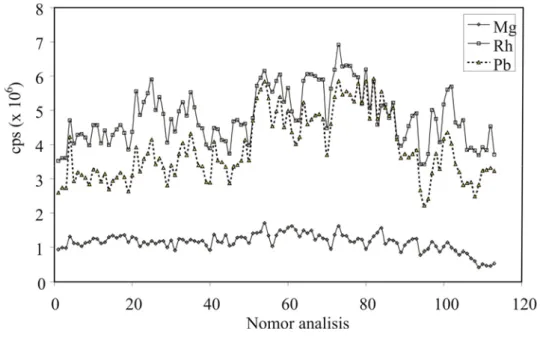
Pada Gambar IV. 1 ditampilkan data hasil optimasi harian alat berdasarkan sensitivitas Mg, Rh dan Pb dengan konsentrasi 10 µg/L. Secara umum, sensitivitas alat terhadap Mg, Rh, dan Pb sangat baik terlihat dari jumlah cacah perdetik (count per second, cps) yang jauh melebihi standar yang diharuskan (Tabel III.3). Sebagai contoh 24Mg, 94 % sensitivitas berada pada level di atas 90.000 cps dan hanya sekitar 6 % yang berada pada ambang batas syarat 40.000 cps. Demikian juga dengan sensitivitas terhadap Rh dan Pb. Batas minimal cacah perdetik untuk Rh dan Pb adalah 200.000 cps, sedangkan data yang diperoleh 85 % berada di atas 400.000 cps untuk Rh dan 83 % berada di atas 300.000 cps untuk Pb. Sensitivitas alat terhadap Rh103 lebih tinggi dibandingkan terhadap 208Pb karena 103Rh adalah isotop tunggal, sedangkan kelimpahan relatif isotop 208Pb hanya 52,4 % dari total Pb.
Walaupun secara keseluruhan data optimasi memenuhi standar kondisi operasional, namun ada kecenderungan setelah beberapa kali analisis sensitivitas
alat menurun. Hal ini dapat disebabkan semakin banyaknya endapan pada cone, cairan pendingin pada sistem pendingin yang tidak berfungsi baik lagi sehingga harus diganti, atau minyak pelumas pompa yang sudah menghitam karena teroksidasi. Jika penurunan cukup signifikan atau tidak memenuhi standar maka dilakukan optimasi lengkap setelah pengecekan alat. Kurva optimasi ini sangat penting untuk melihat kondisi operasional alat, sehingga interpretasi data hasil pengukuran dapat dilakukan dengan lebih baik.
Gambar IV. 1 Data hasil optimasi harian analisis ICP-QMS berdasarkan sensitivitas Mg, Rh, dan Pb
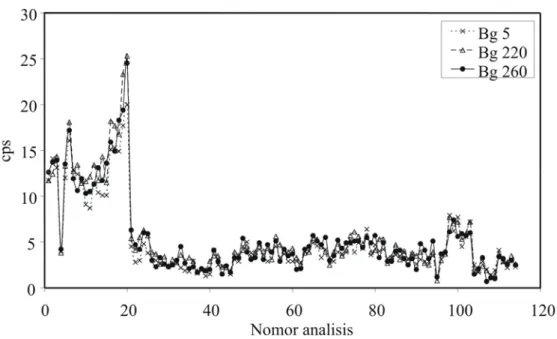
Gangguan elektronik yang terjadi selama pengukuran dapat diamati dengan mengukur cacah gangguan latar (background noise, Bg) pada m/z 5, 220 dan 260 pada saat optimasi harian. Maksimum cacah Bg adalah 30 cps. Pada Gambar IV. 2 dapat dilihat grafik hubungan nomor analisis dan cacah Bg yang menunjukkan semua pengukuran memenuhi kriteria kecil dari 30.
Gambar IV. 2 Data hasil optimasi harian analisis ICP-QMS berdasarkan jumlah cacah gangguan (Background noise, Bg) pada m/z 5, 220, dan 260 (Bg 5, Bg 220, dan Bg 260)
Pada awal percobaan hingga sampai percobaan ke 20, cacah Bg rata-rata di atas sepuluh dan cenderung meningkat sampai 25. Indikasi ini menunjukkan penampilan alat ICP-QMS cenderung menurun dengan meningkatnya cacah Bg, sehingga diperlukan optimasi bulanan dan penggantian detektor maupun cone. Selain itu, tingginya noise juga disebabkan oleh kondisi laboratorium yang kurang kondusif. Pada saat awal analisis sampai analisis ke 20 pengukuran dilakukan dalam laboratorium darurat karena laboratorium sedang direnovasi. Percobaan ke 21 dan selanjutnya dilakukan dalam laboratorium yang baru direnovasi dengan menggunakan alat yang sama tetapi dengan detektor quadrupole dan cone yang baru. Pada kondisi tersebut, gangguan elektronik dapat diperkecil yang ditandai dengan cacah Bg stabil pada kisaran 3-5 cps. Grafik ini sangat membantu dalam meninjau penampilan alat ICP-QMS berdasarkan gangguan elektronik yang terjadi.
Analisis ICP-QMS adalah suatu analisis yang berdasarkan pengukuran m/z, yaitu ion positif bermuatan satu. Dengan demikian, diharapkan semua atom terionisasi
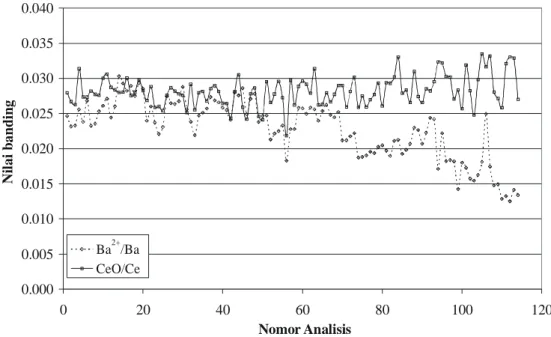
membentuk ion M+. Namun kenyataannya, ada sebagian atom analit yang terionisasi membentuk ion bermuatan positif lebih dari satu atau teroksidasi. Oleh karena itu perlu diamati laju pembentukan oksida dan pembentukan ion positif bermuatan dua dalam optimasi harian. Berdasarkan penelitian, unsur yang mudah teroksidasi dalam analisis ICP-QMS adalah Ce, sehingga angka banding CeO dan Ce dapat digunakan sebagai indikator laju pembentukan oksida analit. Demikian juga halnya Barium, adalah unsur yang paling mudah terionisasi membentuk Ba2+, sehingga digunakan sebagai indikator pembentukan ion positif dua.
Pada Gambar IV. 3 ditampilkan grafik hubungan nomor analisis dengan angka banding laju pembentukan oksida dan ion positif dua. Secara garis besar optimasi ini memenuhi kriteria standar analisis yaitu angka banding kecil dari 0,03 (3%). Beberapa percobaan pada tahap akhir penelitian dilakukan dengan kondisi sedikit di atas angka banding 0,03 untuk laju pembentukan oksida. Kondisi ini tidak dimaksudkan untuk mengabaikan kriteria standar, namun dengan pertimbangan laju pembentukan oksida analit yang diteliti jauh lebih rendah dibandingkan dengan cerium sehingga angka banding CeO/Ce sedikit di atas 0,03 tidak berpengaruh secara signifikan terhadap analisis. Pertimbangan lain adalah pada analisis tahap lanjut, jumlah analit dalam sampel semakin mengecil sehingga tujuan optimasi harian lebih dititik beratkan pada perolehan cps Rh yang maksimal yang merupakan indikator kepekaan alat terhadap analit.
Pada Gambar IV. 3 terlihat ada kecenderungan peningkatan laju pembentukan oksida dan pembentukan ion positif dua setelah beberapa kali percobaan, yang menunjukkan bahwa penampilan alat ICP-QMS menurun dan merupakan indikasi untuk melakukan optimasi lengkap. Pada Lampiran F ditampilkan data hasil optimasi Alat ICP-QMS.
Gambar IV. 3 Data hasil optimasi harian analisis ICP-QMS berdasarkan laju pembentukan ion positif 2 (Ba2+/Ba) dan pembentukan oksida (CeO/Ce)
IV.3 Validasi metode destruksi dan analisis total unsur dengan ICP-QMS. Masalah utama yang harus diselesaikan dalam proses analisis adalah persiapan sampel yang handal untuk menghindari hilangnya sampel dan kontaminasi. Oleh karena itu dilakukan perhitungan persen perolehan kembali material rujukan standar untuk mengetahui apakah metode destruksi dan metode analisis ICP-QMS yang dikembangkan valid untuk sampel yang dianalisis (Koplik dkk., 1998; Quevauviller, 2003). Validasi dilakukan dengan menggunakan material rujukan standar daun tanaman poplar (poplar leaves) serta ranting dan daun tanaman semak (bush twigs and leaves). Proses destruksi cairan floem dan material rujukan standar dilakukan pada saat bersamaan dengan penambahan pereaksi yang sama. Pada Tabel IV. 2 ditampilkan data hasil analisis material rujukan standar daun tanaman poplar (poplar leaves) serta ranting dan daun tanaman semak (bush twigs and leaves). Data tersebut kemudian diuji secara statistik menggunakan t-tes satu sampel untuk mengetahui apakah data hasil analisis bersesuaian dengan nilai tersertifikasi. Uji statistik ini dilakukan dengan program SPSS versi 11,5. Jenis uji yang dilakukan adalah dua sisi dengan hipotesis H0 diterima jika rerata sampel
sama dengan µ0 sebaliknya H0 ditolak jika rerata sampel tidak sama dengan µ0.
0.000 0.005 0.010 0.015 0.020 0.025 0.030 0.035 0.040 0 20 40 60 80 100 120 Nomor Analisis Ba /Ba2+ CeO/Ce N il a i ba n d in g
Dalam hal ini µ0 adalah nilai tersertifikasi masing-masing logam. Tingkat
signifikansi yang digunakan adalah 95 %.
Tabel IV. 2 Hasil analisis material rujukan (reference) standar*.
Ranting tanaman semak (bush twigs)
Daun tanaman semak (bush leaves)
Daun tanaman poplar (poplar leaves) Unsur Hasil analisis Nilai tersertifikasi Hasil analisis Nilai tersertifikasi Hasil analisis Nilai tersertifikasi Mg 0,285 ± 0,014 0,287 ± 0,011 0,469 ± 0,060 0,48 ± 0,03 0,722 ± 0,062 0,65 ± 0,03 Ca 2,172 ± 0,136 2,22 ± 0,07 1,672 ± 0,116 1,68 ± 0,06 1,623 ± 0,435 1,81 ± 0,07 Mn 58,188 ± 4,151 58 ± 3 62,458 ± 5,248 61 ± 3 48,433 ± 4,352 45 ± 2 Zn 21,157 ± 1,325 20,6 ± 1,0 56,717 ± 4,634 55 ± 2 40,816 ± 8,520 37 ± 1 Mo 0,264 ± 0,049 0,26 ± 0,03 0,287 ± 0,057 0,28 ± 0,03 0,184 ± 0,035 0,18 ± 0,01 Cd 0,147 ± 0,020 0,14 ± 0,01 0,416 ± 0,010 (0,38) 0,361 ± 0,040 0,32 ± 0,05 *Satuan konsentrasi untuk Mg dan Ca dalam persen sedangkan unsur lain dalam µg/g. (n = 3; berat sampel = ± 100 mg)(Anonim, 1990).
Berdasarkan uji statistik t-tes satu sampel (Lampiran G) yang dilakukan ketahui bahwa secara keseluruhan tidak ada perbedaan signifikan konsentrasi logam hasil analisis material rujukan standar dengan nilai tersertifikasi kecuali untuk analisis Cd dalam daun tanaman semak (bush leaves). Nilai sertifikasi Cd dalam daun tanaman semak (bush leaves) merupakan nilai semikuantitatif, dimana dalam sertifikat hanya dituliskan (0,38) tanpa nilai standar deviasi (Tabel IV.2). Nilai tersebut menunjukkan sulitnya untuk menentukan total Cd dalam daun tanaman semak (bush leaves) secara eksak walaupun kisaran total Cd dalam daun tanaman semak (bush leaves) lebih besar dibandingkan dalam daun tanaman poplar (poplar leaves) dan ranting tanaman semak (bush twigs). Secara keseluruhan dapat disimpulkan bahwa metoda destruksi dan analisis total unsur dengan metode ICP-QMS yang dikembangkan dapat digunakan untuk analisis total unsur cairan floem dalam tanaman jarak serta untuk analisis selektif unsur dalam fraksi SEC dan QPNC PAGE.
Pada Tabel IV.3 tertera data hasil analisis total unsur dalam cairan floem tanaman jarak. Secara umum dapat dilihat bahwa perbedaan media kultur tidak berpengaruh secara signifikan terhadap total Mg dan Zn, namun berpengaruh terhadap Ca, Mn, Mo dan Cd. Kandungan Mn, Mo, dan Cd dalam cairan floem lebih tinggi dengan media aeroponik sebaliknya kandungan Ca lebih rendah. Fenomena ini sangat menarik, karena umumnya penyerapan larutan nutrisi dengan media aeroponik lebih baik dibandingkan dengan media pot dan serapan logam yang tinggi berbanding lurus dengan kandungan logam dalam floem. Fenomena ini juga ditemukan oleh Grusak dkk (1996) dalam Pomper dan Grusak (2004) yang menyatakan bahwa konsentrasi Ca dalam xilem kacang polong pada tanaman yang dikulturkan dengan media hidroponik lebih rendah dibandingkan pada tanaman yang ditumbuhkan pada lahan tanah.
Tabel IV. 3 Hasil analisis total unsur dalam cairan floem tanaman jarak*.
Logam Aeroponik Pot
Mg 131,129 ± 15,782 114,953 ± 10,639 Ca 50,136 ± 7,117 70,454 ± 6,244 Mn 576,754 ± 70,781 394,989 ± 59,116 Zn 6,396 ± 0,333 5,574 ± 0,458 Mo 505,072 ± 21,737 65,719 ± 5,828 Cd 3,735 ± 1,015 2,278 ± 0,226
*Satuan konsentrasi dalam mg/L untuk Ca, Mg, dan Zn dan µg/L untuk Mn, Mo, dan Cd. (n = 3; berat sampel = ± 300 - 500 mg)
IV.4 Pemisahan spesi Mg, Ca, Mn, Zn, Mo dan Cd dengan SEC
Pemisahan tahap I cairan floem dilakukan dengan menggunakan metode SEC. Ada dua kolom yang digunakan pada penelitian ini yaitu kolom sephadex G-50 SF dan kolom sephadex G-25 M. Pemisahan utama dilakukan dengan menggunakan kolom sephadex G-50 SF sedangkan pemisahan preparatif dengan tujuan pemisahan lebih lanjut digunakan kolom sephadex G-25 M. Kondisi operasional pemisahan SEC telah ditampilkan pada Tabel III.6.
IV.4.1 Kalibrasi kolom sephadex G-50
Kolom sephadex G-50 SF dikalibrasi dengan menggunakan kit campuran standar penanda berat molekul yang terdiri dari thyroglobulin (670 kDa), bovin globulin
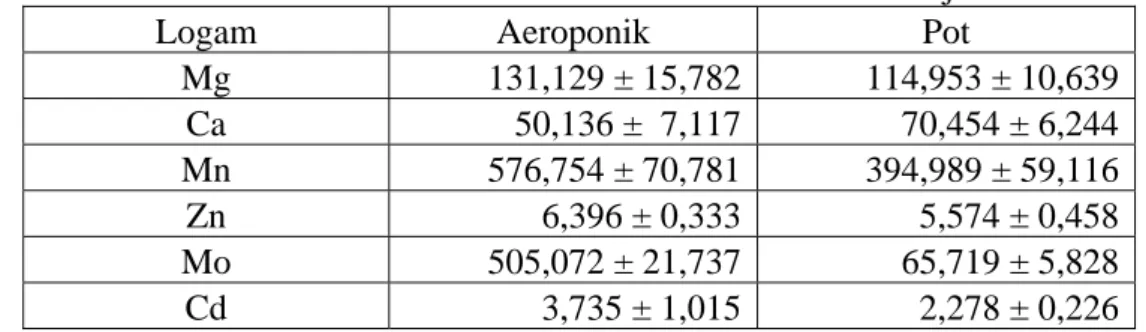
(158 kDa), chicken ovalbumin (44 kDa), equine myoglobin (17,5 kDa), dan vitamin B12 (1,35 kDa). Pada Gambar IV. 4 dapat dilihat profil serapan UV campuran standar tersebut.
Pada Gambar IV. 4 terlihat protein A dan B terelusi pada volume mati, sebagaimana diketahui bahwa range fraksinasi gel ini adalah 1,5 – 30 kDa untuk protein globular dan 0,5 – 10 kDa untuk dekstran (Tabel III.6), sehingga semua protein diatas 30 kDa akan terelusi pada volume mati. Keunggulan metode pemisahan yang dikembangkan adalah kemampuan untuk memisahkan ovalbumin (puncak C) yang berat molekulnya 44 kDa dari thyroglobulin dan bovin globulin. Keunggulan tersebut menunjukkan metode pemisahan yang dikembangkan mempunyai resolusi lebih tinggi dari kisaran teoritis berat molekul relatif pada volume mati kolom sephadex G-50 SF. Oleh karena itu, puncak yang muncul pada volume mati akan dinotasikan mempunyai berat molekul besar lebih dari 44 kDa dan bukan 30 kDa.
Gambar IV. 4 Profil elusi kalibrasi kolom sephadex G-50 SF (buffer MES). A (5 mg thyroglobulin, 670 kDa), B (5 mg bovin globulin, 158 kDa), C (5 mg chicken ovalbumin, 44 kDa), D (2,5 mg equine myoglobin, 17,5 kDa), dan E (0,5 mg vitamin B12, 1,35 kDa). Pendeteksian serapan UV pada 254 nm.
Myoglobin dan vitamin B12 mudah dideteksi ketika terelusi karena keduanya berwarna. Myoglobin berwarna kuning sedangkan vitamin B12 berwarna pink.
Intensitas serapan vitamin B12 cukup besar relatif dibandingkan dengan protein lainnya walaupun jumlahnya hanya 0,5 mg sedangkan protein lain beratnya 5 mg kecuali myoglobin 2,5 mg.
Berdasarkan profil elusi tersebut, dibuat kurva kalibrasi berat molekul relatif kolom sephadex G-50 (Lampiran H) dan diperoleh persamaan kalibrasi sebagai berikut:
Kav = - 0,519 log MW + 2,4588
dimana Kav adalah koefisien partisi dan MW adalah berat molekul relatif dengan
nilai koefisien korelasi (R2) sebesar 0,9998. Dengan menggunakan persamaan ini berat molekul relatif spesi dapat ditentukan.
IV.4.2 Profil serapan UV cairan floem
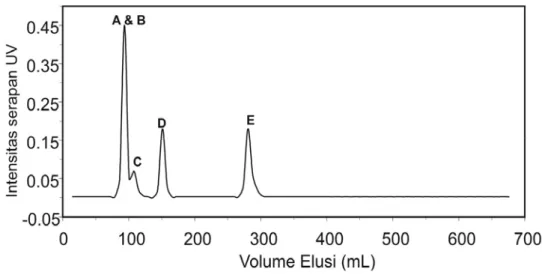
Pada Gambar IV. 5 ditampilkan profil serapan UV cairan floem tanaman Jarak menggunakan fasa gerak larutan MES dan NaCl. Resolusi pemisahan dengan fasa gerak Tris-HCl kurang jelas sehingga tidak ditampilkan.
Gambar IV. 5 Profil serapan UV cairan floem tanaman Jarak pada kolom Sephadex G-50 SF. Pendeteksian UV pada panjang gelombang 254 nm. (a) sampel cairan floem sebanyak 0,5 mL difraksinasi menggunakan 20 mM MES/ 1 mM NaN3 pH 8,0 dan (b) sampel
cairan floem sebanyak 1,0 mL difraksinasi menggunakan 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Berdasarkan profil serapan UV yang muncul, dapat disimpulkan paling sedikit ada 6 kelompok senyawa aktif UV berdasarkan perbedaan berat molekulnya dalam cairan floem. Intensitas serapan UV kelompok A sangat lemah (0,1) relatif dibandingkan intensitas serapan kelompok C. Telah dilakukan juga optimasi metode dengan menurunkan kepekaan detektor dan memperkecil jumlah sampel untuk menurunkan intensitas serapan kelompok C, namun serapan kelompok C tetap lebih dari 1,0 sehingga puncaknya tidak muncul dan efeknya puncak serapan kelompok A, E dan F tidak terdeteksi. Dalam hal ini metode pemisahan yang optimal yang dipilih adalah jika kelompok A masih dapat terdeteksi dengan baik (intensitas serapan UV maksimal 0,1).
Kelompok A terelusi pada volume mati baik menggunakan fasa gerak MES maupun NaCl. Kelompok B dan C tidak dapat dipisahkan dengan menggunakan buffer MES, sedangkan pemisahan dengan fasa gerak NaCl kelompok B dapat dipisahkan dengan baik namun kelompok C dan D tidak dapat dipisahkan. Dengan demikian pemisahan dengan menggunakan kedua fasa gerak tersebut saling komplementer.
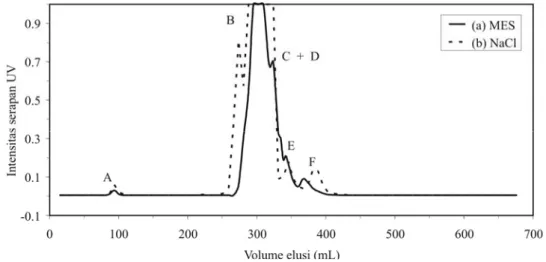
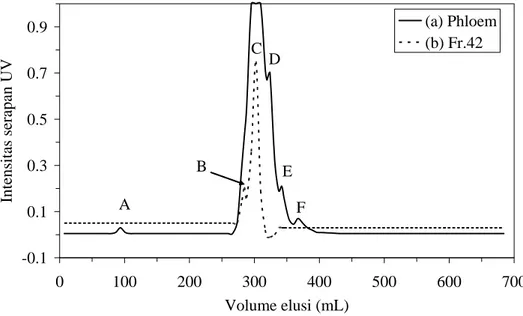
Gambar IV. 6 Profil serapan UV cairan floem tanaman Jarak pada kolom Sephadex G-50 SF menggunakan buffer 20 mM MES/ 1 mM NaN3 pH 8,0. Pendeteksian UV pada panjang gelombang 254 nm.
(a) sampel cairan floem sebanyak 0,5 mL dan (b) fraksinasi lanjutan 2 mL fraksi 42 dari hasil pemisahan (a).
-0.1 0.1 0.3 0.5 0.7 0.9 0 100 200 300 400 500 600 700 Volume elusi (mL) Intens itas s erapan U V (a) Phloem (b) Fr.42 A E D C B F
Kelompok B dan C dapat dipisahkan setelah isolasi lebih lanjut fraksi 42 pada volume elusi 302,4 mL (Gambar IV. 6) menggunakan kolom dan fasa gerak yang sama (MES). Adapun Kelompok E dapat terpisah dengan baik dengan menggunakan fasa gerak NaCl namun tidak terpisah dengan baik dalam MES. Kesimpulan yang dapat ditarik adalah larutan MES dan NaCl dapat digunakan sebagai fasa gerak pada proses pemisahan cairan floem tanaman jarak.
IV.4.3 Profil Elusi karbon, sulfur dan fosfor
Gambaran profil elusi senyawa organik dalam cairan floem setelah pemisahan dengan metode SEC dapat diinterpretasikan dari profil elusi atom karbon, fosfor dan sulfur. Profil elusi nitrogen tidak dapat digunakan untuk maksud tersebut karena fasa gerak mengandung NaN3 dan matriks larutan analit ICP-QMS dalam
larutan asam nitrat. Kelimpahan senyawa organik dalam cairan floem sangat besar sehingga isotop yang digunakan isotop minor untuk menghindari penghitungan cacah yang terlalu tinggi (over count). Fosfor adalah monoisotop, sehingga tidak ada pilihan lain kecuali menggunakan isotop 31P. Jika terjadi over count, maka pembacaan cacah tidak dapat dideteksi. Untuk menghindari hal tersebut maka dwel ltime fosfor diturunkan (3-5 ms). Jumlah cps fosfor tertinggi yang masih dapat dideteksi oleh alat adalah 657576 cps. Isotop karbon dan sulfur yang digunakan adalah karbon 13 (persen kelimpahan 1,10%) dan sulfur 34 (persen kelimpahan 4,21 %).
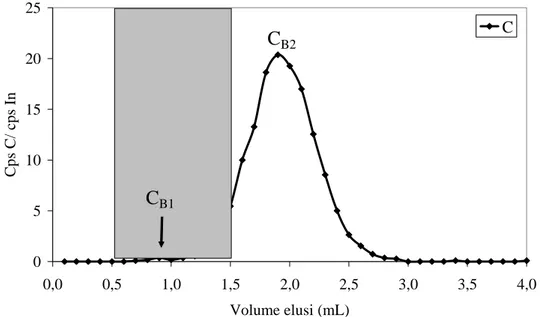
Pada Gambar IV. 7 ditampilkan profil elusi karbon dalam cairan floem setelah pemisahan SEC pada kolom sephadex G-25 M. Untuk menghindari perbedaan penghitungan cps akibat perbedaan viskositas analit maupun kondisi elektronik alat pada saat analisis berlangsung, sebagai sumbu Y digunakan angka banding cps unsur dibagi cps In.
Seperti yang terlihat pada Gambar IV. 7, ada dua spesi karbon dalam cairan floem, yaitu spesi minor CB1 pada volume elusi 0,7 – 1,0 mL dengan kelimpahan
relatif 0,58 % dan spesi utama CB2 pada volume elusi 1,1 – 2,9 mL. Spesi CB2
cairan floem dimana konsentrasi karbon tertinggi terdeteksi pada fraksi 19 (volume elusi 1,9 mL). Jika dibandingkan dengan profil elusi protein (lihat Sub Bab IV.4.5 dan Gambar IV.22), yaitu pada volume elusi 0,5 – 1,5 mL, menunjukkan bahwa spesi minor karbon dan sebagian spesi utama karbon berkorelasi positif dengan profil elusi protein. Persen cps karbon pada daerah elusi polipeptida/protein sekitar 7,78 % dari seluruh cps karbon dalam cairan floem. Penghitungan ini sangat berguna untuk melihat komposisi senyawa organik dalam cairan floem. Berdasarkan profil tersebut juga terlihat bahwa spesi minor karbon merupakan spesi dengan berat molekul relatif besar dan spesi utama karbon adalah spesi dengan berat molekul kecil.
Gambar IV. 7 Profil distribusi karbon pada kolom sephadex G-25. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. Kondisi fraksinasi: jumlah sampel: 500 µL; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Krüger dkk. (2002) telah melakukan analisis sukrosa dalam cairan floem dalam kecambah jarak yang berumur 7 hari. Sukrosa terelusi pada daerah molekul rendah (kolom NAP-5, buffer MES pH 5,5) dengan profil yang mirip pada Gambar IV.7. Jika persen kelimpahan spesi CB2 yang sebesar 99,42 % dikurangi
dengan persen kelimpahan karbon pada daerah elusi protein/polipeptida (7, 78 %) maka secara perhitungan kelimpahan relatif senyawa karbon di luar daerah elusi
0 5 10 15 20 25 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 Volume elusi (mL) C p s C/ cps In C
C
B1C
B2protein/polipeptida adalah sebesar 91,64 %. Hasil ini bersesuaian dengan kandungan sukrosa dalam cairan floem (lebih besar dari 90 %) yang kemukakan oleh Pate (1975 dalam Salisbury dan Ross 1995). Hal ini menunjukkan bahwa sebagian besar spesi CB2 kemungkinan sukrosa dan karbohidrat lainnya yang
terdapat dalam cairan floem tanaman jarak.
Sukrosa merupakan fotosintat terpenting dalam cairan floem. Penelitian tentang sukrosa dalam cairan floem tanaman jarak telah banyak dilakukan baik menggunakan kecambah (Kallarackal dkk., 1989; Verscht dkk., 1998; Kalusche dkk., 1999; Geigenberger dkk., 1993; Krüger dkk., 2002) maupun tanaman jarak dewasa (Vreugdenhil dan Koot-Gronsveld, 1989; Jongebloed dkk., 2004). Dalam beberapa penelitian tersebut dibahas tentang proses transport, pemuatan dan pembongkaran (loading and unloading) sukrosa floem, dan metabolismenya. Namun sebagian besar menggunakan kecambah tanaman jarak sebagai obyek penelitian dan penambahan/adisi karbohidrat tertentu untuk memudahkan proses pengamatan (Geigenberger dkk., 1993) atau penggunaan bahan radioaktif (Kalusche dkk., 1999). Pemodelan proses transport dengan menggunakan kecambah memudahkan untuk mempelajari proses transport sukrosa pada batasan-batasan tertentu. Adapun penelitian yang dilakukan menggunakan cairan floem yang diperoleh dari tanaman yang ditumbuhkan alami tanpa bahan radioaktif dan analisis pemisahan dan pendeteksian tanpa penambahan aditif karbohidrat sehingga orisinalitas cairan floem dari tanaman dewasa dapat dipertahankan.
Forfor terelusi pada volume elusi 0,8 – 3,0 mL dan dinyatakan sebagai spesi PB1,
PB2, PB3 dan PB4 yang saling tumpang tindih (Gambar IV. 8). Puncak spesi PB1
sulit ditentukan posisinya yang berada pada kaki spesi PB2 sedangkan puncak
spesi PB2, PB3 dan PB4 berturut-turut pada volume elusi 1,7; 2,0; dan 2,2 mL.
Fraksi fosfor (Spesi PB1 dan sebagian spesi PB2) pada daerah elusi
Gambar IV. 8 Profil distribusi fosfor pada kolom sephadex G-25. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. Kondisi fraksinasi: jumlah sampel: 500 µL; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Keberhasilan penelitian ini adalah dapat mendiferensiasikan fosfor dalam cairan floem menjadi empat spesi fosfor yang tidak dapat dapat dipisahkan oleh Van Goor dan Wiersma (1976). Van Goor dan Wiersma (1976) telah melakukan fraksinasi spesi fosfor dalam cairan floem jarak menggunakan kolom sephadex G-10, G-15 dan G-25. Dalam penelitian tersebut digunakan radioisotop 32P dan pendeteksian selektif fosfor dilakukan dengan pencacah radiasi ß (philips liquid scintillation counter PW 4510). Hasil penelitian menunjukkan cuma ada satu spesi fosfor dengan menggunakan ketiga kolom tersebut. Kenyataan ini menunjukkan bahwa pendeteksian selektif fosfor dengan ICP-QMS yang dilakukan telah berhasil mendeteksi dengan baik keberadaan keempat spesi fosfor tersebut.
Profil elusi sulfur (Gambar IV. 9) agak unik dibandingkan profil elusi karbon dan fosfor yang dapat diinterpretasikan dengan mudah. Dengan mempertimbangkan terbentuknya bahu pada profil sulfur, terdeteksi minimal 7 puncak sulfur pada daerah elusi 0,5 – 2,5 mL. Ada 4 spesi pada daerah elusi polipeptida/protein dan 3
0,0 0,5 1,0 1,5 2,0 2,5 3,0 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 Volume elusi (mL) Cps C / cp s In P
P
B1P
B4P
B3P
B2spesi pada daerah berat molekul rendah. Spesi utama terletak pada daerah berat molekul rendah. Persen sulfur pada daerah elusi polipeptida/protein adalah 23,65 % dari total sulfur.
Gambar IV. 9 Profil distribusi sulfur pada kolom sephadex G-25. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. Kondisi fraksinasi: jumlah sampel: 500 µL; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Fraksi SEC dari kolom Sephadex G-25 M yaitu fraksi 5-15; yang berkorelasi positif dengan daerah elusi polipeptida/protein, dikumpulkan lalu dipisahkan lebih lanjut menggunakan kolom sephadex G-50 SF untuk melihat profil fraksi polipeptida/protein cairan floem pada kolom sephadex G-50 SF dan mendapatkan hasil pemisahan spesi dengan resolusi yang lebih baik. Pada Gambar IV. 10 dapat dilihat profil elusi karbon pada kolom sephadex G50 SF. Dari gambar tersebut terlihat dengan jelas dua spesi karbon yaitu CA1 dan CA2. Spesi CA1 terelusi pada
volume mati (persen kelimpahan spesi CA1 7,78 %) dan spesi CA2 pada daerah
elusi serapan maksimum UV cairan floem. Hal ini tidak berarti tidak ada spesi karbon pada daerah volume elusi 110 - 260 mL. Namun karena intensitasnya yang sangat kecil dan berada di bawah batas kuantifikasi sehingga tidak terdeteksi.
0,0 1,5 3,0 4,5 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 Volume elusi (mL) Cps C/ cps In S
S
B4S
B1S
B2S
B3S
B5S
B6S
B7Gambar IV. 10 Profil distribusi karbon pada kolom sephadex G-50 setelah bidimensional pemisahan. Kondisi fraksinasi: jumlah sampel: 400 µL akumulasi fraksi 5-15 SEC Sephadex G25 M; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Spesi fosfor dari sampel fraksi 5-15 kolom sephadex G25 juga dapat dibuktikan setelah bidimensional pemisahan dengan kolom sephadex G50 SF (Gambar IV. 11). Terdeteksi ada 4 spesi fosfor, yaitu PA1, PA2, PA3, dan PA4. Spesi-spesi
tersebut berturut-turut terdeteksi pada volume mati, volume elusi 216, 280, 302 mL. Profil elusi spesi PA1, PA3, dan PA4 berkorelasi positif dengan profil serapan
aktif UV cairan floem.
Jika pada kolom sephadex G25, terdeteksi 7 spesi sulfur, maka pada kolom sephadex G50 terdeteksi lebih banyak lagi yaitu 11 spesi sulfur (Gambar IV. 12). Hal ini menunjukkan metode SEC pada kolom sephadex G50 SF mempunyai resolusi yang lebih tinggi sehingga mampu memisahkan spesi sulfur dengan lebih baik. Jika spesi karbon dan fosfor umumnya terdeteksi pada daerah serapan aktif UV cairan floem saja, maka spesi sulfur tersebar mulai dari volume mati hingga volume elusi 350 mL. Spesi SA1 pada volume mati kemungkinan bagian dari
protein dengan berat molekul besar dari 44kDa.
0 3 6 9 0 50 100 150 200 250 300 350 400 Volume elusi (mL) cp s C/cps In C 13
C
A1C
A2Gambar IV. 11 Profil distribusi fosfor pada kolom sephadex G-50 setelah bidimensional pemisahan. Kondisi fraksinasi: jumlah sampel: 400 µL akumulasi fraksi 5-15 SEC Sephadex G25 M; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0. Insert: Profil PA1.
.
Gambar IV. 12 Profil distribusi sulfur pada kolom sephadex G-50 setelah bidimensional pemisahan. Kondisi fraksinasi: jumlah sampel: 400 µL akumulasi fraksi 5-15 SEC Sephadex G25 M; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0. 0,0 0,2 0,4 0,6 0,8 0 50 100 150 200 250 300 350 400 Volume elusi (mL) cp s P/cp s In P 31
P
A2P
A4P
A3P
A1 -0,001 0,001 0,003 0,005 50 100 150 200 Volume elusi (mL) cp s P /c p s In P 31 PA1 0,0 0,2 0,4 0,6 0,8 0 50 100 150 200 250 300 350 400 Volume elusi (mL) cp s P/cp s In P 31P
A2P
A4P
A3P
A1 -0,001 0,001 0,003 0,005 50 100 150 200 Volume elusi (mL) cp s P /c p s In P 31 PA1 0,0 0,3 0,6 0,9 1,2 0 50 100 150 200 250 300 350 400 Volume elusi (mL) cps S/cp s In S 34S
A1S
A5S
A6S
A4S
A3S
A2S
A8S
A7S
A9S
A10S
A11IV.4.4 Profil Elusi dan distribusi berat molekul spesi Mg, Ca, Mn, Zn, Mo, dan Cd pada kolom sephadex G-50 SF
Cairan floem yang telah melalui kolom sephadex G-50 SF difraksinasi menjadi 95 fraksi kemudian dideteksi selektif unsur menggunakan ICP-QMS. Sebelumnya, setiap fraksi dibagi dua, satu bagian untuk pendeteksian selektif unsur dan bagian lainnya untuk pemisahan lebih lanjut. Data mentah hasil pendeteksian selektif unsur direduksi dengan nilai batas kuantifikasi untuk masing-masing unsur. Hasil reduksi data mentah yang bernilai negatif dianggap nol. Hasil pengolahan data tersebut diplotkan dengan nomor fraksi atau volume elusi setiap fraksi sehingga diperoleh profil elusi spesi setelah pemisahan. Pengolahan data pemisahan SEC dapat dilihat pada Lampiran J.
Pada Gambar IV. 13 ditampilkan profil elusi spesi Mg, Ca, Mn, Zn, Mo dan Cd dengan menggunakan larutan MES sebagai fasa gerak yang dibandingkan dengan profil elusi serapan UV cairan floem. Untuk memudahkan interpretasi awal data hasil penelitian, sebagai sumbu y digunakan satuan konsentrasi ternormalisasi dengan fraksi yang mengandung konsentrasi tertinggi. Hal ini dilakukan karena rentang konsentrasi untuk setiap unsur berbeda mulai dari rentang konsentrasi pg/mL sampai µg/mL.
Secara umum pada Gambar IV. 13 terlihat bahwa sebagian besar spesi yang dideteksi berkorelasi positif dengan serapan UV cairan floem. Spesi pertama Mg, Ca, Zn, Mo, Mn dan Cd terdeteksi pada daerah volume mati dengan kelimpahan relatif yang sangat kecil dibandingkan spesi lainnya kecuali Cd. Spesi utama umumnya terdeteksi pada daerah di bawah 1 kDa, yaitu pada daerah serapan UV maksimum. Hanya spesi MgA2, ZnA2, Cd A2, dan CdA3 yang tidak bersesuain
Gambar IV. 13 Profil elusi spesi Mg, Ca, Mn, Zn, Mo, dan Cd serta serapan UV 0,5 mL cairan floem tanaman jarak pada kolom Sephadex G-50 SF menggunakan buffer 20 mM MES/ 1 mM NaN3 pH 8,0.
Deteksi UV pada panjang gelombang 254 nm dan deteksi selektif unsur menggunakan ICP-QMS. Daerah yang diarsir adalah daerah serapan UV. (A) spesi Mg, Ca, dan serapan UV, (B) spesi Mn dan Zn, dan (C) spesi Mo dan Cd.
Pada Gambar IV. 14 ditampilkan perbandingan profil elusi spesi Mg cairan floem tanaman jarak yang dikulturkan secara aeroponik dan pot setelah fraksinasi menggunakan metode SEC. Berdasarkan gambar tersebut, terlihat bahwa tidak ada perbedaan yang signifikan pada profil elusi spesi Mg dan kisaran konsentrasinya untuk masing-masing spesi dengan menggunakan kedua kultur. Kenyataan ini semakin menunjukkan bahwa tidak ada batasan kandungan Magnesium dalam tumbuhan (Salisbury dan Ross, 1995).
0 500 1000 1500 2000 2500 0 100 200 300 400 500 600 700 Volume elusi (mL) Ko ns en tra si /fra ksi (µg/ L) (a) aeroponik (b) pot 0.0 0.5 1.0 1.5 2.0 50 100 150 200 Volume elusi (mL) K o n sen tr as i/ fr aks i ( µ g /L ) (a) aeroponik (b) pot MgA1 MgA2 MgA3 MgA1 0 500 1000 1500 2000 2500 0 100 200 300 400 500 600 700 Volume elusi (mL) Ko ns en tra si /fra ksi (µg/ L) (a) aeroponik (b) pot 0.0 0.5 1.0 1.5 2.0 50 100 150 200 Volume elusi (mL) K o n sen tr as i/ fr aks i ( µ g /L ) (a) aeroponik (b) pot MgA1 MgA2 MgA3 MgA1
Gambar IV. 14 Profil distribusi spesi Mg pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 500 µL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0; kultur tanaman (a) aeroponik dan (b) pot.
Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Tiga spesi Mg terdeteksi, yaitu spesi MgA1 yang terdeteksi pada volume mati;
spesi MgA2, yang merupakan spesi utama dengan berat molekul relatif 1780 Da;
dan spesi MgA3 di bawah 1350 Da. Penentuan berat molekul spesi MgA1 dan MgA3
yang lebih eksak tidak dapat dilakukan karena berada di luar rentang kurva kalibrasi kolom sephadex G-50 SF. Pendeteksian selektif unsur dengan menggunakan ICP-QMS dengan batas kuantifikasi 1,198 µg/L telah berhasil dengan baik mendeteksi spesi MgA1 (insert pada Gambar IV. 14) dengan
dengan makromolekul karena mempunyai berat molekul relatif di atas 44 kDa. Makromolekul tersebut kemungkinan enzim yang diperlukan dalam proses fotosintesis, respirasi, dan pembentukan DNA maupun RNA (Salisbury dan Ross, 1995).
Tabel IV. 4 Distribusi Spesi Mg dalam cairan floem tanaman Jarak (Ricinus communis L.)*.
Kelimpahan relatif (%) Spesi Berat molekul relatif
(Da) Aeroponik Pot
MgA1 > 44.000 0,08 0,01 ± 0,01
MgA2 1780 ± 250 98,21 97,28 ± 2,52
MgA3 < 1350 1,71 2,71 ± 2,53
*Pemisahan dilakukan dengan menggunakan SEC pada kolom Sephadex G-50 SF, buffer 20 mM MES/ 1 mM NaN3 pH 8,0. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Pada Tabel IV. 5 dan Gambar IV. 15 dapat dilihat profil distribusi spesi Ca dalam cairan floem tanaman Jarak menggunakan kolom sephadex G-50 SF, dimana ditemukan 3 spesi Ca berdasarkan perbedaan berat molekulnya. Seperti halnya spesi MgA1 dan MgA3, ketiga spesi Ca berada di luar rentang kurva kalibrasi berat
molekul relatif kolom sephadex G-50 SF, sehingga tidak bisa ditentukan dengan dengan eksak berat molekulnya. Spesi CaA1 ditemukan pada daerah berat molekul
tinggi (> 44.000 Da) sedangkan kedua spesi Ca lainnya pada daerah berat molekul rendah (< 1350 Da).
Tabel IV. 5 Distribusi Spesi Ca dalam cairan floem tanaman Jarak (Ricinus communis L.)*.
Kelimpahan relatif (%) Spesi Berat molekul relatif
(Da) Aeroponik Pot
CaA1 > 44.000 1,95 2,12 ± 1,72
Ca A2 < 1350 74,75 79,76 ± 2,04
Ca A3 < 1350 23,30 18,12 ± 0,32
*Pemisahan dilakukan dengan menggunakan SEC pada kolom Sephadex G-50 SF, buffer 20 mM MES/ 1 mM NaN3 pH 8,0. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Gambar IV. 15 Profil distribusi spesi Ca pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 500 µL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0; kultur tanaman (a) aeroponik dan (b) pot.
Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Profil elusi Ca cairan floem jarak yang ditumbuhkan dengan media aeroponik dan pot relatif sama, namun distribusi spesi Ca signifikan berbeda. Spesi CaA1 (lihat
insert pada Gambar IV. 16), seperti halnya spesi Mg A1, terdeteksi pada volume
mati dengan kelimpahan relatif sekitar 1,95 – 3,33%. Kelimpahan relatif spesi CaA1 dan CaA2 menggunakan media tanam aeroponik lebih rendah dibandingkan
dengan menggunakan media pot.
Pada Gambar IV. 15 terlihat juga perbedaan total kandungan Ca yang signifikan. Fenomena menarik ini menunjukkan adanya perbedaan penyerapan Ca dan pendistribusian Ca dalam cairan floem tanaman jarak berdasarkan perbedaan media kulturnya. Adapun total kandungan Ca spesi CaA3 berkisar antara 6 – 8
mg/L dan tidak berbeda secara signifikan dengan menggunakan kedua media tersebut. 0 200 400 600 800 1000 1200 0 100 200 300 400 500 600 700 Volume elusi (mL) Kon sent rasi/fraks i (µ g/ L) (a) aeroponik (b) pot 0 10 20 30 40 50 50 100 150 200 Volume elusi (mL) K o n sen tr as i/ fr ak si ( µ g /L ) (a) aeroponik (b) pot
Ca
A1Ca
A2Ca
A3Ca
A1 0 200 400 600 800 1000 1200 0 100 200 300 400 500 600 700 Volume elusi (mL) Kon sent rasi/fraks i (µ g/ L) (a) aeroponik (b) pot 0 10 20 30 40 50 50 100 150 200 Volume elusi (mL) K o n sen tr as i/ fr ak si ( µ g /L ) (a) aeroponik (b) potCa
A1Ca
A2Ca
A3Ca
A1Pada tahap awal penelitian, jumlah sampel cairan floem yang difraksinasi adalah 500 µL berdasarkan pertimbangan sulitnya memperoleh cairan floem dalam jumlah besar dan tujuan utama untuk melihat profil distribusi unsur yang diteliti secara keseluruhan. Berdasarkan hasil fraksinasi tersebut, sebagian kecil unsur obyek penelitian ditemukan pada daerah volume mati, yaitu pada daerah fraksi 12-17, kecuali Mn. Pengamatan lebih intens dilakukan pada data mentah hasil pendeteksian selektif Mn, yang menunjukkan adanya kecenderungan peningkatan konsentrasi Mn mulai pada fraksi 12 yang puncaknya pada fraksi 14 yang kemudian menurun sampai fraksi 17. Hal ini menunjukkan kemungkinan adanya Mn pada daerah tersebut, yang merupakan daerah terdapatnya makromolekul dengan massa molekul relatif besar dari 44 kDa. Sebagaimana diketahui bahwa Mn dibutuhkan dalam proses fotosintesis dimana atom Mn berperan pada pusat katalitik oksidasi air dalam sistem fotosintesis II dan dibutuhkan sebagai kofaktor untuk beberapa enzim seperti enzim Mn-superoksida dismutase (MnSOD) (Pittman, 2005). Dengan demikian, tidak ditemukannya Mn pada daerah void volume kolom, kemungkinan karena sedikitnya jumlah sampel yang diaplikasikan dan konsentrasi Mn yang sangat rendah (sekitar 0,150 µg/L) yang berada di bawah batas kuantifikasi Mn sebesar 0,169 µg/L untuk percobaan dengan menggunakan media tanam aeroponik dan 0,174 µg/L untuk percobaan dengan menggunakan media tanam pot. Oleh karena itu, dilakukan percobaan dengan jumlah sampel yang lebih besar yaitu 1,5 mL dengan tujuan untuk membuktikan keberadaan Mn pada volume mati kolom dan untuk isolasi lebih lanjut beberapa spesi lainnya.
Percobaan dengan aplikasi sampel 1,5 mL telah berhasil menunjukkan adanya sebagian kecil Mn (kelimpahan relatif 0,4%) pada daerah volume mati. Keberhasilan pembuktian ini dicapai pertama karena aplikasi sampel yang lebih besar akan meningkatkan konsentrasi Mn dalam setiap fraksi. Sebagai contoh, data mentah konsentrasi Mn dalam fraksi 14 adalah 0,132 – 0,168 µg/L untuk aplikasi sampel 0,5 mL dan 0,232 µg/L untuk aplikasi sampel 1,5 mL. Keberhasilan kedua dicapai dengan menurunkan batas kuantifikasi Mn menjadi 0,097 µg/L. Batas kuantifikasi Mn dapat diturunkan setelah melakukan
pembersihan kedua cone, torch, dan optimasi lengkap ICP-QMS, dan pengaturan kondisi operasional ICP-QMS dengan prioritas analisis selektif Mn. Aplikasi jumlah sampel yang berbeda pada percobaan ini masih dapat ditolerir karena tidak mempengaruhi profil elusi spesi Mn. Hal ini terbukti dengan terdeteksinya puncak MnA2 dan MnA3 pada fraksi yang sama untuk kedua percobaaan. Distribusi spesi
Mn dalam cairan floem tanaman jarak setelah fraksinasi menggunakan kolom Sephadex G-50 SF dapat dilihat pada Tabel IV. 6 dan Gambar IV. 16.
Tabel IV. 6 Distribusi Spesi Mn dalam cairan floem tanaman Jarak (Ricinus communis L.)*.
Kelimpahan relatif (%) Spesi Berat molekul relatif
(Da) Aeroponik Pot
MnA1 > 44.000 - 0,16 ± 0,23
MnA2 < 1350 80,42 73,72 ± 0,04
MnA3 < 1350 19,58 26,12 ± 0,19
*Pemisahan dilakukan dengan menggunakan SEC pada kolom Sephadex G-50 SF, buffer 20 mM MES/ 1 mM NaN3 pH 8,0. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Seperti yang tertera dalam Tabel IV. 6 , ada tiga spesi Mn yang terdeteksi dalam cairan floem tanaman jarak. Spesi MnA1 terdeteksi pada volume mati dengan
kelimpahan relatif 0,02 – 0,16 %, spesi MnA2 yang merupakan spesi utama
dengan kelimpahan relatif 73 – 80 % dan berat molekul relatif kecil dari 1350 Da. Terakhir spesi MnA3 juga mempunyai berat molekul dibawah 1350 Da dan
kelimpahan relatif 19 – 27%. Hasil penelitian ini bersesuaian dengan penelitian Van Goor dan Wiersma (1976). Keunggulan penelitian yang dilakukan adalah kemampuan mendeteksi keberadaan spesi MnA1 yang tidak terdeteksi oleh Van
Goor dan Wiersma.
Berbeda dengan spesi CaA2 yang ditemukan dalam jumlah lebih besar dalam
cairan floem tanaman jarak pada media pot, spesi MnA2 justru terdapat lebih
banyak dalam cairan floem tanaman jarak pada media aeroponik. Hal ini menunjukkan adanya perbedaan sifat spesi CaA2 dan spesi MnA2 yang
dan perbedaan sifat Ca yang immobil (Hanger, 1979; Reddy, 2001) dan Mn yang mobil dalam floem. Selain ketiga spesi tersebut, ada sebagian Mn yang terdistribusi sebagai ekor (tailing) pada volume elusi 350 mL sampai 500 mL, yang kemungkinan adalah ion Mn2+.
Gambar IV. 16 Profil distribusi spesi Mn pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 500 µL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0; kultur tanaman (a) aeroponik dan (b) pot. Insert:
percobaan dengan aplikasi sampel 1,5 mL dengan media tanam pot. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Pengambilan keputusan untuk menginterpretasi data dan pengelompokkan sekumpulan titik yang membentuk puncak sebagai suatu spesi tersendiri merupakan suatu hal yang tidak mudah. Spesi ZnA1 dapat dengan mudah
dikelompokkan sebagai suatu spesi Zn, berdasarkan pengamatan spesi unsur lain yang juga teramati pada volume mati dan keberadaannya yang relatif signifikan yaitu sekitar 5 – 12% (Gambar IV. 17). Demikian juga dengan spesi ZnA3 sebagai
spesi utama yang terdeteksi pada volume elusi 288 mL dengan kelimpahan relatif 80 – 88% (Tabel IV. 7), sangat mudah untuk dikelompokkan sebagai suatu spesi
0
2
4
6
8
0
100
200
300
400
500
600
700
Volume elusi (mL)
Konse
n
tras
i/fraks
i (µg/L)
(a) aeroponik
(b) pot
Mn
A1Mn
A2Mn
A3 0.0 0.1 0.2 50 100 150 Volume elusi(mL) K ons en tr as i/ fr aks i ( µ g /L ) MnA10
2
4
6
8
0
100
200
300
400
500
600
700
Volume elusi (mL)
Konse
n
tras
i/fraks
i (µg/L)
(a) aeroponik
(b) pot
Mn
A1Mn
A2Mn
A3 0.0 0.1 0.2 50 100 150 Volume elusi(mL) K ons en tr as i/ fr aks i ( µ g /L ) MnA1Zn. Namun tidak demikian untuk spesi ZnA2 yang bentuknya mirip fronting
puncak spesi ZnA3. Setelah pengamatan lebih teliti dari beberapa data hasil
percobaan, teramati adanya penurunan konsentrasi Zn dalam fraksi 37/38 sebelum kemudian naik kembali membentuk kelompok spesi ZnA3. Berdasarkan hal
tersebut dikelompokkan puncak yang terbentuk pada fraksi 32 sampai 36/37 sebagai spesi ZnA2.
Tabel IV. 7 Distribusi Spesi Zn dalam cairan floem tanaman Jarak (Ricinus communis L.)*.
Kelimpahan relatif (%) Spesi Berat molekul relatif (Da)
Aeroponik Pot
ZnA1 > 44.000 6,82 8,20 ± 5,09
ZnA2 2057 ± 300 12,64 7,98 ± 2,85
ZnA3 1350 ± 200 80,54 83,82 ± 7,94
*Pemisahan dilakukan dengan menggunakan SEC pada kolom Sephadex G-50 SF, buffer 20 mM MES/ 1 mM NaN3 pH 8,0. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Gambar IV. 17 Profil distribusi spesi Zn pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 500 µL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0; kultur tanaman (a) aeroponik dan (b) pot.
Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
0 40 80 120 160 0 100 200 300 400 500 600 700 Volume elusi (mL) Ko nsen tr as i/ fr ak si (µg /L) (a) aeroponik (b) pot ZnA1 Zn A2 ZnA3
Tidak ada pengaruh media tanam terhadap laju elusi spesi ZnA1 namun menggeser
puncak spesi ZnA2 dan ZnA3 satu fraksi pada media tanam pot. Puncak spesi ZnA2
teramati pada fraksi 36 pada media tanam aeroponik sedangkan pada media tanam pot pada fraksi 37 dan puncak spesi ZnA3 terdeteksi pada fraksi 39 untuk media
tanam aeroponik dan pada fraksi 40 untuk media tanam pot. Perbedaan posisi puncak sebesar satu fraksi masih dapat diterima dan telah diperhitungkan dalam rentang berat molekul relatif spesi sebagai standar deviasi perhitungan berat molekul relatif.
ZnA1 ditemukan kurang lebih dua kali lebih banyak dalam cairan floem tanaman
jarak dengan media pot dibandingkan dengan media aeroponik baik jumlah total Zn maupun persen kelimpahan relatifnya. Sebaliknya jumlah total Zn untuk spesi ZnA2 pada media pot lebih kecil dibandingkan pada media aeroponik. Adapun
untuk spesi ZnA3 tidak ditemukan pengaruh perbedaan media tanam yang
signifikan terhadap jumlah total Zn dalam spesi tersebut.
Secara keseluruhan dapat disimpulkan metode fraksinasi SEC dan pendeteksian selektif unsur ICP-QMS yang diterapkan telah berhasil mendeteksi spesi Zn dalam cairan floem tanaman jarak dengan baik dan persen perolehan kembali (recovery) yang tinggi dengan menggunakan sampel cairan floem dari tanaman jarak yang berbeda dan kultur tanam yang berbeda serta waktu analisis yang berbeda.
Pada Tabel IV. 8 dan Gambar IV. 18 dapat dilihat profil distribusi spesi Mo dalam cairan floem tanaman Jarak menggunakan kolom sephadex G-50 SF. Ada dua spesi Mo yang dapat dideteksi dengan mudah, yaitu spesi MoA1 yang terdeteksi
pada volume mati dan puncak spesi MoA2 yang terdeteksi pada volume elusi 316
mL. Seperti halnya spesi pertama unsur lainnya, spesi MoA1 merupakan spesi
Tabel IV. 8 Distribusi Spesi Mo dalam cairan floem tanaman Jarak (Ricinus communis L.)*.
Kelimpahan relatif (%) Spesi Berat molekul relatif
(Da) Aeroponik Pot
MoA1 > 44.000 1,97 5,87 ± 0,84
MoA2 < 1350 98,03 94,13 ± 0,84
*Pemisahan dilakukan dengan menggunakan SEC pada kolom Sephadex G-50 SF, buffer 20 mM MES/ 1 mM NaN3 pH 8,0. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Perbedaan media tanam tidak berpengaruh terhadap profil elusi spesi Mo namun berbeda nyata terhadap jumlah total Mo dalam setiap spesi. Spesi MoA1 terdapat
kurang lebih lima kali lebih besar dan spesi MoA2 sepuluh kali lebih besar dalam
cairan floem tanaman jarak dengan media aeroponik dibandingkan dengan media pot. Hal ini menunjukkan adanya perbedaan yang signifikan terhadap penyerapan Mo dengan media aeroponik dan media pot. Dengan media aeroponik Mo terserap lebih banyak oleh pembuluh akar tanaman jarak yang konsekuensinya meningkatkan jumlah kandungan Mo dalam cairan floem.
Kelimpahan relatif spesi MoA1 pada media aeroponik hanya sekitar 2% jika
dibandingkan dengan media pot yang dapat mencapai sampai 7% relatif terhadap spesi MoA2. Hasil penelitian ini menunjukkan kemungkinan pembentukan spesi
MoA1 yang merupakan makromolekul lebih lambat dibandingkan dengan sintesis
spesi MoA2 yang berat molekul relatifnya di bawah 1 kDa.
Pada Gambar IV. 19 dan Tabel IV. 9 dapat dilihat profil elusi spesi Cd dalam cairan floem tanaman jarak. Minimal ada 5 spesi Cd dalam sampel tersebut, yaitu CdA1, CdA2, CdA3, CdA4, dan CdA5 dengan berat molekul masing-masing besar dari
44 kDa, 15560 ± 2000 Da, 2057 ± 300 Da, dan dua spesi terakhir dibawah 1350 Da. Secara keseluruhan terlihat bahwa konsentrasi spesi Cd dalam cairan floem tanaman jarak yang ditumbuhkan dengan menggunakan media aeroponik lebih tinggi dibandingkan dengan menggunakan media pot seperti halnya pada spesi Mo.
Gambar IV. 18 Profil distribusi spesi Mo pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 500 µL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0; kultur tanaman (a) aeroponik dan (b) pot.
Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Gambar IV. 19 Profil distribusi spesi Cd pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 500 µL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0; kultur tanaman (a) aeroponik dan (b) pot.
Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
0.00 0.01 0.02 0.03 0.04 0.05 0 100 200 300 400 500 600 700 Volume elusi (mL) K o nsentra si/ fraksi (µ g/ L ) (a) aeroponik (b) pot CdA1 CdA5 CdA4 CdA3 CdA2 0 2 4 6 8 10 12 14 0 100 200 300 400 500 600 700 Volume elusi (mL) K o nsentra si/frak si (µg/L) (a) aeroponik (b) pot MoA1 MoA2
Tabel IV. 9 Distribusi Spesi Cd dalam cairan floem tanaman Jarak (Ricinus communis L.).
Kelimpahan relatif (%) Spesi Berat molekul relatif
(Da) Aeroponik Pot
CdA1 > 44.000 10,37 7,13 ± 3,00
CdA2 15560 ± 2000 25,58 15,42 ± 2,87
CdA3 2377 ± 300 41,67 62,78 ± 1,11
CdA4 < 1350 8,51 13,95 ± 0,22
CdA5 < 1350 13,86 2,55 ± 1,57
*Pemisahan dilakukan dengan menggunakan metode SEC pada kolom Sephadex G-50 SF, buffer 20 mM MES/ 1mM NaN3 pH 8,0. Pendeteksian selektif unsur dilakukan menggunakan ICP-QMS.
Kemungkinan ada korelasi positif yang kuat antara Cd dan sulfur dalam cairan floem yang terbukti karena kemiripan profil elusinya. Terutama untuk spesi CdA1
yang terdeteksi juga pada volume mati seperti spesi SA1, CdA2 yang berkorelasi
dengan spesi SA4, spesi CdA3 dengan spesi SA8 dan spesi CdA4 dengan spesi SA9.
hanya spesi CdA5 yang tidak berkorelasi positif dengan profil elusi sulfur.
Kemungkinan CdA5 adalah Cd dalam bentuk ionik. Grill dkk. (1985 dalam
Günther dan Kastenholz, 2005) menyatakan ada sebagian kecil spesi Cd yang berikatan dengan protein dengan berat molekul besar dari 30 kDa. Telah ditemukan juga protein yang mengikat Cd dengan berat molekul relatif sekitar 3100 Da dan adanya kandungan sistein sebesar 40 % dari akar jagung (Rauser, 1984 dalam Günther dan Kastenholz, 2005). Informasi ini semakin mendukung hasil penelitian ini dan adanya kemungkinan interaksi Cd dengan sulfur pada spesi Cd dalam cairan floem tanaman jarak.
IV.4.5 Penentuan protein dalam cairan floem dan fraksi SEC
Tujuan utama penentuan protein dalam cairan floem dan fraksi SEC adalah untuk melihat profil elusi protein dalam cairan floem setelah melewati kolom SEC. Konsentrasi protein ditentukan dengan metode Bradford. Standar protein yang digunakan untuk pembuatan kurva kalibrasi adalah albumin serum sapi (BSA, bovine serum albumin). Pengukuran konsentrasi protein dalam fraksi dilakukan
sesegera mungkin setelah proses fraksinasi untuk menghindari terjadinya kerusakan protein dan digunakan larutan standar protein segar setiap saat pengukuran. Pada Gambar IV. 20 dapat dilihat salah satu kurva kalibrasi larutan standar yang digunakan untuk penentuan konsentrasi protein dalam cairan floem dan fraksi SEC.
Gambar IV. 20 Salah satu kurva kalibrasi yang digunakan untuk penentuan konsentrasi protein dalam cairan floem dan fraksi SEC berdasarkan metode Bradford.
Konsentrasi protein dalam cairan floem yang telah terdistribusi dalam fraksi SEC setelah melewati kolom sephadex G-50 terlalu rendah sehingga tidak dapat ditampilkan profil elusinya. Hal ini disebabkan karena kandungan protein dalam cairan floem tanaman jarak hanya sekitar 125 ± 20 µg/mL dan tingginya faktor pengenceran sampel selama melewati kolom dan pada saat penentuan konsentrasi protein menyebabkan konsentrasi protein dalam fraksi tidak terdeteksi.
Salah satu aspek penting dalam proses spesiasi adalah mempertahankan spesi dalam bentuk aslinya dan mencegah terjadinya transformasi spesi maupun hilangnya spesi selama proses spesiasi. Salah satu proses pengujian yang dilakukan adalah pengujian kemungkinan teradsorpsi/transformasi spesi yang berasosiasi dengan protein. Oleh karena itu, larutan standar protein thyroglobulin
y = 0.0269 x + 0.0076 R2 = 0.9935 0.0 0.2 0.4 0.6 0.8 1.0 1.2 0 5 10 15 20 25 30 35 40 Konsentrasi protein (µg/mL) Absorbansi pada 5 95 nm
(670 kDa) dilewatkan melalui kolom dan ditentukan konsentrasinya dalam setiap fraksi. Pada Gambar IV. 21 ditampilkan profil elusi protein standar setelah melewati kolom sephadex G-50. Sebagai hasil eksperimen, thyroglobulin terelusi pada volume mati dengan persen perolehan kembali 95,89 %. Hal ini menunjukkan kemungkinan adsorpsi protein oleh kolom sangat kecil.
Gambar IV. 21 Profil distribusi protein thyroglobulin pada kolom sephadex G-50. Kondisi fraksinasi: jumlah sampel: 1000 µL thyroglobulin 2,18 mg/mL; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0;
Pendeteksian protein berdasarkan metode Bradford. Jumlah total protein yang terdeteksi 290,329 µg/mL dengan persen perolehan kembali 95,89%.
IV.4.6 Profil Elusi spesi Mg, Ca, Mn, Zn, Mo, dan Cd setelah melalui kolom sephadex G-25 M
Untuk melihat kesesuaian profil elusi protein dan spesi logam yang dianalisis, digunakan kolom yang lebih kecil yaitu sephadex G-25. Keuntungan penggunaan kolom ini adalah fraksinasi dapat berlangsung lebih cepat (kurang lebih satu jam) sehingga analisis protein dapat dilakukan pada hari yang sama. Keuntungan lain
0 40 80 120 160 200 0 100 200 300 400 500 Volume elusi (mL) Ko nse n tras i prot ein (µg/m l)
adalah penggunaan kolom yang kecil hanya memerlukan sampel cairan floem relatif lebih sedikit dan faktor pengenceran sampel yang tidak terlalu besar. Profil elusi protein dalam cairan floem setelah melewati kolom sephadex G-25 ditampilkan pada Gambar IV. 22.
Gambar IV. 22 Profil distribusi protein cairan floem pada kolom sephadex G-25. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; buffer: 20 mM NaCl/ 1 mM NaN3 pH 8,0; Pendeteksian protein
berdasarkan metode Bradford. Jumlah total protein yang terdeteksi 144,536 µg/mL. Persen perolehan kembali protein 87,64%.
Pada Gambar IV. 22 terlihat bahwa protein terelusi sebagai satu puncak pada volume elusi 0,5 – 1,5 mL. Persen perolehan kembali protein tersebut setelah melalui kolom sephadex G-25 M sebesar 87,64 % dengan jumlah total protein sebesar 144,536 µg/mL. Untuk melihat korelasi profil elusi protein dan profil elusi unsur setelah melewati kolom, pada Gambar berikutnya daerah elusi protein yaitu pada volume elusi 0,5 – 1,5 mL akan diarsir. Profil protein yang sama juga telah dikemukakan oleh Krüger dkk. (2002). Hal ini menunjukkan bahwa tidak ada perbedaan profil protein cairan floem kecambah dan tanaman dewasa jarak.
-5 15 35 55 75 95 0.0 1.0 2.0 3.0 4.0 Volume elusi (mL) K ons entras i protein (µg/m L )
Pada Gambar IV. 23 terlihat bahwa secara keseluruhan hanya terdapat dua puncak yaitu spesi utama MgB2 dan spesi MgB3. Spesi MgB1 tidak dapat dipisahkan dari
spesi MgB2 mengingat kecilnya kelimpahan relatif spesi tersebut. Jika
dibandingkan puncak pertama spesi Mg sebelum dan sesudah destruksi, terlihat puncak tersebut mulai muncul pada volume elusi 0,9 mL sebelum destruksi dan 1,2 mL setelah destruksi. Pada kolom kecil seperti sephadex G-25 yang digunakan, perbedaan volume elusi dalam satuan 0,1 mL dapat menunjukkan rentang berat molekul yang sangat besar, terutama pada volume elusi 0,5 – 1,5 mL.
Gambar IV. 23 Profil distribusi Mg pada kolom sephadex G-25 sebelum dan sesudah destruksi dengan proteinase. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. MgB1 kemungkinan spesi Mg yang berasosiasi
dengan protein yang terdestruksi setelah uji proteinase. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; buffer: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Penghitungan total konsentrasi dan kelimpahan relatif spesi Mg pada daerah serapan 0,9-1,2 mL pada pemisahan sebelum destruksi menunjukkan kemungkinan terdapatnya spesi MgB1 yang kemudian terdestruksi setelah uji
0 40 80 120 160 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Volume elusi (mL) Konsentrasi/fraksi (mg/L)
(a) Mg sebelum destruksi (b) Mg setelah destruksi
MgB1
MgB3
proteinase. Hasil penelitian ini bersesuain dan menguatkan penemuan spesi Mg dalam cairan floem yang dipisahkan dengan menggunakan kolom sephadex G-50 dimana ditemukan juga 3 spesi Mg dengan profil sebaran kelimpahan yang tidak berbeda jauh. Sehingga dengan demikian dapat dikatakan bahwa spesi MgB1,
MgB2, dan MgB3 yang terdeteksi dengan menggunakan kolom sephadex G-25
bersesuaian dengan berturut-turut spesi MgA1, MgA2, dan MgA3 yang ditemukan
setelah pemisahan dengan kolom sephadex G-50.
Pada Gambar IV. 24 ditampilkan profil distribusi Ca pada kolom sephadex G-25. Terdeteksi hanya dua spesi Ca, yang diberi notasi sebagai spesi CaB1 da CaB2.
Spesi CaB1 terdeteksi pada daerah arsiran, yang menunjukkan adanya
kemungkinan spesi CaB1 berasosiasi dengan polipeptida /protein yang mana spesi
ini terdestruksi setelah uji proteinase. Kemungkinan pengikatan kalsium oleh protein telah banyak dibahas. Kalmodulin merupakan salah satu protein kecil yang mengikat Ca. Pengikatan tersebut mengubah bentuk kalmodulin sedemikian rupa sehingga kemudian Kalmodulin dapat mengaktifkan beberapa enzim (Salisbury dan Ross, 1995; Zhang dan Lu, 2003).
Adapun spesi CaB2 kemungkinan akumulasi dari spesi CaA2 dan CaA3 berdasarkan
perhitungan kelimpahan relatifnya. Interpretasi ini juga didukung berdasarkan data berat molekul relatif spesi CaA2 dan CaA3 (kurang dari 1350 Da) yang tidak
dapat dipisahkan dengan menggunakan kolom sephadex G-25.
Pada Gambar IV. 25 ditampilkan profil elusi Mn pada kolom sephadex G-25 M. Terdeteksi secara nyata dua spesi Mn yaitu MnB1 dan MnB2, dimana sebagian
spesi MnB1 terdestruksi setelah uji proteinase K. Profil elusi Mn berupa tailing
setelah destruksi yang pada akhir elusi menunjukkan dengan kuat profil elusi ion Mn2+ sebagai hasil destruksi sebagian spesi MnB1. Jika diperhatikan tingginya
kelimpahan relatif spesi MnB1 yang dapat mencapai 16%, diperkirakan MnB1
Spesi MnB2 kemungkinan merupakan akumulasi dari sebagian spesi MnA2 dan
MnA3.
Gambar IV. 24 Profil distribusi Ca pada kolom sephadex G-25 sebelum dan sesudah destruksi dengan proteinase. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. CaB1 kemungkinan spesi Ca yang berasosiasi
dengan protein yang terdestruksi setelah uji proteinase. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; buffer: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
Van Goor dan Wiersma (1976) telah meneliti bentuk kimiawi Mn dan Zn dalam cairan floem tanaman jarak yang berusia 2 bulan. Penelitian ini menggunakan isotop 54Mn dan 65Zn yang dicampurkan ke dalam larutan nutrisi. Pemisahan dilakukan pada kolom sephadex G-10, G15 dan G-25 menggunakan buffer Tris-HCl pH 8,2. Isotop 54Mn dan 65Zn dalam fraksi dideteksi menggunakan pencacah gamma. Hasil penelitiannya menunjukkan Mn muncul dalam dua bentuk, yaitu sebagai kation Mn dan senyawaan organik dengan berat molekul 1-5 kDa. Informasi ini mendukung hasil penelitian yang diperoleh, dimana terdeteksi dua spesi Mn dengan profil elusi yang mirip.
0 10 20 30 40 50 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Volume elusi (mL) K ons en tr as i/f ra k si (m
g/L) (a) Ca sebelum destruksi
(b) Ca setelah destruksi
CaB1
Gambar IV. 25 Profil distribusi Mn pada kolom sephadex G-25 sebelum dan sesudah destruksi dengan proteinase. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. Sebagian spesi MnB1 kemungkinan spesi Mn yang
berasosiasi dengan protein yang terdestruksi setelah uji proteinase. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; buffer: 20 mM NaCl/ 1 mM NaN3 pH 8,0;
Krüger dkk.(2002) telah melakukan pemisahan spesi Zn dalam cairan floem kecambah jarak menggunakan kolom NAP-5 dan fasa gerak MES (volume elusi 0,5 mL). Dalam penelitian tersebut Zn terdeteksi sebagai satu spesi pada fraksi dengan berat molekul rendah. Profil elusi Zn tersebut bersesuaian dengan profil elusi sukrosa dalam cairan floem kecambah jarak.
Pada penelitian ini (Gambar IV. 26) terdeteksi 3 spesi Zn yaitu ZnB1, ZnB2 dan
ZnB3 dengan kelimpahan relatif berturut-turut 4-5 %, 9-11%, dan 83-86%.
Pendeteksian ketiga spesi Zn ini menunjukkan bahwa metode yang dikembangkan telah berhasil memisahkan dan mendiferensiasikan spesi Zn yang dideteksi oleh Krüger dkk menjadi 3 spesi yang berbeda berdasarkan berat molekulnya.
0 100 200 300 400 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Volume elusi (mL) Ko nsen tr a si/ frak si (mg /L)
(a) Mn sebelum destruksi (b) Mn setelah destruksi MnB2
Gambar IV. 26 Profil distribusi Zn pada kolom sephadex G-25 sebelum dan sesudah destruksi dengan proteinase. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; buffer: 20 mM NaCl/ 1 mM NaN3 pH 8,0;
Pada pemisahan sebelumnya dengan menggunakan kolom sephadex G-50 SF juga ditemukan tiga spesi Zn dengan kelimpahan yang relatif sama. Hal ini menunjukkan adanya kemungkinan bahwa spesi ZnB1 merupakan ZnA1, ZnB2 serta
ZnB3 identik dengan ZnA2 dan ZnA3. Walaupun spesi ZnB1 dan ZnB2 berada pada
daerah arsiran elusi protein, tidak teramati perbedaan profil elusi sebelum dan sesudah destruksi. Hal ini menunjukkan bahwa spesi ZnB1 dan ZnB2 tidak
berasosiasi dengan polipeptida atau protein. Hipotesa ini mendukung pernyataan Krüger dkk (2002), dimana sebagian kecil fraksi Zn kemungkinan berasosiasi dengan ligan yang lebih besar dibanding sukrosa. Van Goor dan Wiersma (1976) juga mendeteksi Zn sebagai satu spesi yang kemungkinan berasosiasi dengan senyawaan organik. Menurut Van Goor dan Wiersma spesi tersebut bermuatan negatif.
Gambar IV. 27 memperlihatkan profil elusi Mo pada kolom sephadex G-25 M. Terdeteksi dua spesi Mo yaitu MoB1 dan MoB2. berdasarkan kelimpahan
relatifnya, kemungkinan spesi MoB1 merupakan akumulasi dari spesi MoA1 dan 0 1000 2000 3000 4000 5000 0.0 0.8 1.6 2.4 3.2 4.0 Volume elusi (mL) Kon sen trasi/frak si (µg /L)
(a) Zn sebelum destruksi (b) Zn setelah destruksi
ZnB2
ZnB1
sebagian spesi MoA2, sedangkan spesi MoB2 merupakan sebagian lain dari spesi
MoA2.
Gambar IV. 27 Profil distribusi Mo pada kolom sephadex G-25 sebelum dan sesudah destruksi dengan proteinase. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. MoB1 kemungkinan spesi Mg yang berasosiasi
dengan protein yang terdestruksi setelah uji proteinase. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; buffer: 20 mM NaCl/ 1 mM NaN3 pH 8,0;
Hasil penelitian ini menunjukkan bahwa spesi MoA2 kemungkinan terdiri dari
beberapa spesi Mo yang berbeda dengan berat molekul kecil dari 1000 Da. Spesi ini kemungkinan ada yang berikatan dengan polipeptida/protein seperti yang ditunjukkan pada Gambar IV. 27, dimana spesi tersebut terdestruksi setelah uji proteinase dan ada yang tidak berasosiasi dengan polipeptida/protein. Profil tailing pada akhir elusi setelah destruksi dengan proteinase K, menunjukkan meningkatnya jumlah Mo dalam bentuk kation, memperkuat dugaan bahwa Mo dalam spesi MoB1 terdestruksi menjadi Mo ionik.
Profil elusi Cd pada kolom sephadex G-25 M sebelum destruksi dengan proteinase K hanya menampilkan satu puncak lebar pada volume elusi 0,8 – 2,2
0.0 10.0 20.0 30.0 40.0 50.0 0.0 0.8 1.6 2.4 3.2 4.0 Volume elusi (mL) Konsentrasi/ fraksi (µ g/L )
(a) Mo sebelum destruksi (b) Mo setelah destruksi
MoB2
mL yang diberi notasi CdB1 dengan konsentrasi maksimum pada volume elusi 1,2
mL (Gambar IV. 28). Jika dibandingkan dengan pemisahan yang dilakukan pada kolom sephadex G-50, ada kemungkinan bahwa spesi CdB1 merupakan akumulasi
dari semua spesi yang terdeteksi pada kolom G-50 SF. Pertanyaan yang muncul adalah mengapa hanya muncul satu puncak Cd setelah pemisahan dengan kolom Sephadex G-25 M sedangkan pemisahan dengan kolom sephadex G-50 SF ada lima spesi yang terdeteksi. Setelah mengamati dengan seksama profil elusi kelimpahan relatif yang kemudian divisualisasikan pada Gambar IV. 29 terlihat dengan jelas bahwa sebaran Cd membentuk suatu puncak yang bersesuaian dengan puncak CdB1.
Gambar IV. 28 Profil distribusi Cd pada kolom sephadex G-25 sebelum dan sesudah destruksi dengan proteinase. Daerah yang diarsir pada volume elusi 0,5-1,5 mL merupakan daerah elusi protein dalam cairan floem. Sebagian spesi CdB1 kemungkinan spesi Cd yang
berasosiasi dengan protein yang terdestruksi setelah uji proteinase. Kondisi fraksinasi: jumlah sampel: 100 µL floem aeroponik; fasa gerak: 20 mM NaCl/ 1 mM NaN3 pH 8,0.
0.0 0.2 0.4 0.6 0.8 1.0 0.0 0.8 1.6 2.4 3.2 4.0 Volume elusi (mL) Kon sentrasi/fraks i (µg /L)
(a) Cd sebelum destruksi (b) Cd setelah destruksi
Gambar IV. 29 Profil distribusi kelimpahan Cd pada kolom sephadex G-50.
Profil elusi spesi CdB1 berkorelasi positif dengan profil elusi protein dalam cairan
floem. Setelah uji proteinase K, terlihat bahwa spesi CdB1 tereduksi yang
menunjukkan bahwa sebagian spesi CdB1 yang berada pada daerah arsiran
kemungkinan berasosiasi dengan protein. Hal ini diperkuat dengan terbentuknya ekor (tailing) pada akhir elusi yang menunjukkan meningkatnya jumlah kation Cd setelah destruksi dibandingkan sebelum destruksi.
IV.5 Pemisahan spesi Mg, Ca, Mn, Zn, Mo dan Cd dalam cairan floem dengan QPNC PAGE
Spesi Mg, Ca, Mn, Zn, Mo dan Cd dalam cairan floem dipisahkan juga dengan menggunakan metode QPNC PAGE. Metode ini diadopsi dari Kastenholz (2004; 2006; 2007). Dalam percobaan ini fasa gerak yang digunakan adalah MES sedangkan Kastenholz menggunakan buffer Tris-HCl. Hasil pemisahan spesi-spesi tersebut dapat dilihat pada Gambar IV. 30. Gambar tersebut terdiri atas tiga kurva , pada bagian A ditampilkan profil elusi spesi Mg; pada bagian B dapat dilihat profil elusi Ca dan Zn serta pada bagian C profil elusi Mn, Mo, dan Cd. Pembagian ini berdasarkan rentang konsentrasi spesi agar hasil penelitian tersebut dapat dianalisis dengan optimal.
0 10 20 30 40 50 60 70
CdA1 CdA2 CdA3 CdA4 CdA5
spesi Cd K el impah an re lat if (%) a) aeroponik b) pot
Gambar IV. 30 Profil elusi spesi Mg (A), Ca dan Zn (B) dan Mn, Mo, dan Cd setelah pemisahan PNC PAGE. Kondisi fraksinasi: jumlah sampel: 500 µL floem aeroponik; buffer: 20 mM MES/ 1 mM NaN3 pH 8,0.