KARAKTERISASI BAKTERI DENITRIFIKASI
YANG DIISOLASI DARI KOLAM IKAN AIR TAWAR
PROVINSI RIAU DAN JAMBI
TIARA APRILLINDA DEWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi Bakteri Denitrifikasi yang Diisolasi dari Kolam Ikan Air Tawar Provinsi Riau dan Jambi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014 Tiara Aprillinda Dewi NIM G34100104
ABSTRAK
TIARA APRILLINDA DEWI. Karakterisasi Bakteri Denitrifikasi yang Diisolasi dari Kolam Ikan Air Tawar Provinsi Riau dan Jambi. Dibimbing oleh IMAN RUSMANA dan YUNI PUJI HASTUTI.
Kualitas air pada kolam ikan air tawar yang menurun dapat disebabkan oleh endapan sisa pakan ikan buatan yang diberikan secara berlebih. Masalah tersebut dapat diatasi dengan bioremediasi menggunakan bakteri denitrifikasi. Penelitian ini bertujuan melakukan karakterisasi aktivitas bakteri denitrifikasi yang berasal dari kolam ikan air tawar di Provinsi Riau dan Jambi dalam mereduksi nitrat. Metode yang dilakukan meliputi peremajaan dan karakterisasi bakteri, uji fermentatif/oksidatif, uji aktivitas reduksi nitrat, dan kinetika reduksi nitrat. Isolat yang dikarakterisasi sebanyak 19 dengan dominasi bentuk sel basil dan seluruh isolat merupakan Gram negatif. Uji selanjutnya yaitu uji fermentatif/oksidatif didapatkan 11 isolat yang merupakan bakteri oksidatif dan sebanyak 8 isolat merupakan bakteri fermentatif. Isolat yang bersifat oksidatif diuji aktivitas reduksi nitrat dan didapatkan reduksi nitrat tertinggi pada kondisi anaerob isolat RD1 dengan persentase 102%. Berdasarkan kinetika reduksi nitrat pada isolat RD1 diperoleh kecepatan maksimum reduksi sebesar 69.44 uM/Jam. Kata kunci: denitrifikasi, Jambi, pakan ikan, Riau
ABSTRACT
TIARA APRILLINDA DEWI. Characterization of Denitrifying Bacteria Isolated from Freshwater Ponds in Riau and Jambi Province. Supervised by IMAN RUSMANA and YUNI PUJI HASTUTI.
Decreasing of water quality freshwater ponds is caused by accumulation of artificial fish-feed. These problems can be solved by bioremediation using denitrifying bacteria. The aim of this study was to characterize the activities of denitrifying bacteria in reducing nitrate from freshwater ponds in Riau and Jambi province. The methods used in this study were the regeneration and characterization of bacteria, fermentative/oxidative test, nitrate reduction activity test, and nitrate reduction kinetics. There were 19 characterized isolates and most of them were basil cells and all of them were Gram-negative bacteria isolates. In fermentative/oxidative test, there were 11 oxidative bacteria and 8 fermentative bacterial isolates. The highest nitrate reduction activity of oxidative bacteria was found in RD1. It could reduce nitrate up to 102% in anaerob condition. RD1 isolate had maximum rate (Vmax) of nitrate reduction of 69.44 uM/Hour.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
KARAKTERISASI BAKTERI DENITRIFIKASI
YANG DIISOLASI DARI KOLAM IKAN AIR TAWAR
PROVINSI RIAU DAN JAMBI
TIARA APRILLINDA DEWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Topik yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 ini ialah Karakterisasi Bakteri Denitrifikasi yang Diisolasi dari Kolam Ikan Air Tawar Provinsi Riau dan Jambi.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana MSi dan Ibu Yuni Puji Hastuti SPi, MSi selaku pembimbing serta Ibu Dra Hilda Akmal MSi yang telah memberikan wawasan dan saran kepada penulis. Di samping itu, penghargaan penulis sampaikan kepada Bapak Jaka dan Ibu Heni dari Laboratorium Mikrobiologi Departemen Biologi IPB yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, seluruh keluarga serta teman-teman, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2014 Tiara Aprillinda Dewi
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
METODE 2
Bahan dan Alat 2
Prosedur Analisis Data 2
HASIL DAN PEMBAHASAN 3
Hasil 3 Pembahasan 8 SIMPULAN 9 DAFTAR PUSTAKA 9 LAMPIRAN 11 RIWAYAT HIDUP 12
DAFTAR TABEL
1 Morfologi dan karakteristik isolat bakteri denitrifikasi 4
2 Hasil uji fermentatif/oksidatif 6
3 Aktivitas reduksi nitrat pada 11 isolat terpilih 7
DAFTAR GAMBAR
1 Morfologi Koloni Isolat a) RCS1 b) AA1 dan c) RD1 pada media
denitrifikasi 5
2 Hasil Pewarnaan Gram pada isolat AA1 dan RD1 5
3 Grafik laju penurunan nitrat dan akumulasi nitrit 7
DAFTAR LAMPIRAN
1 Kurva Standar Nitrat 11
1
PENDAHULUAN
Latar Belakang
Budidaya ikan air tawar merupakan salah satu jenis budidaya yang berkembang setiap tahunnya, sejak tahun 2007 perkembangan produksi ikan air tawar semakin meningkat. Kenaikan rata-rata produksi ikan air tawar pada tahun 2012 mencapai 24.92% (KKP 2013). Provinsi yang menghasilkan lebih dari separuh ikan air tawar di Indonesia diantaranya adalah Provinsi Riau dan Jambi. Provinsi Riau memiliki luas perairan budidaya air tawar seluas 8200 Ha dengan realisasi lahan seluas 3685 Ha dan Provinsi Jambi memiliki 3000 Ha dengan realisasi lahan seluas 1606 Ha (KKP 2009). Sistem budidaya perikanan yang banyak digunakan adalah sistem budidaya intensif. Sistem budidaya ini memiliki kelemahan, diantaranya dapat menyebabkan kualitas air kolam ikan air tawar menurun. Hal tersebut terjadi karena pemberian pakan buatan yang berlebih sehingga sisa pakan ikan akan mengendap pada dasar kolam ikan air tawar. Akumulasi sisa pakan yang mengendap akan menghasilkan metabolit toksik yang dapat berpengaruh terhadap kualitas air kolam ikan air tawar tersebut.
Kualitas air yang buruk mengakibatkan tingginya senyawa nitrogen organik yang dihasilkan dan pada akhirnya akan menyebabkan produktivitas kolam ikan air tawar menurun. Kualitas air tersebut dapat diperbaiki dengan cara bioremediasi. Bioremediasi merupakan proses degradasi kontaminan di lingkungan dengan menggunakan metode biologi yang memanfaatkan kemampuan metabolisme mikroorganisme (Scragg 2005). Proses bioremediasi tidak terlepas dari peran mikroorganisme. Salah satunya dengan menggunakan bakteri pereduksi nitrat melalui denitrifikasi. Denitrifikasi adalah reduksi nitrat (NO3-) menjadi NO2-, NO, N2O, dan N2 dengan bantuan enzim nitrat dan nitrit reduktase. Proses reduksi nitrat berjalan optimum pada kondisi tidak ada oksigen. N2O adalah produk utama dari denitrifikasi pada perairan dengan kadar oksigen yang sangat rendah sedangkan molekul nitrogen adalah produk utama dari proses denitrifikasi pada perairan yang memiliki kondisi anaerob (Effendi 2003). Denitrifikasi merupakan langkah terakhir dalam menyisihkan nitrogen secara biologis dimana nitrat menggantikan oksigen sebagai akseptor elektron terakhir (Pranoto 2006).
Proses pengendalian masalah lingkungan tersebut pada beberapa spesies tertentu menghasilkan produk akhir N2O yang dapat menyebabkan pemanasan global. Oleh karena itu diperlukan seleksi terhadap aktivitas bakteri denitrifikasi dari kolam ikan air tawar, sebagai tahap awal pemanfaatan bakteri tersebut sebagai agen bioremediasi yang dapat memperbaiki kualitas kolam ikan air tawar.
Tujuan Penelitian
Tujuan penelitian ini adalah melakukan karakterisasi bakteri denitrifikasi yang berasal dari kolam ikan air tawar yang berasal dari Provinsi Riau dan Jambi.
2
Manfaat Penelitian
Penelitian ini diharapkan sebagai langkah awal dalam seleksi aktivitas bakteri denitrifikasi sebagai agen bioremediasi dan untuk mendapatkan isolat potensial yang dapat menurunkan kadar nitrat pada kolam ikan air tawar.
METODE
Bahan dan Alat
Bahan yang digunakan meliputi 19 isolat bakteri denitrifikasi yang berasal dari Provinsi Riau dan Provinsi Jambi. Kode isolat huruf depan R untuk isolat dari Provinsi Riau dan J isolat dari Provinsi Jambi. Media cair dan padat selektif denitrifikasi yang digunakan terdiri dari (gr/l): 10 Na Asetat, 5 KNO3, 0.5 (NH4)2SO4, 0.2 KH2PO4, 0.92 K2HPO4, 0.1 CaCl2.2H2O, 0.5 MgSO4.3H2O dan 0.2 EDTA (Rodina 1972), media semi padat uji fermentatif/oksidatif (Hugh dan Leifson 1953). Alat yang digunakan dalam penelitian ini meliputi Laminar Air Flow Cabinet, spektrofotometer, autoklaf dan peralatan laboratorium lainnya.
Prosedur Analisis Data Peremajaan Bakteri dan Karakterisasi Morfologi
Isolat bakteri dimurnikan dengan menggunakan metode gores kuadran pada media selektif denitrifikasi dan diambil satu koloni murni yang terpisah. Setelah itu isolat digoreskan pada media agar miring sebagai biakan stok dan selanjutnya diamati bentuk, warna, tepian dan elevasi koloni isolat. Karakterisasi bentuk sel dan Gram sel diamati dengan pewarnaan Gram (Hadioetomo 1983). Uji Fermentatif/Oksidatif
Uji ini digunakan untuk memastikan bahwa isolat bukan termasuk bakteri fermentatif. Sebanyak satu lup isolat diinokulasikan pada media semi padat fermentatif/oksidatif (Hugh dan Leifson 1953). Untuk menciptakan suasana anaerob, media diisi satu tabung penuh dan di bagian atas tabung diberi minyak parafin kemudian diinkubasi selama 3 hari. Perubahan warna dari warna biru menjadi berwarna kuning menunjukkan hasil fermentatif, sedangkan untuk hasil oksidatif warna media tetap berwarna biru.
Analisis Nitrat dan Nitrit
Analisis nitrat dilakukan dengan mengambil 2 mL sampel yang ditambahkan 0.2 mL NaCl solution, 1 mL H2SO4 80%, 0.05 brucine sulfanic acid dan dipanaskan pada suhu 95oC selama 20 menit (Rand et al. 1979). Konsentrasi nitrat diukur menggunakan spektrofotometer dengan panjang gelombang 410 nm, sedangkan untuk analisis nitrit 2 mL sampel ditambahkan colour reagent sebanyak 0.08 mL (Eaton et al. 2005). Absorbansi diukur pada panjang gelombang 543 nm. Sebelum dilakukan analisis, terlebih dahulu dibuat kurva standar nitrat (Lampiran 1) dan kurva standar nitrit (Lampiran 2).
3 Uji Aktivitas Reduksi Nitrat
Sebanyak satu lup isolat diinokulasikan pada 10 mL media denitrifikasi dengan konsentrasi nitrat sebesar 16510.52 µM, lalu diinkubasi selama 7 hari dalam kondisi aerobik dan anaerobik. Tabung yang tertutup dihembuskan gas N2 dengan menggunakan syringe selama 3 menit untuk menciptakan kondisi anaerob. Inkubasi dilakukan pada inkubator berpenggoyang dengan suhu 28oC-30oC dan kecepatan 75 rpm. Masing-masing perlakuan diberikan kontrol. Setelah masa inkubasi, sebanyak 2 mL isolat disentrifuge, lalu pelet diambil untuk dilakukan analisis nitrat dan nitrit. Jumlah nitrat yang direduksi dan nitrit yang dihasilkan dihitung menggunakan rumus sebagai berikut:
Kinetika Reduksi Nitrat
Isolat yang memiliki kemampuan mereduksi nitrat yang paling tinggi dipilih untuk tahap selanjutnya yaitu pada tahap kinetika reduksi nitrat. Isolat diinkubasi selama 7 hari pada 100 mL media denitrifikasi. Sebanyak 2 mL kultur bakteri diinokulasikan ke dalam 50 mL media denitrifikasi dengan konsentrasi nitrat 100, 500, 1000, 2000 µM dan diinkubasi dalam keadaan anaerob di inkubator berpenggoyang selama 3 jam. Analisis kadar nitrat dilakukan pada selang waktu 3 jam dan dihitung menggunakan persamaan Michaelis-Menten (White 1995).
HASIL DAN PEMBAHASAN
Hasil
Peremajaan dan Karakterisasi Morfologi Bakteri
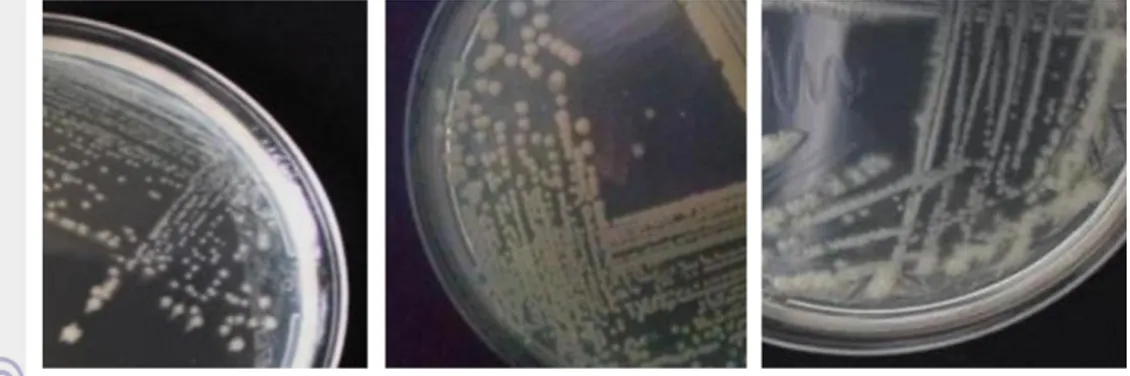
Isolat bakteri tumbuh maksimal pada hari ke-4 inkubasi. Berdasarkan hasil pengamatan morfologi didapatkan isolat dengan bentuk koloni bundar dan warna koloni kekuningan mendominasi (Gambar 1). Hasil pewarnaan gram juga menunjukkan bahwa 19 isolat merupakan bakteri Gram negatif serta didominasi oleh bentuk sel basil (Tabel 1) (Gambar 2).
4
Tabel 1 Morfologi dan karakteristik isolat bakteri denitrifikasi
No Isolat
Morfologi Koloni Sel
Bentuk Warna Tepian Elevasi Pewarnaan
Gram Bentuk
1 RD2 Bundar Kuning Licin Cembung Negatif Kokus
2 RDS1 Bundar Krem
Kekuningan Licin Datar Negatif Basil
3 RB1 Bundar Krem
Kekuningan Licin Cembung Negatif Kokus
4 RAS2 Bundar Kuning Licin Datar Negatif Basil
5 RB1 Bundar Putih Licin Cembung Negatif Basil
6 RCS1
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Cembung Negatif Basil
7 RD1
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Cembung Negatif Basil
8 RA1 Bundar Kuning Licin Cembung Negatif Basil
9 RC1 Bundar Krem
Kekuningan Licin Cembung Negatif Basil
10 RCS2
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Datar Negatif Basil
11 JBA1
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Cembung Negatif Basil
12 JDA2
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Datar Negatif Basil
13 JAA2 Bundar Kuning Licin Cembung Negatif Basil
14 JBS2 Bundar Putih Licin Cembung Negatif Basil
15 JDA1
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Cembung Negatif Basil
16 JBA2 Bundar Kuning Licin Datar Negatif Basil
17 JAA1 Bundar Krem
Kekuningan Licin Cembung Negatif Basil
18 JCS2
Bundar dengan tepian
timbul
Krem
Kekuningan Licin Cembung Negatif Basil
19 JAS2
Bundar dengan tepian
timbul
Krem
5
Gambar 1 Morfologi koloni isolat a) RCS1 b) AA1 dan c) RD1 pada media denitrifikasi
Gambar 2 Hasil pewarnaan Gram pada isolat AA1 dan RD1
Uji Fermentatif/Oksidatif
Hasil uji fementatif/oksidatif menunjukkan bahwa sebanyak 11 isolat bersifat oksidatif dan 8 isolat bersifat fermentatif. Hal ini ditunjukkan dengan perubahan warna media dari warna biru menjadi kuning.
6
Tabel 2 Hasil uji fermentatif/oksidatif
No. Isolat Uji Fermentatif
1 RD2 Fermentatif 2 RDS1 Fermentatif 3 RB1 Fermentatif 4 RAS2 Oksidatif 5 RB1 Fermentatif 6 RCS1 Oksidatif 7 RD1 Oksidatif 8 RA1 Oksidatif 9 RC1 Oksidatif 10 RCS2 Oksidatif 11 JBA1 Fermentatif 12 JDA2 Oksidatif 13 JAA2 Oksidatif 14 JBS2 Fermentatif 15 JDA1 Fermentatif 16 JBA2 Fermentatif 17 JAA1 Oksidatif 18 JCS2 Oksidatif 19 JAS2 Oksidatif
Uji Aktivitas Reduksi Nitrat
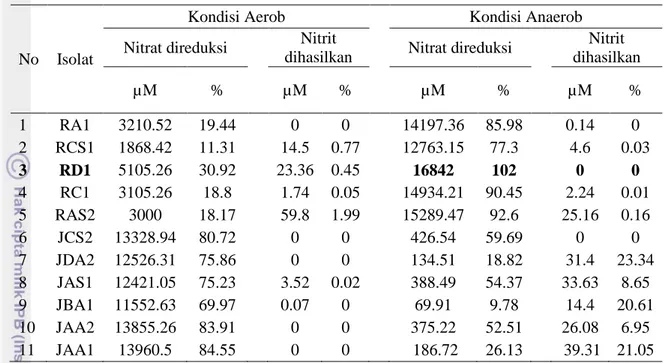
Dari hasil uji aktivitas reduksi nitrat, isolat RD1 dengan nilai sebesar 102% merupakan isolat yang memiliki kemampuan reduksi yang paling tinggi pada kondisi anaerob. Sedangkan pada kondisi aerob, isolat dengan aktivitas reduksi nitrat yang paling tinggi adalah isolat JAA1 yaitu sebesar 84.55%. Isolat yang dapat diuji pada tahap selanjutnya adalah isolat yang memiliki aktivitas paling tinggi dalam mereduksi nitrat yaitu isolat RD1 pada kondisi anaerob.
7 Tabel 3 Aktivitas reduksi nitrat pada 11 isolat terpilih
No Isolat
Kondisi Aerob Kondisi Anaerob
Nitrat direduksi Nitrit
dihasilkan Nitrat direduksi
Nitrit dihasilkan µM % µM % µM % µM % 1 RA1 3210.52 19.44 0 0 14197.36 85.98 0.14 0 2 RCS1 1868.42 11.31 14.5 0.77 12763.15 77.3 4.6 0.03 3 RD1 5105.26 30.92 23.36 0.45 16842 102 0 0 4 RC1 3105.26 18.8 1.74 0.05 14934.21 90.45 2.24 0.01 5 RAS2 3000 18.17 59.8 1.99 15289.47 92.6 25.16 0.16 6 JCS2 13328.94 80.72 0 0 426.54 59.69 0 0 7 JDA2 12526.31 75.86 0 0 134.51 18.82 31.4 23.34 8 JAS1 12421.05 75.23 3.52 0.02 388.49 54.37 33.63 8.65 9 JBA1 11552.63 69.97 0.07 0 69.91 9.78 14.4 20.61 10 JAA2 13855.26 83.91 0 0 375.22 52.51 26.08 6.95 11 JAA1 13960.5 84.55 0 0 186.72 26.13 39.31 21.05
Kinetika Reduksi Nitrat
Berdasarkan hasil uji kinetika reduksi nitrat pada isolat RD1 diperoleh nilai Vmaks sebesar 69.44 µM/Jam dan nilai Km 429.29 µM. Hasil laju rata-rata reduksi nitrat menunjukkan peningkatan dari konsentrasi substrat 100, 500, 1000, 2000, sedangkan laju akumulasi nitrit pada konsentrasi 100, 500, 1000 dan 2000 rendah (Gambar 3).
Gambar 3 Grafik laju penurunan nitrat dan akumulasi nitrit Laju penurunan nitrat ( ), Laju akumulasi nitrit ( )
0 4 8 12 16 20 24 28 0 20 40 60 80 100 100 500 1000 2000 L aj u ak u m u lasi n itr it (uM /Jam ) L aj u r ed u k si n itr at (uM /Jam )
8
Pembahasan
Sembilan belas isolat tumbuh dengan baik pada suhu 28 – 30oC dengan masa inkubasi selama 7 hari. Bakteri denitrifikasi ditumbuhkan pada media yang mengandung sumber karbon seperti asetat. Keberadaan sumber karbon tersebut juga berpengaruh penting pada proses denitrifikasi (Khanitchaidecha et al. 2010). Sumber karbon lain yang dapat digunakan untuk bakteri denitrifikasi heterotrof adalah etanol, metan, glukosa, pepton, gliserol, asam laktat dan molase. Sebanyak 19 isolat bakteri denitrifikasi telah dimurnikan dan diremajakan lalu dikarakterisasi dalam hal morfologi selnya. Hasil pengamatan menunjukkan terdapat bentuk sel basil dan kokus, Gram negatif, dan warna koloni kekuningan. Menurut Holt et al. (1994) pada umumnya bakteri denitrifikasi memiliki bentuk bulat atau batang dan merupakan Gram negatif.
Proses denitrifikasi adalah proses reduksi nitrat (NO3-) menjadi nitrit dengan produk akhir gas N2. Proses ini dapat terjadi pada kebanyakan bakteri anaerob fakultatif yang menggunakan oksigen sebagai penerima elektron selama respirasi, menggunakan nitrat sebagai penerima elektron terakhir apabila dalam kondisi O2 yang rendah. Hampir semua bakteri denitrifikasi merupakan bakteri heterotrof yang menggunakan sumber karbon sebagai sumber energi (Robertson 1999). Terdapat beberapa faktor yang mempengaruhi proses denitrifikasi, diantaranya oksigen, pH, karbon organik dan suhu (Knowles 1982). Perubahan warna pada uji fermentatif/oksidatif merupakan indikator isolat-isolat yang telah dikarakterisasi bersifat fermentatif atau oksidatif. Isolat yang bersifat oksidatif akan menghasilkan asam pada tabung reaksi yang tidak diberi minyak parafin, sedangkan pada tabung reaksi yang diberikan minyak parafin tidak mengalami perubahan warna (Hugh dan Leifson 1953). Delapan isolat yang memiliki sifat fermentatif positif tidak melalui uji selanjutnya, sedangkan sebelas isolat yang bersifat oksidatif dapat melalui uji selanjutnya yaitu analisis aktivitas reduksi nitrat. Rusmana dan Nedwell (2004) melaporkan bahwa proses denitrifikasi dilakukan oleh mikroorganisme dengan tipe metabolisme respirasi dan DNRA dilakukan oleh bakteri yang memiliki sifat fermentatif. Bakteri denitrifikasi memperoleh energi dari fosforilasi oksidatif pada membran sel dengan menggunakan senyawa nitrat sebagai penerima elektron terakhir pengganti oksigen pada respirasi anaerob. Sedangkan pada proses fermentasi mendapat energi yang berasal dari fosforilasi tingkat substrat pada sitosol dengan karbon organik glukosa sebagai penerima elektron terakhir (White 1995).
Aktivitas reduksi nitrat dari sebelas isolat yang diuji menunjukkan bahwa seluruh isolat dapat mereduksi nitrat dengan baik, tetapi kebanyakan isolat tidak memiliki aktivitas yang tinggi dalam mereduksi nitrat. Hanya terdapat satu isolat yang memiliki kemampuan reduksi nitrat yang tinggi, yaitu pada kondisi anaerob isolat RD1. Satu isolat yang memiliki kemampuan yang paling tinggi pada kondisi aerob adalah isolat JAA1. Tinggi rendahnya kemampuan isolat dalam mereduksi nitrat dapat dipengaruhi oleh enzim-enzim yang turut berperan dalam proses denitrifikasi. Enzim-enzim tersebut adalah nitrate reductase (NAR), nitrite reductase (NIRs dan NIRk), periplasmic nitrate reductase (NAP), nitric oxide reductase (NOR) dan nitrous oxide reductase (NOS). Aktivitas isolat RD1 yang tinggi dalam mereduksi nitrat dalam keadaan anaerob dapat disebabkan karena keberadaan enzim NAR yang dapat bekerja pada kondisi anaerob dengan lebih
9 baik dibandingkan dengan isolat pada kondisi aerob yang mengekspresikan enzim NAP (Richardson 2000).
Perbedaan kemampuan tiap isolat dalam mereduksi nitrat dapat dipengaruhi oleh lingkungan atau oleh perbedaan aktivitas metabolisme yang bekerja pada bakteri. Jumlah nitrat yang direduksi juga dapat dipengaruhi oleh jumlah elektron yang diperoleh pada oksidasi senyawa karbon yang tersedia pada medium denitrifikasi. Elektron yang dihasilkan dari oksidasi senyawa karbon terdapat pada molekul NADH dan FADH2 yang berperan sebagai donor elektron pada rantai respirasi. Kelompok bakteri denitrifikasi menggunakan nitrat sebagai penerima elektron terakhir pada kondisi anaerob (Madigan et al. 2006).
Tinggi rendahnya laju potensial denitrifikasi berpengaruh pada ketersediaan sumber karbon. Menurut Masrukhin (2013) laju proses denitrifikasi yang tinggi terjadi ketika sumber karbon lebih sedikit dibandingkan substrat. Ketika sumber karbon yang tersedia tinggi, maka akan terjadi proses DNRA. Hasil uji menunjukkan bahwa laju akumulasi nitrit isolat RD1 tergolong rendah. Uji kinetika reduksi nitrat dilakukan pada isolat terpilih yang memiliki kemampuan reduksi nitrat yang tertinggi pada kondisi anaerob. Pada uji ini digunakan persamaan Michaelis-Menten, Km adalah konsentrasi substrat yang separuh dari lokasi aktifnya telah terisi, yaitu bila kecepatan reaksi enzim telah mencapai ½ Vmaks sedangkan nilai Vmaks merupakan salah satu parameter kinetika enzim (Wiseman 1989). Nilai Km digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S) indikator yang menunjukkan kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S. Nilai Km yang rendah menunjukkan bahwa afinitas enzim terhadap substrat tinggi sedangkan nilai Km yang besar menunjukkan afinitas enzim terhadap substrat rendah (Fox 1991).
SIMPULAN
Sembilan belas bakteri denitrifikasi yang telah dikarakterisasi didominasi oleh bakteri yang memiliki bentuk sel batang dan semua isolat merupakan Gram negatif. Sebelas isolat yang memiliki sifat oksidatif pada uji fermentatif/oksidatif pada uji aktivitas reduksi nitrat diperoleh isolat RD1 yang dapat mereduksi nitrat yang paling besar yaitu sebesar 102%. Nilai Konstanta Michaelis-Menten (Km) sebesar 429.29 µM dan nilai kecepatan reaksi maksimum (Vmaks) sebesar 69.44 µM/Jam diperoleh pada kinetika reduksi nitrat.
DAFTAR PUSTAKA
Eaton AD, Clesceri LS, Greenberg AE, Rice EW. 2005. Standard Method of Examination of Water and Wastewater. Ed ke-21. Washington DC (US): APHA-AWWA-WPCF.
Effendi H. 2003. Telaah Kualitas Air: Bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Yogyakarta (ID): Kanisius.
10
Fox PF. 1991. Food Enzymology. London (UK): Elsevier Applied Science.
Hadioetomo RS. 1983. Mikrobiologi Dasar dalam Praktek. Jakarta (ID): PT Gramedia Pustaka Utama.
Holt JG, Krieg NR, Sneath PH, Staley JT, Williams ST. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltimore (US): Williams & Wilkins.
Hugh R, Leifson E. 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram-negative rods. J Bacteriol 66:24–26.
[KKP] Kementerian Kelautan dan Perikanan. 2013. Statistik Menakar Target Ikan Air Tawar Tahun 2013. Jakarta (ID): Pusat Data, Statistik dan Informasi. [KKP] Kementerian Kelautan dan Perikanan. 2009. Kelautan dan Perikanan
dalam Angka 2009. Jakarta (ID): Pusat Data, Statistik dan Informasi. Khanitchaidecha W, Sumino T, Kazama F. 2010. Influence of Carbon Source on
Biological Nitrogen Removal by Immobilised Bacteria. J Warp 2:527-531. Knowles R. 1982. Denitrification. J Microbiol Rev 46(1): 43-70.
Madigan MT, Martinko JM. 2006. Brock Biology of Microorganisms.Ed ke-10. New Jersey (US): Prentice Hall Internasional Inc.
Masrukhin. 2013. Laju Potensial dan Kelimpahan Bakteri Nitrifikasi, Denitrifikasi dan Disimilatory Nitrate Reduction to Ammonium (DNRA) pada Lahan Perkebunan Karet di Jambi [Skripsi]. Bogor: Institut Pertanian Bogor. Pranoto SH. 2006. Isolasi dan Seleksi Bakteri Nitrifikasi dan Denitrifikasi Sebagai
Agen Bioremediasi pada Media Pemeliharaan Udang Vaname (Litopenaeus vannamei) [Skripsi]. Bogor: Institut Pertanian Bogor.
Putra GPG. 2009. Penentuan kinetika enzim poligalakturonase (PG) endogenous dari pup biji kakao. J Biol 8(1): 21-24.
Rand MC, Greenberg AE, Taras MJ. 1979. Standard Method of Examination of Water and Wastewater. Ed ke-14. Washington DC (US): APHA-AWWA-WPCF.
Richardson DJ. 2000. Bacterial respiration: a flexible process for a changing environment. J Microbiol 146:551-571.
Robertson GP. 1999. Standart Soil Methods for Long Term Ecological Research. New York (US): Oxford University Press.
Rodina AG. 1972. Methods in Aquatic Microbiology. Baltimore (US): University Park Press.
Rusmana I, Nedwell DB. 2004. Use of chlorate as a selective inhibitor to distinguish membrane-bound nitrate reductase (Nar) and periplasmic nitrate reductase (Nap) of dissimilative nitrate reducing bacteria in sediment. J FEMS Microbiol Ecol 48:379-386.
Scragg A. 2005. Environmental Biotechnology. New York (US): Oxford University Press.
White D. 1995. The Psysiology and Biochemistry of Prokaryotes. Ed ke-2. New York (US): Oxford University Press.
Wiseman, A. 1989. Handbook of Enzymes Biotechnology. Ed ke-2. New York (US): Ellis Howard
11
Lampiran 1 Kurva Standar Nitrat
Lampiran 2 Kurva Standar Nitrit
y = 0,0535x + 0,2845 R² = 0,9915 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 0 2 4 6 8 10 12 Abs o rba n (4 1 0 nm ) Konsentrasi (uM) y = 0,0598x + 0,0013 R² = 0,9999 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0 2 4 6 8 10 12 A b sor b an si ( 543 n m ) Konsentrasi (uM)
12
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 29 April 1993, sebagai anak tunggal, dari pasangan Sumaedi dan Eni Kustiyati. Lulus dari SMA Al Muslim Bekasi pada tahun 2010, kemudian diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur BUD.
Selama mengikuti perkuliahan di Departemen Biologi IPB, penulis aktif di Badan Eksekutif Mahasiswa FMIPA IPB (BEM FMIPA) tahun 2011-2012, Badan Eksekutif Mahasiswa IPB (BEMKM IPB) tahun 2012-2013. Selain itu penulis juga aktif di komunitas fotografi IPB (Shutter) dan menjadi asisten praktikum mata kuliah Fisiologi Prokariot pada tahun ajaran 2013/2014.
Pada tahun 2012 penulis melaksanakan kegiatan studi lapang dengan topik Cendawan Patogen Pada Beberapa Tanaman di Kebun Raya Cibodas dan Lokasi Sekitarnya. Tahun 2013 penulis melaksanakan kegiatan Praktek Lapangan di PT SGS Indonesia dengan topik Analisis Bakteri Escherichia coli Pada Makanan Ringan DI PT SGS Indonesia.