3 BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari hingga September 2013 di Laboratorium Mikrobiologi Pangan, Kimia Pangan, dan Biokimia Pangan Departemen Ilmu dan Teknologi Pangan serta Laboratorium Mutu dan Keamanan Pangan SEAFAST Center Gedung PAU, Institut Pertanian Bogor, Bogor.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah getah pepaya segar (diperoleh dari University Farm IPB, Bogor), susu sapi segar (kandang Fakultas Peternakan IPB, Bogor), kultur Staphylococcus aureus ATCC 25923, media
Trypticase Soy Agar (TSA), media Trypticase Soy Broth (TSB), media Mueller Hinton Agar (MHA), media Baird Parker Agar (BPA), media Brain Heart Infution Broth (BHIB) (Oxoid, Hampshire, UK), kuning telur, Telurit 1%, HCl 6
M, etanol 96%, gas nitrogen, kasein (Merck, Dramstadt, Germany), trikloroasetat (Merck, Dramstadt, Germany), folin Ciocalteu’s (Merck, Dramstadt, Germany),
Dimethyl sulfoxide (DMSO) (Merck, Dramstadt, Germany), dinatrium karbonat,
tirosin (Merck, Dramstadt, Germany), Natrium klorida 0,85%, KH2PO4, K2HPO4, DNA probe propidium iodida (Invitrogen, Carlsbad, USA), SYBR Green (Kapa Biosystem, USA), kertas Whatman No. 1, trisodium sitrat, air deionisasi,
commassie briliant blue (Merck, Dramstadt, Germany), asam fosfat 85% (Merck,
Dramstadt, Germany).
Alat
Alat-alat yang digunakan pada penelitian ini adalah spektrofotometer 1800 UV (Shimadzu, Jepang), mikroskop fluoresens (Olympus CH30, Jepang), inkubator, oven vakum (VWR Scientific, Kanada), sonikator (cleaning bath) (BRANSONIC Ultrasonic cleaner 8510E-MTH, USA), termometer, rotary
evaporator (BUCHI, Swiss), sentrifuse (Hermle Z383K, Germany), mortar, jar steril, laminar air flow, pipet mikro 10-100 µL, pipet mikro 100-1000 µL, pipet mikro 1-10 mL (finnpipette, Thermo Fisher Scientific, USA), alat-alat gelas.
Metodologi
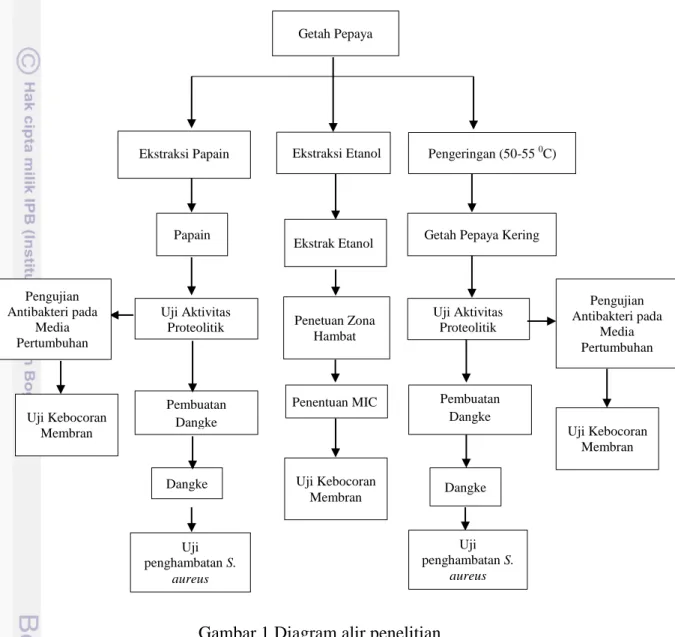
Penelitian ini dilaksanakan dalam beberapa tahap yang terdiri dari: 1) pengeringan getah pepaya menggunakan oven vakum pada suhu 55 selama 22 jam, 2) ekstraksi papain kasar dari getah pepaya segar dengan tujuan mengisolasi komponen proteolitik yang terdapat pada getah pepaya, 3) ekstraksi etanol getah pepaya untuk memperoleh komponen bioaktif non-proteolitik yang larut di dalam etanol, 4) pengujian aktivitas antibakteri getah pepaya dan papain pada media pertumbuhan yang dilanjutkan dengan pengujian aktivitas antibakteri getah pepaya dan papain pada dangke, 5) pengujian aktivitas antibakteri ekstrak etanol
Ekstraksi Etanol Getah Pepaya
Getah Pepaya Kering Papain Pengeringan (50-55 0C) Ekstraksi Papain Ekstrak Etanol Pembuatan Dangke Dangke Uji penghambatan S. aureus Uji Aktivitas Proteolitik Uji Aktivitas Proteolitik Pengujian Antibakteri pada Media Pertumbuhan Uji Kebocoran Membran Penetuan Zona Hambat Penentuan MIC Pengujian Antibakteri pada Media Pertumbuhan Uji Kebocoran Membran Pembuatan Dangke Dangke Uji penghambatan S. aureus Uji Kebocoran Membran
getah pepaya berdasarkan penentuan zona hambat dan dilanjutkan dengan menentukan konsentrasi hambat minimum (KHM), 6) pengujian pengaruh getah pepaya kering, papain, dan ekstrak etanol terhadap membran S. aureus berdasarkan pelepasan material sel yang mampu menyerap cahaya pada panjang gelombang 260 nm dan pengamatan dengan mikroskop fluoresens (Gambar 1).
Gambar 1 Diagram alir penelitian
Ket : Uji ketahanan membran dilakukan dengan pengukuran pelepasan material sitoplasma dan pengamatan kebocoran membran menggunakan mikroskop fluoresens dengan bantuan DNA probe berupa SYBR Green dan PI.
Metode Penelitian Pengeringan getah pepaya (Yapa et al. 1994)
Getah pepaya dapat diperoleh dari beberapa bagian tanaman pepaya, salah satunya adalah bagian buah. Buah pepaya muda (2 sampai 5 bulan) ditoreh dengan kedalaman kurang lebih 2 sampai 3 mm. Penorehan getah pepaya dilakukan pada pagi hari sekitar pukul 05.00 hingga pukul 06.30 untuk memperoleh hasil yang maksimal. Getah yang mengalir kemudian ditampung menggunakan wadah. Getah yang dikumpulkan selanjutnya dikeringkan dengan menggunakan oven vakum pada suhu sekitar 50 sampai 55 hingga diperoleh getah yang kering dan tidak lengket. Getah kering yang diperoleh kemudian dihaluskan menjadi bubuk dan ditentukan aktivitas proteolitiknya dengan metode Bergmeyer (1984).
Ekstraksi papain dari getah pepaya (Modifikasi Nitwasang et al. 2006) Ekstraksi papain dari getah pepaya dilakukan dengan terlebih dahulu menghomogenkan getah pepaya segar menggunakan buffer posfat pH 8. pH larutan kemudian dibuat menjadi 5.6 dengan menggunakan HCl 6 M lalu diaduk selama 15 menit pada suhu 4 . Filtrat dan bagian yang tidak larut dipisahkan dengan penyaringan menggunakan kertas saring Whatman no. 1. Filtrat yang diperoleh dipisahkan dan protease yang larut di dalamnya dipisahkan dengan presipitasi menggunakan etanol. Etanol ditambahkan pada filtrat dengan perbandingan 1:6 (v/v). Endapan yang diperoleh selanjutnya dipisahkan dengan sentrifugasi pada kecepatan 4000 rpm dengan suhu 4 . Presipitat yang diperoleh dikeringkan menggunakan oven vakum pada suhu 50 hingga diperoleh papain kasar kering lalu dihaluskan hingga diperoleh bubuk papain kasar. Papain kasar yang diperoleh dihitung rendemen dan aktivitas proteolitiknya dengan metode Bergmeyer (1984).
Persiapan ekstrak etanol getah pepaya (Modifikasi Wang et al. 2008)
Ekstrak etanol getah pepaya diperoleh dengan mencampurkan getah pepaya kering dan etanol dengan perbandingan 1:20 (b/v). Kemudian dilakukan ultrasonikasi menggunakan ultrasonikator selama 20 menit pada frekuensi 40 kHz. Larutan getah yang telah melalui proses ultrasonikasi disaring menggunakan kertas saring Whatman no.1. Filtrat yang diperoleh kemudian dipekatkan dengan evaporasi menggunakan rotavapor pada suhu 40 Ekstrak kering diperoleh dengan menghembus ekstrak yang telah dievaporasi menggunakan gas nitrogen hingga diperoleh berat konstan. Rendemen ekstrak etanol yang diperoleh selanjutnya dihitung.
Persiapan kultur S. aureus (Modifikasi Oonmetta-aree et al. 2006)
Kultur S. aureus yang berada dalam media TSA miring diinokulasikan ke media BHIB lalu diinkubasi selama 18 sampai 24 jam pada suhu 37 . Suspensi bakteri yang diperoleh kemudian digores pada media TSA di cawan lalu diinkubasi selama 24 jam pada suhu 37 . Koloni identik dan tunggal diambil
lalu diinokulasi ke dalam 10 mL media TSB dan diinkubasi selama 18 sampai 24 jam pada suhu 37 . Penghitungan jumlah koloni dilakukan berdasarkan metode BAM (2003). Suspensi S. aureus pada media TSB inilah yang digunakan sebagai kultur kerja untuk pengujian aktivitas antibakteri getah pepaya.
Aktivitas antimikroba getah pepaya dan papain pada media pertumbuhan (Modifikasi Eshamah et al. 2013)
Getah pepaya kering atau papain dimasukkan ke dalam 2 mL TSB hingga diperoleh konsentrasi yang setara dengan konsentrasi getah pepaya segar yang digunakan pada pembuatan dangke berdasarkan aktivitas proteolitiknya (0.0277 g/100 mL untuk getah pepaya kering dan 0.0011 g/100 mL untuk papain). Suspensi S. aureus dengan konsentrasi 108 CFU/mL diperoleh dengan menggunakan standar 0.5 Mc Farland dengan mengukur absorbansi suspensi S.
aureus dalam 0.85% NaCl steril pada panjang gelombang 625 nm, konsentrasi 108
setara dengan nilai absorbansi sebesar 0.08 sampai 0.12 (Andrews 2005). Konsentrasi yang diperoleh berdasarkan standar 0.5 McFarland dikonfirmasi dengan menghitung jumlah koloni yang ditumbuhkan pada media TSA berdasarkan metode BAM (2003). Sebanyak 20 L S. aureus dengan konsentrasi 106 CFU/mL ditambahkan ke dalam media sehingga diperoleh konsentrasi kira-kira 104 CFU/mL kemudian diinkubasi dengan inkubator bergoyang selama 24 jam pada suhu 37 . Penurunan jumlah S. aureus akibat aktivitas antimikroba ditentukan dengan menumbuhkan bakteri yang telah dipaparkan dengan antimikroba selama 24 jam pada media TSA dan dihitung dengan menggunakan metode BAM (2003).
Pembuatan dangke dan penghambatan S. aureus pada dangke
Kemampuan getah pepaya menghambat pertumbuhan S. aureus pada dangke ditentukan dengan menghitung jumlah S. aureus yang tumbuh pada dangke selama penyimpanan pada suhu ruang. Dangke dibuat dengan memanaskan susu sapi segar hingga mencapai suhu 63 selama 10 menit. Setelah suhu diturunkan hingga 50 , 0.0027 g getah pepaya kering atau 0.0011 g papain ditambahkan ke dalam 100 mL susu (setara dengan konsentrasi getah pepaya basah berdasarkan aktivitas proteolitik). CaSO4 1% juga digunakan sebagai koagulan untuk membuat dangke dengan konsentrasi sebanyak 250 mL/L susu, sebagai kontrol negatif. Pemanasan terus dilanjutkan dengan pengadukan hingga protein susu menggumpal dan terjadi pemisahan antara curd dan whey.
Curd yang terbentuk disaring dan dipadatkan hingga air yang ada pada curd tidak
tersisa lagi. Jumlah S. aureus pada dangke dihitung selama penyimpanan 0, 24, dan 48 jam pada suhu ruang berdasarkan metode BAM (2003).
Aktivitas antimikroba ekstrak etanol getah pepaya metode difusi sumur (Baskaran et al. 2012)
Pengujian awal aktivitas antibakteri ekstrak etanol getah pepaya adalah dengan menentukan zona penghambatan ekstrak etanol getah pepaya terhadap S.
aureus. Penentuan zona hambat ekstrak etanol getah pepaya dilakukan dengan
disentrifugasi pada kecepatan 10000 rpm selama 10 menit untuk dipisahkan pelet dengan supernatannya. Pelet yang diperoleh selanjutnya diresuspensi menggunakan NaCl 0.85% steril dan konsentrasinya dibuat menjadi kira-kira 108 CFU/mL berdasarkan standar 0.5 McFarland. Suspensi S. aureus kemudian disebar pada media MHA menggunakan cotton bud steril lalu dibuat sumur menggunakan pembolong agar steril berdiameter 4 mm. Ekstrak etanol getah pepaya dengan konsentrasi 100, 32, 16, 8, and 4 mg/mL masing-masing diteteskan ke sumur sebanyak 20 µL. Cawan yang telah diteteskan antimikroba didiamkan selama kurang lebih satu jam pada suhu ruang untuk memberikan kesempatan bagi antimikroba berdifusi ke agar, lalu diinkubasi pada suhu 37 selama 24 jam. Zona penghambatan ekstrak etanol getah pepaya yang ditandai dengan terbentuknya zona bening diukur diameternya.
Penentuan KHM ekstrak etanol getah pepaya (Consentino et al. 1999)
Konsentrasi hambat minimum ekstrak etanol getah pepaya ditentukan dengan metode pengenceran makro atau macrodilution. Senyawa antimikroba dimasukkan ke dalam tabung berisi 2 mL TSB dan dibuat seri pengenceran dua kali hingga diperoleh konsentrasi antibakteri masing-masing 16 mg/mL; 8 mg/mL; 4 mg/mL; dan 2 mg/mL, sedangkan sebagai kontrol digunakan media TSB yang tidak ditambahkan antibakteri. Kultur S. aureus yang berumur 18 sampai 24 jam pada media TSB dipisahkan pelet dengan supernatannya dengan sentrifugasi pada kecepatan 10000 rpm selama 10 menit. Pelet yang diperoleh selanjutnya diresuspensi menggunakan NaCl 0.85% steril dan dibuat konsentrasinya menjadi kira-kira 108 CFU/mL berdasarkan standar 0.5 McFarland. Masing-masing tabung kemudian ditambahkan S. aureus dengan konsentrasi 106 cfu/mL sebanyak 100 µL. Inkubasi dilakukan dengan menggunakan inkubator bergoyang pada suhu 37 selama 24 jam. Penurunan jumlah S. aureus ditentukan dengan menumbuhkan masing-masing perlakuan pada media TSA dan dihitung jumlah S. aureus, KHM yang digunakan pada penelitian ini adalah KHM90, yaitu konsentrasi dimana senyawa antimikroba mampu menurunkan jumlah bakteri sebesar 90% atau 1 logaritma setelah inkubasi selama 24 jam.
Pemaparan S. aureus dengan antibakteri untuk pengujian pengaruh antibakteri terhadap integritas membran berdasarkan OD 260 (Oonmetta-aree et al. 2006)
S. aureus diinokulasi pada 10 ml media TSB lalu diinkubasi selama 18
sampai 24 jam pada 37 . Sentrifugasi dengan kecepatan 10000 rpm selama 10 menit dilakukan setelah inkubasi selesai untuk memisahkan sel bakteri dengan media kemudian sel disuspensikan kembali di dalam NaCl 0.85% steril hingga diperoleh konsentrasi kira-kira 1010 CFU/mL. Konsentrasi 1010 CFU/mL diperoleh dengan mengukur absorbansi suspensi bakteri pada panjang gelombang 260 nm, konsentrasi 1010 CFU/mL diperoleh dengan nilai absorbansi sebesar 0.3 (Carson et al. 2002). Getah pepaya atau papain ditambahkan ke media dengan konsentrasi setengah, satu, dua kali, dan tiga kali konsentrasi yang digunakan pada pembuatan dangke serta setengah, satu, dan dua kali MIC untuk ekstrak
etanol. Suspensi bakteri kemudian diinokulasikan ke media, kemudian dikontakkan selama 2 jam pada suhu 37 . Kemampuan antimikroba dalam merusak membran sel ditentukan dengan menghitung nilai absorbansi supernatan pada panjang gelombang 260 nm menggunakan spektrofotometer UV-VIS. Pemaparan S. aureus dengan antibakteri untuk pengamatan efek antimikroba terhadap S. aureus menggunakan mikroskop fluoresens
Untuk pengujian pengaruh antibakteri terhadap S. aureus, sel bakteri yang telah dipisahkan dengan media melaui sentrifugasi pada 10000 rpm selama 10 menit dicuci sebanyak dua kali dengan NaCl 0.85% steril. Pencucian dilakukan dengan melarutkan pelet NaCl 0.85% steril sebanyak 1 mL lalu disentrifugasi dan supernatannya dipisahkan. Proses yang sama dilakukan sebanyak dua kali. Pelet yang telah dicuci selanjutnya diresuspensi menggunakan NaCl 0.85% steril dan dikonsentrasikan hingga konsentrasi kira-kira 108 CFU/mL (Iwalokun et al. 2004). Getah pepaya kering atau papain ditambahkan ke 1 mL suspensi bakteri hingga diperoleh konsentrasi yang setara dengan konsentrasi getah pepaya segar pada pembuatan dangke berdasarkan aktivitas proteolitik (0.0277 mg/100 mL untuk getah pepaya kering dan 0.0011 mg/100 mL untuk papain). Ekstrak etanol getah pepaya ditambahkan ke 1 mL suspensi bakteri hingga diperoleh konsentrasi yang setara dengan nilai KHM. Pemaparan dilakukan selama 2 jam pada suhu 37 . Pewarnaan dilakukan dengan menggunakan DNA probe SYBR Green dan propidium iodida.
Prosedur Analisa
Penghitungan rendemen, getah pepaya kering, papain dan ekstrak etanol getah pepaya
Rendemen papain dalam getah pepaya dihitung dengan membandingkan jumlah papain yang diperoleh setelah ekstraksi dengan berat getah pepaya basah yang digunakan. Persamaan yang digunakan adalah :
Rendemen (%) = dimana : A = berat sampel yang digunakan (g)
B = berat getah pepaya kering/papain/ekstrak yang diperoleh (g) Penentuan kadar air getah pepaya basah, getah pepaya kering, dan papain (AOAC 2005)
Pengukuran kadar air sampel dilakukan dengan metode termogravimetri dengan tahapan sebagai berikut, cawan kosong dan tutupnya dikeringkan dalam oven selama 15 menit. Ditimbang dengan cepat kurang lebih 2 g sampel yang sudah dihomogenkan dalam cawan. Cawan yang berisi sampel kemudian dikeringkan dengan menggunakan oven pada suhu 105 selama 3 jam. Setelah itu, cawan didinginkan selama 3 sampai 5 menit kemudian ditimbang. Bahan
kembali dikeringkan kembali ke dalam oven ± 30 menit dan ditimbang kembali hingga diperoleh berat yang konstan.
Kadar air dihitung dengan rumus :
dimana : A = berat cawan kosong (g) B = berat cawan dan sampel (g)
C = berat konstan cawan dan sampel (g)
Pengujian aktivitas proteolitik getah pepaya segar, getah pepaya kering, dan papain (Bergmeyer 1984)
Aktivitas proteolitik enzim dihitung dengan mereaksikan enzim dan substrat, yang dalam hal ini digunakan kasein. 1 mL larutan kasein 2% (b/v) dicampur dengan 1 mL buffer pH 8 dan 0.2 mL larutan enzim kemudian diinkubasi pada suhu 37 selama 10 menit. Reaksi dihentikan dengan menambahkan 2 mL asam trikloroasetat 0.1 M dan dibiarkan selama 10 menit pada suhu 37 . Campuran kemudian dipisahkan dengan sentrifugasi pada 9000 rpm selama 20 menit. Filtrat diambil sebanyak 1.5 mL dan dicampur dengan 5 mL dinatrium karbonat 0.5 M dan 1 mL pereaksi Folin Ciocalteu’s, dibiarkan 20 menit pada suhu 37 . Absorbansi diukur pada panjang gelombang 578 nm. Untuk blanko, larutan enzim diganti dengan air suling dan untuk standar, larutan enzim diganti dengan standar tirosin (5 mmol/L). Aktivitas protease dihitung dalam satuan unit mL enzim. Unit aktivitas protease dihitung dengan rumus :
-dimana:
U = Unit aktivitas protease per menit (Unit/mL) Asp = Nilai absorbansi contoh
Ast = Nilai absorbasi standar Abl = Nilai absorbansi blanko P = Faktor pengenceran
T = Waktu inkubasi enzim (menit) Penghitungan jumlah bakteri (BAM 2003)
Jumlah bakteri yang tumbuh dihitung dengan menyebar suspensi bakteri dari beberapa tingkat pengenceran pada permukaan media TSA sebanyak 0,1 mL. cawan diinkubasi selama 24 sampai 48 jam pada suhu 35 sampai 37 . Koloni yang tumbuh diamati dan dihitung jumlahnya. Cawan yang digunakan hanya yang koloninya berjumlah 25 sampai 250.
Jumlah mikroba yang tumbuh pada cawan dihitung dengan persamaan :
dimana :
N = total CFU/mL
∑C = jumlah koloni yang dihitung
n1 = jumlah cawan yang digunakan pada pengenceran 1 n2 = jumlah cawan yang digunakan pada pengenceran 2 n3 = jumlah cawan yang digunakan pada pengenceran 3 d = pengenceran terendah
Analisis kualitatif kandungan fitokimia ekstrak etanol getah pepaya
Senyawa fitokimia yang diuji pada penelitian ini adalah alkaloid, flavonoid, fenol, hidroquinon, steroid, triterpenoid, tanin, dan saponin berdasarkan metode Harborne (2006) sebagai berikut :
Analisis alkaloid. beberapa tetes NaOH ditambahkan ke 1 mL ekstrak lalu divorteks dan disaring. Kemudian beberapa tetes H2SO4 pekat ditambahkan ke filtrat lalu divorteks. Lapisan bening yang terbentuk di permukaan diambil dan diuji dengan pereaksi Mayer, Wagner dan Dragendorf. Uji positif alkaloid bila terbentuk endapan putih (pereaksi mayer), endapan coklat (pereaksi Wagner) dan terbentuk endapan merah bata (peraksi Dragendorf).
Analisis flavonoid. 0.1 gram ekstrak ditambahkan air panas dan dididihkan selama 5 menit lalu disaring. Pada filtrat ditambahkan 0.5 gram serbuk magnesium dan 2 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume sama) dan 2 mL amil alkohol. Campuran divortex dan terbentuknya warna merah, kuning dan jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
Analisis fenol. 0.1 sampai 0.2 gram ekstrak yang telah dilarutkan diteteskan pada cawan bercak dan ditambahkan NaOH 10%. Uji positif bila terbentuk warna merah.
Analisis steroid dan triterpenoid. 1 mg ekstrak dilarutkan ke dalam 2 ml kloroform. 10 tetes asam asetat anhidrida dan 3 tetes asam sulfat pekat ditambhakan ke larutan ekstrak lalu dikocok secara perlahan dan dibiarkan selama beberapa menit. Uji positif steroid bila terbentuk warna hijau dan positif triterpenoid bila terbentuk warna merah atau ungu.
Analisis tanin. 0.1 gram ekstrak ditambahkan air panas dan didihkan selama 5 menit lalu disaring. Beberapa ml larutan FeCl3 1% ditambahkan ke filtrat dan uji positif bila terterbentuk warna biru tua atau hijau kehitaman.
Analisis saponin. 0.5 ml ekstrak dilarutkan dalam 5 ml air suling. Larutan dikocok beberapa saat dan bila terbentuk busa yang konstan menunjukkan uji positif mengandung saponin.
Pengujian efek antibakteri terhadap S. aureus dengan pengukuran absorbansi supernatan pada 260 nm (Oonmetta-aree et al, 2006)
Pengukuran absorbansi supernatan S. aureus yang telah dipaparkan antibakteri dilakukan dengan terlebih dahulu memisahkan sel dengan sentrifugasi pada 10000 rpm selama 10 menit. Komponen sel yang keluar dari dalam sel akibat aktivitas antibakteri ditentukan dengan mengukur absorbansi supernatan yang diperoleh menggunakan spektrofotometer UV-VIS pada panjang gelombang 260 nm.
Pengamatan efek antibakteri terhadap S. aureus dengan mikroskop fluoresens
Suspensi bakteri yang telah dipaparkan dengan antibakteri dipisahkan antara sel dengan media melalui sentrifugasi pada kecepatan 10000 rpm selama 10 menit. Pelet yang diperoleh dicuci menggunakan NaCl 0.85% steril. Pencucian dilakukan dengan menambahkan 1 ml NaCl 0.85% steril ke dalam tabung berisi pelet S. aureus kemudian disentrifugasi seperti perlakuan sebelumnya, proses ini dilakukan sebanyak dua kali. Larutan stok SYBR Green diencerkan sebanyak 25 kali dan larutan stok propidium iodida dengan konsentrasi 1 mg/mL diencerkan hingga diperoleh konsentrasi 0.02 mg/ml dengan menggunakan staining buffer berupa 20x saline sodium citrate (SSC). Sel bakteri diwarnai dengan menggunakan 200 L SYBR Green dan 200 L propidium iodida 0.2 mg/mL lalu diinkubasi selama 15 menit pada suhu ruang dan kondisi gelap, kemudian diamati menggunakan mikroskop fluoresens. Sebagai pembanding digunakan sel S.
aureus yang tidak dipaparkan antibakteri. Sel bakteri yang utuh menghasilkan
fluoresensi hijau dan sel dengan membran yang rusak menghasilkan fluoresensi merah. Fluoresensi hijau oleh SYBR Green terdeteksi dengan energi eksitasi 495 nm dan emisi 525 nm, sedangkan fluoresensi merah terdeteksi pada energi eksitasi maksimum 535 nm dan emisi maksimum 617 nm.
Analisa Statistik
Analisa dilakukan dengan dua ulangan dirata-ratakan. Data pengujian aktivitas antibakteri getah pepaya, papain, dan ekstrak etanol getah pepaya diolah menggunakan analisa sidik ragam dengan taraf signifikansi 0.05. Jika terdapat pengaruh yang nyata (p<0.05), maka dilanjutkan dengan uji Duncan. Software yang digunakan adalah IBM SPSS Statistic 20. Hasil dilaporkan sebagai nilai rata-rata ± standar deviasi (SD).