Skripsi
Studi Selektivitas Interaksi Senyawa Turunan Maleimida
dan PRIMA-1 Terhadap Protein p53
yang Termutasi pada Residu 273
Disusun oleh :
Nur Mujahidah Mardhiyah ( M0302036)
Disusun dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
SURAKARTA 2009
ii
HALAMAN PENGESAHAN Skripsi ini dibimbing oleh :
Pembimbing I
Dr. rer.nat Fajar Rakhman Wibowo, M.Si NIP 132 258 067
Pembimbing II
Venty Suryanti, M.Phil NIP 132 162 026
Dipertahankan didepan TIM Penguji Skripsi pada : Hari : Rabu
Tanggal : 28 januari 2009
Anggota TIM Penguji :
1. Prof. Dra. Neng Sri Suharty, M.S, Ph.D NIP. 130 902 529
2. Yuniawan Hidayat, M.Si NIP. 132 308 802
1. ………
2. ………
Disahkan oleh Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Ketua Jurusan Kimia,
Drs. Sentot Budi Rahardjo, Ph.D NIP. 131 570 162
iii
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi yang berjudul “STUDI SELEKTIFITAS SENYAWA TURUNAN MALEIMIDA dan PRIMA-1 TERHADAP PROTEIN p53 TERMUTASI PADA RESIDU 273” ini adalah benar-benar karya saya sendiri yang disusun untuk memenuhi sebagian syarat dalam memperoleh gelar kesarjanaan di perguruan tinggi, dan sepanjang pengetahuan saya tidak terdapat kerja atau pendapat yang ditulis atau diterbitkan oleh orang lain, kecuali secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Januari 2009
iv ABSTRAK
Nur Mujahidah M. 2008.” STUDI SELEKTIVITAS SENYAWA TURUNAN MALEIMIDA DAN PRIMA-1 TERHADAP P53 TER MUTASI PADA RESIDU 273”. Skripsi. Jurusan Kimia. Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret
Protein p53 akan menginduksi terjadinya apoptosis ketika terjadi kegagalan perbaikan sel atau DNA yang rusak. Mutasi pada p53 membuat induksi apoptosis tidak berjalan sehingga berpotensi terjadinya kanker. Mutasi p53 pada residu 273 dapat menyertai kerusakan DNA yang menyebabkan terjadinya kanker paru-paru, usus, dan payudara. Mutan p53 dapat dikembalikan fungsinya melalui reaktivasi p53. Potensi penyembuhan kanker melalui reaktivasi p53 memerlukan reaktivator yang selektif. Untuk mengetahui reaktivator p53 yang selektif dilakukan studi selektivitas senyawa reaktivator p53 terhadap mutasi p53 pada residu 273. Teknik yang digunakan untuk mempelajari selektivitas senyawa reaktivator p53 adalah studi teoritis dengan metode docking. Senyawa reaktivator p53 yang digunakan adalah turunan maleimida (MIRA: mutant-p53-dependent induction of rapid apoptosis) dan PRIMA-1 (p53 Reaktivation and Induction of massive Apoptosis). Tujuan dari studi ini adalah mengetahui interaksi spesifik senyawa reaktivator p53 dengan p53 termutasi residu 273.
Hasil studi menunjukkan bahwa interaksi spesifik berada disekitar residu 273 yang termutasi. Interaksi spesifik yang terjadi dapat menunjukkan potensi reaktivasi p53 termutasi. Dari hasil studi ini PRIMA-1 memiliki interaksi spesifik yang berbeda dengan turunan maleimida, sehingga potensi untuk mereaktivasipun juga berbeda. Hasil studi ini sejalan dengan eksperimen Bykov dan kawan-kawan tentang kemampuan reaktivasi PRIMA-1 dan turunan Malaeimida terhadap berbagai mutan p53.
Kata Kunci: Senyawa Reaktivator p53, Kanker, Apoptosis, p53, Residu 273, Docking
v
ABSTRACT
Nur Mujahidah Mardhiyah, 2009, “SELECTIVITY STUDY ON INTERACTION OF MALEIMIDA ANALOG AND PRIMA-1 AT PROTEIN P53 MUTATED 273 RESIDUE”. Thesis. Department of Chemistry. Mathematic and natural science. Sebelas Maret university.
Protein p53 will induce apoptosis when damage of DNA or cell failure to repaired. Mutation p53 make p53 inacvtivate so that have potency of cancer. Mutated 273 residu which follow damage of DNA or cell have potency to occur lug, breast and colon cancer. Mutant p53 can be restorated its function through p53 reactivation. Reactivation it need reactivator p53 agent which selective. In order to understand its selectivity has done Selectivity Study on Interaction of p53 Reactivator at Mutated 273 Residue. Technique of this study is theoretical study with docking method. Reaktivator p53 agent represent Derivative of Maleimida (MIRA: mutant-p53-dependent induction rapid of apoptosis) and PRIMA-1 (p53 Reaktivation and Induction of Massive Apoptosis). Intention of this study is know specific interaction of p53 reaktivator agent at mutated 273 residue.
Result of study indicate that specific interaction around mutated 273 residue. Specific interaction can show potency mutant p53 reaktivation. Result of this study of PRIMA-1 has different specific interaction with Derivative of maleimida, so that potency for reactivation also differ. Result of this study in line with Bykov et al experiment about ability of PRIMA-1 reaktivate and Derivative of Malaeimida to various mutant p53
vi Motto
Tiada kekayaan yang lebih utama dari pada akal Tiada kepapaan yang lebih menyedihkan dari pada kebodohan
Tiada warisan yang lebih baik dari pada pendidikan. (Ali Bin Abi Tholib)
I am only one, but I am still one. I can’t do everything, but still I can do something. And Because I can’t do everything I will
not refuse to do the something that I can do. (Helen Keller)
Courage is going from failure to failure without losing enthuiasm (Winston Churchil)
vii
Persembahan
Karya ini kupersembahkan tuk agama dan bangsaku
Abah dan Mak e yang selalu memberikan dukungan materiil dan spirituil.
Adik-adikku Ifah dan Nisa yang selalu menguatkanku
Adik-adikku Miftah, Uli, Fatih yang lucu dan setia menemani kak nur
Sahabatku Mutya N, Nila RF, Putri Palupi K Mutiara DNI,
viii
KATA PENGANTAR
Segala puji syukur penulis panjatkan kehadirat Allah SWT atas limpahan nikmat dan karunianya sehingga skripsi ini dapat terselesaikan sebagai salah satu syarat memperoleh gelar sarjana sains Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta.
Penyusunan skripsi ini tidak akan selesai tanpa adanya bimbingan, dukungan, dan bantuan dari berbagai pihak. Oleh karena itu, dalam kesempatan ini penyusun menyampaikan ucapan terimakasih kepada:
1. Prof. Sutarno M.Sc., selaku dekan Fakultas MIPA Universitas Sebelas maret Surakarta.
2. Drs. Sentot Budi Rahardjo, Ph.D., selaku ketua Jurusan Fakultas MIPA Universitas Sebelas maret Surakarta.
3. Yuniawan Hidayat, M.Si., selaku Pembimbing Akademik, atas segala bimbingan dan arahannya selama ini.
4. Dr.rer.nat. Fajar Rakhman Wibowo, M.Si., selaku dosen Pembimbing I atas segala pengarahan dan bimbingannya pada penyusunan skripsi ini.
5. Venty Suryanti M Phil., selaku dosen Pembimbing II atas segala pengarahan dan bimbingannya dalam penyusunan skripsi ini.
6. Bapak, Ibu dosen dan seluruh staf jurusan kimia serta semua pihak yang tidak dapat kami sebutkan satu-persatu yang telah membantu penyusunan skripsi ini.
Penyusun menyadari sepenuhnya bahwa skripsi ini masih sangat jauh dari kesempurnaan. Oleh karena itu penyusun mengharapkan kritik dan saran yang membangun guna kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat memberi manfaat pada berbagai pihak.
Surakarta, Januari 2009
ix DAFTAR ISI Halaman HALAMAN JUDUL………..i HALAMAN PENGESAHAN………ii SURAT PERNYATAAN...………iii ABSTRAK...………..iv ABSTRACT...v MOTTO ...vi
HALAMAN PERSEMBAHAN ...vii
KATA PENGANTAR ... .viii
DAFTAR ISI ...ix
DAFTAR TABEL... xi DAFTAR GAMBAR...xii DAFTAR LAMPIRAN...xiii BAB I. PENDAHULUAN………..1 A. LATAR BELAKANG..………...1 B. IDENTIFIKASI MASALAH....……….……...3 C. BATASAN MASALAH.………....…. 3 D. RUMUSAN MASALAH……….…....4 E. TUJUAN………...…... .5 F. MANFAAT...5
BAB II. A. TINJAUAN PUSTAKA……….…...…6
Kanker...………....6
Bunuh Diri Terprogram………...7
p53 Tumor Supressor...9
Struktur Protein dan Mutasi...11
Mutasi Residu 273 ...12
Agen Reaktivator p53...13
Docking ...16
Algoritma Lamarckian Genetik...17
x
B KERANGKA PEMIKIRAN………..……..22
C HIPOTESIS………...23
BAB III. METODOLOGI PENELITIAN ………..24
A. TEMPAT DAN WAKTU ...24
B. ALAT DAN BAHAN ...24
C. PROSEDUR PENELITIAN ...25
D. TEKNIK PENGUMPULAN DAN ANALISIS DATA ...27
BAB IV. HASIL DAN PEMBAHASAN...28
A .Pemetaan Interaksi Turunan Maleimida pada Protein p53...28
B . Pemetaan Interaksi PRIMA-1 pada Makromolekul p53...39
C. Pengaruh Struktur Ligan dan Jenis Mutasi ...43
BAB V . KESIMPULAN DAN SARAN A. KESIMPULAN ...44
B. SARAN ...44
DAFTAR PUSTAKA...45
xi
DAFTAR TABEL
Tabel 1. Hasil Docking Lanjut Turuan Maleimida………... ... ..…...30
Tabel 2. Ringkasan Hasil Docking Turunan Maleimida pada Site Beda ...33
xii
DAFTAR GAMBAR
Gambar 1. Siklus Perkembangan Sel ... 7
Gambar 2. Interaksi p53 dengan DNA pada Domain inti ... 10
Gambar 3. Urutan spesifik (sequence-specific) protein p53... 10
Gambar 4. Mekanisme reaktivasi p53 dengan kemoterapi... 14
Gambar 5. Struktur Senyawa Reaktivator p53…………... 15
Gambar 6. Skematik docking molekul antara ligan dengan protein target... 17
Gambar 7. Prinsip Genetik Algoritma. terjadinya crossover turunan yang dihasilkan oleh parental 1 dan parental 2………... 19
Gambar 8. Proses Perhitungan energi menggunakan LGA……… 21
Gambar 9. Grid maps mencakup berbagai kemungkinan pergerakan atom yang dipunyai oleh ligan... 26
Gambar10. Situs Terendah Turunan Maleimida pada p53... 29
Gambar11. Perbandingan p53 normal manusia dan Tikus... 31
Gambar12. Peta interaksi site 6 MIRA-1 pada 2J20 ... 34
Gambar13. Peta interaksi MIRA-1 site 6 pada 2J20... 36
Gambar14. Peta interaksi site 7 MIRA-2 pada 2BIM... 37
Gambar15. Peta interaksi site 8 MIRA-2 pada 2J20... 38
Gambar16. Pemetaan site Energi Terendah PRIMA-1 pada 1GZH... 39
Gambar17. Peta interaksi site 4 PRIMA-1 pada 2BIM ... 41
xiii
DAFTAR LAMPIRAN
Lampiran 1. Interaksi ikatan hidrogen Situs beda Turunan Maleimida pada p53... 47 Lampiran 2. Histogram hasil docking lanjut Turunan Maleimida pada
situs beda ... 50 Lampiran 3. Ikatan hidrogen pada 5 site terendah MIRA-1 terhadap
1GZH... 52 Lampiran 4. Gambar monomer p53 normal dan p53 termutasi pada
1 BAB I PENDAHULUAN A. LATAR BELAKANG
Kanker merupakan penyakit yang disebabkan oleh pembelahan sel yang tidak terkendali serta mempunyai kemampuan untuk menjalar baik dengan dengan pertumbuhan jaringan bersebelahan (invasi) atau dengan migrasi sel ke tempat yang jauh (metastasis). Tiap kanker memberi gejala yang berbeda tergantung pada lokasi, karakter keganasan dan adanya metastasis. Metastasis terjadi karena sel-sel yang mengalami transformasi menjadi ganas sehingga memiliki kemampuan untuk melakukan proliferasi ke lokasi-lokasi yang jauh di dalam tubuh untuk mengkolonisasi berbagai organ tubuh.(Salmon & Sartorell., 1999)
Pengendalian pertumbuhan sel tidak lepas dari adanya gen tumor suppressor, yang salah satunya dikenal dengan nama p53. Ketika terjadi kerusakan DNA (deoxyribonucleic acid/asam deoksiribosanukleat) dan kerusakan sel yang lain sebelum terjadinya replikasi maka dilakukan perbaikan, apabila proses perbaikan gagal, protein p53 akan menginduksi terjadinya bunuh diri terprogram (apoptosis). (Alberts et al., 2002).
Kemoterapi dapat mematikan sel-sel kanker, namun umumnya sel-sel normal sulit dihindari tidak ikut rusak. Efek samping ini dapat direduksi dengan target yang spesifik. Induksi apoptosis merupakan suatu target yang spesifik, karena apoptosis hanya terjadi jika ada kerusakan DNA dan/atau sel yang lain, sehingga hanya sel yang rusak saja yang mengalami bunuh diri terprogram (apoptosis).
Kurang lebih 55% sel tumor manusia kehilangan fungsi p53 diakibatkan oleh mutasi. Mutasi pada p53 sebagian besar terdapat pada bagian domain intinya, ada enam titik yang sering termutasi (hot spots) yang terkait dengan kanker manusia yaitu R175H, G245S, R248Q, R249S, R273H, dan R282W (Hainaut & Hallstein., 2003). Hilangnya fungsi p53 menyebabkan kerusakan DNA atau cacat sel lain yang tidak diikuti dengan penghentian replikasi.
2
Apoptosis tidak dapat berjalan meskipun terjadi kenaikan konsentrasi p53 (Bykov et al., 2002a).
Menurut Bykov dkk (2002) penempelan ligan ataupun peptida pendek dapat mengembalikan aktivitas p53. Beberapa penelitian untuk mengembalikan fungsi p53 termutasi dengan molekul kecil telah dilakukan. Bukti-bukti menunjukkan bahwa fungsi p53 dapat dikembalikan dengan mengatur konformasi mutan p53 sehingga menyerupai wt (wild type) p53. Senyawa yang digunakan dalam penelitian tersebut berbeda-beda antara lain PRIMA-1(p53 reactivation and induction of massive apoptosis) (Bykov et al.,2002b), turunan maleimida, MIRA (mutant–p53-dependent induction of rapid apoptosis) (Bykov et al.,2005) dan beberapa peptida pendek spesifik (Issaeva et al.,2003). Namun demikian, permasalahan sitotoksisitas dan farmakokinetik masih menjadi kendala bagi penggunaan senyawa ini secara klinis serta dalam penelitian ini belum bisa menjelaskan mekanisme restorasi p53 termutasi.
Pemahaman tentang interaksi spesifik antara ligan dan p53 akan memberikan sumbangan yang cukup besar dalam pengembangan obat anti-kanker. Informasi tentang interaksi spesifik ini dapat ditelusuri dengan menggunakan teknik pemodelan molekuler menggunakan bantuan komputer.
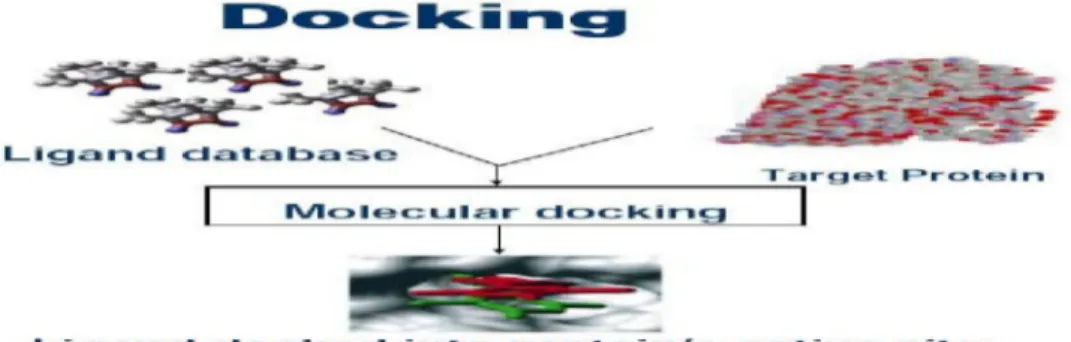
Permasalahan interaksi spesifik tersebut dapat diselesaikan dengan melihat kemungkinan-kemungkinan interaksi antara ligan dengan makromolekul. Cara yang dilakukan yakni dengan menempatkan ligan pada makromolekul secara sistematik yang dikenal dengan metode docking. Metode docking merupakan sebuah studi untuk memprediksikan struktur dari suatu komplek yang terbentuk antara dua atau lebih molekul serta proses interaksi yang terjadi.(Kaapru & Ojanen, 2002).
Hasil penelitian secara eksperimen oleh Bykov dkk 2002, PRIMA-1 memiliki potensi untuk merestorasi p53 termutasi pada asam amino penyusun polipeptida urutan ke 273 (residu 273), sedang senyawa turunan maleimida kurang berpotensi untuk merestorasi mutan p53 residu 273. Namun pada eksprimen Bykov tentang kemampuan PRIMA-1 dan turunan maleimida merestorasi p53 termutasi belum diketahui interaksi yang terjadi. Dalam
penelitian ini dilakukan studi untuk mempelajari interaksi ligan-ligan yang telah terbukti dapat merestorasi mutan p53 terhadap p53 yang termutasi residu 273 dengan metode docking sehingga dapat diketahui ligan mana yang selektif terhadap p53 termutasi residu 273.
B. IDENTIFIKASI MASALAH
Pada umumnya kemoterapi selain merusak sel kanker kerusakan sel-sel normal sulit dihindari. Maka pengobatan kanker secara kemoterapi harus diteliti lebih lanjut. Eksperimen Bykov dkk telah membuktikan bahwa PRIMA-1 dan Turunan Maleimida mampu merestorasi fungsi p53 termutasi, hasil eksperimen Issaeva dkk juga membuktikan bahwa peptida pendek mampu merestorasi p53 termutasi. Perbedaan kemampuan restorasi obat kanker satu dengan yang lain belum sepenuhnya diketahui pengaruhnya terhadap p53 termutasi pada residu yang sama. Terutama masalah interaksi yang terjadi antara obat kanker terhadap p53 termutasi. Ada beberapa teknik yang digunakan untuk mengetahui kemampuan restorasi obat kanker, yaitu dengan eksperimen dan/atau teoritis. Teknik yang sering dipakai dalam studi teoritis adalah docking. Beberapa program yang sering dipakai untuk proses docking adalah Autodock, Dock serta FlexX.
Hasil eksperimen Bykov menunjukkan bahwa PRIMA-1 memiliki potensi untuk merestorasi p53 termutasi residu 273 sehingga dapat berinteraksi kembali dengan DNA, sedang MIRA, turunan maleimida memiliki potensi lebih rendah dari pada PRIMA-1. Hasil eksperimen ini belum diketahui interaksi spesifik yang terjadi antara ligan dengan makromolekul. Interaksi spesifik tersebut dapat dilihat bagaimana posisi penempelan (Binding site) ligan terhadap p53 termutasi residu 273, serta interaksi-interaksi yang terjadi pada situs tersebut (binding mode), seperti apa pengaruhnya terhadap restorasi p53 termutasi residu 273.
4
C. BATASAN MASALAH
Senyawa–senyawa yang telah diteliti secara eksperimen berpotensi untuk merestorasi mutan p53 antara lain PRIMA-1 (Bykov et al.,2002b), turunan maleimida, MIRA (Bykov et al.,2005) dan beberapa peptida pendek spesifik (Issaeva et al.,2003). Proses pengembalian fungsi p53 melalui pengembalian konformasi domain inti dari p53 termutasi memerlukan interaksi spesifik antara ligan dan p53 termutasi. Namun interaksi spesifik yang dimaksud belum dapat dilihat dari struktur senyawa yang telah terbukti dapat mengembalikan fungsi p53
Interaksi spesifik dapat dilihat dengan cara menempatkan ligan pada makromolekul secara sistematis yang dikenal dengan metode docking (Morris et al.,1998). Program docking yang digunakan dalam studi ini adalah Autodock, pada program Autodock tersedia beberapa algoritma untuk proses perhitungan antara lain Simulated annealing, Local search, algoritma genetik dan Algoitma Lamarckian genetik. Dalam studi selektitas senyawa reaktivator p53 terhadap p53 termutasi residu 273 dibatasi pada:
1 Senyawa reaktivator p53 yang digunakan adalah PRIMA –1 serta Turunan Maleimida (MIRA-1, MIRA-2, MIRA-3 ). Struktur senyawa ini digambar dengan program molden kemudian dioptimasi terlebih dahulu dengan metode ab initio pada level teori HF dan Basis set 6-31G*
2 Makromolekul yang diteliti adalah p53 termutasi dengan Residu R273H (kode pdb: 2BIM), R273C (Kode pdb:2J20), wt p53 pada manusia (kode pdb: 1GZH) dan wt p53 pada tikus (kode pdb: 2IOO). Makromalekul ini dibuat rigid
3 Proses Docking yang dilakukan dengan program Autodock 3.0 menggunakan metode Lamarckian-Genetic Algorithm.
D. RUMUSAN MASALAH
1 Bagaimana interaksi PRIMA–1 dan Turunan Maleimida (MIRA-1, MIRA-2, MIRA-3) terhadap makromolekul p53.
2 Apa pengaruh jenis mutasi residu 273 terhadap interaksi ligan dan makromolekul .
3 Ligan mana yang selektif terhadap p53 termutasi R273H dan/atau p53 termutasi R273C.
E. TUJUAN
1. Mengetahui interaksi PRIMA–1, Turunan Maleimida (MIRA-1, MIRA-2, MIRA-3) dengan makromolekul p53.
2. Mengetahui pengaruh jenis mutasi residu 273 terhadap interaksi ligan dan makromolekul
3. Mengetahui ligan mana yang selektif terhadap p53 termutasi R273H dan/atau R273C
F. MANFAAT
1. Teoritis: Memberi informasi tentang ligan mana yang selektif terhadap mutan p53 pada residu 273
2. Praktis: Memberi sumbangan informasi pada dunia kesehatan terutama masalah kemoterapi.
6 BAB II LANDASAN TEORI
A. TINJAUAN PUSTAKA Kanker
Karsinoma atau kanker merupakan penyakit sel yang berasal dari sel normal dalam tubuh yang mengalami transformasi menjadi abnormal dan mengalami perkembangan yang tak terkendali. Proses transformasi ini terjadi karena mutasi spontan atau induksi karsinogen. Pengaruh paparan karsinogen menyebabkan terjadinya kerusakan mekanisme pengaturan dasar perilaku sel, khususnya mekanisme pertumbuhan dan differensiasi sel yang diatur oleh gen (Maliya, 2004).
Kerusakan mekanisme pengaturan dasar perilaku sel menyebabkan terjadinya proliferasi (pembelahan sel yang serupa) secara berlebihan dan membentuk tumor lokal. Tumor lokal ini mempunyai kemampuan untuk menekan dan menginvasi struktur normal yang ada di sekitarnya. Sel-sel abnormal yang terbentuk mempunyai kemampuan untuk melakukan proliferasi ulang ke lokasi-lokasi yang jauh di dalam tubuh untuk mengkolonisasi berbagai organ tubuh, proses ini disebut metastasis. Proses invasif dan metastasis serta serangkaian abnormalitas metabolisme yang disebabkan oleh kanker menyebabkan penyakit dan pada akhirnya menyebabkan kematian pasien, kecuali jika neoplasma itu dapat diberantas dengan pengobatan (Salmon & Sartorelli,1999).
Pada awal pengetahuan para ahli hanya terbatas pada pengertian bahwa sifat yang membahayakan dari sel kanker adalah dapat tumbuh dan menyebar secara tidak terkendali. Khasiat suatu obat hanya dilihat dari dapat tidaknya menghambat pembelahan sel, atau menginjeksi senyawa kimia tersebut pada sel kanker dan mengamati terjadi penciutan. Ternyata beberapa senyawa yang menyerang sel kanker juga dapat merusak jaringan sehat, sehingga terjadi efek samping yang membahayakan kesehatan penderita.
Dewasa ini, kelainan atau kerusakan secara molekular yang mengubah sel normal menjadi sel ganas mulai jelas. Beberapa kelainan disebabkan oleh terjadinya mutasi pada kunci utama dari gen yang bertanggung jawab dalam reproduksi sel. Mutasi tersebut mengubah kuantitas atau sifat protein yang dikode oleh gen pengatur tumbuh dan selanjutnya menganggu fungsi kontrol pembelahan sel (Sofyan, 2000).
Pemahaman tentang perkembangan sel kanker berhubungan dengan mekanisme terjadinya proliferasi dan diferensiasi (perubahan sifat sel) dalam sebuah siklus sel. Terdapat tiga kelompok sel yang berperan penting dalam siklus sel yaitu terdiri dari kelompok sel yang aktif melakukan proliferasi, kelompok sel yang selalu berdiferensiasi serta kelompok sel yang aktif berproliferasi yang dapat masuk dalam siklus sel dengan stimulasi khusus (Karsono, 2006).
Bunuh Diri Terprogram
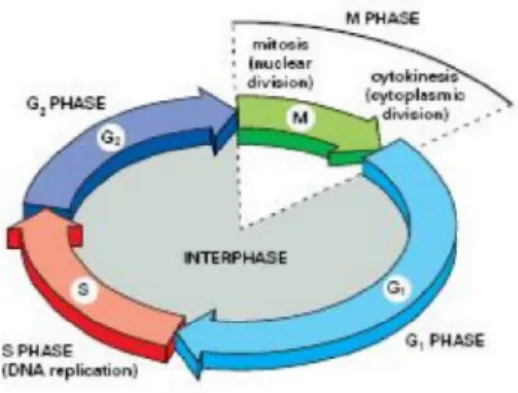
Dalam siklus sel (Gambar 1) pengaturan sel pada tahap G1/S memegang peran penting, fase G1 (Fase paska mitosis) adalah fase terjadinya pemeriksaan dalam siklus sel, jika DNA mengalami kerusakan DNA maka siklus akan dihambat dan dilakukan kerusakan terhadap sel-sel tersebut, jika kerusakan tidak dapat diperbaiki maka akan dilakukan bunuh diri terprogram (kresno,2002)
Gambar 1. Siklus perkembangan sel, proses cek poin berlangsung selama fase G1 dan G2. Fase S merupakan fase pembentukan RNA dan protein lain yang diperlukan (Mitchison, 1997)
8
Ghobrial et al (2005) menyatakan bahwa ada dua mekanisme utama pembunuhan sel yaitu necrosis dan apoptosis. Pada necrosis pembunuhan sel dilakukan oleh external injury sehingga necrosis merupakan program pembunuhan sel yang independen. Necrosis merupakan rute alternatif untuk mati yang sama-sama efisiennya dengan apoptosis dan dapat berfungsi sebagai mekanisme cadangan atau sebagai tipe utama program bunuh diri sel. Sedang apoptosis merupakan peristiwa bunuh diri sel yang dirangsang oleh internal diri sel sendiri atau eksternal yaitu jaringan di sekelilingnya.
Menurut Ghobrial et al (2005) bunuh diri terprogram sel merupakan mekanisme kontrol umum yang dilakukan sel–sel mati ketika DNA tidak dapat diperbaiki. Bunuh diri terprogram merupakan salah satu mekanisme pengendalian pertumbuhan sel yang biasa dikenal sebagai apoptosis. Pemahaman terhadap proses apoptosis memberi dasar untuk kemoterapi melalui induksi kematian sel kanker (Ghobrial et al., 2005). Proses apoptosis dapat terjadi melalui beberapa jalur. Salah satunya mempunyai kaitan erat dengan kanker adalah melalui induksi apoptosis oleh protein p53. Protein p53 merespon kerusakan DNA atau stress sel yang lain dengan menghambat siklus sel atau menginduksi apoptosis (Albert et al., 2002). Pada sel kanker mekanisme ini tidak bekerja secara normal.
Sejak awal tahun 1990an penelitian mengenai apoptosis berkembang pesat (Capaulade et al.,2001;Yu Jian & Zhang Lin.,2005). Proses apoptosis yang tidak sempurna dapat mengakibatkan timbul penyakit, apoptosis dalam jumlah besar akan menyembuhkan penyakit sedang dalam jumlah kecil atau sedikit akan menyebabkan kanker. Apoptosis dapat terjadi secara instan ketika suatu sel mengalami kerusakan melebihi yang diperbaiki, atau adanya infeksi oleh virus. Bila kemampuan sel yang mengalami apoptosis mengalami kerusakan misalnya mutasi atau jika inisiator apoptosis terhalang oleh virus maka sel akan rusak dan membelah terus menerus tanpa batas dan akan tumbuh menjadi kanker.
p53 Tumor Supressor
Protein yang berperan penting dalam proses pengecekan agar sel dapat memasuki fase S adalah gen tumor suppressor, gen tumor supressor yang pertama kali ditemukan adalah pRb pada retino blastoma manusia, meskipun pada akhirnya pRb menyebabkan tumor tetap bertahan ada. Tumor supressor yang cukup penting adalah p53 tumor supressor.
Protein p53 (gambar 2) memainkan peran penting di dalam proses seluler (Lane.,1992; Levine.,1993), p53 berperan sebagai aktivator transkripsi dari sejumlah kerusakan DNA .
Tumor Supressor memiliki fungsi antara lain:
1. Menekan gen-gen essensial untuk melanjutkan siklus sel. Bila gen tidak nampak maka siklus sel tidak berlanjut, sehingga menghambat pembelahan sel.
2. Berpasangan dengan DNA yang rusak. Selama DNA rusak di dalam sel maka dia akan mengalami pembelahan. Setelah kerusakan diperbaiki, siklus sel diteruskan.
3. Merangsang inisiasi sel untuk mengalami apoptosis, ketika kerusakan tidak dapat diperbaiki, maka sel harus diinisiasi untuk mengalami apoptosis agar menciptakan kondisi yang lebih baik di dalam organisme.
4. Mencegah penyebaran tumor, beberapa sel terlibat dalam penempelan sel tumor untuk mencegah penyebaran, dan menghalangi kehilangan kontak dengan penghambat serta menghambat metastasis.
10
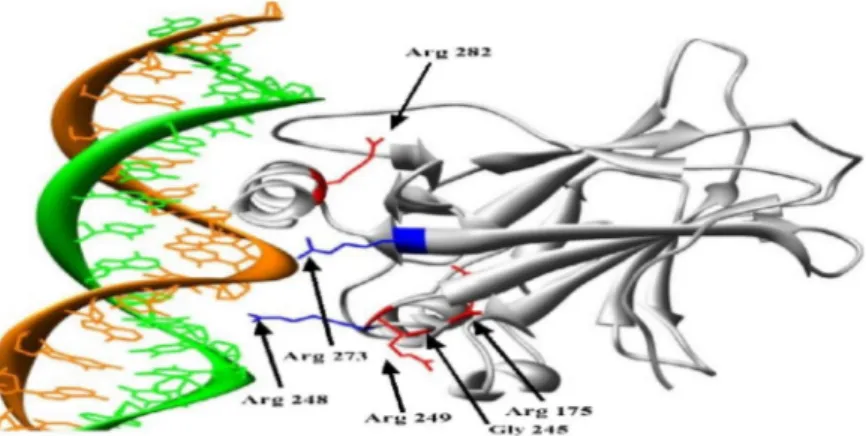
Gambar 2. Interaksi p53 dengan DNA. Asam amino Arg 273 berinteraksi langsung pada groove mayor DNA sementara itu Arg 248 berinteraksi pada groove minor DNA. Interaksi ini secara struktural distabilkan oleh 4 residu utama yakni Arg 175, Gly 245, Arg 249 dan Arg 282. Visualisasi menggunakan perangkat lunak chimera (Pettersen et al., 2004) dengan kode protein p53 1TSR.
Protein p53 merupakan faktor transkripsi yang mengatur siklus sel sehingga berfungsi sebagai tumor supressor. Pada manusia p53 berlokasi di kromosom 17 dan p53 terdiri dari rantai asam amino panjang (393 asam amino) yang terbagi 4 domain (gambar 3) yaitu : N-terminal Transcription –Activation Domain (TAD), sebagai pengaktif transkripsi, terdapat pada residu 1-44. Pusat DNA Binding Core Domain (DBD) yang berisi l seng dan residu asam amino yang berawal dari residu 102-292. C-terminal homo Oligomeration Domain (OD). Bertanggung jawab terhadap proses tetramerisasi yang berpengaruh pada peningkatan aktivitas p53 in vivo, yaitu pada residu 320-356. Dan domain regulator yang terdiri dari residu 356-393. (Zhao et al., 2001)
Gambar 3. urutan spesifik protein p53. Domain inti merupakan bagian yang berhubungan langsung dengan DNA (Bai dan Zhu, 2006)
Protein p53 berikatan secara tetramer merespon elemen-elemen melalui urutan– spesifik– Interaksi DNA domain inti yang terbentang dari residu asam amino 96-308 (Pavletich et al.,1993). Hollstein dan kawan-kawan (1991) studi dari tumor yang berhubungan dengan p53 termutasi memperlihatkan tidak efektifnya kemampuan p53 dalam merespon residu-residu urutan–spesifik– Interaksi DNA domain inti sehingga tidak dapat aktif melakukan proses transkripsi
Kira-kira 50% dari penyakit kanker yang diderita manusia dipengaruhi oleh kegagalan dari fungsi p53 (William Kaelin, 1999), p53 merupakan protein labil yang terdiri dari lipatan dan wilayah tidak berstruktur dimana fungsinya dalam sinergisitas gaya. Hilangnya fungsi p53 yang diakibatkan karena terjadinya mutasi sebagian besar terjadi pada domain inti (DNA-Binding) (Pavletich et al., 1993). Kebanyakan dari mutasi ini merusak kemampuan protein untuk berikatan dengan target pada DNA pasangannya, dan mencegah aktivitas transkripsi dari gen ini.
Protein p53 memiliki fungsi atau kegunaan dalam mekanisme kanker antara lain
1 Mengaktifkan protein untuk memperbaiki DNA ketika DNA mengalami kerusakan.
2 Mempertahankan siklus sel pada pengaturan G1/S perbaikan kembali DNA yang rusak.
3 Menginisiasi apoptosis, bunuh diri terprogram, jika kerusakan DNA tidak dapat diperbaiki.
Struktur Protein dan Mutasi
Struktur protein tersusun atas 4 tingkatan struktur, yaitu struktur primer, sekunder, tersier serta struktur kuartener. Struktur primer protein ditentukan oleh ikatan kovalen C karbonil dengan N antara residu asam amino yang berurutan membentuk ikatan peptida. Urutan, macam, jumlah asam amino yang membentuk rantai peptida merupakan struktur primer protein. Struktur sekunder protein terjadi karena ikatan hidrogen pada backbonenya, ikatan hidrogen dalam satu
12
rantai polipeptida memungkinkan terbentuknya konformasi spiral yang disebut struktur heliks. Bila ikatan hidogen tersebut terjadi antara dua rantai polipeptida maka akan membentuk rantai paralel dengan bentuk berkelok-kelok yang disebut β sheet (lembaran β). Struktur tersier protein terbentuk karena terjadi pelipatan (folding) rantai α heliks maupun β sheet. Kemantapan struktur tersier disebabkan oleh ikatan disulfida serta ikatan non kovalen yang menunjang terjadinya pelipatan. Ikatan non kovalen yang terjadi antara gugus rantai samping polipeptida terdiri dari ikatan hidrogen antar peptida, ikatan hidrogen rantai samping, ikatan elektrostatik, interaksi hidrofob serta ikatan van der walls. (Lehninger,1970)
Mutasi pada protein bisa akan membuat sruktur primer berubah, tetapi struktur sekunder dan tersier belum tentu berubah tergantung dari mutasi dan posisi residu yang termutasi. Mutasi dapat mengubah struktur sekunder dan tersier jika perbedaan rantai yang termutasi cukup signifikan, contoh: glisin yang tersubtitusi oleh tirosin yang memiliki rantai samping relatif lebih besar akan membuat struktur sekunder dan/atau struktur tersier protein tersebut berubah. Mutasi pada residu yang menjaga stabilitas struktur dengan energi destabilisasi struktur lebih dari 3 kkal/mol akan menyebabkan pembukaan lipatan protein secara luas pada suhu tubuh sehingga struktur tersier akan berubah. (Joerger et al., 2005).
Mutasi residu 273
Hilangnya fungsi protein p53 diakibatkan oleh mutasi 90% terjadi pada Domain inti, dari 90 % tersebut 40% mutasi terjadi pada residu-residu yang terkait dengan kanker yang dikenal dengan sebutan hot spots (Wang et al ,1999). Menurut Hainaut dan Hollstein (2000) enam hot spots yang sering terkait dengan kanker pada manusia adalah R175.G245, R248, R249, R273 dan R282.
Mutasi pada p53 domain inti akan menurunkan kemampuan protein p53 untuk dapat berinteraksi dengan targetnya pada DNA pasangannya, sehingga aktivitas transkripsi jadi terganggu.
Residu 273 merupakan residu yang kontak lansung dengan DNA, menurut Joerger dan kawan-kawan (2006) residu 273 merupakan residu yang berinteraksi
dengan DNA pada major groove. Pada p53 normal residu 273 merupakan senyawa arginin yang memiliki gugus guanidin, muatan positif gugus guanidium residu R273 berinteraksi dengan muatan negatif kerangka phospat pada DNA. Selain itu R273 juga membentuk jembatan garam dengan gugus karboksilat residu D281 pada heliks C-terminal (Joerger et al.,2005). Ketika Arginin residu 273 tersubtitusi oleh histidin maupun sistein maka gugus guanidin akan tergantikan oleh gugus imidazol pada histidin atau gugus thiol pada sistein. Gugus thiol maupun gugus imidazol relatif lebih pendek dibanding gugus guanidin sehingga interaksi dengan DNA makin melemah dan cenderung akan kehilangan kontak langsung dengan DNA.
Agen reaktivator p53
Pendekatan dalam pencegahan kanker yang biasa dilakukan antara lain dengan: pencegahan interaksi dengan agen penyebab kanker, meningkatkan mekanisme pertahanan terhadap kanker, modifikasi gaya hidup dan pencegahan dengan bahan kimia (Murray.,1998). Terapi dengan mengunakan bahan kimia atau yang dikenal dengan kemoterapi merupakan salah satu pendekatan yang sering dipakai. Dalam hal ini efek samping dari terapi dapat dihindari dengan target obat yang bersifat spesifik. Berdasarkan perbedaan kontrol pertumbuhan pada sel kanker dengan sel normal, mekanisme kontrol pertumbuhan melalui proses apoptosis sebagaimana gambar 4 merupakan target terapi yang menjanjikan (Wang et al., 2003).
14
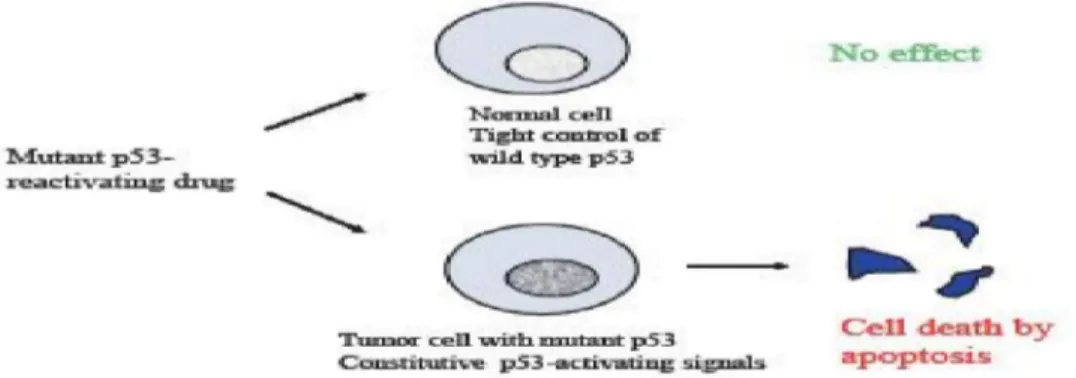
Gambar 4. Mekanisme reaktivasi p53 dengan kemoterapi, mutan p53 yang direaktivasi diharapkan dapat menginduksi terjadinya kematian sel dengan jalur apoptosis (Bykov et al., 2007).
Senyawa kemoterapi kanker pada umumnya merupakan senyawa hasil alam atau analognya dari hasil sintesis (Sun et al., 2004). Bahan alam seperti retinoid, polifenol dan vaniloid dapat menstimulasi apoptosis per-maglinan sel secara in vitro dan in vivo.
Proses pengembalian fungsi p53 melalui pengembalian konfomer domain inti dari p53 termutasi dengan molekul kecil telah dilakukan. Bukti-bukti menunjukkan bahwa fungsi p53 dapat dikembalikan dengan mengatur konfomasi mutan p53 sehingga menyerupai wild-type p53, senyawa yang digunakan antara lain PRIMA–1 oleh Bykov dan kawan-kawan (2002), dan pada tahun 2005 Bykov dkk mengunakan turunan maleimida (MIRA-1,MIRA-2 dan MIRA-3), CP-31398 oleh Wang dkk pada tahun 2003.
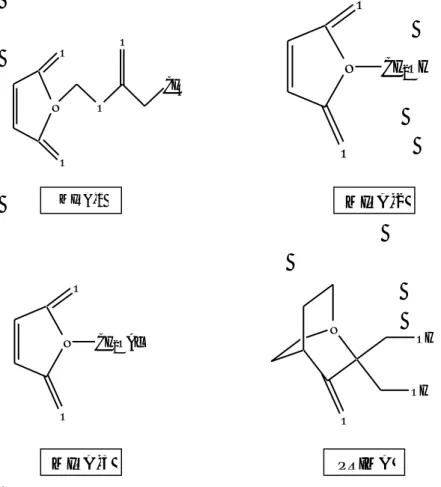
PRIMA-1 (gambar 5) telah diketahui dapat menghambat pertumbuhan tipe tumor melalui jalur yang bergantung pada p53, turunan maleimida (gambar 5) MIRA-1(1-propoksimetil-maleimida), MIRA-2 (1-hidroksimetil-maleimida), MIRA-3 (1-etoksimetil-maleimida) mempunyai fungsi serupa dengan PRIMA–1 (2,2-bis(hidroksimetil)-1-aza bisiklo [2,2,2] oktan-3-one) karena sama-sama memiliki gugus pendonor elektron yang akan berinteraksi dengan residu-residu pada protein targetnya. Permasalahan sitotoksisitas dan farmakolinetik masih
menjadi masalah bagi pengunaan senyawa-senyawa tersebut secara klinis. Struktur senyawa tersebut tidak menunjukkan kemiripan yang tinggi, sehingga untuk merancang suatu senyawa baru diperlukan informasi lebih dari kemiripan struktur. Melalui penelitian dengan metode docking diharapkan memperoleh informasi yang dapat digunakan untuk mempermudah proses penemuan senyawa yang dapat digunakan untuk terapi kanker secara spesifik.
Gambar 5 : Beberapa struktur senyawa reaktivator p53 yang terbukti secara eksperimen dapat merestorasi fungsi p53. Turunan maleimida dan PRIMA-1 N O CH3 O O O MIRA-1 N O O CH2OH MIRA-2 MIRA-3 N O O CH2OAc N OH OH O PRIMA
16
Docking
Aplikasi komputasi kimia salah satunya teknik docking yang merupakan sebuah studi untuk memprediksi struktur 3 dimensi suatu kompleks yang terbentuk antara suatu ligan dengan makromolekul, misalnya protein (Choi., 2005). Menurut Teodore dan kawan-kawan (2000) docking mampu memprediksikan kompleks ligan-protein dalam waktu yang cepat dan dengan biaya yang relatif murah. Metode docking dilakukan dengan menempatkan ligan secara sistematis pada situs aktif dari makromolekul (Morris et al., 1998)
Proses pengembalian fungsi p53 melalui pengembalian domain inti dari p53 termutasi memerlukan interaksi spesifik antara molekul kecil dengan makromolekul, problema interaksi spesifik dapat diselesaikan salah satunya dengan melihat kemungkinan-kemungkinan interaksi antara molekul kecil dengan makromolekul. Proses pencarian kemungkinan-kemungkinan interaksi tersebut dilakukan dengan menempatkan molekul kecil pada makromolekul secara sistematis yang dikenal dengan metode docking yang ditunjukkan oleh gambar 6. Dengan metode ini upaya pencarian molekul baru dapat digunakan untuk tujuan yang sama dapat dipercepat dan diturunkan biayanya.
Interaksi yang terjadi apabila suatu ligan ditempelkan pada suatu makromolekul, akan mempengaruhi struktur 3 dimensinya, yang dipengaruhi oleh adanya kontribusi interaksi elektrostatik, van der waals, ikatan hidrogen dan sumbangan interaksi yang lain. Akibatnya ada beberapa kemungkinan tipe konformasi bersama yang terbentuk. Konformasi yang terbentuk tersebut dalam docking diketahui dengan melihat tempat penempelan (binding site), tipe penempelan (binding mode) dan energi penempelan (binding energi) (Aatu kaapru & Janne ojanen, 2002).
Gambar 6. Skematik docking molekul antara ligan dengan protein target, ligan menempel pada situs (bagian) aktif pada protein. Proses penempelan atau docking dilakukan dengan komputerisasi (Samee W, 2006)
Menurut Kitchen et al., 2004 ada dua masalah umum yang dijumpai dalam docking molekul, masalah yang pertama adalah pemilihan fungsi energi yang digunakan selama proses docking serta pemilihan algoritma yang tepat. Proses docking dipengaruhi oleh afinitas ikatan antara ligan dengan reseptor. Afinitas ikatan ini tergantung oleh degree of freedom (DOF) dari ligan, untuk satu interaksi molekul dengan molekul yang lain terdapat enam kemungkinan konfigurasi atau ada enam degree of freedom (sumbangan 3 translasi dan 3 rotasi) (Teodoro et al., 1999).
Autodock merupakan software yang digunakan untuk proses docking. Algoritma yang disediakan dalam proses docking pada autodock adalah SA (Simulated Annealing Monte Carlo), algoritma genetik, Local search (LS) dan algoritma Lamarckian Genetik. Pemetaan dengan algoritma SA dilakukan secara acak ke seluruh area pada protein. Kelemahan metode ini hanya cocok untuk ligan yang fleksibelitasnya maksimal 8 ikatan yang mampu berotasi, diatas 8 perhitungan akan menjadi sulit karena banyaknya kemungkinan konfigurasi dalam docking sehingga global minimal sulit didapatkan. Algoritma Genetik dikenal juga sebagai traditional Darwinian genetic algoritm, karena dasar yang digunakan adalah teori genetik dan evolusi Darwin. Proses pemetaan tidak dilakukan secara acak sehingga peluang global minimal tercapai cukup besar, namun untuk protein yang memiliki cekungan (cavity) yang cukup dalam langkah
18
yang dilakukan banyak sehingga kurang efisien untuk mendapatkan posisi minimal. Local Search (LS), LS merupakan algoritma mencari energi pada lokal atau cekungan tertentu . LGA (Lamarckian genetic Algoritm) merupakan algoritma gabungan antara GA-LS (Genetic algoritma-local search), disebut LGA karena anak diperbolehkan untuk mewarisi adaptasi local search dari orang tuanya. Pada LGA optimasi global dilakukan mengunakan GA sedang optimasi lokal digunakan LS. Dengan algoritma gabungan ini cekungan yang cukup dalam yang dilakukan perhitungan sedang cekungan yang lain tidak terlalu diperhitungkan, kelebihan metode ini proses docking menjadi lebih efisien dan langkah yang digunakan tidak terlalu panjang (Huey and Morries., 2003).
Dalam sebuah docking, data dan keterangan interaksi ligan dengan makromolekul yang merupakan representasi translasi, rotasi dan konformasi diasumsikan sebagai variabel posisi dari ligan. Variabel posisi tersebut kemudian diasumsikan sebagai sebuah gen, dimana posisi ligan merupakan genotip sedangkan koordinat atom dari posisi ligan merupakan fenotip. “Fitnes” atau kemampuan interaksi merupakan total energi interaksi antara ligan dengan protein yang dihitung dengan fungsi energi pada persamaan1
E
dock=E
vdw+E
Hbond+E
electrostatik+E
internalPersamaan ……… 1 Dimana Evdw ; Energi dispersi E H-bond ; mengambarkan ikatan hidrogen
EElectrostatic ; merupakan energi elektostatik, sedangkan E internal meliputi
Econform ,Etor, serta Esol.. Esol yaitu mengambarkan desolvasi ikatan dan efek
hidrofobik sedangkan Econform adalah deviasi dari geometri kovalen dan E tor
mewakili retrisi dan rotor internal dari rotasi dan translasi global.
Algoritma Lamarckian Genetik
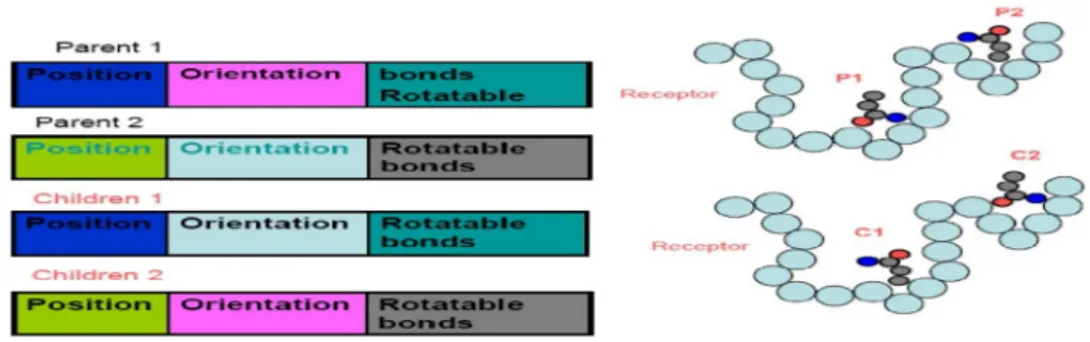
Algoritma genetik meniru kaidah dalam genetika. Kaidah genetika yang digunakan antara lain posisi dan orientasi dari gen. Algoritma genetik mengenal adanya mutasi hasil turunan individu pada populasi awal serta terjadinya crossover yang ditunjukkan pada gambar 7 yaitu konformasi turunan yang
merupakan penyilangan antara dua konformasi yang dianggap sebagai parental. Persilangan parent (induk) 1 dan parent (induk) 2 akan menghasilkan individu baru dengan sifat campuran. Gambar 7 mengilustrasikan induk 1 dan induk 2 menghasilkan turunan dengan orientasi saling bersilangan, turunan 1 memiliki orientasi sama dengan induk 2 sedang turunan 2 memiliki orientasi sama dengan induk 1. Dari hasil persilangan akan menghasilkan individu yang memiliki sifat campuran dari kedua induknya.
Gambar 7.Prinsip genetik algoritma terjadinya crossover turunan yang dihasilkan oleh parental 1 dan parental 2. Kiri mengambarkan genotip pada induk dan anak yang diwakili posisi, orientasi serta ikatan yang dapat berotasi pada ligan sedang gambar kanan merupakan ilustrasi gambar kiri dalam penerapan docking (Ravichandran, 2006).
Individu-individu baru dari populasi awal baik yang turunan asli ataupun yang mengalami mutasi dan crossover masing-masing dihitung fitnessnya. Pada Autodock proses akan terus berulang sampai didapatkan individu yang bagus yaitu dengan fitness yang minimal (Morris et al., 1998).
Pada proses penterjemahan masing-masing genotip individu ke fenotip, fitness masing–masing individu dievaluasi setiap saat. Fitness dari tiap-tiap individu di hitung untuk menentukan individu yang layak untuk beregenerasi (membuat individu baru). Proses seleksi merupakan bagian penting dalam algoritma ini untuk menentukan populasi baru. Seleksi ini menggunakan rumus pada persamaan 2. Dalam persamaan ini, apabila selisih antara individu terjelek (fitness terbesar) dengan fitness tiap individu serta fitness rata-rata hampir sama,
20
maka akan didapatkan jumlah individu turunan yang dihasilkan dengan nilai integer. Dengan demikian tidak semua populasi awal akan menghasilkan keturunan karena tiap individu dengan energi terbesar akan dibuang. Proses akan berhenti apabila jumlah individu baru tinggal satu setelah beberapa generasi. Selain itu apabila individu terjelek dengan rata-rata individu sama maka proses akan langsung berhenti dan proses dianggap telah konvergen. Di bawah ini adalah persamaan algoritma yang digunakan dalam proses seleksi
n ff ff fw f w i w ≠ − − = ; 0 Persamaan ………..2 Keterangan: w
f = Individu dengan fitness terbesar (Energi yang tertinggi)
fi = fitness tiap individu f = rata-rata fitness
0
n = jumlah individu yang dipertahankan
w
f akan selalu lebih besar dari f maupun f , kecuali jika i f = f i yang artinya dalam proses docking populasi diasumsikan telah konvergen dan proses docking akan berakhir(Morris et al, 1998). Perhitungan dengan algoritma Lamarckian Genetik memberikan nilai residual error hasil perhitungan konstanta ikatan kompleks sebesar 2.177 kkal/mol (Morris et al.,1998). Nilai residual error menunjukkan akurasi perhitungan dengan autodock dapat digunakan untuk menunjukkan interaksi spesifik antara ligan dengan makromolekul pada umumnya.
Persilangan yang diikuti mutasi akan mempengaruhi individu baru yang mampu bertahan, secara matematis mutasi dibentuk dengan menambahkan suatu bilangan real acak yang memiliki distribusi Cauchy. Distribusi Cauchy disajikan pada persamaan 3
( , , ) π
(
β2(
α χ)
2)
β χ β α − − = C ...Persamaan 3α
≥ 0, β≥ 0, - ∼ < χ < ∼Dimana α dan β merupakan parameter yang mempengaruhi rerata dan sebaran distibusi.
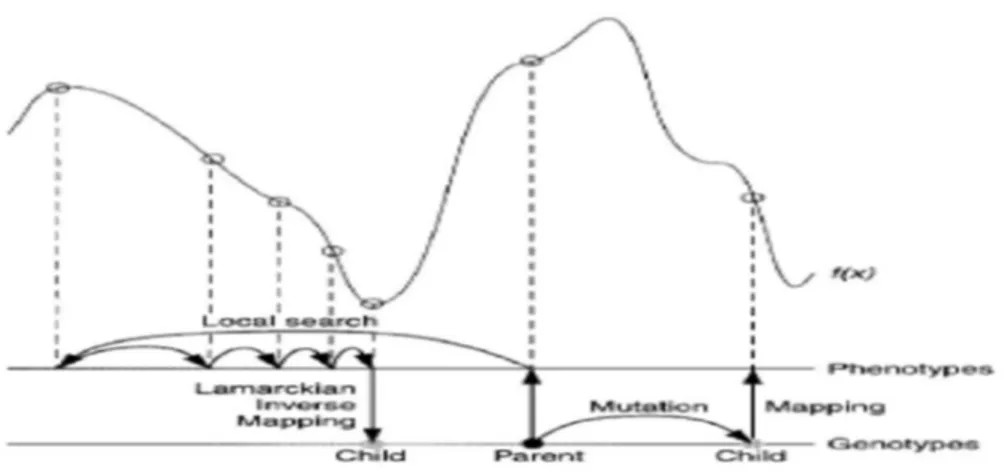
Kekurangan GA, jika protein memiliki potensial energi surface yang dalam atau lebar serta dalam jumlah yang banyak maka akan diperlukan langkah yang banyak dan kurang efisien untuk mendapatkan posisi yang minimal. (Ravicandran, 2006). Untuk mengatasi kelemahan GA maka digunakan algoritma hibrid yaitu gabungan antara GA dengan local search (LS) yang dikenal dengan istilah Lamarckian Genetic Algoritm (LGA). Metode ini membuat langkah proses docking tidak terlalu panjang dan lebih efisien (Morris et al., 1998). Dalam data hasil docking dan keterangan interaksi ligan dengan makromolekul mengambarkan translasi, rotasi dan konformasi yang diasumsikan sebagai variabel posisi dari ligan. Variabel posisi tersebut kemudian diasumsikan sebagai sebuah gen, dimana posisi ligan merupakan genotip dan koordinat posisi ligan merupakan fenotip ini dapat digambarkan pada gambar 8 yang mengambarkan proses perhitungan pada LGA.
22
Gambar 8 mengilustrasikan proses perhitungan algoritma Lamarckian Genetik. Garis mendatar terbawah merepresentasikan genotip, sedangkan fenotip direpresentasikan garis datar di atasnya. Genotip dipetakan ke fenotip dengan fungsi pemetaan f (x). Gambar sisi kanan mengambarkan perhitungan algoritma genetik dan sisi kiri local search.
B. KERANGKA PEMIKIRAN
Protein p53 merupakan salah satu pemicu proses apoptosis, hilangnya fungsi protein p53 karena mutasi dapat mengganggu proses apoptosis dan mengakibatkan terganggunya mekanisme pengendalian pertumbuhan sel yang tidak terkendali yang biasa disebut tumor. Residu 273 salah satu hot spot yang sering mengalami mutasi dan menyertai kanker seperti kanker pada usus, paru-paru dan payudara. Untuk mengobati kanker biasanya dilakukan kemoterapi dengan obat-obat kanker yang berupa peptida pendek maupun Ligan. Dari eksperimen Bykov molekul ligan (PRIMA –1, Turunan Maleimida (MIRA-1, MIRA-2, MIRA-3) telah terbukti dapat menghambat kanker dengan mengembalikan aktivitas p53. Dari hasil penelitian Bykov dkk, 2002 PRIMA-1 mampu merestorasi mutan p53 pada R273H sedang turunan maleimida MIRA-1 lemah untuk membuat mutan R273 pada p53 termutasi kembali berinteraksi dengan DNA, dari hasil eksperimen ini belum dapat diketahui interaksi yang terjadi antara ligan dengan p53 termutasi pada residu 273. Oleh karena itu diperlukan suatu studi untuk mengetahui interaksi yang terjadi mengunakan metode docking dengan terlebih dulu ligan dioptimasi kemudian membandingkan energi ikatan antara ligan dengan wild-type p53/p53 termutasi residu 273 pada sisi potensial dari reseptor yang merupakan kontribusi dari ikatan hidrogen dan gaya van der waals. Hasil docking ditentukan situs beda yaitu situs yang dimiliki p53 termutasi tetapi tidak dimiliki wt-p53. Interaksi yang terjadi pada situs beda (Binding mode) dianalisis apakah interaksi tersebut dapat membuat p53 termutasi 273 menyerupai wt-p53.
C HIPOTESIS
1. Tempat terjadinya interaksi yang memiliki kebolehjadian tertinggi antara PRIMA-1 dan turunan maleimida berbeda.
2. Jenis mutasi residu 273 akan mengarahkan tempat-tempat interaksi ligan dan makromolekul.
3. PRIMA-1 merupakan ligan yang selektif terhadap p53 termutasi R273H dan/atau R273C
24 BAB III
METODOLOGI PENELITIAN
Metode Penelitian
Metode penelitian yang digunakan adalah teoritis dengan teknik docking yaitu memetakan interaksi mikromolekul (Ligan) dengan makromolekul (Wild-type p53/p53 termutasi residu 273), kemudian melihat interaksi spesifik antara ligan dengan residu 273.
Tempat dan Waktu Pelaksanaan
Penelitian dilakukan laboratoriun komputasi jurusan kimia F MIPA UNS dari bulan Maret 2007-Februari 2008.
Alat dan Bahan
1. Alat
Peralatan yang digunakan dalam penelitian ini adalah :
Komputer dengan spesifikasi: prosesor AMD X2 3600+, RAM 512MB, dan hard disk 250 GB.Software autodock versi 3.0 (Morris et al., 1998), autodocks versi 1.5(Sanner et al.,2000),chimera (Pettersen et al., 2004), Molden (Klinsky et al.,2004) Rasmol versi 2.7 (Bernstein et al.,1998).
2. Bahan
a. Struktur Wild-type p53 pada manusia kode PDB=1 GZH (Derbyshire et al ,2002) serta Wild-type p53 pada tikus kode PDB =2IOO (Zhao et al ,2006) b. Struktur p53 termutasi pada R273H dengan kode PDB=2BIM (Joeger et a,l 2005 dan R273C ,kode PDB =2J20 (Joeger et al 2006).
Prosedur Penelitian
Optimasi Geometri senyawa reaktivator p53
Struktur senyawa reaktivator (PRIMA-1, MIRA-1, MIRA-2, MIRA-3) dipersiapkan melalui optimasi geometri berdasar struktur 2 dimensi dengan program molden (Klinsky et al, 2000), kemudian dioptimasi geometri dengan dengan gaussian 98 pada level teori HF dengan basis set 6 -31G*. Struktur yang selesai dioptimasi disimpan sebagai ligan pdb yang akan digunakan dalam proses docking.
Pemetaan Interaksi Spesifik dengan docking Mengunakan program autodock3. a. Penyiapan ligan
Struktur ligan dengan tipe file pdb yang telah dioptimasi ditambahkan muatan parsialnya dengan metode Geistager, dihilangkan hidrogen non polar dan ditentukan end rootnya (atom pusat rotasi) serta bagian-bagian yang rotatable (dapat berotasi) dan unrotatable (tidak dapat berotasi) dan disimpan dalam pdbq.
b. Persiapan Makromolekul
Struktur protein p53 dari Protein Data bank (PDB) diambil domain inti, kemudian dipilih cincin yang utuh. Molekul tersebut dihilangkan airnya jika ada, ditambahkan hidrogen polar serta dihilangkan hidrogen non polarnya kemudian muatannya diparameterisasi dengan metode kollman jika belum integral maka muatan yang tidak integral disebar sehingga menjadi integral selanjutnya ditambahkan paramerisasi solvasi atomik untuk logam Zn diganti M dan dimasukkan akan Rii =1.10 dan epsii :0.0125 kemudian disimpan dalam makromolekul. pdbqs dan secara manual parameter atom Zn diubah M.
c. Docking Awal
Makromolekulqs dan ligan.outq dibuatkotak (grid box), ukuran kotak dibuat maksimal dengan maksud agar ligan dapat bergerak dengan bebas pada makromolekul, pusat dari box pada pusat massa makromolekul.
26
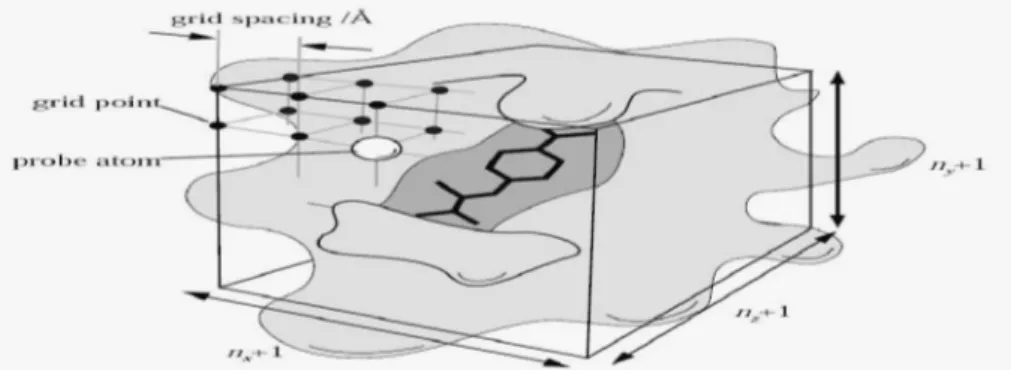
Adapun gridbox yang dimaksud adalah ruang dimana ligan dapat bergerak bebas dalam makromolekul seperti terlihat dalam Gambar 9 .Parameter lain mengacu pada pengatutan asli dari autodock. Dan perhitungan autogrid dijalankan.
Gambar 9. Grid map, Ligan dapat berikatan dengan makromolekul pada situs aktif dari makromolekul dan setiap kemungkinan pergerakan atom dilakukan penghitungan (Morris et al ., 1998)
Proses autogrid selesai maka makromolekul dan ligan disiapkan dan metode perhitungan dipilih Algoritma genetik dengan parameter docking jumlah langkah 250 dan setiap langkah dilakaukan perulangan perhitungan energi sebanyak 250.000 kali. Parameter yang lain mengacu pada pengaturan asli autodock (Sanner, et al.,2000) .Kemudian disimpan dalam lamarckian GA selanjutnya proses autodock dijalankan. Setelah perhitungan selesai klaster–klaster dianalisis dan dicek situs-situs potensial dengan bantuan chimera.
d. Docking Lanjut
Situs-situs yang berpotensi dapat diakses oleh ligan di docking lanjut dengan memperkecil ukuran box dengan syarat ligan dapat bergerak bebas pada situs tersebut, dan sebagai pusatnya adalah ligan dengan pusat koordinat pada root (sumbu rotasi). Setelah autogrid lanjut selesai kemudian didocking lanjut dengan mengubah jumlah perulangan perhitungan energi menjadi 50.000.000 serta jumlah rlangkah diperkecil menjadi 20. Analisis hasil dilakukan dengan Autodocks dan Chimera
E TEKNIK PENGUMPULAN DATA
Pengumpulan Data
Data yang diambil adalah interaksi spesifik antara ligan (PRIMA-1, MIRA-1,MIRA-2,MIRA-3) dengan makromolekul (Wild-type p53/p53 termutasi residu 273 ). Interaksi yang terjadi berupa energi ikat yang merupakan kontribusi ikatan hydrogen dan van der waals, dari data energi ikat dan model ikatan yang terjadi dapat diperkirakan situs potensial ligan serta perkiraan model restorasi p53 termutasi residu 273.
Analisa Data
Dari informasi interaksi spesifik ligan dengan reseptor (Wild-type p53/p53 termutasi 273) yang berupa energi penempelan (Binding Energi) dilakukan analisis dengan melakukan pengelompokan klaster–klaster yang memiliki binding energi terendah dengan RMSD (Root Mean Square Deviation) maksimal 0.5. Dari pengelompokkan klaster tersebut diamati posisi penempelannya dan dianalisis apakah posisi tersebut memungkinkan. Situs yang memungkinkan terjadi binding didocking lanjut. Dari hasil docking lanjut binding energi dibandingkan antara 1GZH dengan 2BIM dan 2J20 untuk masing-masing ligan. Apakah ada situs beda, yaitu situs yang tidak dimiliki oleh 1GZH tetapi dimiliki oleh 2BIM dan atau 2J20. Jika ada situs beda, maka situs beda tersebut dianalisis tipe penempelannya (binding mode), dari binding mode dapat diperkirakan ligan memiliki peluang atau tidak untuk merestorasi fungsi mutan p53 R273H dan atau mutan p53 R273C.
28 BAB IV
HASIL DAN PEMBAHASAN
A. Pemetaan Interaksi Turunan Maleimida pada protein p53 Pemetaan interaksi antara turunan maleimida (MIRA-1, MIRA-2, MIRA-3) pada protein wt p53 dan p53 termutasi residu 273 bertujuan untuk mengetahui interaksi spesifik yang terjadi. Selain p53 normal manusia digunakan p53 normal pada tikus sebagai pembanding untuk mengetahui apakah terdapat perbedaan yang cukup signifikan terhadap interaksi yang terjadi. Hasil yang diperoleh akan menjadi pertimbangan pada pengujian secara in vitro. Apabila terjadi perbedaan interaksi cukup kuat ada kemungkinan terdapat perbedaan pengaruh ligan pengujian dengan tikus dan pengujian langsung pada manusia.
Pemetaan awal diperoleh beberapa situs potensial pada domain inti p53. Situs-situs potensial hanya pada bagian yang memungkinkan untuk terjadinya interaksi. Bagian rantai yang berikatan dengan tetramer lainnya diabaikan karena daerah tersebut memiliki kebolehjadian yang sangat kecil untuk terjadinya interaksi antara ligan dengan makromolekul p53. Interaksi spesifik turunan maleimida dapat diketahui dengan evaluasi lebih detail terhadap situs– situs awal yang diduga berpotensi melalui docking lanjut. Verifikasi terhadap situs pada docking awal maupun docking lanjut dilakukan untuk mengetahui perubahan energi maupun posisi ligan pada makromolekul. Analisis lebih detail terhadap interaksi yang terjadi perlu dilakukan untuk mengetahui kemungkinan terjadinya pola interaksi yang berbeda antara wt p53 dengan p53 termutasi pada residu 273. Proses docking lanjut dengan langkah docking diturunkan 20 kali dan masing-masing langkah dilakukan evaluasi energi 50.000.000 kali diharapkan akan ditemukan tempat interaksi spesifik turunan maleimida terhadap makromolekul p53.
Hasil pemetaan interaksi turunan maleimida diambil situs dengan energi yang terendah. Kemudian energi tersebut dibandingkan antara satu ligan dengan ligan yang lain maupun antara makromalekul wt p53 dengan p53 termutasi residu 273. Penomoran situs 1 sampai 5 berdasarkan urutan energi terendah dari hasil pemetaan MIRA-1 terhadap 1GZH, sedangkan situs 6 sampai 8 mengikuti dari urutan situs berikutnya sesuai penyajian tabel 1. Hasil pemetaan tersebut dapat dilihat pada gambar 10.
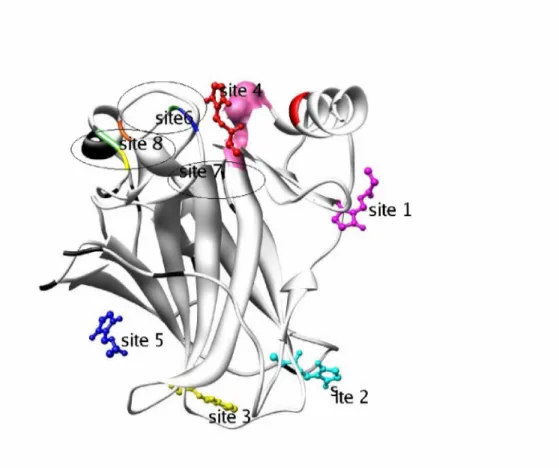
Gambar 10. situs dengan energi terendah yang dapat diakses oleh turunan maleimida pada makromolekul p53 sesuai data pada tabel 1. Pita merupakan makromolekul p53 normal pada manusia, sedangkan bola dan stik adalah ligan. Situs yang ditunjukan pada p53 normal relatif sama dengan p53 termutasi residu 273. Tanda Oval merupakan posisi situs beda.
30
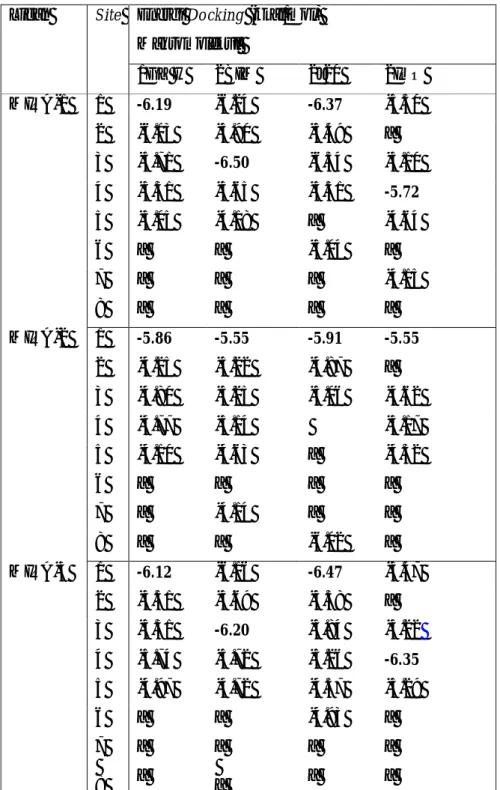
Tabel 1. Hasil docking lanjut Turunan Maleimida pada situs dengan energi terendah. Situs-situs tabel 1 mengacu pada gambar 10.
Energi Docking (kkal/mol) Makromolekul Ligan Site 1GZ H 2BIM 2J20 2IOO 1 -6.19 -6.24 -6.37 -5.50 2 -6.03 -5.90 -5.49 _ 3 -5.71 -6.50 -6.34 -5.10 4 -5.31 -5.65 -5.51 -5.72 5 -5.05 -4.18 _ -4.64 6 _ _ -5.04 _ MIRA-1 7 8 _ _ _ _ _ _ -4.15 _ 1 -5.86 -5.55 -5.91 -5.55 2 -4.25 -5.22 -4.87 _ 3 -4.80 -5.25 -5.06 -4.62 4 -4.77 -5.14 -5.17 5 -4.10 -4.63 _ -4.32 6 _ _ _ _ 7 _ -4.14 _ _ MIRA-2 8 _ _ -6.02 _ 1 -6.12 -6.16 -6.47 -5.47 2 -5.51 -5.69 -5.38 _ 3 -5.31 -6.20 -5.84 -5.22 4 -5.74 -5.72 -5.26 -6.35 5 -4.97 -4.72 -4.57 -5.29 MIRA-3 6 7 8 _ _ _ _ _ _ -4.93 _ _ _ _ _ Tanda _ menunjukkan situs tersebut tidak diakses oleh ligan.
Pemetaan ketiga ligan turunan Maleimida: MIRA-1, MIRA-2 dan MIRA-3 pada 2IOO memiliki situs-situs yang hampir sama dengan 1GZH (tabel 1), karena struktur 2IOO dengan 1GZH serupa tapi tidak sama hal ini dapat dilihat dari gambar 11. Secara struktural p53 manusia dengan p53 tikus hampir sama, meskipun ada beberapa urutan asam amino yang berbeda terutama asam amino yang membentuk loop.
Gambar 11. a) p53 normal pada manusia (1GZH ) (b) p53 normal pada tikus (21OO). Terdapat 3 perbedaan utama antara makromolekul p53 normal pada tikus dan manusia yang ditunjukkan dengan tanda kotak, namun perbedaan ini tidak terlalu mempengaruhi pola interaksi ligan terhadap p53 normal pada manusia dan tikus hal ini didukung oleh data tabel 1 .
Situs beda merupakan situs atau daerah yang tidak diakses ligan pada wt p53 (p53 normal) tetapi diakses oleh ligan pada p53 termutasi. Gambar 10 situs beda (situs 6, situs 7 dan situs 8) berada di sekitar residu 273 yang termutasi ini menunjukkan bahwa mutasi dapat mengarahkan tempat interaksi.
Situs-situs yang diakses oleh MIRA-1 dan MIRA-3 pada 2BIM memiliki energi yang tidak terbedakan (tabel 1) karena masih dalam range residual error perhitungan autodock yaitu 2.177 kkal/mol. Situs beda (situs 6) MIRA-1 dan MIRA-3 setelah dievaluasi lanjut MIRA-1 dan MIRA-3 pada situs tersebut berpindah ke situs 4, artinya bahwa MIRA-1 dan MIRA-3 kurang menyukai posisi situs 6. MIRA-1 dan MIRA-3 tidak cukup stabil pada situs 6 sehingga MIRA-1
32
dan MIRA-3 belum mampu membedakan p53 normal dengan p53 termutasi R273H (arginin tersubtitusi histidin).
Hasil pemetaan pada 2J20 (p53 termutasi R273C) MIRA-1 dan MIRA-3 muncul situs beda (situs 6) yang tidak diakses pada p53 normal. Ini menunjukkan bahwa MIRA-1 dan MIRA-3 dapat membedakan antara p53 normal dengan p53 termutasi R273C. Energi antara situs-situs pada 2J20 belum cukup terbedakan karena selisihnya masih dalam range residual error program autodock yaitu 2.177 kkal/mol, sehingga situs 6 memiliki peluang hampir sama dengan situs yang lain untuk diakses MIRA-1 dan MIRA-3 .
MIRA-2 dapat membedakan antara p53 normal dengan p53 termutasi 273 baik pada 2BIM maupun 2J20. Ini ditandai dengan munculnya situs beda pada 2BIM yaitu situs 7 dan situs 8 pada 2J20, situs tersebut tidak diakses MIRA-2 pada 1GZH (p53 normal). Situs beda MIRA-2 pada 2J20 dan 2BIM memiliki energi yang belum cukup terbedakan dengan energi pada situs terendah yang lain, karena masih dalam batas nilai residual error perhitungan autodock. Sehingga situs beda ini memiliki peluang sama dengan situs dengan energi terendah yang lain untuk dapat diakses oleh MIRA-2.
Tipe mutasi akan mempengaruhi situs spesifik (situs beda) yang dapat diakses oleh ligan, MIRA-2 memiliki situs yang berbeda jika dipetakan pada 2BIM dan 2J20, MIRA-1 dan MIRA-3 hanya memiliki situs beda pada 2J20, namun pada 2BIM situs dengan energi terendah berpindah ke situs 3. Selain itu faktor sterik ligan juga mempengaruhi pola pemetaan. MIRA-1 dan MIRA-3 tidak memiliki situs beda ketika dipetakan ke p53 termutasi R273H sedangkan MIRA-2 yang memiliki rantai samping yang lebih pendek mampu membedakan p53 normal dengan p53 termutasi R273H. Pemetaan turunan maleimida pada 2J20, MIRA-2 dengan jumlah gugus karbonil yang lebih sedikit memiliki situs beda yang tidak sama dengan MIRA-1 dan MIRA-3 yang memiliki gugus karbonil lebih banyak (gambar 5). Sedangkan MIRA-1 dan MIRA-3 dengan jumlah karbonil yang sama memiliki situs yang sama ketika dipetakan pada p53 termutasi R273C (2J20).
Situs beda (6, 7 dan 8) yang diakses turunan maleimida berada pada sekitar hot spot 273 (Gambar 10). Posisi penempelan ( Binding site) turunan maleimida yang mampu membedakan p53 normal dengan p53 termutasi memiliki peluang untuk merestorasi p53 termutasi residu 273 agar kembali binding dengan DNA. Potensi ligan tersebut harus dievaluasi binding mode (tipe interaksi) ligan dengan residu-residu p53 disekitar situs beda. Tabel 2 menunjukkan hasil docking lanjut lebih detail dari situs beda turunan maleimida.
Tabel 2 : Ringkasan hasil docking lanjut Turunan Maleimida terhadap 2J20 dan 2BIM pada posisi situs beda.
Situs beda Jumlah
Klaster Jumlah populasi Dalam klaster Terendah Energi final docking (kkal/mol) Energi rata-rata Docking (kkal/mol) Energi ikat (kkal/mol) Situs 6, MIRA-1 pada 2J20 2 16 -5.04 -5.03 -4.17
Situs 7, MIRA-2 pada 2JBIM
1 20 -4.15 -4.14 -3.74
Situs 8, MIRA-2 pada 2J20
3 17 -6.02 -6.00 -5.72
Situs 6, MIRA-3 pada 2J20
1 20 -4.93 -4.92 -3.95
Jumlah klaster situs 6 MIRA-1 pada 2J20 ada 2, artinya ada dua kemungkinan posisi dan/atau orientasi situs 6 MIRA-1 pada 2J20. Pengecekan pemetaan MIRA-1 pada 2J20 dengan visualisasi chimera, 2 klaster tersebut berada pada situs yang sama tetapi berbeda orientasi disebabkan bagian ligan yang dapat berotasi. Residu-residu pada 2J20 yang berinteraksi dengan MIRA-1 pada situs 6 antara klaster satu dengan yang lain sama, pembedanya adalah jumlah ikatan hidrogen pada residu lys 139. Klaster dengan energi terendah jumlah ikatan hidrogen pada Lys 139 ada tiga. Karena adanya perbedaan orientasi ikatan hidrogen pada lys 139 berkurang satu sehingga energi ikat relatif lebih tinggi dan
34
pada hasil pemetaan akan muncul jumlah klaster lebih dari 1, maka situs 6 MIRA- 1 pada 2J20 akan memiliki interaksi yang relatif fleksibel, kadang kuat kadang melemah.
Jumlah klaster situs 6 MIRA-3 pada 2J20 adalah 1 begitu juga situs 7 MIRA-2 pada 2BIM ini menandakan ligan pada situs tersebut relatif stabil dengan deviasi energi dockingnya relatif kecil, karena selisih energi docking terendah dan energi rata-rata adalah 0.01 kkal/mol.
Situs 8 MIRA-2 pada 2J20 terdapat 3 klaster setelah divisualisasi posisi situs tersebut dengan chimera, 2 klaster terjadi perpindahan situs dengan energi yang relatif lebih tinggi daripada energi klaster yang tetap berada pada situs 8. situs 8 memiliki presisi yang relatif lebih tinggi ini ditandai dengan jumlah random 17 dari 20 (peluang situs tersebut diakses oleh ligan 17/20), dengan kata lain 3 ligan MIRA-2 berada pada situs lain, dengan presisi yang sangat rendah.
Analisis jumlah kluster menunjukan ligan turunan maleimida pada situs beda relatif stabil. Visualisasi hasil pemetaan pada situs beda akan membantu menganalisis interaksi yang terjadi pada situs tersebut. Visualisasi interaksi situs beda turunan maleimida disajikan pada gambar 12,13,14 serta 15.
Gambar 12. Peta interaksi MIRA-1 dengan asam amino pada situs sekitar hot spots 273. MIRA-1 digambarkan sebagai bola dan stik.
a. visualisasi 1GZH b 2J20 sekitar residu hot spots 273. Pada 1GZH tidak ada ligan yang cukup dekat dengan situs tersebut.
Pada klaster terendah terdapat 5 ikatan hidrogen, yaitu 3 ikatan hidrogen pada residu lisin 139, dari H pada NH2 gugus amino berinteraksi dengan O
karbonil pada MIRA-1, 1 ikatan hidrogen pada residu Leusine 137 H pada gugus NH2 berinteraksi dengan O karbonil pada MIRA-1, dan yang terakhir 1 ikatan
hidrogen pada residu Tirosin 239, dimana H pada OH gugus fenolik-OH berinteraksi dengan O karbonil pada MIRA-1 (gambar 20 lampiran 1), jika dievaluasi binding site dan binding mode serta pengaruh interaksi dengan residu lain belum ada kemungkinan MIRA-1 melakukan reaktivasi p53 termutasi R273C, karena ikatan hidrogen pada ketiga residu tersebut belum berpotensi untuk membuat 2J20 mirip dengan 1GZH (gambar 12), sehingga MIRA-1 dimungkinkan belum dapat membuat p53 termutasi R273C kembali binding dengan DNA, diduga MIRA-1 hanya menempel saja pada p53 termutasi R273C tanpa memiliki potensi untuk mengaktifkan kembali fungsi p53 termutasi R273C. Hal ini sejalan dengan eksperimen Bykov tahun 2002.
MIRA-3 memiliki rantai samping relatif lebih panjang dari MIRA-1 tetapi jumlah karbonilnya sama, kedua ligan tersebut memiliki situs beda yang sama yaitu situs 6. Analisis binding mode situs 6 MIRA-3 (gambar 13) residu-residu yang berinteraksi sama dengan situs 6 pada pemetaan interaksi MIRA-1 terhadap 2J20 (gambar 12). Ada perbedaan interaksi pada lisin139, pada MIRA-3 terjadi penurunan jumlah ikatan hidrogen sehingga energi pada situs 6 MIRA-3 relatif lebih tinggi dibanding MIRA-1. Hasil docking lanjut MIRA-1 menghasilkan 2 klaster, klaster kedua memiliki energi relatif lebih tinggi dari klaster pertama. Interaksi klaster kedua pada situs 6 MIRA-1 sama dengan MIRA-3.