PREDIKSI SOLUBILITAS GAS CO2 DI DALAM LARUTAN POTASIUM KARBONAT DAN MDEA MENGGUNAKAN
MODEL ELEKTROLIT UNIQUAC
Saidah Altway ( 2306100091 ), Kusendra Dwi Marhetha ( 2306100106 ) Pembimbing : 1. Dr. Ir. Kuswandi, DEA
2. Ir. Winarsih
Laboratorium: Thermodinamika PENDAHULUAN
Gas CO2 sering dinamakan sebagai gas asam. Karena sifat asamnya ini, CO2 tergolong
gas impurities yang sangat merugikan. Gas CO2 bersifat korosif, menurunkan nilai kalor
pembakaran turbin, menimbulkan pembekuan pada proses pendinginan, dan juga merupakan racun terhadap katalis sintesa amoniak. Melihat besarnya kerugian yang dapat ditimbulkan oleh CO2, maka penting sekali dilakukan proses pemisahan CO2 dari aliran gas. Proses removal gas
CO2 dari gas proses yang banyak diaplikasikan di industri kimia adalah absorpsi disertai reaksi
kimia dari gas CO2 menggunakan pelarut K2CO3 dengan penambahan amine sebagai promotor.
Winarno et al (2008) melakukan penelitian mengenai proses absorpsi disertai reaksi kimia gas CO2 memakai larutan K2CO3 dan bahan aktivator DEA. Penelitian dilakukan dengan
menggunakan metode wetted wall column sedangkan hasil eksperimen dikorelasikan dengan model ENRTL. Hasil eksperimen menunjukkan bahwa kenaikan konsentrasi CO2 dalam gas
umpan pada temperatur konstan akan menyebabkan kenaikan CO2 loading, kadar KHCO3,
kelarutan CO2, dan tekanan parsial kesetimbangan CO2, serta penurunan kadar K2CO3.
Dari penelitian didapatkan data solubilitas gas CO2 di dalam larutan potasium karbonat
dengan promotor MDEA pada variasi tekanan dan komposisi K2CO3-MDEA dengan
menggunakan model elektrolit-UNIQUAC, di mana data solubilitas tersebut dapat digunakan sebagai acuan untuk merancang packed column absorpsi/stripping CO2.
METODOLOGI
Untuk sistem CO2-K2CO3-MDEA-H2O terjadi reaksi sebagai berikut :
2 H2O H3O+ + OH- K1 CO2 + 2 H2O H3O+ + HCO3- K2 HCO3- + H2O H3O+ + CO32- K3 MDEAH+ + H2O H3O+ + MDEA K4 Neraca Elemen : 0 2 3 2 tot H HCO O H n n x x tot (1) 2 32 3 0 tot tot C HCO CO CO n n x x x (2) 2 2 2 3 32 3 3 0 tot tot O HCO CO CO O H n n x x x x (3) 0 tot MDEA MDEA n n x tot (4) 0 tot tot K K n n x (5)
Neraca Komponen : 0 2 2O H O H (6) 0 2 2 C O CO (7) 0 3 3 H C O HCO (8) 0 MDEA MDEA (9) 0 3 2 3 C O CO (10) 0 K K (11) 0 1 3 2 3 2 2O CO CO HCO K MDEA H x x x x x x (12) Di mana : i i o i i x RT ln ln (13) RT k k (14) MDEA K HCO CO CO O H tot n n n n n n n 3 2 3 2 2 (15) xi= ni/(ntot) (16)
Dengan setting awal i = 1, maka ada 12 persamaan dengan 12 variabel yang tidak
diketahui yaitu:
-H,C,O,K,MDEA
- Enam fraksi mol komponen di fasa cair xi: K CO MDEA HCO CO O H x x x x x x , , , , 2 , 3 3 2 2
- Mol total di fasa cair : ntot
Setelah didapat fraksi mol masing-masing komponen di fasa cair dengan metode Newton Raphson maka koefisien aktifitas i dihitung dengan model Elektrolit UNIQUAC yang dilakukan
secara iteratif sampai harga xidan i konvergen.
Konstanta kesetimbangan masing-masing reaksi dihitung dengan persamaan: T C T C T C C K 1 2 / 3ln 4 ln (17)
Potensial kimia kondisi standar o i
dihitung dari konstanta kesetimbangan K :
o i N i ij j K RT
1 ln j =1,2,...,R (18)Tekanan parsial CO2dan fraksi uap CO2pada tekanan atmosfer dihitung dengan persamaan :
2 2 2 2 CO CO CO CO x H P (19) tot CO CO P P y 2 2 (20)
Dengan, HCO2 adalah konstanta Henry CO2dalam larutan yang dihubungkan dengan konstanta
Henry CO2dalam air murni HwCO2melalui koefisien aktifitas i :
w CO CO CO H H 2 2* 2 (21) T T T Hw CO 170.7126 8477.711/ 21.95743ln 0.005781 ln 2 (22)
Sedangkan tekanan parsial H2O dan fraksi uap H2O dihitung dengan persamaan : s O H O H O H O H x P P 2 2 2 2 (23) tot O H O H P P y 2 2 (24)
Untuk tekanan tinggi diperhitungkan pula koefisien fugasitas, di mana fraksi mol uap dapat dicari dengan Persamaan (25) dan (26).
Molekular solute CO2
RT
P
P
v
H
x
P
y
s w w m P w m m m m m s w)exp
,(
)
( , *
(25) Pelarut H2ORT
P
P
v
P
x
P
y
s w l w s w s w O H O H O H O H)
(
exp
2 2 2 2
(26)Perhitungan koefisien fugasitas (φi) pada tekanan tinggi adalah :
a = 0.427480 (27)
= 0.086640 (28)
αi(Tri,ωi) = [ 1 + (0.480 + 1.574 ωi– 0.176 ωi2) (1-Tri1/2)]2 (29)
dimana Tri= dan i = H2O, CO2 Soave Redlich Kwong (SRK) equation of state : = − (( , )) (30)
Dimana : (T,ω) = aα (T,ω) SRK equation of state dapat juga di tulis sebagai cubic equation dalam volume : − + ( − − ) − = 0 (31)
Untuk menghitung φimurni : = − ∫ ( − ) (32)
Untuk menghitung φidalam campuran :
camp m j j ij m m i m m camp m m i i V b a y a b b RT b a V b Z Z b b ( ) ln 1 ) ( 2 ) ( 1 ln ) 1 ( ln (33) Dimana : = (34) ( ) = ( ) / (35) ( ) = ∑ ∑ ( ) (36) = ∑ (37)10.8 %
HASIL DAN PEMBAHASAN
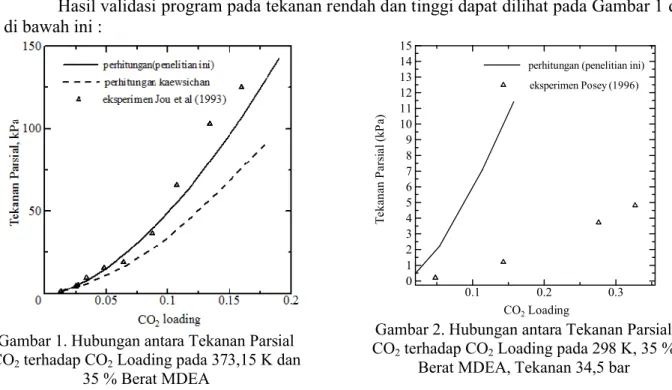
Hasil validasi program pada tekanan rendah dan tinggi dapat dilihat pada Gambar 1 dan 2 di bawah ini :
Gambar 1. Hubungan antara Tekanan Parsial
CO2terhadap CO2Loading pada 373,15 K dan
35 % Berat MDEA
Gambar 2. Hubungan antara Tekanan Parsial
CO2terhadap CO2Loading pada 298 K, 35 %
Berat MDEA, Tekanan 34,5 bar
Dari hasil validasi program, untuk tekanan rendah menunjukkan bahwa program yang dibuat telah akurat. Keakuratan program dapat dilihat dari kesamaan profil grafik perhitungan program pada penelitian ini dengan perhitungan Kaewsichan (1999) dan eksperimen Jou et al (1993), dengan ARD (Average Relative Deviation) tekanan parsial CO2 10,26% dan ARD CO2
loading 7,75%. Untuk tekanan tinggi dibandingkan dengan data eksperimen Posey (1996), dengan ARD tekanan parsial CO289,57% dan ARD CO2 loading 60,21 %. Dapat dilihat bahwa
ARD yang diperoleh besar, sehingga model elektrolit UNIQUAC yang digunakan pada perhitungan program ini untuk tekanan tinggi kurang relevan.
Hasil perhitungan program yang disesuaikan dengan hasil eksperimen Sholichatun dan Finalis (2010) dapat dilihat pada Gambar 3 di bawah ini :
Gambar 3. Hubungan antara Fraksi Uap CO2terhadap CO2Loading pada Temperatur 30ºC,
Tekanan 1 atm, dan 30% K2CO3 (–2% MDEA,–5% MDEA)
eksperimen Posey (1996) perhitungan (penelitian ini)
CO2Loading T ek an an P ar si al (k P a) 0.1 0.2 0.3 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 CO2loading fr ak si ua p
eksperimen sholichatun dan finalis (2010) -2% eksperimen sholichatun dan finalis (2010) -5% perhitungan (penelitian ini) -2% perhitungan(penelitian ini) -5% 0.012 0.016 0.02 0.024 0.028 0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16
Gambar 3 menunjukkan kesamaan profil grafik perhitungan program dengan hasil eksperimen. Dengan semakin naiknya CO2 loading maka fraksi uap CO2 juga semakin besar.
Dari hasil perhitungan, didapatkan ARD fraksi mol uap CO2 program terhadap eksperimen
sebesar 4,95 % untuk 30 % K2CO3- 2 % MDEA dan 8,32 % untuk 30 % K2CO3- 5 % MDEA.
Sedangkan ARD CO2loading program terhadap eksperimen sebesar 1,88 % untuk 30 % K2CO3
-2 % MDEA dan 4,31 % untuk 30 % K2CO3-5 % MDEA.
Hasil perhitungan dengan model UNIQUAC dapat dilihat pada Gambar 4 dan 5 di bawah ini :
Gambar 4. Hubungan antara Tekanan Parsial
CO2terhadap CO2Loading pada Temperatur
30oC, Tekanan 1 atm, dan 30% K
2CO3(-2%
MDEA, -5% MDEA)
Gambar 5. Hubungan antara Tekanan Parsial
CO2terhadap CO2Loading pada Temperatur
30oC, Tekanan 30 atm, dan 30% K
2CO3(-2%
MDEA, -5% MDEA)
Semakin besar CO2loading maka tekanan parsial CO2 juga semakin besar. Dapat dilihat
pula bahwa hasil perhitungan program pada penelitian ini menunjukkan profil grafik yang sama dengan hasil eksperimen. Pada persen berat MDEA yang tetap, semakin meningkatnya CO2
loading maka kelarutan CO2akan semakin meningkat. Pada tekanan parsial CO2yang sama, CO2
loading untuk 5 % berat MDEA lebih besar dari pada 2 % berat MDEA. Semakin tinggi tekanan operasi maka tekanan parsial CO2juga semakin tinggi.
KESIMPULAN
Dari penelitian ini dapat disimpulkan beberapa hal berikut :
1. Telah dikembangkan program untuk memprediksi kelarutan CO2 dalam larutan K2CO3
dengan promotor MDEA dengan menggunakan model elektrolit-UNIQUAC.
2. Validasi program dilakukan dengan menggunakan data eksperimen Jou et al (1982, 1993, 1994) dalam Kaewsichan (1999) yang dibandingkan dengan perhitungan Kaewsichan (1999) pada sistem CO2-MDEA-H2O dengan ARD untuk tekanan parsial CO2 10,26 %
-28,64 % dan ARD untuk CO2loading 0,64 % - 7,75 %.
3. Validasi program untuk tekanan tinggi dilakukan dengan menggunakan data eksperimen Posey (1996) pada sistem CO2-MDEA-H2O dengan ARD untuk tekanan parsial CO2
89,57 % dan ARD untuk CO2loading 60,21 %. CO2 T ek an an pa rs ia l,k P a loading
2% MDEA perhitungan (penelitian ini)
5% MDEA eksperimen Sholichatun dan finalis (2010) 2% MDEA eksperimen Sholichatun dan finalis (2010) 5% MDEA perhitungan (penelitian ini)
0.012 0.016 0.02 0.024 2 3 4 5 6 7 8 9 10 11 12 13 14 15 2% MDEA 5% MDEA CO2 T ek an an pa rs ia l, kP a loading 0.050 0.06 0.07 0.08 0.09 50 100 150 200 250 300 350
4. Model elektrolit UNIQUAC yang digunakan pada perhitungan program ini untuk tekanan tinggi kurang relevan, model lebih relevan digunakan pada tekanan rendah dengan rentang 1 atm sampai 5 atm.
5. Pada penelitian ini telah diperoleh nilai energy interaction parameters UNIQUAC untuk sistem CO2-K2CO3-MDEA-H2O pada 30oC.
6. Hasil prediksi kelarutan CO2 dalam larutan K2CO3 dengan promotor MDEA
dibandingkan dengan data eksperimen Sholichatun dan Finalis (2010) dengan ARD untuk fraksi mol uap CO24,95 % - 8,32 % dan ARD untuk CO2loading 1,88 % - 4,31 %.
7. Kenaikan CO2 loading sebesar 33,4 % - 71,2 % menyebabkan kenaikan tekanan parsial
CO2sebesar 90,5 % - 202,1 %.
8. Kenaikan persen berat MDEA dari 2 % menjadi 5 % memberikan efek penurunan tekanan parsial CO2sebesar 25,5 % - 47,8 %.
9. Kenaikan tekanan dari 1 atm menjadi 30 atm menyebabkan kenaikan CO2 loading
sebesar 3 – 4 kali dan kenaikan tekanan parsial CO2sebesar 17 – 24 kali lebih besar.
10. Kenaikan CO2loading dan kenaikan tekanan menyebabkan kenaikan kelarutan CO2.
DAFTAR PUSTAKA
Austgen, D.M., G.T. Rochelle, Xiao Peng, dan Chau-Chyun Chen. Model of Vapor-Liquid Equilibria for Aqueous Acid Gas-Alkanolamine Systems Using the Electrolyte-NRTL Equation. Ind. Eng. Chem. Res. 28 (1989) 1060-1073
Brelvi, S.W. dan J.P. O’Connell. Corresponding States Correlations for Liquid Compressibility and Partial Molal Volumes of Gases at Infinite Dilution in Liquids. AIChE Journal. 18 (1972) 1239-1243
Constantinides, A. dan N. Mostoufi. Numerical Methods for Chemical Engineering with MATLAB Applications. Prentice Hall International Series In The Physical and Chemical Engineering Sciences, New Jersey (1999)
Kaewsichan, L. A Vapor-Liquid Equilibrium Model for CO2-H2
S-Monoethanolamine-Methyldiethanolamine-Water System Using The Electrolyte UNIQUAC Equation. Ph.D. Thesis, Colorado School of Mines (1999)
Kaewsichan, L., O. Al-Bofersen, V.F. Yesavage, dan M.S. Selim. Predictions of The Solubility of Acid Gases in Monoethanolamine (MEA) and Methyldiethanolamine (MDEA) Solutions Using The Electrolyte-UNIQUAC Model. Fluid Phase Equilibria 183-184 (2001) 159-171
Kuswandi, K. Anam, dan Y.P. Laksana. Solubilitas Gas CO2 dalam Larutan Potassium
Karbonat. Institut Teknologi Sepuluh Nopember (2008)
Posey, M.L. Thermodynamics Model for Acid Gas Loaded Aqueous Alkanolamine Solutions. University of Texas at Austin, Austin (1996)
Sholichatun dan E.R. Finalis. Pengaruh Penambahan Aditif MDEA terhadap Solubilitas CO2
dalam Larutan K2CO3. Skripsi, Teknik Kimia Institut Teknologi Sepuluh Nopember
(2010)
Smith, J.M., H.C. Van Ness, dan M.M. Abbott. Introduction to Chemical Engineering Thermodynamics. Sixth edition, Mc. Graw Hill, Singapore (2001)
Winarno, H., G. Wibawa, dan Kuswandi. Eksperimental dan Estimasi Kesetimbangan Fase Uap-Cair Sistem Larutan Elektrolit CO2-K2CO3-Diethanolamine-H2O. Institut Teknologi