BAB 2
TINJAUAN PUSTAKA
2.1 Anatomi
2.1.1 Nasofaring
Nasofaring adalah ruang trapezoid di belakang koana yang berhubungan dengan orofaring dan terletak di superior palatum molle. Ukuran nasofaring pada orang dewasa yaitu 4 cm tinggi, 4 cm lebar dan 3 cm pada dimensi anteroposterior. Dinding posteriornya sekitar 8 cm dari aparatus piriformis sepanjang dasar hidung (Chew, 1997). Bagian atap dan dinding posterior dibentuk oleh permukaan yang melandai dibatasi oleh basis sfenoid, basis oksiput dan vertebra cervical I dan II. Dinding anterior nasofaring adalah daerah sempit jaringan lunak yang merupakan batas koana posterior. Batas inferior nasofaring adalah palatum molle. Batas dinding lateral merupakan fasia faringobasilar dan m. konstriktor faring superior (Witte and Neel, 1998; Lin, 2006)
Tuba Eustachius membelah dinding lateral ini, masuk dari telinga tengah ke nasofaring melalui celah di fasia faringobasilar di daerah posterosuperior, tepat di atas batas superior muskulus konstriktor faring superior, disebut fossa russenmuller (resessus faringeal). Fossa russenmuller merupakan tepi dinding posterosuperior nasofaring, yang merupakan tempat asal munculnya sebagian besar KNF dan yang paling sensitif terhadap penyebaran keganasan pada nasofaring.
Gambar 2.1.1. Anatomi Nasofaring (Witte and Neel, 1998)
Fossa russenmuller mempunyai hubungan anatomi dengan sekitarnya, sehingga berperan dalam kejadian dan prognosis KNF. Tepat di atas apeks dari fossa russenmuller terdapat foramen laserum, yang berisi arteri karotis interna dengan sebuah lempeng tipis fibrokartilago. Lempeng ini mencegah penyebaran KNF ke sinus kavernosus melalui karotis yang berjalan naik. Tepat di anterior fossa russenmuller, terdapat nervus mandibula (V3) yang berjalan di dasar tengkorak melalui foramen ovale. Kira-kira 1.5 cm posterior dari fossa russenmuller terdapat
foramen jugulare, yang dilewati oleh saraf kranial IX-XI, dengan kanalis hipoglosus
yang terletak paling medial (Witte and Neel, 1998).
Fossa russenmuller yang terletak di apeks dari ruang parafaring ini merupakan tempat menyatunya beberapa fasia yang membagi ruang ini menjadi 3 kompartemen, yaitu : 1) kompartemen prestiloid, berisi a. maksilaris, n. lingualis dan n. alveolaris inferior; 2) kompartemen poststiloid, yang berisi sarung karotis; dan 3) kompartemen retrofaring, yang berisi kelenjar Rouviere. Kompartemen retrofaring ini berhubungan dengan kompartemen retrofaring kontralateral, sehingga pada
keganasan nasofaring mudah terjadi penyebaran menuju kelenjar limfa leher kontralateral. Lokasi fossa russenmuller yang demikian itu dan dengan sifat KNF yang invasif, menyebabkan mudahnya terjadi penyebaran KNF ke daerah sekitarnya yang melibatkan banyak struktur penting sehingga timbul berbagai macam gambaran klinis (Witte and Neel, 1998; Lin, 2006).
Dinding daerah nasofaring mengandung komponen lapisan otot, jaringan fibrosa dan mukosa. Dinding lateral daerah nasofaring dibentuk oleh muskulus konstriktor superior. Ruang antara tepi atas muskulus konstriktor superior dan dasar tengkorak disebut sinus Morgagni. Daerah ini dilindungi oleh fasia faringobasilar yang ditunjang oleh muskulus levator veli palatini. Ujung medial dari tuba Eustachius membentuk sebuah penonjolan (torus tubarius) yang terletak di bagian atas dinding lateral. Dari tepi posterior orifisium tuba Eustachius terdapat sebuah lipatan mukosa yang dibentuk oleh muskulus salpingofaringeus, berjalan ke bawah dan turun secara bertahap pada dinding faring bagian lateral. Lapisan fibrosa terdiri dari dua lapisan yan berada di sebelah dalam dan di sebelah luar muskulus konstriktor. Kedua lapisan ini bersambunng dengan fasia di leher. Lapisan luar atau fasia bukofaring menutupi bagian superfisial muskulus konstriktor superior. Komponen dalam atau
aponeurosis faringeal yang berada di antara lapisan mukosa dan muskulus konstriktor adalah bagian dari fasia faringobasilar. Kedua lapisan fasia pada tepi atas muskulus konstriktor superior naik ke arah dasar tengkorak sebagai bagian tersendiri.
Lapisan mukosa ialah daerah nasofaring yang dilapisi oleh mukosa dengan epitel kubus berlapis semu bersilia pada daerah dekat koana dan daerah di sekitar atap, sedangkan pada daerah posterior dan inferior nasofaring terdiri dari epitel skuamosa berlapis. Daerah dengan epitel transisional terdapat pada daerah pertemuan antara atap nasofaring dan dinding lateral. Lamina propria seringkali
diinfiltrasi oleh jaringan limfoid, sedangkan lapisan submukosa mengandung kelenjar serosa dan mukosa (Gibb, 1999).
2.1.2 Perdarahan dan persarafan
Pembuluh darah arteri utama yang memperdarahi daerah nasofaring adalah arteri faringeal asendens, arteri palatina asendens, arteri palatina desendens, dan cabang faringeal arteri sfenopalatina. Semua pembuluh darah tersebut berasal dari arteri karotis eksterna dan cabang-cabangnya. Pembuluh darah vena berada di bawah membran mukosa yang berhubungan dengan pleksus pterigoid di daerah superior dan fasia posterior atau vena jugularis interna di bawahnya (Gibb, 1999).
Gambar 2.1.2 Perdarahan nasofaring, dikutip dari Atlas Netter
Daerah nasofaring dipersarafi oleh pleksus faringeal yang terdapat di atas otot konstriktor faringeus media. Pleksus faringeus terdiri dari serabut sensoris saraf glossofaringeus (IX), serabut motoris saraf vagus (X) dan serabut saraf ganglion servikalis simpatikus. Sebagian besar saraf sensoris nasofaring berasal dari saraf
glossofaringeus, hanya daerah superior nasofaring dan anterior orifisuim tuba yang mendapat persarafan sensoris dari cabang faringeal ganglion sfenopalatina yang berasal dari cabang maksila saraf trigeminus (V1) (Gibb, 1999).
Gambar 2.1.3. Persarafan nasofaring, dikutip dari Atlas Netter
2.1.3 Sistem limfatik
Nasofaring mempunyai pleksus submukosa limfatik yang luas. Kelompok pertama adalah kelompok nodul pada daerah retrofaringeal yang terdapat pada ruang retrofaring antara dinding posterior nasofaring, fasia faringobasilar dan fasia prevertebra (Chew, 1997). Pada dinding lateral terutama di daerah tuba Eustachius paling kaya akan pembuluh limfe. Aliran limfenya berjalan ke arah anterosuperior dan bermuara di kelenjar retrofaringeal atau ke kelenjar yang paling proksimal dari masing-masing sisi rantai kelenjar spinal dan jugularis interna, rantai kelenjar ini terletak di bawah otot sternokleidomastoid pada tiap prosessus mastoid. Beberapa kelenjar dari rantai jugular letaknya sangat dekat denan saraf-saraf kranial terakhir yaitu saraf IX,X,XI,XII (Bourhis et al, 1999). Metastase ke kelenjar limfe ini dapat
terjadi sampai dengan 75% penderita KNF, yang mana setengahnya datang dengan kelenjar limfe bilateral (Dhingra, 2004).
2.2 Karsinoma Nasofaring
Karsinoma nasofaring (KNF) adalah tumor ganas yang berasal dari sel epitel permukaan nasofaring (Brennan, 2006). Tumor ini bermula dari dinding lateral nasofaring (fosa russenmuller) dan dapat menyebar ke dalam atau keluar nasofaring menuju dinding lateral, posterosuperior, dasar tengkorak, palatum, kavum nasi, dan orofaring serta metastase ke kelenjar limfe leher (Gustafson dan Neel, 1989).
2.2.1 Epidemiologi
Angka insiden karsinoma nasofaring cukup tinggi tergantung dari letak geografinya (Khabir et al., 2005). Berdasarkan data IARC (International Agency for Research on Cancer) pada tahun 2002 ditemukan sekitar 80.000 kasus baru KNF di seluruh dunia dan sekitar 50.000 kasus meninggal diantaranya adalah berasal dari Cina sekitar 40% (Ma and Cao, 2010). Umur rata-rata penderita KNF yaitu 45-55 tahun, dengan 23.3 kasus/100.000 laki-laki dan 8.9 kasus/100.000 perempuan. Rasio laki-laki : perempuan yaitu 2-3 : 1 (Lo et al., 2004; Lo, 2007; Ma and Cao, 2010). Di Indonesia memberikan hasil yang beragam, dengan laki-laki lebih banyak menderita KNF daripada perempuan seperti yang telah dilaporkan oleh Armiyanto (2003) 2,2:1; Lutan (2003) 2,3:1; Henny (2004) 2,4:1; Masrin (2005) dan Harahap (2009) dengan 2,5:1. Kelompok umur yang terbanyak terjadi adalah pada umur 41-50 tahun. Insiden tertinggi dilaporkan berasal dari provinsi Guandong dan daerah Guangxi Cina Selatan yaitu mencapai lebih dari 50 per 100.000 orang/tahun (Ganguly, 2003; Ma and Cao, 2010). Etnis Cina yang bermigrasi ke luar negeri juga mempunyai angka insiden yang tinggi, tetapi etnis Cina yang lahir di Amerika Utara, mempunyai angka insiden yang rendah dibandingkan dengan yang lahir di Cina (Chou et al., 2008). Temuan ini mengindikasikan bahwa faktor genetik, etnik, dan
lingkungan memegang peranan penting terhadap meningkatnya KNF (Lo et al., 2004). Insiden yang tinggi juga ditemukan pada penduduk Eskimo di Alaska, Greenland dan Tunisia sebanyak 15-20 kasus per 100.000 orang per tahun. Angka insiden sedang ditemukan pada daerah Afrika Utara dan Asia Tenggara (Vietnam, Indonesia, Thailand, Filipina) yaitu antara 3-8 per 100.000/tahun. Dan jarang terjadi pada negara Eropa dan Amerika Utara (Chew, 1997; Khabir et al., 2005; Lin, 2006). Di RSUP H. Adam Malik Medan pada tahun 1998-2002 ditemukan 130 penderita KNF dari 1370 penderita baru onkologi kepala dan leher (Lutan, 2003).
2.2.2 Etiologi
Penyebab dari karsinoma nasofaring adalah multifaktor yaitu genetik, faktor lingkungan/adat kebiasaan dan infeksi virus Epstein-Barr (VEB) (Ganguly, 2003; Korcum et al., 2006)
2.2.2.1 Faktor Genetik
Tingginya angka insiden KNF di daerah Cina Selatan, baik yang tinggal di Cina atau yang sudah bermigrasi, dan angka insiden sedang pada populasi keturunan cina campuran, diduga mempunyai hubungan genetik dalam terjadinya karsinoma nasofaring. Telah dilaporkan bahwa Histocompatibility Locus Antigen
(HLA) yaitu HLA-A2 (HLA-A*0207) dan HLA-Bsin2 berhubungan dengan KNF pada orang Cina Selatan, tetapi jarang pada orang kulit putih. Dan telah diidentifikasi bahwa terdapat kelainan pada beberapa kromosom, yaitu kromosom 1, 2, 3, 4, 5, 6, 8, 9, 11, 13, 14, 15, 16, 17, 22, dan kromosom X (Lo et al., 2004; Lin, 2006). Penelitian di bagian THT FKUI/RSCM tahun 1997 didapatkan fenotip antigen HLA kelas 1, HLA-A24 dan HLA-B63 untuk kemungkinan faktor penyebab bagi orang Indonesia asli. (Chew, 1997; Ahmad, 2002; Cottrill and Nutting, 2003). Penelitian di Medan menemukan alel gen paling tinggi pada penderita KNF suku Batak adalah alel gen HLA-DRB1*12 dan HLA-DQB*0301 dimana alel gen yang potensial sebagai
penyebab kerentanan timbulnya KNF pada suku Batak adalah alel gen HLA-DRB1*08 (Delfitri M, 2007).
2.2.2.2 Lingkungan/adat kebiasaan
Beberapa kebiasaan/makanan telah dilaporkan berhubungan dengan meningkatnya resiko dari KNF. Mengkomsumsi ikan asin dan makanan yang diawetkan yang mengandung volatile nitrosamin, merupakan faktor karsinogenik yang penting yang berhubungan dengan KNF. Dan telah terbukti bahwa mengkonsumsi ikan asin sejak anak-anak meningkatkan resiko KNF di Cina Selatan (Ganguly, 2003; Lo et al., 2004; Can et al., 2005; Lin, 2006).
Clifford dan Bulbrook dalam penelitiannya yaitu orang Afrika, Kenya yang hidup dengan ventilasi rumah yang jelek dengan asap yang terperangkap di dalam rumah, meningkatkan angka kejadian KNF. Mereka melaporkan asap yang berasal dari kayu bakar mengandung zat karsinogen yang akan terakumulasi pada dinding nasofaring posterior dan lateral, dengan waktu terpapar sampai beberapa jam sehari selama bertahun-tahun (Ganguly, 2003).
Juga telah dilaporkan orang yang mengkonsumsi rokok selama 10 tahun atau lebih mempunyai resiko yang tinggi terhadap KNF, tetapi paparan yang rendah terhadap asap rokok sebagai perokok pasif dan mengkonsumsi alkohol bukan merupakan faktor resiko KNF (Ganguly, 2003).
Penelitian yang dilakukan oleh Nolodewo, dkk di RS Dr. Kariadi Semarang menyatakan bahwa paparan formaldehid bentuk uap dan asap yang terhirup berpengaruh paling besar terhadap kejadian KNF, keduanya terbukti secara bersama-sama berpengaruh secara signifikan terhadap kejadian KNF (Nolodewo, Yuslam, Muyassaroh, 2007).
2.2.2.3 Virus Epstein-Barr (VEB)
Virus Epstein-Barr merupakan karsinogen yang menjadi penyebab beberapa keganasan pada manusia, termasuk KNF. Hubungan antara KNF dan VEB telah diteliti pada beberapa studi seroepidemik dari berbagai negara. Mereka meneliti adanya DNA VEB persisten dan/atau virus determined nuclear antigen (EBNA) pada sel-sel KNF. Henle dan Henle, pertama sekali menerangkan bahwa serum antibodi IgA yaitu virus capsid antigen (VCA) dan early antigen (EA) berhubungan signifikan dengan KNF (Ganguly, 2003; Lo et al., 2004). Infeksi laten VEB telah diidentifikasi pada sel-sel kanker pada semua kasus KNF pada daerah endemik. VEB genome juga telah dideteksi pada karsinoma yang invasif dan pada lesi displasia (Lo et al., 2004). Protein virus laten (latent membrane protein 1 dan 2) memiliki efek yang substansial pada ekspresi gen selular, menghasilkan pertumbuhan yang sangat invasif serta pertumbuhan ganas dari karsinoma (Wei and Sham, 2005; Lutzky et al., 2008).
2.2.3 Gejala Klinis
Keluhan penderita KNF berhubungan dengan lokasi tumor primer, derajat dan arah penyebarannya (Soetjipto, 1989).
2.2.3.1 Gejala Dini
Menegakkan diagnosis KNF secara dini merupakan hal yang paling penting dalam menurunkan angka kematian akibat penyakit ini. Gejala dini berupa :
Gejala Telinga
a. Oklusi tuba Eustachius/kataralis
Umumnya keluhan berupa rasa penuh di telinga, telinga berdengung (tinitus), atau dengan gangguan pendengaran yang biasanya tuli konduktif dan
bersifat unilateral. Gejala ini disebabkan karena pertumbuhan atau infiltrasi tumor primer pada otot tuba dan mengganggu mekanisme pembukaan ostia tuba. Tuba oklusi dapat menjadi permanen, jika tumor menyebar dan menyumbat muara tuba.
b. Gangguan pendengaran
Sering bersifat tuli konduktif dan unilateral. Gejala ini disebabkan karena otitis media serosa akibat gangguan fungsi tuba. Tuli saraf mungkin terjadi pada penderita KNF tetapi sebagai efek radioterapi dan jarang akibat penyebaran langsung tumor ke saraf VIII.
c. Otitis media serosa sampai perforasi membran timpani
Penyebabnya adalah sumbatan muara tuba Eustachius oleh massa tumor.
d. Tinitus
Sering dijumpai pada penderita KNF, dapat sangat mengganggu dan sulit diobati. Gejala ini juga disebabkan akibat gangguan fungsi tuba.
e. Otalgia
Gejala ini jarang ditemukan dan bila ada menunjukkan bahwa tumor telah menginfiltrasi daerah parafaring dan mengerosi dasar tengkorak. Rasa sakit di telinga akibat infiltrasi pada saraf glossofaringeus yang mempunyai cabang saraf sensoris ke telinga tengah.
Gejala Hidung
a. Epistaksis
Umumnya berupa ingus bercampur darah yang dapat terjadi berulang-ulang dan biasanya dalam jumlah sedikit. Gejala ini timbul akibat permukaan tumor rapuh sehingga pada iritasi ringan dapat terjadi perdarahan.
b. Obstruksi hidung
Gejala ini biasanya menetap dan bertambah berat. Gejala ini akibat pertumbuhan massa tumor menutupi koana. Gejala menyerupai pilek kronis, kadang-kadang disertai dengan gangguan penciuman. Bila terjadi obstruksi hidung total menunjukkan stadium yang lanjut dari KNF.
2.2.3.2 Gejala Lanjut 1. Limfadenopati Servikal
Ditandai dengan pembesaran kelenjar limfe regional yang merupakan penyebaran terdekat secara limfogen dari KNF. Dapat terjadi unilateral atau bilateral. Kelenjar limfe retrofaringeal (Rouviere) merupakan tempat pertama penyebaran sel tumor ke kelenjar, tetapi pembesaran kelenjar limfe ini tidak teraba dari luar. Ciri yang khas penyebaran KNF ke kelenjar limfe leher yaitu terletak di bawah prosesus mastoid (kelenjar limfe jugulodigastrik), di bawah angulus mandibula, di dalam otot sternokleidomastoid, konsistensi keras, tidak terasa sakit, tidak mudah digerakkan terutama bila sel tumor telah menembus kelenjar dan mengenai jaringan otot di bawahnya.
Lebih dari 40% dari seluruh kasus KNF, keluhan adanya tumor di leher ini yang paling sering dijumpai dan yang mendorong penderita untuk datang berobat (Soetjipto, 1989; Ahmad,2002).
2. Gejala Neurologis
Sindroma petrosfenoidal, akibat penjalaran tumor primer ke atas melalui foramen laserum dan ovale sepanjang fosa kranii medial sehingga mengenai saraf kranial anterior berturut-turut yaitu saraf VI, saraf III, saraf IV, sedangkan saraf II paling akhir mengalami gangguan. Dapat pula menyebabkan parese saraf V. Parese saraf II menyebabkan gangguan visus, parese saraf III menyebabkan kelumpuhan otot levator palpebra dan otot tarsalis superior
sehingga menimbulkan ptosis, dan parese saraf III, IV dan VI menyebabkan keluhan diplopia karena saraf-saraf tersebut berperan dalam pergerakan bola mata, dan saraf V (trigeminus) dengan keluhan rasa kebas di pipi dan wajah yang biasanya unilateral.
Sindroma parafaring/penjalaran secara retroparotidian, akibat tumor menjalar ke belakang secara ekstrakranial dan mengenai saraf kranial posterior yaitu saraf VII sampai XII dan cabang saraf simpatikus servikalis yang menimbulkan sindroma Horner. Parese saraf IX menyebabkan keluhan sulit menelan karena hemiparese otot konstriktor faringeus superior. Parese saraf X menyebabkan gangguan motorik berupa afoni, disfoni, disfagia, spasme esofagus, gangguan sensorik berupa nyeri daerah laring dan faring, dispnu, dan hipersalivasi, parese saraf XI menyebabkan atrofi otot trapezius, sternokleidomastoideus serta hemiparese palatum molle, parese saraf XII menyebabkan hemiparese dan atrofi sebelah lidah, sedangkan saraf VII dan VIII jarang terkena karena letaknya agak tinggi.
KNF juga kadang-kadang menimbulkan gejala yang tidak khas berupa trismus. Gejala ini timbul bila tumor primer telah menginfiltrasi otot pterigoid sehingga menyebabkan terbatasnya pembukaan mulut. Gejala trismus sangat jarang dijumpai tetapi lebih sering terdapat sebagai efek samping radioterapi yang diberikan, sehingga menyebabkan degenerasi serat otot pterigoid dan masseter.
Sakit kepala yang hebat merupakan gejala yang paling berat bagi penderita KNF, biasanya merupakan stadium terminal dari KNF. Hal ini disebabkan tumor mengerosi dasar tengkorak dan menekan struktur di sekitarnya (Witte dan Neel, 1998; Ahmad, 2002).
2.2.3.3 Gejala Metastasis jauh
Metastasis jauh dari KNF dapat secara limfogen atau hematogen, yang dapat mengenai spina vertebra torakolumbar, femur, hati, paru, ginjal, dan limpa. Metastasis jauh dari KNF terutama ditemukan di tulang (48%), paru-paru (27%), hepar (11%) dan kelenjar getah bening supraklavikula (10%). Metastasis sejauh ini menunjukkan prognosis yang sangat buruk, biasanya 90% meninggal dalam waktu 1 tahun setelah diagnosis ditegakkan (Chiesa and De Paoli, 2001).
2.2.4 Histopatologi
Pada 1978 WHO menetapkan KNF sebagai kanker yang berasal dari sel skuamousa dan dibedakan berdasarkan mikroskop cahaya menjadi 3 tipe yaitu:
1. WHO Tipe 1 : karsinoma sel skuamosa berkeratin
2. WHO Tipe 2 : karsinoma sel skuamosa tidak berkeratin
3. WHO Tipe 3 : karsinoma tidak berdiferensiasi
Gambaran histopatologi WHO tipe 1, khas tampak gambaran sekat intraselular dan gambaran pembentukan keratin yang menonjol. Gambaran tersebut menyerupai karsinoma sel skuamosa di daerah lainnya, seperti pada traktus aerodigestivus. WHO tipe 1 ini terdapat pada 75% populasi kulit putih di Amerika Serikat, non-Hispanic kulit putih tetapi jumlah tersebut hanya sebesar 1-2% pada populasi endemik (Witte and Neel, 1998).
WHO tipe 2 memperlihatkan kematangan dari epitel skuamosa, tetapi tidak ada gambaran pembentukan keratin (Witte dan Neel, 1998; Chou et al., 2008).
Pada WHO tipe 3, terdapat sel-sel dengan morfologi yang bervariasi terdiri dari nukleus vesikuler, gambaran nukleus yang menonjol dan sinsitia (sel raksasa
berinti banyak). Ditemukan sebanyak 95% pada semua kasus di daerah endemik, namun di populasi resiko rendah seperti populasi pada populasi kulit putih Amerika Utara hanya ditemukan sebanyak 60% (Witte and Neel, 1998).
Kebanyakan kasus KNF yang terjadi pada anak-anak dan remaja adalah tipe 3, sedikit kasus pada tipe 2. Secara histologik, KNF WHO tipe 2 dan 3 berhubungan dengan infeksi laten VEB sekitar 65-100% kasus dan pada WHO tipe 1 pada daerah endemis, tetapi tidak terdapat pada WHO tipe 1 terutama pada daerah nonendemis (Lo et al., 2004; Brennan, 2006; Chou et al., 2008).
2.2.5 Diagnosis
Diagnosa KNF ditegakkan dengan pemeriksaan klinis dan histopatologi. Pemeriksaan histopatologi yaitu dengan melakukan biopsi massa pada nasofaring, yang lebih baik dilakukan dengan bantuan nasofaringoskopi optik. Jika terdapat pembesaran kelenjar getah bening leher, maka dilakukan aspirasi jarum halus. Untuk mengetahui letak tumor dan penyebarannya secara akurat, direkomendasikan untuk melakukan CT-Scan dan MRI nasofaring, dasar tengkorak dan leher. Foto rongten toraks (anteroposterior dan lateral) untuk melihat penyebaran karsinoma nasofaring ke daerah paru. Skrining tulang, abdomen biasanya juga dilakukan jika hasil klinis dan laboratorium menunjukkan adanya suatu metastase (Brennan, 2006).
2.2.6 Stadium tumor
Terdapat beberapa cara untuk menentukan stadium KNF. Di beberapa negara Asia digunakan penentuan stadium yang dikemukakan oleh Ho pada tahun 1978 (Ho’s system), sementara di Amerika dan Eropa lebih disukai penentuan stadium sesuai dengan kriteria yang ditetapkan AJCC/UICC (American Joint Committee on Cancer / International Union Against Cancer). Cara penentuan stadium KNF yang terbaru adalah menurut AJCC/UICC edisi ke-6 tahun 2002, yaitu (Brennan, 2006) :
Tumor di nasofaring (T)
Tx : Tumor primer tidak dapat ditemukan
T0 : Tidak ditemukan adanya tumor primer
Tis : Carcinoma in situ
T1 : Tumor terbatas di nasofaring
T2 : Tumor meluas ke jaringan lunak
T2a : Tumor meluas sampai daerah orofaring dan/atau fossa nasalis tanpa perluasan ke depan parafaring
T2b : Dengan perluasan ke parafaring
T3 : Tumor menginvasi struktur tulang dan/atau sinus paranasal
T4 : Tumor meluas ke intrakranial dan/atau mengenai saraf kranial, fossa infratemporal, hipofaring, orbita atau ruang mastikator
Kelenjar limfe regional (N)
Nx : Pembesaran KGB regional tidak dapat ditentukan
N0 : Tidak ada pembesaran KGB regional
N1 : Metastasis ke KGB unilateral, ukuran ≤ 6 cm, terletak di atas fossa supraklavikula
N2 : Metastasis ke KGB bilateral, ukuran ≤ 6 cm, terletak di atas fossa supraklavikula
N3 : Metastasis ke KGB:
N3b : Terletak pada fossa supraklavikula
Metastasis jauh (M)
Mx : Adanya metastasis jauh tidak dapat ditentukan
M0 : Tidak ada metastasis jauh
M1 : Ada metastasis jauh
Stadium KNF 0 : Tis N0 M0 I : T1 N0 M0 IIa : T2a N0 M0 IIb : T1-2a N1 M0, T2b N0-1 M0 III : T1-2b N2 M0, T3 N0-2 M0 IVa : T4 N0-2 M0 IVb : Semua T N3 M0 IVc : Semua T N0-3 M1
2.3 Virus Epstein-Barr (VEB)
Virus Epstein-Barr merupakan suatu virus gamma herpes yang mengandung DNA yang termasuk dalam keluarga herpes viridae yang ditemukan oleh oleh Ied Tony Epstein dan Yvone Barr pada tahun 1964 (Korcum et al., 2006). Virus ini dapat menginfeksi lebih dari 90% populasi dunia
dan mempunyai hubungan dengan sejumlah keganasan termasuk karsinoma nasofaring, penyakit Hodgkin, limfoma Burkitt, kanker lambung, leiomyosarcoma
dan kemungkinan kanker payudara (Feng et al., 2002; Straathof et al., 2003). Di Hongkong, 80% anak umur 6 tahun telah terinfeksi oleh VEB dan hampir 100% telah terdeteksi pada anak umur 10 tahun (Chang and Adami, 2006).
Gambar 2.3. Genom Virus Epstein-Barr (Sun, 2006)
VEB dapat berada pada inti maupun sitoplasma sel dengan ukuran diameter 75-200 nm. Struktur virus ini sama dengan struktur virus herpes lainnya. Secara garis besar terdiri dari protein nukleoid yang terbungkus bersama-sama dengan DNA (genom) virus dan disebut nukleokapsid, memiliki 162 kapsomer dan berbentuk ikosahedral. Selain itu terdapat pula subunit protein lainnya yang terletak antara nukleokapsid dan envelop. Envelop virus tersusun dari bagian membran inti maupun membran-membran sel yang berasal dari sel host. Pada lapisan luar envelop terdapat beberapa tonjolan glikoprotein. Protein kapsid yang utama adalah p160,47 dan 28 kDa, sedangkan tonjolan
envelop terbanyak adalah gp350/220 dan 152 kDa (Mongan dan Harahap,2000; Ibrahim et al., 2001).
2.3.1. Patogenesis Infeksi Virus Epstein-Barr
Virus Epstein-Barr menginfeksi populasi dunia terutama dewasa yang didahului dengan infeksi primer, yang mana Individu yang terinfeksi dengan virus Epstein-Barr dapat dipertahankan selama hidupnya. Pada negara yang belum berkembang, infeksi primer VEB biasanya terjadi selama beberapa bulan pertama sampai beberapa tahun kehidupan dan sering tanpa gejala. Sedangkan pada negara berkembang, infeksi primer lebih sering terjadi pada waktu remaja atau dewasa, dan pada beberapa kasus memberikan gejala yang khas atau infeksi mononukleosis (Tao et al., 2006).
Pada awal proses infeksi, bagian envelop virus akan berfusi dulu dengan membran sel host sehingga nukleokapsid virus dapat masuk ke dalam sel dan dalam keadaan inaktif atau sebaliknya mulai aktif membentuk enzim-enzim yang diperlukan untuk pembentukan partikel virus baru. Hal tersebut menentukan apakah terjadi infeksi laten atau litik. Infeksi litik lebih sering berlangsung pada epitel mukosa sedangkan infeksi laten pada limfosit B dan beberapa jenis epitel tertentu (Kieff et al., 1995; Mongan dan Harahap, 2000).
Infeksi VEB terjadi melalui kontak saliva yang infeksius dan permulaan infeksi terjadi di orofaring, kemudian akan bereplikasi di sel epitel faring dan kelenjar ludah. Tahap awal infeksi virus akan terikat pada reseptor C3d yang merupakan komponen komplemen (CR2 atau CD21). Ketika virus menempel pada permukaan sel maka sel akan teraktivasi dan masuk ke dalam siklus sel dimana beberapa gen VEB terekspresi dan menyebabkan proliferasi tanpa batas. Selanjutnya VEB masuk melalui rute orofaring dan menginfeksi resting B
cells dan atau sel-sel epitel. Virus dilepaskan selama fase produktif yang selanjutnya akan menginfeksi sel-sel B di sirkulasi yang melalui orofaring, menghasilkan infeksi laten. VEB akan memicu limfosit B untuk berproliferasi, yang mana hal ini akan diekspresikan oleh spesific growth-promoting genes, yang mempunyai kemampuan untuk menjadi tumor (Murray et al., 2001; Korcum
et al., 2006).
Infeksi VEB yang utama adalah infeksi laten, tetapi VEB pada waktu tertentu dapat teraktivasi kembali dan tereplikasi menjadi infeksi litik. Perubahan infeksi laten menjadi litik dipicu oleh VEB immediate-early transcription factor ZEBRA (BZLF1, Zta, Z, EB1). ZEBRA mengaktifkan promotor gen infeksi litik VEB berikatan dengan ZREs (ZEBRA Response Elements), yang menginduksi kaskade ekspresi dari lebih 50 gen virus. ZEBRA juga menurunkan regulasi latency-associated promotor, yang merupakan bagian dari faktor replikasi, menginduksi tertahannya siklus sel host, mengubah respon imun seluler dan aktivitas faktor transkripsi. Hasil dari perubahan ini adalah transkripsi yang luas pada gen virus dan terbentuknya EA dan antigen lanjut VCA (Petosa et al., 2006).
.
Pada infeksi primer VEB, diproduksi tiga antibodi yaitu IgG, IgM, IgA untuk melawan VCA dari VEB, dua antibodi IgG dan IgA diproduksi untuk melawan EA D, serta satu antibodi IgG untuk merespon EA R (Thompson and Kurzrock, 2004).
Pada masa laten, VEB menghasilkan enam VEB nuklear antigen (EBNA 1, 2, 3A, 3B, 3C, dan LP), dan tiga Latent membrane Protein (LMP1, 2A, 2B), serta dua VEB Non-Polyadenylated RNAs (EBERs) (Zheng et al., 2007)
2.3.2 Hubungan Karsinoma Nasofaring dan Virus Epstein Barr
Pada tahun 1966, Old et al. pertama sekali menemukan hubungan antara VEB dan KNF dengan menggunakan hibridisasi in situ dan pemeriksaan
anticomplement and immunoflorecent (ACIF). Old et al melaporkan adanya peningkatan titer antibodi terhadap antigen VEB pasien KNF, khususnya IgA anti VCA dan EA, yang ditemukan pada serum pasien. Konsentrasi titer IgA-VCA ≥ 1/10 menandakan adanya infeksi VEB. (Okano, 2000; Leung et al., 2004). Pada penelitian lain disebutkan bahwa ekspresi dari gen laten VEB pada sel-sel KNF menguatkan bukti adanya VEB (Gullo et al., 2008).
Ekspresi dari Early Antigen VEB pada pertumbuhan KNF dengan VEB positif, dihubungkan dengan mengkonsumsi ikan asin dan makanan yang diawetkan diduga berhubungan dengan faktor kebiasaan atau pola makan (Gullo et al., 2008).
EBNA1 dan LMP1 yang merupakan produk onkogen VEB terbukti menyebabkan transformasi sel epitel faring dan imortalisasi limfosit B. Adanya partikel VEB pada jaringan tumor spesimen biopsi penderita KNF secara konsisten, mendukung hipotesis VEB sebagai faktor etiologi utama pada KNF (Niedobitek, 2000).
Tingginya kadar antibodi terhadap protein VEB pada orang sehat yyang kemudian menderita KNF, dan pada penderita dengan tumor primer ataupun yang mengalami kekambuhan menunjukkan adanya hubungan yang kuat antara VEB dengan KNF. Adanya infeksi VEB yang laten pada sel-sel KNF dan tidak didapatkan pada epitel yang normal, memperkuat dugaan adanya hubungan yang kuat antara VEB dan KNF (Liebowitz et al., 1994; Pathmanathan et al., 1995; Murray et al., 2001).
2.4 Latent Membrane Protein 1 (LMP1)
Latent membrane protein 1 (LMP1) salah satu antigen dari VEB yang diekspresikan pada fase laten dari VEB. Infeksi VEB telah diduga sebagai penyebab dari KNF dan LMP1 memegang peranan penting dalam aktifitas transformasi VEB pada KNF. (Sheen et al., 1999; Lo et al., 2003).
LMP1 merupakan protein membran dengan berat molekul ± 60-66 kDa, berasal dari transkripsi BNLF1. Protein ini terdiri dari 25 amino acid intracytoplasmis N-terminus yang mengandung sedikit peptida berfungsi untuk sebagai sinyal dan merupakan tempat ikatan dengan vimentin (protein dari matriks seluler) (Hu, 1996).
Gambar 2.4 Struktur Onkoprotein LMP1 (Zhang et al., 2005)
LMP 1 merupakan protein membran integral dengan struktur molekul yang kompleks yang terdiri dari enam segmen membran hidrofobik yang terbentuk dari 3 (tiga) lengkung eksternal dan 2 (dua) lengkung internal serta 200 amino acid intracytoplasmic C terminus yang kaya residu asam (Hu, 1995; Korcum et al., 2006).
Ada empat jalur sinyal yang diindikasikan sebagai fungsi dari LMP 1 yaitu Nuclear Factor - NF-ĸB, JNK (c-Jun N Terminal Kinase)/AP-1 (Activator Protein-1), p38/MAPK (Mitogen-activated Protein Kinase) dan JAK(Janus Kinase)/STAT (Signal Transducer and Activator of Transcription) (Xu et al., 2000).
Di dalam gugus C terminal dari LMP 1 mempunyai dua daerah yang aktif yaitu disebut dengan CTAR-1 dan CTAR-2 (C-terminal activating region 1 dan 2). CTAR-1 berlokasi di daerah proksimal dari membran (asam amino 186-231) dan penting sebagai mediator VEB untuk transformasi primer di dalam sel B.
CTAR-2 (asam amino 351-386) berlokasi di daerah ekstrim C terminal dari LMP 1 dan dibutuhkan untuk pertumbuhan VEB di dalam sel dalam waktu yang lama (Xu et al., 2000).
Aktivasi dari transkripsi faktor NF-ĸB merupakan indikasi pertama yang penting bagi penyimpangan sinyal sel dari LMP 1. CTAR-1 dan CTAR-2 dapat mengaktifkan NF-ĸB secara independen. Sekitar 70-80% dari CTAR-2 dari LMP 1 merupakan mediator yang mengaktifkan NF-ĸB melalui interaksinya dengan Tumor Nekrosis Factor Receptor (TRAFs) - associated death domain protein (TRADD). Sedangkan sisanya 20-30% dari LMP 1 sebagai mediator aktivasi NF-ĸB dicapai melalui CTAR-1 yang berinteraksi dengan beberapa TNFR associated factor (TRAFs) (Damania, 2004).
LMP1 oleh 3 C-terminalactivation region 1,2,3 (CTAR1, CTAR2,CTAR3). LMP1 CTAR1 menginduksi NIK/IKKs dan fosforilase IКBα, yang akan
mengekspresikan p65 dan p50 kemudian mengaktivasi NF-КB melalui TRAF1,
TRAF2 dan TRAF3, yang juga menginduksi jaras PI3K yang akan mengaktivasi Akt (protein kinase B, PKB) sementara CTAR2 mengaktivasi NF-КB melalui
TRADD, dan TRAF2. NF-КB aktif menginduksi immortalisasi sel melalui
peningkatan regulasi aktivitas telomerase melalui translokasi ikatan protein hTERT ke NF-КB, menghambat apoptosis sel melaui peningkatan regulasi
aktivitas survivin, dan merangsang proliferasi sel melalui regulasi survivin, Cycline D1 dan EGFR dan lain-lain. Juga, LMP1 dapat meningkatkan tingkat fosforilasi serine dari Annexin A2 oleh aktivasi jaras penandaan PKC yang dapat merangsang proliferasi sel. LMP1 CTAR2 memicu AP-1 dengan mengaktifkan ERK, P38 dan c-Jun N-Terminal kinase (JNKs), anggota stress activated group dari MAP kinase, melalui pengikatan dengan kompleks TRADD/TRAF2. AP-1 aktif meningkatkan regulasi ekspresi MMP9 dan memediasi invasi dan metastasis sel KNF. LMP1 CTAR3 antara CTAR1 dan CTAR2 memicu jaras
JAK3/STAT yang akan meningkatkan transkripsi dan ekspresi VEGF, dengan demikian meningkatkan invasi dan metastasis sel KNF (Zheng et al., 2007).
LMP1 dapat menginduksi antigen CD70 (TNF family) pada sel epitel (in vitro). Observasi ini relevan oleh karena banyak dari WHO tipe 2 KNF terdapat CD70 positif walaupun ekspresi CD70 tidak berhubungan dengan KNF LMP1 positif. Sebagai tambahan, CD 80/86 telah dideteksi pada sel-sel epitel dari WHO tipe 2 KNF, tetapi hanya muncul terbatas pada kasus-kasus KNF dengan LMP1 positif (Niedobitek, 2000).
Gambar 2.5 Jaras LMP1 pada karsinogenesis KNF (Zheng et al, 2007)
LMP1 mendapat perhatian yang besar dari para peneliti oleh karena LMP1 menghambat differensiasi keratin (in vivo) dengan adanya perubahan morfologi sel dan mengubah fibroblas dan sel-sel epitel pada penelitian in vitro
(Dawson et al., 1990; Hu et al.,1995). LMP1 mengubah sel-sel limfoid yang diekspresikan oleh aktivasi antigen sel B, molekul adhesi, reseptor transferrin, dan sensitifitas terhadap TGF-beta, yang mana hal ini akan menghambat apoptosis dengan meningkatnya level Bcl-2 (Lo et al., 2003).
LMP1 mempunyai kemampuan dalam menginduksi EGFR (epidermal growth factor receptor) yang merupakan suatu reseptor tyrosine kinase yang dijumpai di permukaan sel, yang mengaktifkan CTAR-1 berinteraksi dengan TRAFs pada sel-sel epitel. Aktivasi ini akan mengakibatkan terbentuknya sel kanker atau adanya suatu proses malignansi dari epitel (Sheen et al., 1999).
LMP1 dapat mengakibatkan terjadinya angiogenesis melalui induksi COX-2 yang di mediasi oleh NF-ĸB melalui CTAR-1 dan CTAR-2 pada sel epitel nasofaring. Yang mana induksi dari COX-2 ini akan meningkatkan produksi dari VEGF (Vascular Endhotelial Growth Factor) pada LMP1 (Murono et al., 2001) dan juga akan menyebabkan akumulasi p53 dan menginduksi tertahannya fase G2/M pada KNF (Chou et al., 2008).
Pada sel epitel, LMP1 akan menghambat p53-mediated apoptosis
melalui induksi dari ekspresi A20. LMP1 akan menginduksi ekspresi dari CD40 dan IL6 (Interleukin 6) serta menurunkan ekspresi citokeratin dan E-chaderin (Tsao et al., 2002). LMP1 juga menginduksi matrix metalloproteinase-9 (MMP-9) dan meningkatkan ekspresi ITGα6 dan LAMC2 yang akan mengakibatkan metastase dari sel-sel tumor (Lo et al., 2003).
Beberapa penelitian terhadap LMP1 telah dilaporkan di Indonesia dan juga luar negeri dengan hasil yang bervariasi.
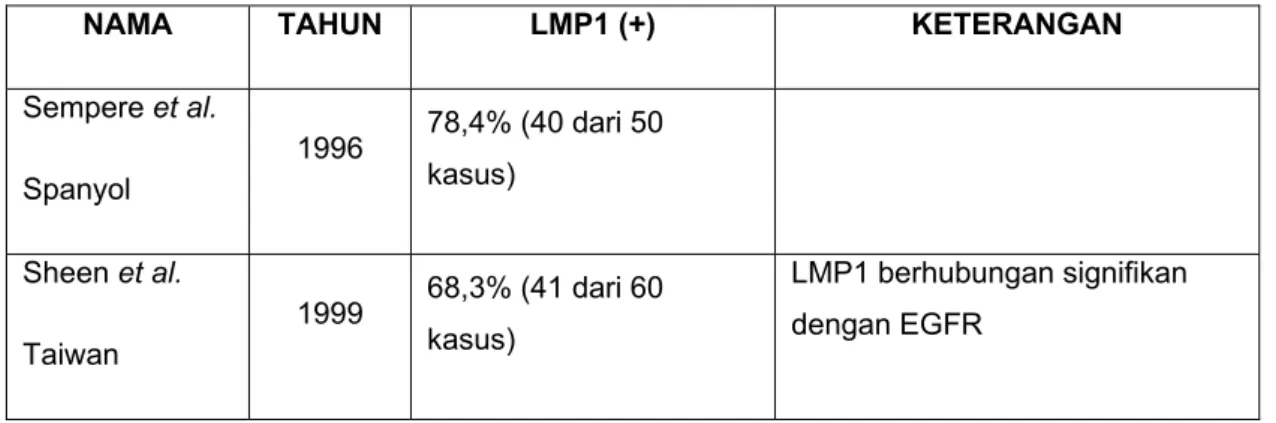
Tabel 1.1 Prevalensi ekspresi LMP1 pada karsinoma nasofaring
NAMA TAHUN LMP1 (+) KETERANGAN
Sempere et al. Spanyol 1996 78,4% (40 dari 50 kasus) Sheen et al. Taiwan 1999 68,3% (41 dari 60 kasus) LMP1 berhubungan signifikan dengan EGFR
NAMA TAHUN LMP1 (+) KETERANGAN
Gondhowiarjo Indonesia
2000 50% (86 dari 172 kasus)
Berhubungan signifikan dengan derajat tumor dan kelenjar getah bening leher Murono et al. Jepang 2001 71,41% (10 dari 14 kasus) Horikawa et al. Jepang 2001 61,5% (24 dari 39 kasus)
Berhubungan signifikan dengan metastase kelenjar getah bening leher (p=0,0172)
Xia et al., Cina 2002 86,36% (19 dari 22 kasus)
LMP1 positif pada penderita KNF dengan metastase
Xia et al., Cina 2003 61,29% (16 dari 31 kasus)
Dietz et al.
Jerman 2004 75% (33 dari 44 kasus)
Jeon et al.
Korea
2004 61% (36 dari 50 kasus)
Insiden tertinggi pada umur 50 tahun dan usia muda.
Berhubungan dengan status N dan MMP9
Kadkhoda Swedia
2007 33%
Tinggi ditemukan pada penderita
KNF ≤50 tahun, berhubungan
signifikan dengan status N
Muhtadi AI Indonesia
2007 75% (36 dari 48 kasus)
Ekspresi LMP1 ditemukan lebih tinggi pada usia <30 tahun dan berhubungan dengan status N dan WHO tipe 3 KNF
Punagi Indonesia
2007 42,1% LMP1 berhubungan dengan
WHO tipe 2 dan VEGFR
Murtono et al.
Indonesia
Khabir et al. dari penelitiannya mendapatkan bahwa ekspresi LMP1 ditemukan lebih tinggi pada usia muda.
Pathmanathan et al. melaporkan ditemukannya ekspresi LMP1 pada lesi preinvasif nasofaring, seperti pada displasia dan karsinoma insitu nasofaring, yang menandakan bahwa VEB menginfeksi sel nasofaring sejak dari tahap inisial terjadinya KNF.
Horikawa et al. melaporkan hasil penelitiannya di Taiwan, bahwa LMP1 VEB pada KNF menginduksi protoonkogen c-Met, sebuah reseptor faktor pertumbuhan hepatosit berafinitas tinggi, yang berperan dalam motilitas dan invasi sel, serta berhubungan dalam proses metastasis atau progresifitas berbagai karsinoma. Dan ekspresi c-Met yang diinduksi oleh LMP1 mempunyai hubungan korelasi positif dengan metastasis KGB pada KNF.
Hu et al. melaporkan dari penelitiannya tahun 1995 dan 2000 bahwa tingkat ekspresi LMP1 pada KNF berkisar 65%, disimpulkan bahwa KNF dengan LMP1 positif mempunyai imunogenesitas yang buruk, sedangkgan LMP1 negatif KNF mempunyai imunogenesitas yang lebih baik.
Pada penelitian kilnis KNF menunjukkan bahwa tumor dengan LMP1 positif lebih progresif perkembangannya menginvasi kelenjar limfe daripada tumor dengan LMP1 negatif (Lo et al., 2003). Tumor dengan LMP1 positif dilaporkan lebih sering mengalami perluasan ke luar nasofaring dibandingkan dengan LMP1 negatif (Korcum et al., 2006).
Penelitian di Jerman melaporkan pasien dengan LMP1 yang negatif pada pulasan imunohistokimia konvensional menunjukkan angka ketahanan hidup 5 tahun yang lebih baik dibandingkan dengan pasien yang mempunyai LMP1 positif (Dietz et al., 2004)
Wakisaka et al. dan Kondo et al. menemukan bahwa LMP1 VEB dapat mengaktivasi Hypoxia-inducible factor 1α (HIF 1α) mengalami up-regulasi pada sebagian besar malignansi. Up-regulasi HIF 1α oleh LMP1 VEB ditemukan pada KNF dengan jenis histopatologi WHO tipe II dan III, sehingga HIF 1α juga berperan dalam tumorigenesis pada keganasan yang disebabkan oleh VEB.
Horikawa et al. menemukan bahwa LMP1 VEB pada KNF dapat menginduksi transisi epitel mesenkim (epithelial-mesenchymal transition/EMT) melalui Twist (sebuah regulator utama transkripsi pada embriogenesis) dan memberikan kontribusi kepada karakter KNF yang mempunyai sifat metastasis yang tinggi.
2.5. Penatalaksanaan
2.5.1 Radioterapi
Radioterapi merupakan pengobatan utama pada KNF. Tumor ini sangat radiosensitif dengan 5-year survival rate 84% pada stadium I dan 68% pada stadium II. Angka kesembuhan akan berkurang pada stadium lanjut (stadium III dan IV). Pada pasien yang mengalami rekuren lokal, radiasi ulang dapat menyelamatkan 30% penderita. Radioterapi juga efektif terhadap terapi paliatif pada kasus yang sudah metastasis jauh (Wee et al., 1999; Tan and Soh, 1999).
Radioterapi pada penderita KNF tanpa metastasis merupakan terapi kuratif utama, yang dapat diberikan dalam dua tipe yaitu radioterapi eksternal dan brakhiterapi. Radioterapi eksternal diberikan pada tumor primer dan nodul servikal yang terlibat metastasis. Disamping itu radioterapi eksternal ulang dapat juga diberikan pada tumor yang rekuren (Teo, 1999).
Walaupun demikian, hasil pengobatan radiasi ini pada stadium lanjut tidak memberikan hasil yang memuaskan oleh karena tingginya angka kekambuhan dan metastasis jauh (Korcum et al., 2006).
Biasanya, dosis radioterapi diberikan pada tumor primer dengan dosis antara 65 – 75 Gy dan jika ada keterlibatan nodul leher dosisnya 65 – 70 Gy. Radiasi elektif dengan tidak adanya nodul, dosis diberikan 50 – 60 Gy. Terapi dengan dosis tersebut pada derajat tumor T1 dan T2 berhasil pada 75% - 90% kasus, pada derajat tumor T3 dan T4 sebesar 50% - 75% kasus. Kasus dengan keterlibatan nodul pada N0 dan N1 memberikan keberhasilan dengan 90%, tetapi pada N2 dan N3 hanya 70% (Wei, 2006)
Setelah diberikan radiasi, maka dilakukan evaluasi berupa respon terhadap radiasi. Respon dinilai dari pengecilan kelenjar getah bening leher dan pengecilan tumor primer di nasofaring. Penilaian respon radiasi berdasarkan kriteria WHO :
- Complete Response: menghilangkan seluruh kelenjar getah bening yang besar.
- Partial Response : pengecilan kelenjar getah bening sampai 50% atau lebih.
- No Change : ukuran kelenjar getah bening yang menetap.
- Progressive Disease : ukuran kelenjar getah bening membesar 25% atau lebih.
Efek samping radioterapi adalah mukositis, merupakan komplikasi akut dari radioterapi yang paling sering, sekitar 18% - 84%, stomatitis, ngilu pada gigi, dan juga hilangnya indra pengecapan (Ondrey and Wright, 2002). Disamping itu juga dapat menyebabkan xerostomia, trismus, otitis media, pendengaran menurun, hipotiroidisme, pigmentasi kulit, fibrois subkutan atau
osteoradionekrosis. Radioterapi dapat juga menyebabkan sindroma Lhermitte karena radiasi myelitis. Gejalanya seperti syok listrik yang menyebar turun ke seluruh tubuh waktu pasien memfleksikan kepala ke depan. Radioterapi juga menyebabkan komplikasi berupa nekrosis lobus temporal, ensefalomiopati,
ankilosis temporomandibular joint, gangguan nervus perifer, atrofi tulang dan gangguan sistem hipotalamus. Terapi dengan kombinasi dengan sitostatika dapat timbul depresi sumsum tulang dan gangguan gastrointestinal (Suzanne, 2001).
2.5.2 Brakhiterapi
Brakhiterapi adalah pemberian ion radiasi dosis tinggi terhadap jaringan dengan volume kecil. Brakhiterapi dapat diberikan secara interstitial implans dan
intracavitary insertion. Metode yang terakhir merupakan cara yang paling sering digunakan untuk pengobatan KNF (Wee et al., 1999; Teo, 1999). Pemberian brakhiterapi terhadap tumor primer KNF dapat di bagi berdasarkan beberapa indikasi. Yaitu Tumor persisten lokal setelah 4 bulan pemberian radioterapi primer, sebagai adjuvant setelah radioterapi eksternal dan tumor persisten regional dimana brakhiterapi diberikan pada penderita yang akan menjalani diseksi leher (Teo, 1999).
Brakhiterapi hanya diberikan pada tumor primer T1 atau T2 yang rekuren setelah pemberian radioterapi eksternal. Biasanya diberikan pada tumor yang hanya melibatkan nasofaring, parafaring atau fosa posterior nasal. Diberikan dosis 45 – 50 Gy, kemudian diikuti dengan tambahan dosis 20 Gy. Brakhiterapi menunjukkan hasil terapi yang memuaskan terhadap KNF dan akan menjadi terapi pilihan di masa akan datang (Wee et al., 1999).
2.5.3. Kemoterapi
Penatalaksanaan KNF pada stadium lanjut, kemoterapi dikombinasikan dengan radioterapi. Kemoterapi biasanya digunakan pada kasus KNF yang rekuren atau yang telah bermetastasis (Wei and Sham, 2005).
Mekanisme kerja kemoterapi adalah sebagai antimetabolit, mengganggu struktur dan fungsi DNA serta inhibitor mitosis. Antimetabolit bekerja dengan menghambat biosintesis purin atau piramidin, sehingga dapat mengubah struktur DNA dan menahan replikasi sel (Lika, 1999).
Kemoterapi yang paling sering digunakan adalah kombinasi antara Cisplatin dan 5-fluoruracil (5-FU). Cisplatin bekerja sebagai sitotoksik juga radiosensitisizer.
Cara pemberian kemoterapi terbagi 3 cara, yaitu:
1. Kemoterapi
neoadjuvant
yaitu pemberian kemoterapi mendahului pembedahan dan radiasi. Kemoterapi neoajuvan dimaksudkan untuk mengurangi besarnya tumor sebelum radioterapi. Pemberian kemoterapi neoadjuvant didasari atas pertimbangan vascular bed tumor masih intak sehingga pencapaian obat menuju massa tumor masih baik. Disamping itu, kemoterapi yang diberikan sejak dini dapat memberantas mikrometastasis sistemik seawal mungkin. Kemoterapi neoadjuvan pada keganasan kepala leher stadium II – IV dilaporkan overall response rate sebesar 80 %- 90 % dan CR (Complete Response) sekitar 50%. Kemoterapi neoadjuvan yang diberikan sebelum terapi definitif berupa radiasi dapat mempertahankan fungsi organ pada tempat tumbuhnya tumor (organ preservation) (Sukardja, 2000 ; Airoldi et al., 2009).
2. Kemoterapi konkomitan
Yaitu kemoterapi yang diberikan secara bersamaan dengan
radioterapi. dimaksud untuk mempertinggi manfaat radioterapi. Dengan
cara ini diharapkan dapat membunuh sel kanker yang sensitif terhadap
kemoterapi dan mengubah sel kanker yang radioresisten menjadi lebih
sensitif terhadap radiasi. Keuntungan kemoradioterapi adalah
keduanya bekerja sinergistik yaitu mencegah resistensi, membunuh
subpopulasi sel kanker yang hipoksik dan menghambat
recovery
DNA
pada sel kanker yang sublethal.
3. Kemoterapi
adjuvant
Tujuan pemberian kemoterapi
adjuvant
adalah pemberian
kemoterapi yang dilakukan setelah radioterapi defenitif. Regimen
kemoterapi yang dipakai biasanya mengandung Cisplatin. Pemberian
kemoterapi ini menunjukkan hasil yang lebih baik untuk harapan hidup
bebas penyakit dan pencegahan metastase jauh.
2.5.4 Pembedahan
Pembedahan hanya sedikit berperan dalam penatalaksanaan KNF. Terbatas pada diseksi leher radikal untuk mengontrol kelenjar yang radioresisten dan metastase leher sesudah radioterapi, pada pasien tertentu pembedahan penyelamatan (salvage treatment) dilakukan pada kasus rekurensi di nasofaring atau kelenjar leher tanpa metastase jauh (Chew, 1997; Wei, 2003; Wei, 2006; Lutzky et al., 2008).
2.5.5 Terapi target molekuler
Dengan tujuan untuk meningkatkan proporsi survival jangka panjang pada pasien KNF yang rekuren atau dengan metastase jauh, bahan sistemik yang lebih baik diperlukan untuk meningkatkan respon komplet. Dengan potensi indeks terapeutik yang lebih tinggi, bahan-bahan target molekuler menampilkan senyawa-senyawa yang dapat melengkapi penggunaan kemoterapi konvensional (Agulnik and Siu, 2005).
Adanya VEB pada sel-sel tumor KNF merupakan target terapi spesifik yang potensial pada KNF. Strategi terapi target VEB telah dikembangkan untuk mengontrol stadium lanjut dari KNF. Protein VEB yang muncul pada KNF merupakan target terapi tingkat sel, termasuk LMP1 dan 2. LMP1 dan 2 merupakan target antigen yang dapat diterapkan untuk terapi dengan limfosit T sitotoksik spesifik (cytotoxic T lymphocytes/CTLs) pada pasien KNF (Bharadwaj et al., 2003; Mertens et al., 2005).
Duraiswamy et al. menggunakan vaksin poxvirus rekombinan yang menyandi protein poliepitop 6 HLA A2 dari LMP1 pada tikus, yang berhasil menekan pertumbuhan tumor yang mengekspresikan LMP1. Sel manusia yang terinfeksi oleh poliepitop rekombinan ini akan dikenali oleh spesifik LMP1 CTL dari HLA A2 individual yang sehat. Penelitian ini menjadi batu loncatan untuk perkembangan vaksin poliepitop berbasis LMP sebagai imunoterapi pada KNF yang berhubungan dengan VEB.
Teh hijau mengandung catechins yaitu epigallocatechin-3-gallate
(EGCG), epicatechin-3-gallate (ECG) dan epicatechin (EC). EGCG memiliki aktivitas biokimia dan farmakologi yang besar termasuk aktivitas antioksidan, modulasi metabolisme karsinogen, menghambat proliferasi sel dan menginduksi apoptosis pada penelitian in vitro dan hewan coba. Pada
penelitian dilaporkan bahwa EGCG tidak hanya menghambat peningkatan ekspresi LMP1 dan sel-sel KNF yaitu mengganggu AP-1 dan jaras transduksi sinyal NF-κB yang dimediasi oleh VEB-LMP1, tetapi juga memblok aktifitas NF-κB yang dipicu oleh LMP1 (Zheng etal., 2007).
Li et al. menyimpulkan bahwa supresi LMP1 VEB jangka panjang in vivo merupakan cara yang efektif untuk mencegah metastasis KNF ke hepar, paru-paru, karena secara bermakna menurunkan mobilitas sel dan kemampuan invasi transmembran VEB. Metastasis pada KNF dapat secara bermakna dihambat bila ekspresi LMP1 ditekan. Penelitian ini memberikan jalan untuk penelitian-penelitian selanjutnya yang menjadikan LMP1 sebagai target terapi sel pada KNF.