PEMISAHAN TORIUM DAN URANIUM DARI PASIR
MONAZIT PULAU BANGKA DENGAN METODE
DESTRUKSI DAN PENGENDAPAN
ANNISA AMELIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
PERNYATAAN MENGENAI SKIRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pemisahan Torium dan Uranium dari Pasir Monazit Pulau Bangka dengan Metode Destruksi dan Pengendapan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2013 Annisa Amelia NIM G44080016
ABSTRAK
ANNISA AMELIA. Pemisahan Torium dan Uranium dari Pasir Monazit Pulau Bangka dengan Metode Destruksi dan Pengendapan. Dibimbing oleh CHARLENA dan MUHAMAD FARID.
Torium dan uranium dapat dipisahkan dari pasir monazit menggunakan metode destruksi dan pengendapan. Destruksi dilakukan dengan NaOH menggunakan metode destruksi basah dan kering. Hasil destruksi yang berupa padatan dilarutkan dengan HCl pekat kemudian dilakukan pengendapan torium dan uranium menggunakan larutan NH4OH pada pH 4 dan 7. Endapan tersebut
dicirikan dengan fluoresensi sinar X. Kadar torium dan uranium dengan metode destruksi kering, yaitu 2.40% dan 0.137%, sedangkan destruksi basah, yaitu 3.52% dan 0.161%. Unsur torium dan uranium memiliki kelarutan yang lebih tinggi dengan metode destruksi basah, dibandingkan dengan metode destruksi kering. Dengan destruksi basah endapan tidak diperoleh pada pH 4, sedangkan pada pH 7 endapan diperoleh dengan kadar torium yang lebih kecil tetapi kadar uranium yang lebih rendah, dibandingkan yang pada destruksi kering. Kadar torium dan uranium dengan kedua metode yang digunakan belum menunjukkan hasil yang memuaskan sebagai luaran pemisahan.
Kata kunci: destruksi, monazit, pengendapan, torium, uranium.
ABSTRACT
ANNISA AMELIA. Separation of Thorium and Uranium from Monazite Sand of Bangka Island through Destruction and Precipitation method. Supervised by CHARLENA and MUHAMAD FARID.
Thorium and uranium can be separated from monazite sand by destruction and precipitation method. Destruction was carried out using NaOH by wet and dry destruction method. Solids as the destruction result were diluted in concentrated HCl, followed by precipitation using NH4OH at pH 4 and 7. The precipitates
were characterized by x-ray fluorescence. Thorium and uranium content from dry destruction were 2.40% and 0.137%, while those from wet destruction were 3.52% and 0.161%, respectively. Thorium and uranium from wet destruction had higher solubility than those from dry destruction method. By wet destruction methods the precipitates could not be obtained at pH 4, while at pH 7 the precipitates showed higher thorium content but lower uranium content than those by dry destruction. Based on thorium and uranium contents, the two methods did not give satification as separation output.
PEMISAHAN TORIUM DAN URANIUM DARI PASIR
MONAZIT PULAU BANGKA DENGAN METODE
DESTRUKSI DAN PENGENDAPAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Skripsi : Pemisahan Torium dan Uranium dari Pasir Monazit Pulau Bangka dengan Metode Destruksi dan Pengendapan
Nama : Annisa Amelia NIM : G440080016
Disetujui oleh
Dr Charlena, MSi Pembimbing I
Drs Muhamad Farid, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan dari bulan April 2012 sampai Desember 2012 yang bertempat di Laboratorium Kimia Anorganik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Terpadu, Institut Pertanian Bogor .
Terima kasih penulis ucapkan kepada Dr Charlena, MSi dan Drs Muhamad Farid, MSi selaku pembimbing, serta Bapak Buchari yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Edi dari Pusat Sumber Daya Geologi Bandung, Ibu Evi dari Balai Tanah Bogor, Bapak Sulis serta Ibu Patmawati dari Pusat Pengembangan Bahan Galian dan Geolologi Nuklir Serpong, yang telah membantu selama pengumpulan data. Terima kasih kepada Bapak Syawal beserta seluruh staf Laboratorium Kimia Anorganik IPB, Bapak Yono beserta seluruh staf Laboratorium Terpadu, dan Bapak Agus yang telah membantu penulis dalam pemakaian alat dan bahan di laboratorium. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, Panji Anom Umboro, adik-adik (Istiqomaah, Dimas, dan Ridho), dan seluruh keluarga atas dukungan dan kasih sayangnya. Ucapan terima kasih juga penulis ucapkan kepada Anna, Hafid, Agita, Hapsah, Debby, Anissa, Ade Irawan, Linda, Wide, Cahya, Taufik, Indah, Suyono, Doni, Fudail, dan Deffy yang telah memberikan semangat, motivasi dan dorongan dalam menyusun karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2013 Annisa Amelia
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2 Analisis Pendahuluan Pasir Monazit dengan XRF 3
Destruksi Kering Pasir Monazit dengan Pelet NaOH 3 Destruksi Basah Pasir Monazit dengan Larutan NaOH 50% 3 Penentuan Daya Pelarutan Uranium dan Torium dengan HCl 37% 3 Penentuan pH Pengendapan Uranium dan Torium 4
Pencirian dengan XRF 4
HASIL DAN PEMBAHASAN 4
Komponen Pasir Monazit dengan XRF 4
Kadar Torium dan Uranium setelah Destruksi Kering 5
Kadar Torium dan Uranium setelah Destruksi Basah 7
Kelarutan Torium dan Uranium dalam HCl 37% 9
Kadar Torium dan Uranium setelah Pengendapan 9
SIMPULAN DAN SARAN 12
Simpulan 12 Saran 12
DAFTAR PUSTAKA 12
DAFTAR GAMBAR
1 Komponen pasir monazit Bangka sebelum proses destruksi 5
2 Kurva TGA/DTA pasir monazit 6
3 Perubahan kadar unsur dalam pasir monazit sebelum destruksi dan sesudah destruksi dengan peleburan
7 4 Perubahan kadar unsur dalam pasir monazit sebelum destruksi dan
sesudah destruksi dengan pembakar bunsen
8 5 Kelarutan torium dan uranium serta logam pengganggu dalam HCl
37%
10 6 Pengendapan torium dan uranium serta logam pengganggu dengan
NH4OH 2N menggunakan metode destruksi kering
11 7 Pengendapan torium dan uranium serta logam pengganggu dengan
NH4OH 2N menggunakan metode destruksi basah
11
DAFTAR LAMPIRAN
1 Diagram alir penelitian 15
2 Hasil analisis pasir monazit dengan metode destruksi kering dan basah dengan XRF
16 3 Hasil analisis kelarutan logam-logam dalam HCl 37% dengan
metode destruksi basah dan kering menggunakan ICP-OES dan AAN 17 4 Hasil analisis pengendapan logam-logam dengan NH4OH 2N
1
PENDAHULUAN
Perkembangan pembangkit listrik tenaga nuklir (PLTN) di dunia saat ini semakin meningkat sehingga berdampak terhadap kebutuhan uranium dan torium sebagai bahan bakar nuklir. Unsur-unsur uranium, torium, dan logam tanah jarang dapat diperoleh sebagai hasil samping pengolahan timah. Salah satu daerah penambangan timah terbesar di Indonesia terdapat di Pulau Bangka. Di daerah ini, unsur-unsur uranium, torium, dan tanah jarang ditemukan dalam bentuk pasir monazit berupa senyawa fosfat logam tanah jarang ([Ce,La,Y,Th]PO3). Menurut
Arif (2007), pasir monazit Bangka dijual ke negara tetangga dengan harga Rp 800 000 per ton. Harga ini tidak sebanding dengan potensinya. Nilai jual pasir monazit akan jauh lebih tinggi setelah diolah dalam bentuk torium oksida murni. Harga monazit dalam bentuk torium oksida bisa mencapai $82.50/kg, sedangkan dalam bentuk torium nitrat mencapai $27.00 per kilogram (Hedrick 2004).
Monazit (Ce, La, Y, Th) PO3) merupakan senyawa fosfat logam tanah
jarang yang mengandung 50-70% oksida logam tanah jarang (LTJ) dan merupakan sumber penting dari torium, lantanum, dan serium. Monazit memiliki kandungan torium yang cukup tinggi sehingga mineral tersebut memiliki sinar α
bersifat radioaktif dan memancarkan radiasi tingkat rendah (Suprapto 2009). Monazit merupakan salah satu mineral ikutan pada proses penambangan timah. Di alam, monazit terdapat dalam campuran dengan mineral lain seperti cassiterite (SnO2), zirkon (ZrSiO4), ilmenite (FeTiO3), rutile (TiO2), magnetit, dan garnet.
Persentase monazit dalam campuran ini biasanya sangat rendah (1-5%) sehingga hanya merupakan suatu hasil samping dari produksi mineral lainya. Pemisahan monazit dari mineral lainnya dapat dilakukan berdasarkan perbedaan bobot jenis atau sifat magnet (Spedding & Daane 1961). Monazit memiliki kemagnetan yang sangat kecil sehingga hanya tertarik oleh magnet yang sangat kuat. Bijih-bijih lainnya dipisahkan dengan magnet yang lebih lemah dan sisanya tidak bersifat magnet (non magnet). Konsentrat monazit dapat diperoleh hingga 60% monazit. Monazit sebagai limbah dari penambangan timah di Bangka mengandung unsur torium dalam bentuk oksida atau garam torium-fosfat yang selalu disertai dengan unsur-unsur logam tanah jarang dengan konsentrasi relatif tinggi maupun yang konsentrasinya rendah. Unsur uranium, torium, dan logam tanah jarang dapat dipisahkan dari monazit melalui pengolahan kimiawi.
Cadangan torium secara global jauh lebih besar sekitar 4 atau 5 kali dari cadangan uranium di alam (IAEA 2005). Uranium oksida (U3O8) merupakan
salah satu bahan baku untuk pembuatan bahan bakar nuklir. Uranium oksida dapat diperoleh dari pasir monazit dengan melakukan proses destruksi, pengendapan, dan ekstraksi. Serbuk U3O8 harus diketahui kadarnya dan
kandungan unsur-unsur pengotor yang ada pada serbuk U3O8 (Boybul 2008).
Torium merupakan bahan fertil yaitu bahan yang dapat digunakan untuk membuat bahan bakar nuklir setelah mengalami penembakan oleh neutron (0n1).
Torium yang ditembakkan oleh neutron akan menghasilkan bahan fisil U233 yang
merupakan bahan untuk membuat bahan bakar nuklir.
Pemisahan dan pemurnian uranium dan torium dari logam tanah jarang dapat dilakukan dengan berbagai cara yaitu ekstraksi, resin penukar ion, dan
pengendapan. Menurut Faizal et al. (1998), pengendapan uranium dengan reagen NH4OH pada kondisi pH 7,0 didapat hasil nilai pemulihan uranium sebesar
67.55% dan torium sebesar 1.23% dengan (RE)2O3 tidak terdeteksi. Reaksi
pengendapan uranium hidroksida dan torium hidroksida secara sempurna terjadi pada pH (5.7-6.4), jika pH>6.4 nilai pemulihan uranium dan torium hidroksida akan mengalami penurunan (Cuthbert 1958). Menurut Erni et al. (1998), kondisi terbaik untuk pengendapan uranium dan torium terjadi pada pH 6.4 selama 1 jam dengan konsentrasi NH4OH 2 N. Kondisi tersebut menghasilkan nilai pemulihan
uranium sebesar 98.99%, torium sebesar 95.00%, logam tanah jarang sebesar 8.03%, dan fosfat tidak terdeteksi. Menurut Amaral et al. (2010) pemisahan Th dan U dari unsur rare earth (RE), yaitu Th dan U diekstraksi secara simultan dari larutan sulfur monazit dengan menggunakan campuran Primene JM-T (amina primer) dan Alamine 336 (amina tersier). Hasil ekstraksi lebih tinggi dari 99.9% untuk torium dan 99.5% untuk uranium, sedangkan ekstraksi unsur tanah jarang di bawah 0.1%.
Destruksi pasir monazit dapat dilakukan dengan menggunakan HF dan HNO3. Destruksi dengan menggunakan HF dapat memberikan efek samping yang
tidak menguntungkan, yaitu kemungkinan terbentuknya endapan dari senyawa lantanida fluorida yang akan mengurangi efektivitas destruksi (Senovita 2008). Oleh karena itu, pada penelitian ini dilakukan destruksi untuk memisahkan torium, uranium, dan logam tanah jarang dari P2O5 dan SiO2 dengan NaOH
menggunakan metode destruksi kering dan destruksi basah. Setelah itu, dilakukan pengayaan torium dan uranium dengan metode pengendapan menggunakan NH4OH.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah oven gelombang mikro, fluoresensi sinar X (XRF) tipe ARL Advent+ XP, alat pembuat pelet, cincin pelet, Agilent
technologies 700 series Inductively Coupled Plasma-Optical Emission Spectroscopy (ICP-OES), dan analisis aktivasi neutron (AAN). Bahan-bahan yang digunakan adalah pasir monazit Bangka PT Koba Tin, polivinil alkohol, dan asam borat
Metode
Penelitian terdiri atas 5 tahap. Tahan pertama analisis pendahuluan pasir monazit dengan XRF. Tahap kedua destruksi kering dan basah pasir monazit dengan NaOH. Tahap ketiga Penentuan daya pelarutan uranium dan torium dalam HCl 37%. Tahap keempat Penentuan pH pengendapan uranium dan torium. Tahap terakhir adalah pencirian dengan XRF (Lampiran 1).
3
Analisis pendahuluan pasir monazit dengan XRF
Preparasi contoh dilakukan di Pusat Survei Geologi Bandung. Contoh berdiameter ±0.1 mm digerus dengan mesin penggerus otomatis lalu diayak 200 mesh (125µm) kemudian diukur dengan XRF.
Destruksi kering pasir monazit dengan pelet NaOH
Pasir monazit yang digunakan dalam destruksi kering adalah pasir monazit yang telah digerus dan diayak dengan ayakan 200 mesh. Sebanyak 3 gram pasir monazit dicampur dengan 18 g pelet NaOH dalam krus besi kemudian di bakar menggunakan bunsen lalu dilebur dalam tanur pada suhu 700 °C selama 2 jam. Setelah itu, suhu dinaikkan pada 800 °C selama 2 jam, kemudian krus besi yang berisi sampel dikeluarkan dan dibiarkan dingin. Sebanyak 250 mL akuades panas dimasukkan ke dalam krus besi secara perlahan-lahan. Larutan dalam krus besi dituang ke dalam gelas piala sehingga terdapat fase padat dan cairan. Setelah itu, dilakukan pengendaptuangan untuk mendapatkan fase padatnya. Fase padat tersebut dilakukan pencucian menggunakan akuades panas sebanyak 250 mL hingga pH 13 kemudian dikeringkan menggunakan oven dan ditimbang fase padatnya, sedangkan fase cairannya ditampung. Fase padat dianalisis menggunakan XRF.
Destruksi basah pasir monazit dengan larutan NaOH 50%
Pasir monazit yang telah digerus dan diayak dengan ayakan 200 mesh. Sebanyak 30 g pasir monazit dicampur dengan 300 mL NaOH 50% di dalam labu Khedjahl 500 mL kemudian dipanaskan menggunakan bunsen hingga larutan NaOH 50% hampir habis menguap. Setelah larutan NaOH 50% hampir habis, dilakukan dekstrusi kembali dengan NaOH 50% sebanyak 300 mL hingga larutan NaOH 50% hampir habis menguap. Larutan tersebut dituang di dalam gelas piala 600 mL sehingga terdapat fase padat dan cairan. Setelah itu, dilakukan pengendaptuangan untuk mendapatkan fase padatnya. Fase padat tersebut dilakukan pencucian menggunakan akuades panas sebanyak 1600 mL hingga pH 7 kemudian dikeringkan menggunakan oven dan ditimbang fase padatnya, sedangkan fase cairannya ditampung. Fase padat dianalisis menggunakan XRF.
Penentuan daya pelarutan uranium dan torium dalam HCl 37%
Sebanyak 1 gram sampel hasil destruksi kering dengan pelet NaOH ditambahkan 80 mL HCl 37% di dalam labu bulat kemudian dilakukan pelarutan menggunakan oven gelombang mikro dengan variasi daya dibuat dari daya rendah, sedang, dan tinggi selama 30 menit. Setelah itu, larutan dikeluarkan dari oven gelombang mikro dan diperoleh fase padat dan cairan kemudian dilakukan pengendaptuangan untuk mendapatkan fase cairannya. Fase cairan ditampung
sedangkan fase padatnya dikering pada suhu ruang di dalam lemari asam. Fase cairan dianalisis menggunakan ICP-OES dan AAN. Tahapan yang sama dilakukan menggunakan sampel hasil destruksi basah dengan larutan NaOH 50%.
Penentuan pH pengendapan uranium dan torium
Larutan HCl yang mengandung torium dan uranium yang terbaik ditambahkan NH4OH 2N tetes demi tetes hingga pH 4. Pengukuran pH dikontrol
menggunakan pH universal. Larutan pH 4 tersebut diaduk selama 1 jam kemudian disentrifius. Endapan hasil sentrifius dikeringkan dalam oven kemudian ditimbang dan dianalisis dengan XRF. Larutan sisa pH 4 ditambahkan NH4OH 2 N hingga
pH 7 kemudian diaduk selama 1 jam kemudian disentrifugasi. Endapan hasil sentrifugasi dikeringkan dalam oven kemudian ditimbang dan dianalisis dengan XRF.
Pencirian dengan XRF
Tahapan penyiapan menggunakan XRF sebagai berikut, pasir monazit (sebelum perlakuan dan sesudah perlakuan pelindihan) sebanyak 5 g yang sudah berukuran 200 mesh ditimbang, ditambahkan polivinil alkohol sebanyak 1 g kemudian dicampurkan dengan cara digerus di mortar. Setelah itu dilakukan tekan dengan alat pembuat pelet. Cincin pelet dipanaskan terlebih dahulu dalam oven sekitar 15 menit kemudian dipasang dan ditambahkan asam borat 2 g lalu diisi dengan sampel yang sudah digerus. Cross bar ditutup dan tombolnya ditekan maka akan muncul gaya tekan yang diberikan dan waktu yang diperlukan untuk terjadinya pelet. Setelah itu dibuka cross bar. Pelet yang sudah jadi diambil dan dimasukan oven selama 15 menit yang selanjutnya dianalisis menggunakan XRF, alat tekan pelet dibersihkan dengan penyedot debu serta alkohol.
HASIL DAN PEMBAHASAN
Komponen pasir monazit dengan XRF
Pemisahan torium dan uranium serta logam tanah jarang dari pasir monazit sulit dilakukan karena pembentukan unsur tanah jarang di alam bersamaan dengan terbentuknya mineral berat lainnya seperti zirkon dan ilmenit. Hal tersebut juga disebabkan kelompok unsur logam tanah jarang mempunyai sifat-sifat kimia dan fisika yang mirip. Menurut Cuthbert (1958), konsentrat pasir monazit biasanya mengandung 60% (RE)2O3, 5-10% Th, dan 25% P2O5.
Menurut Graeser & Schwander (1987), ada 3 jenis monazit berbeda bergantung pada komposisi unsur relatif mineral, yaitu monazit-Ce (Ce, La, Pr, Nd, Th, Y) PO4; monazit-La (La, Ce, Nd, Pr) PO4; dan monazit-Nd (Nd, La, Ce,
5 11.60%, u (La, Ce, N dan logam mengandu Analisis s torium seb 63.5607% ini termas digunakan uranium seb Nd, Pr) PO4 m pengotor ung logam ampel pasir besar 3.27% % (Lampiran suk monaz n mirip deng besar 0.4%, mengandun sebesar 93 pengotor 9 r monazit s %, uranium s n 2). Sampe it-La karen gan jenis mo dan logam ng torium s 3.99%. Mon 99.83% dan sebelum did sebesar 0.19 el pasir mon na dilihat d onazit-La (G pengotor s sebesar 4.51 nazit-Nd (N n tidak terd destruksi me 9%, dan log nazit yang d dari kompo Gambar 1). ebesar 87.1 1%, uranium Nd, La, Ce, dapat torium enggunakan gam-logam p digunakan d osisi sampe 6%. Monaz m sebesar 0. , Pr) PO4 h m dan uran n XRF dipe pengotor se dalam pene el monazit zit-La .21%, hanya nium. eroleh ebesar elitian yang 1 Kadar (% ) 0 20 40 60 80 100 samp G Kan dalam pas pemisahan memecah terdapat si dengan N membentu oksida log endapan d (Ln, Th)P (Rehim 20 Nisb ini diguna yang dibu Penelitian optimum 1:2. Hal i kecil. Sebe dilakukan analysis ( Gambar 1 K Kadar ndungan fos sir monazit n torium da struktur m isa fosfat. P NaOH memb uk natrium t gam transisi dengan reak PO4 (s) + 3N 002). bah jumlah akan karena utuhkan 6 k n yang telah destruksi di ini disebab elum samp analisis th DTA). TG Komponen p torium dan sfat (8.50%) t dari hasi an uranium. monazit seh Proses destr bentuk silik trifosfat, se i dan oksida si sebagai b NaOH(s) sampel den a kadar silik kali dari jum h dilakukan iperoleh pa kan kadar el dilebur p hermal grav GA bertujua pel monasi Komp pasir monaz n uranium ), silika (6.1 l samping Oleh karen hingga diha ruksi dengan ka alkali ya edangkan se a alkali tana berikut: Na ngan NaOH ka dan fosfa mlah sampe n oleh Prati ada nisbah j silika dan pada suhu vimetry ana an untuk me it-Ce monasi ponen pasir m zit Bangka s setelah des 10%), dan z konsentrat na itu, perlu arapkan pad n NaOH m ang dapat l enyawa lant ah bereaksi a3PO4 (aq) + pada saat d fat yang ting el untuk me wi (2012) m jumlah sam fosfat dala yang berag alysis (TGA elihat perub torrium uraanium loggam pengotor it-La monasiit-Nd monasit
sebelum prooses destrukksi
struksi keriing zirkon (7.60 timah dap u dilakukan da tahap aw enyebabkan larut denga tanida (LnP dengan Na 0% )yang t pat mengga n destruksi u wal sudah n silikat ber an air dan f PO4), Th3(P aOH memb tinggi anggu untuk tidak reaksi fosfat PO4)4, entuk + Ln(OH)3 (s) + Th(OHH)4 (s) destruksi ad ggi sehingg ereaksikan s menyatakan mpel dengan am sampel dalah 1:6. N ga jumlah N silika dan f n bahwa ko n NaOH se yang digun Nisbah NaOH fosfat. ondisi ebesar nakan gam, maka A) dan diff bahan mass terlebih d ferential te a sebagai f ahulu ermal fungsi
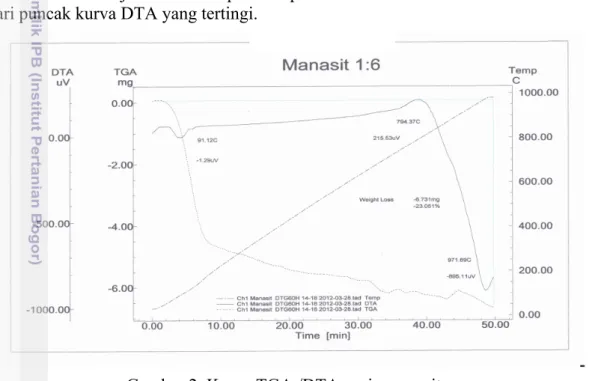
temperatur. Sampel pasir monazit yang diukur dengan TGA dan DTA adalah sampel yang direaksikan dengan pelet NaOH berupa serbuk yang merupakan hasil pembakaran menggunakan pembakar gas dan pengeringan pada oven. Kurva TGA pasir monazit pada Gambar 2 menunjukkan garis yang menurun tajam (garis putus-putus) sampai pada suhu 350 °C. Penurunan garis tersebut disebabkan oleh terdekomposisinya molekul air yang terikat secara kimia sehingga yang tersisa adalah logam-logam dalam bentuk oksida. Kurva DTA ditunjukkan garis yang berwarna hitam, garis tersebut sedikit menurun pada suhu 91.12 °C (puncak endoterm) menunjukkan proses lepasnya air terikat secara fisik, kemudian garis tersebut meningkat perlahan-lahan hingga suhu 794.37 °C (puncak eksoterm) lalu menurun tajam dengan berat sampel berkurang sebesar 23.051%. Hal ini disebabkan oleh proses dekomposisi logam-logam dalam bentuk hidroksida menjadi oksida-oksida dan atom logam bebas pada suhu 794.37 °C. Hasil analisis TGA/DTA menunjukkan suhu optimum peleburan monazit ialah 800 °C dilihat dari puncak kurva DTA yang tertingi.
Gambar 2 Kurva TGA /DTA pasir monazit
Peleburan dengan pelet NaOH pada suhu 700 °C selama 2 jam dan 800 °C selama 2 jam bertujuan memecahkan struktur monazit sehingga diharapkan pada tahap peleburan sudah tidak tedapat sisa fosfat. Penurunan kadar unsur Si, Ti, Al, Mn, Ca, P, Zr, Hf, Nb, Sn, LTJ, Th, dan U setelah peleburan berturut-turut, yaitu 5.39%, 1.38%, 1.281, 0.057%, 0.0368%, 8.37%, 3.99%, 0.063%, 0.39%, 0.24%, 8.76%, 0.87%, dan 0.058% (Gambar 3). Penurunan kadar torium dan uranium disebabkan oleh keberadaan torium dan uranium yang ikut larut dalam NaOH dan adanya reaksi inti atom yang menyebabkan peluruhan menjadi logam-logam lain seperti nikel dan molibledum. Penurunan kadar unsur Si dan P sangat tinggi karena silika bereaksi dengan NaOH membentuk natrium silikat, sedangkan fosfat bereaksi dengan NaOH membentuk natrium trifosfat. Kadar unsur fosfat dan silika yang tersisa disebabkan kurangnya jumlah pelet NaOH yang direaksikan terhadap senyawa tersebut. Oleh karena itu, untuk menghilangkan fosfat dan silika dilakukan peleburan dengan nisbah sampel dengan pelet NaOH ialah 1:8. Unsur
timbal dan bersama t dapat laru dan natriu sehingga pekat. Ha Peningkat peleburan mengikis menggang karena tid masih ada Gambar 3 Dest memecahk tedapat sis Ti, Al, Fe 0.37%, 0.3 karena ad menyebab Kadar sili destruksi (±450 °C) suhu mak antara ato peleburan monazit d 0 5 10 15 20 25 30 35 S Kadar (% ) n belerang l torium dan ut dengan N um, yaitu 16 dapat meng al ini unsur tan terjadi k mengguna dan mengen ggu proses dak dilakuka a NaOH yan Perubahan sesudah de Kadar truksi basa kan struktur sa fosfat. H e, P, dan U 36%, 5.19% da yang iku bkan peluruh ika dan fo kering. Ha ) lebih kec ka energi ki om natrium monazit d dengan NaO i Ti Al larut sempu uranium. S aOH, peleb 6.35% dan gganggu pr r besi mem karena krus akan suhu ndap bersam pemisahan an pencuci ng ikut meng n kadar unsu estruksi deng torium dan ah pasir r monazit s Hasil destruk setelah des %, dan 0.003 ut larut da han menjad sfat lebih al ini didug cil dibandin inetik akan m dengan s dengan Na OH pada suh Fe Mn Ca urna dengan Selain terja buran ini jug
13.28% (G roses pelaru miliki kelaru s yang digu yang ting ma sampel. n torium d an dengan gendap dala ur dalam pa gan pelebur n uranium monazit d sehingga dih ksi basah m struksi basa 34% (Gamb alam NaOH di logam-log tinggi pada ga karena s ngkan destru n semakin b silika dan OH akan l hu yang ting a Na P Komponen d Sebelum Setelah NaOH sehi adi penurun ga terjadi pe ambar 3). K utan torium utan yang unakan iala ggi menyeb Kadar unsu dan uranium akuades hin am sampel. asir monazit ran setelah des dengan lar harapkan p menunjukkan ah berturut-t bar 4). Penu H dan adan
gam lain sep a destruksi suhu yang uksi kering besar sehing fosfat. Hal lebih semp ggi menyeb S Pb Zr dalam sampel m destruksi ke h destruksi ker ingga tidak nan senyaw eningkatan Kadar unsur m dan uran tinggi dida ah krus bes babkan kru ur natrium m. Peningk ngga pH 6. ikut menge wa-senyawa kadar unsur r besi menin nium dalam alam HCl p si. Ketika p us besi ter yang tinggi katan ini te Oleh karen t sebelum de struksi bas rutan NaO ada tahap a n penurunan turut, yaitu urunan kadar nya reaksi perti nikel d basah dib digunakan g (800 °C). gga akan t l ini meny purna semp babkan silik Hf Nb Sn l ering ring estruksi dan sah OH 50% u awal sudah n kadar uns u 3.18%, 0. r uranium te inti atom dan molible bandingkan destruksi b Semakin t erjadi tumb yebabkan p purna. Peleb ka dan fosfa LTJ Th 7 endap yang r besi ngkat m HCl pekat. proses rsebut i juga erjadi na itu, n U n untuk tidak ur Si, .02%, erjadi yang edum. pada basah tinggi bukan proses buran at dari
pada natriu meny meni dinai yang Pb, M bersa larut LTJ, 0.11% peng diban Penin destr dalam dan logam munc peng a pasir mon um silikat yatakan bah ingkat. Be ikkan maka g memiliki e Mn, dan S ama torium dalam laru dan Th set %, 9.98%, gambilan sa ndingkan p ngkatan kad ruksi kuran m larutan N sedikitnya m tanah j culnya unsu gikisan labu nazit akan dan natrium hwa jika su erdasarkan a laju reaks energi lebih larut semp m dan urani utan NaOH 5 telah destru dan 0.25 ampel yang pengambila dar Ca, Na ng sempurn NaOH 50%. peningkata arang dan ur molibden Kjeldahl ke lebih muda m trifosfat. uhu semakin distribusi si akan men h tinggi dari purna deng ium. Selain 50% juga te uksi basah b 5% (Gamba digunakan an sampel , Zr, Hf, da na sehingga . Banyakny an kadar Ca torium m num sebesar etika dipana ah terdekom dapat dilih n meningka Arrhenius ningkat kar i energi akti gan NaOH n terjadi pen erjadi penin berturut-turu ar 4). Pen n kemungki yang digu an Sn dikar a senyawa ya penuruna a, Na, Zr, H meningkat. r 0.09% dan askan selam mposisi ole hat dari per at maka nil energi m ena semaki ivasi (Senov sehingga t nurunan se ngkatan kad ut, yaitu 0.0 ningkatan k nan memili unakan pad renakan pen -senyawa t an kadar Si, Hf, dan Sn Peningkata n nikel sebe ma destruksi eh NaOH m rsamaan k= lai e-Ea/R.T d molekuler, in banyak t vita 2008). idak ikut m enyawa-seny dar Ca, Na, Z
052%, 0.55 kadar toriu iki kadar y da destruk ncucian end tersebut se , Ti, Al, Fe n menyebab an kadar z esar 0.11% d i. membentuk = A×e-Ea/R.T dan k akan jika suhu tumbukkan Unsur Nb, mengendap yawa yang Zr, Hf, Sn, 5%, 1.28%, um karena yang tinggi ksi kering. dapan hasil edikit larut e, P, dan U bkan kadar zirkon dan disebabkan 1 1 2 2 3 3 4 4 Kadar (% ) 0 5 10 15 20 25 30 35 40 45 Si Ti Gam destr destr basah kada dan u mbar 4 Perub sesud Kadar tori ruksi kering ruksi kering h lebih baik ar besi dan uranium me bahan kada dah destruks ium dan ura g (Lampira g lebih kec k dibanding natrium pa enurun. Al Fe Mn ar unsur dala si dengan pe anium lebih an 2). Nam cil dibandi gkan destruk da destruks Ca Na P Komp sebelum d setelah de am pasir mo embakar bun tinggi deng mun, jumla ingkan dest ksi kering. si kering ya S Pb Zr ponen dalam destruksi basa estruksi basa onazit sebel nsen gan destruks ah kadar lo truksi basa
Hal ini dik ang mengak a
Hf Nb Snn Ni Mo LTTJ Th U
sampel
lum destrukksi dan si basah dib ogam peng ah sehingga arenakan pe kibatkan ka bandingkan gotor pada a destruksi eningkatan adar torium
9
Kelarutan torium dan uranium dalam HCl 37%
Pelarutan logam tanah jarang, uranium, torium, dan fosfat hasil destruksi kering dan destruksi basah dengan HCl menurut reaksi sebagai berikut:
LTJ(OH)3 + 3HCl LTJCl3 + 3H2O
Th(OH)4 + 4HCl ThCl4 + 4H2O
UO2(OH)2 + 2HCl UO2Cl2 + 2H2O (Erni et al. 1998).
Unsur-unsur tersebut dan logam-logam pengotor dapat larut dengan HCl bila dalam bentuk senyawa hidroksida atau fosfat dan terdekomposisi secara sempurna. Faktor yang berpengaruh terhadap kelarutan torium dan uranium, yaitu jumlah HCl yang digunakan, suhu, dan waktu pelarutan optimal. Jumlah HCl yang semakin banyak, suhu semakin tinggi dan waktu semakin lama maka nilai pemulihan pelarutan logam tanah jarang, torium, dan uranium semakin tinggi (Erni et al. 1998).
Pelarutan hasil destruksi kering dalam HCl 37% menggunakan oven gelombang mikro dengan variasi daya sedang dan tinggi selama 30 menit, sedangkan destruksi basah dengan variasi daya, yaitu rendah, sedang, dan tinggi. Penggunaan oven gelombang mikro dalam proses pelarutan bertujuan untuk mempercepat proses pelarutan dengan pemanasan menggunakan daya rendah, sedang, dan tinggi. Hasil analisis destruksi kering menggunakan AAN pada daya sedang diperoleh uranium sebesar 0.05% dan torium sebesar 0.35%, daya tinggi diperoleh uranium sebesar 0.06% dan torium sebesar 0.44%, (Gambar 5). Hasil tersebut menunjukkan kadar uranium dan torium yang tinggi pada daya tinggi. Hal ini dikarenakan pada energi tinggi kalor yang dikeluarkan lebih tinggi sehingga suhu yang dihasilkan juga tinggi. Semakin tingginya suhu akan meningkatkan kelarutan uranium dan torium dalam HCl pekat. Kadar logam-logam pengotor hasil pelarutan ini dengan variasi daya sedang dan tinggi, yaitu 44.21% dan 47.89% (Lampiran 3). Unsur besi yang memiliki kelarutan yang tinggi dalam HCl 37% menyebabkan logam pengotor lebih banyak pada destruksi kering. Hal ini dikarenakan unsur besi masih berada dalam bentuk hidroksida atau fosfat sehingga larut dalam HCl pekat.
Hasil analisis destruksi basah menggunakan AAN pada daya rendah diperoleh uranium sebesar 0.21% dan torium sebesar 1.53%, daya sedang diperoleh uranium sebesar 0.21% dan torium sebesar 1.61%, dan daya tinggi diperoleh uranium sebesar 0.21% dan torium sebesar 1.51% (Gambar 5). Uranium memiliki kadar yang sama pada daya rendah, sedang, dan tinggi, sedangkan torium memiliki kadar yang berbeda pada daya rendah, sedang, dan tinggi tetapi perbedaannya tidak signifikan. Kadar torium yang paling tinggi ialah pada daya sedang tetapi daya yang digunakan untuk tahap pengendapan ialah daya tinggi. Hal ini dikarenakan kadar torium dan uranium pada daya sedang dan tinggi tidak berbeda secara signifikan. Selain itu, kadar torium dan uranium lebih tinggi menggunakan daya tinggi pada destruksi kering sehingga daya tinggi dipilih sebagai daya pembanding untuk kedua metode tersebut. Kadar logam pengotor hasil pelarutan ini dengan variasi daya rendah, sedang, dan tinggi, yaitu 31.52%, 39.15%, dan 40.44% (Lampiran 3). Hasil kelarutan torium dan uranium tidak mencapai 100% dikarenakan ada sebagian unsur torium dan uranium berada pada fase padatan ketika dilarutkan dengan HCl. Selain itu, masih banyak logam-logam
peng dan F destr peng diban bentu gotor yang i Fe. Unsur u ruksi basah gotor mem ndingkan de uk hidroksid ikut larut da uranium da h dibanding miliki kelar estruksi bas da atau fosf alam HCl 3 an torium m gkan denga rutan yang sah karena fat sehingga 37% seperti memiliki kel an destruks g lebih tin logam-loga a larut dalam i logam tana larutan yan i kering. N nggi deng am pengotor m HCl peka ah jarang, H g lebih ting Namun, log an destruk r masih ber t. Hf, Ca, Zr, ggi dengan gam-logam ksi kering rada dalam logaam pengotor 0 10 20 30 40 50 Kadar logam terlarut (% ) Gam daya kons mem menc dapa RE(O Peng suhu destr sedan 0.006 ini d adan seper Enda urani urani melih peng 7 kad tingg dan b mbar 5 Kel K Hasil dest a tinggi. L entrasi NH merlukan jum capai pH ya at menyeba OH)3 sehin gendapan ur u ruang sela ruksi kering ngkan pada 61% (Gamb dikarenakan nya reaksi i rti wolfram apan torium ium memil ium menge hat kadar e gotor. Kadar dar logam p gi pada pH besi pada p larutan toriu Kadar toriu truksi basah Larutan ters H4OH 2N mlah reagen ang diingink abkan terb ngga akan ranium dan ama 1 jam g pada pH a pH 7 kadar bar 6). Kada masih ada inti atom y m, barium, m memiliki iki kadar t endap pada endapan to r logam pen pengotor seb 4 dibanding pH 4 lebih t destruksi (low) um dan uran um dan ura h dan destru sebut diend karena ko n yang bany kan, sedang entuknya n bersama-n torium dil m pada pH H 4 sebesa r endapan u ar torium da a torium da yang menye kromium, i kadar yan tertinggi pa pH 4,64 d rium dan u ngotor pada besar 5.20% gkan pada p tinggi diban destruksi (medium) d nium serta l anium setel uksi kering d dapkan den onsentrasi N yak sehingg gkan konset impuritis y -sama men lakukan den 4 dan 7. K ar 0.0024% uranium seb an uranium an uranium ebabkan pe sesium, ma ng tinggi p ada pH 7. H dan 6,48 da uranium, d a pH 4 sebe % (Lampiran pH 7. Hal i ndingkan pa destruksi (high) le (m Daya logam pengo lah pengen dilarutkan d ngan NH4O NH4OH le ga memerlu rasi NH4OH yang disel ngendap ( ngan param Kadar enda % dan toriu esar 0.0070 yang diper yang tidak eluruhan me agnesium, k pada pH 4,
Hal ini dik ari perhitung apat dilihat sar 16.67 % n 4). Kadar ini dikarena ada pH 7. T eburan medium) l otor dalam ndapan dengan HCl OH 2N. P ebih rendah ukan waktu H lebih ting limuti oleh (Erni et a meter NH4O apan uraniu um sebesa 0% dan toriu roleh sangat k ikut meng enjadi loga kalium, dan , sedangkan karenakan t gan nilai K t kadar log %, sedangka logam peng akan kadar Tingginya k Urannium toriuum leburan (high) HCl 37% l 37% pada enggunaan h dari 2N yang lama ggi dari 2N h endapan al. 1998). OH 2N dan um dengan ar 0.102%, um sebesar t kecil. Hal gendap dan am lainnya n vanadin. n endapan torium dan Ksp. Selain gam-logam an pada pH gotor lebih unsur klor kadar unsur
11 klor dan penggangu lutesium, praseodium 7, yaitu h brom, kro tanah jara Hal ini di dari 6 berd besi karen u yang tid iterbium, mium, fluor holmium, lu omium, fluo ang lebih ba ikarenakan dasarkan nil na suasana dak ikut ter
erbium, r, yodium, s utesium, tu or, vanadin anyak tidak kebanyakan lai Ksp. pH 4 ter redapkan p tulium, d sesium, bari ulium, terbi , wolfram, mengendap n logam tan rmasuk sua pada pH 4 disprosium, ium, dan wo ium, hafniu fosfor, kal p pada pH nah jarang asana asam , yaitu terb , samarium olfram , sed um, nlobium lium, dan b 4 dibanding mengendap m. Logam-l bium, holm m, gadolin dangkan pad m, molibde belerang. L gkan pada p p pada pH ogam mium, nium, da pH enum, ogam pH 7. lebih 0 2 4 6 8 10 12 14 16 18 l pH4 pH7 Kadar (% ) Gambar 6 Hasi metode de 0.0023% ( terdapat e uranium, d Gambar 7 Kadar (% ) Pengendap NH4OH 2N il analisis p estruksi bas (Gambar 7) endapan pa dapat diliha Pengendap dengan NH 0 2 4 6 8 10 12 logam pan torium N mengguna pengendapa sah diperole ). Pengenda ada pH ters at kadar loga pan torium H4OH 2N m logam pengoto m pengotor K dan uranium akan metod an torium d eh kadar tor apan pada pH sebut. Selai am-logam p dan uranium menggunaka or T Komponen Th Komponen m serta loga de destruksi dan uranium rium dan u H 4 tidak d in melihat pengotor seb m serta loga n metode d Th n dalam sam h dalam sam am pengotor kering m pada pH ranium, yai dapat dilaku kadar enda besar 11,26% am pengotor estruksi bas U mpel U mpel r dengan 7 menggun itu 0.5440% ukan karena apan torium % (Lampira nakan % dan tidak m dan an 4). r pada pH 77 sah
Unsur torium lebih mengendap pada pH 7 dengan metode destruksi basah dibandingkan pada pH 4 dan 7 dengan metode destruksi kering, tetapi unsur uranium lebih mengendap pada pH 7 dengan metode destruksi kering. Logam-logam pengotor berupa Logam-logam tanah jarang lebih banyak pada pH 7 dengan destruksi basah dan kering dibandingkan pada pH 4 dengan destruksi kering.
SIMPULAN DAN SARAN
Simpulan
Kadar uranium mengalami penurunan setelah destruksi kering dan basah, sedangkan kadar torium mengalami kenaikkan setelah destruksi basah dan mengalami penurunan setelah desttuksi kering. Kadar silikat dan fosfat pada destruksi kering lebih kecil dibandingkan destruksi basah. Unsur torium dan uranium memiliki kelarutan yang lebih tinggi dengan metode destruksi basah, yaitu 1.51% dan 0.214%, dibandingkan dengan metode destruksi kering, yaitu 0.44% dan 0.065%. Unsur torium lebih mengendap pada pH 7 dengan metode destruksi basah dan uranium lebih mengendap pada pH 7 dengan metode destruksi kering dibandingkan pada pH 4 dengan metode dekstruksi kering. Logam-logam pengotor berupa logam tanah jarang lebih banyak pada pH 7 dengan destruksi basah dan kering dibandingkan pada pH 4 dengan destruksi kering. Kadar torium dan uranium dengan kedua metode yang digunakan belum menunjukkan hasil yang memuaskan sebagai luaran pemisahan.
Saran
Dalam penelitian ini perlu dilakukan perlu dilakukan ekstraksi TBP dalam kerosen untuk memisahkan torium dan uranium dari logam-logam pengotor. Selain itu, perlu dilakukan modifikasi dengan penggabungan destruksi basah dan destruksi kering. Selama proses destruksi disarankan tidak menggunakan krus besi dan labu Kjeldahltetapi menggunakan alat-alat yang tahan terhadap NaOH seperti cawan platina.
DAFTAR PUSTAKA
Amaral J, Morais CA. 2010. Thorium and uranium eXtraction from rare earth elements in monazite sulfuric acid liquor through solvent eXtraction. J Minerals Eng 23: 498-503.
Arif A. 2007. Nanoteknologi [terhubung berkala]. http://www.unisosdem. Org/article detail.php?aid=8321&coid=59&gid=2. html. diakses pada 7 Maret 2011.
13
Boybul, Indaryati S, Haryati I. 2008. Analisis pengotor Cd, Be, Co, dan Al dalam serbuk U3O8 dengan spektrofotometer serapan atom. Hasil-hasil Penelitian EBN. Hlm 622-629.
Cuthbert FL. 1958. Thorium Production Technology. Massachusetts : Addison-Wesley.
Erni RA, Rudi P, Zahardi, Susilaningtyas. 1998. Pengolahan bijih uranium asal rirang: pemisahan LTJ dari hasil digesti basah. Di dalam: Prosiding Presentasi Ilmiah Daur Bahan Bakar Nuklir V; 2000 Feb 22; Jakarta, Indonesia. Jakarta (ID): Pusat Pengembangan Bahan Galian Nuklir Batan. Hlm 94-101.
Erni RA, Sumiarti, Widowati, Susilaningtyas. 1998. Pengolahan bijih uranium asal rirang: pengendapan RE dari larutan RE(Cl)3. Di dalam: Prosiding
Presentasi Ilmiah Daur Bahan Bakar Nuklir VI; 2001 Nov 7-8; Jakarta, Indonesia. Jakarta (ID): Pusat Pengembangan Bahan Galian Nuklir Batan. Hlm 55-60.
Faizal R, Hafni LN, Budi S, Sugeng W, Susilaningtyas. 1998. Pengolahan bijih uranium asal rirang secara basah pemurnian uranium hidroksida dari LTJ. Di dalam: Prosiding Presentasi Ilmiah Daur Bahan Bakar Nuklir V; 2000 Feb 22; Jakarta, Indonesia. Jakarta (ID): Pusat Pengembangan Bahan Galian Nuklir Batan. Hlm 102-108.
Graeser S, Schwander. 1987. Gasparite-(Ce) and monazite-(Nd): two new minerals to the monazite group from the Alps. Schweiz Mineral Petrog Mitt 67: 103–113.
Hendrick JB. 2004. Geological Survey Minerals Yearbook. USA: US Geological Survey.
[IAEA] International Atomic Agency. 2005. Thorium Fuel Cycle-potential Benefits and Challenges. Vienna: IAEA.
Pratiwi F. 2012. Pengembangan metode destruksi unsur logam tanah jarang dari tailing pasir timah pulau Bangka [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor.
Rehim AAM. 2002. An innovative method for processing Egyptian monazite. Hydrometallurgy 67: 9-17.
Senovita R. 2008. Optimasi destruksi mineral monazit bangka untuk pemungutan unsur tanah jarang [skripsi]. Bandung (ID): Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Teknologi Bandung.
Spedding FH, Daane AH. 1961. The Rare Earth Elements. New York : Jhon Wiley.
Suprapto SJ. 2009. Tinjauan tentang unsur tanah jarang. Makalah Ilmiah. Buletin Sumber Daya Geologi, 4(1).
15
Lampiran 1 Diagram alir penelitian
Preparasi sampel dan analisis pendahuluan dengan XRF
Penentuan daya pelarutan endapan uranium dan torium
dalam HCl 37% dengan variasi rendah, sedang, dan
tinggi Analisis larutan dengan AAN Pengendapan larutan dengan NH4OH 2 N pada pH 7 Destruksi kering pasir
monazit dengan pelet NaOH
Destruksi kering pasir monazit dengan larutan
NaOH 50% Pencuciaan endapan dengan akuades Pencuciaan endapan dengan akuades Penentuan daya pelarutan endapan uranium dan torium dalam HCl 37% dengan variasi rendah,
sedang, dan tinggi
Analisis larutan dengan AAN Analisis endapan dengan XRF Analisis endapan dengan XRF Pengendapan larutan dengan NH4OH 2 N pada pH 4 dan 7 Analisis endapan dengan XRF Analisis endapan dengan XRF Pasir monazit
Lampiran 2 Hasil analisis pasir monazit dengan metode destruksi kering dan basah dengan XRF
ttd= tidak terdeteksi
Unsur Pasir monazit
(%) kering (%) Destruksi Destruksi basah (%) Analat (Logam target) Th 3.2700 2.4000 3.5200 U 0.1950 0.1370 0.1610 Matriks (logam pengotor) Si 6.1000 0.7050 2.9200 Ti 3.0600 1.6800 3.0400 Al 1.4100 0.1290 1.0400 Fe 1.6000 17.9500 1.2400 Mn 0.0747 0.0177 ttd Ca 0.1070 0.0702 0.1590 Na 0.1440 13.4200 0.6930 P 8.5200 0.1500 3.3300 S 0.0286 ttd ttd Pb 0.0297 ttd ttd Zr 7.6000 3.6100 8.8800 Hf 0.1190 0.0560 0.2280 Nb 0.0422 0.0294 ttd Mo ttd ttd 0.0907 Sn 0.4180 0.1740 0.5470 Ni ttd ttd 0.1150 Gd 0.7270 0.7660 0.9410 Y 5.4700 4.1200 6.6800 Nd 5.2000 3.7700 6.9400 La 6.2000 4.0200 7.6800 Lu 0.0515 0.0394 ttd Yb 0.4600 0.4250 0.5990 Er 0.4450 0.3780 0.6490 Pr 1.0400 0.9620 1.4900 Dy 0.6790 0.6490 0.8720 Sm 0.5850 0.6600 0.8970 Ce 13.450 9.5100 17.5500 Tb ttd 0.1030 ttd Ho ttd 0.1210 ttd Tm ttd 0.0331 ttd
17
Lampiran 3 Hasil analisis kelarutan logam-logam dalam HCl 37% dengan metode destruksi basah dan kering menggunakan ICP-OES dan AAN
ttd= tidak terdeteksi
Unsur
Daya destruksi kering (%)
Daya destruksi basah (%)
Sedang Tinggi Rendah Sedang Tinggi
Analat (Logam target) dengan AAN Th 0.3500 0.4400 1.5300 1.6100 1.5100 U 0.0550 0.0650 0.2130 0.2140 0.2140 Matriks (logam pengotor) dengan ICP-OES Fe 16.4900 17.6700 ttd ttd ttd Ca 0.1500 0.1900 0.1200 0.1300 0.1800 Na ttd ttd ttd ttd ttd Zr 4.2800 4.4900 0.0700 0.0100 0.0400 Hf 0.0800 0.0900 0.0200 0.0100 0.0060 Nb ttd ttd ttd ttd ttd Gd 0.5800 0.6400 0.5800 0.6200 0.6500 Y 0.7100 0.7900 0.7900 4.8000 5.2200 Nd 3.1000 3.3900 4.5700 5.1500 5.2500 La 6.6600 7.0200 7.3900 8.3800 8.5000 Lu 0.0800 0.0800 0.0200 0.0100 0.0100 Yb 0.5900 0.6400 0.0500 0.0500 0.0400 Er 0.6100 0.6900 0.2000 0.2000 0.2000 Pr 2.9200 3.2300 4.1100 4.6000 4.7200 Dy 0.7800 0.8600 0.2900 0.3100 0.3100 Sm 0.7400 0.8500 1.0700 1.1800 1.1900 Ce 6.1200 6.9400 12.0200 13.4100 13.8300 Tb 0.1300 0.1200 0.0900 0.0900 0.1000 Ho 0.1900 0.2000 0.1300 0.1400 0.1300 Tm ttd ttd ttd 0.0600 0.0600
Jumlah matriks (logam pengotor)
Lampiran 4 Hasil analisis pengendapan logam-logam dengan NH4OH 2N
menggunakan XRF
ttd= tidak terdeteksi
Unsur Destruksi kering (%) Destruksi basah (%)
pH 4 pH 7 pH 7 Analat (Logam target) Th 0.1020 0.0061 0.5440 U 0.0024 0.0070 0.0023 Matriks (logam pengotor) Si 0.1510 0.0171 0.0801 Ti 0.2920 0.0085 0.172 Al 0.0735 0.0143 0.0549 Fe 1.7400 0.0981 0.0377 Ca 0.0069 0.0009 0.0025 Mg 0.0701 0.0078 0.0027 Na 0.1660 0.0227 0.0203 K 0.0060 ttd 0.0015 P 0.0127 ttd 0.0076 S 0.0053 ttd 0.0037 V 0.0009 ttd ttd Zr 0.5570 0.0225 0.0198 Hf 0.0047 ttd ttd Nb 0.0027 ttd ttd Mo 0.0019 ttd 0.0057 Sn 0.0381 0.0022 ttd Cl 13.4500 4.9000 10.4900 Br 0.0014 ttd 0.0010 I ttd 0.0029 ttd Cr 0.0129 ttd ttd F ttd ttd 0.0620 Cs ttd 0.0049 0.0071 Ba ttd 0.0089 0.0126 W ttd ttd 0.0022 Gd ttd 0.0029 0.0306 Y 0.0148 0.0303 0.0382 Nd 0.0102 0.0141 0.2120 La 0.0143 0.0058 0.0575 Lu ttd ttd ttd Yb ttd 0.0068 ttd Er ttd 0.0039 0.0030 Pr ttd 0.0028 0.0481 Dy ttd 0.0045 0.0131 Sm ttd 0.0023 0.0556 Ce 0.0381 0.0190 0.4380 Tb ttd ttd 0.0026 Ho ttd ttd ttd Tm ttd ttd ttd
Jumlah matriks (logam pengotor)
19
RIWAYAT HIDUP
Penulis dilahirkan di Koba pada tanggal 11 Januari 1990 dari Bapak Amir dan Ibu Istyah. Penulis merupakan anak pertama dari empat bersaudara. Penulis menyelesaikan studi di SMA 1 Koba pada tahun 2008. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) pada Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti masa perkuliahan penulis aktif dalam komunitas Capoeira Alegria IPB. Selain itu, pernah menjadi panitia Pesta Sains, MPD, MPF, dan Spirit. Penulis juga pernah mengikuti praktek lapangan di PT Koba Tin Bangka Tengah.