Untuk kelas SMA/MA Sifat koligatif larutan dapat digunakan untuk menentukan massa molekul relatif, derajat ionisasi, dan jumlah ion terlarut.
Molalitas dan Fraksi mol
Jika seluruh NaCl dalam air terionisasi menjadi Na+ dan Cl–, hitung fraksi mol total ion-ion dalam larutan.
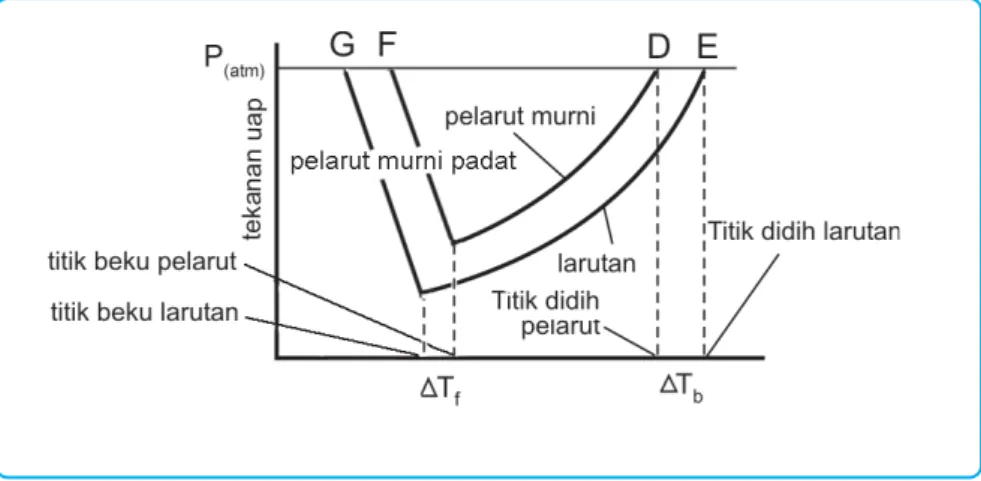
Penurunan Tekanan Uap ( P)
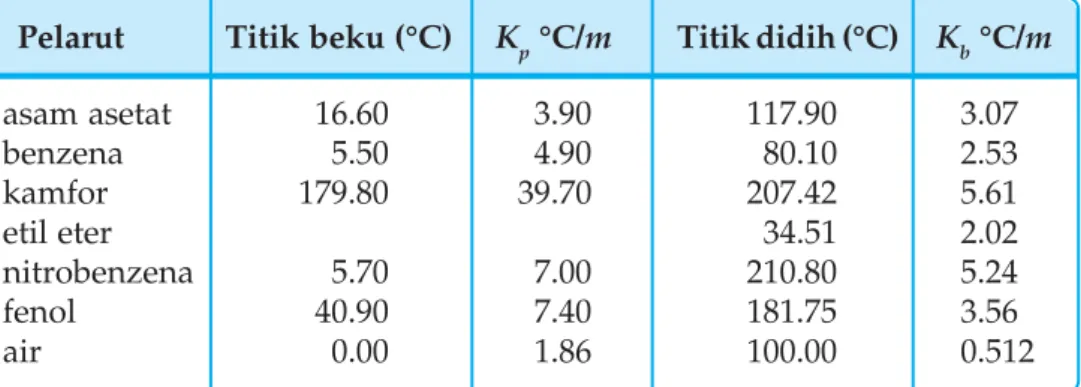
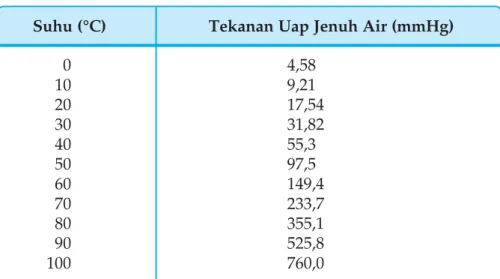
Dalam larutan encer, kenaikan titik didih dan penurunan titik beku berbanding lurus dengan konsentrasi molar larutan. Selain menggunakan penurunan tekanan uap, kenaikan titik didih, dan penurunan titik beku, pengukuran tekanan osmotik juga dapat digunakan untuk menentukan massa molekul relatif (Mr) suatu senyawa. Bandingkan data titik didih dan titik beku larutan urea dan NaCl yang molalitasnya sama, dengan 'Tb dan 'Tf lebih besar.
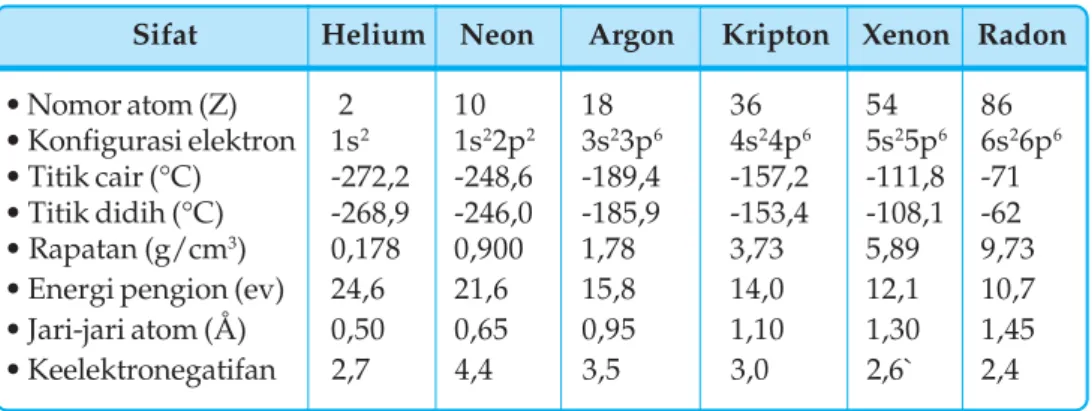
Sedangkan wujud gas pada suhu kamar disebabkan oleh rendahnya titik leleh dan titik didih gas mulia. Dari data kekerasan (skala Mohs) terlihat semakin menurun dari atas ke bawah, artinya semakin rendah semakin lunak 2) Titik didih dan titik leleh. Dari titik leleh dan titik didihnya dapat disimpulkan bahwa unsur natrium hingga belerang berbentuk padat, sedangkan klor dan argon berbentuk gas pada suhu biasa.
Titik leleh dan titik didih unsur periode ketiga dari natrium ke kanan meningkat dan mencapai puncaknya pada silikon dan kemudian menurun. Semakin besar massa molekul relatif maka gaya Van der Waals semakin kuat, akibatnya titik leleh dan titik didih semakin tinggi. Ar, sehingga belerang memiliki titik leleh dan titik didih yang lebih tinggi dibandingkan P4, Cl2 dan Ar. 3) energi ionisasi.
Mengapa silikon mempunyai titik leleh dan titik didih paling tinggi diantara unsur periode ketiga lainnya? Unsur transisi umumnya mempunyai titik leleh dan titik didih yang tinggi karena ikatan antar atom logam pada unsur transisi lebih kuat. Mengapa titik leleh dan titik didih logam transisi lebih tinggi dibandingkan titik leleh dan titik didih logam alkali dan alkali tanah?
Mengapa titik leleh dan titik didih logam transisi periode keempat lebih tinggi dibandingkan logam alkali dan alkali tanah.
Kenaikan titk didih ( Tb) dan Penurunan titik beku ( Tf)
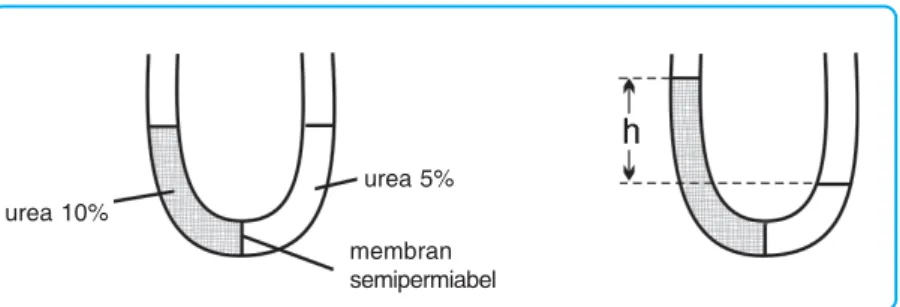
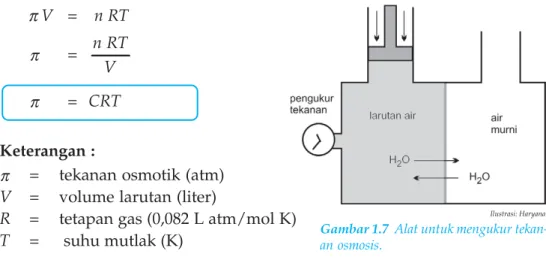
Tekanan Osmotik ( )
Untuk larutan yang sangat encer, mengukur tekanan osmotik lebih akurat daripada mengukur titik didih atau titik beku sehingga menentukan massa molekul. Jika tekanan osmotik darah manusia pada suhu 37°C adalah 7,7 atm, berapa gram glukosa C6H12O6 yang diperlukan untuk membuat 500 ml larutan yang isotonik dengan darah.
Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan terdiri dari penurunan tekanan uap ('P), kenaikan titik didih ('Tb), penurunan titik beku ('Tf) dan tekanan osmotik (S). Larutan elektrolit mempunyai sifat koligatif yang lebih besar dibandingkan sifat koligatif larutan non-elektrolit dengan konsentrasi yang sama.
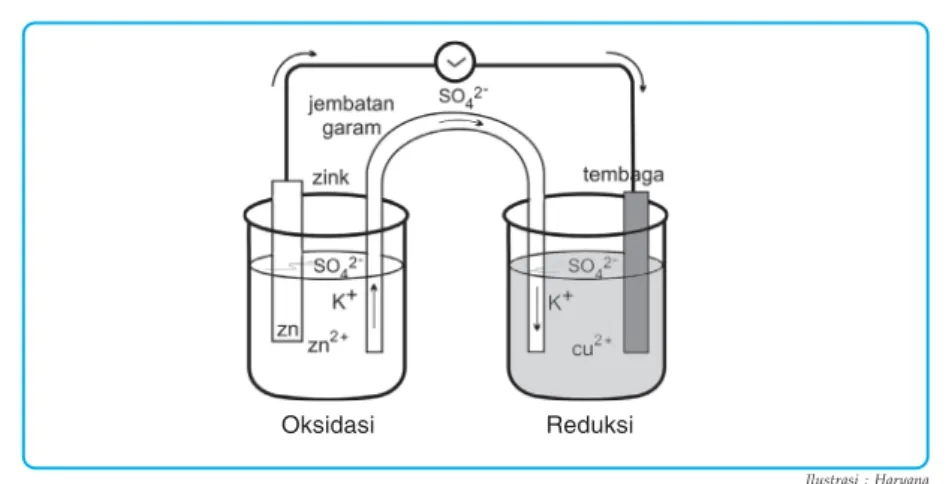
Sel Elektrokimia
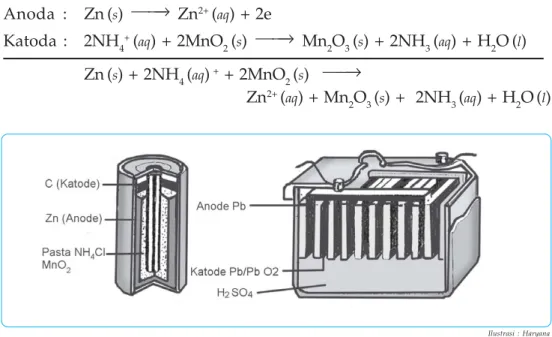
Pada sel volta yang tersusun dari elektroda Zn dan Cu, elektroda Zn tampak mengalami oksidasi. Dalam sel volta yang baru saja kita pelajari, reaksi redoks spontan menghasilkan arus listrik.
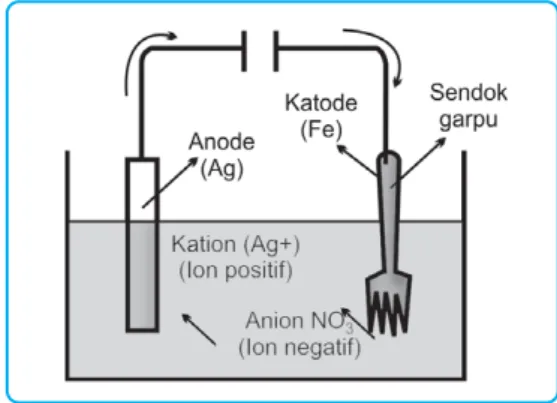
Kegunaan Elektrolisis
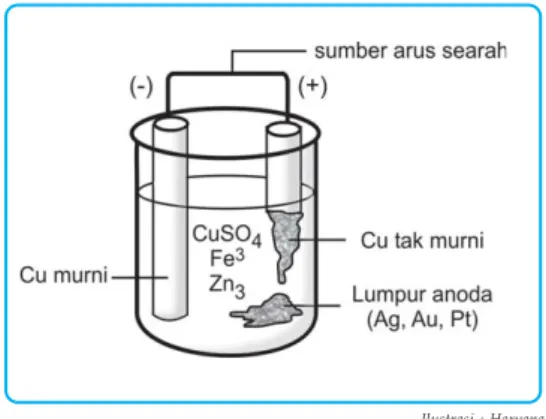
Saat mengolah tembaga dari bijih kalkopirit, kami memperoleh tembaga yang dicampur dengan sedikit perak, emas, dan platinum. Contoh: Pada peralatan makan baja pelat perak dipasang garpu sebagai katoda dan logam perak sebagai anoda dengan larutan elektrolit AgNO3.
Korosi (Perkaratan)
Jika arus listrik yang sama dialirkan pada dua atau lebih sel elektrolit, perbandingan jumlah zat yang dilepaskan sama dengan perbandingan massa ekuivalennya. Berapa gram logam Cu yang mengendap pada katoda jika arus listrik sebesar 1930 coulomb digunakan untuk mengelektrolisis larutan CuSO4 dengan elektroda platina.
Sifat-Sifat Unsur
Unsur gas mulia dalam tabel periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) dan Radon (Rn). Alkali adalah unsur golongan IA selain hidrogen, yang meliputi litium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs), dan fransium (Fr). Unsur alkali tanah terdiri dari berilium (Be), magnesium (Mg), kalsium (Ca), strontium (Sr), barium (Ba) dan radium (Ra).
Unsur alkali tanah kecuali berilium (Be) semuanya merupakan logam berwarna putih keperakan dan lebih keras dari alkali. Tanah alkali dapat bereaksi dengan hampir semua unsur nonlogam melalui ikatan ionik (kecuali berilium yang membentuk ikatan kovalen). Semua logam alkali tanah dapat bereaksi dengan oksigen membentuk oksida yang mudah larut dalam air.
Energi ionisasi unsur periode ketiga umumnya bertambah dari kiri ke kanan, namun Al dan S berkurang sehingga energi ionisasi Mg > Al dan energi ionisasi P > S. Berbeda dengan periode ketiga, jari-jari atom unsur transisi periode keempat tidak teratur dari kiri ke kanan. Dari data potensial elektroda, unsur transisi periode keempat mempunyai nilai potensial elektroda negatif kecuali Cu (E° = + 0,34 volt).
Pembuatan dan manfaat beberapa unsur dan senyawanya
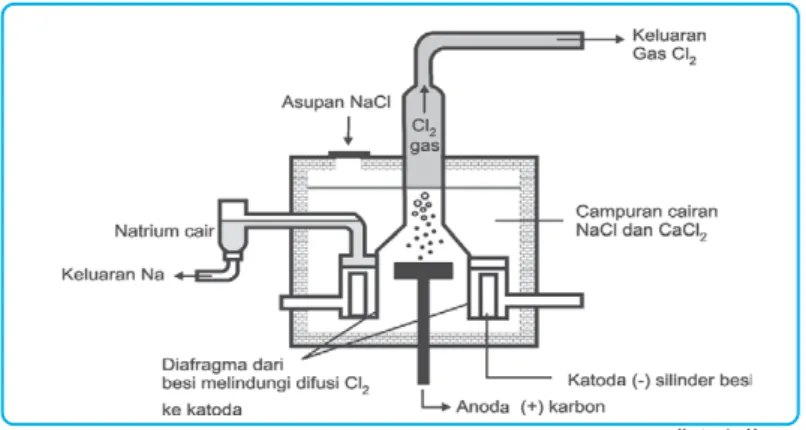
NaCl lebih dikenal dengan sebutan garam meja, selain sebagai bumbu masakan, NaCl sering digunakan untuk membuat berbagai bahan kimia, misalnya NaOH, NaCl dan digunakan untuk mengawetkan ikan. Paduan logam ini kuat, ringan dan tahan korosi, serta digunakan untuk membuat komponen pesawat terbang. Aluminium merupakan logam yang ringan, tahan karat dan tidak beracun sehingga banyak digunakan untuk peralatan rumah tangga, pesawat terbang, kaleng dan kabel.
Selain untuk pelapis, timah juga digunakan untuk membuat paduan, misalnya perunggu (Cu + Sn) dan untuk solder (Sn + Pb). Kromium adalah logam keras, sangat mengkilat dan tahan karat, oleh karena itu digunakan untuk melapisi logam lain. Alias ini digunakan untuk ketahanan kawat pada alat pemanas, stainless steel (72% Fe, 19% Cr, 9% Ni).
Emas merupakan logam berwarna kuning mengkilat, tahan terhadap karat, mudah ditempa dan tidak bereaksi dengan asam, sehingga digunakan untuk perhiasan, pelapis logam lain dan pembuatan medali. Klorin digunakan untuk klorinasi hidrokarbon untuk bahan baku plastik dan untuk produksi senyawa klorin lainnya. Kromium merupakan logam yang sangat mengkilat, keras dan tahan karat yang digunakan untuk pelapisan logam alias plating.
Sinar Radioaktif
Pada tahun 1898, Paul Ulrich Villard menemukan sinar radioaktif yang tidak terpengaruh medan magnet yaitu sinar gamma (J. Setahun kemudian, Ernest Rutherford berhasil menemukan dua sinar radioaktif lainnya yaitu sinar alfa (D) dan sinar beta (E. Selain itu dari D), sinar E dan unsur radioaktif J juga memancarkan partikel lain, misalnya positron (elektron positif) 01e, neutron 01n, proton 11p, detron 21D dan triton 31T.
Jika suatu unsur radioaktif memancarkan sinar D, maka akan dihasilkan unsur baru yang nomor atomnya dikurangi dua dan nomor massanya dikurangi empat. Jika suatu unsur radioaktif memancarkan sinar E, maka akan dihasilkan unsur baru dengan nomor atom bertambah satu dan nomor massa tetap.
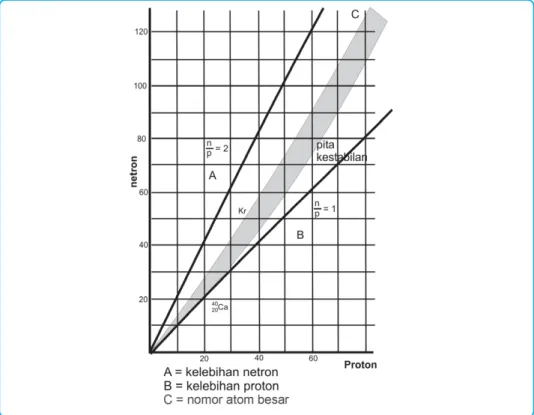
Stabilitas inti
Nuklida stabil dengan nomor atom tertinggi 83 adalah 20983Bi, sedangkan nuklida dengan Z > 83 tidak stabil. Sampai nomor atom 80, inti atom stabil, perbandingan antara neutron dan proton lebih besar.
Peluruhan
Simbol tipe partikel/radiasi elektron magnet Inti yang terletak di sisi berlawanan dari pita stabilitas (Z > 83) mencapai stabilitas dengan memancarkan alfa.
Kecepatan Peluruhan
Mula-mula jumlah zat radioaktif N0 setelah waktu paruh pertama menjadi 1/2 a, setelah waktu paruh kedua menjadi , dan seterusnya. Jika aktivitas C-14 pada makhluk hidup = 180 cpm dan waktu paruh C-14 5770 tahun, perkirakan umur naskah tersebut.
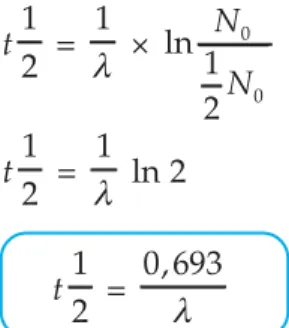
Deret Keradioaktifan
Reaksi Inti
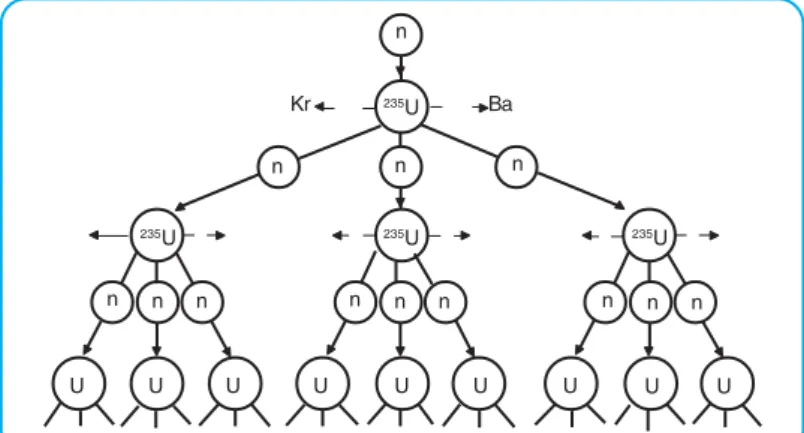
Dari percobaan tersebut dapat disimpulkan bahwa suatu nuklida dapat diubah menjadi nuklida lain melalui reaksi nuklir. Dengan demikian, isotop radioaktif dapat dibuat di laboratorium dengan cara pembakaran (reaksi nuklir). Nuklida hasil reaksi fisi 23592U lebih stabil dan neutron yang dipancarkan dapat melepaskan 23592U lain yang terjadi secara berantai.
Jika reaksi berantai ini tidak dikendalikan maka akan menghasilkan energi yang sangat besar seperti bom atom yang dijatuhkan di Hiroshima dan Nagasaki. Reaksi fisi dapat dikendalikan dalam reaktor nuklir dengan mengendalikan neutron yang dihasilkan sehingga hanya sebagian saja yang mencapai 23592U sehingga memperlambat reaksi fisi. Suatu unsur radioaktif, setelah memancarkan sinar E, menghasilkan unsur stabil yang terletak pada gugus VA SPU.
Penggunaan tenaga atom dan radioisotop
Selain itu, energi yang dihasilkan dari reaksi nuklir pada reaktor atom dapat digunakan untuk menghasilkan listrik yang dikenal dengan PLTN (Pembangkit Listrik Tenaga Nuklir). Setelah Friederick Wohler berhasil mensintesis urea (yang kita klasifikasikan sebagai senyawa organik) di luar tubuh makhluk hidup, yaitu dengan memanaskan amonium sianat, maka pengklasifikasian senyawa karbon organik dan anorganik tidak lagi berdasarkan asal usulnya, melainkan berdasarkan asal usulnya. sifat dan struktur. Senyawa karbon organik mempunyai ciri yaitu terdapat gugus fungsi dalam strukturnya yang menentukan sifat senyawa karbon dan adanya rantai karbon, hal ini tidak terdapat pada senyawa karbon anorganik.
Untuk memudahkan mempelajari senyawa karbon yang mempunyai banyak jenis dan jumlah, maka senyawa karbon diklasifikasikan berdasarkan gugus fungsi yang dimilikinya. Berdasarkan gugus fungsinya, senyawa karbon organik dibedakan menjadi beberapa golongan, yaitu haloalkana, alkanol, alkoksi, alkana, alkana, alkanon, alkanoat, dan alkil alkanoat. Setelah mempelajari bab ini, Anda akan dapat menjelaskan struktur, ejaan, tata nama, sifat, kegunaan, dan identifikasi senyawa karbon.
Di kelas X kita mempelajari senyawa karbon yaitu golongan hidrokarbon yang terdiri dari alkana, alkena dan alkuna. Gugus fungsi pada senyawa karbon menentukan sifat senyawa tersebut karena pada reaksi organik reagen menyerang gugus fungsi. Karena setiap gugus fungsi mempunyai sifat yang spesifik (hanya dapat bereaksi dengan reagen (tertentu), senyawa karbon dapat diidentifikasi berdasarkan gugus fungsi yang dimilikinya dengan reagen yang bersangkutan.
Senyawa Karbon
Secara komersial, formaldehida diproduksi dengan mereaksikan uap alkohol (metanol) dengan katalis tembaga dan memanaskan a) Larutan formaldehida (metanal) 37% dalam air yang disebut formalin digunakan untuk mengawetkan objek anatomi. Alkanon digunakan sebagai pelarut dan bahan bahan organik lainnya, misalnya kloroform diperoleh dengan mereaksikan aseton dengan gas klor dan NaOH. Asam karboksilat dan ester merupakan isomer karena mempunyai rumus molekul yang sama yaitu CnH2nO2.
Asam karboksilat atau asam alkanoat dapat dianggap sebagai turunan alkana dengan mengganti 1 atom H alkana dengan suatu gugus. Nama asam karboksilat diambil dari nama alkana dengan cara mengganti akhiran ana dengan anoat dan penomoran gugus fungsi serta menambahkan awalan asam. Isomer asam karboksilat disebabkan oleh ada tidaknya cabang dan letak cabangnya, selain itu asam karboksilat juga mempunyai isomer fungsional dengan ester.
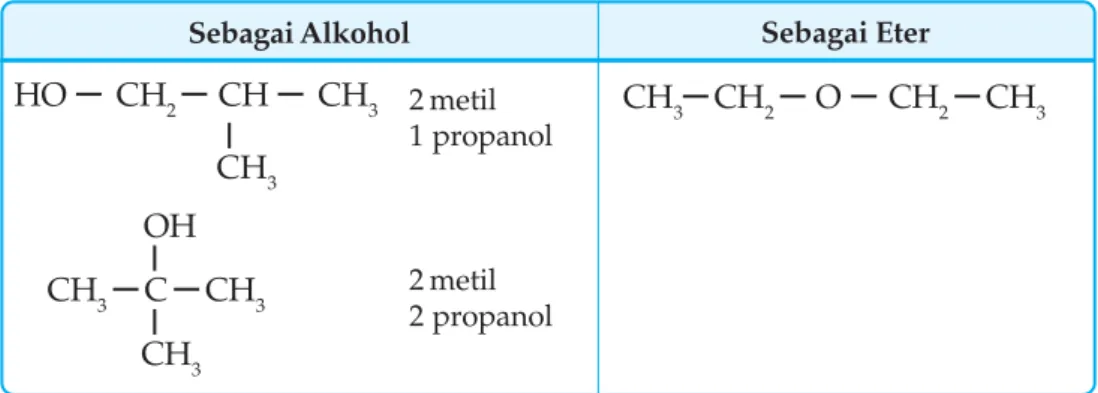
Asam karboksilat kadar rendah berbentuk cairan encer, kadar tinggi berbentuk cairan agak kental, dan asam karboksilat kadar tinggi berbentuk padatan. Berdasarkan gugus fungsinya, senyawa karbon dibedakan menjadi beberapa golongan antara lain alkohol (R OH), eter (RO R), aldehida ( ), keton ( ), asam karboksilat. Asam karboksilat dapat dibuat dengan oksidasi alkohol primer atau dengan mereaksikan gas CO2 dengan pereaksi Grignard.
Sifat-sifat Benzena
Pembuatan Benzena
Kegunaan Benzena
Turunan Benzena
Tata Nama Turunan Benzena
Pembuatan dan Kegunaan Beberapa Turunan Benzena yang Penting . 199
Penggolongan Polimer
Beberapa polimer dan kegunanaannya
Protein
Lemak dan Minyak