Penulis mengucapkan puji dan syukur kehadirat Tuhan Yang Maha Esa atas segala karunia dan rahmat-Nya sehingga penulis dapat menyelesaikan Modul Praktikum Kimia Dasar revisi ini. Segala puji bagi Allah SWT, Yang mengajari (manusia) dengan pena, yang mengajarkan segala sesuatu yang tidak mereka ketahui. Modul Praktikum Kimia Dasar ini merupakan buku ajar bagi mahasiswa D-3 dan D-4 yang menjalani Praktikum Kimia Dasar di Laboratorium Kimia Politeknik Negeri Malang Jurusan Teknik Kimia, serta mata kuliah lain yang relevan.
Jadi kritik dan saran dari para pembaca sangat kami harapkan dan kami sangat terbuka agar modul ini menjadi lebih sempurna dan lengkap. Oleh karena itu, kami berharap Buku Pedoman Praktik ini dapat membantu mahasiswa untuk melaksanakan praktik dengan baik, sehingga tercapai kompetensinya dan memberikan manfaat bagi semua pihak yang memerlukannya.
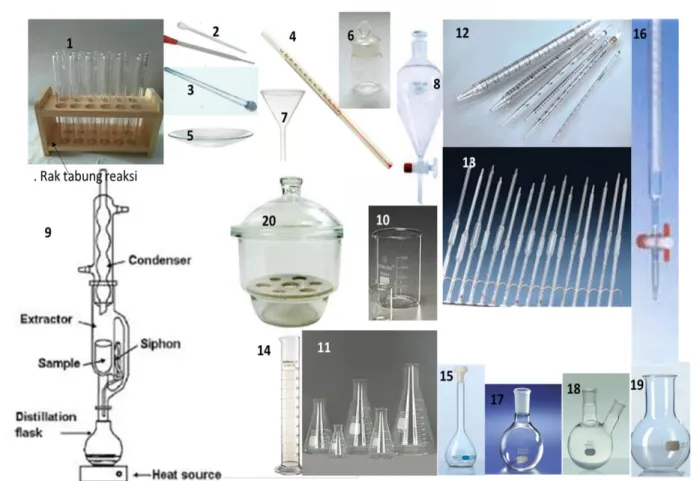
PERALATAN PENDUKUNG LABORATORIUM KIMIA DASAR
- Kompetensi
- Klasifikasi alat-alat Laboratorium Kimia
- Form Penilaian Uji Kompetensi
- Tugas Pendahuluan
Medan dan alu merupakan alat tumbukan yang terbuat dari porselen tebal untuk menghancurkan zat kimia padat. Corong Buchner adalah corong porselen dengan septum berlubang untuk menampung kertas saring yang digunakan untuk filtrasi pompa vakum. Pembakar bunsen adalah sebuah tabung logam yang dilengkapi dengan pengatur gas dan udara yang digunakan untuk membakar dengan nyala api bunsen.
Selain alat-alat sederhana di atas, laboratorium juga harus mempunyai alat-alat berupa rangkaian elektronik, rangkaian listrik, dan peralatan tetap. Timbangan analitik, merupakan alat elektronik yang digunakan untuk menimbang bahan kimia dengan ketelitian penimbangan yang tinggi, empat digit hingga koma desimal. Digunakan untuk menyimpan larutan pekat dan untuk melakukan reaksi kimia yang menghasilkan gas berbahaya.
PEMBUATAN LARUTAN
- Kompetensi
- Dasar Teori
- Peralatan dan Bahan Percobaan
- Tugas Pendahuluan
- Form Penilaian Uji Kompetensi
- Perhitungan dan Pembahasan
Jika zat terlarut berbentuk padat dan hanya dapat diambil dalam jumlah dengan satuan massa (gram), untuk mengambil sejumlah mol tertentu, Anda perlu mengetahui berat molekul/massa molekul relatif (Mr) zat tersebut dan derajat kemurniannya. Jika zat terlarut berbentuk larutan pekat, harus diketahui data yang secara langsung atau tidak langsung dapat menunjukkan kadar zat terlarut dalam larutan pekat tersebut. Jadi HCl pekat yang akan dijadikan larutan dapat diperoleh dengan cara ditimbang atau dengan menggunakan alat volumetrik.
Jika larutan dibuat dengan larutan induk yang diketahui konsentrasinya, dapat dilakukan dengan cara pengenceran dengan rumus 𝑀0× 𝑉0= 𝑀1× 𝑉1. Masukkan larutan dengan benar ke dalam labu ukur (teknik yang benar dan tepat pada tanda skala). Hitung konsentrasi larutan yang anda buat (berdasarkan data penimbangan bahan/volume larutan pekat yang dipipet dan volume larutan yang anda buat).
KELARUTAN GARAM-GARAM ALKALI-TANAH
- Kompetensi
- Dasar Teori
- Perincian Kerja Percobaan
- Peralatan dan Bahan Percobaan
- Prosedur Kerja Percobaan
- Tugas Pendahuluan
- Data Pengamatan
- Perhitungan dan Pembahasan
Artinya Qsp diberikan untuk larutan tak jenuh (sebelum jenuh), jenuh atau lewat jenuh. Masukkan 2 ml masing-masing larutan garam yang mengandung kation Ba2+, Sr2+, Ca2+ dan Mg2+ ke dalam tabung reaksi secara terpisah. Masukkan semua tabung ke dalam centrifuge dengan kecepatan 2000 rpm, atau dalam penangas air selama 10 menit.
Ulangi langkah (a) kemudian tambahkan 2 ml larutan Na2CO3 1 M ke setiap tabung reaksi sebagai pereaksi pengendapan. Ulangi langkah (a) lalu tambahkan 2 ml larutan 0,25 M (NH4)2C2O4 sebagai reagen ke dalam setiap tabung reaksi. Ulangi langkah (a) kemudian tambahkan 2 ml larutan K2CrO41.0 M sebagai pereaksi pengendapan ke dalam setiap tabung reaksi.
Tambahkan 2 mL larutan CH3COOH 1 M ke dalam setiap tabung reaksi, amati dan catat hasilnya dalam tabel. Buatlah barisan kelarutan garam alkali tanah dari pengamatan Anda dan bandingkan apakah barisan ini sesuai dengan tabel periodik. Jelaskan alasan ada/tidaknya pengendapan produk reaksi ditinjau dari nilai Qsp dan Ksp garam-garam tersebut.
REAKSI-REAKSI KIMIA DAN PEMBUATAN UNSUR DAN
- Kompetensi
- Dasar Teori
- Peralatan dan Bahan Percobaan
- Prosedur Kerja Percobaan
- Tugas Pendahuluan
- Data Pengamatan
- Pembahasan
Unsur-unsur dalam tabel periodik panjang dibagi menjadi tiga golongan besar, yaitu unsur logam, nonlogam, dan unsur transisi (antara logam dan nonlogam). Unsur-unsur logam, jika digabungkan satu sama lain, membentuk molekul atau senyawa logam yang berbeda. Unsur-unsur yang bersama-sama mempunyai berat molekul tinggi, mempunyai ikatan hidrogen, atau mempunyai struktur makromolekul dapat berada dalam fasa cair, seperti H2O (cair), Br2 (cair), bahkan ada pula yang mempunyai fasa padat, seperti I2 (padat). ), S2 (padat) dan C (grafit) (padat).
Lakukan pengamatan segera setelah logam Mg ditambahkan ke dalam larutan CuSO4 dan setelah reaksi berlangsung 5 menit. Lakukan pengamatan segera setelah logam Cu ditambahkan ke dalam larutan AgNO3 dan setelah reaksi berlangsung 5 menit. Siapkan dua tabung reaksi, masukkan 2 mL larutan kalium kromat (K2CrO4) 0,1 M ke dalam kedua tabung reaksi.
Siapkan dua buah tabung reaksi, tuang 2 mL larutan kalium dikromat (K2Cr2O7) 0,1 M ke dalam kedua tabung reaksi, Amati dan bandingkan hasil reaksi yang berlangsung pada tabung reaksi I dan II. Setelah beberapa menit amati warna uap Br2 diatas cairan - Ambil tabung reaksi.
Ambil cairan yang mengandung Br2 (±2 ml cairan hijau), masukkan ke dalam tabung reaksi lain dan tambahkan 3 ml TCE. Catat semua pengamatan. Gantilah larutan NaBr 1 M dengan larutan KI 1 M saja. Catat semua yang diamati seperti pada pengamatan Br2 C. Masukkan 5 ml larutan Na2SO3 1 M ke dalam tabung reaksi. Amati apa yang terjadi dan uji bau dan sifat asam gas SO2. dengan lakmus), warna dan rasa terbakar (dengan obat nyamuk).
Amati apa yang terjadi dan uji sifat gas untuk mengetahui bau dan keasamannya. menggunakan lakmus), warna dan spirit (menggunakan obat nyamuk).
TITRASI ASAM DAN BASA MONOPROTIK DAN BIPROTIK
- Kompetensi
- Dasar Teori
- Perincian Kerja Percobaan
- Peralatan dan Bahan Percobaan
- Prosedur Kerja Percobaan
- Tugas Pendahuluan
- Data Pengamatan
- Form Penilaian Uji Kompetensi
- Perhitungan dan Pembahasan
Caranya zat tersebut bereaksi dengan larutan standar dalam jumlah berlebih, dan kelebihan larutan standar tersebut dititrasi dengan larutan standar lain. CaCO3 memiliki kelarutan yang relatif rendah dalam air, pada suhu 20oC sebesar 1,4 x 10-3%, oleh karena itu CaCO3 terlebih dahulu direaksikan dengan larutan standar HCl berlebih dengan reaksi sebagai berikut. Melakukan titrasi untuk menentukan konsentrasi larutan asam dan basa menggunakan titrasi NaOH dan HCl.
Timbang 1,9069 gram Boraks lalu masukkan ke dalam gelas kimia lalu tambahkan ± 20 mL air panas dan masukkan ke dalam labu takar 100 mL sampai tanda batas. Titrasi larutan dengan larutan standar HCl (HCl yang digunakan adalah larutan HCl yang telah distandarisasi di atas) dari warna merah hingga tidak berwarna. Lakukan titrasi blanko dengan mengambil 25 ml alkohol pelarut dan menambahkan 3 tetes indikator pp kemudian dititrasi dengan NaOH dari tidak berwarna hingga berwarna merah muda.
Titrasi larutan dengan larutan standar NaOH yang telah distandardisasi di atas dari tidak berwarna menjadi merah muda. Bilas buret bersih dengan larutan standar yang akan digunakan sebanyak 3 kali dengan penambahan 5 ml. Titrasi secara perlahan dengan larutan standar HCl dengan indikator fenol ftalat hingga terjadi perubahan warna dari merah jambu menjadi hampir tidak berwarna.
Titrasi secara perlahan dengan asam HCl standar menggunakan indikator Meyl orange atau bromophenol blue sampai warna larutan berubah dari kuning menjadi oranye samar. Tuliskan pengertian titrasi asam basa, titran, indikator titrasi, standar primer, standar sekunder, standarisasi, titik ekuivalen, dan titik akhir titrasi. Lakukan titrasi dengan teknik yang benar Hentikan titrasi pada titik akhir titrasi secara akurat, cermat dan tepat pada setiap pengulangan titrasi.
TITRASI REDUKSI-OKSIDASI
- Kompetensi
- Dasar Teori
- Perincian Kerja Percobaan
- Peralatan dan Bahan Percobaan
- Prosedur Kerja Percobaan
- Tugas Pendahuluan
- Form Penilaian Uji Kompetensi
- Data Pengamatan dan Perhitungan
- Pembahasan
Peralatan Percobaan Bahan Percobaan 1 Labu ukur 100 mL Kalium permanganat (KmnO4) 2 Erlenmeyer 250 mL Natrium oksalat (Na2C2O4). Titrasi dengan larutan kalium permanganat yang telah disiapkan hingga volume titran ± 36 mL (penambahan tidak perlu 36 tergantung konsentrasi KMnO4. Timbang ~2,0 gram sampel (Fe2+), larutkan dengan 10 mL air demineralisasi dan tambahkan Tambahkan 2 tetes H2SO4 pekat, kemudian encerkan hingga volume 100 ml dalam labu takar.
Setelah menuliskan reaksi yang terjadi pada penentuan kandungan besi dan melakukan pengamatan, buktikan bahwa reaksi tersebut merupakan reaksi reduksi-oksidasi menurut teori.
TITRASI KOMPLEKSOMETRI
- Kompetensi
- Dasar Teori
- Perincian Kerja Percobaan
- Peralatan dan Bahan Percobaan
- Prosedur Kerja Percobaan
- Tugas Pendahuluan
- Form Uji Kompetensi
- Data Pengamatan
- Perhitungan dan Pembahasan
Larutkan campuran dengan air suling dalam gelas kimia, kemudian pindahkan ke dalam labu takar 1000 ml dan encerkan sampai tanda batas. Timbang 0,08 gram standar primer CaCO3 yang telah dikeringkan pada suhu 100 °C dan pindahkan ke dalam gelas kimia 100 ml. Aduk 20 mL air suling hingga larut, kemudian tambahkan larutan HCl (1:1) tetes demi tetes hingga larutan jernih.
Hitung setiap konsentrasi standar primer dan hitung kesadahan sampel buatan, kemudian diskusikan perbandingan kekerasan sampel percobaan dan persyaratan kesadahan air baku mutu air (apakah air tersebut layak untuk air minum/irigasi/air pertanian) /adalah apakah termasuk dalam kategori Air Limbah? ).
GRAVIMETRI (PENENTUAN NIKEL DAN SULFAT)
- Tujuan
- Dasar Teori
- Perincian Kerja Percobaan
- Peralatan dan Bahan Percobaan
- Prosedur Kerja Percobaan
- Tugas Pendahuluan
- Data Pengamatan
- Data Pengamatan Penentuan Nikel
- Data Pengamatan Penentuan Sulfat
Rebus larutan campuran dan tambahkan setetes demi setetes larutan BaCl2 5% sambil diaduk hingga terbentuk endapan putih BaSO4. Diamkan campuran selama beberapa menit dan uji supernatannya dengan menambahkan 5% BaCl2 setetes demi setetes untuk mengetahui apakah sedimentasi sudah sempurna. Tempatkan endapan pada kertas saring sambil menyemprotkan air panas dari botol semprot untuk membantu memindahkannya.
Timbang dengan hati-hati 0,3 g nikel sulfat NiSO4.6H2O ke dalam gelas kimia 400 mL yang dilengkapi dengan sumbat kaca arloji besar dan pengaduk. Segera tambahkan larutan amonia encer setetes demi setetes langsung ke dalam larutan (jangan melalui dinding gelas kimia) sambil terus diaduk hingga terjadi pengendapan. Saring larutan/endapan menggunakan krus Gooch (pengkilap kaca yang sebelumnya dipanaskan hingga suhu 110-120oC dan ditimbang setelah didinginkan dalam desikator).
Pada tahun 1982, beliau lulus dari Jurusan Pendidikan Kimia, Fakultas Keguruan dan Ilmu Eksakta, IKIP Malang dan mendapat gelar Doktor (Drs). Pada tahun 2004 mengikuti kursus dan pelatihan korosi di Ikatan Korosi Indonesia (Indocor) Bandung dan memperoleh Sertifikat Kompetensi Ahli Korosi Muda. Pada tahun 2006 mengikuti kursus dan pelatihan ahli proteksi katodik korosi dan memperoleh sertifikat Kompetensi Ahli Proteksi Katodik Level 1.
Saat ini penulis mengajar mata kuliah kimia dasar, praktikum kimia dasar, kimia organik, praktikum kimia organik, pengetahuan teknik material dan korosi. Telah menulis buku ajar Analisis Instrumental untuk mahasiswa semester 2 Jurusan Teknik Kimia Politeknik Negeri Malang. Lulus dari Jurusan Kimia, Fakultas Matematika dan Sains, Institut Teknologi Bandung dan mendapat gelar Sarjana Sains (S.Si) pada tahun 2006.
Mata kuliah yang pernah diajarkan di AKARAFMA antara lain: Kimia Analitik, Kimia Organik, K3 (Lingkungan dan Keselamatan Kerja), Kimia Farmasi, Analisa Makanan dan Minuman, Teknik Pemisahan, Teknik Analisa Fisika dan Elektrokimia, Farmakognosi, Fitokimia dan mata kuliah lain yang telah ada. yang diajarkan i. yang diajarkan di POLINEMA meliputi: Kimia Dasar, Kimia Dasar dan Bioproses, magang dan keahlian Minat II (makanan dan minuman).

