ABSTRACT
THE EFFECT OF ADMINISTRATING ETHANOL EXTRACT 40% OF MANGOSTEEN PEEL (Garcinia Mangostana L.) TOWARDS A LIVER HISTOPATHOLOGY AND THE MALE STRAIN Sprague Dawley OF THE
KIDNEY OF WHITE RATS (Rattus Norvegicus) THAT ARE INDUCTED BY ISONIAZID
By
FAKHMIYOGI
Isoniazid is one of tuberculosis drugs which inducts kidney and liver malfunction. Mangosteen peel has the pharmacology activities such as anti-inflammatory, antihistamine, the treatment of heart disease, anti bacterial, and anti-fungal. Xanthone compound in mangosteen peel is considered to be able to influence the liver and kidney damage which are impacted by using isoniazid. The objective of this research is to find out the effect of administrating ethanol extract 40% of mangosteen peel (Garcinia mangostana L.) towards a liver histopathology and the male strain Sprague Dawley of the kidney of white rats that are inducted by isoniazid.
In this research, 25 male rats were divided in each five group randomly and they were given treatment for 14 days. K1 was given aquadest, K2 was given isoniazid 30 mg/100gBB), K3 was given mangosteen peel extract 20 mg/100grBB and isoniazid 30 mg/100gBB, K4 was given mangosteen peel extract 40 mg/100gBB and isoniazid 30 mg/100gBB, K5 was given mangosteen peel extract 80 mg/100gBB and isoniazid 30 mg/100gBB.
The result of this research showed that the average of number of the swelling hepatocyte cells in K1: 3±4,472; K2: 96±4,183; K3: 61±4,183; K4: 42±7,582; dan K5: 16±5,477 and the average of number of the renal tubules damage in K1: 2,50±2,50; K2: 92,5±1,76; K3: 66,5±3,79; K4: 39±3,35; dan K5: 8±2,09. The conclusion of this research showed that ethanol extract 40% of mangosteen peel with dose are 20 mg/100gBB, 40 mg/100gBB, and 80 mg/100gBB have the effect towards a liver histopathology and rats kidney that are inducted by isoniazid.
ABSTRAK
PENGARUH PEMBERIAN EKSTRAK ETANOL 40% KULIT MANGGIS (Garcinia Mangostana L.) TERHADAP GAMBARAN HISTOPATOLOGI HEPAR DAN GINJAL TIKUS PUTIH (Rattus norvegicus) JANTAN GALUR Sprague Dawley YANG
DIINDUKSI ISONIAZID
Oleh
FAKHMIYOGI
Isoniazid merupakan salah satu obat tuberkulosis yang menginduksi kerusakan hepar dan ginjal. Kulit manggis mempunyai aktifitas farmakologi seperti antiinflamasi, antihistamin, pengobatan penyakit jantung, antibakteri, dan antijamur. Senyawa xanton dalam kulit manggis dianggap mampu mempengaruhi kerusakan hepar dan ginjal akibat penggunaan isoniazid. Tujuan penelitian ini untuk mengetahui pengaruh pemberian ekstrak etanol 40% kulit manggis (Garcinia mangostana L.) terhadap gambaran histopatologi hepar dan ginjal tikus putih (Rattus norvegicus) Jantan galur Sprague Dawley yang diinduksi isoniazid.
Pada penelitian ini, 25 tikus jantan dibagi dalam 5 kelompok secara acak dan diberi perlakuan selama 14 hari. K1 yang diberi aquadest, K2 yang diberi isoniazid 30mg/100gBB), K3 yang diberi ekstrak kulit manggis 20mg/100grBB dan isoniazid 30mg/100gBB, K4 yang diberi ekstrak kulit manggis 40mg/100gBB dan isoniazid 30mg/100gBB, dan K5 yang diberi ekstrak kulit manggis 80mg/100gBB dan isoniazid 30mg/100gBB.
Hasil penelitian menunjukkan bahwa rerata jumlah pembengkakan sel hepatosit pada K1: 3±4,472; K2: 96±4,183; K3: 61±4,183; K4: 42±7,582; dan K5: 16±5,477 dan rerata jumlah kerusakan tubulus ginjal pada K1: 2,50±2,50; K2: 92,5±1,76; K3: 66,5±3,79; K4: 39±3,35; dan K5: 8±2,09. Kesimpulan dari penelitian ini adalah bahwa ekstrak etanol 40% kulit manggis dosis 20 mg/100gBB, 40 mg/100gBB, dan 80 mg/100gBB berpengaruh terhadap gambaran histopatologi hepar dan ginjal tikus yang diinduksi isoniazid.
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka teori ... 8
2. Kerangka konsep ... 9
3. Gambaran makroskopik hati manusia dari anterior ... 13
4. Lobulus hepatik ... 15
5. Gambaran mikroskopik dengan perbesaran 30x hati manusia ... 16
6. Pembengkakan sel disertai vakuolisasi ... 17
7. Anatomi ginjal manusia ... 21
8. Histologi ginjal normal manusia ... 22
9. Penampang histologi normal ginjal ... 24
10.Ginjal manusia ... 26
11.Potongan melintang ginjal tikus yang mengalami kerusakan ... 28
12.Edema glomerulus pada ginjal tikus yang dikelilingi oleh tubulus yang mengalami degenerasi hidropis ... 28
13.Struktur isoniazid ... 31
14.Garcinia mangostana L. ... 36
viii
16.Histopatologi hepar tikus kelompok kontrol normal ... 60
17.Histopatologi hepar tikus kelompok kontrol positif ... 61
18.Histopatologi hepar tikus kelompok III ... 62
19.Histopatologi hepar tikus kelompok IV ... 63
20.Histopatologi hepar tikus kelompok V ... 64
21.Grafik perbandingan persentasi hepatosit yang mengalami degenerasi bengkak keruh ... 67
22.Histopatologi ginjal tikus kelompok kontrol normal ... 72
23.Histopatologi ginjal tikus kelompok kontrol positif ... 73
24.Histopatologi ginjal tikus kelompok III ... 74
25.Histopatologi ginjal tikus kelompok IV ... 75
26.Histopatologi ginjal tikus kelompok V ... 76
27.Grafik perbandingan persentasi sel nekrosis tubulus ... 80
DAFTAR LAMPIRAN
1. Lampiran 1. Foto-foto Gambaran Histopatologi Hepar Tikus
2. Lampiran 2. Foto-foto Gambaran Histopatologi Ginjal Tikus
3. Lampiran 3. Foto-foto Penelitian
4. Lampiran 4. Hasil Analisis Statistik Histopatologi Hepar Tikus
5. Lampiran 5. Hasil Analisis Statistik Histopatologi Ginjal Tikus
BAB I PENDAHULUAN
1.1Latar Belakang
Tuberkulosis adalah infeksi bakteri melalui udara yang disebabkan oleh
mikroorganisme Mycobacterium tuberculosis yang terutama menyerang paru,
meskipun organ dan jaringan-jaringan lain mungkin dapat terlibat. Sekitar 2,2
miliar orang, atau sepertiga dari populasi dunia, terinfeksi bakteri tuberkulosis
dimana kebanyakan dari penderita adalah tuberkulosis laten, yang berarti dalam
tubuh mereka terdapat kuman tuberkulosis, tetapi sistem kekebalan tubuh mereka
dapat melindungi mereka untuk tidak menjadi sakit. Bagaimanapun, lebih dari
9,2 juta orang mengidap penyakit tuberkulosis aktif (American Lung
Association, 2010).
Prevalensi tuberkulosis di Indonesia sangat tinggi. Dalam Global Tuberculosis
Report WHO 2013, Indonesia menduduki peringkat kesembilan dengan insidensi
185 kasus per 100 ribu penduduk dan peringkat ketiga dalam regional
asia-tenggara dengan angka kasus kejadian mencapai 82.799 kasus baru pada tahun
Indonesia, meningkat dari sebelumnya yang hanya berjumlah 71.454 kasus
(WHO, 2013).
Regimen pengobatan untuk Tuberkulosis Nasional yang direkomendasikan,
yakni: Isoniazid (INH), Rifampisin (R), Etambutol (E), pirazinamid (P) dan
Streptomisin (S) (Kishore dkk, 2010). Efek samping yang mungkin timbul adalah
hepatotoksik. Obat anti tuberkulosis yang dapat menyebabkan hepatotoksik salah
satunya adalah isoniazid. Rifampisin sebagai obat utama tuberkulosis
mempunyai efek hepatotoksik yang paling rendah bila dibandingkan dengan
isoniazid (Sherlock & Dooley, 2011). Pengobatan TB membutuhkan waktu
panjang sekitar 6 sampai 8 bulan untuk mencapai penyembuhan dengan
kombinasi beberapa macam obat (Bagiada & Primasari, 2010).
Isoniazid adalah obat yang sangat efektif untuk pengobatan tuberkulosis (TB)
dibandingkan dengan obat antituberkulosis yang lainnya secara eksperimen pada
hewan percobaan. Akan tetapi, efek samping yang ditimbulkan dari obat
Isoniazid cukup banyak seperti neurotoksisitas pusat dan perifer serta
hepatotoksisitas yang ditandai dengan uji fungsi hati yang abnormal, peningkatan
kadar bilirubin dan nekrosis multilobular (Katzung, 2008). Toksisitas ginjal
isoniazid telah dilaporkan secara sporadis dan histologi nefrotoksisitas dari
isoniazid dikaitkan dengan nefritis akut tubulointerstitial (ATIN), tubular
nekrosis, nekrosis papiler, nekrosis kortikal akut, dan penyakit perubahan
3
WHO merekomendasi penggunaan obat tradisional termasuk herbal dalam
pemeliharaan kesehatan masyarakat, pencegahan dan pengobatan penyakit,
terutama untuk penyakit kronis, penyakit degeneratif dan kanker. WHO juga
mendukung upaya-upaya dalam peningkatan keamanan dan khasiat dari obat
tradisional (WHO, 2008).
Salah satu manfaat dari kulit buah manggis adalah sebagai antioksidan. Jung et
al. (2006) dalam penelitiannya mengenai senyawa antioksidan kulit manggis
pada tikus yang diinduksi DMBA (7,12-dimethylbenz[α]anthracene) didapatkan
bahwa dari berbagai senyawa xanthone yang terisolasi, mayoritas secara aktif
menginhibisi adalah α-mangostin dan γ-mangostin. Dan dalam Chen et al.
(2008), menunjukkan bahwa senyawa α-mangostin dan γ-mangostin juga
mempuyai potensi sebagai antiinflamasi. Selain xanthone, antosianin pada kulit
manggis juga merupakan senyawa yang potensial memiliki aktivitas antioksidan
(Supiyanti dkk., 2010).
Berdasarkan hal diatas, peneliti tertarik untuk mengetahui pengaruh pemberian
ekstrak etanol 40% kulit manggis (Garcinia mangostana L.) yang diindikasi
memiliki efek antioksidan dan antinflamasi terhadap gambaran histopatologis
hepar dan ginjal tikus putih (Rattus norvegicus) jantan galur Sprague Dawley
1.2Perumusan Masalah
Tuberkulosis (TB) merupakan masalah penting bagi kesehatan karena merupakan
salah satu penyebab utama kematian. Ada sekitar sepertiga penduduk dunia telah
terinfeksi oleh Mycobacterium tuberculosis dan 98% diantaranya mengalami
kematian. Pengobatan untuk mengatasi tuberkulosis dirasa belum memuaskan
karena memiliki efek samping yang tidak baik bagi kesehatan. Oleh karena itu
diperlukan suatu hepatoprotektor dan nefroprotektor yang dapat diberikan
sebagai obat pendamping. Dari uraian singkat tersebut dapat dirumuskan :
1. Apakah ada pengaruh pemberian ekstrak etanol 40% kulit manggis (Garcinia
mangostana L.) terhadap gambaran histopatologi hepar dan ginjal tikus putih
(Rattus norvegicus) jantan galur Sprague Dawley yang diinduksi isoniazid ?
2. Apakah ada pengaruh pemberian peningkatan dosis ekstrak etanol 40% kulit
manggis (Garcinia mangostana L.) 20 mg, 40 mg, dan 80 mg terhadap
gambaran histopatologi hepar dan ginjal tikus putih (Rattus norvegicus)
jantan galur Sprague Dawley yang diinduksi isoniazid ?
1.3Tujuan Penelitian
1. Tujuan Umum
Mengetahui adanya pengaruh pemberian ekstrak etanol 40% kulit manggis
(Garcinia mangostana L.) terhadap gambaran histopatologi hepar dan ginjal
tikus (Rattus norvegicus) jantan galur Sprague Dawley yang diinduksi
5
2. Tujuan Khusus
Mengetahui adanya pengaruh pemberian peningkatan dosis ekstrak etanol
40% kulit manggis (Garcinia mangostana L) 20 mg, 40 mg, dan 80 mg
terhadap gambaran histopatologi hepar dan ginjal tikus (Rattus norvegicus)
jantan galur Sprague Dawley yang diinduksi isoniazid.
1.4Manfaat Penelitian
a. Bagi Ilmu Pengetahuan
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai
efek ekstrak kulit mangggis terhadap hepar dan ginjal yang diinduksi oleh
Isoniazid.
b. Bagi Peneliti
Penelitian ini sebagai wujud pengaplikasian disiplin ilmu yang telah dipelajari
sehingga dapat mengembangkan wawasan keilmuan peneliti.
c. Bagi Pembangunan
Hasil penelitian ini diharapkan dapat menjadi acuan yang akan mendukung
upaya pemeliharaan tanaman buah manggis (Garcinia mangostana L.)
sebagai salah satu tanaman berkhasiat obat. Dengan demikian akan
mendukung upaya pemerintah untuk menyukseskan program tanaman obat
d. Bagi Fakultas Kedokteran Universitas Lampung (FK Unila)
Meningkatkan penelitian dibidang agromedicine sehingga dapat menunjang
pencapaian visi FK Unila sebagai Fakultas Kedokteran Sepuluh Terbaik di
Indonesia pada Tahun 2025 dengan Kekhususan agromedicine.
e. Bagi Peneliti Lain
Dapat dijadikan bahan acuan untuk dilakukannya penelitian yang serupa yang
berkaitan dengan efek kulit buah manggis (Garcinia mangostana L.)
1.5 Kerangka Penelitian
1.5.1Kerangka Teori
Isoniazid adalah obat yang sangat efektif untuk pengobatan tuberkulosis
(TB) dibandingkan dengan obat antituberkulosis yang lainnya secara
eksperimen pada hewan percobaan. Akan tetapi, efek samping yang
ditimbulkan dari obat Isoniazid cukup banyak seperti neurotoksisitas pusat
dan perifer serta hepatotoksisitas yang ditandai dengan uji fungsi hati yang
abnormal, peningkatan kadar bilirubin dan nekrosis multilobular (Katzung,
2008).
Toksisitas ginjal isoniazid telah dilaporkan secara sporadis dan histologi
nefrotoksisitas dari isoniazid dikaitkan dengan nefritis akut
tubulointerstitial (ATIN), tubular nekrosis, nekrosis papiler, nekrosis
7
Kandungan kimia kulit buah manggis antara lain derivat xanton yaitu mangostin, gartanin, α-mangostin, γ-mangostin, garsimangoson B, garsinon
D, garsinon E, mangostinon, kudraxanton G, garsimangoson A,
1.6 Hipotesis
1. Ada pengaruh pemberian ekstrak etanol 40% kulit manggis (Garcinia
mangostana L.) terhadap gambaran histopatologi hepar dan ginjal tikus putih
(Rattus norvegicus) jantan galur Sprague Dawley yang diinduksi isoniazid.
2. Ada pengaruh pemberian peningkatan dosis ekstrak etanol 40% kulit manggis
(Garcinia mangostana L.) 20 mg, 40 mg, dan 80 mg terhadap gambaran
histopatologi hepar dan ginjal tikus putih (Rattus norvegicus) jantan galur
BAB II
TINJAUAN PUSTAKA
2.1Hati
2.1.1Anatomi Hati
Hati merupakan kelenjar terbesar dalam tubuh manusia dengan berat
kurang lebih 1,5 kg (Junqueira dkk., 2007). Hati adalah organ viseral
terbesar dan terletak di bawah kerangka iga (Sloane, 2004).
Hepar bertekstur lunak, lentur, dan terletak di bagian atas cavitas
abdominalis tepat di bawah diaphragma. Sebagian besar hepar terletak di
profunda arcus costalis dextra dan hemidiaphragma dextra memisahkan
hepar dari pleura, pulmo, pericardium, dan cor. Hepar terbentang ke
sebelah kiri untuk mencapai hemidiaphragma sinistra (Snell, 2006).
Hepar tersusun atas lobuli hepatis. Vena centralis pada masing-masing
lobulus bermuara ke venae hepaticae. Dalam ruangan antara
lobulus-lobulus terdapat canalis hepatis yang berisi cabang-cabang arteria
hepatis). Darah arteria dan vena berjalan di antara sel-sel hepar melalui
sinusoid dan dialirkan ke vena centralis (Sloane, 2004).
2.1.2Fisiologi Hati
Menurut Guyton & Hall (2008), hati mempunyai beberapa fungsi yaitu:
a. Metabolisme karbohidrat
Fungsi hati dalam metabolisme karbohidrat adalah menyimpan glikogen
dalam jumlah besar, mengkonversi galaktosa dan fruktosa menjadi glukosa,
glukoneogenesis, dan membentuk banyak senyawa kimia yang penting dari
hasil perantara metabolisme karbohidrat.
b. Metabolisme lemak
Fungsi hati yang berkaitan dengan metabolisme lemak, antara lain:
mengoksidasi asam lemak untuk menyuplai energi bagi fungsi tubuh yang
lain, membentuk sebagian besar kolesterol, fosfolipid dan lipoprotein,
membentuk lemak dari protein dan karbohidrat.
c. Metabolisme protein
Fungsi hati dalam metabolisme protein adalah deaminasi asam amino,
pembentukan ureum untuk mengeluarkan amonia dari cairan tubuh,
pembentukan protein plasma, dan interkonversi beragam asam amino dan
13
d. Lain-lain
Fungsi hati yang lain diantaranya hati merupakan tempat penyimpanan
vitamin, hati sebagai tempat menyimpan besi dalam bentuk feritin, hati
membentuk zat-zat yang digunakan untuk koagulasi darah dalam jumlah
banyak dan hati mengeluarkan atau mengekskresikan obat-obatan, hormon
dan zat lain.
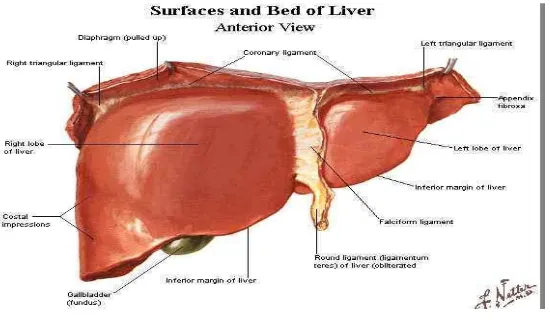
Gambar 3. Gambaran makroskopik hati manusia dari anterior (Putz & Pabst, 2007).
2.1.3Histologi Hati
Sel–sel yang terdapat di hati antara lain: hepatosit, sel endotel, dan sel
makrofag yang disebut sebagai sel kuppfer, dan sel ito (sel penimbun
lemak). Sel hepatosit berderet secara radier dalam lobulus hati dan
membentuk lapisan sebesar 1-2 sel serupa dengan susunan bata. Lempeng
sel ini mengarah dari tepian lobulus ke pusatnya dan beranastomosis secara
lempeng-lempeng ini mengandung kapiler yang disebut sinusoid hati
(Junquiera et al., 2007).
Sinusoid hati adalah saluran yang berliku–liku dan melebar, diameternya
tidak teratur, dilapisi sel endotel bertingkat yang tidak utuh. Sinusoid
dibatasi oleh 3 macam sel, yaitu sel endotel (mayoritas) dengan inti pipih
gelap, sel kupffer yang fagositik dengan inti ovoid, dan sel stelat atau sel
Ito atau liposit hepatik yang berfungsi untuk menyimpan vitamin A dan
memproduksi matriks ekstraseluler serta kolagen. Aliran darah di sinusoid
berasal dari cabang terminal vena portal dan arteri hepatik, membawa
darah kaya nutrisi dari saluran pencernaan dan juga kaya oksigen dari
jantung (Eroschenko, 2010; Junqueira et al., 2007).
Traktus portal terletak di sudut-sudut heksagonal. Pada traktus portal, darah
yang berasal dari vena portal dan arteri hepatik dialirkan ke vena sentralis.
Traktus portal terdiri dari 3 struktur utama yang disebut trias portal.
Struktur yang paling besar adalah venula portal terminal yang dibatasi oleh
sel endotel pipih. Kemudian terdapat arteriola dengan dinding yang tebal
yang merupakan cabang terminal dari arteri hepatik. Dan yang ketiga
adalah duktus biliaris yang mengalirkan empedu. Selain ketiga struktur itu,
15
Gambar 4. Lobulus hepatik (Gartner, 2003).
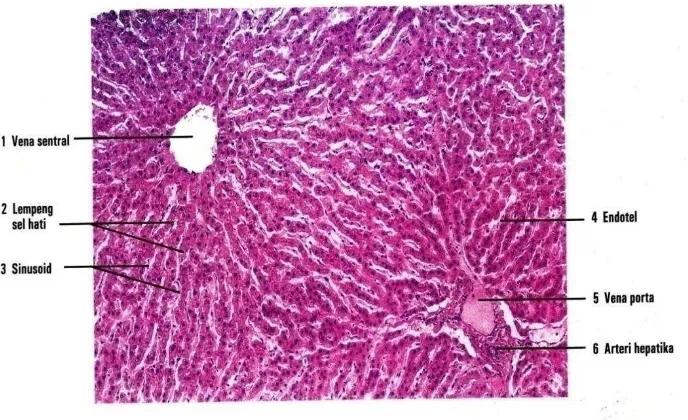
Aliran darah di hati dibagi dalam unit struktural yang disebut asinus
hepatik. Asinus hepatik berbentuk seperti buah berry, terletak di traktus
portal. Asinus ini terletak di antara 2 atau lebih venula hepatic terminal,
dimana darah mengalir dari traktus portalis ke sinusoid, lalu ke venula
tersebut. Asinus ini terbagi menjadi 3 zona, dengan zona 1 terletak paling
dekat dengan traktus portal sehingga paling banyak menerima darah kaya
oksigen, sedangkan zona 3 terletak paling jauh dan hanya menerima sedikit
oksigen. Zona 2 atau zona intermediet berada diantara zona 1 dan 3. Zona 3
Gambar 5. Gambaran mikroskopik dengan perbesaran 30x hati manusia (Eroschenko, 2010).
2.1.4Histopatologi Hati
Jejas sel dalam hati dapat bersifat reversibel atau ireversibel (Chandrasoma
& Taylor, 2005).
1. Jejas reversible
a. Pembengkakan Sel
Pembengkakan merupakan manifestasi pertama yang ada hampir pada
semua bentuk jejas sel, sebagai akibat pergeseran air ekstraseluler ke
dalam sel, akibat gangguan pengaturan ion dan volume karena
17
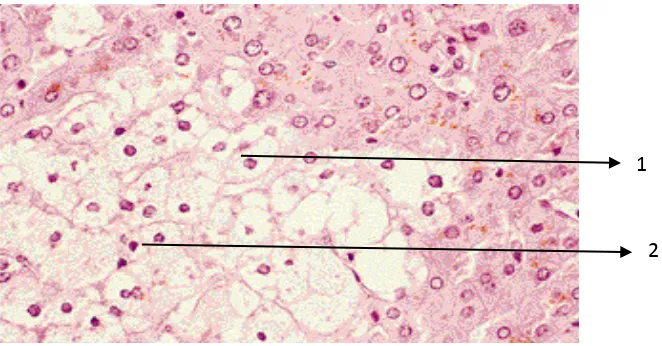
Gambar 6. Pembengkakan sel disertai vakuolisasi; Ket.: 1. Sel yang MengalamiVakuolisasi; 2. Inti Sel Menggeser ke Tepi (Robbins dkk., 2007).
Bila air berlanjut tertimbun dalam sel, vakuol-vakuol kecil jernih
tampak dalam sitoplasma yang diduga merupakan retikulum
endoplasma yang melebar dan menonjol keluar atau segmen
pecahannya. Gambaran jejas nonletal ini kadang-kadang disebut
degenerasi hidropik atau degenerasi vakuol. Selanjutnya hepatosit
yang membengkak juga akan tampak edematosa (degenerasi balon)
dengan sitoplasma ireguler bergumpal dan rongga-rongga jernih yang
lebar (Robbins et al., 2007).
b. Perlemakan Hati
Perlemakan hati merupakan akumulasi trigliserida dalam sel-sel
parenkim hati. Akumulasi timbul pada keadaan berikut:
1. Peningkatan mobilisasi lemak jaringan yang menyebabkan
peningkatan jumlah asam lemak yang sampai ke hati;
1
2. Peningkatan kecepatan konversi dari asam lemak menjadi
trigliserida di dalam hati karena aktivitas enzim yang terlibat
meningkat;
3. Penurunan oksidasi trigliserida menjadi asetil-koA dan penurunan
bahan keton;
4. Penurunan sintesis protein akseptor lipid (Chandrasoma & Taylor,
2005).
2. Jejas Ireversibel
a. Nekrosis
Nekrosis sel dapat terjadi langsung atau dapat mengikuti degenerasi
sel (jejas reversibel). Gambaran mikroskopik dari nekrosis dapat
berupa gambaran piknosis, karioreksis, dan kariolisis. Berdasarkan
lokasinya nekrosis terbagi menjadi tiga yaitu nekrosis fokal,
nekrosis zona, nekrosis submasif. Nekrosis sel hati fokal adalah
nekrosis yang terjadi secara acak pada satu sel atau sekelompok
kecil sel pada seluruh daerah lobulus-lobulus hati. Nekrosis ini
dikenali pada biopsi melalui badan asidofilik (councilman) yang
merupakan sel hati nekrotik dengan inti piknotik atau lisis dan
sitoplasma terkoagulasi berwarna merah muda. Selain itu dapat
dikenali juga pada daerah lisis sel hati yang dikelilingi oleh
kumpulan sel kupffer dan sel radang. Nekrosis zona sel hati adalah
19
lobulus hati, sedangkan nekrosis submasif merupakan nekrosis sel
hati yang meluas melewati batas lobulus, sering menjembatani
daerah portal dengan vena sentralis (bridging necrosis).
(Chandrasoma & Taylor, 2005).
b. Fibrosis
Fibrosis merupakan akumulasi matriks ekstraseluler yang
merupakan respon dari cedera akut atau kronik pada hati. Pada
tahap awal, fibrosis mungkin terbentuk di dalam atau di sekitar
saluran porta atau vena sentralis atau mungkin mengendap langsung
didalam sinusoid. Hal ini merupakan reaksi penyembuhan terhadap
cedera.Cedera pada hepatosit akan mengakibatkan pelepasan
sitokin dan faktor solubel lainnya oleh sel kupffer serta sel tipe
lainnya pada hati. Faktor-faktor ini akan mengaktivasi sel stelat
yang akan mensintesis sejumlah besar komponen matriks
ekstraseluler (Robbins et al., 2007).
c. Sirosis
Berlanjutnya fibrosis dan cedera parenkim menyebabkan hepar
terbagi-bagi menjadi nodus hepatosit yang mengalami regenerasi
dan dikelilingi oleh jaringan parut. Jaringan parut ini disebut sirosis
2.2 Ginjal
2.2.1Anatomi Ginjal
Ginjal terletak di bagian belakang abdomen atas, di belakang peritoneum,
di depan dua iga terakhir, dan tiga otot besar transversus abdominis,
kuadratus llumborum, dan psoas mayor. Ginjal dipertahankan dalam posisi
tersebut oleh bantalan lemak yang tebal. Kelenjar adrenal terletak diatas
kutub masing-masing ginjal. Ginjal terlindung dengan baik dari trauma
langsung-di sebelah posterior dilindungi oleh kosta dan otot-otot yang
meliputi kosta, sedangkan di anterior dilindungi oleh bantalan usus yang
tebal. sedikit lebih rendah daripada ginjal kiri karena besarnya lobus
hepatis dekstra (Price & Wilson, 2006).
Pada orang dewasa, panjang ginjal adalah sekitar 12 cm sampai 13 cm (4,7
hingga 5,1 inci), lebarnya 6 cm (2,4 inci), tebalnya 2,5 cm (1 inci) dan
beratnya sekitar 150 g. Ukurannya tidak berbeda menurut bentuk dan
ukuran tubuh. Perbedaan panjang dari kutub ke kutub kedua ginjal yang
lebih dari 1,5 cm (0,6 inci) atau perubahan bentuk merupakan tanda yang
penting karena sebagian besar manifestasi penyakit ginjal adalah perubahan
struktur (Price &Wilson, 2006).
Secara anatomis ginjal terbagi menjadi 2 bagian korteks dan medula ginjal
(Junquiera et al., 2007). Di dalam korteks terdapat berjuta–juta nefron
21
unit fungsional terkecil dari ginjal yang terdiri atas tubulus kontortus
proksimal, tubulus kontortus distal, dan tubulus koligentes (Purnomo,
2012).
Setiap ginjal memiliki sisi medial cekung, yaitu hilus tempat masuknya
syaraf, masuk dan keluarnya pembuluh darah dan pembuluh limfe, serta
keluarnya ureter dan memiliki permukaan lateral yang cembung (Junquiera
et al., 2007). Sistem pelvikalises ginjal terdiri atas kaliks minor,
infundibulum, kaliks major, dan pielum/pelvis renalis.
Ginjal mendapatkan aliran darah dari arteri renalis yang merupakan cabang
langsung dari aorta abdominalis, sedangkan darah vena dialirkan melalui
vena renalis yang bermuara ke dalam vena kava inferior. Sistem arteri
ginjal adalah end arteries yaitu arteri yang tidak mempunyai anastomosis
dengan cabang–cabang dari arteri lain, sehingga jika terdapat kerusakan
salah satu cabang arteri ini, berakibat timbulnya iskemia/nekrosis pada
Gambar 7. Anatomi ginjal manusia (Moore & Agur, 2002).
2.2.2 Histologi Ginjal
Unit kerja fungsional ginjal disebut sebagi nefron. Dalam setiap ginjal
terdapat sekitar 1 juta nefron yang pada dasarnya mempunyai struktur dan
fungsi yang sama. Dengan demikian, kerja ginjal dapat dianggap sebagai
jumlah total dari fungsi semua nefron tersebut (Price & Wilson, 2006).
Setiap nefron terdiri atas bagian yang melebaryakni korpuskel renalis,
tubulus kontortus proksimal, segmen tipis, dan tebal ansa henle, tubulus
kontortus distal, dan duktus koligentes (Junquiera et al., 2007).
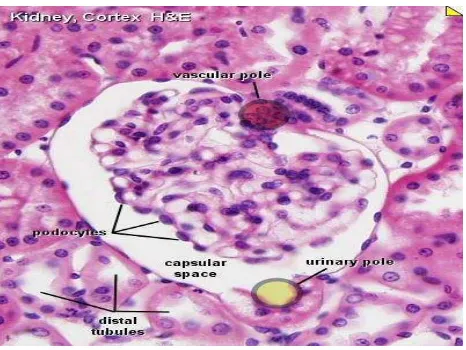
Gambar 8. Histologi ginjal normal manusia (Slomianka, 2009).
1. Tubulus Kontortus Proksimal
Pada kutub urinarius di korpuskel renalis, epitel gepeng di lapisan
parietal kapsula bowman berhubungan langsung dengan epitel tubulus
kontortus proksimal yang berbentuk kuboid atau silindris rendah. Filtrat
23
tubulus kontortus proksimal yang merupakan tempat dimulainya proses
absorbsi dan ekskresi. Selain aktivitas tersebut, tubulus kontortus
proksimal mensekresikan kreatinin dan subsatansi asing bagi
organisme, seperti asam para aminohippurat dan penisilin, dari plasma
interstitial ke dalam filtrat (Junquiera et al., 2007).
2. Tubulus Kontortus Distal
Segmen tebal asenden ansa henle menerobos korteks, setelah menempuh
jarak tertentu, segmen ini menjadi berkelak–kelok dan disebut tubulus
kontortus distal. Sel–sel tubulus kontortus distal memiliki banyak
invaginasi membran basal dan mitokondria terkait yang menunujukkan
fungsi transpor ionnya (Junquiera et al., 2007).
3. Tubulus Duktus Kolingentes
Tubulus koligentes yang lebih kecil dilapisi oleh epitel kuboid. Di
sepanjang perjalanannya, tubulus dan duktus koligentes terdiri atas sel–
sel yang tampak pucat dengan pulasan biasa. Epitel duktus koligentes
responsif terhadap vasopressin arginin atau hormon antidiuretik, yang
disekresi hipofisis posterior. Jika masukan air terbatas, hormon
antidiuretik disekresikan dan epitel duktus koligentes mudah dilalui air
Gambar. 9. Penampang histologi normal ginjal (Eroschenko, 2010).
2.2.3 Fisiologi Ginjal
Menurut Guyton & Hall (2008), ginjal adalah organ utama untuk
membuang produk sisa metabolisme yang tidak diperlukan lagi oleh tubuh.
Produk-produk ini meliputi urea (dari sisa metabolisme asam amino),
kreatin asam urat (dari asam nukleat), produk akhir dari pemecahan
hemoglobin (bilirubin). Ginjal tersusun dari beberapa juta unit fungsional
(nefron) yang akan melakukan ultrafiltrasi terkait dengan ekskresi
(pembentukan urin) dan reabsorpsi. Kerja ginjal dimulai saat dinding
kapiler glomerulus melakukan ultrafiltrasi untuk memisahkan plasma darah
25
Berikut ini adalah fungsi spesifik yang dilakukan oleh ginjal, yang
sebagian besar ditujukkan untuk mempertahankan kestabilan lingkungan
cairan internal:
Fungsi Eksresi:
1. Mempertahankan osmolalitas plasma sekitar 285 mili Osmol
dengan mengubah-ubah ekresi air;
2. Mempertahankan volume ECF dan tekanan darah dengan
mengubah-ubah ekresi natrium;
3. Mempertahankan konsentrasi plasma masing-masing elektrolit
individu dalam rentang normal;
4. Mempertahankan derajat keasaman/pH plasma sekitar 7,4 dengan
mengeluarkan kelebihan hidrogen dan membentuk kembali karbonat;
5. Mengeksresikan produk akhir nitrogen dari metabolisme protein
(terutama urea, asam urat dan kreatinin);
6. Bekerja sebagai jalur eksretori untuk sebagian besar obat (Guyton &
Hall, 2008).
Fungsi non eksresi :
Menyintesis dan mengaktifkan hormon:
a. Renin: penting dalam pengaturan tekanan darah.
b. Eritropoitin: merangsang produksi sel darah merah oleh sumsum
c. 1,25-dihidroksivitamin D3 sebagai hidroksilasi akhir vitamin D3
menjadi bentuk yang paling kuat.
d. Prostaglandin: sebagian besar adalah vasodilator bekerja secara
lokal dan melindungi dari kerusakan iskemik ginjal.
e. Degradasi hormon polipeptida, insulin, glukagon, parathormon,
prolaktin, hormon pertumbuhan, ADH, dan hormon gastrointestinal
(Guyton & Hall, 2008).
Gambar 10. Ginjal manusia (Slomianka, 2009).
2.2.4 Patologi ginjal
Menurut Junquiera (2007), Pada keadaan normal glomerulus tidak dapat
dilalui oleh protein yang bermolekul besar, tetapi pada keadaan patologis
27
menambahkan zat-zat kimiawi seperti yodium, amonia dan hippuric acid.
Pada disfungsi glomerulus, bahan-bahan asing tiba di tubulus dalam kadar
yang abnormal melalui ruang Bowman. Hal ini menyebabkan sel epitel
tubulus mengalami degenerasi bahkan kematian jika terlalu banyak
bahan-bahan yang harus diserap kembali.
Tubulus proksimal memiliki fungsi utama yaitu menyerap kembali
natrium, albumin, glukosa dan air, dan juga bermanfaat dalam penggunaan
kembali bikarbonat. Epitelium tubulus proksimalis merupakan bagian yang
paling sering terserang iskemia atau rusak akibat toksin, karena kerusakan
yang terjadi akibat laju metabolisme yang tinggi (Suyanti, 2008).
Nefrosis merupakan istilah morfologik untuk kelainan ginjal degeneratif
terutama yang mengenai tubulus. Kelainan tubulus dapat menyebabkan
albuminuria dan sedimen abnormal di urin. Secara mikroskopis kelainan
dijumpai pada tubulus kontortus proksimal berupa degenerasi hidropis,
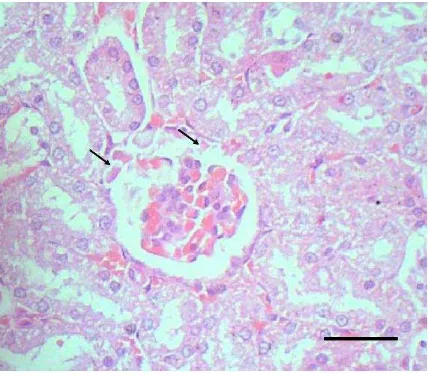
Gambar 11. Potongan melintang ginjal tikus yang mengalami kerusakan (Soeksmanto, 2006).
Gambar 12. Edema glomerulus pada ginjal tikus yang dikelilingi oleh tubulus yang mengalami degenerasi hidropis (Suyanti, 2008).
2.3 Tikus Putih (Rattus norvegicus) Galur Sprague Dawley
Tikus putih (Rattus norvegicus) merupakan hewan pengerat dan sering
digunakan sebagai hewan percobaan atau digunakan untuk penelitian,
29
sehingga kelengkapan organ, kebutuhan nutrisi, metabolisme biokimianya,
sistem reproduksi, pernafasan, peredaran darah dan ekskresi menyerupai
manusia. Tikus yang digunakan dalam penelitian adalah galur Sprague Dawley
berjenis kelamin jantan berumur kurang lebih 3 bulan. Tikus Sprague Dawley
dengan jenis kelamin betina tidak digunakan karena kondisi hormonal yang
sangat berfluktuasi pada saat mulai beranjak dewasa, sehingga dikhawatirkan
akan memberikan respon yang berbeda dan dapat mempengaruhi hasil penelitian
(Kesenja, 2005).
2.3.1. Klasifikasi
Kingdom : Animalia
Filum : Chordata
Kelas : Mamalia
Ordo : Rodentai
Subordo : Odontoceti
Familia : Muridae
Genus : Rattus
Species : Rattus norvegicus (Narendra, 2007).
2.3.2. Jenis
Terdapat beberapa galur atau varietas tikus yang memiliki kekhususan
Tikus galur Sprague Dawley memiliki ciri-ciri albino putih, berkepala
kecil dengan ekor yang lebih panjang daripada badannya. Tikus galur
Wistar memiliki ciri-ciri bentuk kepala lebih besar dengan ekor yang lebih
pendek sedangkan galur Long Evans memiliki ciri badan berukuran lebih
kecil dari tikus putih, berwarna hitam pada bagian kepala dan tubuh
bagian depan. Tikus putih (Rattus norvegicus) galur Sprague Dawley
merupakan tikus yang paling sering digunakan untuk percobaan. Tikus ini
memiliki temperamen yang tenang sehingga mudah dalam penanganan.
Rata-rata ukuran berat badan tikus Sprague Dawley adalah 10.5 gram. Berat badan dewasa adalah 250−300 gram untuk betina, dan 450−520
gram untuk jantan. Tikus ini jarang hidup lebih dari 3 tahun (Putra, 2009).
2.4 Isoniazid (INH)
Isoniazid termasuk obat lini pertama pengobatan TB. Isoniazid saat ini
direkomendasikan untuk mencegah TB pada kelompok pasien human
immunodeficiency virus (HIV) dan anak-anak yang tinggal bersama penderita TB
paru. Bukti-bukti genetik menunjukkan bahwa mutasi gen-gen katG, inhA, ahpC,
oxyR dan kasA merupakan penyebab kekebalan terhadap isoniazid, dengan
persentase mutasi pada gen katG sebesar 60−70%, dan selebihnya pada gen lain
(Purnami et al., 2009).
31
Kerja obat ini adalah dengan menghambat enzim esensial yang penting
untuk sintesis asam mikolat dan dinding sel Mycobacterium tuberculosis.
INH dapat menghambat hampir semua basil tuberkel, dan bersifat
bakterisidal terutama untuk basil tuberkel yang tumbuh aktif. Obat ini
kurang efektif untuk infeksi mikobakteri atipikal meskipun M. kansasii
rentan terhadap obat ini. INH dapat bekerja baik intra maupun ekstraseluler
(Katzung, 2008).
Gambar 13. Struktur isoniazid (Katzung, 2008).
2.4.2. Farmakokinetik
Isoniazid mudah diabsorpsi pada pemberian oral maupun parenteral.
Kadar puncak dicapai dalam waktu 1−2 jam setelah pemberian oral. Di
hepar isoniazid terutama mengalami asetilasi dan pada manusia kecepatan
metabolisme ini dipengaruhi oleh faktor genetik yang secara bermakna
mempengaruhi kadar obat dalam plasma dan masa paruhnya. Asetilator
cepat didapatkan pada orang-orang Eskimo dan Jepang, asetilator lambat
Asetilasi cepat merupakan fenotip yang dominan heterozigot atau
homozigot. Pada pasien yang tergolong asetilator cepat, kadar isoniazid
dalam sirkulasi berkisar antara 30−50% kadar pada pasien dengan
asetilator lambat. Masa paruhnya pada keseluruhan populasi antara 1−4
jam. Masa paruh rata-rata pada asetilator cepat hampir 70 menit, sedangkan nilai 2−5 jam adalah khas untuk asetilator lambat. Masa paruh
obat ini dapat memanjang bila terjadi insufisiensi hepar. Perlu ditekankan
bahwa perbedaan kecepatan asetilasi tidak berpengaruh pada efektivitas
atau toksisitas isoniazid bila obat ini diberikan setiap hari. Bila pasien
tergolong asetilator cepat diberikan isoniazid seminggu sekali maka
penyembuhannya mungkin kurang baik (Setiabudy dkk., 2008).
Isoniazid mudah berdifusi ke dalam sel dan semua cairan tubuh. Obat
terdapat dengan kadar yang cukup dalam cairan pleura dan cairan asites.
Kadar dalam cairan serebrospinal pada radang selaput otak kira-kira sama
dengan kadar dalam cairan plasma. Isoniazid mudah mencapai material
kaseosa. Kadar obat ini mulanya lebih tinggi dalam plasma dan otot
daripada dalam jaringan yang terinfeksi, tetapi kemudian obat tertinggal
lama di jaringan yang terinfeksi dalam jumlah yang lebih dari cukup
sebagai bakteriostatik (Setiabudy dkk., 2008).
Antara 75−95% isoniazid diekskresi melalui urin dalam waktu 24 jam dan
hampir seluruhnya dalam bentuk metabolit. Ekskresi terutama dalam
33
isokotinat acid yang merupakan metabolit proses hidrolisis. Sejumlah
kecil diekskresi dalam bentuk isokotinil glisin dan isokotinil hidrazon, dan
dalam jumlah yang kecil sekali N-metil isoniazid (Setiabudy dkk., 2008).
2.4.3. Efek Samping
Insiden dan berat ringannya efek non terapi INH berkaitan dengan dosis
dan lamanya pemberian. Reaksi alergi obat ini dapat berupa demam, kulit
kemerahan, dan hepatitis. Efek toksik ini meliputi neuritis perifer,
insomnia, lesu, kedut otot, retensi urin, dan bahkan konvulsi, serta episode
psikosis. Kebanyakan efek ini dapat diatasi dengan pemberian piridoksin
yang besarnya sesuai dengan jumlah INH yang diberikan (Katzung, 2008).
Efek samping lain yang dapat ditimbulkan oleh penggunaan isoniazid
adalah ikterus dan kerusakan hepar yang fatal akibat terjadinya nekrosis
multilobular. Penggunaan obat ini pada pasien yang menunjukkan adanya
kelainan fungsi hepar akan menyebabkan bertambah parahnya kerusakan
hepar (Setiabudydkk., 2008).
Mekanisme toksisitas isoniazid pada hepar terutama disebabkan karena
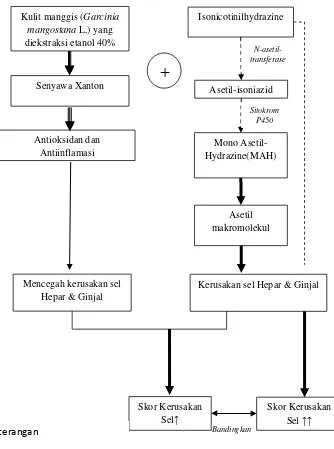
metabolit toksik isoniazid yaitu Mono Asetil Hidrazin (MAH). Eliminasi
isoniazid yang kebanyakan berlangsung di hepar, yaitu dengan asetilasi
oleh N-asetil transferase-2 (NAT-2). Asetilasi dari asetil isoniazid akan
menghasilkan pembentukan dari MAH yang merupakan zat hepatotoksik
menghasilkan reaktif alkilating agen yang dapat berikatan secara kovalen
dengan makromolekul jaringan dan menyebabkan nekrosis hepar.
Pendapat lain menyebutkan bahwa metabolit reaktif yaitu MAH
kemungkinan menjadi agen toksik pada jaringan melalui produksi radikal
bebas (Saukkonen et al., 2009). Menurut Min (2013) Toksisitas ginjal
isoniazid telah dilaporkan secara sporadis dan histologi nefrotoksisitas
dari rifampisin dikaitkan dengan nefritis akut tubulointerstitial (ATIN),
tubular nekrosis, nekrosis papiler, nekrosis kortikal akut, dan penyakit
perubahan minimal.
2.4.4. Dosis
Dewasa dan anak: 5 mg/kg BB/hari (4−6 mg/kg BB/hari; maksimal 300
mg atau 10 mg/kg BB 3x seminggu atau 15 mg/kg BB 2x seminggu)
35
2.5 Tanaman Manggis
2.5.1 Taksonomi Tanaman Manggis (Garcinia mangostana L)
Kerajaan : Plantae
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Parietales
Suku : Guttifera
Marga : Garcinia
Jenis : Garcinia mangostana L
Di Indonesia manggis disebut dengan berbagai macam nama lokal, seperti
angoita (Aceh), manggista (Sumatera Utara), manggih (Sumatera Barat),
manggu (Jawa Barat), mangghis (Madura), kirasa (Makassar) dan
mangustang (Halmahera) (Kukuh, 2011).
2.5.2. Ekologi dan penyebaran
Garcinia mangostana L. merupakan tanaman buah yang banyak tumbuh di
daerah iklim tropis. Tanaman manggis ini dapat ditemukan di
negara-negara Asia Tenggara seperti Thailand, Malaysia, Filipina, Vietnam dan
termasuk Indonesia, kemudian tanaman ini tersebar ke negara-negara tropis
lainnya termasuk Sri Lanka, India Selatan, Amerika Tengah, Brazil dan
2.5.3. Morfologi
Gambar 14. Garcinia mangostana L. (Aiello, 2005).
Garcinia Mangostana L. merupakan pohon buah dengan tinggi mencapai
25 meter. Berbatang kayu dengan warna hijau kotor yang bulat tebal dan
tegak dengan diameter batang 45 cm memiliki daun tunggal yang berwarna
hijau dan berbentuk lonjong dengan ujung runcing, pangkal yang tumpul
dan tepi yang rata, pertulangan menyirip, berukuran panjang 20−25 cm dan
lebar 6−9 cm. Berbunga tunggal berwarna kuning, berkelamin dua dan
berada di ketiak daun dengan panjang 1−2 cm. Buah berbentuk bola yang
tertekan, garis tengah 3,5−7 cm, berwarna ungu tua, dinding buah tebal dan
berdaging. Berbiji bulat, berwarna kuning dengan diameter ± 2 cm, dalam
satu buah terdapat 5−7 biji, diselimuti oleh selaput biji yang tebal dan
37
2.5.4. Kandungan kimia dan manfaat
Kandungan kimia kulit buah manggis antara lain derivat xanton yaitu mangostin, gartanin, α-mangostin, γ-mangostin, garsimangoson B, garsinon
D, garsinon E, mangostinon, kudraxanton G, garsimangoson A,
garsimangoson C (Trifena, 2012).
Pemanfaatan kulit buah manggis sebenarnya sudah dilakukan sejak dahulu.
Berbagai penelitian di luar negeri menjelaskan, kulit buah manggis yang
sudah makan mengandung polihidroxi-xanton yang merupakan deivat
mangostin dan beta mangostin. Xanton mempunyai kemampuan sebagai
antioksidan dan antiinflamasi (Iswari, 2011).
a. Xanton sebagai antioksidan
Dalam proses metabolisme tubuh, terjadi reaksi oksidasi dan reduksi
sehingga terbentuk radikal bebas yang bersifat oksidator dengan
oksigen yang reaktif. Karena kereaktifannya, radikal bebas itu akan
mengoksidasi zat-zat yang bermanfaat bagi tubuh, sehingga
menyebabkan sejumlah jaringan tubuh rusak (Yatman, 2012).
Oleh karena mudah teroksidasi, radikal bebas, dalam hal ini radikal
peroksil (ROO) akan mengoksidasi xanton dengan cepat, sehingga
radikal peroksil itu akan berubah menjadi R-H. Perubahan itu terjadi
karena molekul oksigen direduksi oleh garsinon B sebagai derivat
xanton. Reaksinya dapat menghambat radikal bebas dari berbagai
(carbon-centered), R, R2NO (nitrogen-centered), RO, H3COO
(O2-centered), atau ROO, dapat dihilangkan oleh xanton jenis garcinon B
atau parvixanton dalam proses oksidasi, sehingga senyawa bermanfaat
dapat berfungsi (Yatman, 2012).
Dalam reaksi xanton dengan radikal bebas itu, R berubah jadi RH, dan
reaksi akan membuat molekul A menjadi tidak aktif. Demikian juga
RO. Dengan adanya xanton (garcinon B atau parvixanton-1), posisi A
diganti sehingga reaksi berubah menjadi ROH, yang dapat menjaga
zat-zat yang bermanfaat bagi tubuh menjadi berfungsi dengan baik
untuk menjaga kesehatan. Hal yang sama juga terjadi pada ROO, yang
dalam proses reaksi itu berubah menjadi ROOH (Yatman, 2012).
b. Xanton sebagai anti-inflamasi
Khasiat antiinflamasi kulit manggis ternyata telah dipraktikan sejak
dulu. Setelah diteliti lebih lanjut, ternyata manggis memang
mengandung zat antiinflamasi pada studi in-vitro. Penelitian lain di
Jepang, menunjukkan bahwa senyawa gamma-mangostin lah yang
mampu mencegah aktifitas COX (Cyclo-oxigenase), enzim yang
bertugas menandai adanya inflamasi dalam tubuh. Untuk alergi,
senyawa xanthon mampu mencegah pelepasan anti-histamin dan
sintesis prostaglandin E2 yang dikeluarkan kerika terjadi alergi.
Prostaglandin itulah penyebab inflamasi menjadi radang. Dalam
39
menghambat pelepasan reseptor pembuat histamine, sedangkan
gammamangostin dapat menghambat pelespasan reseptor pembuat
BAB III
METODE PENELITIAN
3.1 Desain Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorik yang
menggunakan metode rancangan acak terkontrol dengan pola post test−only
control group design. Sebanyak 25 ekor tikus putih (Rattus norvegicus) jantan
galur Sprague Dawley berumur 10−16 minggu yang dipilih secara acak dan
dibagi menjadi 5 kelompok, dengan pengulangan sebanyak 5 kali digunakan
sebagai subjek penelitian.
3.2 Tempat dan Waktu
Penelitian dilakukan di BPPV (Balai Penyidikan dan Pengujian Veteiner)
sedangkan pembuatan preparat dan pengamatannya dilakukan di Laboratorium
Patologi Anatomi Rumah Sakit Umum Abdul Moeloek. Penelitian dilaksanakan
41
3.3 Populasi dan Sampel
Populasi penelitian ini adalah tikus putih (Rattus norvegicus) jantan galur
Sprague Dawley berumur 10−16 minggu yang diperoleh dari laboratorium Balai
Penelitian Veteriner (BALITVET) Bogor.
Sampel penelitian sebanyak 25 ekor yang dipilih secara acak yang dibagi dalam
5 kelompok dengan pengulangan sebanyak 5 kali. Untuk penelitian eksperimen
dengan rancangan acak lengkap, acak kelompok atau faktorial, secara sederhana
dapat dirumuskan:
(n−1)−(t−1) ≥ 15
Dimana t merupakan jumlah kelompok percobaan dan n merupakan jumlah
pengulangan atau jumlah sampel tiap kelompok. Penelitian ini menggunakan 5
kelompok perlakuan sehingga perhitungan sampel menjadi: (n−1)−(5−1) ≥ 15
penelitian ini menggunakan 25 ekor tikus putih dari populasi yang ada.
Kriteria inklusi:
1.Sehat (tidak tampak penampakan rambut kusam, rontok, atau botak, dan
2. Memiliki berat badan 100 gram;
3. Berjenis kelamin jantan;
4. Berusia sekitar ± 10−16 minggu (dewasa).
Kriteria eksklusi:
1.Terdapat penurunan berat badan lebih dari 10% setelah masa adaptasi
dilaboratorium;
2. Mati selama masa pemberian perlakuan.
3.4 Bahan dan Alat Penelitian
3.4.1 Bahan Penelitian
Berdasarkan penelitian Ergul (2010) dosis isoniazid yang digunakan 30
mg/100gBB dan Bahan ekstrak digunakan kulit manggis (Garcinia
mangostana L.) yang diekstraksi etanol 40% dengan dosis 20, 40, dan 80
mg.
3.4.2 Bahan Kimia
Bahan yang digunakan untuk pembuatan preparat histopatologi dengan
metode paraffin meliputi larutan formalin 10% untuk fiksasi, alkohol
70%, alkohol 96%, alkohol absolut, etanol, xilol, pewarna hematoksilin
43
3.4.3Perangkat Penelitian
1.Alat Penelitian
Alat penelitian yang digunakan dalam penelitian ini adalah:
Neraca analitik Metler Toledo dengan tingkat ketelitian 0,01 g,
untuk menimbang berat tikus;
Spuit oral 1 cc, 3 cc dan 5 cc;
Minor set, membedah tikus untuk mengidentifikasi hepar;
Kapas dan alcohol;
Alat pemeriksaan mikroskopis: Mikroskop, gelas objek cairan
emersi;
Kamera digital.
2. Alat Pembuat Preparat Histopatologi
Alat pembuat preparat histopatologi yang digunakan adalah object
glass, deck glass, tissue cassette, rotarymicrotome, oven, water
bath, platening table, autochnicom processor, staining jar, staining
3.5 Prosedur Penelitian
3.5.1Prosedur Pemberian Ekstrak Kulit Manggis
1. Metode Pembuatan Ekstrak Kulit Manggis
Menurut Nakatani dalam chaverri (2008) Proses pembuatan ekstrak
kulit manggis (Garcinia mangostana L.) dalam penelitian ini
menggunakan etanol sebagai pelarut. Penelitian ini menggunakan
pelarut etanol 40%, dikarenakan memiliki efek yang paling poten.
Menurut Sulistianto (2004), ekstraksi dimulai dari penimbangan buah
manggis (Garcinia mangostana L.). Selanjutnya dikeringkan dalam
almari pengering, dibuat serbuk dengan menggunakan blender atau
mesin penyerbuk. Etanol dengan kadar 40% ditambahkan untuk
melakukan ekstraksi dari serbuk ini selama kurang lebih 2 (dua) jam
kemudian dilanjutkan maserasi selama 24 jam. Setelah masuk ke tahap
filtrasi, akan diperoleh filtrat dan residu. Filtrat yang didapatkan akan
diteruskan ke tahap evaporasi dengan Rotary evaporator pada suhu 40 0
C sehingga akhirnya diperoleh ekstrak kering.
2. Prosedur Pemberian Dosis Kulit Manggis
Dosis kulit manggis pada ekperimen ini adalah 200 mg/kgBB, 400
mg/kgBB, 800 mg/kgBB. yang didapat dari dosis penelitian
45
Dosis kulit manggis pada ekperimen ini adalah 200 mg/kgBB, 400
mg/kgBB, 800 mg/kgBB. yang didapat dari dosis penelitian
sebelumnya, dimana dosis tersebut mempengaruhi sel yang rusak.
Dosis untuk 100g tikus adalah 20 mg/100gBB. Dalam penelitian ini
kelompok kontrol negatif dan kontrol positif tidak diberikan ekstrak
kulit manggis (Garcinia mangostana L.) (Wijaya dkk., 2011).
1) Dosis untuk tiap tikus kelompok III
2) Dosis untuk tiap tikus kelompok IV
3) Dosis untuk tiap tikus kelompok V
Volume ekstrak kulit manggis (Garcinia mangostana L.) diberikan
secara oral sebanyak 1 ml yang merupakan volume yang boleh
diberikan berdasarkan pada volume normal lambung tikus yaitu 3−5
ml. Jika volume ekstrak melebihi volume lambung, dapat berakibat Dosis tikus (100g) = 200 mg/kgBB /100
= 0,2 mg x 100 = 20 mg/100gBB
Dosis tikus (100g) = 400 mg/kgBB /100
= 0,4 mg x 100 = 40 mg/100gBB
Dosis tikus (100g) = 800 mg/kgBB /100
dilatasi lambung secara akut yang dapat menyebabkan robeknya
saluran cerna (Ngatidjan, 2006).
3.5.2 Prosedur Pemberian Dosis Isoniazid (INH)
Berdasarkan penelitian Ergul (2010) Dosis INH yang digunakan untuk
menimbulkan efek toksik pada tikus sebesar 50 mg/kgBB per hari. Jika
dilakukan konversi untuk dosis tikus dewasa adalah sebagai berikut:
Berat manusia dewasa umumnya 70 kg jika dosis toksik 50 mg/Kg
BB/hari maka dosis toksik total 3500 mg untuk manusia. Angka konversi
dosis dari manusia 70 kg ke tikus 200 gr adalah 0,018. Sehingga dosis
toksik isoniazid untuk tikus 200 gr adalah 0,018 x 3500 mg = 63 mg.
Rerata berat tikus yang digunakan pada penelitian ini adalah 100 gr. Dosis
toksik untuk tikus dengan berat 100 gr adalah 31,5 mg dibulatkan
menjadi 30 mg.
Dosis isoniazid yang dipilih adalah isoniazid tablet sediaan 300 mg, hal ini
dikarenakan pemberian peroral dimana kadar puncak dicapai dalam waktu
2 jam setelah pemberian oral ( Setiabudy, 2009), Isoniazid tabet digerus
dan dilarutkan dalam 10 ml aquadest. Jadi dalam 1 ml larutan isoniazid
terdapat 30 mg dan diberikan 1 kali sehari kepada tikus kontrol postif
(KII), K III, K IV dan K V.
47
a. Tikus sebanyak 25 ekor, dikelompokkan dalam 5 kelompok.
Kelompok I sebagai kontrol negatif, hanya yang diberi aquades.
Kelompok II sebagai kontrol positif, diberikan INH dengan dosis
30 mg/kgBB. Kelompok III adalah kelompok perlakuan coba
dengan pemberian dosis kulit manggis dengan dosis 20
mg/100gBB, kelompok IV dengan dosis kulit manggis sebanyak
40 mg/100gBB, dan kelompok V dengan dosis kulit manggis
sebanyak 80 mg/kgBB. Kemudian selang 2 jam, kelompok III, IV
dan V diberikan induksi isoniazid sebesar 30 mg/kgBB.
Masing−masing diberikan secara peroral satu kali sehari selama 14
hari;
b. Setelah 14 hari, perlakuan diberhentikan;
c. Selanjutnya tikus di anesthesia kemudian dilakukan euthanasia;
d. Dilakukan pemeriksaan morfologi hepar dan ginjal secara
mikroskopis:
Organ hepar dan ginjal dibuat preparat histopatologi dengan
pewarnaan Hematoksilin−Eosin. Kemudian preparat histopatologi
dikirim ke laboratorium Patologi Anatomi untuk dikonsultasikan
dengan ahli patologi anatomi.Pengamatan mikroskopis dilakukan
oleh peneliti sendiri.
Gambaran kerusakan hepatosit tikus dilihat dengan melakukan
perbesaran 400x pada 5 lapangan pandang dimana setiap lapangan
pandang diamati berupa degenerasi bengkak keruh yang terjadi pada
hepatosit. Skala degenerasi bengkak keruh kemudian dihitung secara
semikuantitatif dalam 5 lapang pandang berbeda. Berikut ini adalah skala
penilaian Kawasaki (2009) dengan modifikasi:
Tabel 1. Skor penilaian derajat degenerasi bengkak keruh.
Tingkat Perubahan Skor
Tidak ada hepatosit yang mengalami degenerasi
bengkak keruh 0
<10% hepatosit yang mengalami degenerasi bengkak
keruh 1
10% – 33% hepatosit yang mengalami degenerasi
bengkak keruh 2
34% – 66% hepatosit yang mengalami degenerasi
bengkak keruh 3
>67% – 100% hepatosit yang mengalami degenerasi
bengkak keruh 4
Gambaran kerusakan tubulus proksimal ginjal mencit dilihat dengan
melakukan pengamatan sediaan histopatologi menggunakan mikroskop
cahaya dengan perbesaran 400x pada 10 lapang pandang, kerusakan
tubulus proksimal ditandai dengan adanya sel yang nekrotik.
Tabel 2. Skor penilaian derajat sel yang mengalami nekrotik.
Tingkat Perubahan Skor
Tidak ada sel yang nekrotik 0
<10% sel yang mengalami nekrotik 1
10% – 33% sel yang mengalami nekrotik 2
49
>67% – 100% sel yang mengalami nekrotik 4
Metode teknik pembuatan preparat histopatologi menurut bagian PA FK
Unila :
1. Fixation
a. Spesimen berupa potongan organ hepar dan ginjal yang telah
dipotong secara representatif kemudian segera difiksasi dengan
formalin 10% selama 3 jam;
b. Dicuci dengan air mengalir sebanyak 3−5 kali.
2. Trimming
a. Organ dikecilkan hingga ukuran ± 3 mm;
b. Potongan organ hepar dan ginjal tersebut lalu dimasukkan ke
dalam tissue cassette.
3. Dehidrasi
a. Mengeringkan air dengan meletakkan tissue cassette pada kertas
tisu;
b. Berturut−turut organ hepar dan ginjal direndam dalam alkohol
70% selama 0,5 jam, alkohol 96% selama 0,5 jam, alkohol
absolut selama 1 jam, dan alkohol xylol 1:1 selama 0,5 jam.
4. Clearing
Untuk membersihkan sisa alkohol, dilakukan clearing dengan xylol
5. Impregnasi
Impregnasi dilakukan dengan menggunakan paraffin selama 1 jam
dalam oven suhu 650 C.
6. Embedding
a. Sisa paraffin yang ada pada pan dibersihkan dengan
memanaskan beberapa saat di atas api dan diusap dengan kapas;
b. Paraffin cair disiapkan dengan memasukkan paraffin ke dalam
cangkir logam dan dimasukkan dalam oven dengan suhu diatas
580C;
c. Paraffin cair dituangkan ke dalam pan;
d. Dipindahkan satu persatu dari tissue cassette ke dasar pan
dengan mengatur jarak yang satu dengan yang lainnya;
e. Pan dimasukkan ke dalam air;
f. Paraffin yang berisi potongan hepardilepaskan dari pan dengan
dimasukkan ke dalam suhu 4−60 C beberapa saat;
g. Paraffin dipotong sesuai dengan letak jaringan yang ada dengan
menggunakan skalpel/pisau hangat;
h. Lalu diletakkan pada balok kayu, diratakan pinggirnya, dan
dibuat ujungnya sedikit meruncing;
i. Memblok paraffin, siap dipotong dengan mikrotom.
7. Cutting
51
b. Sebelum memotong, blok didinginkan terlebih dahulu di lemari
es;
c. Dilakukan pemotongan kasar, lalu dilanjutkan dengan
pemotongan halus dengan ketebalan 4−5 mikron. Pemotongan
dilakukan menggunakan rotary microtome dengan disposable
knife.
d. Dipilih lembaran potongan yang paling baik, diapungkan pada
air, dan dihilangkan kerutannya dengan cara menekan salah satu
sisi lembaran jaringan tersebut dengan ujung jarum dan sisi yan
lain ditarik menggunakan kuas runcing;
e. Lembaran jaringan dipindahkan ke dalam water bath suhu 600C
selama beberapa detik sampai mengembang sempurna;
f. Dengan gerakan menyendok, lembaran jaringan tersebut diambil
dengan slide bersih dan ditempatkan di tengah atau pada
sepertiga atas atau bawah;
g. Slide yang berisi jaringan ditempatkan pada inkubator (suhu
370C) selama 24 jam sampai jaringan melekat sempurna.
8. Staining (pewarnaan) dengan Harris Hematoksilin−Eosin
Setelah jaringan melekat sempurna pada slide, dipilih slide yang
terbaik, selanjutnya dilakukan deparafinisasi dalam larutan xylol I
selama 5 menit dan larutan xylol II selama 5 menit. Kemudian,
dihidrasi dalam ethanol absolut selama 1 jam, alkohol 96% selama 2
dilakukan pulasan inti denganHarris Hematoksilin selama 15 menit,
dibilas dengan air mengalir, lalu diwarnai dengan eosin selama
maksimal 1 menit. Selanjutnya, didehidrasi dengan alkohol 70%
selama 2 menit,alkohol 96% selama 2 menit, dan alkohol absolut
selama 2 menit.Kemudian dilakukan penjernihan dengan xylol I
selama 2 menit dan xylol II selama 2 menit.
9. Mounting dengan entelan dan tutup dengan deck glass
Setelah pewarnaan selesai, slide ditempatkan di atas kertas tisu pada
tempat datar, ditetesi dengan bahan mounting, yaitu entelan, dan
ditutup dengan deck glass, cegah jangan sampai terbentuk
gelembung udara.
10. Slide dibaca dengan mikroskop
Slide diperiksa di bawah mikroskop cahaya dengan perbesaran
400x.Preparat histopatologi dikirim ke laboratorium Patologi
Anatomi untuk dikonsultasikan dengan ahli patologi anatomi.
53
Timbang berat badan tikus
K1 K2 K3 K4 K5
Tikus diadaptasikan selama 7 hari
Tikus diberi perlakuan selama 14 hari
Cekok Cekok Cekok INH 30 mg INH 30 mg INH 30 mg 1 X sehari 1 X sehari 1 X sehari
Cekok I.P I.P. I.P. I.P.
Aquadest INH 30mg Kulit manggis 20 mg Kulit manggis 40 mg Kulit manggis 80 mg 1 x sehari 1x sehari
Tikus di anesthesia kemudian di authanasia
Lakukan laparotomi lalu hepar dan ginjal tikus di ambil
Sampel hepar dan ginjal difiksasi dengan formalin 10%
Sample hepar dan ginjal dikirim ke Laboratorium PA Rumah Sakit Umum Abdul Moeloek
Pengamatan sediaan histopatologi dengan mikroskop
Interpretasi hasil pengamatan
Gambar 15. Diagram alur penelitian.
3.5.3 Identifikasi Variabel dan Definisi Operasional Variabel
1. Identifikasi Variabel
a. Variabel Independen adalah dosis ekstrak etanol 40% kulit
manggis (Garcinia mangostana L.) yang di ekstraksi etanol yang
diberikan kepada tikus putih (Rattus norvegicus) jantan galur
Sprague Dawley.
b. Variabel dependen adalah gambaran histopatologi hepar dan ginjal
55
2. Definisi Operasional Variabel
Tabel 3. Definisi Operasional Variabel.
Variabel Definisi Skala
Dosis efektif kulit manggis adalah 80 mg/100gBB Kelompok I (kontrol negatif) = pemberian aquadest Kelompok II (kontrol positif) = pemberian INH 30 mg
Kelompok III (perlakuan coba) = pemberian mkulit manggis
Gambaran kerusakan hepatosit tikus dilihat dengan melakukan pengamatan sediaan histopatologi menggunakan mikroskop dengan perbesaran 400x pada 5 lapangan pandang dimana setiap lapangan pandang diamati berupa degenerasi bengkak keruh yang terjadi pada hepatosit. Skaladegenerasi bengkak keruh kemudian dihitung secara semi kuantitatif dalam 5 lapang pandang berbeda. Skala penilaian Kawasaki (2009).
Gambaran kerusakan tubulus ginjal tikus dilihat dengan melakukan pengamatan sediaan histopatologi menggunakan mikroskop cahaya dengan perbesaran 400x pada 10 lapang pandang, kerusakan tubulus ditandai dengan hilangnya inti pada sel tubulus atau disebut sel nekrotik. Persentase sel yang rusak tiap lapangan pandang dijumlahkan dan dirata−ratakan.
Kategorik
Numerik
Numerik
Data yang diperoleh dari hasil pengamatan histopatologi di bawah mikroskop
diuji analisis statistik menggunakan software analisis statistik Hasil penelitian
dianalisis apakah memiliki distribusi normal atau tidak secara statistik dengan uji
normalitas Shapiro−Wilk karena jumlah sampel ≤50. Kemudian, dilakukan uji
Levene untuk menyetahui apakah dua atau lebih kelompok data memiliki varians
yang sama atau tidak. Jika varians data berdistribusi normal dan homogen,
dilanjutkan dengan metode uji parametrik one way ANOVA.Bila tidak
memenuhi syarat uji parametrik, digunakan uji nonparametrik
Kruskal−Wallis.Hipotesis dianggap bermakna bila p<0,050. Jika pada uji
ANOVA atau Kruskal−Wallis menghasilkan nilai p<0,050, maka dilanjutkan
dengan melakukan analisis Post−Hoc LSD untuk melihat perbedaan antar
kelompok perlakuan.
3.7 Ethical Clearance
Penelitian ini telah diajukan ke Komisi Etik Penelitian Kesehatan Fakultas
Kedokteran Universitas Lampung, dengan menerapkan prinsip 3R dalam
protokol penelitian, yaitu:
1. Replacement, adalah keperluan memanfaatkan hewan percobaan sudah
diperhitungkan secara seksama, baik dari pengalaman terdahulu maupun
literatur untuk menjawab pertanyaan penelitian dan tidak dapat digantikan
57
2. Reduction, adalah pemanfaatan hewan dalam penelitian sesedikit mungkin,
tetapi tetap mendapatkan hasil yang optimal. Dalam penelitian ini sampel
dihitung berdasarkan rumus Frederer yaitu (n−1) (t−1) ≥ 15, dengan n adalah
jumlah hewan yang diperlukan dan t adalah jumlah kelompok perlakuan.
3. Refinement, adalah memperlakukan hewan percobaan secara manusiawi,
dengan prinsip dasar membebaskan hewan coba dalam beberapa kondisi.
a. Bebas dari rasa lapar dan haus, pada penelitian ini hewan coba diberikan
pakan standar dan minum secara ad libitum;
b. Bebas dari ketidaknyamanan, pada penelitian hewan coba ditempatkan di
animal house dengan suhu terjaga 20−25°C, kemudian hewan coba
terbagi menjadi 3−4 ekor tiap kandang. Animal house berada jauh dari
gangguan bising dan aktivitas manusia serta kandang dijaga
kebersihannya sehingga, mengurangi stress pada hewan coba;
c. Bebas dari nyeri dan penyakit dengan menjalankan program kesehatan,
pencegahan, dan pemantauan, serta pengobatan terhadap hewan
percobaan jika diperlukan, pada penelitian hewan coba diberikan
perlakuan dengan menggunakan nasogastric tube dilakukan dengan
mengurangi rasa nyeri sesedikit mungkin, dosis perlakuan diberikan
Prosedur pengambilan sampel pada akhir penelitian telah dijelaskan
dengan mempertimbangkan tindakan manusiawi dan anesthesia serta
euthanasia dengan metode yang manusiawi oleh orang yang terlatih
untuk meminimalisasi atau bahkan meniadakan penderitaan hewan coba
100
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Pengaruh pemberian ekstrak etanol 40% kulit manggis dapat menurunkan
jumlah pembengkakan sel hepatosit dan kerusakan tubulus ginjal.
2. Pengaruh pemberian ekstrak etanol 40% kulit manggis dosis 20, 40, 80 mg
dapat menurunkan jumlah pembengkakan sel hepatosit sebesar 61%, 42% dan
16% serta menurunkan jumlah kerusakan tubulus ginjal sebesar 66,5%, 39%
dan 8%.
5.2. Saran
1. Peneliti lain disarankan untuk menguji lebih lanjut toksisitas dan efektivitas
pada ekstrak kulit manggis;
2. Peneliti lain disarankan untuk meneliti lebih lanjut tentang potensi zat-zat
aktif dalam kulit manggis sebagai fitofarmaka;
3. Peneliti lain disarankan untuk meneliti lebih lanjut terkait dosis teurapeutik
4. Peneliti lain disarankan untuk meneliti lebih lanjut dengan jangka waktu lebih
lama terkait pemberian ekstrak kulit manggis terhadap gambaran histopatologi
ginjal yang diinduksi dengan isoniazid;
5. Peneliti lain disarankan untuk meneliti lebih lanjut efek kulit manggis pada
DAFTAR PUSTAKA
Aiello A. 2005. Smithsonian tropical research institute: Garcinia mangostana Fruit. http://biogeodb.stri.si.edu/bioinformatics/dfm/metas/view/41486, [ Diakses 3 2010. 101-104 site: www.lung.org/assets/documents/publications/solddc-chapters/tb.pdf - 39k - 2010-03-26 [Diakses 2 September 2013].
Bagiada IM, Primasari NLP. 2010. Faktor-faktor yang mempengaruhi tingkat ketidak patuhan penderita tuberculosis dalam berobat di poliklinik dots RSUP sanglah denpasar. Artikel kesehatan. Denpasar: FKUNUD. hlm.158−59.
Bhara M. 2009. Pengaruh pemberian kopi dosis bertingkat peroral 30 hari terhadap gambaran histopatologi hepar tikus wistar. Laporan akhir karya tulis ilmiah. UNDIP.
Chambers HF. 2011.Antimycobacterial drugs, dalam Katzung, BG (editor), basic and clinical pharmacology, 8th Ed. new york: McGraw-Hill, pp. 796−8.
Chandrasoma P, Taylor CR. 2006. Ringkasan patologi anatomi, Edisi ke−2. Jakarta: EGC. hlm. 230.
Chasani S. 2008. Antibiotik nefrotoksik: penggunaan pada gangguan fungsi ginjal. Artikel kesehatan. Semarang: FK UNDIP. hlm. 2.