LAPORAN PRAKTEK KERJA LAPANG
PENETAPAN P-TERSEDIA METODE OLSEN/BRAY DAN
PENETAPAN PK-POTENSIAL (HCl25%)
Oleh :
M.Zulfahmi
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN DAN PETERNAKAN
UNIVERSITAS ISLAM NEGERI SULTAN SYARIF KASIM RIAU PEKANBARU
LEMBAR PENGESAHAN
Judul : Penetapan P-Tersedia Metode Olsen/Bray Dan Penetapan PK-Potensial (HCl 25%)
Nama : M.Zulfahmi
NIM : 11382100405
Program Studi : Agroteknologi
Menyetujui,
Pembimbing,
OKSANA, SP,. MP. NIP. 197604162009122002
Mengetahui:
Dekan Ketua
Fakultas Pertanian dan Peternakan Program Studi Agroteknologi
EDI ERWAN, S.pt, M.sc, ph.D OKSANA, SP,. MP.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan Laporan Praktek Kerja Lapang ini dengan judul “PENETAPAN P-TERSEDIA METODE OLSEN/BRAY DAN PENETAPAN PKHCL 25% DI LAB KIMIA BALITTANA BOGOR”. Salawat dan salam tak lupa penulis haturkan kepada Nabi Muhammad SAW., yang mana berkat rahmat beliau kita dapat merasakan dunia yang penuh dengan ilmu pengetahuan ini.
Ucapan terima kasih juga penulis ucapkan kepada Kedua orang tua saya Efendi dan Sumiati, Dosen pembimbing saya Oksana, SP.,MP, Ketua Program Studi Agroteknologi OKSANA, SP.,MP, Perusahaan tempat melakukan PKL BALAI PENELITIAN TANAH BOGOR Dan ibuk hesti selaku pembimbing lapang.
Penulis berharap memperoleh manfaat secara pribadi. Semoga laporan praktek kerja lapang ini bermanfaat bagi kita semua baik masa kini maupun untuk masa yang akan datang.
Pekanbaru, Februari 2016
DAFTAR ISI
2.2. Analisis Tanah Rutin ... 4
2.3. Instrumen Laboratorium ... 10
2.4. Topik 4... x
III. METODE PELAKSANAAN ... 22
3.1. Tempat dan Waktu... 22
3.2. Alat dan Bahan ... 22
3.3. Metodologi ... 24
3.4. Pengamatan ... 24
3.5. Kegiatan Praktek Kerja Lapang ... 24
IV. HASIL DAN PEMBAHASAN ... 25
4.1. Gambaran Umum Lokasi PKL ... 25
4.2. Hasil dan Pembahasan ... 33
4.2.1 Penetapan P-Olsen/Bray... 33
4.2.2 Penetapan PK-Potensial HCl25%... 34
V. PENTUP ... 36
5.1. Kesimpulan ... 36
5.2. Saran ... 36
DAFTAR PUSTAKA... 37
DAFTAR TABEL
Tabel Halaman
3.1 Sejarah dan perkembangan Balittanah... 25
3.2. Tabel Hasil Pengamatan ... 33
DAFTAR GAMBAR
Gambar Halaman
3.1 pH meter... 11
3.2. Spektrofotometer visible dan ultraviolet... 14
4.1 Spektro Serapan Atom... 19
DAFTAR SINGKATAN
BBSDLP Balai Besar Sumber Daya Lahan Pertanian
BALITTANAH Balai Penelitian Tanah
SNI Standar Nasional Indonesia
DAFTAR LAMPIRAN
Lampiran Halaman
1. Kegiatan Praktek Kerja Lapang... 45
2. Jurnal Harian Praktek Kerja Lapang ... 46
I. PENDAHULUAN 1.1.Latar Belakang
Tanah merupakan media tempat tanaman bisa tumbuh dan berkembang. Ilmu tanah merupakan ilmu yang menjelaskan sumber daya alam dan ilmu yang menjelaskan berbagai aspek ilmu tanah seperti pembentukan, pemetaan, klasfikasi, berbagai karakteristik fisik, biologis, kimiawi, kesuburannya, sekaligus mengenai pengelolaan dan pemanfaatannya. Tanah adalah lapisan yang menyelimuti bumi antara atmosfr dan litosfer (bebatuan yang membentuk kerak bumi).
Didalam tanah ada hal penting yang harus kita ketahui yaitu fisik, biologi dan kimia tanah, didalam penerapan ilmu pertanian ketiga sifat tersebut sangat urgen untuk keberhasilan usaha pertanian, oleh karena itu perlu dilakukan pengkajian lebih dalam tentang ketiga aspek tersebut yang salah satunya saya fokuskan di Praktek kerja lapang saya memilih Penetapan P-metode Olsen dan Metode Bray serta Penetapan PK-Potensial HCl 25% di Lab Kimia tanah Bogor pada kegiata Analisis Tanah Rutinya .
Analisis Tanah rutin merupakan kegiatan berskala laboratorium yang bertujuan untuk mengetahui serta menetapkan unsur-unsur kimia yang terkandung dalam tanah seperti Tekstur tanah, Ph tanah, N-total, bahan organik tanah, P dan K potensial, P-tersedia (metode olsen dan bray), nilai tukar kation, kapasitas tukar kation, kadar air.
Setelah kita mengetahui hasil analisis kimia pada tanah maka kita mudah mendapatkan acuan dalam penentuan pemberian nutrisi tambahan pada lahan yang akan dibudidayakan, serta memudahkan kita dalam memilih komoditas tanaman apa yang cocok ditanah dengan kandungan kimia yang telah kita analisis tersebut.
1.2. Tujuan
Praktek kerja lapang ini bertujuan untuk Mempelajari Penetapan P-Tersedia metode olsen dan Bray serta Penetapan PK-POTENSIAL HCL 25%. 1.3 Manfaat
1. Bagi Mahasiswa, Mahasiswa mendapatkan keterampilan untuk melaksanakan program kerja pada perusahaan maupun instansi pemerintahan. Melalui praktek kerja lapangan mahasiswa mendapatkan bentuk pengalaman nyata serta permasalahan yang dihadapi dunia kerja. Selain itu, mahasiswa akan menumbuhkan rasa tanggung jawab profesi di dalam dirinya melalui praktek kerja lapangan.
2. Bagi Lembaga Perguruan Tinggi, Lembaga dapat menjalin kerjasama dengan dunia usaha, Lembaga BUMN, BUMD, Perusahaan Swasta, dan Instansi Pemerintahan. Praktek Kerja Lapangan dapat mempromosikan keberadaan
Akademik ditengah-tengah dunia kerja.
II. TINJAUAN PUSTAKA 2.1. Analisis Fosfor
P-tersedia hanya sedikit terdapat didalam tanah karena cenderung bereaksi dengan komponen tanah menjadi senyawa tidak larut atau tidak tersedia. Fosfor diserap tanaman dalam bentuk H2PO4- (Ortofosfat primer), HPO42- (Ortofosfat sekunder), dan sedikit sekali P-Organik yang larut dalam air.(Soepartini,1978)
Fosfor berada dalam tanah sebagai tersedia atau cadangan. P-tersedia adalah fosfor yang dapat langsung diserap oleh tanaman. Sedangkan p-cadangan adalah fosfor yang tidak tersedia (terikat) tetapi suatu saat nanti akan berubah menjadi P-tersedia dengan proses tertentu. Untuk menilai kadar fosfor, kadar cadangan ditetaapkan dengan ekstrak HCL 25%, serta kadar tersedia ditetapkan dengan cara olsen pada ph netral- basa atau cara Bray pada pH tanah asam. besar, seperti contoh tertukar, terjadi perubahan fisik, kimia, susunan contoh dari lapangan dan banyak hal lainya. Hal ini sangat perlu teliti dan hati-hati untuk mencegah terjadinya kesalhan terhadap seluruh hasil analisis contoh.
Contoh tanah biasanya dikering udarakan dengan kelembaban antara 20-60%. Alternatifnya, tanah dapat dikeringkan didalam oven berkipas angin pada suhu 40
C selama 24 jam. Tanah dapat disimpan dalam kantong plastik besar atau tempat lainya yang bersih agar terhindar dari kontaminasi air dan udara (Harizoni.2011)
2. Kadar Air
penentuan kadar air dari tanah. Agar terjadinya pergerakan air(penguapan air),
tanah dikeringkan dalam oven selama maximals 4 jam dan pada suhu 105oC. Perlunya penetapan kadar air yaitu untuk mendapatkan faktor koreksi kadar air. Tanah tanah yang lembab tentunya mengandung air, sehingga jumlah tanah analisis relatif lebih sedikit dari pada yang kurang lembab dan ini mempengaruhi kandungan unsur-unsur hara yang sebenarnya (adhi, 1976).
3. Tekstur Tanah
Tekstur tanah adalah perbandingan relatif antara fraksi pasir, debu dan liat. Pengetahuan tentang tekstur tanah sangat penting karena komposisi tiga fraksi tersebut akan menentukan sifat fisika, fisika-kimia dan kimia tanah. Adapun segitiga tekstur menurut USDA dibagi atas 12 kelas, meliputi:
1.pasir
Tanah bertekstur ringan (kandungan pasir tinggi) mudah merembeskan air dan sukar mengolahnya (Hakim, 1996).
Secara umum, tekstur tanah terbagi atas fraksi yaitu: 1. Pasir berdiameter 2,00-0,05 mm
2.Debu berdiameter 0,05-0,002 mm
3.liat berdiameter <0,002 mm (kurnia,1997).
maka tanah yang berteksut halus lebih aktif dalam reaksi kimia daripada tanah yang bertekstur kasar.
Di dalam metode penetapan tekstur tanah dilapangan biasanya dapat ditentukan dari memijit tanah basah dengan jari jari dan dirasakan halus kasarnya. Sedangkan dilaboratorium dapat dilakukan dengan cara kuantitatif
(Subagyo,1990). Sesuai hukum stoke, pemisahan debu dan liat dapat dilakukan dengan dua cara, yaitu:
1. Pemipetan
Perlakuan terhadap contoh sebelum analisi tekstur cara pemipetan adalah contoh dikeringkan, untuk fragmen fragmen yang berukuran > 2mm seperti humus atau zat organik dioksidasikan dengan H2O2 dan CaCO3 dalam tanah dihilangkan dengan menambah HCL. Pemipetan dilakukan pada waktu dan keadaan tertentu.
2. Cara Hirometer
Pengukuran ini dilakukan pada waktu tertentu dengan hidrometer Boyoucus,
sejenis pengukur kadar alkohol dengan skala g?liter. pemisahan cara hidrometer sangat dipengaruhi oleh suhu cairan ( Subagyo, 1990)
4.Kemasaman Tanah
Data pH tanah merupakan nilai yang sangat berguna, misalnya secara umum dapat dikatakan jika suatu tanah dengan nilai pH dibawah 4,0 dapat diduga dalam tanah tersebut terkandung asam-asam bebas, sering kali oksidasi dari sulfida. Suatu pH jika dibawah 5,5 menunjukan kemungkinan Al-dapat ditukar dalam jumlah yang memerlukan pertimbangan dan antara pH7,8-8,2 menunjukan adanya akumulasi CaCO3 dalam tanah. Pada pH yang sangat rendah ion-ion sulfida serta Al3+ dan Mn3+ sering kali ada dalam jumlah yang cukup banyak hingga dapat meracuni tanaman. Selain itu pH juga dapat digunakan dalam perkiraan kejenuhan basa dari suatu tanah.
Metode penetapan pH ada dua macam, yaitu: a. Cara Kolorimeter
b. Cara pH meter yang disebut juga Potensiometer
pH meter menggunakan elektroda kolomel sebagai pembandingan.
5.Bahan Organik
Bahan organik merupakan penimbunan dari sisa-sisa tumbuhan dan binatang yang sebagian telah mengalami pelapukan oleh mikroorganisme dalam tanah dan telah mengalami pembentukan kembali. Bahan organaik umumnya terdapat diatas permukaan tanah yang jumlahnya relatif lebih kecil yaitu berkisar antara 3-4% tetapi mempunyai pengaruh yang besar terhadap sifat-sifat tanah. Bahan organik juga merupakan perekat butiran lepas dan sumber utama nitrogen, fosfor, dan belerang.
Bahan organik berperan sebagai (Granulator) dari bahan mineral sehingga membuat tanah tersebut akan semakin gembur. Ada 3 metode penetapan Bahan organik tanah yang saya sajikan didalam laporan PKL ini, diantaranya:
1. Metode berdasarkan kehilangan bobot karena pemansan
Bahan organik yang terkandung dalam sejumlah tanah dihilangkan seluruhnya dengan pemanasan pada suhu tertentu. Didalam pelaksanaanya tidaklah sederhana, karena cara ini tidak mampu memisahkan antara kehilangan bahan organik dan CO2 dari senyawa karbon dan air serta senyawa hidroksil dari liat.
2. Metode berdasarkan pewarna
Unsur Karbon dapat ditetapkan secara jumlah melalui pereaksi pewarna, kadar C-organik ini dapat dinyatakan sebagai kadar bahan organik yang dikalikan dengan faktor Van Bemmelen yaitu 1,724 100/58. Penggunaan faktor ini
didasarkan pada anggapan bahwa bahan organik pada permukaan tanah kurang lebih 1,9 dan untuk subsoil sekitar 2,5.
3. Metode berdasarkan Oksidasi Basah
Bahan organik dioksidasi oleh Cr2O72-dalam suasana asam. Jumlah Cr2O7 2-yang tereduksi setara dengan jumla C-Organik dalam tanah.
Nitrogen tanah terdapat dalam dua bentuk yaitu an organik seperti (NO3, NO2, N2O, dan Gas N2) dan N-Organik dalam tanah pada umumnya terdapat dalam asam amino dan protein.
Tanah N-Total tanah berkisar dari 0,02% dalam subsoil dalam tanah gambut. Lapisan dari tanah-tanah pertanian mengandung 0,06% - 5% nitrogen. Tanah-tanah dengan bahan organik yang sudah stabil mempunya harga C/N sekitar 10.
C/N merupakan suatu rasio yang menunjukan tingkat dekomposisi suatu tanah, tanah yang sudah terdekomposisi memiliki C/N yang rendah. Perbandingan antara karbon dan Nitrogen penting bagi pertanian. Nilai C/N tanah pertanian pada lapisan tanah olah berkisar antara 8-15, sedangkan yang terbaik adalah 11(Oepartini,1978).
Nitrogen dalam tanah mengalami perubahan-perubahan melalui proses Aminisasi, amonifikasi, dan nitrifikasi.
a. Aminisasi, Pembentukan senyawa amina dari bahan organik (Protein) oleh bermacam-macam mikroorganisme.
b. Amonifikasi, Pembentukan amonia dari senyawa amino-amino oleh mikroorganisme.
c. Nitrifikasi, Perubahan dari amonium menjadi nitrit oleh bakteri nitrosomonas
yang kemudian diubah menjadi nitrat oleh nitrobakter Dua cara penetapan yang biasa dilakukan untuk penetapan N-total yaitu metode Kjeldahl dan metode
Dumas (Djayakirana, 1986)
7.Fosfor
P-tersedia hanya sedikit terdapat didalam tanah karena cenderung bereaksi dengan komponen tanah menjadi senyawa tidak larut atau tidak tersedia. Fosfor diserap tanaman dalam bentuk H2PO4- (Ortofosfat primer), HPO42- (Ortofosfat sekunder), dan sedikit sekali P-Organik yang larut dalam air.(Soepartini,1978)
dengan cara olsen pada ph netral- basa atau cara Bray pada pH tanah asam. (Suhardjo,1990).
8.Kalium
Penyerapan kalium oleh tanaman dapat mendekati jumlah Nitrogen bahkan melebihi jumlah nitrogen tersebut, walaupun jumlah kalium dalam tanah terbatas. Ketersedian kalium tersedia diartikan sebagai kalium yang dapat dipertukarkan dan dapat diserap oleh tanaman. Sehubungan dengan itu maka ketersedian kalium sangat tergantung pada penambahan dari luar dan juga adanya kehilangan dalam tanah. Bentuk-bentuk kalium dalam tanah dapat dibedakan kedalam tiga kelompok, yaitu tidak tersedia, Lambat, tersedia, dan K-langsung tersedia.
Didalam tanah terjadi keseimbangan antara tiga bentuk tersebut. Bila tanaman menyerap K-langsung tersedia dan K-tidak langsung tersedia akan membentuk atau mengisi kembali kekurangan K-tersedia.(Soepartini,1978)
K-tidak tersedia K-lambat tersedia K-langsung tersedia
Ada penetapan untuk penilaian kadar K20, Kadar K potensial ditetapkan dengan ekstrak CH3COONH4 pH 7,0. Dalam penetapan potensial lahan, biasanya digunakan penetapan K-tersedia(suhardjo,1990). Metode penetapan kalium pada umumnya ialah perkiraan kalium tukar, yaitu bentuk yang mudah tukar dengan kation kation lain. Pengekstraksian dengan HCL 25% akan mengubah bentuk kalium dalam tanah menjadi kalium yang larut dalam larutan tanah karena adanya pertukaran oleh ion H+ (suhardjo,1990).
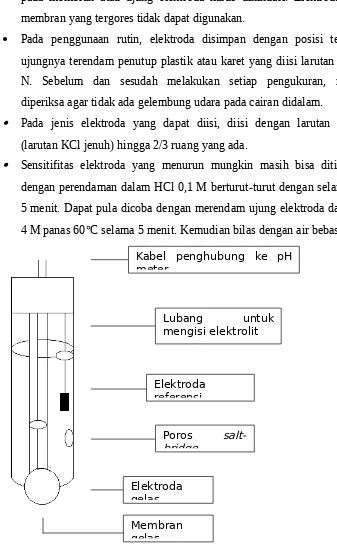
2.3. Instrumen Laboratorium Kimia Balittanah a. pH-meter
Pengukuran pH dengan pH-meter merupakan metode analisis potensiometri. Elektroda berfungsi untuk mengukur perbedaan tegangan antara referensi dengan larutan contoh. Elektroda tunggal hanya memiliki salah satu fungsi pengukuran tersebut. Sedangkan pada elektroda kombinasi kedua fungsi pengukuran ada dalam 1 elektroda. Biasanya untuk pengukuran pH digunakan elektroda kombinasi gelas dengan Ag atau AgCl sebagai referensi. Untuk mengkombinasikan alat agar dalam keadaan normal maka diperlukan kalibrasi dengan cara, pada alat E diatur menjadi 0 mV pada bufer pH 7 (kalibrasi 1). Penyesuaian nilai slope dilakukan dengan buffer kedua (kalibrasi 2) sedangkan kompensasi pengaruh suhu dilakukan pada tombol yang sama, tombol lain atau secara otomatis oleh alat, menurut vogel (1979) kalibrasi alat harus dilakukan dengan suatu buffer, yang pH-nya harus sedekat mungkin dengan pH dari larutan uji.
pada membran atau ujung elektroda harus dihindari. Elektroda dengan membran yang tergores tidak dapat digunakan.
Pada penggunaan rutin, elektroda disimpan dengan posisi tegak dan ujungnya terendam penutup plastik atau karet yang diisi larutan KCL 0.5 N. Sebelum dan sesudah melakukan setiap pengukuran, membran diperiksa agar tidak ada gelembung udara pada cairan didalam.
Pada jenis elektroda yang dapat diisi, diisi dengan larutan elektrolit (larutan KCl jenuh) hingga 2/3 ruang yang ada.
Sensitifitas elektroda yang menurun mungkin masih bisa ditingkatkan dengan perendaman dalam HCl 0,1 M berturut-turut dengan selang waktu 5 menit. Dapat pula dicoba dengan merendam ujung elektroda dalam KCl
4 M panas 60C selama 5 menit. Kemudian bilas dengan air bebas ion.
Gambar 5. Skema elektroda gelas kombinasi.
berdasarkan atas emisi atau adsorbsi radiasi elektromagnetik yang merupakan sifat khas dari perubahan energi tertentu dalam suatu molekul atau atom. Perubahan energi ini berupa tingkatan energi terkuantisasi yang mencirikan jenis-jenis atom atau molekul.
Teori Korpuskuler menurut Isaac Newton–Max Planck menganggap radiasi sebagai suatu arus dari paket-paket energi yang disebut foton atau kuanta yang bergerak dalam ruang pada kecepatan tetap c (c = 2,998 x 108 ms -1 dalam ruang hampa). Hubungan antara energi foton (E) dengan frekuensi (v) oleh teori gelembung dinyatakan dengan :
E = hv = hc/λ
Keterangan : h = tetapan Planck (6,6 x 10-34 Js) λ = panjang gelombang
Besaran energi dari radiasi elektromagnetik meliputi daerah luas yang disebut spektrum elektromagnetik. Bila suatu substansi diradiasi dengan radiasi elektromagnet, energi dari foton dapat dipindahkan ke atom atau molekul sehingga mengubah tingkatnya dari energi dasar ke energi eksitasi (tereksitasi). Proses ini dikenal sebagai adsorbsi, disertai pelemahan radiasi pada frekuensi tertentu dan hanya akan terjadi bila perbedaan energi (∆E) kedua tingkat itu sama tepat dengan energi dari foton (hv). Energi yang diserap dengan cepat diradiasikan kembali (emisi) dan hilang ke sekeliling disebabkan tubrukan, sehingga sistem kembali ke energi dasar. Kadangkala energi tidak hilang seperti ini, namun diemisikan kembali beberapa milidetik kemudian. Proses ini dikenal sebagai florosensi. Dengan memanaskan bahan hingga suhu tinggi pada nyala, sebagian energi panas digunakan untuk mengeksitasi atom ke tingkat energi lebih tinggi. Atom tereksitasi kembali ke tingkat asal dengan memancarkan emisi spontan dengan frekuensi (V) yang sesuai dengan perbedaan tingkat energinya.
alasan instrumenasi, hanya transisi yang berhubungan dengan proses tertentu dari atom atau molekul dan terbatas pada daerah sempit dari spektrum elektromagnetik yang digunakan.
b.1 Spektrofotometer Visibel dan Ultraviolet
Spektrofotometer adalah alat instrumen analisis yang bekerja berdasarkan prinsip kolorimetri yaitu metode yang menyatakan bahwa tua-mudanya warna tergantung pada kepekatan suatu media. Hukum yang mendasari penetapan secara spektrofotometri adalah hukum Lambert-Beer yang berbunyi: ‘Apabila suatu cahaya monokromatis melewati suatu media transparan, maka bertambah turunnya intensitas cahaya yang di pancarkan sebanding dengan bertambahnya kepekatan dan ketebalan media”.
Besarnya fraksi radiasi elektromagnetik monokromatik yang diadsorbsi oleh suatu substansi merupakan fungsi dari konsentrasi substansi dan ketebalan media.
T = I/Iо Keterangan:
T (transmittance) : Radiasi yang diteruskan I : Intensitas yang tidak diserap
Iо : Intensitas awal
Adsorbansi (A) atau kerapatan optik (OD = optikal density) merupakan logaritma dari kebalikan transmitasi,
A = log 1/T = log Io/I = ε C t
Yang dikenal sebagai hukum Lambert-Beer. Dimana ε adalah tetapan yang disebut koefisien adsorbsivitas molar (adsorbansi larutan 1 M dalam 1 cm sel), adalah konsentrasi zat yang diukur dan t adalah ketebalan media. Jadi A berbanding lurus dengan konsentrasi zat yang diukur. Hukum ini umumnya berlaku untuk konsentrasi rendah.
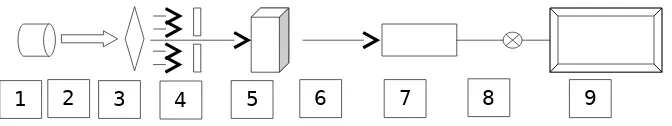
1 2 3 4 5 6 7 8 9
Komponen-komponen dasar dari spektrofotometer terdiri atas sumber radiasi, monokromator, sel tempat larutan contoh (cuvet), detektor, penguat tegangan dan alat pembaca (Gambar 6).
Gambar 6. Skema Bagian-bagian Utama Dari Spektrofotometer
Keterangan:
1. Sumber Radiasi (Lampu Katoda) 2. Sinar
3. Monokromator 4. Slit
5. Larutan Contoh (cuvet) 6. Sinar Transmisi
7. Detektor
8. Penguat Tegangan
9. Display (Alat Pembaca)
oleh aluminium yang permukaannya berlekuk-lekuk seperti gergaji, jumlah lekukan dapat mencapai 15.000 – 30.000 garis per inci (Ismail, 2001). Permukaannya dibuat mengkilat dan dilapisi resin. Banyaknya celah/saluran berkisar dari 20 saluran/nm pada infra red jauh hingga lebih dari 3600 saluran/nm untuk daerah visible dan ultraviolet (Sulaeman, 2000). Grating holografik dibuat dengan proses fotografik yang cepat, grating yang lain dibuat secara mekanik.
Cuvet yang dipakai harus memenuhi syarat-syarat diantaranya ialah
tidak berwarna, permukaannya secara optis sejajar, tahan terhadap pereaksi, tidak rapuh, mempunyai bentuk yang sederhana. Gelas yang biasa dipakai adalah plexyglass atau kwarsa. Cuvet yang digunakan di Balittanah ada yang mempunyai sistem continous flow sehingga contoh yang diperiksa bisa lebih cepat dan lebih banyak karena waktu pemeriksaan tidak terlalu lama.
Detektor harus membangkitkan sinyal yang sesuai dengan intensitas radiasi yang akan datang. Fotovoltamik merupakan detektor yang paling sederhana namun kurang peka. Alat yang lebih sensitif adalah fotometrik atau fototube hampa. Detektor yang jauh lebih peka lagi adalah fotomultipliertube yang mengandung 16 elektroda (diode) atau lebih dan diode array detektor yang terbuat dari silikon integrated circuit (ic) chips yang mengandung hingga 200 fotodiode dan kapasitor. Penguat tegangan terdiri dari penguat DC linier dan logaritmik dengan nois rendah. Untuk display dapat digunakan galvanometer, LCD, recorder dan printer.
Pada instrumen yang menggunakan prinsip double beam cahaya monokromatik dari sumber dibagi dua dengan intensitas yang sama. Berkas yang satu melewati contoh dan lainnya melalui referensi. Fasilitas ini memberikan koreksi dari efek matriks, ketidakstabilan instrumen dan arus.
Agar instrumen dapat digunakan lebih lama dalam kondisi yang baik perlu diperhatikan pemeliharaannya (Sulaeman, 2000).
Tidak menumpahkan larutan contoh mengenai alat dan bersihkan permukaan luarnya setiap digunakan.
Pada waktu membuka bagian monokromator, jangan menyentuh komponen optik yang ada sehingga merubah posisinya.
Jangan membersihkan grating dengan menyekanya. Permukaan cemin dan komponen optik lainnya dapat dibersihkan dengan kapas atau tisu yang dibasahi sedikit alkohol 70 %. Bila perlu grating dibersihkan dengan penghembus udara atau udara tekan yang kering dan bersih.
Pada waktu penggantian lampu, pegang bagian yang tidak terbuat dari gelas.
Setiap selensai pengukuran, bilas cuvet (sel) dan pipa saluran contoh (pada model continous flow) dengan air bebas ion hingga benar-benar bersih. Untuk auto analyzer ditambah dengan membilas semua saluran pipa menggunakan lampu katoda cekung yang memberikan radiasi lebih spesifik.
Apabila radiasi yang karakteristik dan transisi elektronik pada orbit terluar atom unsur tertentu melewati uap atom unsur tersebut, maka sebagian radiasi akan diserap. Radiasi terserap mengeksitasi elektron dari energi dasar ke tingkat energi lebih tinggi (tingkat eksitasi). Tingkat adsorbansi merupakan pengukuran kuantitatif konsentrasi atom energi dasar yang ada dalam uap atom. Perubahan energi yang terlibat sesuai dengan radiasi daerah UV dan
Visible dari spektrum. Oleh karena hanya atom dalam kondisi energi dasar
yang memberikan respon dalam cara ini, kondisi penguapan dan dekomposisi contoh harus menghindari ionisasi. Hal ini dicapai dengan menggunakan nyala
dengan panas yang tidak melebihi 3000 K.
dikuatkan oleh amplifier dan kemudian dibaca pada galvanometer, recorder
atau printer. Sumber radiasi lampu deuterium digunakan untuk back
correction. Monokromator mengisolasi garis emisi tertentu dari banyak garis
emisi yang dipancarkan lampu katoda. Pengukuran adsorbansi dilakukan dengan dan tanpa pemasukan larutan contoh ke dalam nyala. Dalam praktiknya adsorbsi di set pada nilai nol adsorbansi dengan larutan standar nol. Untuk menghindari gangguan emisi yang berasal dari atom yang tereksitasi dari nyala, radiasi dari lampu katoda dimodulasi (biasanya pada frekuensi 50 Hz) dan sistem pendeteksian juga diatur pada frekuensi yang sama. Untuk keperluan ini dapat pula digunakan chopper yang bekerja secara mekanik.
Fotometer nyala berfungsi seperti SSA tanpa menggunakan lampu katoda. Intensitas radiasi yang dilepaskan oleh atom yang tereksitasi oleh nyala dan kemudian kembali ke energi dasar sebanding dengan konsentrasi analit.
Untuk pemeliharaan alat dan keamanan perlu diperhatikan hal-hal sebagai berikut (Sulaeman, 2000):
Tabung gas diletakkan di luar ruangan dalam posisi tegak dan diikat. Kompresor dengan suara keras sebaiknya ditempatkan di luar ruangan.
Jaga tabung gas, regulator, dan pipa-pipa dari kebocoran, gunakan cairan penditeksi kebocoran. Tabung regulator dan pipa yang bocor harus segera diganti.
Bersihkan filter gas dan filter udara sesuai petunjuk. Periksa tabung kompresor, bila ada air segera keluarkan. Keluarkan semua udara dalam tabung kompresor setiap hari seusai jam kerja.
Cairan atau contoh yang terpercik alat segera dibersihkan. Gunakan kain atau tisu halus untuk membersihkan badan alat, bila perlu gunakan sedikit air atau larutan deterjen encer. Jangan gunakan pelarut organik.
Jalur sinar lampu katoda pada lampu dan kaca jendela jangan dipegang, bila kotor dibersihkan dengan tisu optik yang diberi sedikit alkohol.
Gunakan burner yang sesuai dengan campuran gas pembakar, burner
tekanan udara jalan, dengan hati-hati bersihkan kerak yang menempel pada celah burner menggunakan lempeng yang disediakan untuk itu.
Bila cara diatas tidak berhasil, matikan semua gas dan biarkan burner mendingin. Lepaskan kunci pengaman, kendurkan ring penguat dan keluarkan burner. Hati-hati bersihkan kerak dibagian dalam dan luar celah
burner dengan alat yang disediakan. Bila perlu burner direndam semalam
dalam larutan deterjen dan kemudian dibilas dengan air bebas ion. Keringkan burner dengan peniup udara bersih. Pasangkan kembali burner
pada tempatnya. Kencangkan ring dengan tangan hingga burner terpasang teguh dan tidak dapat diputar. Pasangkan kunci pengaman.
Bilas nebulizer dan spray chamber setiap selesai memakai alat. Pastikan pipa kapiler yang dipakai menghisap contoh terpasang dengan benar pada
nebulizer. Bila pipa tersumbat, matikan nyala dan biarkan tekanan udara
untuk jalan, gunakan kawat halus yang disediakan untuk mendorong bahan yang menyumbat.
Dianjurkan untuk membersihkan saluran pembuangan burner setiap hari setelah selesai kerja. Matikan semua gas dan listrik. Lepaskan burner dan tuangkan air melalui leher burner untuk membersihkan sisa-sisa bahan yang dapat merusak. Bersihkan liquid trap dan isi kembali dengan air bebas ion.
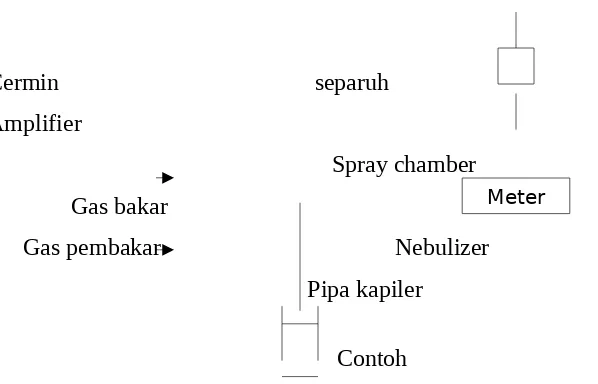
Cermin separuh dilapis
Amplifier
Spray chamber Gas bakar
Gas pembakar Nebulizer Pipa kapiler
Contoh
Gambar 7. Diagram Sederhana Spektrofotometer Serapan Atom.
c. Auto Analyzer
Pada dasarnya alat ini sama dengan spektrofotometer. Auto analyzer
adalah spektrofotometer yang ditambah fasilitas pemberian pereaksi dan pengambilan contoh secara otomatis. Pengambilan larutan contoh dilakukan dengan contoh. Pereaksi dihisap dengan pompa peristaltik kemudian dicampur menjadi satu. Diaduk dalam manifold dan kemudian dialirkan kedalam sel spektrofotometer untuk pengukuran. Hasil pengukuran direkam oleh plotter, monitor atau printer. Keunggulan auto analyzer adalah lebih cepat, hemat tenaga dan hasil pengukuran lebih konsisten. Waktu pencampuran pereksi dengan setiap contoh dan deret standar tepat sama. Hal ini penting terutama pada pembentukan warna dengan senyawa yang kurang stabil. Berikut ini adalah ilustrasi auto analyzer:
Meter
Gambar 8. Bagan Auto Analyzer
Flamefotometer merupakan instrumen yang mengukur intensitas cahaya dari warna nyala yang dihasilkan oleh suatu atom. Hukum yang mendasari penetapan secara flamefotometri adalah hukum mekanik kuantum
Niels Bohr dan hukum Planck. Dengan alat ini pengukuran dilakukan berdasarkan emisi (pancaran kembali) cahaya dari contoh yang bersangkutan. Intensitas emisi sebanding dengan jumlah analat. Proses eksitasi yang terjadi sama dengan SSA, hanya saja pada flamefotometri yang dibaca pada detektor adalah % emisi (%E) dari nyala yang dipancarkan atom pada proses eksitasi, hanya tidak terdapat sumber cahaya. Alat ini terdiri dari pengatur tekanan gas, atomizer, pembakar, system optik, dan detektor.
Selain peralatan instrumen, laboratorium kimia Balittanah dilengkapi dengan alat-alat penunjang yang sangat penting dalam membantu proses persiapan atau preparasi contoh diantaranya peralatan gelas, neraca, buret
digital, dispenser, oven, mesin pengocok, alat destruksi, pemanas listrik, alat pemusing, ruang asam, dan lain sebagainya.
III. METODE PELAKSANAAN 3.1.Tempat dan Waktu
Praktek kerja lapang ini dilaksanakan pada tnggal 01 februari 2016 sampai dengan 28 februari 2016 di Balai Penelitian Tanah Bogor yang bertempat di Jl.Tentara pelajar no 12, Bogor 16114-Jawa Barat. Telp: 0251-836757, Fax:0251-8321608, Website:balittanah@litbang.pertanian.go.id, Email:soil-ri@indo.net.id.
3.2. Alat dan Bahan
A. Alat dan Bahan Untuk Menetapkan P-metode Olsen
Alat-alat yang digunakan yaitu Botol kocok 50 mL, Timbangan, Labu Ukur 100 ml, Tabung reaksi, Erlenmayer 100 ml, Pipet 1 mL, Dispenser 20 mL, Diluter Hamiltion, Mesin Vortex (Untuk menghomogenkan sampel di tabung reaksi), Mesin pengocok untuk Botol kocok, Instrumen Spektrofotometer UV-VIS.
Bahan-bahan yang digunakan NaHCO3, P-pekta, PO4 (Titrisol 1000 ppm), Air Bebas Ion, Asam askorbat, Kertas Saring, Contoh tanah
B.Alat dan Bahan Untuk Menetapkan P-metode Bray
Alat-alat yang digunakan yaitu Dispenser 20 mL, Timbangan, Tabung reaksi, Pipet 1 mL, Vortex, Erlenmayer, Botol kocok 50 mL, Diluter hamiltion, Mesin pengocok Edmun Buhler, Instrumen Spektrofotometer UV-VIS
Bahan-bahan yang digunakan NH4F, HCL 5N, P- Pekat, Asam Askorbat, Air bebas Ion, Contoh tanah.
C.Alat dan Bahan Untuk Penetapan PKHCL
Alat-alat yang digunakan yaitu Botol kocok, Alat pengocok (shaker), Alat pemusing (centrifuge), Tabung reaksi, Dispenser 10 mL, Pipet volume, Instrumen Spektrofotometer UV-VIS, Instrumen SSA.
Bahan-bahan yang digunakan HCl 25 %, Pereaksi P pekat Pereaksi pewarna P dan contoh tanah.
3.3.Metodologi
Untuk kegiatan Analisis Tanah di Lab Kimia menggunakan Metode yang sudah ditetapkan dari Balittanah.
3.4. Pengamatan
Pengamatan yang dilakukan pada PKL yaitu pengamatan Unsur Fosfor dengan tiga metode dan K dengan satu metode , metode Fosfor dengan Olsen/Bray/dan ekstrak HCl25% sedangkan K menggunakan metode ekstrak HCl25%.
3.5. Kegiatan Praktek Kerja Lapang
IV. HASIL DAN PEMBAHASAN
4.1. Gambaran Umum Lokasi PKL
Balai Penelitian Tanah (Balittanah) merupakan lembaga penelitian yang awalnya didirikan oleh pemerintah Belanda, namun dalam perkembangannya sudah sering berganti nama dan berubah struktur organisasi serta visi dab misi dari Balittanah.
6. 1961 Lembaga Penyelidik Tanah dan Pemupukan
7. 1976 Lembaga Penelitian Tanah
8. 1981 Pusat Penelitian Tanah
9. 1990 Pusat Penelitian Tanah dan Agroklimatologi (Puslittanak)
10. 2001 Pusat Penelitian dan Pengembangan Tanah dan Agroklimat (Puslitbangtanak)
11. 2002 Balai Penelitiian Tanah (Balittanah)
Sebagai Balai Penelitian tingkat nasional, Balittanah mempunyai tugas melaksanakan penelitian untuk menghasilkan teknologi pengelolahan sumber daya tanah yang meliputi konservasi, rehabilitasi dan reklamasi tanah, kesuburan tanah dan pupuk dan biologi tanah serta melaksanakan kerjasama dan penyebar luaskan hasil-hasil penelitian.
4.1.2 Visi dan Misi Balittanah
Visi Balittanah adalah menjadi lembaga penyedia teknologi pengelolaan sumberdaya tanah yang handal dan berkelas dunia untuk mendukung sistem pertanian industrial dan pembangunan pertanian berkelanjutan.
Misi Balittanah adalah berkontribusi nyata dakam peningkatan produktivitas pertanian melalui penciptaan inovasi baru, meningkatkan efisiensi dan percepatan diseminasi teknologi, mengembangkan jaringan kerjasama nasional dan internasional, dan mengembangkan kapasitas institusi dan SDM penelitian tanah yang profesional dan berintegritas. 4.1.3 Tugas dan Fungsi Balittanah
Sebagai Balai penelitian tingkat nasional, Balittanah mempunyai tugas melaksanakan penelitian dalam bidang invetarisasi dan pengelolaan sumber daya tanah untuk mendukung pembangunan pertanian dan menjaga kelestariannya.
Balittanah menyelenggarakan fungsi:
1. Inventarisasi dan evaluasi potensi sumber daya tanah.
2. Penelitian konservasi tanah
3. Penelitian kesuburan tanah dan pemupukan
4. Penelitian biologi tanah
5. Penelitian aplikasi teknik penginderaan jauh dan sistem informasi geografi
6. Pemberian pelayanan teknis penelitian tanah serta penyebarluasan informasi dan hasil penelitian tanah
4.1.4 Stuktur Organisasi Balittanah
Balai Penelitian Tanah dipimpin oleh seorang Kepala Balai yang struktur oganisasinya terdiri dari:
1. Dua unit struktural,yaitu:
a. Bidang Tata Operasional
b. Bidang Pelayanan Penelitian
2. Unit Fungsional, unit ini terdiri dari tiga kelompok penelitian yaitu:
a. Kelompok Peneliti Kimia dan Kesuburan Tanah
b. Kelompok Peneliti Fisika dan Konservasi Tanah
c. Kelompok Peneliti Biologi dan Kesehatan Tanah
Balai Penelitian Tanah dalam melaksanakan tugasnya dipimpin oleh seorang kepala balai yang dibantu oleh subbag tata usaha, dan seksi-seksi, serta kelompok peneliti.
KIMIA dan FISIKA danKELTI BIOLOGIKELTI
4.1.5 Instalasi Laboratorium Kimia Balai Tanah
Laboratorium kimia dalam struktur organisasi Balittanah dimasukkan dalam satu bagian yang disebut instalasi. Laboratorium ini mendapat pengawasan dari atasan langsung yang bertanggung jawab kepada Kepala Balittanah. Selain analisis rutin, laboratorium kimia juga membantu proyek penelitian, serta membantu pihak yang memerlukan data analisis kimia tanah, tanaman, pupuk dan air irigasi.
1. Tugas Laboratorium Kimia, meliputi:
a. Memberikan data analisis kimia tanah untuk penelitian klasifikasi dan evaluasi tanah, serta penilaian kesuburan tanah untuk menyusun rekomendasi secara lebih rasional.
b. Memberikan data analisis tanaman yang berhubungan dengan analisis tanah yang berlokasi di rumah kaca atau di lapang.
c. Memberikan data analisis pupuk d. Menganilisis kualitas air dan irirgasi. 2. Susunan Laboratorium
Laboratorium terdiri atas ruang utama yang cukup luas, dilengkapi dengan meja laboratorium dan ruang khusus, seperti: ruang timbang, ruang asam, ruang instrumen dan ruang administrasi. Selain itu terdapat pula ruang persiapan contoh serta ruang penyimpanan bahan kimia, alat gelas dan lain-lain.
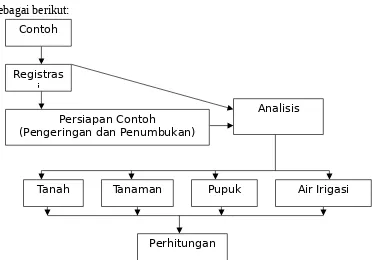
3. Jenis-jenis Analisis
Analisis tanah rutin akan dijelaskan pada bagan analisis tanah dibawah ini, yaitu:
Pengeringan
Gambar 2. Bagan Analisis Tanah Di Laboratorium Kimia Balittanah
Tahapan-tahapan kerja analisis terhadap contoh yang akan dianalisis sebagai berikut:
Gambar 3. Bagan Tahapan Kerja Analisis Laboratorium Kimia Balittanah 4.1.6 Pengawasan Hasil Analisis
Penyelesaian hasil analisis lebih dari 10.000 contoh tiap tahun merupakan proses produksi tersendiri, yang diperlukan pengawasan khusus. Untuk memudahkan pengawasan perlu mengetahui sumber-sumber yang mungkin dapat menimbulkan kesalahan.
Menyangkut semua yang berhubungan dengan keadaan kelompoknya terdiri dari 57 laboratorium di Indonesia. Balai Besar Litbang SDLP juga ikut dalam kelompok uji silang internasional yaitu IPE( International Plant Exchange) dalam hal uji silang tanaman, dan ISE (International Soil Exchange) untuk uji silang tanah yang berpusat di Belanda.
Bahan yang dianalisis
Contoh berasal dari berbagai daerah yang merupakan objek penelitian staf ataupun dari institusi lain dan perseorangan.
Metode yang digunakan di laboratorium berdasarkan SNI (Standar Sehingga diperlukan keseragaman agar diperoleh hasil yang tepat dan akurat. Tahapan persiapan contoh terdiri dari: registrasi contoh, pengeringan, penumbukan, pengayakan, dan penyimpanan ke dalam kantong plastik dalam satu baki sebagai satu seri penetapan.
Alat-alat
1.Oven berkipas angin 2. Lumpang porselen 3. Tampah
5. Kertas dan kantong plastic
Bahan Contoh tanah
Cara kerja
a. Pencatatan Contoh
1. Contoh dari lapang yang disertai dengan surat permintaan analisis yang berisi daftar contoh dan jenis analisis yang diperlukan, diterima oleh administrasi laboratorium.
2. Nomor permintaan analisis, jumlah, dan nomor contoh dicatat dalam buku administrasi.
3. Setiap contoh dibuat nomor laboratorium yang ditulis pada label karton. 4. Administrasi laboratorium membuat laporan hasil analisis yang telah
dikerjakan. Surat permintaan dan daftar hasil analisis didokumentasikan.
b. Pengeringan
1. Contoh disebarkan diatas tampah yang dialasi kertas sampul. Label karton yang berisi nomor laboratorium contoh disimpan di bawah kertas sampul tersebut.
2. Dibuang akar-akar atau sisa tanaman segar, kerikil, dan kotoran lainnya. 3. Bongkahan besar dikecilkan dengan tangan.
4. Disimpan pada rak didalam ruangan khusus bebas kontaminan yang terlindung dari sinar matahari atau dimasukkan ke dalam oven dengan suhu 40oC.
c. Penumbukan dan Pengayakan
2. Disiapkan kantong plastik dan botol contoh, kemudian diberi nomor urut, nomor laboratorium, dan nomor seri.
3. Contoh dimasukan ke dalam plastik kemudian dimasukan ke dalam botol plastik agar contoh tidak tertukar dengan yang lainnya
4. Contoh-contoh tanah dengan ukuran partikel <2 mm dan <0,5 mm disiapkan sebagai berikut:
Contoh ditumbuk pada lumpang porselen atau mesin giling untuk tanah keras dan diayak menggunakan ayakan dengan ukuran lubang 2 mm.
Disimpan dalam botol yang sudah diberi nomor contoh.
Contoh < 0,5 mm diambil dari contoh < 2 mm, digerus atau digiling dan diayak dengan ayakan 0,5 mm.
d. Penyimpanan
1.Contoh yang akan dianalisis disimpan di tempat contoh di dalam ruang timbang.
4.2 Kadar Penetapan P-tersedia metode Olsen/bray dan PK-Potensial HCl 25%
Contoh yang dianalisis berasal dari lokasi Taman Asri, Purbolinggo, Lampung Timur, Lampung. Sebelum melakukan analisis perlu dilakukan penentuan kadar air untuk menentukan nilai faktor koreksi setiap perhitungan analisis. Kadar air didapatkan dengan melakukan pemanasan hingga suhu 105oC yang bertujuan untuk menghilangkan kandungan air pada contoh. Perlakuan ini berdasar pada titik didih air yang berkisar 100oC sehingga pemanasan dengan suhu 105oC, molekul air dapat hilang dari contoh. Namun apabila contoh dilakukan pengeringan diatas 105oC, maka akan terjadi perubahan fisik dan kimia tanah. Faktor koreksi selanjutnya digunakan dalam perhitungan analisis seperti P-tersedia metode Bray/Olsen PK-cadangan dengan ekstrak HCl 25 %.
ppm dan dengan metode Olsen untuk contoh 5 sebesar 58 ppm sehingga contoh 1, 2, 3 4, 5 memiliki kandungan P sangat tinggi.
Metode Bray ditujukan untuk tanah masam dengan pH <5,5 dengan menggunakan pengekstrak NH4F yang berfungsi untuk membebaskan senyawa fosfat yang diikat oleh Al dan Fe. Pada penambahan pereaksi pewarna P akan menghasilkan larutan berwarna biru dimana semakin biru warna larutan maka konsentrasi fosfor dalam larutan semakin tinggi karena adanya reaksi dari ion ortofosfat dalam larutan. Fosfat dalam suasana asam akan diikat sebagai garam H2PO4- (ortofosfat) yang bereaksi dengan NH4F dan HCl dan akan dibebaskan sebagai PO43-. Ion fosfat dalam bentuk ekstrak akan bereaksi dengan amonium molibdat yang akan direduksi oleh asam askorbat menghasilkan warna biru menggunakan pengekstrak NaHCO3 yang berfungsi untuk mengendapkan Ca dan Mg sehingga ion PO43- dapat terlepas. Fosfat dalam suasana alkali dalam tanah akan terikat sebagai HPO42-. Dengan menggunakan pengekstrak NaHCO3 dengan pH 8,5 maka akan terjadi pertukaran kation sehingga membentuk PO43-. Anion fosfat dalam ekstrak bereaksi dengan amonium molibdat dalam suasana asam membentuk asam fosmomolibdat, selanjutnya direduksi oleh asam askorbat membentuk warna biru mobildat (Prijono dan Kusuma, 2012).
HPO42- + NaHCO3 PO43- + H2O + CO2 + Na+ PO43- + 12MoO42- + 27H+ H7 (P(Mo2O7)6) + 10H2O H7 (P(Mo2O7)6) + Vit.C Biru molibden
4.2.2 Penetapan PK-HCl 25 %
menggunakan metode HCl 25 % dengan prinsip melarutkan semua bentuk senyawa fosfat hingga mendekati kadar fosfat total tanah. Pengekstrak HCl 25 % akan merusak matriks tanah dan melarutkan bentuk-bentuk senyawa fosfat mendekati kadar P total. Ion fosfat dalam ekstrak akan bereaksi dengan amonium molibdat dalam suasana asam membentuk asam fosfomolibdat yang akan bereaksi dengan asam askorbat menghasilkan larutan berwarna biru.
Ca-P
Fe-P + HCl PO43- + Al3++ Ca2+ + Fe3+ +Cl- Al-P
PO43- + 12MoO42-27H+ H7 (P(Mo2O7)6) +10 H2O H7 (P(Mo2O7)6) + C6H8O6 biru molibdat
Berdasarkan analisis, didapat kadar fosfor cadangan ekstrak HCl 25 % pada contoh 1, 2, 3, 4, 5 berturut-turut sebesar 24 mg/100g ; 26 mg/100g ; 26 mg/100g ; 48 mg/100g ; 19 mg/100g menunjukkan bahwa pada contoh 1 ,2, 3 memiliki kadar fosfor sedang, pada contoh 4 memiliki kadar fosfor tinggi, dan pada contoh 5 memiliki kadar fosfor rendah.
Seperti halnya fosfor, kalium potensial/cadangan ditetapkan sebagai K2O dilakukan dengan menggunakan ekstrak HCl 25 %. Penentuan K cadangan menggunkan metode HCl 25 % dengan prinsip melarutkan semua bentuk senyawa kalium hingga mendekati kadar kalium total tanah. Pengekstrak HCl 25 % akan merusak matriks tanah dan melarutkan bentuk-bentuk senyawa kalium mendekati kadar K total. k.a K + HCl k.a H + K+ + Cl
-K+ K K + e
V. KESIMPULAN DAN SARAN 5.1.Kesimpulan
Penetapan kadar fosfor tersedia dengan metode Bray untuk contoh 1, 2, 3, 4 berturut-turut sebesar 57, 49, 66, 104 ppm dan dengan metode Olsen untuk contoh 5 sebesar 58 ppm sehingga contoh 1, 2, 3, 4, 5 memiliki kandungan P sangat tinggi.
Penetapan kadar fosfor cadangan pada contoh 1, 2, 3, 4, 5 berturut-turut sebesar 24 mg/100g ; 26 mg/100g ; 26 mg/100g ; 48 mg/100g ; 19 mg/100g menunjukkan bahwa pada contoh 1, 2, 3 memiliki kadar fosfor sedang, pada contoh 4 memiliki kadar fosfor tinggi, dan pada contoh 5 memiliki kadar fosfor rendah.
Penetapan kalium pada contoh 1, 2, 3, 4, 5 berturut-turut sebesar 4 mg/100g ; 7 mg/100g ; 6 mg/100g ; 12 mg/100g ; 4 mg/100g yang menunjukkan bahwa pada contoh 1,2,3,5 memiliki kadar kalium cadangan sangat rendah, sedangkan pada contoh 4 memiliki kadar kalium cadangan rendah.
5.2. Saran
DAFTAR PUSTAKA
Adhi, I. 2008. Dasar Masalah dan Penilaian Uji Tanah. Bogor: Lembaga Penelitian Tanah
Leiwakabessy, F.M. 2002. Bahan Kuliah Kesuburan Tanah. Bogor: Institut Pertanian Bogor.
Soepartini,M. 1978. Diktat Kimia Tanah. Lembaga Penelitian Tanah. Bogor
Krisnandi,Ismail. 2004. Pengantar Analisis Instrumental. Sekolah Menengah Analisis Kimia Bogor. Bogor
Madjid, A. 2009. Dasar-Dasar Ilmu Tanah. Bahan Ajar Online. Palembang: Universitas Sriwijaya
Adhi, I. 2008. Dasar Masalah dan Penilaian Uji Tanah. Bogor: Lembaga Penelitian Tanah
LAMPIRAN
Lampiran Daftar Penilaian Angka-angka Hasil Analisis Tanah
Nilai Sangat
Renda h
Renda h
Sedang Agak
Tinggi
Tinggi Sangat Tinggi
pH H2O 4,5 4,5 –
5,5
5,6 – 6,5 6,6 – 7,5
Lampiran Perhitungan Analisis Kimia tanah
1. Perhitungan Kadar Air Bobot contoh = 5 g
Bobot pinggan + contoh awal = 34,3330 g
Bobot pinggan + contoh setelah pengeringan = 29,6214 g
Kadar air = Bobot contoh yang hilang x 100%
142/190 = faktor konversi dari pentuk PO4 menjadi P2O5
0 5 10 15 20 25
Kurva Deret Standar P-Tersedia Metode Bray
Linear ()
ppm blanko = (Abs contoh – intercept) Slope
= (0 – 2,6894) 43,4488
= -0,061898
3. Penentuan P-Tersedia Metode Olsen V ekstrak = 20 ml
Abs contoh = 314 fk = 1,0612
Bobot contoh = 1 g
142/190 = faktor konversi dari pentuk PO4 menjadi P2O5
Std 0 2 4 8 12 16 20
Kurva Deret Standar P-Tersedia Metode Olsen
Linear ()
ppm blanko = (Abs contoh – intercept) Slope
= (0 – 2,9300) 39,7176
= -0,073771
Kadar P2O5 = ppm kurva x V ekstrak x 1000 g x 142/190x fp x fk
4. Penentuan P Potensial Ekstrak HCl 25 % V ekstrak = 10 ml
Abs contoh = 66 fp = 20 x
fk = 1,0612
Bobot contoh= 2 g
142/190 = faktor konversi dari pentuk PO4 menjadi P205
Std 0 4 8 16 24 32 40
Kurva Deret Standar P-HCl 25 %
= 2,8816074
ppm blanko = (Abs contoh – intercept) Slope
= (0 – 1,9727) 22,2193
= -0,088783
ppm kurva = ppm contoh – ppm blanko = 2,8816074 – (-0,088783) = 2,9703906
Kadar P2O5 = ppm kurva x V ekstrak x 100 g x 142/190 x fp x fk 1000 ml x bobot contoh
= 2,9703906x 10 x 100 x 142/190 x 20 x 1,0612 1000 x 2
= 23,558387 mg/100 g = 24 mg/100 g
5. Penentuan K-Potensial Ekstrak HCl 25 % V ekstrak = 10 ml
Abs contoh = 173 fp = 20 x
fk = 1,0612
Bobot contoh = 2 g
94/78 = faktor konversi dri bentuk K menkadi K2O
Std 0 1,5 3 6 9 12 15
0 5 10 15 20 25
Kurva Deret Standar K-HCl 25 %
Linear ()
ppm blanko = (Abs contoh – intercept) Slope
= (0 – 80,9010) 569,9636 = -0,141941
Lampiran 1. Kegiatan Praktek Kerja Lapang
Jadwal Kerja Praktek Kerja Lapang di PT. Asam Jawa no Hari/tanggal Kegiatan
1
2 Senin/Rabu 1-3 february
Ditugaskan pada penetapan Tekstur yang didampingi analis pak iwan
Ditugaskan pada Penetapan P-Olsen/Bray yang didampingi oleh analis pak Maulana Yusuf
6 Jum’at/selasa 12, 15,16 february
Ditugaskan pada penetapan NTK dan KTK yang didampingi oleh analisnya
Ditugaskan pada penetapan PK-Cadangan HCl 25% yang didampingi oleh analis pak Yadi
9 Rabu/kamis 24-25
Lampiran 2. Jurnal Harian PKL
JURNAL HARIAN PKL
Nama : Nama Mahasiswa
NIM : 12324234
Hari / Tanggal : Senin, 01 Februari 2016
No
. Kegiatan
1. Lembar ini diisi setiap hari dengan tulis tangan dan ditandatangani oleh pembimbing lapangan
Lampiran 3. Photo-Photo Kegiatan
1. Kegiatan Pada saat melakukan pekerjaan bersama para analis
a.Saat Penimbangan Sampel Tanah b.Saat Menambahkan Pengekstrak
e. Saat melakukan Pemipetan f. Saat melakukan penghomogenan
2.Foto Alat pengukur Fosfor dan Kalium