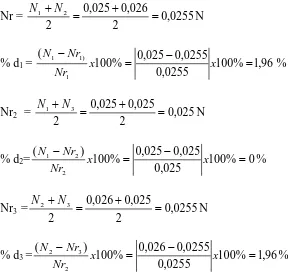1
PENENTUAN KADAR PROTEIN DAN NON PROTEIN
NITROGEN PADA JANGKRIK DAN HASIL OLAHANNYA
DENGAN METODE KJELDAHL
SKRIPSI
OLEH
NOVARIANTI MARBUN
NIM : 091524068
PROGRAM EKSTENSI JURUSAN FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2
PENENTUAN KADAR PROTEIN DAN NON PROTEIN
NITROGEN PADA JANGKRIK DAN HASIL OLAHANNYA
DENGAN METODE KJELDAHL
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH
NOVARIANTI MARBUN NIM : 091524068
PROGRAM EKSTENSI JURUSAN FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
3 Pembimbing II,
(Drs. Immanuel Meliala, M.Si., Apt.) NIP 195001261983031002
LEMBAR PENGESAHAN
PENENTUAN KADAR PROTEIN DAN NON PROTEIN NITROGEN PADA JANGKRIK DAN HASIL OLAHANNYA DENGAN METODE
KJELDAHL
OLEH
NOVARIANTI MARBUN NIM : 091524068
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara
Pada Tanggal : Juni 2011
Medan, Juni 2011 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
(Prof. Dr. Sumadio Hadisahputra., Apt.) NIP. 195311281983031002 Pembimbing I,
(Dra. Masria Lasma Tambunan, M.Si.,Apt.) NIP 19500598197722001
Panitia Penguji,
(Dr. Ginda Haro, M.Sc., Apt.) NIP 195108161980031002
(Dra. Masria Lasma Tambunan, M.Si., Apt.) NIP 195005081977022001
(Drs. Fathur Rahman Harun, M.Si., Apt.) NIP 195201041980031002
4
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan rahmat kasih dan karunianya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul ”Penentuan Kadar Protein dan Non Protein Nitrogen pada Jangkrik dan Hasil Olahannya”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Terimakasih dan penghargaan yang tulus kepada Ayahanda dan Ibunda tercinta, Drs. J. Marbun dan T. Naibaho, yang tiada pernah ada hentinya berkorban dengan tulus ikhlas bagi kesuksesan penulis, juga kepada Abangku Josua Tambun, S.Si serta teman-teman Extensi Farmasi Angkatan 2009/2010 khususnya Santaria Sinaga, Eva Solina, Puspa Utary, Maria Silitonga yang selalu setia memberi doa, dorongan dan semangat.
Pada kesempatan ini penulis juga mengucapkan terima kasih yang tulus dan ikhlas kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan.
5
3. Dra. Masria Lasma Tambunan, M.Si, Apt. dan Drs. Immanuel S. Meliala, M.Si, Apt. selaku pembimbing yang telah memberikan waktu, bimbingan, dan nasehat selama penelitian hingga selesainya penyusunan skripsi ini.
4. Bapak Dr. Ginda Haro, M.Sc., Apt., Ibu Dra. Masria Lasma Tambunan, M.Si., Apt., Bapak Drs. Fathur Rahman Harun, M.Si., Apt dan Ibu Dra. Siti Nurbaya, Apt. selaku dosen penguji yang telah memberikan kritik, saran, dan arahan kepada penulis dalam menyelesaikan skripsi ini.
5. Ibu kepala Laboratorium Teknologi Pangan Fakultas Pertanian Dr. Ir. Herla Rusmarilin, MS., serta staff yang telah membimbing dan memberikan fasilitas serta petunjuk selama penelitian.
6. Sahabat-sahabatku PP GKPI Ressort Khusus Perumnas Mandala II Medan, serta rekan-rekan farmasi extensi stambuk 2009, senior dan junior mahasiswa fakultas farmasi, serta kawan-kawan yang tidak dapat disebutkan satu persatu yang memberi bantuan, dukungan, motivasi, dan inspirasi selama masa perkuliahan hingga selesainya penulisan skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk penyempurnaannya. Harapan saya semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan kefarmasian.
Medan, Mei 2011
Penulis
6
PENENTUAN KADAR PROTEIN DAN NON PROTEIN NITROGEN PADA JANGKRIK DAN HASIL OLAHANNYA DENGAN METODE
KJELDAHL
ABSTRAK
Jangkrik merupakan salah satu serangga yang bermanfaat karena dapat dimakan sebagai makanan sumber protein. Dengan adanya proses pengolahan dengan penggorengan dan perebusan maka akan mempengaruhi protein yang dikandungnya. Penelitian ini bertujuan untuk mengetahui kadar protein dalam jangkrik segar dan pengaruh perlakuan cara pengolahan terhadap kadar proteinnya. Sampel jangkrik diperoleh dari pasar tradisonal Putri Hijau. Penentuan kadar protein dan NPN pada sampel jangkrik dilakukan sebelum dan sesudah digoreng dan direbus. Metode yang dilakukan dengan metode Kjeldahl. Hasil penentuan kadar protein dan NPN pada jangkrik segar dan hasil olahannya dengan metode Kjeldahl secara berturut-turut adalah : Jangkrik segar : protein kasar 13,7292 %, protein murni 8,1107 % dan NPN 40,92 %. Jangkrik goreng : protein kasar berkurang menjadi 10,465 %, protein murni menjadi 5,7321 % dan NPN bertambah menjadi 45,22 %. Jangkrik rebus : protein kasar semakin menurun menjadi 6,1262 %, protein murni menjadi 2,815 % dan NPN bertambah besar menjadi 54,04 %. Kadar protein pada jangkrik rebus paling kecil dibanding jangkrik goreng dan jangkrik segar tetapi NPN-nya paling besar.
7
DETERMINING PROTEIN CONTENT AND NPN IN CRICKET AND ITS PROCESSING RESULT WITH
KJELDAHL METHOD
ABSTRAK
Cricket is one of the beneficial insect that can be eaten as a source of protein. With this frying and boiling process, it will affect the protein contains. This study aims to find out for protein in fresh cricket and the effect of treatments on levels of protein processing. Sample of cricket obtained from traditional market Putri Hijau. Determination of protein content and NPN on cricket’s sample taken before and after being fried and boiled. The method performed by the Kjeldahl method. The result of the determination of protein content and NPN in fresh cricket and processed product with Kjeldahl method respectly are : Fresh cricket : crude protein 13,7292 %, pure protein 8,1107 % and NPN 40,92 %. Fried cricket : crude protein is recuded to 10,465 %, a purified protein 5,7321 % and NPN increased to 45,22 %. Boiled cricket : crude protein declined to be 6,1262 %, a pure protein 2,815 % and NPN grows to 54,04 %. Contain of protein on boiled cricket is smallest than fried cricket and fresh cricket but its NPN is the biggest one.
8 DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 2
1.4 Tujuan Penelitian ... 2
1.5 Manfaat Penelitian... 2
BAB II. TINJAUAN PUSTAKA ... 3
2.1 Protein dan Non Protein Nitrogen ... 3
2.2 Asam amino ... 6
2.3 Sruktur protein ... 9
2.4 Nilai Gizi protein... 10
2.5 Pengaruh Pengolahan Terhadap Protein ... 10
9
2.7 Analisis Protein ... 12
2.8 Jangkrik Brachytrupes portentosus ... 17
BAB III. METODOLOGI PERCOBAAN... 18
3.1 Alat yang digunakan ... . 18
3.2 Bahan yang digunakan... 18
3.3 Sampel...18
3.3.1 Pengambilan Sampel ... 18
3.3.2 Pengolahan Sampel ... 18
3.4 Lokasi Penelitian ... 19
3.5 Pembuatan Pereaksi ... . 19
3.6 Pembakuan NaOH 0,02 N ... ... 20
3.7 Penentuan Kadar Air... .... 20
3.8 Pemeriksaan Kualitatif... ... 20
3.9 Prosedur Penentuan Kadar... ... 21
3.9.1Pemisahan Protein dari NPN... .... 21
3.9.2 Penentuan Kadar protein Murni... ... 22
3.9.3 Penentuan Kadar Non Protein Nitrogen... ... 22
BAB IV. HASIL DAN PEMBAHASAN ... 23
4.1 Pemeriksaan Kualitatif ... 23
4.2 Pemeriksaan Kadar Protein dan NPN...23
BAB V. KESIMPULAN DAN SARAN ... 25
5.1 Kesimpulan ... 25
5.2 Saran ... 25
10
DAFTAR TABEL
Halaman
Tabel 1. Daftar Kadar Protein Beberapa Bahan Makanan ... 11
Tabel 2. Kebutuhan Protein Menurut WHO ... 12
Tabel 3. Data Hasil Kadar N-total, N-protein dan NPN ... 23
Tabel 4. Data Mentah Protein Jangkrik Segar... 31
Tabel 4. Data Mentah Protein Jangkrik Goreng... 32
11
DAFTAR GAMBAR
Halaman
Gambar 1.1 Pentapeptida... 8
Gambar 1.2 Rantai Polipeptida... 8
Gambar 1.3 Struktur Primer, Sekunder, Tersier, Kuartener... 10
Gambar 1. Sampel Jangkrik Taiwan ... 46
Gambar 2. Lokasi Penelitian ... 46
Gambar 3. Hasil Uji Kualitatif Protein. ... 47
Gambar 4. Proses Destruksi Protein ... 47
Gambar 5. Proses Destilasi Protein... 48
12
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Penetapan Kadar Protein Jangkrik
dengan Metode Kjeldhal... 28
Lampiran 2. Perhitungan Pembakuan Natrium Hidroksida 0,02 N... 29
Lampiran 3. Data Mentah Hasil Penelitian... 31
Lampiran 4. Perhitungan Kadar Protein Kasar Jangkrik Segar... 34
Lampiran 5. Perhitungan Kadar Protein Kasar Jangkrik Goreng... 36
Lampiran 6. Perhitungan Kadar Protein Kasar Jangkrik Rebus ... 38
Lampiran 7. Perhitungan Kadar Protein Murni Jangkrik Segar... 40
Lampiran 8. Perhitungan Kadar Protein Murni Jangkrik Goreng... 42
Lampiran 9. Perhitungan Kadar Protein Murni Jangkrik Rebus... 44
Lampiran 10. Surat Keterangan dari LIPI Bogor... 45
6
PENENTUAN KADAR PROTEIN DAN NON PROTEIN NITROGEN PADA JANGKRIK DAN HASIL OLAHANNYA DENGAN METODE
KJELDAHL
ABSTRAK
Jangkrik merupakan salah satu serangga yang bermanfaat karena dapat dimakan sebagai makanan sumber protein. Dengan adanya proses pengolahan dengan penggorengan dan perebusan maka akan mempengaruhi protein yang dikandungnya. Penelitian ini bertujuan untuk mengetahui kadar protein dalam jangkrik segar dan pengaruh perlakuan cara pengolahan terhadap kadar proteinnya. Sampel jangkrik diperoleh dari pasar tradisonal Putri Hijau. Penentuan kadar protein dan NPN pada sampel jangkrik dilakukan sebelum dan sesudah digoreng dan direbus. Metode yang dilakukan dengan metode Kjeldahl. Hasil penentuan kadar protein dan NPN pada jangkrik segar dan hasil olahannya dengan metode Kjeldahl secara berturut-turut adalah : Jangkrik segar : protein kasar 13,7292 %, protein murni 8,1107 % dan NPN 40,92 %. Jangkrik goreng : protein kasar berkurang menjadi 10,465 %, protein murni menjadi 5,7321 % dan NPN bertambah menjadi 45,22 %. Jangkrik rebus : protein kasar semakin menurun menjadi 6,1262 %, protein murni menjadi 2,815 % dan NPN bertambah besar menjadi 54,04 %. Kadar protein pada jangkrik rebus paling kecil dibanding jangkrik goreng dan jangkrik segar tetapi NPN-nya paling besar.
7
DETERMINING PROTEIN CONTENT AND NPN IN CRICKET AND ITS PROCESSING RESULT WITH
KJELDAHL METHOD
ABSTRAK
Cricket is one of the beneficial insect that can be eaten as a source of protein. With this frying and boiling process, it will affect the protein contains. This study aims to find out for protein in fresh cricket and the effect of treatments on levels of protein processing. Sample of cricket obtained from traditional market Putri Hijau. Determination of protein content and NPN on cricket’s sample taken before and after being fried and boiled. The method performed by the Kjeldahl method. The result of the determination of protein content and NPN in fresh cricket and processed product with Kjeldahl method respectly are : Fresh cricket : crude protein 13,7292 %, pure protein 8,1107 % and NPN 40,92 %. Fried cricket : crude protein is recuded to 10,465 %, a purified protein 5,7321 % and NPN increased to 45,22 %. Boiled cricket : crude protein declined to be 6,1262 %, a pure protein 2,815 % and NPN grows to 54,04 %. Contain of protein on boiled cricket is smallest than fried cricket and fresh cricket but its NPN is the biggest one.
13 BAB I
PENDAHULUAN
1.1 Latar Belakang
Salah satu jenis serangga yang menarik adalah jangkrik, merupakan ordo Orthoptera. Siklus hidup jangkrik : telur-nimpha-dewasa. Ditemukan dirumah-rumah, sisa tanaman yang masih lembab (jerami), dipertanaman kopi, teh, dan ketela pohon (Lilies, 1991).
Di Indonesia tercatat ada 123 jenis jangkrik yang tersebar di pelosok daerah. Salah satu jenis jangkrik yaitu jangkrik kebun (Gryllinae). Jangkrik kebun merupakan jangkrik yang umum dibudidayakan (Paimin, 1999). Jangkrik ada dua yakni : yang dibudidayakan dan jangkrik liar. Penelitian yang akan dilakukan menggunakan sampel jangkrik liar yang ditangkap dari alam.
Dari hasil identifikasi melalui LIPI BOGOR jenis jangkrik kebun yang akan diteliti adalah Brachytrupes portentosus lichtenstein (jangkrik Taiwan), dimana diduga mengandung protein tinggi. Kata protein berasal dari proteos yang berarti utama atau pertama. Protein merupakan komponen penting utama sel hewan atau manusia. Fungsi utamanya sebagai struktur pembangun sel/jaringan tubuh (Poedjiadi, 1994).
14
protein dalam jangkrik dan pengaruh perlakuan cara pengolahan terhadap kadar proteinnya. Pengambilan sampel dilakukan secara purposive sampling. Pada penelitian ini uji kualitatif digunakan Uji Biuret dan Xanthoprotein, sedangkan uji kuantitatif menggunakan metode Kjeldhal untuk mengetahui kadar protein pada jangkrik segar, goreng dan rebus.
1.2Perumusan Masalah
- Berapakah kadar protein pada jangkrik Taiwan
- Bagaimana pengaruh pengolahan terhadap kadar protein dan NPN (Non Protein Nitrogen) pada jangkrik Taiwan
1.3Hipotesa
- Kadar protein pada jangkrik Taiwan hampir sama dengan makanan laut - Pengolahan terhadap jangkrik Taiwan mempengaruhi kadar protein dan NPN (Non Protein Nitrogen)nya
1.4 Tujuan penelitian
- Untuk mengetahui sejumlah kandungan protein dan NPN pada jangkrik Taiwan
- Untuk mengetahui pengaruh pengolahan terhadap kadar protein dan NPN (Non Protein Nitrogen) pada jangkrik Taiwan
1.5Manfaat penelitian
15 BAB II
TINJAUAN PUSTAKA
2.1 Protein dan Non Protein Nitrogen
Dalam jaringan hidup, nitrogen terdapat sebagai protein dalam jumlah relatif besar dan sebagai non protein nitrogen (NPN) dalam jumlah relatif kecil. Protein adalah biopolimer asam amino yang bergabung melalui ikatan peptida, yaitu ikatan antara gugus karboksil dari satu asam amino dengan gugus amino dari asam amino disampingnya. NPN yang terdiri dari senyawa-senyawa nitrogen seperti asam amino bebas, alkaloid, vitamin, nitrat, dsb. Selama proses pengolahan bahan makanan, protein dapat terurai menjadi NPN berupa senyawa peptida, asam amino bahkan menjadi amonia, tergantung pada cara pengolahan yang diterapkan (Silalahi, 1994). Biasanya protein mengandung 100-1000 molekul asam amino dan mempunyai berat molekul 16000-1.0000.0000. Komposisi dasar dari protein sekitar 55 % karbon, 7 % hidrogen, 23 % oksigen, 16 % nitrogen, 1 % sulfur dan kurang dari 1 % fosfor. Protein dapat digolongkan menurut struktur susunan molekulnya, larutannya, adanya senyawa lain dalam molekul, tingkat degradasinya dan fungsinya (Winarno, 1984 ; Tarigan, 1983). Protein memegang peran penting dalam hampir semua proses biologi. Peran dan aktivitas protein terlihat dalam contoh berikut ini :
a. Katalis enzimatik
16
bersifat sederhana, sedangkan reaksi lainnya seperti replikasi kromosom sangat rumit. Enzim ini mempunyai daya katalitik yang besar, umumnya meningkatkan kecepatan reaksi sampai jutaan kali. Fakta menunjukkan bahwa hampir semua enzim yang diketahui adalah protein. Jadi protein merupakan pusat dalam menetapkan pola transformasi kimia dalam sistem biologis.
b. Pengangkutan dan penyimpanan
Berbagai molekul kecil dan ion ditransport oleh protein spesifik. Misalnya transport oksigen dalam eritrosit oleh hemoglobin, dan mioglobin suatu protein sejenis mentransport oksigen dalam otot. Besi dalam plasma darah terikat pada transferin dan disimpan dalam hati dalam bentuk kompleks dengan feritin.
c. Koordinasi gerak
Protein merupakan komponen utama dalam otot. Kontraksi otot berlangsung akibat pergeseran 2 jenis filamen protein.
d. Penunjang mekanis
Ketegangan kulit dan tulang disebabkan oleh adanya kolagen yang merupakan protein fibrosa.
e. Proteksi imun
Antibodi merupakan protein yang sangat spesifik dan dapat mengenal benda asing seperti virus, bakteri, dan sel yang berasal dari organisme lain.
f. Membangkitkan dan menghantar impuls saraf
17
seperti asetilkolin, berperan dalam transmisi impuls saraf pada sinap yang menghubungkan sel-sel saraf.
g. Pengaturan pertumbuhan dan difrensiasi
Pengaturan urutan ekspresi informasi genetik sangat penting bagi pertumbuhan yang beraturan serta difrensiasi sel. Pada organisme tingkat tinggi,pertumbuhan dan difrensiasi diatur oleh protein faktor pertumbuhan (Styrer, 2000).
Protein kasar (crude protein) adalah kandungan protein dalam bahan makanan yang didapat dengan mengalikan kandungan nitrogennya dengan faktor konversi yaitu 6,25 menggunakan metode Kjeldahl. Protein kasar tidak hanya mengandung
true protein saja tetapi juga mengandung nitrogen yang bukan berasal dari protein
(non protein nitrogen). Nilai gizi protein adalah kemampuan protein untuk memenuhi kebutuhan asam amino yang diperlukan (Silalahi, 1994).
NPN merupakan senyawa bukan protein yang mengandung nitrogen seperti asam amino bebas, asam nukleat, amonia, urea, trimetilamina (TMA) , dimetilamina (DMA), nitrat dll. Asam amino bebas yang terdapat dalam jaringan hidup merupakan hasil residu dari sintesis protein yang kemungkinan hasil degradasi dari protein. Sedangkan dari asam amino bebas ini dapat terbentuk senyawa-senyawa NPN lainnya merupakan hasil deaminasi atau dekarboksilasi dari asam amino bebas, yang dikatalis oleh enzim-enzim tertentu (Silalahi, 1994).
18
protease, yang termasuk kedalam kelompok enzim yang disebut hirolase. Enzim-enzim proteolitik dikeluarkan dalam cairan lambung. Masuknya protein kedalam perut menstimulasi pelepasan hormon gastrin, yang kemudian menyebabkan pelepasan asam hidroklorat. Asam hidroklorat dalam pencernaan berfungsi menurunkan pH kandungan perut sampai pH 2 yang membunuh sebagian besar mikroorganisme dan mendenaturasi protein, sehingga membuat ikatan peptidanya lebih mudah untuk hidrolisis enzimatik (Ngili, 2009).
Protein yang merupakan suatu biopolimer heterogen dari molekul menjadi asam amino, dapat terhidrolisa atau terurai menjadi komponen – komponen yang lebih kecil, dengan pemanasan dalam larutan asam kuat seperti HCl, atau dalam larutan alkali seperti NaOH, juga oleh beberapa jenis enzim yang disebut dengan enzim proteolitik (Sudarmadji, 1989).
2.2 Asam amino
Asam amino merupakan unit dasar struktur protein. Suatu asam amino alfa terdiri dari gugus amino, gugus karboksil, atom H dan gugus R tertentu, yang semuanya
terikat pada atom karbon α. Gugus R menyatakan rantai samping.
Struktur umum dari asam amino dapat dilihat pada gambar di bawah ini :
Gugus karboksil dan gugus amin yang terikat pada karbon α dapat mnegionisasi.
19
gugus amin bermuatan positif yang bersifat basa. Dengan adanya dua gugus dengan muatan yang berbeda tersebut, maka asam amino disebut bersifat amfoter, artinya dapat bersifat asam maupun basa. Sifat asam atau basa inidipengaruhi pH lingkungannya (Kusnandar, 2010).
Apabila asam amino dalam keadaan basa, maka asam amino akan terdapat dalam bentuk (I) karena konsentrasi ion OH− yang tinggi mampu mengikat ion-ion H+ pada gugus NH3+. Sebaliknya bila dalam keadaan asam, maka konsentrasi ion H+ yang tinggi mampu berikatan dengan ion −COO − sehingga terbentuk gugus – COOH maka asam amino akan terdapat dalam bentuk (II) (Poedjiadi, 1994)
(Poedjiadi, 1994)
Semua protein pada semua spesies mulai dari bakteri sampai manusia dibentuk dari 20 asam amino. Keanekaragaman fungsi yang diperantarai oleh protein dimungkinkan oleh keragaman susunan yang dapat dibuat dari 20 jenis asam amino ini sebagai unsur pembangun (Stryer, 2000).
Banyak asam amino yang berikatan melalui ikatan peptida membentuk
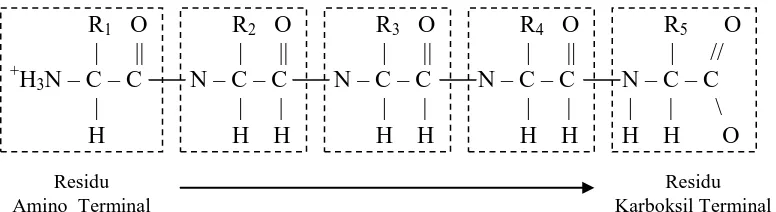
rantai polipeptida bercabang (Gambar 1.1). Satu unit asam amino dalam rantai
20
karboksil-α. Ujung amino diletakkan pada awal rantai polipeptida, berarti urutan asam amino dalam rantai polipeptida ditulis dengan diawali oleh residu amino-terminal (Styrer, 2000).
Gambar 1.1 Pentapeptida. Residu asam amino terdapat dalam kotak. Rantai dimulai pada ujung amino (Styrer, 2000).
Rantai polipeptida dibentuk dari rantai utama yang berulang secara teratur dan rantai samping tertentu (R1, R2, R3) (Gambar 1.2). Kebanyakan polipeptida di alam mengandung antara 50-2000 residu asam amino. Berat molekul rata-rata residu asam amino adalah 110 (Styrer, 2000).
Gambar 1.2 Rantai Polipeptida (Styrer, 2000).
Urutan asam amino sangat penting. Peranan urutan asam amino dapat terlihat sebagai berikut : sangat membantu untuk menjelaskan mekanisme kerja protein, hubungan urutan asam amino dan struktur 3 dimensi protein mengungkapkan hubungan antara pesan genetik DNA yang menentukan fungsi biologis protein tersebut, perubahan urutan asam amino dapat mengakibatkan gangguan fungsi protein dan menimbulkan penyakit, urutan asam amino dalam protein banyak mengungkapkan proses sejarah evolusi (Ngili, 2009).
R1 O
Amino Terminal
Residu Karboksil Terminal
21 2.3 Struktur Protein
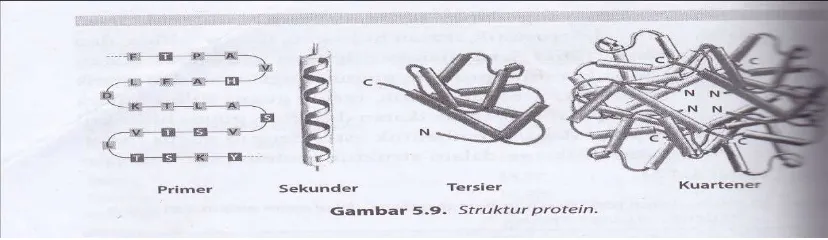
Protein merupakan makromolekul dengan struktur yang berbeda. Adanya ikatan-ikatan kimia yang terbentuk antar gugus fungsional asam amino maka protein dapat membentuk struktur primer, sekunder, tersier dan kuartener.
- Struktur primer adalah struktur dasar dari protein. Struktur primer protein
menentukan identitas, mengatur struktur sekunder, tersier, dan kuartener. Struktur primer protein dibentuk oleh ikatan peptida yang menghubungkan asam amino penyusun protein.
- Struktur sekunder protein terbentuk oleh adanya ikatan hidrogen antar
asam amino dalam rantai protein sehingga strukturnya tidak lurus, melainkan bentuk coil. Ikatan hidrogen terutama terjadi pada asam amino yang memiliki gugus hidroksil, amida dan fenol.
- Struktur tersier. Dengan adanya ikatan antar asam amino-ikatan hidrogen,
interaksi hidrofobik, jembatan garam, interaksi elektrostatik dan jembatan sulfida pada struktur molekul protein sehingga terbentuk struktur tersier.
- Struktur kuartener terbentuk oleh adanya interaksi antar beberapa rantai
molekul protein yang berbeda melalui ikatan hidrogen, interaksi hidrofobik, interaksi elektrostatik, dan jembatan sulfida. Struktur kolagen dan insulin membentuk struktur kuartener.
22
Gambar 1.3 Struktur primer, sekunder, tersier dan kuartener dari protein 2.4 Nilai Gizi Protein
Kalau susunan asam amino jumlah dan jenisnya di dalam protein makanan sama dengan susunan yang diperlukan tubuh untuk sintesa protein tubuh, maka semua asam amino protein makanan tersebut akan dipergunakan, sehingga efisisensi penggunaannya menjadi 100 %. Bila ada satu atau lebih asam amino essensial mempunyai kwantum yang lebih rendah dari yang diperlukan unutk sintesa protein tubuh, maka hanya sebagian saja dari seluruh asam amino essensial makanan tersebut dapat dipergunakan, sehingga efisiensi penggunaan protein makanan tersebut lebih rendah dari 100 %. Jadi persentase penggunaan protein makanan (kualitas protein makanan) ditentukan oleh ada atau tidaknya semua jenis asam amino essensial di dalam makanan tersebut mencukupi kebutuhan untuk sintesa protein tubuh (Djaeni, 2008).
2.5 Pengaruh Pengolahan terhadap Protein
23
Pada bahan makanan yang difermentasi, terjadi perubahan protein menjadi komponen yang lebih kecil oleh adanya enzim yang bekerja pada bahan makanan tersebut, baik yang berasal dari mikroba atau dari bahan makanan itu sendiri. Beberapa faktor yang mempengaruhi hasil peruraian protein seperti sifat-sifat asal bahan pangan itu sendiri, jenis mikroba yang tumbuh selama fermentasi, kondisi fermentasi dan lamanya waktu fermentasi (Winarno, 1980).
2.6 Sumber Protein
Dalam kualifikasi protein berdasarkan sumbernya, telah kita ketahui protein hewani dan protein nabati. Dalam analisa bahan makanan yang lebih teliti, dipergunakan faktor konversi lain yang sudah diketahui jumlahnya, bila secara umum faktor konversi dianggap 6,25 dengan asumsi kandungan nitrogen dalam protein adalah 16 % (Djaeni, 2008).
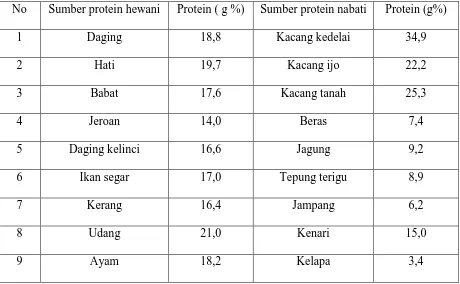
Jenis dan jumlah kandungan proteinnya dapat dilihat pada Tabel 1. Tabel 1. Daftar Kadar Protein Beberapa Bahan Makanan
No Sumber protein hewani Protein ( g %) Sumber protein nabati Protein (g%)
1 Daging 18,8 Kacang kedelai 34,9
2 Hati 19,7 Kacang ijo 22,2
3 Babat 17,6 Kacang tanah 25,3
4 Jeroan 14,0 Beras 7,4
5 Daging kelinci 16,6 Jagung 9,2
6 Ikan segar 17,0 Tepung terigu 8,9
7 Kerang 16,4 Jampang 6,2
8 Udang 21,0 Kenari 15,0
24
10 Telur 12,8 Daun singkong 6,6
11 Susu sapi 3,2 Singkong. tapioca 1,1
(Djaeni. 2008)
Tabel 2 Kebutuhan Protein menurut FAO/WHO Usia
(Tahun)
Jumlah yang aman dikonsumsi (g protein/kg per hari) Bayi dan anak-anak
0,25-0,5 1,86
0,75-1,0 1,48
2-3 1,13
9-10 0,99
Masa pertumbuhan
10-11 0,99
14-15 0,96
17-18 0,86
Dewasa 0,75
(FAO/WHO)
- Untuk masa kehamilan kebutuhan protein meningkat hingga 6 gr/hari - Untuk masa menyusui kebutuhan menjadi 16 gr/hari
2.7 Analisis Protein
Analisis protein secara umum dilakukan dengan dua metode , yaitu kualitatif dan kuantitatif . Reaksi pengenalan (kualitatif) yang dapat dilakukan yakni reaksi Xantoprotein dan reaksi Biuret.
- Reaksi Xantoprotein dibuat dengan cara : larutan asam nitrat pekat
25
terjadi endapan putih yang dapat berubah menjadi kuning apabila dipanaskan. Reaksi yang terjadi adalah nitrasi pada inti benzena yang terdapat pada molekul protein. Reaksi ini positif untuk protein yang mengandung tirosin, fenilalanin dan triptofan.
- Metode Biuret dilakukan dengan cara : larutan protein dibuat alkalis
dengan NaOH kemudian ditambahkan larutan CuSO4 encer. Uji ini untuk menunjukkan adanya senyawa-senyawa yang mengandung gugus amida asam yang berada bersama gugus amida yang lain. Uji ini memberikan reaksi positif yaitu ditandai dengan timbulnya warna merah violet atau biru violet (Sudarmadji, 1989).
Setelah dilakukan uji kualitatif, kemudian dilakukan uji kuantitatif. Bentuk uji kuantitatif (penentuan kadar) yang dapat dilakukan :
Metode Kjeldahl
Metode Kjeldahl merupakan metode yang sederhana untuk penetapan nitrogen total pada asam amino, protein dan senyawa yang mengandung nitrogen. Cara Kjeldahl digunakan untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung karena senyawa yang dianalisisnya adalah kadar nitrogennya. Dengan mengalikan hasil analisis tersebut dengan faktor konversi 6,25 diperoleh nilai protein dalam bahan makanan tersebut. Penentuan kadar protein dengan metode ini mengandung kelemahan karena adanya senyawa lain yang bukan protein yang mengandung N akan tertentukan sehingga kadar protein yang diperoleh langsung dengan cara kjeldahl ini sering disebut dengan kadar protein kasar/crude protein (Sudarmadji, 1989).
26 a. Tahap Destruksi
Pada tahap ini, sampel dipanaskan dalam asam sulfat pekat sehingga terjadi destruksi menjadi unsur-unsurnya. Elemen karbon (C) dan hidrogen (H) teroksidasi menjadi karbon monoksida (CO), karbondioksida (CO2), dan air (H2O). Elemen Nitrogen akan berubah menjadi amonium sulfat. Banyaknya asam sulfat yang digunakan untuk destruksi diperhitungkan terhadap kandungan protein, karbohidrat dan lemak.
Untuk mempercepat destruksi maka ditambahkan katalisator. Dengan penambahan katalisator, maka titik didih asam sulfat akan dipertinggi sehingga proses destruksi akan berjalan lebih cepat. Katalisator yang digunakan yaitu campuran Selenium yang dapat mempercepat proses oksidasi dan juga dapat menaikkan titik didih asam sulfat. Proses destruksi diakhiri jika larutan telah menjadi warna hijau jernih.
Reaksi yang terjadi pada proses destruksi :
(Meloan, 1987) b. Tahap Destilasi
Pada tahap destilasi, amonium sulfat dapat dipecah menjadi amonia, yaitu dengan penambahan larutan NaOH sampai alkalis dan dipanaskan. Amonia yg dibebaskan ditangkap oleh larutan asam. Asam yg dapat dipakai adalah H2SO4. Agar kontak antara larutan asam dengan amonia berjalan sempurna, maka ujung selang pengalir destilat harus tercelup kedalam larutan asam. Destilasi diakhiri
|
n – C – NH2 + H2SO4 CO2 + (NH4)2SO4 + SO2 |
protein
27
jika semua amonia sudah terdestilasi sempurna menggunakan indikator mengsel sebagai indikator penunjuk. Reaksi yang terjadi pada tahap destilasi yaitu :
(NH4)2SO4 + 2 NaOH 2 NH3↑ + Na2SO4 + 2H2O
c. Tahap Titrasi
Apabila penampung destilat yang digunakan adalah larutan asam sulfat, maka sisa asam sulfat yang tidak bereaksi dengan amonia dititrasi dengan NaOH 0,025 N menggunakan indikator mengsel (indikator campuran metil red dan metil blue). Selisih jumlah titrrasi sampel dan blanko merupakan jumlah nitrogen.
% N = N .NaOH 14,007 100%
1000 x (g) Sampel B.
Sampel)
-(Blanko NaOH
. ml
× ×
×
Setelah diperoleh % N selanjutnya dihitung kadar proteinnya dengan mengalikan % N dengan suatu faktor konversi. Besarnya faktor konversi nitrogen tergantung pada persentase nitrogen yang menyusun protein dalam bahan pangan yg dianalisa tersebut. Reaksi yang terjadi pada tahap titrasi ini yaitu:
NH3 + H2SO4 (NH4)2SO4
Kelebihan H2SO4 + 2 NaOH Na2SO4 + 2H2O ( Sudarmadji. 1989)
28
Ketelitian penentuan kadar NPN tergantung pada metode yang digunakan untuk memisahkan protein dari NPN. Setelah pemisahan protein dari NPN maka kadar protein dan NPN dapat ditentukan kadarnya dengan metode Kjeldahl. Dari analisa yang telah dilakukan, umumnya larutan ATA 10 % dipilih untuk mengendapkan protein dalam bahan makanan. Beberapa keuntungan pemakaian larutan ATA ini yaitu pengerjaannya mudah, endapan protein yang diperoleh mudah dipisahkan dari larutan ATAnya dan tidak mempengaruhi ketelitian metode Kjeldahl. Ada 2 cara yang dapat dilakukan untuk mengetahui kadar NPN ini, yaitu dengan menentukan langsung kadar NPN dengan metode Kjeldahl, atau dengan cara mengurangkan kadar N total yang diperoleh dengan kadar N endapan (N protein) (Silalahi. 1994).
29
2.8Jangkrik Brachytrupes portentosus lichtenstein
Jangkrik Brachytrupes portentosus lichtenstein merupakan hasil determinasi dari jangkrik yang diteliti. Masyarakat Medan menyebutnya jangkrik kebun karena ditangkap dari habitatnya area kebun.
Sistematika dari Brachytrupes portentosus lichtenstein : - Filum : Hexapoda
- Subfilum : Pterygota - Ordo : Orthoptera - Subordo : Ensifera
- Famili : Gryllidae (jangkrik) - Subfamili : Gryllinae
- Genus : Brachytrupes
- Spesies : Brachytrupes portentosus lichtenstein Bid. Zoologi, LIPI Bogor, dapat dilihat pada Lampiran 11.
30 BAB III
METODOLOGI PENELITIAN
3.1. Alat yang digunakan
Alat-alat yang digunakan terdiri dari: tabung reaksi, labu Kjeldahl, kompor gas, pendingin liebig, erlenmeyer, kertas saring Whatman, buret 50 ml, cawan porselin, desikator, oven, neraca analitis, blender, mortir dan stemper, dan alat-alat gelas laboratorium lainnya.
3.2. Bahan yang digunakan
Bahan pereaksi bila tidak dinyatakan lain adalah berkualiatas pro analisis (E.Merck), NaOH, H2SO4 98%, indikator campuran K2SO4 dengan CuSO4.5H2O, dan indikator mengsel (indikator campuran metil red dan metil blue dalam alkohol 96 %), dan sebagai pelarut menggunakan aquadest.
3.3. Sampel
Penelitian ini dilakukan di Laboratorium Teknologi Bahan Pangan Fakultas Pertanian Universitas Sumatera Utara. Penelitian ini dilakukan secara eksperimental. Metodologi penelitian meliputi penyiapan sampel dan identifikasi analisa protein.
3.3.1. Pengambilan sampel
31 3.3.2 Pengolahan sampel
Bagian yang digunakan adalah seluruh bagian tubuh jangkrik (tanpa sayap). Pengolahan dilakukan dengan cara jangkrik segar dibersihkan dari kotoran yang melekat kemudian dicuci dengan air bersih, lalu jangkrik digiling hingga halus menggunakan blender dengan penambahan air secukupnya. Kemudian jangkrik yang telah digiling halus ini dikeringkan pada oven dengan suhu ± 550 C hingga berat konstan. Hasil pengeringan ini yang dijadikan simplisia kering sebagai sampel untuk analisa penentuan kadar protein.
Untuk hasil olahan jangkrik (jangkrik goreng dan rebus), setelah diolah lalu digiling halus menggunakan blender dengan menggunakan air secukupnya. Untuk proses selanjutnya diberi perlakuan yang sama dengan jangkrik segar.
3.4. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Teknologi Bahan Pangan Fakultas Pertanian Universitas Sumatera Utara. Penelitian ini dilakukan secara eksperimental.
3.5. Pembuatan Pereaksi
- NaOH 40 % diperoleh dengan melarutkan 40 gram pellet NaOH di dalam aquadest bebas CO2 hingga 100 ml.
- H2SO4 0,02 N yaitu dengan mencampurkan 1,4 ml H2SO4 98% dan akuades di dalam labu hingga 2500 ml. NaOH 0,02 N dibuat dengan melarutkan 0,8 gram NaOH dengan akuades bebas CO2 di dalam labu 1000 ml (Sudarmadji, 1989).
32
- Pembuatan indikator mengsel yaitu dengan melarutkan 500 mg metal biru dan 450 mg metil merah dengan akuades di labu 500 ml (Sudarmadji, 1989).
- Larutan asam trikloroasetat 10 % dibuat dengan cara sebanyak 100 gr ATA dilarutkan dalam air suling secukupnya hingga 1000 ml (Silalahi, 1994). 3.6Pembakuan NaOH 0,02 N
Ditimbang seksama 100 mg kalium bifthalat kemudian dilarutkan dalam air bebas CO2 sebanyak 30 ml. Ditambah 2 tetes indikator fenolftalein, dititrasi dengan NaOH hingga terjadi warna merah muda mantap. Dilakukan perlakuan yang sama tiga kali dan dihitung normalitas larutan. 1 ml natrium hidroksida 1 N setara dengan 204,2 mg kalium biftalat.
Normalitas NaOH =
bifthalat K
BE x (ml) Vol.NaOH
(mg) Bifthalat K
Berat
− −
Data volume NaOH yang terpakai dan pembakuan NaOH 0,02 N dapat dilihat pada Lampiran 2.
3.7 Penentuan Kadar Air
Timbang teliti 5 gr sampel didalam botol timbang yang telah diketahui beratnya, kemudian keringkan di oven suhu 550C sampai diperoleh berat yang konstan. Kadar air dihitung dengan rumus berikut :
Kekurangan bobot X 100% : berat sampel 3.8 Pemeriksaan Kualitatif
33
- Pada tabung reaksi pertama ditambahkan asam nitrat pekat (reaksi Xantoprotein). Bila terjadi warna kuning menunjukkan hasil positif mengandung protein.
- Pada tabung reaksi kedua ditambahkan larutan CuSO4 dan NaOH (reaksi Biuret). Masing-masing tabung reaksi diamati perubahan warna yang terjadi. Bila terjadi warna kuning pada tabung pertama dan warna ungu pada tabung kedua maka menunjukkan hasil positif mengandung protein (Sudarmadji. 1989).
3.9 Prosedur Penentuan Kadar
Ditimbang seksama 0,250 gram sampel dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan 3 ml H2SO4 pekat dan 2 gram indikator campuran selenium. Didestruksi (Labu Kjeldahl dipanaskan perlahan-lahan dengan suhu dibawah suhu didih, kemudian suhu dinaikkan dan pemanasan dilanjutkan sampai cairan berwarna hijau jernih) lebih kurang selama 3 jam dan didinginkan. Ditambahkan dengan 10 ml akuades, dipindahkan kedalam erlenmeyer. Campuran ditambahkan dengan 30 ml NaOH 40% (ketika air pada labu erlenmeyer destilasi mendidih) sampai terbentuk warna hitam dan didestilasi. Disediakan penampung yang berisi 25 ml H2SO4 0,02 N dan indikator mengsel di dalam erlenmeyer. Destilasi hingga diperoleh kira-kira 125 ml destilat. Destilat dititrasi dengan NaOH 0,02 N sampai terjadi perubahan warna dari ungu menjadi hijau. Dilakukan hal yang sama terhadap blanko (Sudarmadji, 1989).
Persentase nitrogen (% N) dihitung dengan menggunakan rumus :
% N = N .NaOH 14,007 100%
1000 x (g) Sampel B.
Sampel)
-(Blanko NaOH
. ml
× ×
×
34 % P = % N × faktor konversi (Winarno,1991)
Bagan penentuan kadar protein dengan metode Kjeldahl dapat dilihat pada Lampiran 1.
3.9.1 Pemisahan Protein dari Non Protein Nitrogen
Untuk mengendapkan protein yang terdapat dalam sampel digunakan larutan ATA (asam trikloro asetat) 10 %. Timbang teliti sejumlah sampel, kemudian tambahkan kedalamnya larutan ATA 10%. Biarkan selama 30 menit sambil dikocok, kemudian disaring. Endapannya berisi protein dan filtratnya mengandung NPN. Protein dapat diketahui sudah mengendap semuanya apabila tidak terjadi lagi endapan dengan penambahan larutan ATA 10% ke dalam filtratnya (Silalahi, 1994).
3.9.2 Penentuan Kadar Protein Murni
Protein murni dapat ditentukan kadarnya setelah proses pemisahan tersebut dari NPN. Endapan protein yang diperoleh ditentukan kadarnya berdasarkan jumlah N yang dimilikinya dengan metode Kjeldahl (Silalahi, 1994).
3.9.3 Penentuan Kadar Non Protein Nitrogen
Penentuan kadar NPN dalam sampel yang dianalisa adalah secara tidak langsung, yaitu dengan cara mengurangi kadar N-protein. Kadar NPN yang terdapat dalam bahan yang ditimbang dengan rumus sebagai berikut : jumlah N total (%) – jumlah N protein (%). Kadar NPN terhadap N-total dihitung dengan rumus sebgai berikut :
35 BAB IV
HASIL DAN PEMBAHASAN
4.1.Pemeriksaan Kualitatif
Pemeriksaan kualitatif pada sampel dilakukan dengan menggunakan metode reaksi Xantoprotein dan Biuret. Berdasarkan hasil pemeriksaan kualitatif, diperoleh hasil warna kuning pada reaksi Xantoprotein dan warna ungu pada reaksi Biuret yang menunjukkan positif mengandung protein. 4.2 Pemeriksaan Kadar Protein dan NPN
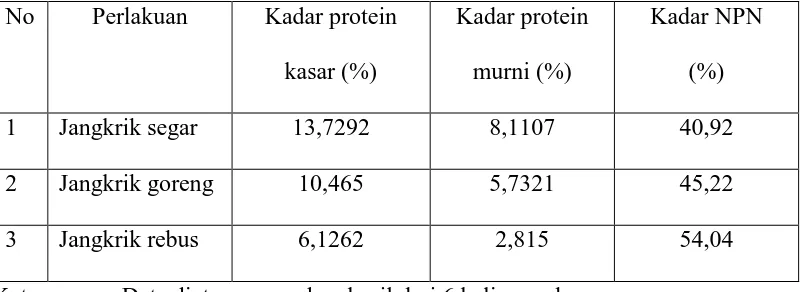
Data mentah hasil penentuan kadar N-total (protein kasar), N-protein dan NPN berturut-turut tertera pada Lampiran 4. Hasil kadar yang diperoleh dapat dilihat pada Tabel 2.
Tabel 3. Hasil kadar N-total, N-protein dan NPN No Perlakuan Kadar protein
kasar (%)
Kadar protein murni (%)
Kadar NPN (%)
1 Jangkrik segar 13,7292 8,1107 40,92
2 Jangkrik goreng 10,465 5,7321 45,22
3 Jangkrik rebus 6,1262 2,815 54,04
Keterangan : Data diatas merupakan hasil dari 6 kali percobaan. NPN dihitung terhadap N-total sampel
36
37 BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Jangkrik dapat menjadi salah satu alternatif makanan yang kadar proteinnya hampir sama dengan makanan laut.
2. Kadar protein kasar yang terdapat pada jangkrik segar : 13,7292 %, sedangkan protein murni 8,1107 & dan NPN-nya : 40, 92 %. Jangkrik goreng protein kasarnya menurun menjadi 10,465 %, protein murni menjadi 5,732 % dan NPN-nya bertambah menjadi 45,22 %. Dan pada jangkrik rebus protein kasar semakin berkurang menjadi 6,1262 % dan protein murninya menjadi 2,815 % sedangkan NPN-nya bertambah besar menjadi 54,04 %.
5.2. Saran
38
DAFTAR PUSTAKA
Djaeni, Achmad. 2008. Ilmu Gizi. Jakarta : PT. Dian Rakyat. Hal 53-65
Goldstein, Gerald. 1996. Biokimia Suatu Pendekatan Fungsional. Surabaya : Airlangga University Press. Hal 5-7
Harris, Robert. 2009. Evaluasi Gizi Pada Pengolahan Bahan Pangan. Bandung : Penerbit ITB. Hal 20-22
Kusnandar, Ferri. 2011. Kimia Pangan Komponen Makro. Jakarta : PT. Dian Rakyat. Hal 206-240
Lilies, Christina. 1991. Kunci Determinasi Serangga. Yogyakarta : Penerbit Kanisius. Hal 11-12
Meloan, Clifton. 1987. Food Analysis : Theory and Practise Second Edition. New York : Van Nostrand Reinhold Company. Page 753-755
Ngili, Yohanis. 2009. Biokimia Metabolisme dan Bioenergitika. Yogyakarta : PT. Graha Ilmu. Hal 239-316
Paimin, Farry. 1999. Beternak Jangkrik. Bogor : PT. Penebar Swadaya. Hal 1-6 Poedjiana, Anna. 1994. Dasar-dasar Biokimia. Bogor : PT. Dian Rakyat. Hal 56 Robinson, David. 2005. Food Biochemistry and Nutritional Value. New York –
Longman Scientific & Technical Group UK. Hal. 216
Silalahi, Jansen. 1983. Kadar Protein yang Terdapat dalam Beberapa Bahan Makanan. Medan : Silalahi. Hal 1-20
Sudarmadji, S. Haryono, B., Suhardi. 1989. Analisa Bahan Makanan dan Pertanian. Jogjakarta: Penerbit Liberty. Hal 119-144
39
Tarigan, P. 1983. Kimia Organik Bahan Makanan. Bandung: Penerbit Alumni. Hal.100-105
Winarno, F.G. 1991. Kimia Pangan dan Gizi. Jakarta: Penerbit Gramedia. Hal 61-62
40
Lampiran 1. Bagan Penetapan Kadar Protein Jangkrik dengan Metode Kjeldhal
Dimasukan ke dalam labu Kjedahl
Ditambahkan 3 ml H2SO4 pekat dan 2 gram sampuran selen Digojog sampai rata dan dipanaskan dalam lemari asam sampai warna jernih (hijau jernih)
setelah dingin ditambahkan 10 ml akuades, pindahkan ke alat
penyuling
Ditambahkan 30 ml NaOH 40%
Sebagai penampung digunakan 25 ml larutan H2SO4 0,02 N yang telah dicampur indikator mengsel
Didestilasi sampai diperoleh 125 ml destilat
Dititrasi dengan larutan NaOH 0,02 N Dilakukan titrasi blanko
0,250 gram l
Destilat
Hasil
41
Lampiran 2. Perhitungan Pembakuan Natrium Hidroksida 0,02 N
Tabel. Data Pembakuan Natrium Hidroksida 0,02 N dengan Standar Primer Kalium Biftalat
No. Berat K-Bifthalat
Normalitas NaOH =
bifthalat
BE K-Bifthalat = 204,2 N1 = 0,025 N
N2 = 0,026 N N3 = 0,025 N
Normalitas rata-rata (Nr) dan persen deviasi (% d)
Nr = 0,0255
42
Lampiran 3. Perhitungan Pembakuan Natrium Hidroksida 0,02 N
Tabel. Data Pembakuan Natrium Hidroksida 0,02 N dengan Standar Primer Kalium Biftalat
No. Berat K-Bifthalat
Normalitas NaOH =
bifthalat
BE K-Bifthalat = 204,2 N1 = 0,0299 N
N2 = 0,0300 N N3 = 0,0300 N
Normalitas rata-rata (Nr) dan persen deviasi (% d)
Nr = 0,02995
43
Lampiran 4. Tabel Hasil Data Mentah Hasil Kadar Protein dan NPN
1. Jangkrik segar
Data Protein Kasar (Normalitas NaOH 0,025 N; vol.blanko 24,30 ml) B. Sampel Vol Titrasi % N % Protein
Data Protein Murni (N=0,025 N; vol.blanko 24,3 ml) B. Sampel Vol Titrasi % N %
Contoh perhitungan data nomor 1
44
Dengan cara yang sama diperoleh kadar protein untuk sampel nomor 2 sampai nomor 6 dan perhitungan yang sama untuk penetapan kadar protein murni juga untuk perhitungan hasil olahan (jangkrik goreng dan rebus).
2. Jangkrik Goreng
Data Protein Kasar (Normalitas NaOH= 0,03 N; vol.blanko 16,2 ml) B. Sampel Vol Titrasi % N % Protein
Data Protein Murni (Normalitas NaOH 0,025 N; vol.blanko 24,30 ml) B.
45
Data Protein Murni (Normalitas NaOH 0,03 N; vol.blanko 16,2 ml)
46
Lampiran 5. Perhitungan kadar protein kasar jangkrik segar sebenarnya.
No. Kadar Protein
Pada tingkat kepercayaan 95% dengan nilai α = 0,05, dk 6-1 diperoleh t-tabel = 2,57
Data diterima jika t-hitung < t-tabel
47 t-hitung data 6 =
6 1181 , 0
7292 , 13 7437 ,
13 −
= -0,3007
Karena nilai t-hitung < t-tabel, maka data yang dipakai adalah keseluruhan data 1,2,3,4,5 dan 6.
48
Pada tingkat kepercayaan 95% dengan nilai α = 0,05, dk 6-1 diperoleh t-tabel = 2,57
Data diterima jika t-hitung < t-tabel
49 t-hitung data 6 =
6 1620 , 0
465 , 10 61 ,
10 −
= 2,1936
Karena nilai t-hitung < t-tabel, maka data yang dipakai adalah keseluruhan data 1,2,3,4,5 dan 6.
50
Pada tingkat kepercayaan 95% dengan nilai α = 0,05, dk 6-1 diperoleh t-tabel = 2,57
Data diterima jika t-hitung < t-tabel
t-hitung =
= 3,8608...(ditolak)
51 t-hitung data 6 =
6 05651 , 0
1262 , 6 1275 ,
6 −
= -0,05652
Karena nilai t-hitung < t-tabel, maka data yang dipakai adalah keseluruhan data 2,3,4, dan 6; sebab data 1 dan data 5, t-hitung > t-tabel sehingga data tersebut ditolak.
52
Pada tingkat kepercayaan 95% dengan nilai α = 0,05, dk 6-1 diperoleh t-tabel = 2,57
Data diterima jika t-hitung < t-tabel
53
Karena nilai t-hitung < t-tabel, maka data yang dipakai adalah keseluruhan data 1,2,3,4,5 dan 6.
54
Pada tingkat kepercayaan 95% dengan nilai α = 0,05, dk 6-1 diperoleh t-tabel = 2,57
Data diterima jika t-hitung < t-tabel
55 t-hitung data 6 =
6 3085 , 0
7321 , 5 1275 ,
6 −
= 3,14058...(ditolak)
Karena nilai t-hitung < t-tabel, maka data yang dipakai adalah keseluruhan data 1,2,3,4, dan 5. Data 6, t-hitung > t-tabel, maka data ini ditolak.
56
Pada tingkat kepercayaan 95% dengan nilai α = 0,05, dk 6-1 diperoleh t-tabel = 2,57
Data diterima jika t-hitung < t-tabel
t-hitung =
= 3,8701...(ditolak)
57 t-hitung data 6 =
6 2754 , 0
815 , 2 83 ,
2 −
= 0,1334
58
GAMBAR 1. JANGKRIK TAIWAN
59
60
61
Sebelum didestilasi (sampel dan penampung)
62
Dari biru ke biru hijau