KAJIAN PENGARUH SUHU, pH, WAKTU DAN
KONSENTRASI INHIBITOR AKAR KAWAO (
Milletia sericea
)
PADA DEGRADASI SUKROSA OLEH INVERTASE
Oleh
ANNISA RACHMA F34102041
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
KAJIAN PENGARUH SUHU, pH, WAKTU DAN KONSENTRASI INHIBITOR AKAR KAWAO (Milletia sericea) PADA DEGRADASI
SUKROSA OLEH INVERTASE
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
ANNISA RACHMA F34102041
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KAJIAN PENGARUH SUHU, pH, WAKTU DAN KONSENTRASI INHIBITOR AKAR KAWAO (Milletia sericea) PADA DEGRADASI
SUKROSA OLEH INVERTASE
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
ANNISA RACHMA F34102041
Dilahirkan pada tanggal 4 Februari 1984 Di Karanganyar
Tanggal lulus : 25 Agustus 2006
Menyetujui, Bogor, September 2006
Annisa Rachma. F34102041. Kajian Pengaruh Suhu, pH, Waktu dan Konsentrasi Inhibitor Akar Kawao (Milletia sericea) Pada Degradasi Sukrosa Oleh Invertase. Di bawah bimbingan Sapta Raharja dan Prayoga Suryadarma. 2006.
RINGKASAN
Kondisi industri gula di Indonesia dewasa ini semakin memprihatikankan. Hal tersebut dapat terlihat dari produksi gula nasional yang semakin menurun dari tahun ke tahun. Sementara kebutuhan konsumsi gula dalam negeri semakin meningkat. Untuk itu impor merupakan jalan keluar yang paling mudah untuk dilakukan.
Rendahnya produksi gula nasional disebabkan oleh produktivitas dan efisiensi industri gula rendah. Salah satu penyebab rendahnya produktivitas dan efisiensi industri gula adalah terjadinya kerusakan gula pada saat alat-alat pengolahan gula mengalami kerusakan (down time). Pada saat tersebut, nira gula menunggu untuk dilakukan pengolahan selanjutnya. Lamanya waktu menunggu tersebut menyebabkan degradasi gula (sukrosa) menjadi gula-gula sederhana (invert), seperti glukosa dan fruktosa atau senyawa turunan lainnya. Selain degradasi sukrosa, senyawa-senyawa hasil degradasi sukrosa tersebut dapat mengganggu proses kristalisasi, sehingga dapat menurunkan rendemen gula sukrosa. Kerusakan sukrosa dalam nira diantaranya disebabkan oleh adanya mikroorganisme yang mengeluarkan enzim dan enzim yang telah ada dalam nira, salah satunya yaitu invertase yang menghidrolisis sukrosa menjadi gula invert. Untuk itu perlu adanya proses penghambatan terhadap aktivitas invertase, sehingga diharapkan rendemen gula sukrosa dapat ditingkatkan.
Pada penelitian ini dilakukan penghambatan aktivitas invertase supaya laju degradasi sukrosa oleh enzim dapat diturunkan. Penghambatan aktivitas enzim dapat dilakukan dengan memberikan kondisi ekstrim bagi reaksi hidrolisis oleh invertase seperti suhu, pH maupun tekanan. Dengan memberikan kondisi ekstrim, diharapkan laju kerusakan sukrosa oleh invertase dapat dihambat. Selain pemberian kondisi ekstrim, penghambatan aktivitas enzim dapat dilakukan dengan penambahan inhibitor. Bahan inhibitor yang digunakan harus sesuai dengan bahan yang akan dihambat aktivitas invertasenya. Bahan inhibitor yang aman untuk pangan misalnya adalah akar kawao (Milletia sericea) yang biasa digunakan oleh petani gula sebagai pengawet nira.
Penelitian ini bertujuan untuk mengetahui pengaruh faktor penghambat laju degradasi sukrosa oleh invertase yang meliputi suhu, pH, waktu dan inhibitor akar kawao (Milletia sericea) yang ditandai dengan penurunan jumlah gula pereduksi. Selanjutnya menentukan permukaan respon faktor yang berpengaruh pada penghambatan laju degradasi sukrosa.
Study on The Effect of Temperature, pH Value, Incubation Time, and Kawao (Milletia serecia) Root Concentration as Inhibitor on Sucrose
Degradation by Invertase.
Summary
The production level of national sugar industry in Indonesia is decreasing from time to time, while the needs of sugar consumption in Indonesia are increasing. The low production level of national sugar industry was caused by decreasing productivity and efficiency of sugar industry. One of the most common cause of bad productivity and efficiency is sugar degradation, where the sugar degradation could occurred when the sugar processing equipment was having a problem or broken (down time). The delaying time of processing the sugarcane juice could convert the form of sugar in the juice (sucrose) in to another form of simple sugar (invert), such as glucose, fructose, or other derivatives compound. Invert sugar forming as a result of sugar degradation will inhibit the sucrose crystallization process and decrease the sugar yield. The sucrose degradation in the sugarcane juice can cause by the existence enzyme on the sugarcane juice, or by the existence of microorganism, which released some enzyme to the juice. One of the most common enzymes is the invertase, which could hydrolyze the sucrose in to form of invert sugar. Due to the related state, an effort is needed to avoid or at least to obstruct the sucrose damage so the yield and the productivity of cane sugar industry can be improved.
On this research, an inhibition of invertase activity was conducted, so the rate of the sucrose degradation could be decreased. The inhibition of enzyme activity could conducted by giving an extreme condition to the hydrolyze reaction, such as temperature, pH, or pressure. By using the extreme condition, hopefully the rate of sucrose damaging by the invertase could be inhibited. Then also add some substance as an inhibitor of the process. One of the substance is the extract of Kawao root (Milletia serecia), which sugar farmers usually used as a sugarcane juice preservative.
The objective of this research was to determined the influence of sucrose degradation inhibitor factors, including temperature, pH value, incubation time, and the addition of Kawao root, which could determined by the decreasing of the reduction sugar. Besides that, it was to determine the factors response surface which correlated to the inhibition of sucrose degradation.
The design experiment which used in this research was two level factorial designs with four factors, while to knowing the response surface, a response surface methodology (RSM) was used. The low and the high point for the temperature were 60oC and 80oC. The low of pH value was 5 and the high one was 8. The low value for inhibitor was 0.875 g while the high one was 3.5 g. The time of low reaction was 40 minutes and the high one was 100 minutes.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul “Kajian Pengaruh Suhu, pH, Waktu Dan Konsentrasi Inhibitor Akar Kawao (Milletia sericea) Pada Degradasi Sukrosa Oleh Invertase” adalah hasil karya saya sendiri dengan arahan dosen Pembimbing Akademik, kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, Agustus 2006 Yang membuat pernyataan,
RIWAYAT HIDUP
Penulis dilahirkan di Karanganyar pada tanggal 4 Februari 1984. Penulis adalah anak pertama dari tiga bersaudara dari pasangan Tri Waspodo dan Sri Rejeki. Pada tahun 1996, penulis menyelesaikan pendidikan sekolah dasar di SDN 2 Karangmojo. Penulis menyelesaikan pendidikan sekolah menengah di SLTP Negeri 1 Karanganyar pada tahun 1999. Kemudian penulis melanjutkan pendidikan di SMUN 1 Karanganyar dan lulus pada tahun 2002.
Penulis melanjutkan pendidikan di Perguruan Tinggi Negeri, Institut Pertanian Bogor tahun 2002 melalui jalur USMI (Undangan Seleksi Masuk IPB) di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian. Selama kuliah di IPB, penulis pernah menjadi pengurus FBI (Forum Bina Islami) periode 2004/2005 dan pengurus FORCES (For Scientist) periode 2004/2005.
KATA PENGANTAR
Syukur alhamdulillah kepada Allah SWT yang telah melimpahkan rahmat, dan hidayah-NYA kepada penulis, sehingga penulis dapat menyelesaikan penelitian dengan judul “Kajian Pengaruh Suhu, pH, Waktu Dan Konsentrasi Inhibitor Akar Kawao (Milletia sericea) Pada Degradasi Sukrosa Oleh Invertase”, serta dapat menyusun dan menyelesaikan skripsi. Karya ilmiah ini ditujukan untuk mendapatkan gelar sarjana teknologi pertanian pada Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan rasa terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Sapta Raharja, DEA selaku dosen pembimbing akademik yang telah memberikan arahan dan membimbing penulis baik selama penelitian dan penulisan skripsi.
2. Prayoga Suryadarma, STP, MT selaku dosen pembimbing II yang telah memberikan arahan dan membimbing penulis baik selama penelitian dan penulisan skripsi.
3. Dr. Ir. Ani Suryani, DEA selaku dosen penguji yang telah bersedia memberikan saran untuk penyempurnaan skripsi ini.
4. Bapak, Ibu, dan adik-adikku tercinta atas pengertian, dukungan, semangat, dan doa-doanya.
5. Reni, Rian, Mbak Fitri dan Pak Ikhsan rekan satu tim penelitian gula atas bantuan dan kebersamaanya.
6. Laboran di Departemen Industri Pertanian atas segala bantuan selama penulis melaksanakan penelitian.
7. Teman-teman di lab. Bioindustri, lab. Teknik Kimia, lab. Pengemasan, lab. Wastu, lab. DIT dan teman-teman TIN 39 atas bantuan, persaudaraan dan persahabatannya selama ini.
8. Teman-teman satu bimbingan Mansyur dan Kristin atas bantuan dan kebersamaannya.
Maryam, Sifa dan adik-adik angkatan 42) atas cinta yang telah kalian berikan dan dukungan selama ini.
10.Teman-teman dari SMU Karanganyar atas kebersamaannya selama ini.
11.Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat Penulis sebutkan satu persatu.
Penulis menyadari tulisan ini masih jauh dari sempurna. Namun penulis berharap semoga tulisan ini bermanfaat bagi pembaca.
Bogor, Agustus 2006
DAFTAR ISI
Halaman
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 4
II. TINJAUAN PUSTAKA ... A. SUKROSA ... 5
B. INVERTASE ... 6
C. AKTIVITAS DAN STABILITAS ENZIM ... 7
D. DEGRADASI SUKROSA ... 8
1. pH ... 9
2. SUHU ... 10
3. KONSENTRASI SUBSTRAT DAN ENZIM ... 12
4. INHIBITOR ... 12
5. KONDISI LINGKUNGAN ... 14
E. KAWAO ( Milletia sericea)... 15
F. ZAT-ZAT BIOAKTIF ... 15
III.METODOLOGI ... 17
A. ALAT DAN BAHAN ... 17
B. METODE PENELITIAN ... 17
1. TAHAPAN PENELITIAN ... 17
2. PROSEDUR PENELITIAN... 21
IV.HASIL DAN PEMBAHASAN ... 23
A. AKTIVITAS INVERTASE ... 23
B. KARAKTERISTIK KAWAO ( Milletia sericea)... 24
D. PERMUKAAN RESPON ... 36
V. KESIMPULAN DAN SARAN ... 41
A. KESIMPULAN ... 41
B. SARAN ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
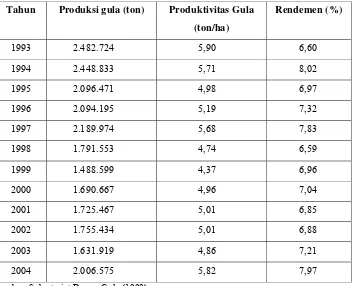
Tabel 1. Produksi, produktivitas dan rendemen gula nasional... 1
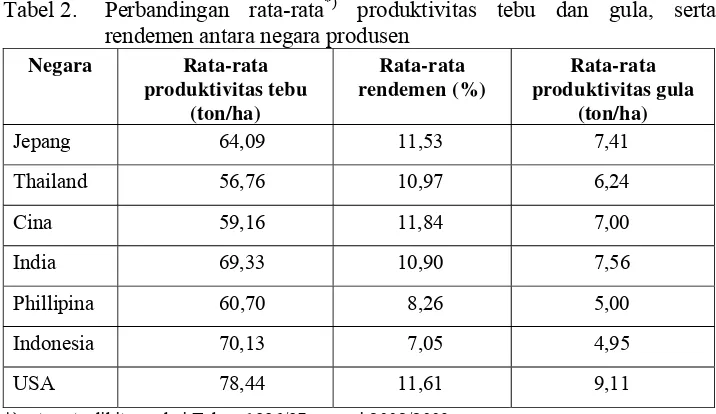
Tabel 2. Perbandingan rata-rata produktivitas tebu dan gula serta rendemen antara negara produsen ... 2
Tabel 3. Nilai rendah dan tinggi perlakuan ... 19
Tabel 4. Rancangan faktorial dari masing-masing variabel reaksi yang berpengaruh ... 20
Tabel 5. Hasil uji fitokimia kawao ( Milletia sericea) ... 24
Tabel 6. Parameter koefisien dan nilai signifikansi ... 27
DAFTAR GAMBAR
Halaman Gambar 1. Reaksi hidrolisis sukrosa menjadi glukosa dan fruktosa dengan
bantuan invertase ... 5
Gambar 2. Model persamaan umum untuk pengaruh pH ... 10
Gambar 3. Pengaruh nilai pH terhadap aktivitas invertase dari gula tebu ... 10
Gambar 4. Pengaruh suhu terhadap aktivitas invertase dari gula tebu ... 11
Gambar 5. Pengaruh inhibitor terhadap aktivitas enzim ... 13
Gambar 6. Tahapan penelitian ... 18
Gambar 7. Kurva aktivitas invertase ... 24
Gambar 8. Interaksi antara suhu reaksi (X1) dan pH (X2) terhadap jumlah gula pereduksi ... 32
Gambar 9. Interaksi antara pH (X2) dan bahan inhibitor akar kawao (X3) terhadap jumlah gula pereduksi ... 32
Gambar 10. Interaksi antara pH (X2) dan waktu (X4) terhadap jumlah gula pereduksi . ... 34
Gambar 11. Interaksi antara suhu (X1) dan inhibitor akar kawao (X3) terhadap jumlah gula pereduksi ... 34
Gambar 12. Interaksi antara suhu (X1) dan waktu (X4) terhadap jumlah gula pereduksi ... 36
Gambar 13. Permukaan respon dari gula pereduksi sebagai fungsi dari suhu, pH dan inhibitor akar kawao ... 37
Gambar 14. Permukaan respon gula pereduksi pada konsentrasi akar kawao tetap ... 38
Gambar 15. Permukaan respon dari gula pereduksi pada suhu tetap ... 39
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data hasil analisis gula pereduksi ... 46
Lampiran 2a. Hasil statistik pengaruh linier variabel terhadap jumlah gula pereduksi menggunakan SAS ... 47
Lampiran 2b. Hasil analisis ragam dari SAS pada hubungan regresi terhadap respon ... 47
Lampiran 2c. Hasil analisis residual dari SAS, pengaruh perlakuan terhadap gula pereduksi... 47
Lampiran 3a. Hasil anlisis ragam dari SAS, pengaruh perlakuan terhadap gula pereduksi pada nilai T ... 48
Lampiran 3b. Hasil analisis ragam dari SAS, pengaruh perlakuan terhadap gula pereduksi pada nilai F ... 48
Lampiran 4. Hasil analisis gula pereduksi pada optimasi ... 49
Lampiran 5a. Hasil statistik pengaruh optimasi variabel berpengaruh terhadap gula pereduksi menggunakan SAS ... 50
Lampiran 5b. Hasil analisis ragam dari SAS pada data hubungan regresi respon ... 50
Lampiran 5c. Hasil analisis residual dari SAS, pengaruh perlakuan terhadap gula pereduksi pada nilai F ... 50
Lampiran 5d. Hasil analisis ragam dari SAS, pengaruh perlakuan terhadap gula pereduksi pada nilai T ... 50
Lampiran 6. Hasil optimasi pengaruh faktor reaksi terhadap gula pereduksi ... 51
Lampiran 7. Metode Uji Fitokimia (Harborne, 1996) ... 52
Lampiran 8. Metode pembuatan pereaksi uji fitokimia ... 54
I.
PENDAHULUAN
A. LATAR BELAKANG
Kondisi industri gula di Indonesia dewasa ini semakin memprihatikankan. Hal tersebut dapat terlihat dari produksi gula nasional yang semakin menurun dari tahun ke tahun seperti disajikan pada Tabel 1 dan posisi indutri gula Indonesia diantara negara-negara produsen gula pada Tabel 2. Sementara kebutuhan konsumsi gula dalam negeri semakin meningkat. Untuk itu impor merupakan jalan keluar yang paling mudah untuk dilakukan. Tabel 1. Produksi, produktivitas dan rendemen gula nasional
Tahun Produksi gula (ton) Produktivitas Gula
(ton/ha)
Rendemen (%)
1993 2.482.724 5,90 6,60
1994 2.448.833 5,71 8,02
1995 2.096.471 4,98 6,97
1996 2.094.195 5,19 7,32
1997 2.189.974 5,68 7,83
1998 1.791.553 4,74 6,59
1999 1.488.599 4,37 6,96
2000 1.690.667 4,96 7,04
2001 1.725.467 5,01 6,85
2002 1.755.434 5,01 6,88
2003 1.631.919 4,86 7,21
2004 2.006.575 5,82 7,97
Tabel 2. Perbandingan rata-rata*) produktivitas tebu dan gula, serta rendemen antara negara produsen
Negara Rata-rata produktivitas tebu
(ton/ha)
Rata-rata rendemen (%)
Rata-rata produktivitas gula
(ton/ha)
Jepang 64,09 11,53 7,41
Thailand 56,76 10,97 6,24
Cina 59,16 11,84 7,00
India 69,33 10,90 7,56
Phillipina 60,70 8,26 5,00
Indonesia 70,13 7,05 4,95
USA 78,44 11,61 9,11
*) rata-rata dihitung dari Tahun 1996/97 sampai 2002/2003 Sumber: Sekretariat Dewan Ketahanan Pangan (2003)
Rendahnya produksi gula nasional disebabkan oleh produktivitas dan efisiensi industri gula rendah. Salah satu penyebab rendahnya produktivitas dan efisiensi industri gula adalah terjadinya kerusakan gula pada saat alat-alat pengolahan gula mengalami kerusakan (down time). Pada saat tersebut, nira gula menunggu untuk dilakukan pengolahan selanjutnya. Lamanya waktu menunggu tersebut menyebabkan degradasi gula (sukrosa) menjadi gula-gula sederhana (invert), seperti glukosa dan fruktosa atau senyawa turunan lainnya. Selain degradasi sukrosa, senyawa-senyawa hasil degradasi sukrosa tersebut dapat mengganggu proses kristalisasi, sehingga dapat menurunkan rendemen gula sukrosa.
Kerusakan sukrosa atau degradasi sukrosa karena proses inversi yang terjadi saat pembuatan gula dapat diakibatkan oleh adanya mikroorganisme dan enzim-enzim dalam nira. Selain adanya enzim karena dihasilkan oleh mikroorganisme, dalam nira tebu telah terkandung beberapa jenis enzim. Salah satu enzim yang ada pada nira dan dapat merusak sukrosa menjadi gula invert adalah invertase.
fruktosa. Penghambatan dapat dilakukan dengan menambahkan bahan penghambat atau disebut inhibitor pada saat proses inversi yang disebut proses inhibisi. Bahan inhibitor ini akan mengubah aktivitas dari suatu enzim dengan menggabungkannya dalam suatu jalur yang mempengaruhi ikatan substrat dan nilai “turn-over”nya. Bahan-bahan ini dapat berupa bahan alami maupun kimia (logam). Beberapa peneliti telah melakukan usaha untuk menghambat aktivitas invertase, seperti Mealor dan Townshend (1968) dalam Trojanowicz
et al (2004) menyatakan bahwa kation logam seperti Cu(II), Zn(II), Cd(II) dan Pb(II) dapat menghambat aktivitas invertase.
Selain penambahan inhibitor, penghambatan aktivitas enzim dapat dilakukan dengan memberikan kondisi ekstrim bagi reaksi inversi oleh invertase seperti suhu, pH maupun tekanan. Seperti penghambatan aktivitas invertase yang dilakukan oleh Cavaille dan Didier (1996) dengan mengkombinasikan perlakuan tekanan tinggi dan suhu, sedangkan menurut Causette et al (1998), perlakuan suhu dan tekanan yang tinggi akan mempengaruhi kualitas produk (sukrosa) akibat terjadinya reaksi lain yang tidak diinginkan (lateral reaction) sedangkan Causette et al (1998) melakukan inaktivasi enzim dengan menggunakan gelembung gas inert.
Penambahan bahan inhibitor harus disesuaikan dengan bahan atau produk yang akan dihambat aktivitas invertasenya hingga didapatkan hasil yang optimal (kondisi optimum penghambatan aktifitas enzim) dan tidak merugikan. Bahan inhibitor yang digunakan untuk produk makanan sebaiknya dari bahan alami seperti menggunakan umbi kentang (Solanum tuberosum L.). Ewing et al (1977) dan Pressey (1966) telah mengidentifikasi adanya inhibitor invertase di dalam umbi kentang. Pressey (1994) dan Weil et al (1994) dalam
Greiner et al (1998) juga telah melakukan studi mengenai adanya inhibitor invertase di dalam tembakau dan tomat.
kandungan sukrosa tinggi dapat dikurangi sehingga kualitas produk tetap baik bahkan diharapkan semakin meningkat dan aman untuk produk pangan.
B. TUJUAN
Penelitian ini bertujuan :
1. Mengetahui pengaruh faktor penghambat laju degradasi sukrosa oleh invertase yang meliputi suhu, pH, waktu dan inhibitor akar kawao (Milletia sericea)
II.
TINJAUAN PUSTAKA
A. SUKROSA
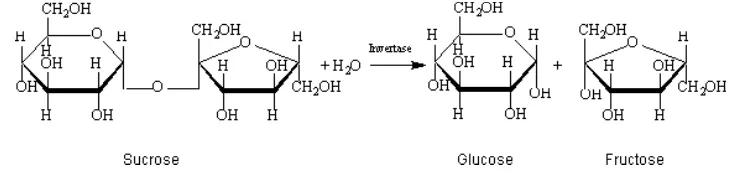
Sukrosa, biasanya diketahui sebagai gula meja (table sugar), merupakan disakarida yang dibentuk dari sebuah molekul α-D-glukosa dan molekul β -D-fruktosa yang dihubungkan oleh ikatan α-1, β-2 glikosidik. Ketika ikatan α-1, β-2 glikosidik terputus oleh reaksi hidrolisis, akan terbentuk campuran
glukosa dan fruktosa. Campuran monosakarida-monosakarida tersebut disebut sebagai gula invert (invert sugar), yang merupakan turunan dari sukrosa. Sukrosa dapat dihidrolisis dengan bantuan enzim yang disebut sebagai invertase atau sukrase (Wang, 2004). Reaksi hidrolisis sukrosa menjadi glukosa dan fruktosa dengan bantuan invertase dapat dilihat pada Gambar 1.
Gambar 1. Reaksi hidrolisis sukrosa menjadi glukosa dan fruktosa dengan bantuan invertase
Menurut Pennington dan Charles (1990) sukrosa adalah gula nonpereduksi dan stabil terhadap panas, larutan netral sampai suhu 100°C. Fruktosa akan terurai pada suhu 60°C dan glukosa maupun fruktosa tidak stabil pada larutan basa, pada kondisi seperti itu sukrosa umumnya paling stabil. Sukrosa akan berubah atau pecah menjadi dua komponen monosakarida, glukosa dan fruktosa dalam larutan asam. Reaksi ini akan dipercepat dengan peningkatan keasaman dan peningkatan suhu. Kebanyakan reaksi sukrosa dalam larutan termasuk metabolisme manusia, dimulai dengan reaksi inversi.
molekul fruktosa. Proses ini dipercepat dengan panas. Inversi larutan sukrosa murni diproses paling cepat sampai mendekati 5000 kali pada 90°C dibanding pada 20°C. Pada prakteknya reaksi ini terjadi pada pH dibawah 7 dan proses dipercepat dengan penurunan pH. Reaksinya adalah indotermik dengan energi aktivasi 25,9 kilokalori per mol pada 20°C. Reaksi ini dapat juga melalui katalisis biokimia dengan beberapa enzim, khususnya invertase (Pennington dan Charles, 1990).
B. INVERTASE
Secara molekuler enzim merupakan protein yang tersusun atas serangkaian asam amino dalam komposisi dan sekuens yang teratur dan tetap. Enzim merupakan biokatalisator yang diproduksi oleh sel hidup dan diklasifikasikan dalam dua kelompok yaitu enzim intraseluler yang bekerja di dalam sel dan enzim ekstraseluler yang bekerja di luar sel (Judoamidjojo et al., 1989).
Menurut Foyer et al (1997), enzim yang biasanya menghidrolisis sukrosa menjadi glukosa dan fruktosa adalah invertase. Glukosa dan fruktosa dilibatkan dalam memberi sinyal jaringan dengan perubahan sukrosa sel tanaman menjadi nutrisi yang dibutuhkan. Jadi aksi invertase memberikan isyarat sukrosa dengan memproduksi dua molekul masenjer sebagai hal yang penting pada proses ini. Sehingga invertase menjadi enzim dengan dua fungsi, sebagai katalis pemecah sukrosa dan pemberi informasi keadaan karbon.
Asam invertase (β-fruktosidase; EC 3.2.1.26) adalah enzim pengkatalis tidak balik yang memecah sukrosa menjadi glukosa dan fruktosa yang merupakan kunci enzim dalam metabolisme sukrosa dalam buah apel (Beruter 1985, Beruter et al. 1997) sebagai pengikat jaringan dalam tanaman (Quick and Schaffer 1996) (dalam PAN et al, 2005).
fungi lainnya. Reed (1966) dalam Pancoast (1980) menyatakan bahwa ragi
Saccharomyces cerevisiae dan S. carlsbergensis merupakan sumber utama penghasil invertase untuk aplikasi industri. Aspergillus orizae dan A. Niger
adalah fungi yang juga merupakan sumber invertase.
Invertase memecah ikatan antara dua gula dengan hidrolisis. Invertase termasuk dalam kelas enzim yang diketahui sebagai hidrolase. Beberapa dari enzim tersebut bekerja dengan memecah ikatan selain kerja yang lain dengan membelokkan ikatan pada waktu yang bersamaan. Enzim yang membelokkan ikatan pada waktu yang bersamaan dengan pemecahan mengakibatkan satu dari gula yang dilepaskan mengalami perubahan konfigurasi dari bentuk awal dirubah dari alpha menjadi beta (enzyme.co.uk).
Invertase tebu dimurnikan dari jaringan batang tebu dewasa menjadi bagian elektroforetikal yang sama dengan penukaran ion kromatografi DEAE-Cellulose dan CM-DEAE-Cellulose pada kolom kromatografi. Berat molekul enzim invertase murni adalah 218 kDa panda SDS-Polyacrylamid gel elektroforesis. Bila enzim dikarakterisasi ditemukan invertase tebu adalah glikoprotein alami dan mengandung 7,29 % gula. Aktivitas enzim tertinggi pada pH 7,2 dan suhu 60°C (Rahman et al., 2004).
C. AKTIVITAS DAN STABILITAS ENZIM
Aktivitas enzim didefinisikan sebagai kecepatan pengurangan substrat atau kecepatan pembentukan produk pada kondisi optimum. Satu unit aktivitas enzim selulase didefinisikan sebagai jumlah enzim yang menghasilkan satu mikromol gula reduksi (glukosa) setiap menit (Lehninger, 1993).
terdenaturasi, sedangkan pada suhu terlalu rendah beberapa enzim tidak dapat bekerja. Aktivitas enzim juga dipengaruhi oleh pH karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi pH.
Stabilitas dan aktivitas enzim ditentukan oleh konformasi tiga dimensinya. Aktivitas enzim pada suhu tinggi terjadi melalui dua mekanisme, yaitu mekanisme intrinsik dan ekstrinsik. Mekanisme intrinsik yaitu struktur enzim secara alamiah mendukung aktivitasnya yang dipengaruhi oleh faktor-faktor interaksi elektrostatik, interaksi hidrofobik, kandungan asam amino alifatik, ikatan disulfida, dan kekompakan struktur. Ikatan hidrofobik akan semakin kuat pada suhu tinggi untuk enzim termostabil, sebaliknya akan semakin lemah untuk enzim termolabil karena terjadi denaturasi. Mekanisme ekstrinsik yaitu terjadinya stabilitas panas akibat adanya interaksi multipoint dengan komponen-komponen lain dan adanya faktor penstabil panas, yaitu pengikatan substrat dengan komponen berberat molekul rendah, kontak antara protein-protein, gugus prostetik, kation logam dan lain-lain (Nam-Soo dan Kim, 1991).
Enzim merupakan salah satu jenis protein globular. Stabilitas dan aktivitas enzim ditentukan oleh konformasi tiga dimensinya yang dipengaruhi oleh struktur tertier protein. Terdapat empat jenis interaksi yang menstabilkan struktur tersebut pada suhu, pH dan konsentrasi ion normal, antara lain ikatan hidrogen, gaya tarik ionik, interaksi hidrofobik dan jembatan kovalen. (Lehninger, 1988).
D. DEGRADASI SUKROSA
Banyak faktor yang mempengaruhi laju reaksi suatu enzim. Diantaranya yang paling penting adalah konsentrasi substrat dan enzim. Beberapa faktor utama lainnya adalah suhu, pH, kekuatan ionik dan adanya inhibitor. Sesungguhnya, segala sesuatu yang mempengaruhi struktur tersier protein enzim akan mempengaruhi laju reaksi enzim (Page, 1989).
Laju degradasi sukrosa dapat diperlambat atau bahkan dihambat dengan penambahan inhibitor.
1. pH
Konsentrasi nyata H+ dan juga OH- di dalam larutan dinyatakan oleh nilai pH. Pengukuran pH adalah satu prosedur yang paling penting dan sering dipergunakan dalam biokimia karena pH menentukan banyak peranan penting dari struktur dan aktivitas makromolekul biologi, seperti aktivitas katalitik enzim (Lehninger, 1995).
Menurut Chaplin dan Bucke (1990) enzim adalah molekul ampoter yang mengandung sejumlah asam dan golongan dasar terutama pada sisi permukaan. Kondisi golongan ini akan berubah-ubah tergantung pada konstanta disosiasi asam dengan pH lingkungannya. Hal ini akan mempengaruhi keadaan total enzim dan beban distribusi pada permukaan luar dengan penambahan reaktif dari golongan aktif pengkatalis. Efek ini sangat penting pada sisi aktifnya. Perubahan yang terjadi pada kondisi pH mempengaruhi aktivitas, daya larut dan stabilitas enzim.
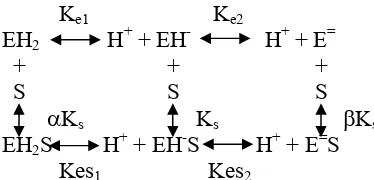
Perubahan laju enzim sebagai fungsi dari pH disebabkan oleh tiga faktor.
1. Status protonasi dari sisi cabang asam amino pada bagian aktif komplek enzim-substrat yang berubah, menghasilkan suatu perubahan dalam kemampuaanya memecah ES menjadi P (misal, perubahan pada Vmax).
2. Perubahan yang bersifat ion dari molekul substrat atau bagian yang aktif mengubah kecenderungan dua molekul untuk berkombinasi membentuk ES.
Ke1 Ke2
EH2 H+ + EH- H+ + E=
+ + + S S S αKs Ks βKs
EH2S H+ + EH-S H+ + E=S
Kes1 Kes2
Gambar 2. Model persmaan umum untuk pengaruh pH (Stauffer, 1989).
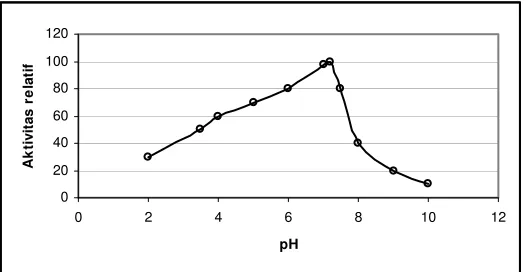
Nilai pH merupakan faktor yang juga berpengaruh terhadap aktivitas enzim. Kebanyakan dari enzim tidak aktif atau infaktif pada nilai pH yang ekstrim. Hal tersebut dapat disebabkan oleh nilai pH yang ekstrim dapat merusak protein yang merupakan komponen penyusun enzim. Pengaruh faktor nilai pH terhadap aktivitas enzim dapat dilihat pada Gambar 3 (Rahman et al., 2004).
0 20 40 60 80 100 120
0 20 40 60 80 100
Suhu (oC)
A k ti v ita s r e la ti f .
Gambar 3. Pengaruh nilai pH terhadap aktivitas invertase dari gula tebu (Rahman et al., 2004)
Berdasarkan Gambar 3, nilai pH merupakan faktor yang berpengaruh terhadap aktivitas invertase dari tebu gula. Peningkatan nilai pH dari 2 sampai dengan 7 dapat menyebabkan peningkatan aktivitas enzim. Dilain pihak, peningkatan pH di atas 7 dapat menyebabkan penurunan aktivitas invertase.
2. Suhu
mengandung air. Protein umumnya lebih stabil dalam konsentrat daripada larutan lemah. Dalam keadaan kering atau secara umum protein tersebut aktif dalam suatu periode sampai suhu 100°C.
Peningkatan suhu pada reaksi enzim mempunyai dua pengaruh, yaitu peningkatan suhu dapat meningkatkan laju reaksi dan peningkatan suhu meningkatkan laju inaktifasi enzim. Sesuai dengan aturan, peningkatan 10°C akan menyebabkan laju reaksi dua kalinya, sementara laju inaktifasi akan meningkat 64 kalilipat (Stauffer, 1989).
Suhu merupakan salah satu faktor yang dapat mempengaruhi aktivitas enzim. Peningkatan suhu dapat meningkatkan reaksi, akan tetapi peningkatan suhu yang tinggi akan menyebabkan denaturasi protein, sehingga akan menurunkan aktivitas enzim. Pengaruh suhu terhadap aktivitas invertase dapat dilihat pada Gambar 4 (Rahman et al., 2004).
0 20 40 60 80 100 120
0 2 4 6 8 10 12
pH A k ti v ita s r e la ti f
Gambar 4. Pengaruh suhu terhadap aktivitas invertase dari gula tebu (Rahman et al., 2004)
3. Konsentrasi Substrat dan Enzim
Pada konsentrasi substrat yang tinggi, acapkali ditemukan laju reaksinya lebih kecil dari nilai maksimum. Hal ini dapat diterapkan bahwa pada konsentrai tinggi tersebut, substrat dapat menghambat laju konversi menjadi produk. Jenis penghambatan ini akan membentuk komplek (dead end complex) satu sisi manakala molekul substrat terikat pada enzim, dan molekul substrat lain terikat pada sisi lain (sekunder) enzim. Sebagai contoh, invertase dihambat oleh sukrosa pada konsentrasi tinggi, penisilin asilase terhambat pada konsentrasi tinggi bensil penisilin (Suryani dan Mangunwidjaja, 2002).
Invertase dapat mengkatalisis sukrosa pada konsentrasi di atas 59%wt/vol. Peningkatan konsentrasi sukrosa lebih lanjut sampai 80%wt/vol menurunkan aktivitas enzim secara signifikan, mungkin disebabkan oleh konsentrasi air rendah, inhibisi oleh substrat atau agregasi substrat (Somiari dan Bielecki, 1995 dalam Filho et al, 1999).
Brown pada tahun 1902 melakukan penelitian tentang invertase, menyatakan bahwa bila konsentrasi sukrosa lebih tinggi daripada enzim, kecepatan reaksi menjadi tidak tergantung pada konsentrasi sukrosa (Pancoast, 1980).
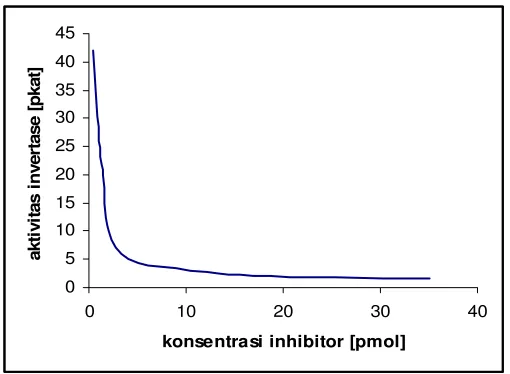
4. Inhibitor
0 5 10 15 20 25 30 35 40 45
0 10 20 30 40
konsentrasi inhibitor [pmol]
a kt ivi tas i n ve rt as e [p k at ]
Gambar 5. Pengaruh inhibitor terhadap aktifitas enzim
Banyak bahan yang dapat mengubah aktivitas suatu enzim dengan menggabungkannya dalam suatu jalur yang mempengaruhi ikatan substrat. Bahan-bahan yang mereduksi aktivitas suatu enzim dengan cara ini dikenal sebagai inhibitor. Inhibitor terbagi menjadi dua jenis, yakni inhibitor reversible yang membentuk kompleks dinamik dengan enzim dan inhibitor irreversible yang dikenal dengan racun pengkatalis (contohnya beberapa logam berat, seperti merkuri, Hg2+). Inhibitor mengikat molekul enzim dan menurunkan aktivitasnya (Flickinger dan Drew, 1999).
Aktivitas enzim sangat dipengaruhi oleh adanya berbagai senyawa dalam cairan reaksi. Beberapa zat yang dapat meningkatkan aktivitas enzim disebut aktivator. Sebaliknya beberapa zat yang dapat menurunkan aktivitas enzim disebut inhibitor. Gejala yang terakhir ini sering dijumpai berbagai reaksi enzimatik (Suryani dan Mangunwidjaja, 2002). Ada berbagai mekanisme dimana inhibitor enzim dapat bekerja. Mekanisme tersebut antara lain:
a. Penghambatan Kompetitif
b. Penghambatan Non-Kompetitif
Dalam inhibisi non-kompetitif, inhibitor mengikat secara langsung ke kompleks enzim-substrat tetapi tidak ke enzim bebas. Inhibisi yang tidak kompetitif menyatakan bahwa inhibitor ini akan mempengaruhi fungsi enzim tetapi tidak terhadap ikatan dengan substrat. Untuk enzim dengan substrat tunggal, sangat sulit untuk mengemukakan bagaimana hal ini terjadi dengan pengecualian terhadap inhibitor kecil.
c. Penghambatan Campuran
Inhibisi yang terjadi karena enzim dan senyawa substrat-enzim mengikat inhibitor. Inhibisi campuran berikatan dengan bagian (site) enzim yang ikut serta baik dalam pengikatan substrat dan katalisator. d. Penghambatan oleh produk
Sebagian besar enzimatik menghasilkan produk berupa penghambat. Jenis penghambat ini dapat berbentuk kompetitif atau bukan kompetitif. Beberapa contoh menyajikan penghambatan reaksi enzimatik oleh produk yang dihasilkan. Amiloglukosidase oleh glukosa, invertase oleh glukosa dan fruktosa, β-amilase oleh maltosa, dan lain-lain. Jenis penghambatan ini juga retroinhibition.
5. Kondisi Lingkungan
Inaktivasi enzim dan mikroorganisme dapat dilakukan dengan perlakuan suhu yang tinggi. Akan tetapi perlakuan suhu yang tinggi juga dapat menyebabkan perubahan produk, sehingga kualitasnya menurun. Metode lain yang dapat digunakan untuk menurunkan aktivitas enzim dan mikroorganisme tanpa merusak produk yang diinginkan adalah dengan cara pemberian gelembung gas inert. Pemberian gelembung gas inert nitrogen mampu menurunkan aktivitas enzim (Causette et al., 1998).
E. KAWAO ( Milletia sericea)
sampai ±1000 m dpl (Backer, Schoolflora). Akar warnanya kehitaman-hitaman, gemangnya sebesar jari tangan, bagian teras berair, sebagian dari akar keluar di atas lumpur. Menurut Teysmann (natuurk. Tijdschr v.N.I. jilid 34 hlm. 407) orang jawa memberikan sepotong akar dalam cairan palem yang masih segar (Bel het verse palmsap) agar cairan tersebut tidak menjadi asam (dalam Heyne, 1987).
Milletia sericea W. & A. (Pongamia sericea VENT.).
Nama daerah. Ind. : Akar mumba, A. tuba, Bori akar (manado) – Sunda :
Areuy kawao, Tuwa laleur.
F. ZAT-ZAT BIOAKTIF
Metabolisme sekunder saat ini dikenal penting pada kehidupan tanaman. Metabolit sekunder berfungsi sebagai sistem perlindungan melawan serangga, bakteri, virus dan fungi yang digunakan sebagai sistem kekebalan hewan (Vickery dan Vickery, 1981). Diantara senyawa metabolit sekunder ini terdapat terpenoid, fenol dan alkaloid.
1. Terpenoid
Terpenoid terdiri atas beberapa macam senyawa, mulai dari komponen minyak atsiri, yaitu monoterpena dan seskuiterpena yang mudah menguap (C10 dan C15), diterpena yang sukar menguap (C20),
sampai ke senyawa yang tidak menguap, yaitu triterpenoid dan sterol (C30), serta pigmen karotenoid (C40) (Harborne, 1987).
2. Fenol
Senyawa fenol meliputi aneka ragam senyawa yang berasal dari tumbuhan, yang mempunyai ciri sama yaitu cincin aromatik mengandung satu atau dua penyulih hidroksil. Senyawa fenol cenderung mudah larut di dalam air karena umumnya fenol berikatan dengan gula sebagai glikosida, dan biasanya terdapat pada vakuola sel.
satuan fenolik dijumpai pada protein, alkaloid dan di antara terpenoid (Harborne, 1987).
3. Alkaloid
Alkaloid umumnya mencakup senyawa basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan sebagai bagian dari sistem siklik. Alkaloid biasanya tanpa warna, seringkali bersifat optis aktif dan berbentuk kristal, hanya sedikit yang berupa cairan pada suhu kamar. Fungsi alkaloid dalam tumbuhan masih belum jelas, diduga sebagai pengatur tumbuh atau penghalau serta penarik serangga (Harborne, 1987).
Menurut Harbone (1996) alkaloid memiliki kelarutan yang berbeda. Alkaloid umumnya larut dalam pelarut lipofil tetapi dalam bentuk garamnya larut dalam pelarut hidrofil. Alkaloid dalam tanaman umumnya terdapat dalam bentuk garam, sehingga alkaloid dapat diekstrak dengan pelarut hidrofil.
III.
METODOLOGI
A. ALAT DAN BAHAN 3. Alat
Peralatan yang digunakan dalam penelitian antara lain alat gelas (erlenmeyer, tabung reaksi, gelas piala, pipet tetes, corong); peralatan ukur (pipet mikro, pipet volumetri, labu takar, termometer, spektrofotometer,
stopwatch dan timbangan); serta peralatan pendukung (water bath dan
vortex).
4. Bahan
Bahan-bahan yang digunakan dalam penelitian antara lain sukrosa, invertase dari SIGMA-Aldrich I 9253 dengan aktivitas 39 unit/mg, aquades, buffer pH 4; 4,5; 5; 6,5 dan 8. Dan bahan inhibitor alami yaitu akar kawao (Millettia sericea) diperoleh dari perkebunan agropolitan daerah Leuwiliang, Bogor. Bahan-bahan kimia lainnya seperti pereaksi DNS.
B. METODE PENELITIAN
Metode penelitian yang dilakukan terdiri atas tahapan penelitian dan prosedur penelitian. Penjelasan untuk tahapan maupun prosedur adalah sebagai berikut.
1. Tahapan Penelitian
Gambar 6. Diagram Alir Tahapan Penelitian a. Penentuan aktivitas invertase
Aktivitas enzim diukur berdasarkan definisi satu unit aktivitas invertase, yaitu banyaknya invertase yang dapat menghasilkan 1 mikromol gula pereduksi dari substrat sukrosa selama 1 menit pada kondisi percobaan. Kondisi yang digunakan adalah kondisi optimum invertase, yaitu pada suhu 55°C, di dalam larutan buffer asetat pH 4.5.
Slope yang diperoleh dari gula pereduksi yang dihasilkan pada setiap konsentrasi yang diujikan merupakan besarnya aktivitas enzim.
b. Karakterisasi akar kawao (Millettia sericea)
Karakterisasi akar kawao perlu dilakukan untuk mengetahui kandungan bahan aktif apa yang terkandung didalamnya. Dengan diketahui kandungannya maka diharapkan dapat diketahui sifat-sifat dari bahan tersebut. Karakterisasi akar kawao dilakukan dengan uji fitokimia akar kawao.
c. Penentuan pengaruh faktor reaksi
Penentuan faktor reaksi dilakukan dengan menginteraksikan nilai minimum dan maksimum faktor yang mempengaruhi aktivitas enzim. Faktor tersebut diantaranya adalah suhu, pH, waktu dan inhibitor akar
Penentuan Aktivitas Enzim
Penentuan Pengaruh Faktor Reaksi
Permukaan Respon Faktor Yang Berpengaruh Karakterisasi Akar Kawao (Millettia sericea)
Mulai
kawao (Millettia sericea) pada konsentrasi yang telah dipilih untuk mendapatkan kondisi optimum penghambatan aktivitas invertase terhadap laju degradasi sukrosa. Suhu yang digunakan adalah 60° - 80°C (X1), pH 5 – 8 (X2), konsentrasi inhibitor akar kawao (Millettia
sericea) 0,875 – 3,5 gr (X3) dan waktu 40-100 menit (X4). Konsentrasi
sukrosa yang digunakan adalah 25 g/l dan konsentrasi invertase yang digunakan ditentukan sampai batas absorbansi dapat terbaca yaitu 0,003 g/l dengan aktivitas 39 unit/mg. Hasil dari pengaruh faktor diolah secara statistika dengan SAS untuk mendapatkan bentuk pengaruh dan tingkat signifikansinya.
Rancangan percobaan yang digunakan untuk menentukan pengaruh faktor reaksi dalam penelitian ini adalah rancangan faktorial dua taraf (two level factoria design) dengan empat variabel proses, yaitu suhu reaksi (X1), pH reaksi (X2), konsentarsi inhibitor (X3) dan
waktu (X4). Nilai tertinggi dan terendah dari variabel yang
mempengaruhi reaksi disajikan pada Tabel 3. Tabel 3. Nilai rendah dan tinggi perlakuan
Jenis Perlakuan Kode Nilai rendah (-) Nilai tinggi (+) Suhu (°C) X1 60 80
pH X2 5 8
Inhibitor akar Kawao (gr) X3 0,875 3,5
Waktu (menit) X4 40 100
Model rancangan percobaan untuk mengetahui pengaruh variabel proses terhadap respon yang diinginkan adalah sebagai berikut:
4
Y = a
o+
∑
a
ix
i+
∑
a
ijx
ix
j i=1 i<jKeterangan:
Y : respon dari masing-masing perlakuan ao, ai, aij : parameter regresi
xi : pengaruh linier variabel utama
d. Permukaan respon faktor yang berpengaruh
[image:36.612.184.515.280.528.2]Penentuan permukaan respon hampir sama dengan penentuan faktor reaksi, namun selain dengan nilai rendah dan tinggi ditambah dengan nilai 1,68 dari nilai rendah maupun tinggi dengan menggunakan Metode Permukaan Respon (Response Surface Methodology). Rancangan faktorial untuk mengetahui permukaan respon dari masing-masing variabel reaksi yang berpengaruh dapat dilihat pada Tabel 4. Selanjutnya untuk mengetahui bentuk dari permukaan respon digunakan program STATISTICA.
Tabel 4. Rancangan faktorial dari masing-masing variabel reaksi yang berpengaruh Run Kode (X1) Kode (X2) Kode (X3) Suhu (°C) pH Inhibitor (gr)
1 -1 -1 -1 60 5 0,875 2 -1 -1 1 60 5 3,5 3 -1 1 1 60 8 3,5 4 1 -1 -1 80 5 0,875 5 1 -1 1 80 5 3,5 6 1 1 -1 80 8 0,875 7 -1 1 -1 60 8 0,875 8 1 1 1 80 8 3,5 9 0 0 0 70 6,5 2,1875 10 0 0 0 70 6,5 2,1875 11 1,68 0 0 86,8 6,5 2,1875 12 -1,68 0 0 53,2 6,5 2,1875 13 0 1,68 0 70 9 2,1875 14 0 -1,68 0 70 4 2,1875 15 0 0 1,68 70 6,5 4,4 16 0 0 -1,68 70 6,5 0
Model rancangan percobaan untuk mengetahui permukaan respon variabel reaksi inhibisi invertase dengan bahan alami adalah sebagai berikut:
4 4
Y = a
o+
∑
a
ix
i+
∑
a
ijx
ix
j+
∑
a
iix
i2 i=1 i<j i=1Keterangan :
Y : respon dari masing-masing perlakuan ao, ai, aij, aii : parameter regresi
xixj : pengaruh linier dua variabel
xi2 : pengaruh kuadratik variabel utama
2. Prosedur Penelitian
Prosedur percobaan yang dilakukan pada penelitian ini adalah sebagai berikut.
a. Penentuan aktivitas invertase
Larutan invertase 0.003 g/l sebanyak 1 ml dan larutan sukrosa 25 g/l sebanyak 1 ml disiapkan pada tabung reaksi. Masing-masing tabung reaksi kemudian diinkubasi di dalam water bath suhu 55°C sehingga suhu tersebut dicapai oleh larutan di dalam tabung reaksi. Selanjutnya sukrosa dimasukkan ke dalam tabung reaksi berisi invertase dan mulai diukur waktu reaksi (t=0). Reaksi dihentikan pada masing-masing waktu yang diujikan, yaitu 0, 30, 60, 90, 120, 180, 240, dan 300 (detik), dengan memasukkan 2 ml pereaksi DNS. Kemudian tabung tersebut dimasukkan ke dalam water bath pada suhu 95 °C selama 10 menit. Setelah 10 menit, tabung reaksi dikeluarkan dan didinginkan untuk diukur absorbansinya pada panjang gelombang 540 nm.
b. Karakterisasi akar kawao (Millettia sericea)
Karakterisasi akar kawao (Millettia sericea) dilakukan dengan membawa sampel akar kawao (Millettia sericea) ke tempat pengujian fitokimia bahan. Uji fitokimia dilakukan di Laboratorium Balai Penelitian Tanaman Rempah dan Obat, Balai Penelitian Tanaman Rempah dan Obat, Bogor.
c. Penentuan pengaruh faktor reaksi
kawao (Millettia sericea) dan larutan enzim 70 ml dan dimulai waktu reaksi. Reaksi dihentikan pada waktu 40 dan 100 menit untuk nilai waktu rendah dan tinggi dengan memasukkan DNS 2 ml pada tabung reaksi yang berisi sampel yang telah diambil dari masing-masing erlenmeyer. Penghentian reaksi untuk nilai tengah pada waktu 70 menit. Kemudian tabung tersebut dimasukkan ke dalam water bath
pada suhu 95 °C selama 10 menit. Setelah 10 menit, tabung reaksi dikeluarkan dan didinginkan untuk diukur absorbansinya pada panjang gelombang 540 nm.
d. Permukaan respon faktor yang berpengaruh
Prosedur untuk penentuan permukaan respon hampir sama dengan prosedur penentuan pengaruh faktor. Faktor-faktor yang berpengaruh dilakukan percobaan kembali untuk mendapatkan permukaan respon dari faktor yang berpengaruh.
IV.
HASIL DAN PEMBAHASAN
Penghambatan terhadap aktivitas invertase dalam mengkonversi sukrosa menjadi gula pereduksi dipengaruhi oleh beberapa faktor seperti suhu, pH, penambahan inhibitor dan waktu. Hasil penelitian mengenai pengaruh faktor reaksi terhadap penghambatan aktivitas invertase pada degradasi sukrosa dibagi atas beberapa bagian sesuai dengan tahapan penelitian. Pada tahap awal (A) disajikan aktivitas invertase yang digunakan dalam penelitian. Tahap kedua (B) menghasilkan karakteristik akar kawao (Milletia sericea) yang menunjukkan kandungan bahan aktif didalamnya. Hasil dari tahap ketiga (C) dari penelitian ini adalah faktor-faktor reaksi yang berpengaruh untuk menurunkan jumlah gula pereduksi dan tahap terakhir (D) disajikan permukaan respon dari faktor-faktor yang berpengaruh serta nilai terendah yang dicapai pada penelitian ini.
A. Aktivitas Invertase
Aktivitas katalitik enzim dapat diukur secara kuantitatif berdasarkan perubahan substrat yang dapat diubah menjadi produk setiap satuan waktu pada suatu reaksi kimia spesifik oleh enzim tersebut. Nilai aktivitas enzim yang diketahui menunjukkan kemampuan enzim dalam mengkatalisis suatu reaksi.
0 20 40 60 80 100
0 100 200 300 400
lam a inkubasi (de tik )
[image:40.612.170.492.81.253.2]ko n sen tr asi gl uk os a + fr uk tos a ( u M )
Gambar 7. Kurva aktivitas invertase, y = 0,3072 x
B. Karakteristik Kawao ( Milletia sericea)
Kawao merupakan tumbuhan perdu yang memanjat, tegak, panjang 10-30 m, biasa ditemukan di hutan-hutan dan di tepi-tepi sungai mulai dataran rendah sampai ± 1000 m dpl. Akar kawao (Milletia sericea) biasa digunakan oleh petani gula aren sebagai pengawet nira aren supaya tidak masam. Kandungan yang terdapat dalam akar kawao (Milletia sericea) dapat diketahui melalui uji fitokimia yang merupakan uji kualitatif terhadap bahan fitokimianya yang disajikan pada Tabel 5.
Tabel 5. Hasil uji fitokimia Kawao (Milletia sericea)
Jenis Contoh Jenis Pengujian Hasil Pengujian Akar Kawao Skrining fitokimia
- Alkaloid - Saponin - *Tanin - *Fenolik - Flavonoid - *Triterfenoid - *Steroid - Glikosida + + + + + - + + + + + + + + + + + + Keterangan :
* : tidak termasuk lingkup akreditasi + + : Positif
- : Negatif + + + : Positif kuat
+ : Positif + + + + : Positif kuat sekali
[image:40.612.150.512.476.657.2]flavonoid dan glikosida yang memberikan respon positif kuat sekali dengan pembentukan warna. Selain tiga bahan tersebut, bahan lain yang terdapat dalam akar kawao (Millettia sericea) dalam jumlah yang relatif lebih sedikit diantaranya saponin, fenolik, triterfenoid dan steroid. Bahan-bahan bioaktif yang terdapat dalam akar kawao (Millettia sericea) umumnya dikenal sebagai bahan antimikroba.
Flavonoid disintesis oleh tanaman untuk merespon infeksi akibat mikroba sehingga efektif secara in vitro terhadap mikroorganisme. Aktivitas flavonoid mungkin disebabkan oleh kemampuannya untuk membentuk kompleks dengan protein ekstraseluler dan terlarut, dan dengan dinding sel. Flavonoid yang bersifat lipofilik mungkin juga akan merusak membran mikroba. Senyawa flavonoid juga memperlihatkan efek inhibitori (penghambatan) terhadap berbagai virus. Menurut Iswantini et al.(2003), temu putih yang mengandung terpenoid, alkaloid dan flavonoid berpotensi tinggi sebagai antikanker. Ekstrak kasar flavonoid temu putih pada berbagai konsentrasi dibawah nilai LC50-nya mempunyai daya hambat terhadap
aktivitas tirosin kinase melebihi inhibitor sintetis genistein. Daya hambat tertinggi diperoleh dari fraksi teraktif ekstrak kasar flavonoid temu putih, yaitu sebesar 93,4 %.
Alkaloid merupakan senyawa nitrogen heterosiklik dan memiliki efek antimikroba. Alkaloid dalam tanaman herbal biasanya diekstrak untuk dimanfaatkan sebagai bahan dasar obat-obatan. Selain senyawa alkaloid, senyawa dalam tanaman yang biasa digunakan sebagai obat adalah senyawa glikosida. Salah satu manfaat dari senyawa glikosida pada tanaman adalah sebagai bahan antikanker seperti senyawa yang lain seperti alkoloid. Alkaloida merupakan racun, senyawa tersebut menunjukkan aktivitas fisiologis yang luas, hampir tanpa terkecuali bersifat basa. Umumnya mengandung nitrogen dalam cincin heterosiklik, diturunkan dari asam amino, biasanya terdapat dalam tanaman sebagai garam asam organik.
Bahan glikosida dapat menghambat pertumbuhan penyakit seperti pada penelitian Jaime Rodriguez, Rita Castro dan Ricardo Riguero menunjukkan senyawa aktif triterpen glikosida menghambat pertumbuhan tumor pada sel limfoid, sel tumor paru manusia, sel tumor serviks, dan melanoma tikus pada kisaran konsentrasi 0,38-0,46 mg/ml.
C. Pengaruh Faktor Reaksi
Proses degradasi sukrosa menjadi gula pereduksi (glukosa dan fruktosa) oleh invertase dipengaruhi oleh beberapa faktor, diantaranya suhu, pH, waktu dan bahan inhibitor. Faktor-faktor tersebut dapat dioptimalkan sehingga laju degradasi sukrosa oleh invertase dapat dihambat. Pada penelitian ini dilakukan interaksi antar faktor yang berpengaruh terhadap hasil degradasi sukrosa menjadi gula pereduksi. Gula pereduksi hasil degradasi dianalisis dengan metode DNS (dinitrosalicylate), kemudian hasil analisis dihitung secara statistik sehingga dapat diketahui pengaruh linier dari faktor-faktor reaksi tersebut.
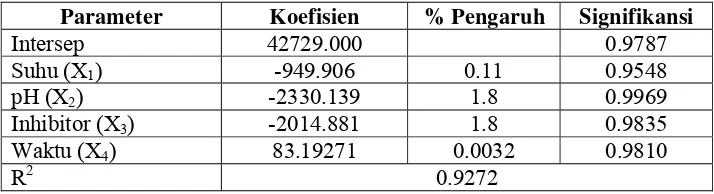
Koefisien parameter dan nilai signifikansi analisis jumlah gula pereduksi hasil degradasi sukrosa disajikan pada Tabel 6.
Tabel 6. Parameter Koefisien dan Nilai Signifikansi
Parameter Koefisien % Pengaruh Signifikansi
Intersep 42729.000 0.9787 Suhu (X1) -949.906 0.11 0.9548
pH (X2) -2330.139 1.8 0.9969
Inhibitor (X3) -2014.881 1.8 0.9835
Waktu (X4) 83.19271 0.0032 0.9810
R2 0.9272
Hasil analisis statistik menunjukkan bahwa faktor-faktor reaksi yang diberikan yaitu suhu (X1), pH (X2) dan inhibitor akar kawao (Millettia sericea)
(X3) memberikan pengaruh terhadap penurunan hasil degradasi sukrosa
menjadi glukosa dan fruktosa, sedangkan faktor waktu tidak memberikan pengaruh terhadap penurunan laju degradasi sukrosa. Ketiga faktor (suhu, pH dan inhibitor akar kawao(Millettia sericea) tersebut mempunyai pengaruh yang negatif terhadap jumlah gula pereduksi hasil degradasi sukrosa atau memberikan respon positif terhadap penghambatan laju degradasi sukrosa. Data dan analisis gula pereduksi yang dihasilkan dari proses degradasi sukrosa disajikan pada Lampiran 2.
Berdasarkan Tabel 6 faktor yang paling berpengaruh adalah faktor pH pada selang kepercayaan 99,69 persen dengan memberikan pengaruh negatif pada jumlah gula pereduksi atu memberikan respon positif terhadap penurunan laju degradasi sukrosa. Pengaruh negatif dari faktor pH artinya dengan semakin meningkatnya pH pada proses reaksi menyebabkan jumlah gula pereduksinya menurun.
Perubahan kedudukan ionisasi rantai samping asam amino dapat mempengaruhi bagian sisi aktif enzim dengan adanya perubahan pH sehingga aktivitasnya menurun karena mengganggu pengikatan substrat dengan enzim.
Perlakuan pH yang diberikan dapat menurunkan laju degradasi sukrosa karena perubahan pH yang berarti nilai pKa lingkungan juga berubah dapat merubah permukaan sisi aktif enzim sehingga mengganggu proses pengikatan enzim dengan substrat pada sisi aktif enzim dan pada akhirnya tidak terbentuk produk. Menurut Winarno (1995) pada umumnya enzim bersifat amfolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya, terutama pada gugus residu terminal karboksil dan gugus terminal aminonya. Perubahan keaktifan enzim diperkirakan akibat perubahan pH lingkungan disebabkan terjadinya perubahan ionisasi enzim, substrat atau komplek enzim substrat.
Aktivitas enzim paling besar terjadi pada pH optimum untuk reaksinya. Invertase pH optimumnya 4,5 dan aktif diantara pH 3.0 dan 5,5 (NCBE Enzymes for Education, 2004), sedangkan pada penelitian ini diberikan perlakuan dari pH 5 sampai pH 8 yang mengakibatkan kerusakan struktur protein invertase sehingga gula pereduksi yang dihasilkan semakin menurun seiring meningkatnya pH. Kerusakan struktur enzim dapat disebabkan terganggunya ikatan kovalen dalam kerangka polipeptida, yaitu ikatan hidrogen antara gugus R-residu. Menurut Martin et al (1981) perubahan enzim mempengaruhi aktivitas enzim baik perubahan struktur ataupun dengan berubahnya fungsi akibat ikatan substrat atau katalisis.
Pada kondisi basa aktivitas invertase rendah karena ion OH- yang berlebihan. Kelebihan ion OH- akan berakibat berubahnya muatan enzim sehingga mengganggu pengikatan enzim dengan substrat. Pada pH tinggi, ion substrat (SH+) mengalami ionisasi dan kehilangan muatan positif :
S H+ S + H+
menurun hal tersebut disebabkan oleh terganggunya interaksi antara enzim dengan sukrosa sebagai substrat untuk membentuk produk berupa gula pereduksi.
Faktor kedua yang berpengaruh terhadap jumlah gula pereduksi hasil degradasi sukrosa oleh invertase adalah bahan inhibitor akar kawao (Millettia sericea) (X3). Pada tingkat kepercayaan 98,35 persen, akar kawao (Millettia
sericea) memberikan pengaruh positif terhadap penurunan laju degradasi sukrosa. Pengaruh dari akar kawao (Millettia sericea) yaitu dengan semakin tinggi konsentrasi kawao (Millettia sericea) yang diberikan menyebabkan jumlah gula pereduksi menurun.
Kandungan akar kawao (Millettia sericea) yang diduga dapat menginhibisi atau menghambat aktivitas invertase adalah senyawa alkaloid. Diantara beberapa jenis bahan inhibitor invertase, bentuk lainnya seperti glikoprotein, polipeptida dan alkaloid (Trojonowics., et al, 2004). Proses inhibisi terjadi apabila sisi aktif enzim yang biasa berikatan dengan substrat digantikan oleh senyawa dari kawao, maka sifat inhibisinya kompetitif. Sifat inhibisi lain yang mungkin terjadi yaitu inhibisi non-kompetitif. Proses tersebut terjadi apabila inhibitor mengikat pada kompleks enzim substrat sehingga mempengaruhi fungsi enzim tetapi tidak mempengaruhi ikatan dengan substrat.
Proses inhibisi invertase oleh akar kawao (Millettia sericea) dapat terjadi karena senyawa bioaktif dari akar kawao (Millettia sericea) membentuk komplek dengan protein dalam hal ini protein enzim melalui ikatan non-spesifik seperti ikatan hidrogen dan efek hidrofobik sebagaimana pembentukan ikatan kovalen. Dengan adanya komplek enzim dengan senyawa dari akar kawao (Millettia sericea) maka struktur dari enzim akan berubah sehingga daya katalitik terhadap substratnya terganggu.
penghambatan laju degradasi sukrosa. Naiknya jumlah gula pereduksi yang dihasilkan mungkin terjadi karena kandungan gula yang terdapat dalam akar kawao (Millettia sericea) terekstrak dengan semakin lamanya waktu reaksi.
Namun pada kenyataannya akar kawao (Millettia sericea) tetap dapat memberikan efek penghambatan terhadap aktivitas invertase. Pengaruh positif waktu tehadap kenaikan jumlah gula pereduksi bukan berarti akar kawao (Millettia sericea) tidak bisa menghambat aktivitas enzim namun apabila waktu reaksi melebihi waktu maksimal efektivitas akar kawao (Millettia sericea) sebagai inhibitor maka senyawa aktif tersebut telah rusak dan gula dalam akar kawao semakin banyak terekstrak dan terukur sebagai gula pereduksi.
Pada selang kepercayaan 95,48 persen, suhu (X1) memberikan pengaruh
yang signifikan terhadap penurunan laju degradasi sukrosa. Suhu reaksi mempunyai pengaruh negatif terhadap laju degradasi sukrosa atau memberikan respon positif terhadap penurunan laju degradasi sukrosa. Semakin tinggi suhu reaksi yang diberikan menyebabkan jumlah gula pereduksi yang dihasilkan menurun.
Menurunnya jumlah gula pereduksi yang dihasilkan disebabkan oleh aktivitas invertase menurun. Aktivitas invertase rendah karena bagian apoenzim yang tersusun atas protein rusak akibat suhu tinggi. Rusaknya struktur enzim mengakibatkan enzim kehilangan daya katalitiknya sehingga tidak optimal untuk mengkonversi sukrosa menjadi gula-gula pereduksi. Sementara aktivitas enzim untuk mengkatalisis suatu reaksi mempunyai kisaran suhu tertentu. Invertase (biasa disebut sukrase atau sakarase) memecah disakarida sukrosa menjadi monosakarida glukosa dan fruktosa. Enzim ini aktif antara suhu 10°C dan 65°C. Inaktifasinya mulai 65°C dan enzim total tidak aktif setelah 5 menit pada suhu 90°C (NCBE Enzymes for Education, 2004). Bila invertase diberikan pada suhu diatas 65°C maka enzim tersebut sudah mulai tidak aktif untuk menghidrolisis sukrosa dan menghasilkan gula pereduksi yang rendah. Hal tersebut karena enzim telah rusak, kerusakan enzim yang merupakan protein dapat berupa berubahnya konfigurasi struktur. Menurut Simanjuntak (2006) diatas suhu tertentu enzim akan kehilangan ikatan kuat dari struktur dalam 3 dimensi yang berguna untuk aktivitas katalitik.
Tabel 7. Parameter Interaksi, Koefisien dan Nilai Signifikansi
Parameter Koefisien Signifikansi
Interaksi X1 dan X2 28.979 0.9960
Interaksi X1 dan X3 16.393 0.9493
Interaksi X1 dan X4 -0.578646 0.9150
Interaksi X2 dan X3 126.746 0.9669
Interaksi X2 dan X4 -4.920139 0.9531
Interaksi X3 dan X4 -1.134921 0.6490
R2 0,9272
tajam terjadi saat pH dinaikan pada suhu di nilai tinggi (80°C), sedangkan penurunan laju degradasi sukrosa pada suhu di nilai rendah (60°C) lebih curam dikarenakan kenaikan pH mempunyai pengaruh negatif terhadap respon. suhu rendah suhu rendah suhu tinggi suhu tinggi 0 500 1000 1500 2000 2500
pH rendah pH tinggi
[image:48.612.164.503.162.343.2]pH gul a pe re duk s i ( µ m ol )
Gambar 8. Interaksi antara suhu reaksi (X1) dan pH (X2) terhadap jumlah
gula pereduksi
Perbedaan kemiringan pada penurunan gula pereduksi disebabkan oleh suhu tinggi (80°C). Pada suhu tinggi enzim telah mengalami denaturasi sehingga dengan kenaikan pH tidak terlalu berpengaruh terhadap penurunan jumlah gula pereduksi.
pH rendah pH rendah pH tinggi pH tinggi 0 200 400 600 800 1000 1200 1400 1600 1800 2000
inhibitor rendah inhibitor tinggi
inhibitor gul a pe re duk s i (µ M )
Gambar 9. Interaksi antara pH (X2) dan bahan inhibitor akar kawao
[image:48.612.167.509.477.658.2]Interaksi pH dengan bahan inhibitor akar kawao (Millettia sericea) berpengaruh positif terhadap laju degradasi sukrosa. Interaksi kedua faktor berpengaruh pada tingkat kepercayaan 96,69 persen. Interaksi faktor reaksi terhadap gula pereduksi disajikan pada Gambar 9. Gambar tersebut menunjukkan dengan semakin tinggi konsentrasi akar kawao (Millettia sericea) yang diberikan pada nilai pH rendah dapat menurunkan jumlah gula pereduksi, namun pada konsentrasi akar kawao (Millettia sericea) tinggi jumlah gula pereduksi yang dihasilkan meningkat. Pada konsentrasi akar kawao (Millettia sericea) rendah laju penurunan degradasi sukrosa lebih besar karena dipengaruhi oleh peningkatan pH yang dapat merusak struktur protein enzim sehingga daya katalitik enzim untuk mengkonversi sukrosa menjadi gula pereduksi menjadi rendah.
Perbedaan kemiringan antara garis pH rendah dengan garis pH tinggi mengindikasikan adanya kenaikan gula pereduksi pada nilai inhibitor tinggi (8) seiring penambahan konsentrasi inhibitor kawao (Millettia sericea). Peristiwa tersebut mungkin disebabkan oleh senyawa bioaktif akar kawao (Millettia sericea) tidak stabil atau rusak pada pH tinggi sehingga tidak efektif lagi sebagai inhibitor ataupun kandungan gula yang mungkin ada dalam akar kawao (Millettia sericea) terekstrak dan terhidrolisis selama proses reaksi. Menurut Robinson (1993) saponin merupakan senyawa glikosida terpenoid atau glikosida steroid dan bersifat polar. Jadi seiring bertambahnya jumlah akar kawao (Millettia sericea) yang diberikan maka gula pereduksi yang dihasilkan juga bertambah. Namun pada pH rendah dengan penambahan inhibitor akar kawao (Millettia sericea) dapat menurunkan laju degradasi sukrosa yang artinya inhibitor akar kawao (Millettia sericea) dapat bekerja efektif pada kisaran pH tertentu. Apabila inhibitor akar kawao (Millettia sericea) digunakan diluar kisaran pH optimumnya maka akar kawao (Millettia sericea) tidak efektif lagi sebagai bahan inhibitor.
pH rendah pH rendah pH tinggi pH tinggi 0 200 400 600 800 1000 1200 1400 1600 1800 2000
waktu rendah waktu tinggi
[image:50.612.168.508.81.261.2]waktu gu la p e re du k s i (µ M )
Gambar 10. Interaksi antara pH (X2) dan waktu (X4) terhadap jumlah
gula pereduksi
Pada Gambar 10 dengan semakin lama waktu reaksi maka jumlah gula pereduksi yang dihasilkan semakin meningkat. Peningkatan jumlah gula pereduksi pada pH rendah lebih curam dibandingkan dengan pH tinggi. Hal tersebut membuktikan bahwa enzim rusak pada pH tinggi atau pH tinggi terbukti lebih efektif terhadap penghambatan enzim.
Interaksi suhu reaksi dengan inhibitor akar kawao (Millettia sericea) berpengaruh positif terhadap laju degradasi sukrosa. Interaksi kedua faktor berpengaruh pada tingkat kepercayaan 94,93 persen. Interaksi faktor reaksi terhadap gula pereduksi disajikan pada Gambar 11.
inhibitor rendah inhibitor rendah inhibitor tinggi inhibitor tinggi 0 200 400 600 800 1000 1200 1400 1600
suhu rendah suhu tinggi
suhu g u la p e re d u ksi ( µ mo l)
Gambar 11. Interaksi antara suhu (X1) dan inhibitor akar kawao (Millettia
[image:50.612.164.503.489.665.2]Pada Gambar 11 diketahui bahwa kenaikan suhu berpengaruh pada penurunan laju degradasi sukrosa yang dibuktikan dengan menurunnya jumlah gula pereduksi yang dihasilkan. Namun, terdapat perbedaan kemiringan antara garis inhibitor rendah dengan garis inhibitor tinggi yang mengindikasikan adanya penurunan jumlah gula pereduksi lebih tinggi untuk nilai rendah inhibitor (0,875 g) saat suhu dinaikkan. Penurunan gula pereduksi untuk inhibitor rendah lebih curam dibandingkan dengan inhibitor tinggi seiring kenaikan suhu. Hal tersebut dapat disebabkan oleh sisi aktif enzim telah terganggu oleh adanya inhibitor dengan konsentrasi tinggi sehingga semakin meningkatnya suhu, pengaruh terhadap penurunan gula pereduksi tidak sebesar pada konsentrasi inhibitor rendah.
Penurunan laju degradasi sukrosa pada inhibitor tinggi tidak sebesar penurunan dengan penambahan inhibitor rendah. Hal tersebut terjadi selain karena aktivitas enzim telah terganggu oleh adanya inhibitor akar kawao tetapi juga oleh adanya kandungan gula yang ada dalam akar kawao (Millettia sericea). Dengan semakin tingginya konsentrasi akar kawao (Millettia sericea) yang diberikan maka kandungan gula yang mungkin terekstrak secara tidak langsung selama reaksi dan terjadi hidrolisis dengan kenaikan suhu semakin tinggi. Kandungan gula akibat hidrolisis tersebut dapat meningkatkan nilai pengukuran terhadap gula pereduksi akibat konversi sukrosa oleh invertase.
suhu rendah suhu rendah suhu tinggi suhu tinggi 0 200 400 600 800 1000 1200 1400 1600 1800
waktu rendah waktu tinggi
[image:52.612.169.509.82.280.2]waktu gul a pe re duk s i ( µ M )
Gambar 12. Interaksi antara suhu (X1) dan waktu (X4) terhadap jumlah
gula pereduksi
D. Permukaan Respon
Respon faktor-faktor yang mempengaruhi laju degradasi sukrosa dapat diketahui dengan menggunakan Metode Permukaan Respon, yaitu suatu bentuk analisa yang digunakan pada respon yang dipengaruhi oleh beberapa faktor dan bertujuan untuk menentukan kondisi optimum dari respon tersebut. Analisis statistik terhadap pengaruh linier dari faktor reaksi terhadap respon berguna untuk mengetahui besarnya pengaruh dari masing-masing faktor dan interaksinya terhadap respon. Hasil analisis pengaruh linier faktor reaksi, yaitu suhu, pH dan inhibitor akar kawao (Millettia sericea) mempunyai pengaruh yang nyata terhadap jumlah gula pereduksi. Analisis selanjutnya bertujuan untuk memperoleh kondisi terbaik penurunan laju degradasi sukrosa sehingga didapatkan jumlah gula pereduksi yang minimum.
Hasil analisis dengan metode permukaan respon disajikan pada Gambar 13. Gambar 13, merupakan gambar permukaan respon dari model persamaan :
Y = 310,5725 - 199,914X1 - 359,399X2 – 124,74X3 + 144,629 X12 + 711,813
Pada model persamaan diketahui bahwa kenaikan suhu mempunyai pengaruh negatif pada jumlah gula pereduksi. Faktor lainnya juga memberikan pengaruh negatif pada jumlah gula pereduksi dengan selang kepercayaan 93,03 untuk pH dan 90,8 untuk penambahan inhibitor akar kawao (Millettia sericea). Hal tersebut menunjukkan dengan semakin naiknya nilai suhu, pH dan inhibitor akar kawao (Millettia sericea) dapat menurunkan laju degradasi sukrosa dengan menurunnya jumlah gula pereduksi karena aktivitas dari invertase dapat dihambat oleh faktor-faktor tersebut. Model persamaan diperoleh dari hasil analisis statistik yang disajikan di Lampiran 5.
Gambar 13. Permukaan respon dari gula pereduksi sebagai fungsi dari suhu, pH dan inhibitor akar kawao (Millettia sericea).
Hasil analisis canonical terhadap permukaan respon diketahui bahwa model permukaan respon berbentuk sadel (saddle point). Hal tersebut menyebabkan nilai optimum tidak dapat ditentukan dari model permukaan respon. Perkiraan nilai terbaik diperoleh dari estimasi nilai minimum respon. Jumlah gula pereduksi minimum adalah 155,1 µM dengan kondisi reaksi : suhu 72,48°C, pH 6,19 dan konsentrasi akar kawao (Millettia sericea) 3,49 g.
2500 2000 1500 1000 500 0
-500
2500 2000 1500 1000 500 0 -500
[image:54.612.135.505.77.275.2](a) (b)
Gambar 14. Permukaan respon dari gula pereduksi pada konsentrasi akar kawao (Millettia sericea) tetap, (a) sisi pada pH rendah dan sisi pada suhu tinggi, (b) sisi pada pH tinggi dan sisi pada suhu rendah
Dari Gambar 14a dapat diketahui bahwa pada pH rendah gula pereduksi mengalami penurunan tajam seiring kenaikan suhu. Namun pada suhu tinggi gula pereduksi mengalami kenaikan yang tidak begitu tajam seiring dengan kenaikan pH. Jumlah gula pereduksi rendah terjadi saat pH rendah dan suhu reaksi berada di nilai tinggi.
Pada Gambar 14b, gula pereduksi mengalami penurunan seiring turunnya suhu pada pH tinggi. Pada suhu rendah gula pereduksi naik dengan tajam sejalan dengan penurunan pH. Pada suhu rendah dan pH tinggi menghasilkan jumlah gula pereduksi yang terendah. Jadi jumlah gula pereduksi tertinggi saat nilai pH rendah dengan suhu rendah
2000 1500 1000 500 0
-500
2000 1500 1000 500 0 -500
[image:55.612.134.505.80.251.2](a) (b)
Gambar 15. Permukaan respon dari gula pereduksi pada suhu tetap, (a) sisi pada inhibitor rendah dan sisi pada pH tinggi, (b) sisi pada inhibitor rendah dan sisi pada pH rendah
Dari Gambar 15a, diketahui bahwa jumlah gula pereduksi menurun tajam seiring dengan kenaikan pH saat konsentrasi inhibitor rendah. Sedangkan pada pH tinggi gula pereduksi cenderung naik terhadap kenaikan konsentrasi inhibitor akar kawao (Millettia sericea). Jumlah gula pereduksi maksimum terjadi saat kondisi pH rendah dengan konsentrasi inhibitor juga rendah. Pada saat nilai pH tinggi dan konsentrasi inhibitor rendah jumlah gula pereduksi rendah.
Pada Gambar 15b, gula pereduksi mengalami penurunan cenderung landai dengan turunnya nilai pH pada konsentrasi inhibitor tinggi. Jumlah gula pereduksi naik tajam seiring turunnya konsentrasi inhibitor pada nilai pH rendah. Jadi jumlah gula pereduksi tertinggi pada nilai pH rendah dengan konsentrasi inhibitor rendah, sedangkan nilai gula pereduksi terendah saat nilai pH tinggi dengan konsentrasi inhibitor rendah.
saat konsentrasi inhibitor rendah dengan suhu reaksi yang diberikan juga rendah. Sehingga nilai minimum gula pereduksi tercapai pada saat diberikan inhibitor berupa akar kawao (Millettia sericea) pada konsentrasi tinggi dan dicapai juga saat diberikan suhu reaksi yang tinggi.
1400 1000 600 200 -200
1400 1000 600 200 -200
[image:56.612.134.506.184.370.2](a) (b)
Gambar 16. Permukaan respon dari gula pereduksi pada nilai pH tetap, (a) sisi pada inhibitor rendah dan sisi pada suhu tinggi, (b) sisi pada inhibitor tinggi dan sisi pada suhu rendah
V.
KESIMPULAN
A. KESIMPULAN
Laju degradasi sukrosa oleh invertase dapat dihambat dengan mengoptimumkan faktor yang berpengaruh pada aktivitas invertase. Faktor yang berpengaruh terhadap jumlah gula pereduksi adalah suhu reaksi, pH dan konsentrasi inhibitor berupa akar kawao (Milletia sericea). Suhu reaksi berpengaruh negatif terhadap laju degradasi sukrosa pada tingkat signifikansi 95,48 persen. pH berpengaruh negatif terhadap laju degradasi sukrosa pada tingkat signifikansi 99,69 persen dan konsentrasi inhibitor akar kawao berpengaruh negatif pada tingkat signifikansi 98,35 persen. Namun faktor waktu berpengaruh positif pada tingkat signifikansi 98,1 persen.
Interaksi antara suhu dengan pH berpengaruh positif pada tingkat signifikasi 99,6%. Interaksi antara pH dan konsentrasi inhibitor akar kawao (Milletia sericea) berpengaruh positif pada tingkat signifikasi 96,69%. Interaksi antara pH dan waktu berpengaruh positif pada tingkat signifikansi 95,31%. Interaksi antara suhu dan konsentrasi inhibitor berpengaruh negatif pada tingkat signifikansi 94,93%. Interaksi antara waktu dan konsentrasi inhibitor akar kawao (Milletia sericea) berpengaruh negatif pada tingkat signifikansi 91,5 %.
Hasil pendugaan nilai terendah dari jumlah gula pereduksi yang menunjukkan penurunan laju degradasi sukrosa sebesar 155,1 µM dihasilkan dengan nilai faktor reaksi suhu 72,48°C, pH 6,19 dan konsentrasi akar kawao (Milletia sericea) sebesar 3,49 g. Hasil analisis canonical terhadap permukaan respon diketahui bahwa model permukaan respon berbentuk sadel (saddle point). Hal tersebut menyebabkan nilai optimum tidak dapat ditentukan dari model permukaan respon. Model dari permukaan respon yang menghasilkan nilai tersebut adalah
Y = 310,5725 - 199,914X1 - 359,399X2 – 124,74X3 + 144,629 X12 + 711,813