AKTIVITAS ANTIPROLIFERASI EKSTRAK DAUN JAMBU
BIJI (Psidium guajava) TERHADAP SEL KANKER
PAYUDARA MCF-7
IGNASIUS SETIADI LEMA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi Aktivitas Antiproliferasi Ekstrak Daun Jambu Biji (Psidium guajava) Terhadap Sel Kanker Payudara MCF-7 adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
ABSTRAK
IGNASIUS SETIADI LEMA. Aktivitas Antiproliferasi Ekstrak Daun Jambu Biji (Psidium guajava) terhadap Sel Kanker Payudara MCF-7. Dibimbing Oleh IRMA HERAWATI SUPARTO dan DEDEN SAPRUDIN.
Ekstrak daun jambu biji memiliki bahan aktif yang diharapkan mampu menghambat proliferasi sel kanker dan tidak bersifat toksik terhadap sel yang normal. Oleh karena itu, penelitian ini bertujuan mengevaluasi efek antiproliferasi dari ekstrak daun jambu biji terhadap sel kanker payudara MCF-7. Evaluasi hambatan ditentukan dengan menggunakan uji 3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolium bromida (MTT). Hasil penelitian menunjukkan kandungan metabolit sekunder simplisia daun jambu biji adalah flavonoid, saponin, tanin, dan triterpenoid. Nilai IC50 dari ekstrak kasar etanol 70% terhadap sel MCF-7 sebesar
35 ppm. Ekstrak menghambat pertumbuhan sel kanker payudara MCF-7 secara maksimal pada konsentrasi 100 ppm tanpa menghambat pertumbuhan sel normal Chang. Fraksionasi dengan eluen terbaik campuran kloroform dan metanol (6:4) menghasilkan fraksi 4 yang memiliki sifat toksisitas selektif paling baik dengan nilai IC50 sebesar 378 ppm. Berdasarkan analisis gugus fungsi menggunakan
spektrofotometer infra merah terhadap fraksi 4, terdapat serapan C=C aromatik, ulur –CH2 asimetrik, C–O eter, dan –OH.
Kata kunci: daun jambu biji, sel MCF-7, spektrofotometer infra merah, uji MTT
ABSTRACT
IGNASIUS SETIADI LEMA. Antiproliferation Activity of Psidium guajava Leaf Exctract on Breast Cancer MCF-7 Cells. Supervised by IRMA HERAWATI SUPARTO and DEDEN SAPRUDIN.
Guava leaf extract contains active compound that could inhibit the proliferation of cancer cells and non-toxic to normal cells. Therefore, the purpose of this study was to evaluate the antiproliferation effect of guava leaf extract on breast cancer MCF-7 cells. MTT (3-(4,5-dimethylthiazolyl-2)-2,5-diphenyltetrazolium bromide) assay was used to test the anticancer effect. The result showed that guava leaf contained secondary metabolites as flavonoids, saponins, tannins and triterpenoids. The IC50 value of 70% ethanol extract to
7 cells was 35 ppm. The ethanol extract inhibited the proliferation of MCF-7 at 100 ppm without inhibited Chang cells. Further fractionation with chloroform and methanol (6:4) as eluent gave a fourth fraction showing excellent selective toxicity with IC50 value of 378 ppm. Based on functional group identification on
this particular fraction using infra-red spectrophotometer, there were aromatic C=C, asymmetric –CH2 stretching, C–O ether, and –OH absorptions.
AKTIVITAS ANTIPROLIFERASI EKSTRAK DAUN JAMBU
BIJI (Psidium guajava) TERHADAP SEL KANKER PAYUDARA
MCF-7
IGNASIUS SETIADI LEMA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Antiproliferasi Ekstrak Daun Jambu Biji (Psidium guajava) Terhadap Sel Kanker Payudara MCF-7
Nama : Ignasius Setiadi Lema NIM : G44100042
Disetujui oleh
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
Tanggal Lulus:
Dr dr Irma Herawati Suparto, MS Pembimbing I
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat melaksanakan penelitian serta menyelesaikan karya ilmiah ini yang berjudul “Aktivitas Antiproliferasi Ekstrak Daun Jambu Biji (Psidium guajava) Terhadap Sel Kanker Payudara MCF-7”. Skripsi ini disusun berdasarkan penelitian yang dilakukan penulis di Pusat Studi Satwa Primata Lembaga Penelitian dan Pengabdian Kepada Masyarakat-Institut Pertanian Bogor (PSSP LPPM-IPB) dan Laboratorium Kimia Anorganik Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan (FMIPA) IPB dari Maret sampai Mei 2014.
Terima kasih penulis ucapkan kepada Ibu Dr dr Irma H. Suparto MS dan Bapak Dr Deden Saprudin MSi selaku pembimbing yang telah banyak memberi saran, bimbingan, serta nasihat-nasihat sehingga penelitian ini dapat berjalan dengan lancar. Di samping itu, penghargaan dari penulis disampaikan kepada Silmi Mariya MSi dan Iin Indriawati SSi serta segenap staf Laboratorium Mikrobiologi dan Imunologi PSSP IPB dan Laboratorium Anorganik Kimia FMIPA IPB yang telah membantu dan membimbing selama penelitian ini berlangsung. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Tak lupa rasa terima kasih juga disampaikan kepada Fahmi Luthfie, Fatia Izzaty, Tri Hidayati, Nadia Ulfa, dan Dita Iryani yang telah memberikan semangat, nasihat, dan bantuannya selama penelitian ini berlangsung.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR
ISI
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode Penelitian 3
Pengadaan dan Pembuatan Simplisia 3
Pembuatan Ekstrak 3
Peremajaan dan Persiapan Kultur Sel 3 Penghitungan Sel Menggunakan Hemasitometer 4
Persiapan Uji Sitotoksisitas 4
Penapisan Konsentrasi Ekstrak Menggunakan Uji MTT 4
Penentuan Eluen Terbaik 5
Fraksionasi Ekstrak Daun Jambu Biji dengan Kromatografi Kolom 5 Identifikasi Gugus Fungsi dengan FTIR 6
HASIL DAN PEMBAHASAN 6
Karakteristik Simplisia Daun Jambu Biji 6 Uji Aktivitas Ekstrak Daun Jambu Biji 7
Fraksionasi Ekstrak Teraktif 10
Uji Aktivitas Fraksi Daun Jambu Biji 12
Identifikasi Fraksi Aktif 14
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
DAFTAR GAMBAR
1 Daun jambu biji 2
2 Persen penghambatan ekstrak air, etanol 30%, etanol 50%, dan etanol 70% daun jambu biji terhadap kultur sel Chang. 8 3 Persen penghambatan kultur sel Chang dan sel MCF-7 terhadap ekstrak daun
jambu biji pada konsentrasi 100 ppm 8 4 Kultur sel Chang setelah penambahan ekstrak etanol 30% selama 48 jam pada
berbagai konsentrasi 9
5 Profil noda pencarian eluen terbaik dengan pelarut tunggal 10 6 Profil noda pencarian eluen terbaik dengan penggabungan pelarut
kloroform-metanol dengan nisbah (1:9) sampai (9:1) 11 7 Profil noda fraksi hasil pemisahan kromatografi kolom 12 8 Persen penghambatan sel Chang terhadap fraksi I, fraksi IV, dan fraksi VI daun
jambu biji pada berbagai konsentrasi 13 9 Persen penghambatan sel MCF-7 terhadap fraksi I, fraksi IV, dan fraksi VI
daun jambu biji pada berbagai konsentrasi. 13 10 Hasil uji FTIR fraksi 4 daun jambu biji 15
DAFTAR LAMPIRAN
1 Bagan alir penelitian 19
2 Perhitungan Sel 20
3 Persen penghambatan sel normal Chang terhadap ekstrak kasar daun jambu biji 21 4 Persen penghambatan sel kanker MCF-7 terhadap ekstrak kasar daun jambu
biji 21
1
PENDAHULUAN
Kanker merupakan penyakit tidak menular yang terjadi akibat adanya pertumbuhan sel-sel jaringan tubuh secara tidak normal. Sel ini dapat menyerang jaringan tubuh lain dari penderita, sehingga bila tidak segera ditangani dapat menyebabkan kematian (Raymond 2007). Berdasarkan data Badan Kesehatan Dunia (WHO 2012), kanker menempati urutan kedua sebagai penyebab kematian terbesar setelah penyakit kardiovaskular. Kanker payudara merupakan salah satu jenis kanker yang paling banyak menyebabkan kematian pada wanita di dunia. Hingga tahun 2012, terdapat lebih dari 1.7 juta kasus kanker payudara pada wanita di seluruh dunia dan sedikitnya 522 000 orang wanita meninggal akibat penyakit ini (International Agency for Research on Cancer 2013). Jika dibandingkan dengan tahun 2008 maka ada peningkatan kasus kanker payudara sebesar 20% dan sebanyak 14% diantaranya berakhir dengan kematian (Bray et al. 2013).
Negara miskin dan berkembang umumnya adalah penyumbang angka yang sangat tinggi untuk tingkat kematian akibat kanker payudara. Selama ini telah dilakukan berbagai upaya untuk menyembuhkan kanker payudara, yaitu dengan cara pembedahan, terapi radiasi, kemoterapi dan pengobatan tradisional. Biaya pengobatan yang mahal menyebabkan metode pengobatan tradisional biasanya dipilih karena biayanya yang lebih murah dan diharapkan minimal efek sampingnya. Penggunaan bahan alami yang berasal dari tanaman tertentu dipercaya mampu menyembuhkan penyakit seperti kanker oleh sebagian masyarakat Indonesia.
2
Gambar 1 Daun jambu biji (Joseph & Priya. 2010)
Obat antikanker yang memenuhi kriteria masih sangat sedikit karena harus memiliki toksisitas selektif, yaitu dapat merusak sel kanker tanpa mengganggu sel normal sehingga tidak ada efek samping yang ditimbulkan (Meiyanto et al. 2006). Penapisan awal untuk menguji bahan yang diduga berpotensi sebagai obat antikanker dapat dilakukan dengan uji sitotoksisitas menggunakan kultur sel. Sel yang digunakan pada penelitian ini adalah sel normal Chang dan sel lestari kanker payudara MCF-7 yang akan diuji dengan metode MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolium bromida). Uji MTT digunakan untuk mengukur proliferasi sel secara kolorimetri dengan pembacaan pada panjang gelombang 595 nm sehingga dapat diketahui besarnya penghambatan yang ditimbulkan ekstrak daun jambu. Penelitian ini bertujuan mengevaluasi aktivitas antiproliferasi ekstrak daun jambu biji pada sel kanker payudara MCF-7 dan mengidentifikasi senyawa aktif yang berperan sebagai antikanker. Setelah diketahui memiliki aktivitas antiproliferasi terhadap sel kanker maka dapat dilakukan fraksionasi untuk memperoleh dan mengidentifikasi zat aktif yang berperan sebagai antikanker dari ekstrak daun jambu biji. Diharapkan ekstrak dan fraksi daun jambu biji yang diperoleh memiliki aktivitas antiproliferasi terhadap sel kanker payudara MCF-7 dan tidak bersifat toksik terhadap sel normal Chang.
BAHAN DAN METODE
Alat dan Bahan
3
Saline (PBS) 1×, tripsin 0.25% dalam PBS 1×, biru tripan 0.1%. Bahan untuk ekstraksi dan fraksionasi, yaitu air suling, etanol, metanol, kloroform, pelat KLT, dan silika gel G 60 F254.
Alat untuk ekstraksi daun jambu biji adalah maserator dan penguap vakum. Alat untuk fraksionasi, yaitu kromatografi kolom diameter 2 cm dan panjang 1 meter. Peralatan lainnya, yaitu penangas air isotemp (Fisher Scientific), Biosafety Cabinet Class 2 (Nuaire), inkubator CO2 (Thermo Forma), kamar hitung
Neubaueur, inverted microscope (Nikon, GS-6R), Spectrafuge 7M Labnet, maxi mix plus (Thermolyne), microplate reader (BIO-RAD i-Mark 11421), dan spektrofotometer inframerah transformasi Fourier Bruker tipe Tensor 37.
Metode Penelitian
Penelitian dilakukan dalam beberapa tahap, yaitu pengadaan dan pembuatan simplisia, pengujian mutu simplisia, pembuatan ekstrak, uji sitotoksisitas dan aktivitas antiproliferasi ekstrak terhadap sel normal dan sel kanker MCF-7 menggunakan uji MTT, fraksionasi ekstrak, dan identifikasi fraksi dengan FTIR (Lampiran 1).
Pengadaan dan Pembuatan Simplisia
Sampel daun jambu biji diperoleh dari kebun Unit Konservasi dan Budi daya Biofarmaka (UKBB) PSB IPB yang berlokasi di Cikabayan Kabupaten Bogor. Daun yang dipanen adalah daun ke enam sampai ke sepuluh dari pucuk. Daun jambu biji dicuci bersih kemudian dikeringkan dengan cara pemanasan oven pada suhu 50 °C selama 2–3 hari hingga daun kering (kadar air kurang dari 10%). Kemudian daun jambu biji digiling hingga menjadi serbuk dengan ukuran 60 mesh dan disimpan dalam wadah kedap udara. Simplisia diuji kadar air, kadar abu dan kandungan fitokimianya.
Pembuatan Ekstrak
Serbuk daun diekstraksi dengan metode maserasi 2×24 jam. Pelarut yang digunakan, yaitu air, etanol 30%, etanol 50% dan etanol 70% masing-masing sebanyak 2 liter. Komposisi pelarut dan zat terlarut 10:1. Hasil ekstraksi masing-masing dikeringkan dengan vakum evaporator hingga dihasilkan ekstrak padat. Hasil ekstraksi tahap pertama ini kemudian digunakan untuk uji aktivitas toksisitas terhadap sel normal Chang yang menggunakan berbagai konsentrasi. Kemudian dilanjutkan untuk pengujian antiproliferasi pada sel kanker payudara MCF-7 menggunakan konsentrasi yang aman dari hasil uji toksisitas. Ekstrak dengan potensi antikanker paling baik selanjutnya difraksionasi dan juga diuji kandungan fitokimianya.
Peremajaan dan Persiapan Kultur Sel
Sel Chang maupun sel MCF-7 dicairkan setelah dikriopreservasi, lalu ditanam pada medium D-MEM/RPMI 1640 dan diinkubasi pada suhu 37 °C dengan CO2 5%. Sel yang telah tumbuh merata (confluent) dalam botol kultur
4
steril sebanyak 5 mL untuk membersihkan botol kultur dari sisa media lalu PBS dibuang. Tripsin kemudian ditambahkan ke dalam botol kultur sebanyak 5 mL dan diinkubasi pada 37 °C selama 5 menit, lalu media ditambahkan ke dalam botol kultur sebanyak 1 mL untuk menghentikan reaksi dari tripsin. Sel yang telah lepas dimasukan ke dalam tabung sentrifugasi 15 mL, kemudian disentrifugasi dengan kecepatan 1500 rpm selama 5 menit. Supernatan dibuang, sel ditambahkan media sebanyak 5 mL, diaduk sampai homogen kemudian dihitung dengan hemasitometer. Sel ditanam kembali sesuai dengan jumlah yang diinginkan ke dalam pelat kultur jaringan 96 sumur yang berisi media D-MEM/RPMI 1640 baru.
Penghitungan Sel Menggunakan Hemasitometer
Penentuan banyaknya jumlah sel yang akan dimasukkan ke dalam pelat sumur menggunakan metode hemasitometer. Sebanyak 20 µL sel Chang dalam media D-MEM ditambahkan 20 µL biru tripan 0.1%. Selanjutnya diambil 20 µL larutan tersebut dan dimasukan ke dalam alat hemasitometer dan dihitung jumlah sel yang hidup menggunakan teknik hemasitometer Spencer Bright-LineImproved Neubauer (Lampiran 2). Banyaknya sel dalam 1 mL dapat dihitung menggunakan rumus sebagai berikut:
Jumlah sel/ml =
Sel Chang yang telah ditumbuhkan pada botol kultur T25 disubkultur ke dalam sumur pelat kultur sel 96 selama 24 jam pada kondisi 5% CO2 dan suhu
37 oC dengan jumlah 5000 sel/sumur.
Persiapan Uji Sitotoksisitas
Sampel yang digunakan adalah ekstrak air, ekstrak etanol 30%, ekstrak etanol 50% dan ekstrak etanol 70% daun jambu biji. Keempat sampel masing-masing dibuat dalam variasi konsentrasi 1000; 500; 250; 125; 62.5; 31.25; 15.6; dan 7.8 ppm dengan menggunakan DMSO 10% sebagai pelarutnya. Masing-masing konsentrasi dilakukan tiga kali pengulangan pada saat pengujian sitotoksisitas. Sel yang digunakan adalah sel normal Chang dan sel kanker payudara MCF-7 dengan metode uji sitotoksisitas menggunakan Uji MTT.
Penapisan Konsentrasi Ekstrak Menggunakan Uji MTT (Wiley 2000)
Uji sitotoksisitas dilakukan untuk mengetahui keamanan ekstrak terhadap sel Chang dan mengetahui kemampuan ekstrak dalam menghambat pertumbuhan sel kanker payudara MCF-7. Sel Chang yang sebelumnya telah disubkultur ke pelat kultur jaringan 96 sumur selama 24 jam pada kondisi 5% CO2 dan suhu 37 o
C dengan jumlah 5000 sel/sumur. Ekstrak yang telah dibuat sebelumnya dimasukkan sebanyak 100 µL/sumur, diinkubasi selama 48 jam, kemudian ditambahkan 10 µL/sumur MTT dan diinkubasi kembali selama 4 jam pada pada kondisi 5% CO2 dan suhu 37 oC. MTT merupakan substrat dari enzim
5
ditambahkan etanol-HCl. HCl berfungsi untuk memecah sel, karena formazan merupakan produk intraseluler dari reaksi enzimatik MTT, sedangkan etanol berfungsi untuk melarutkan formazan (kristal garam). Pembacaan rapatan optis dilakukan menggunakan microplate reader pada panjang gelombang 595 nm. Hasil yang diperoleh berupa nilai absorbans. Persen penghambatan dapat dihitung dengan rumus sebagai berikut:
penghambatan
Setelah nilai penghambatan pada sel normal Chang diketahui, data yang diperoleh digunakan untuk mencari nilai IC50.Nilai IC50 dapat ditentukan dengan
persamaan garis linear antara konsentrasi (sumbu x) dan persen penghambatan (sumbu y). Nilai IC50 yang diperoleh digunakan sebagai acuan konsentrasi ekstrak
yang dipilih untuk uji aktivitas antiproliferasi dengan metode Uji MTT terhadap sel kanker payudara MCF-7.
Penentuan Eluen Terbaik
Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat aluminium jenis silika gel G60F254 dari Merck dengan ukuran lebar 1 cm dan panjang 10 cm.
Ekstrak daun jambu biji terbaik ditotolkan pada pelat KLT sebanyak 20 kali totolan. Setelah kering, totolan dielusi dalam bejana kromatografi yang telah dijenuhkan uap eluen pengembang. Pada tahap pertama, proses elusi ekstrak daun jambu biji pada pelat KLT dilakukan dengan menggunakan eluen tunggal dari pelarut yang umum digunakan untuk pemisahan ekstrak daun jambu biji, yaitu n -heksana, kloroform, etil asetat, dan metanol. Noda yang dihasilkan dari proses elusi masing-masing eluen diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm. Eluen yang menghasilkan noda terpisah dipilih sebagai eluen terbaik. Jika diperoleh 2 eluen yang dapat membuat noda terpisah, maka eluen-eluen tersebut dicampurkan dengan nisbah tertentu sehingga diperoleh campuran eluen terbaik untuk menghasilkan noda terpisah pada pelat KLT (Houghton dan Raman 1998).
Fraksionasi Ekstrak Daun Jambu Biji dengan Kromatografi Kolom
6
Identifikasi Gugus Fungsi dengan FTIR
Sebanyak 0.5 mg serbuk fraksi aktif dicampurkan dengan 180 mg KBr, kemudian dihomogenisasi dan dibentuk pelet menggunakan hand press Shimadzu (tekanan 8 ton selama 10 menit). Pengukuran spektrum FTIR dilakukan pada daerah IR tengah (4000–400 cm-1) dengan melibatkan pengontrol kerja berupa personal komputer yang dilengkapi perangkat lunak OPUS versi 4.2. Spektrum dihasilkan dengan kecepatan 32 detik dan resolusi 4 cm-1. Tampilan data spektrum yang mengandung 1866 titik serapan kemudian diderivatisasi sehingga didapat jumlah titik 19. Identifikasi gugus fungsi dari hasil spektrum yang didapat berdasarkan bilangan gelombang tertentu (Rohaeti et al. 2011).
HASIL DAN PEMBAHASAN
Karakteristik Simplisia Daun Jambu Biji
Daun jambu biji kering yang diperoleh dijadikan simplisia dan ditentukan kadar air serta kadar abunya. Kadar air dan kadar abu dari simplisia daun jambu biji berturut-turut sebesar 9.77% dan 6.53%. Kadar air yang lebih rendah dari 10% membuat sampel lebih tahan terhadap kontaminan mikrob dan mempermudah perhitungan jumlah bahan yang dibutuhkan berdasarkan rendemennya (Budijanto et al. 2010). Kadar abu menunjukkan kandungan mineral yang terdapat dalam bahan (Winarno 2008). Komponen metabolit sekunder secara kualitatif dapat ditentukan dengan uji fitokimia. Berdasarkan hasil uji fitokimia diketahui bahwa simplisia daun jambu biji mengandung senyawa metabolit sekunder flavonoid, saponin, tanin, dan triterpenoid. Hasil ini sesuai dengan data fitokimia pada daun jambu biji yang berhasil dihimpun Shruti et al. (2013). Hasil uji fitokimia pada ekstrak etanol 70% daun jambu biji menunjukkan hasil positif untuk uji senyawa metabolit sekunder flavonoid, saponin, dan tanin. Hal ini menunjukkan bahwa pelarut etanol 70% mampu mengekstraksi metabolit sekunder yang bersifat polar dari daun jambu biji. Chollom et al. (2012) melaporkan hasil fitokimia ekstrak air daun jambu biji mengandung flavonoid, dan saponin dengan intensitas tinggi sedangkan tanin, glikosida, dan agen pereduksi terdeteksi dengan intensitas yang rendah.
7
saja. Ekstrak yang diperoleh selanjutnya diuji aktivitas antiproliferasi dan diharapkan ekstrak terbaik memiliki aktivitas yang antiproliferasi yang tinggi pada konsentrasi rendah, tidak bersifat toksik pada sel normal serta memiliki rendemen yang besar.
Uji Aktivitas Ekstrak Daun Jambu Biji
Penapisan konsentrasi ekstrak dilakukan berdasarkan hasil uji toksisitas masing-masing ekstrak terhadap sel normal Chang. Uji sitotoksisitas ditentukan berdasarkan nilai konsentrasi penghambatan 50% (IC50) yang merupakan
konsentrasi tertentu yang menghasilkan penghambatan 50% populasi sel yang sama dalam waktu spesifik dan kondisi percobaan yang sesuai (Rajbhandari et al. 2001). Nilai IC50 ini menunjukkan batasan konsentrasi yang dianggap berpotensi
sebagai racun bagi sel normal. Dengan mendapatkan nilai IC50 dari ekstrak
terhadap sel normal, maka untuk pengujian terhadap sel kanker dapat digunakan konsentrasi yang nilainya lebih rendah dari nilai IC50 yang diperoleh. Hal ini
dilakukan karena diharapkan konsentrasi yang digunakan aman terhadap sel normal dan memberikan aktivitas antiproliferasi terhadap sel kanker. Dengan demikian ekstrak terbaik memiliki sifat toksisitas selektif, yaitu dapat merusak atau menghambat perkembangan sel kanker tanpa mengganggu sel normal sehingga tidak ada efek samping yang ditimbulkan (Meiyanto et al. 2006).
Metode penapisan konsentrasi ekstrak menggunakan uji MTT. Larutan MTT yang berwarna kuning akan tereduksi menjadi formazan di dalam mitokondria sel hidup. Garam tetrazolium akan masuk ke dalam mitokondria sel hidup karena adanya muatan positif dan potensial membran plasma. Dengan bantuan enzim suksinat dehidrogenase di mitokondria yang hanya dihasilkan oleh sel hidup maka garam tetrazolium tersebut akan tereduksi menjadi formazan (Willey 2000). Formazan yang terbentuk berbanding lurus dengan jumlah sel yang hidup (Moorthi et al. 2011). Selanjutnya dengan penambahan etanol absolut mampu melarutkan kristal formazan dan menghasilkan warna ungu yang serapan sinarnya dapat dibaca pada panjang gelombang 595 nm. Kelebihan dari metode MTT ini, yaitu relatif cepat, sensitif, akurat dan dapat digunakan untuk mengukur sampel dalam jumlah besar (Wiley 2000).
Persen penghambatan sel normal Chang terhadap berbagai ekstrak daun jambu biji berbanding lurus dengan konsentrasi (Lampiran 3). Berdasarkan hasil uji dapat dilihat bahwa batas konsentrasi yang aman dari berbagai ekstrak daun jambu biji terhadap sel normal Chang adalah 100 ppm (Gambar 2). Konsentrasi yang lebih tinggi dari 100 ppm menghasilkan nilai penghambatan diatas 50% yang memiliki toksisitas tinggi terhadap sel normal sehingga tidak digunakan untuk pengujian terhadap sel kanker payudara MCF-7. Hal ini dikarenakan meskipun memiliki nilai penghambatan yang besar terhadap sel kanker namun bersifat toksik dan dapat merusak sel yang normal. Nilai IC50 dari ekstrak air,
etanol 30%, etanol 50% dan etanol 70% berturut-turut sebesar 224.38 ppm, 200.55 ppm, 306.20 ppm dan 336.37 ppm. Dari nilai IC50 yang diperoleh
8
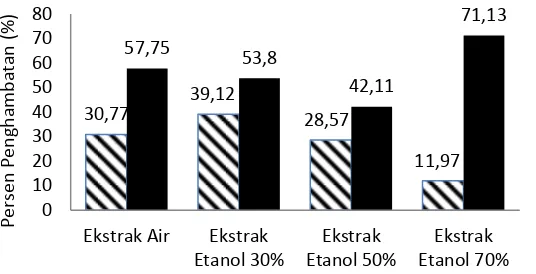
Gambar 2 Persen penghambatan ekstrak air ( ), etanol 30% ( ), etanol 50% ( ), dan etanol 70% ( ) daun jambu biji terhadap kultur sel Chang.
Ekstrak dengan konsentrasi yang aman terhadap sel normal Chang selanjutnya diujikan terhadap sel kanker payudara MCF-7. Penambahan ekstrak air, etanol 30%, etanol 50% dan etanol 70% pada sel dengan konsentrasi 100 ppm memberikan nilai penghambatan berturut-turut sebesar 57.75%, 53.80%, 42.11% dan 71.13% (Lampiran 4). Berdasarkan nilai penghambatan yang diperoleh, semua ekstrak memiliki aktivitas penghambatan yang lebih besar terhadap sel MCF-7 dibandingkan pada sel normal Chang pada konsentrasi yang sama sehingga dapat dikatakan semua ekstrak memiliki sifat toksisitas selektif dan memiliki potensi sebagai obat antikanker (Gambar 3). Nilai IC50 ekstrak air,
etanol 30%, etanol 50% dan etanol 70% yang diperoleh sebesar 20.23 ppm, 74.77 ppm, 163.68 ppm dan 35.08 ppm. Meskipun nilai IC50 dari ekstrak air paling besar
namun ekstrak etanol 70% dipilih sebagai ekstrak terbaik karena pada konsentrasi 100 ppm menghasilkan nilai penghambatan yang paling rendah terhadap sel normal Chang dan nilai penghambatan paling tinggi terhadap sel kanker MCF-7.
Gambar 3 Persen penghambatan kultur sel Chang ( ) dan sel MCF-7 ( ) terhadap ekstrak daun jambu biji pada konsentrasi 100 ppm
9
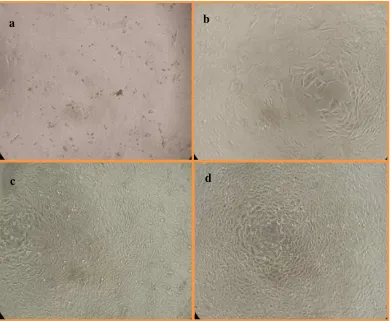
Gambar 4 menunjukkan pengaruh penambahan ekstrak dengan berbagai konsentrasi terhadap pertumbuhan dan morfologi sel. Gambar 4d merupakan sel normal Chang tanpa penambahan ekstrak yang menunjukkan pertumbuhannya sangat baik, morfologi tidak terganggu dan menempati seluruh permukaan pelat sumur. Pelat sumur yang berisi sel dengan penambahan ekstrak konsentrasi 800 ppm dan 100 ppm menunjukkan adanya penghambatan pada pertumbuhan sel normal Chang. Gambar 4a menunjukkan sel dengan penambahan konsentrasi ekstrak sebesar 800 ppm yang menyebabkan hampir seluruh sel mati, sedangkan sel yang ditambahkan ekstrak dengan konsentrasi 100 ppm terlihat tidak tumbuh dengan baik dan hanya memenuhi sebagian permukaan sumur (Gambar 4b). Sel dengan penambahan konsentrasi ekstrak 6.25 ppm dapat tumbuh dengan baik dan hampir sama pertumbuhannya dengan kontrol. Penambahan sampel dengan konsentrasi 6.25 ppm sebenarnya memberikan pengaruh terhadap sel, tetapi hanya memberikan perubahan pada morfologinya saja dan tidak sampai pada tahap mematikan sel. Kekurangan metode uji MTT tidak dapat membedakan morfologi sel sehingga apabila ada sel seperti Gambar 4a dan 4b masih dihitung sebagai sel hidup meski terjadi kelainan yang disebabkan oleh toksisitas bahan, sehingga nilai penghambatan yang dihasilkan menjadi lebih rendah karena sel tetap dianggap hidup. Parameter sitotoksik yang sering digunakan dalam pengujian sel diantaranya morfologi sel, viabilitas sel, penempelan sel, proliferasi sel dan kerusakan membran (Doyle dan Griffiths 2000).
Gambar 4 Kultur sel Chang setelah penambahan ekstrak etanol 30% selama 48 jam pada konsentrasi a) 800 ppm, b) 200 ppm, c) 6.25 ppm, dan d) kontrol (perbesaran 4000x)
a
d c
10
Fraksionasi Ekstrak Teraktif
Ekstrak etanol 70% yang merupakan ekstrak dengan aktivitas penghambatan terhadap sel kanker paling baik selanjutnya difraksionasi dengan menggunakan kromatografi kolom. Fraksionasi ini bertujuan untuk memperoleh fraksi yang berperan sebagai antikanker dan memiliki aktivitas penghambatan terhadap sel kanker yang lebih besar dibandingkan ekstrak kasar dan tetap tidak bersifat toksik terhadap sel normal. Fraksionasi dilakukan dengan menggunakan eluen terbaik. Pencarian eluen terbaik dilakukan dengan elusi sampel pada pelat KLT menggunakan pelarut tunggal yang memiliki kepolaran berbeda. Pelarut tunggal yang digunakan adalah metanol, etil asetat, kloroform, dan heksana.
Berdasarkan analisis KLT pada Gambar 5, pelarut kloroform dan metanol menunjukkan elusi yang baik karena menghasilkan jumlah noda yang lebih banyak dan lebih terpisah. Pelarut metanol membawa ekstrak lebih banyak karena sifat kepolaran yang sama dengan ekstrak etanol 70% yang juga polar. Kloroform mampu membawa sebagian komponen yang bersifat kurang polar. Oleh karena itu, perlu dilakukan penggabungan dua pelarut tunggal dengan berbagai nisbah sehingga komponen yang dibawa lebih terpisah dan banyak.
Gambar 5 Profil noda pencarian eluen terbaik dengan pelarut tunggal (kiri ke kanan: n-heksana, etil asetat, kloroform, dan metanol).
11
Gambar 6 Profil noda pencarian eluen terbaik dengan penggabungan pelarut kloroform-metanol dengan nisbah (1:9) sampai (9:1) (kiri ke kanan)
Tabel 1 Perbandingan jumlah noda dan Rf dari masing-masing eluen Eluen (kloroform:metanol) Jumlah noda Rf
1:9 3 0.025; 0.725; 0.85 2:8 3 0.0375; 0.7375; 0.8375 3:7 4 0.025; 0.225; 0.7125; 0.85 4:6 3 0.0375; 0.65; 0.925 5:5 3 0.05; 0.7; 0.9375
6:4 7 0.0375; 0.0875; 0.225; 0.5; 0.775; 0.8875; 0.9625
7:3 5 0.0375; 0.2875; 0.725; 0.8625; 0.9375
8:2 4 0.125; 0.425; 0.8875; 0.95
9:1 5 0.0125; 0.05; 0.125; 0.175; 0.9375
Fraksionasi selanjutnya dilakukan dengan menggunakan kolom kromatografi menggunakan sistem isokratik (satu jenis eluen) dengan fase gerak eluen terbaik yang diperoleh, yaitu kloroform-metanol (6:4). Sistem elusi isokratik dipilih karena lebih sederhana, hemat waktu dan juga pelarut. Eluen yang keluar dari kolom kromatografi selanjutnya ditampung dalam tabung reaksi dan diuji nodanya menggunakan KLT. Eluen yang ditampung kemudian digabungkan menjadi satu fraksi berdasarkan nilai Rf dan kesamaan noda yang dihasilkan. Kecepatan suatu komponen melewati fase diam pada kromatografi kolom bergantung pada sifat kepolaran dan ukuran molekul dari komponen dalam ekstrak (Hosstettman et al. 1995). Karena fase diam yang digunakan bersifat lebih polar dibandingkan eluen yang digunakan, maka komponen yang bersifat kurang polar akan lebih cepat melewati fase diam akibat kecilnya afinitas komponen terhadap fase diam.
Hasil fraksionasi dengan kolom kromatografi diperoleh 7 fraksi (Gambar 7) dengan rendemen dari fraksi 1 sampai fraksi 7 berturut-turut sebesar 4.15%, 9.03%, 0.97%, 13.46%, 3.35%, 2.18%, dan 1.71%. Tidak semua fraksi yang
12
diperoleh diuji aktivitasnya dengan pertimbangan efektifitas uji MTT. Fraksi yang digunakan untuk diuji aktivitas antiproliferasi menggunakan uji MTT adalah fraksi 1, 4 dan 6. Pemilihan fraksi dilakukan dengan memperhatikan pola sebaran fraksi yang diperoleh berdasarkan polaritas. Ketiga fraksi tersebut mewakili 7 fraksi yang diperoleh.
Gambar 7 Profil noda fraksi hasil pemisahan kromatografi kolom
Uji Aktivitas Fraksi Daun Jambu Biji
Ketiga fraksi yang dipilih, yaitu fraksi 1, 4, dan 6 diuji toksisitasnya terhadap sel normal Chang dan aktivitas antiproliferasi terhadap sel kanker payudara MCF-7. Penapisan konsentrasi masing-masing konsentrasi dilakukan dengan konsentrasi 800, 400. 200, 100, 50, 25, 12.5 dan 6.25 ppm menggunakan uji MTT untuk mengetahui toksisitas fraksi terhadap sel normal Chang. Hasil uji toksisitas ketiga fraksi menunjukkan bahwa fraksi 1 memiliki toksisitas yang sangat tinggi pada konsentrasi 50 ppm hingga 800 ppm (Lampiran 5). Sedangkan fraksi 4 dan fraksi 6 tidak menghambat proliferasi sel normal Chang dan bukan merupakan zat yang toksik terhadap sel normal karena persen penghambatannya masih di bawah 50%.
Fraksi-fraksi ini selanjutnya diuji aktivitas antiproliferasi terhadap sel kanker payudara MCF-7 dengan konsentrasi yang tidak menghambat pertumbuhan sel normal. Berdasarkan data pada Gambar 8, konsentrasi yang digunakan untuk fraksi 1 harus lebih rendah dari 50 ppm. Penggunaan konsentrasi diatas 50 ppm untuk fraksi 1 bersifat sangat toksik terhadap sel normal. Sedangkan untuk fraksi 4 dan 6 konsentrasi yang dapat digunakan, yaitu dari 6.25 ppm hingga 800 ppm karena tidak menghambat pertumbuhan sel normal (Lampiran 6).
13
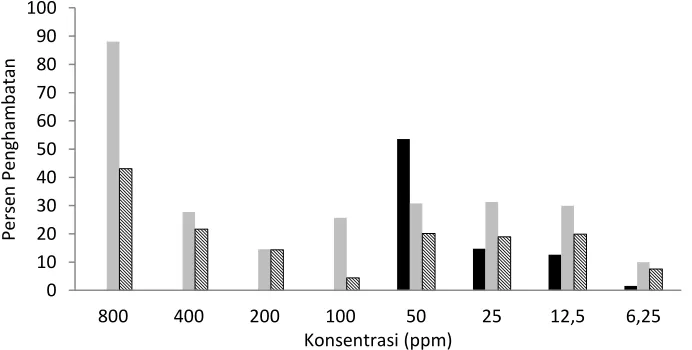
Gambar 8 Persen penghambatan sel Chang terhadap fraksi I ( ), fraksi IV ( ), dan fraksi VI ( ) daun jambu biji pada berbagai konsentrasi
Berdasarkan data pada Gambar 9 diketahui bahwa fraksi 1 memiliki aktivitas antiproliferasi yang sangat baik terhadap sel kanker karena pada konsentrasi yang rendah, yaitu 50 ppm dapat memberikan persen penghambatan sebesar 53.52%. Namun pada konsentrasi yang sama, persen penghambatan terhadap sel normal menghasilkan nilai yang tidak jauh berbeda sebesar 47.15% sehingga fraksi 1 tidak memiliki sifat toksisitas selektif. Dengan demikian, meskipun fraksi 1 berpotensi sebagai obat antikanker namun kemungkinan timbul efek samping sangat besar karena sifatnya yang juga dapat menghambat pertumbuhan sel normal.
Gambar 9 Persen penghambatan sel MCF-7 terhadap fraksi I ( ), fraksi IV ( ), dan fraksi VI ( ) daun jambu biji pada berbagai konsentrasi.
Fraksi 4 dan fraksi 6 pada konsentrasi di bawah 400 ppm relatif tidak memberikan aktivitas penghambatan terhadap sel kanker MCF-7. Pada konsentrasi 800 ppm fraksi 4 memberikan aktivitas penghambatan sebesar 88.02% dan fraksi 6 sebesar 43.12%. Bila dibandingkan antara nilai penghambatan pada sel normal Chang dan nilai penghambatan pada sel kanker MCF-7 maka fraksi 4 memiliki sifat toksisitas selektif yang sangat baik. Pengaruh
14
penghambatan terhadap sel kanker lebih besar dibandingkan pengaruhnya terhadap sel normal pada semua konsentrasi yang diujikan. Pada konsentrasi 800 ppm, fraksi 4 tidak bersifat toksik terhadap sel normal ditunjukan dengan nilai penghambatan yang bernilai negatif, yaitu sebesar -22.68. Persen penghambatan yang bernilai negatif ini menunjukkan bahwa pertumbuhan sel normal sangat baik dan tidak mengalami penghambatan karena bahan tidak bersifat toksik. Nilai penghambatan yang negatif pada konsentrasi tinggi juga dapat diakibatkan karena adanya komponen yang tidak larut sempurna dalam media pertumbuhan sel sehingga menghasilkan kesalahan positif. Kesalahan positif ini terjadi karena komponen yang tidak larut memberikan serapan pada saat pembacaan absorbans. Kesalahan positif ini sebenarnya dapat dihilangkan dengan cara pencucian dan penggantian dengan media baru sebelum pengukuran absorbans, namun bila tidak dilakukan dengan teliti dikhawatirkan ada sel yang ikut tercuci. Pada konsentrasi yang sama, fraksi 4 memberikan nilai penghambatan sebesar 88.02% terhadap sel kanker MCF-7. Dengan demikian fraksi 4 merupakan fraksi yang paling memenuhi syarat sebagai fraksi yang berpotensi sebagai obat antikanker bila mempertimbangkan sifat toksisitas selektifnya.
Nilai IC50 dari ekstrak etanol 70%, fraksi 1 dan fraksi 4 masing-masing
sebesar 35.08 ppm, 42.32 ppm dan 377.72 ppm. Sebagai perbandingan, nilai IC50
dari ekstrak daun jambu terhadap sel kanker leukemia Kasumi-1 sebesar 200 ppm dan terhadap sel kanker prostat DU-145 sebesar 250 ppm (Arkene dan Shanna 2012; Chen et al. 2009). Penelitian yang dilakukan Manosroi et al. (2006) juga memperoleh ekstrak minyak esensial dari daun jambu biji dengan aktivitas antiproliferasi terhadap sel kanker leukemia (P388) paling tinggi dengan nilai IC50
sebesar 37.9 ppm yang 4.37 kali lebih berpotensi dibandingkan obat komersial vincristine. Nilai IC50 ekstrak etanol 70% mendekati standar National Cancer
Institute (NCI) Amerika yang menyatakan bahwa standar efektifitas komponen bioaktif untuk melawan sel kanker harus lebih rendah atau sama dengan 30 ppm (Albuntana et al. 2011). Dengan demikian, ekstrak etanol 70% lebih memiliki potensi untuk dikembangkan sebagai agen kemoterapi yang baru untuk menghambat pertumbuhan tumor dan kanker. Hal ini menunjukkan bahwa dalam ekstrak etanol terdapat sinergi dari banyak senyawa sehingga memberikan aktivitas yang lebih tinggi dibandingkan hasil fraksionasi. Kombinasi dan proses sinergi dari berbagai senyawa yang berperan dalam pencegahan sel kanker masih belum banyak dipelajari (Aboul-Enein et al. 2011).
Identifikasi Fraksi Aktif
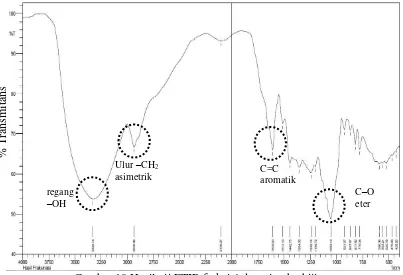
Identifikasi gugus fungsi dari hasil spektrum yang didapat berdasarkan bilangan gelombang tertentu (Rohaeti et al. 2011). Berdasarkan hasil interpetasi FTIR pada Gambar 10, terdapat serapan aromatik C=C–H pada bilangan gelombang 1608.63 cm-1 dan 1442.75 cm-1 dengan pembuktian regang C=C di bilangan gelombang 1400-1600 cm-1. Serapan kuat dan lebar pada bilangan gelombang 3329.14 cm-1 untuk regang –OH dan serapan kuat C–O eter pada bilangan gelombang 1199.72 cm-1. Pada bilangan gelombang 2935.66 cm-1 terdapat serapan ulur –CH2 asimetrik. Selain itu terdapat substituen aromatik pada
15
Gambar 10 Hasil uji FTIR fraksi 4 daun jambu biji
SIMPULAN DAN SARAN
Simpulan
Kandungan metabolit sekunder pada simplisia dan ekstrak etanol 70% daun jambu biji adalah flavonoid, saponin, triterpenoid dan tanin. Ekstrak kasar etanol 70% merupakan ekstrak terbaik karena memberikan penghambatan sebesar 71.13% terhadap sel MCF-7 dan 11.97% terhadap sel normal Chang pada konsentrasi 100 ppm. Nilai IC50 dari ekstrak etanol 70% terhadap sel MCF-7
sebesar 35.08 ppm. Hasil fraksionasi terhadap ekstrak etanol 70% diperoleh fraksi ke-4 yang memiliki sifat toksisitas selektif sangat baik karena pada konsentrasi 800 ppm tidak bersifat toksik terhadap sel normal namun memberikan penghambatan sebesar 88.02% terhadap sel kanker MCF-7. Nilai IC50 dari fraksi 4
terhadap sel MCF-7 sebesar 377.72 ppm.
Saran
Perlu dilakukan identifikasi lebih lanjut dan isolasi senyawa yang berperan sebagai antikanker. Penelitian lebih lanjut dapat dilakukan untuk mengetahui mekanisme yang terjadi dalam penghambatan pertumbuhan sel kanker.
%
Tr
ansmi
tans
regang
–OH C–O eter
Ulur –CH2
16
DAFTAR PUSTAKA
Aboul-Enein AM, Faten Abu El-Ela, Emad AS, Hany A, El-Shemy. 2011. Traditional medical plants research in Egypt: studies of antioxidant and anticancer activities. J Med Plants Res. 6(5): 689-703. doi: 10.5897/JMPR11.968.
Albuntana A, Yasman, Wardhana W. 2011. Uji toksisitas ekstrak empat jenis teripang suku Holothuriidae dari Pulau Penjaliran Timur, Kep. Seribu Jakarta menggunakan BSLT. J Ilmu Teknol Kelautan Trop. 3:65-72.
[ATCC] American Type Culture Collection. 1988. Catalogue of Cell Lines and Hybrodomas 6th Edition. Rockville (US): Maryland.
Barbalho SM, Flavia MV, Farinazzi-Machado, Ricardo AG, Anna CSB. 2012. Psidium guajava (guava): A plant of multipurpose medical applications. Med Aromat Plants. 1(1):1-4. doi:10.4172/2167-0412.1000104.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2005. Gerakan Nasional Minum Temulawak. Jakarta (ID): BPOM RI.
Bray F, Ren JS, Masuyer E, Ferlay J. 2013. Global estimates of cancer prevalence for 27 sites in the adult population in 2008. Int J Cancer. 132(5):1133–1145. http://dx.doi.org/10.1002/ijc.27711.
Budijanto S, Sitanggang AZ, Silalahi BE, Murdiati W. 2010. Penentuan Umur Simpan Seasoning Menggunakan Metode Accelerated Shelf-Life Testing (ASLT) dengan Pendekatan Kadar Air Kritis. J Agr Technol. 2(11):071-077. Chollom SC, Agada GOA, Bot DY, Okolo MO, Dantong DD, Choji T P, Echeonwu BC, Bigwan EI, Lokason S. 2012. Phytochemical analysis and antiviral potential of aqueous leaf extract of Psidium guajava against Newcastle disease virus in ovo. J Appl Pharm Scl. 2(10):045-049.
Doyle A, Griffiths JB. 2000. Cell and Tissue Culture for Medicinas Research. London (UK): J Wiley.
Goncalves AF, Andrade NM, Bezerra NSJ, Macrae A, Sousa VO, Fonteles FAA, Vieira HSF. 2008. Antibacterial activity of guava, Psidium guajava Linnaeus, leaf exctracts on diarrhea-causing enteric bacteria isolated from seabob shrimp, Xiphopenaeus kroyeri (Heller). Rev Inst Med Trop S Paulo. 50(1):11-15.
Houghton PJ, Raman A. 1998. Laboratory Handbook for The Fractionation of Natural Extract. London (GB): Chapman & Hall.
Hostettman K, Hostettman M, Marston A. 1995. Cara Kromatografi Preparatif Penggunaan pada Isolasi Senyawa Alam. Kosasih Padmawinata, penerjemah. Bandung (ID): Institut Teknologi Bandung. Terjemahan dari Preparative Chromatography Techniques: Applications in Natural Product Isolation.
[IARC] International Agency for Research on Cancer. 2013. Latest World Cancer Statistics. Lyon (FRA): International Agency for Research on Cancer. Itharat A, Ooraikul B. 2007. Research on Thai medicinal plants for cancer
treatment. Med Plant Res. 1(2): 287-317.
17
Kamanth JV, Nair R, Ashok KCK, Mohana Lakshmi S. 2008. Psidium guajava L: A determination of a spasmolytic principle. Arch Med Res. 25(1): 5-11. Kuber BR, Lakshmi MR, Deepika E, Yamini P. 2013. Phytochemical screening,
invitro anti-bacterial and antioxidant activity of the Psidium guajava root bark. Int J Curr Microbiol App Sci. 2(10): 238-248.
Lakhanpal P, Rai KD. 2007. Quercetin: A versatile flavonoid. Int J Med Up. 2(2): 22-37.
Lee SB, Park HR. 2010. Anticancer activity of guava (Psidium guajava L.) branch extract against HT-29 human colon cancer cells. J Med Plant Res. 4:891-896.
Manosroi J, Dhumtanom P, Manosroi A. 2006. Anti-proliferative activity of essential oil extracted from Thai medicinal plants on KB and P38 cell lines. Cancer Let. 235:114-120.
Manthey JA, Grohmann K, Guthrie N. 2001. Biological properties of citrus flavonoids pertaining to cancer and inflammation. Curr Med Chem. 8:135-153.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Kosasih Padmawinata, penerjemah. Bandung (ID) : Institut Teknologi Bandung. Terjemahan dari Techniques of Flavonoid Identification.
Meiyanto E, Supardjan, Muhammad Da’I, Dewi A. 2006. Efek antiproliferatif Pentagamavunon-0 terhadap sel kanker payudara T47D. J Ked Yarsi. 1(14): 11-15.
Mukhtar HM, Ansari SH, Bhat ZA, Naved T, Singh P. 2006. Antidiabetic activity of ethanol extract obtained from the stem bark of Psidium guajava (Myrtaceae). Pharmazie. 61(8): 725-727.
Moorthi C, Kathiresan K, Kiran Khrisnan, Manavalan R. 2011. In-vitro cell based assay: A preffered anticancer drug screening techniques for the academic researchers. J Pharm Res. 4(3): 671-675.
Ojowole JA. 2006. Antiinflammatory and analgesic effects of Psidium guajava Linn (Myrtaceae) leaf aqueous extract in rats and mice. Methods Find Exp Clin Pharmacol. 28(7): 441-446.
Pavia DL, Lampman GM, Kriz GS, Vyvyan JR. 2009. Introduction to Spectroscopy. Ed ke-4. Washington (US): Thomson Learning.
Peng CC, Peng CH, Chen KC, Hsieh CL, Peng RY. 2011. The aqueous soluble polyphenolic fraction of Psidium guajava leaves exhibits potent anti-angiogenesis and anti-migration actions on DU145 cells. Ev Bas Comp Alt Med. doi:10.1093/ecam/neq005.
Porwal V, Singh P, Gurjar D. 2012. A comprehensive study on different methods of extraction from guajava leaves for curing various health problem. Int J Eng Res App. 2:490-496.
Rajbhandari M, Wegner U, Julich M, Schopke T, Mentel. 2001. Screening of Nepalese medicinal plants for antiviral activity. J Ethnopharmacol. 251-255.
Raymond W R. 2007. Cancer Biology. Ed ke-4. Michigan (US): Oxford University Pr.
18
Rohaeti E, Heryanto R, Rafi M, Wahyuningrum A, Darusman LK. 2011. Prediksi kadar flavonoid total tempuyung (Sonchus arvensis) menggunakan kombinasi spektroskopi IR dengan regresi kuadrat terkecil parsial. J Chem. 5(2) : 101-108
Rouessac F, Rouessac A. 1994. Chemical Analysis Modern Instrumentation Methods and Techniques. Ed ke-2. New York (US): J Wiley
Ryu HN, Park RK, Kim MS, Yun MH, Nam D, Lee GS, Jang JH, Ahn SK, Kim HS, Shim SB et al. 2012. A hexane fraction of guava leaves (Psidium guajava L.) induces anticancer activity by suppressing AKT/mammalian target of rapamycin/ribosomal p70 S6 kinase in human prostate cancer cells. J Med Food. 15(3): 231-241.
Sato R, Dang KM, McPherson BG, Brown AC. 2010. Anticancer activity of guava (Psidium guajava) extracts. J Compl Integ Med. 7(1): 43. doi: 10.2202/1553-3840.1361.
Shruti SD, Roshan A, Timilsina SS, Sunita S. 2013. A review on the medicinal plant Psidium guajava Linn.(Myrtaceae). J Drug Deliv Therap. 3(2): 162-168.
Wiley J. 2000. Cell and Tissue Culture for Medical Research. Porton (UK): Scientific Consultancy and Publishing.
Winarno FG. 2008. Kimia Pangan dan Gizi Edisi Terbaru. Bogor (ID): M-BRIO Pr.
19
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Maserasi 2 x 24 jam Sampel jambu biji
(simplisia)
Etanol 30%
Uji aktivitas antiproliferasi terhadap sel kanker payudara MCF-7 Uji toksisitas terhadap sel normal
Chang
Etanol 50% Etanol 70%
Air
Uji fitokimia
Fraksionasi ekstrak terbaik
Uji aktivitas antiproliferasi terhadap sel kanker payudara MCF-7
Fraksi terbaik
Identifikasi senyawa aktif menggunakan
FTIR
Uji toksisitas terhadap sel normal Chang
Uji MTT
20
Lampiran 2 Perhitungan Sel
a. Sel Normal Chang
Jumlah sel = 40 sel
Lapang pandang = 2
Faktor pengenceran = 40/20 = 2
Faktor konversi = 104
Jumlah sel/well = 5000 sel
Jumlah well = 120 well/plate x 2 plate Volume/well = 100 µl
Jumlah sel/ml =
=
Jumlah sel yang diperlukan = 5000 sel × 240 well = 1.200.000 sel
Jumlah sel yang diambil = = 3 ml sel + 21 ml media
b. Sel Kanker Payudara MCF-7
Jumlah sel = 41 sel
Lapang pandang = 2
Faktor pengenceran = 40/20 = 2
Faktor konversi = 104
Jumlah sel/well = 5000 sel
Jumlah well = 120 well/plate Volum/well = 100 µl
Jumlah sel/ml =
=
Jumlah sel yang diperlukan = 5000 sel × 120 well = 600.000 sel
21
Lampiran 3 Persen penghambatan sel normal Chang terhadap ekstrak kasar daun jambu biji
Lampiran 4 Persen penghambatan sel kanker MCF-7 terhadap ekstrak kasar daun jambu biji
22
Lampiran 6 Persen penghambatan sel kanker MCF-7 terhadap fraksi daun jambu biji
Konsentrasi (ppm)
% Penghambatan
Fraksi 1 Fraksi 4 Fraksi 6 800 - 88.45 53.44 400 - 40.22 23.93 200 - 22.07 32.40
100 - 36.22 8.29
23
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 11 September 1991 dari pasangan Fransiskus Salar Lema dan Tien Hartini. Penulis adalah anak keempat dari empat bersaudara. Tahun 2010 penulis lulus dari Sekolah Menengah Atas (SMA) 1 Bogor dan melanjutkan studi di Departemen Kimia, FMIPA IPB melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan, penulis aktif sebagai staf Departemen Pengembangan Kimia dan Seni Himpunan Profesi Ikatan Mahasiswa Kimia (IMASIKA) pada tahun 2011-2013. Penulis berkesempatan menjadi ketua pelaksana Seminar Nasional Teknologi Kimia Aplikatif (SENSITIF) 2012 dan ketua pelaksana kegiatan olahraga dan temu alumni Hyperchem-Silika Alumina Departemen Kimia 2012, serta sebagai staf divisi Liaison Officer Seminar dan Rapat Tahunan FMIPA se-Indonesia (SEMIRATA) 2014.