PRENILASI SENYAWA
β
-DIKETON SEBAGAI PREKURSOR
3-PRENILFLAVON
INDRA SUGIARTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
i
ABSTRAK
INDRA SUGIARTO. Prenilasi Senyawa
β
-Diketon sebagai Prekursor
3-Prenilflavon. Dibimbing oleh PURWANTININGSIH SUGITA dan BUDI
ARIFIN.
Salah satu kelompok flavonoid yang belum banyak disintesis adalah
prenilflavon. Tujuan utama penelitian ini adalah membuat prekursor
3-prenilflavon berupa
β
-diketon terprenilasi. Mula-mula
β
-diketon disintesis melalui
4 tahap dari senyawa awal fenol dengan rendemen 24%. Prenilasi
β
-diketon
dengan prenil bromida dan basa K
2CO
3menghasilkan 4 fraksi yang dipisahkan
menggunakan kromatografi lapis tipis prepraratif (KLTP) dengan eluen
n-heksana:EtOAc (8:2). Fraksi dengan
R
f= 0.80 dipisahkan lebih lanjut
menggunakan KLTP dengan eluen
n-
heksana:EtOAc (99:1). Diperoleh 2 fraksi
dengan
R
f= 0.38 dan 0.42. Fraksi pertama telah dicirikan sebagai
β
-diketon
terdiprenilasi dengan rendemen 49%. Penggunaan gugus pelindung pada gugus
OH fenolik pada
β
-diketon diperlukan agar diperoleh
β
-diketon termonoprenilasi
yang dapat disiklisasi menjadi 3-prenilflavon.
Kata kunci: flavonoid, 3-prenilflavon, prenilasi, sintesis
ABSTRACT
INDRA SUGIARTO. Prenylation of
β
-Diketone Compound as Precursor of
3-Prenylflavone. Supervised
by PURWANTININGSIH SUGITA and BUDI
ARIFIN.
One group of flavonoids that has not been commonly synthesized is
3-prenylflavone. The main objective of this experiment was to synthesize precursor
of 3-prenylflavone. Firstly,
β
-diketone was synthesized via 4 steps from phenol as
starting compound with total yield of 24%. Prenylation of
β
-diketone with prenyl
bromide and K
2CO
3base produced 4 fractions which were separated by using
preparative thin layer chromatography (PTLC) with
n-
hexane:EtOAc (8:2) as the
eluent. Fraction with
R
f= 0.80 was further separated by using preparative PTLC
with
n
-hexane:EtOAc (99:1) as the eluent. Two fractions were obtained with
R
f=
0.38 and 0.42. The first fraction has been characterized as diprenylated
β
-diketone
with 49% yield. Application of protecting group on the phenolic OH group in
β
-diketone are needed to obtain monoprenylated
β
-diketone which can be further
cyclized into 3-prenylflavone.
PRENILASI SENYAWA
β
-DIKETON SEBAGAI PREKURSOR
3-PRENILFLAVON
INDRA SUGIARTO
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
Judul Skripsi: Prenilasi Senyawa
β
-Diketon sebagai Prekursor 3-Prenilflavon
Nama :
Indra Sugiarto
NIM :
G44062743
Disetujui
Pembimbing I
Prof Dr Purwantiningsih Sugita, MS
NIP 19631217 198803 2 002
Pembimbing II
Budi Arifin, SSi, MSi
NIP 19830109 200604 1 004
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Segala puji dan syukur ke hadirat Allah SWT atas rahmat dan hidayah-Nya,
penulis dapat menyusun dan menyelesaikan karya tulis ini. Karya tulis ini disusun
berdasarkan kegiatan penelitian dengan judul Prenilasi Senyawa
β
-Diketon
sebagai Prekursor 3-Prenilflavon yang dilaksanakan pada bulan Desember 2011
sampai dengan Juli 2012 di Laboratorium Kimia Organik, Departemen Kimia
FMIPA IPB, Bogor.
Penulis mengucapkan terima kasih kepada orang tua dan keluarga yang
telah memberikan motivasi, doa, serta kasih sayang selama menempuh studi,
penelitian, dan penulisan karya tulis ini. Penelitian ini dapat terlaksana berkat
kepercayaan dan bimbingan dari Prof Dr Purwantiningsih Sugita, MS dan Budi
Arifin, SSi, MSi selaku pembimbing yang dengan sabar memberi arahan serta
masukan atas segala permasalahan dalam melaksanakan penelitian ini.
Penulis mengucapkan terima kasih kepada Bapak Sabur, Ibu Yenni, dan
Mba
Nia atas fasilitas dan bantuan yang diberikan selama di Laboratorium
Penelitian Kimia Organik. Semangat dan inspirasi selama menyelesaikan
penelitian ini datang dari teman-teman seperjuangan di Laboratorium Penelitian
Kimia Organik, yaitu Lia Anggraini, Wahyu Hendana, Indah Soekma, Dwi Utami,
Dwi Artha, Livia Elsa, Rina, Rizki Amilia, M. Rifai, Umar Toriq, Indra Bayu,
Fadli Muntaqo, dan Ridho Putrotomo. Analisis
1H NMR dalam skripsi ini dapat
terselesaikan tidak terlepas berkat bantuan saran dan masukan Dumas Flis Tang.
Terima kasih pula kepada teman-teman Program S1 Departemen Kimia angkatan
43 atas kebersamaan selama menempuh studi di Departemen Kimia. Semoga
karya tulis ini dapat bermanfaat bagi ilmu pengetahuan secara umum.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Banyumas pada tanggal 14 Oktober 1988. Penulis
merupakan anak ketiga dari enam bersaudara dari pasangan Siswandi dan Suwarti.
Penulis menyelesaikan pendidikan di SMA Negeri 1 Jatilawang pada tahun
2006 dan kemudian diterima di Institut Pertanian Bogor (IPB) pada Program S1
Kimia melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan penulis pernah aktif dalam Badan Eksekutif
Mahasiswa Fakultas Matematika dan Ilmu Pengetahuan Alam (BEM FMIPA) IPB
pada tahun 2007/2008, Himpunan Profesi Ikatan Mahasiswa Kimia (Imasika) IPB
pada tahun 2007/2008, Dewan Pengawas Ikatan Mahasiswa Kimia (Imasika) IPB
pada tahun 2008/2009, dan Badan Eksekutif Mahasiswa Keluarga Mahasiswa
(BEM KM) IPB pada tahun 2008/2009. Pada tahun 2012, penulis juga aktif
sebagai mentor dan juri dalam rangkaian acara program
Leadership and
Enterpreneurship School
(LES) yang khusus diadakan oleh BEM KM bagi
mahasiswa TPB (Tingkat Persiapan Bersama) jalur UTM (Ujian Talenta Mandiri).
Selain itu, penulis juga aktif dalam organisasi nasional luar kampus, seperti
Young
On Top Campus Ambassador
2010/2011 dan
The Connector Climate Change
Indonesia 2010.
Beberapa prestasi yang pernah diraih penulis selama menempuh pendidikan
di IPB ialah berhasil lolos didanai “Program Mahasiswa Wirausaha 2009” yang
diadakan oleh Dikti dengan merintis usaha “Katalis
Corporation
”,
Most Favorited
Youth Start-up Icon
wilayah Jabodetabek 2011 yang diadakan oleh
The
Marketers
, dan finalis wilayah Jabodetabek Wirausaha Muda Mandiri 2011
kategori mahasiswa yang diadakan oleh Bank Mandiri. Kecintaan akan kampus
IPB diwujudkan penulis dengan aktif mendirikan komunitas
online
@tweetIPB di
media sosial Twitter yang hingga skripsi ini dibuat telah mencapai 19150
followers
dari kalangan civitas akademika IPB.
DAFTAR
ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
BAHAN DAN METODE
Bahan dan Alat ... 2Langkah Kerja ... 2
Sintesis Fenil Asetat ... 2
Sintesis o-Hidroksiasetofenon ... 2
Sintesis o-Benzoiloksiasetofenon ... 3
Sintesis β-Diketon ... 3
Pemurnian β-Diketon ... 3
Prenilasi β-Diketon ... 4
HASIL
β-Diketon Kasar ... 4β-Diketon Murni ... 5
β-Diketon Terprenilasi ... 5
PEMBAHASAN
β-Diketon ... 6β-Diketon Terprenilasi ... 7
SIMPULAN DAN SARAN ... 8
DAFTAR PUSTAKA ... 8
iii
DAFTAR TABEL
Halaman
1 Hasil sintesis fenil asetat ... 4
2 Hasil sintesis
o-
HAP ... 4
3 Hasil sintesis
o-
BAP ... 4
4 Hasil sintesis
β
-diketon ... 4
5 Hasil pemurnian
β
-diketon ... 5
6 Hasil KLTP produk prenilasi
β
-diketon ... 5
7 Hasil KLTP fraksi 3 dan 4 ... 5
8
Perbandingan hasil produksi
β
-diketon………..………...6
9 Posisi
sinyal-sinyal
1H NMR 1,3-diketon terprenilasi (pelarut CDCl
3).…….. 7
DAFTAR GAMBAR
Halaman
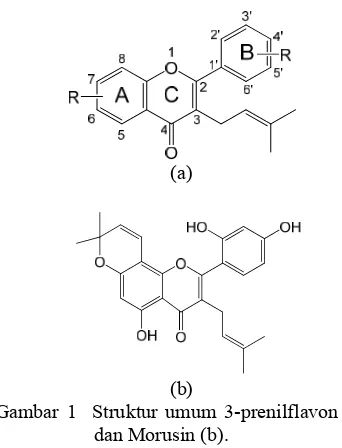
1 Struktur umum 3-prenilflavon dan morusin ... 1
2 Analisis retrosintesis 3-prenilflavon ... 2
3 Kristal
o
-BAP kering ... 4
4
β
-Diketon kasar ... 4
5
β
-Diketon murni ... 5
6
β
-Diketon terprenilasi kasar ... 5
7 Reaksi sintesis fenil asetat ... 5
8 Reaksi penataan-ulang Fries fenil asetat……. ... 5
9 Reaksi benzoilasi
o
-HAP ... 6
10 Reaksi penataan-ulang BV
o
-BAP menjadi
β
-diketon ... 6
11 Reaksi prenilasi
β
-diketon ... 6
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 11
2 Mekanisme reaksi tiap tahap sintesis ... 12
3 Spektrum
1H-NMR hasil prenilasi
β
-diketon fraksi 3A ... 14
PENDAHULUAN
Flavonoid merupakan senyawa metabolit sekunder yang terbentuk secara alami dalam tumbuhan, dengan kerangka karbon berupa 2 cincin fenil yang dihubungkan oleh rantai alifatik 3 karbon (C6−C3−C6). Flavonoid mempunyai banyak aktivitas farmakologi antara lain sebagai antioksidan (Zuhra et al. 2008), antibakteri (Sukadana 2009), antiradang (Kim et al. 2004), antiobesitas (Lee et al. 2004), antihipertensi, diuretik, analgesik, antialergi, dan antikarsinogenik (Aslam dan Intekhab 2009). Terkait khasiatnya, flavonoid banyak dipelajari oleh para ilmuwan dan digunakan dalam industri obat dan makanan. Isolasi flavonoid secara langsung dari alam biasanya menghasilkan rendemen yang relatif rendah. Wang et al. (2008) dan Sukadana (2009) melaporkan rendemen flavonoid hasil isolasi berturut-turut sebesar 2.78−4.10% dan 0.14%. Selain kandungan flavonoid yang terbatas dalam tumbuhan, proses isolasi umumnya cukup panjang sehingga rendemen flavonoid yang dapat diisolasi relatif rendah. Oleh sebab itu, perlu dikembangkan sintesis senyawa golongan flavonoid untuk mendapatkan rendemen yang lebih tinggi.
Salah satu kelompok flavonoid yang belum banyak disintesis adalah 3-prenilflavon (Gambar 1a). Senyawa ini banyak diisolasi dari tanaman genus Artocarpus (Mustapha 2009) dan Morus (Ferlinahayati 2010). Sejauh ini baru ditemukan 1 laporan tentang sintesis senyawa dari kelompok 3-prenilflavon, yaitu sintesis morusin (Gambar 1b) oleh Tseng et al. (2010). Banyak manfaat 3-prenilflavon telah dilaporkan, di antaranya artokarpin menunjukkan toksisitas terhadap larva udang
Artemia salina, daya hambat terhadap transpor asam amino leusina pada membran usus ulat sutera Bombyx mori, serta aktivitas hambat terhadap enzim 5α-reduktase dan aktivitas pemutih kulit (Ferlinahayati 2010). Manfaat terpenting 3-prenilflavon adalah sebagai antikanker dan antimalaria yang dilaporkan oleh Mustapha (2009) dan Ferlinahayati (2010).
Berbagai bioaktivitas senyawa 3-prenilflavon lainnya telah diteliti. Senyawa artokarpin memperlihatkan aktivitas sitotoksik yang sangat aktif terhadap sel murin leukemia P-388 (Musthapa 2009). Kudraflavon B memiliki efek hepatoprotektif, kuwanon C merupakan antibakteri dan antitrombosit, dan morusin dapat digunakan sebagai promotor
(a)
(b)
Gambar 1 Struktur umum 3-prenilflavon (a) dan Morusin (b).
antitumor, anti HIV-1, antibakteri, antitrombosit, dan antiradang (Ferlinahayati 2010). Prenilasi di C-3 serta pola trioksigenasi cincin-B di C-2’, C-4’, dan C-5’ diusulkan sebagai penentu utama bioaktivitas tersebut (Nomura et al. 1988; Musthapa 2009; Ferlinahayati 2010).
Flavon adalah kelompok flavonoid terisoprenilasi paling melimpah kedua setelah flavanon. Sebagian besar substituen isoprenoid (C5: prenil; C10: geranil, neril, atau lavanduil; atau C15: farnesil) terikat secara langsung ke molekul flavon (C -prenilflavon), sedangkan O-prenilasi jarang terjadi (Valant-Vetschera dan Wollenweber 2006).
Dalam penelitian sebelumnya, Arifin (2010) dan Septiani (2011) telah berhasil menyintesis β-diketon 1-(2-hidroksifenil)-3-fenilpropana-1,3-dion sebagai prekursor untuk mendapatkan flavon dengan cincin A dan B tidak tersubstitusi. 3-Prenilflavon tak-tersubstitusi akan disintesis dari prekursor β -diketon tersebut. Oleh karena itu, dalam penelitian ini β-diketon dimurnikan dan diprenilasi untuk menghasilkan β-diketon terprenilasi sebagai prekursor 3-prenilflavon.
β-Diketon kasar disintesis mengikuti prosedur Anggraini (2012) yang merupakan optimalisasi prosedur Arifin (2010) dan Septiani (2011).
Analisis retrosintesis 3-prenilflavon dalam penelitian ini ditunjukkan pada Gambar 2. Senyawa 3-prenilflavon disintesis dari prenilasi β-diketon (2) yang diperoleh dari kondensasi senyawa 4 (fragmen C6-C2), yaitu
2
Strategi ini dipilih karena reaksinya sederhana dan bahan awalnya mudah diperoleh.
Gambar 2 Analisis retrosintesis 3-prenilflavon.
BAHAN
DAN METODE
Bahan dan Alat
Pereaksi menggunakan bahan-bahan khusus untuk analisis (p.a) yang diproduksi oleh Merck, seperti AlCl3, fenol, benzoil klorida, piridina kering (< 0.0075% H2O), piridina, pelet KOH 85%, asam asetat glasial 99.8%, H2SO4 95–97%, metanol, aseton, HCl pekat, pelet NaOH, dan NaHCO3. Selain itu, digunakan pula pelarut teknis, yaitu metilena klorida (MTC), etil asetat, dan aseton yang didistilasi terlebih dahulu 2 kali sebelum dipakai. Semua bahan p.a digunakan langsung tanpa praperlakuan terlebih dahulu.
Peralatan yang digunakan antara lain radas refluks, radas distilasi uap, dan radas penentuan titik leleh Mel-Temp Model 1202D Barnstead® (tanpa koreksi). Spektrum NMR diukur dengan spektrometer JEOL ECA 500 yang bekerja pada frekuensi 500 MHz (1H) di Pusat Penelitian Kimia LIPI, Puspiptek Serpong.
Langkah Kerja
Tahapan penelitian (Lampiran 1) terdiri atas sintesis fenil asetat dari fenol dan anhidrida asetat, penataan-ulang Fries fenil asetat membentuk o-HAP, benzoilasi o-HAP dengan benzoil klorida, penataan-ulang BV ester yang terbentuk menghasilkan β-diketon, dan prenilasi β-diketon. Produk prenilasi dicirikan dengan spektroskopi NMR. Semua zat antara dalam proses prenilasi β-diketon
diidentifikasi dengan membandingkan nilai Rf, titik leleh, dan kenampakannya dengan produk sintesis Anggraini (2012).
Sintesis Fenil Asetat (modifikasi Septiani 2011)
Sebanyak 0.25 mol fenol dicampurkan dengan 0.375 mol anhidrida asetat dalam gelas piala. Campuran ini larut sempurna. Kemudian sebanyak 0.018 mol CuSO4 anhidrat ditambahkan dan diaduk selama 3 jam. Selama pengadukan, warna katalis berangsur-angsur berubah dari putih menjadi biru. Setelah itu, campuran di-work-up dengan menambahkan 750 mL larutan NaHCO3 10%, dan produk fenil asetat diekstraksi menggunakan MTC. Proses ekstraksi dikendalikan menggunakan KLT dengan eluen MTC. Ekstrak MTC dikeringkan dengan Na2SO4 anhidrat, lalu dipekatkan, dan ditimbang.
Modifikasi metode yang dilakukan adalah waktu sintesis yang lebih lama. Septiani (2011) melakukan sintesis fenil asetat selama 1.5 jam dan masih tersisa fenol. Dengan waktu sintesis yang lebih lama, semua fenol didapati bereaksi dan tidak tersisa pada produk.
Sintesis o-Hidroksiasetofenon
(Anggraini 2012)
Sepuluh mmol AlCl3 dimasukkan ke dalam labu leher dua yang telah dirangkai dengan pendingin refluks. Gas N2 dialirkan untuk mengusir uap air dari dalam radas, kemudian 10 mmol fenil asetat ditambahkan tetes demi tetes dengan bantuan syringe, sambil diaduk dengan pengaduk magnet pada suhu kamar. Campuran dipanaskan selama 1.5 jam dengan suhu 120 °C sambil terus diaduk. Campuran kemudian didiamkan ke suhu kamar, lalu HCl dingin 1:1 ditambahkan sedikit demi sedikit hingga suhu tidak naik lagi. Hasil sintesis berupa pasta berwarna merah. Campuran isomer o- dan p-HAP dipisahkan melalui proses distilasi uap.
o-HAP terdistilasi oleh uap, menyisakan p-HAP sebagai residu. Sisa fenil asetat, sedikit p -HAP, dan pengotor ikut terbawa bersama distilat. Fenil asetat memiliki Rf sama dengan o-HAP, maka harus dipisahkan melalui ekstraksi pengendalian pH.
bagian kemudian diekstraksi dengan NaOH 5%. Garam o-HAP akan terbawa ke fase NaOH 5%, sedangkan fenil asetat tertinggal di fase MTC. Fase NaOH 5% pada ekstraksi pertama berwarna kuning tua dan semakin memudar pada ekstraksi berikutnya. Akhir ekstraksi ditunjukkan oleh uji FeCl3 negatif pada fase MTC yang dipekatkan (tidak menghasilkan warna ungu).
Fase NaOH 5% kemudian diasamkan dengan HCl 1:1 (pH diperiksa dengan indikator universal). Warna kuning akan memudar dan hilang kembali (seperti distilat awal). Setelah itu, diekstraksi beberapa kali dengan MTC sampai semua komponen terekstraksi (dipantau dengan KLT). Selain o -HAP, sedikit p-HAP dan pengotor masih terbawa ke fase MTC. Pemurnian o-HAP untuk skala besar dilakukan dengan kromatografi cair vakum (KCV), sedangkan untuk skala kecil digunakan KLT preparatif, keduanya dengan eluen MTC.
Sintesis o-Benzoiloksiasetofenon
(Anggraini 2012)
Lima mmol o-HAP dimasukkan ke dalam gelas piala 50 mL, kemudian ditambahkan berturut-turut 2 mL piridina kering dan 10 mmol benzoil klorida tetes demi tetes. Reaksi berjalan eksoterm. Campuran diaduk kuat hingga tidak terbentuk kalor lagi, lalu ditambahkan 60 mL HCl 3% dan ±20 g es batu secara bersamaan sambil diaduk kuat dengan batang pengaduk. Terbentuk lapisan minyak kental berwarna kuning yang dapat dipisahkan dengan mudah dari air.
Lapisan minyak ditambah dengan bebe-rapa porsi metanol untuk kristalisasi. Kristal murni o-BAP yang terbentuk disaring. Filtrat metanol masih mengandung 3 komponen (hasil pemantauan KLT), termasuk sebagian
o-BAP yang tidak ikut mengkristal. Filtrat ini dipekatkan, kemudian didiamkan di suhu kamar untuk pembentukan kristal. Kristal
o-BAP yang terbentuk masih mengandung pengotor, dan dicuci dengan 1.5 mL metanol dan 1 mL air dingin.
Air yang dipisahkan dari lapisan minyak juga masih mengandung sedikit o-BAP dan didinginkan semalaman pada suhu 0 °C. Campuran beku kemudian dibiarkan mencair di suhu kamar, kristal yang terbentuk disaring dan dikering-udarakan. Seluruh kristal murni yang terbentuk digabungkan, ditimbang bobot totalnya, dan ditentukan titik lelehnya.
Sintesis β-Diketon
(Anggraini 2012)
Lima mmol o-BAP dalam gelas piala 50 mL ditambahkan 5 mL piridina kering, lalu dipanaskan ke suhu 50 °C dalam penangas air. Sementara itu, 7.5 mmol (1.5 ekuivalen) KOH 85% dihaluskan dengan alu dan lumpang yang telah dipanaskan dalam oven 100 °C. Serbuk KOH ini segera ditambahkan ke dalam campuran di gelas piala dan diaduk selama 15 menit. Selama pengadukan, larutan akan mengental dan berubah menjadi pasta berwarna kuning-muda. Campuran dibiarkan mendingin ke suhu kamar, kemudian diasamkan dengan 7 mL asam asetat 10%. Endapan kuning-muda yang terbentuk disaring, dikeringkan di dalam oven pada suhu 60 °C. Setelah kering, endapan ditimbang dan ditentukan titik lelehnya.
Pemurnian β-Diketon
(modifikasi Wheeler 1963)
Satu mmol β-diketon kasar ditimbang ke dalam gelas piala 50 mL lalu dipanaskan di dalam penangas air. Sambil menunggu suhu penangas naik, sebanyak 20 mL etanol 95% yang akan digunakan untuk melarutkan β -diketon dipanaskan hingga mendidih (±70° C) di atas penangas tersebut. Etanol 95% panas tersebut kemudian ditambahkan tetes demi tetes dan perlahan ke dalam β-diketon kasar hingga semua larut. Larutan disaring dalam kondisi masih panas dan endapan hasil penyaringan diperiksa dengan KLT serta diuji penambahan FeCl3 dan pengukuran titik leleh.
Prenilasi β-Diketon
(modifikasi Nogueira et al. 2000)
4
menggunakan eluen yang sama. Pengukuran spektroskopi 1H NMR dilakukan untuk mengelusidasi produk akhir.
HASIL
β-Diketon Kasar
Fenil asetat sebagai bahan baku o-HAP disintesis dengan memodifikasi metode Septiani (2011) dalam hal lama pengadukan. Rerata rendemen yang diperoleh 96 % (Tabel 1).
Tabel 1 Hasil sintesis fenil asetat
Ulangan mmol PhOH
mmol PhOAc
Rendemen (%)
1 250 236.95 94.8
2 250 241.56 96.6
Rerata 95.7
Isomerisasi fenil asetat menjadi o-HAP dilakukan dengan metode Anggraini (2012). Sintesis ini menghasilkan produk samping p -HAP yang cukup besar. Mekanisme lengkap pembentukan o-HAP dapat dilihat di Lampiran 2. Sintesis o-HAP dilakukan 5 kali ulangan. Hasil sintesis ulangan 1 dimurnikan dengan KLTP. Hasil sintesis ulangan 2 digabung dengan ulangan 3 dan ulangan 4 digabung dengan ulangan 5 lalu dimurnikan dengan KCV agar lebih efisien. Rendemen o -HAP yang didapat ditunjukkan pada Tabel 2, rerata sebesar 33.5%.
Tabel 2 Hasil sintesis o-HAP
Ulangan mmol PhOAc
mmol
o-HAP
Rendemen (%)
1 100.84 31.95 31.7
2 & 3 202.38 68.64 33.9 4 & 5 175.06 60.64 34.7 Rerata 33.5
Benzoilasi o-HAP menjadi o-BAP juga dilakukan dengan metode Anggraini (2012).
o-BAP kering berbentuk kristal putih (Gambar 3). Rendemen yang dihasilkan mencapai 76%, berdasarkan 2 data terbaik yang diperoleh (Tabel 3). Sebelumnya, sintesis o -BAP dilakukan dengan mmol o-HAP lebih kecil, yaitu 5, 20, dan 33 mmol dan rendemen yang dihasilkan berturut-turut 34.1, 46.9, dan 69.5%.
Gambar 3 Kristal o-BAP kering
Tabel 3 Hasil sintesis o-BAP
Ulangan mmol
o-HAP
mmol o -BAP
Rendemen (%)
1 50.97 38.13 74.9
2 52.29 40.13 76.5
Rerata 75.7
Senyawa β-diketon diperoleh dari penataan-ulang Baker-Venkataraman o-BAP, berbentuk padatan kuning-muda dengan nilai
Rf~0.49 dalam eluen heksana-MTC (8:2) (Gambar 4). Rendemen β-diketon sebesar 83% (Tabel 4) dengan titik leleh 115–118 °C. Data lengkap hasil sintesis β-diketon dapat dilihat di Tabel 4.
Gambar 4 β-Diketon kasar
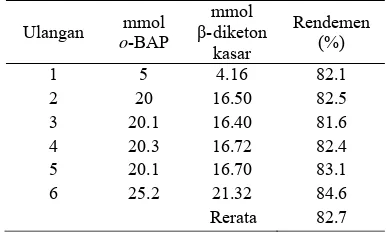
Tabel 4 Hasil sintesis β-diketon
Ulangan mmol
o-BAP mmol β-diketon kasar Rendemen (%)
1 5 4.16 82.1
2 20 16.50 82.5
3 20.1 16.40 81.6
4 20.3 16.72 82.4
5 20.1 16.70 83.1
6 25.2 21.32 84.6
Rerata 82.7
Pemurnian β-Diketon
Gambar 5 β-Diketon murni
Tabel 5 Hasil pemurnian β-diketon
Ulangan
mmol β -diketon kasar
mmol β -diketon murni
Rendemen (%)
1 25 23.80 95.2
2 25 23.91 95.6
3 26.5 25.39 95.8
Rerata 95.5
β-Diketon Terprenilasi
Prenilasi dilakukan terhadap β-diketon yang telah dimurnikan sebanyak 2.4 g (10 mmol). Produk prenilasi berwarna cokelat muda dan dimurnikan dengan KLTP sebanyak 2 kali. Eluen pertama ialah n-heksana:EtOAc 8:2, menghasilkan 4 fraksi (Tabel 6). Dari 4 fraksi tersebut, fraksi 2 tidak selalu muncul. Fraksi 3 dan 4 dielusi kembali dengan eluen
n-heksana:EtOAc 99:1, masing-masing terpisah menjadi 2 fraksi (Tabel 7). Rendemen fraksi 3A yang kemudian dielusidasi sebagai
β-diketon terdiprenilasi adalah 49%. Spektrum 1H NMR fraksi 3A disajikan pada Lampiran 3. Fraksi 3B dan 4B yang bobotnya terbanyak ketiga dan keempat juga ditentukan spektrum 1H NMR-nya (Lampiran 4) dan didapati merupakan pengotor. Fraksi 4A merupakan sisa β-diketon yang tidak bereaksi.
(a) (b) (c)
Gambar 6 β-Diketon terprenilasi kasar (a); fraksi 3 (b) dan 3A (c) dari β -diketon terprenilasi
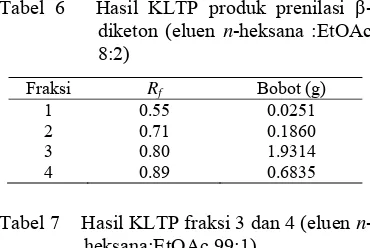
Tabel 6 Hasil KLTP produk prenilasi β -diketon (eluen n-heksana :EtOAc 8:2)
Fraksi Rf Bobot (g)
1 0.55 0.0251 2 0.71 0.1860 3 0.80 1.9314 4 0.89 0.6835
Tabel 7 Hasil KLTP fraksi 3 dan 4 (eluen n -heksana:EtOAc 99:1)
Fraksi Rf
Bobot
(g) Rendemen (%) 3A 0.38 1.7219 48.9
3B 0.42 0.1930 -
4A 0.50 0.4325 -
4B 0.69 0.1760 -
PEMBAHASAN
β-Diketon
Produksi β-diketon dilakukan melalui 4 tahap reaksi. Tahap awal adalah esterifikasi fenol menjadi fenil asetat (Gambar 7). Tahap berikutnya memiliki rendemen terendah, yaitu sintesis o-HAP. Sintesis o-HAP dilakukan dengan penataan-ulang Fries dari fenil asetat (Gambar 8). Rendemen yang rendah disebabkan oleh rendahnya regioselektivitas reaksi sehingga p-HAP juga banyak dihasilkan.
Gambar 7
Reaksi sintesis fenil asetat
Gambar 8 Reaksi penataan-ulang Fries fenil asetat.
Tahap berikutnya adalah esterifikasi o -HAP menjadi o-BAP (Gambar 9) dilanjutkan dengan penataan-ulang Baker-Venkataraman (BV) senyawa o-BAP tersebut menghasilkan
6
Pengasaman ion fenoksida yang terbentuk akan menghasilkan β-diketon.
Gambar 9 Reaksi benzoilasi o-HAP
Gambar 10 Reaksi penataan-ulang BV o -BAP menjadi β-diketon.
Semua tahap produksi β-diketon menghasilkan rendemen yang tidak jauh berbeda dengan rendemen tertinggi yang diperoleh Septiani (2011) dan Anggraini (2012) (Tabel 8). Mekanisme reaksi lengkap semua tahap produksi β-diketon dapat dilihat di Lampiran 3. Secara keseluruhan, β-diketon murni pada penelitian ini diperoleh sebanyak 24% dari bahan awal fenol (Tabel 8) atau 59% dari o-HAP.
Tabel 8 Perbandingan hasil produksi
β-diketon
Tahap Septiani (2011)
Anggraini (2012)
Sugiarto (2012) I 95% - 96% II 33% 41% 33% III 44% 73% 76% IV 85% 86% 83%
V - - 93%
VI 12% 26% 24% Keterangan:
I = Sintesis PhOAc II = Sintesis o-HAP III = Sintesis o-BAP IV = Sintesis β-diketon V = Pemurnian β-diketon VI = Rendemen seluruh tahap
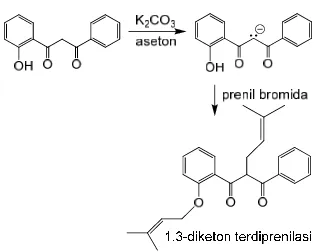
β-Diketon Terprenilasi
Prenilasi β-diketon dapat dilakukan dengan prenil bromida atau prenil alkohol. Pada penelitian ini digunakan prenil bromida (Gambar 11) karena mekanisme sintesisnya
yang lebih sederhana. Basa K2CO3 digunakan untuk mengambil Hα pada β-diketon sehingga terbentuk karbanion yang berperan sebagai nukleofili dan bereaksi SN2 dengan prenil bromida. Kemungkinan lain, terjadi prenilasi pada gugus –OH fenolik yang bersifat asam dan mudah terdeprotonasi oleh K2CO3. Mekanisme prenilasi selengkapnya dapat dilihat di Lampiran 2.
Gambar 11 Reaksi prenilasi β-diketon
Prenilasi dilakukan dengan bahan awal 10 mmol β-diketon. Setelah sintesis selama 24 jam diperoleh 4 fraksi KLTP dengan eluen n -heksana-EtOAc (8:2). Dua fraksi paling dominan ialah fraksi 3 dan 4 (Tabel 6). Fraksi 1 dan 2 menunjukkan 1 noda pada berbagai eluen, sedangkan fraksi 3 dan 4 menghasilkan masing-masing 2 noda ketika dielusi dengan
n-heksana:EtOAc (99:1) (Tabel 7). Analisis sinyal-sinyal NMR proton fraksi 3A yang merupakan senyawa β-diketon terdiprenilasi dirangkum pada Tabel 9.
Spektrum 1H NMR menunjukkan 28 hidrogen yang tersebar dari 1.55 hingga 7.98 ppm. Secara umum, proton tersebut terbagi menjadi 2 jenis, yaitu proton gugus prenil dan proton cincin aromatik. Ada 2 jenis gugus prenil, yaitu O-prenil dan C-prenil. Empat sinyal singlet muncul di daerah alifatik dan berasal dari 4 gugus –CH3. Sinyal ini merupakan bukti kuat bahwa diketon telah mengalami diprenilasi. Jika β-diketon hanya termonoprenilasi, spektrum 1H NMR hanya akan menunjukkan 2 sinyal pada daerah tersebut dan jika tidak terjadi prenilasi, sinyal proton –CH3 tidak muncul.
Posisi Karbon
δH 500
MHz (ppm)
Multiplisitas,
J (Hz)
Integrasi (Σ H)
2 5.53 m 1
6 6.88 d, 8.4 1
7 7.52 t (lebar), 7.8 1 8 6.96 t (lebar), 7.8 1 9 7.73 dd, 7.8, 1.9 1 11, 15 7.98 d, 7.1 2 12, 13,
14 7.40–7.45 m 3
16 2.65–2.75 m 2
17 5.12 t (lebar), 5.85 1
19, 20, 24, 25 1.55 1.59 1.63 1.68 s s s s 3 3 3 3
21 4.44 d, 6.5 2
22 5.25 t (lebar), 6.5 1
Proton pada posisi 17 dan 22 memiliki geseran kimia yang sangat berdekatan, yaitu 5.12 dan 5.25 ppm, daerah geseran kimia yang khas untuk proton vinilik. Proton vinilik pada posisi 17 lebih ke medan bawah karena adanya sedikit perambatan tarikan-elektron dari atom O eter. Pola pembelahannya triplet karena bertetangga dengan gugus metilena. Kedua triplet tersebut agak melebar karena pengaruh kopling alilik jarak-jauh, dan satu sama lain memiliki kemiripan pola pembelahan.
Proton metilena pada posisi 21 lebih ke medan bawah (4.44 ppm) dibandingkan dengan proton metilena pada posisi 16 (2.65– 2.75 ppm) karena adanya tarikan-elektron langsung oleh atom O eter. Normalnya proton –CH2– memiliki geseran kimia di sekitar 2–3 ppm seperti pada proton 16. Sinyal proton 21 memiliki pola pembelahan doblet karena bertetangga dengan sebuah proton vinilik, sedangkan sinyal proton 16 triplet karena juga bertetangga dengan atom hidrogen-α. Efek enantiotopik menyebabkan kedua proton 16 muncul sebagai 2 sinyal berbeda dalam spektrum NMR meskipun kondisinya setara secara kimia. Proton 27 tidak memperlihatkan
efek enantiotopik tersebut, maka hanya muncul 1 sinyal. Menurut Pavia et al. (2009), efek enantiotopik terjadi jika penggantian salah satu proton dengan gugus lain akan menghasilkan sepasang enantiomer.
Proton C-2 yang mengikat gugus prenil bertetangga dengan 2 gugus karbonil sehingga sangat terawaperisai dengan nilai geseran kimia 5.53 ppm. Proton-α lazimnya memiliki geseran kimia pada kisaran 2–3 ppm jika hanya bertetangga dengan 1 gugus karbonil dan tidak terjadi tautomerisasi. Adanya sinyal proton C-2 ini membuktikan bahwa di antara 2 gugus prenil yang terikat ke β-diketon, hanya salah satu terikat ke atom C-2 sehingga tersisa 1 proton, gugus prenil lainnya terikat ke atom O fenolik. Sinyal ini juga menunjukkan bahwa bentuk enol tidak dijumpai pada produk sintesis, berbeda dengan β-diketon kasar yang memunculkan sinyal enol pada geseran kimia 15.59 ppm (Septiani 2011). Sinyal kecil di daerah 12 ppm (Lampiran 3) adalah sinyal pengotor. Jadi, keberadaan prenil menggeser kesetimbangan tautomerisasi keto-enol ke bentuk keto.
Proton pada daerah aromatik terbagi menjadi 2 jenis, yaitu proton cincin A dan cincin B. Jumlah total proton pada kedua cincin ini ada 8, sesuai dengan jumlah sinyal 1
H NMR proton yang teramati pada kisaran 7– 8 ppm. Meskipun kedua cincin sama-sama mengalami tarikan-elektron dari gugus karbonil, secara umum cincin A lebih terperisai karena efek sumbangan-elektron dari atom O eter. Jadi, sinyal-sinyal yang lebih ke medan atas dari 8 sinyal proton aromatik tersebut berasal dari cincin A.
Sinyal proton aromatik pada cincin A terbagi menjadi 2, yaitu daerah yang lebih ke medan bawah (7 dan 9) dan yang lebih ke medan atas (6 dan 8). Posisi 7 dan 9 lebih terawapaerisai karena efek tarikan-elektron gugus C=O menghasilkan geseran kimia di 7.52 ppm (posisi 7) dan 7.73 ppm (posisi 9). Posisi 7 sedikit lebih ke medan atas karena posisinya lebih jauh dari C=O sehingga efek tarikan-elektron yang dirasakan lebih lemah. Sementara posisi 6 dan 8 lebih terperisai karena efek-sumbangan elektron dari atom O eter.
8
sinyal yang berasal dari 3 proton di posisi
meta dan para terhadap gugus karbonil. Spektrum 1H NMR β-diketon terdiprenilasi masih memiliki beberapa sinyal pengotor. Sinyal pengotor ini sebagian juga terdeteksi pada spektrum 1H NMR untuk fraksi 3B dan 4B (Lampiran 4). Hal ini menunjukkan bahwa pengotor yang ada kemungkinan besar terbawa dari β-diketon awal. Jadi, senyawa β-diketon yang telah dimurnikan diduga belum cukup murni dan masih perlu dimurnikan lebih lanjut seperti dengan kromatografi kolom. Namun, secara umum pengotor yang muncul lebih sedikit dibandingkan dengan spektrum 1H NMR hasil sintesis dengan β-diketon tanpa pemurnian sama sekali (hasil tidak dipublikasikan).
SIMPULAN DAN SARAN
β-Diketon murni telah berhasil disintesis dengan rendemen 24% dalam 4 tahap dari senyawa awal fenol. Prenilasi β-diketon tersebut dengan prenil bromida dan basa K2CO3 dalam aseton menghasilkan β-diketon terdiprenilasi di Cα dan di O dengan rendemen 49%.
Pemberian gugus pelindung pada gugus – OH β-diketon diperlukan agar diperoleh produk yang termonoprenilasi di Cα. β -Diketon yang digunakan juga perlu dimurnikan kembali.
DAFTAR PUSTAKA
Anggraini L. 2012. Sintesis flavon dari fenol dan benzoil klorida [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Arifin B. 2010. Pembuatan β-diketon sebagai zat antara untuk sintesis 3-prenilflavon [tesis]. Bandung (ID): Institut Teknologi Bandung.
Aslam M, Intekhab J. 2009. Isolation of a flavonoid from the roots of Citrus sinensis.
Mal J Pharmaceut Sci. 7:1-8.
Ferlinahayati. 2010. Fitokimia dan sifat sitotoksik senyawa turunan fenol dari genus Morus yang tumbuh di Jawa Barat. [disertasi]. Bandung (ID): Institut Teknologi Bandung.
Lee JI, Son HS, Park H. 2004. An efficient synthesis of flavones from
2-hydroxybenzoic acids. Bull Korean Chem Soc. 25:1945-1947.
Kim HP, Son KH, Chang HW, Kang SS. 2004. Anti-inflammatory plant flavonoids and cellular action mechanisms. J Pharmacol Sci. 96:229-245.
Musthapa I. 2009. Keanekaragaman metabolit sekundr turunan fenol dari beberapa spesies tumbuhan Artocarpus asal Indonesia serta aktivitas biologinya [disertasi]. Bandung (ID): Institut Teknologi Bandung.
Nay B, Arnaudinaud V, Vercauteren J. 2002. Total synthesis of asymmetric flavonoids: the development and applications of 13 C-labelling. CR Chimie 5:577-590.
Nogueira MA, Mahalga EG, Magalha AF, Biloti DN, Laverde A, Pessine FBT, Carvalho JE, Koh LK, Antonio MA, Marsaioli AJ. 2003. A novel sunscreen agent having antimelanoma activity. Il Farmaco. 58:1163-1169.
Nomura T, Hano Y, Aida M. 1998. Isoprenoid-subtituted flavonoids from
Artocarpus plants (Moraceae).
Heterocycles 47: 179-1205.
Pavia DL, Lampman GM, Kriz GS, Vyvyan JR. 2009. Introduction to Spectroscopy.
Ed ke-4. Belmont: Brooks/Cole.
Septiani D. 2011. Sintesis 1-(2-hidroksifenil)-3-fenilpropana-1,3-dion dari o -hidroksiasetofenon dan benzoil klorida [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sukadana IM. 2009. Senyawa antibakteri golongan flavonoid dari buah belimbing manis (Averrhoa carambola Linn.). J Kim.
3:109-116.
Tseng TH, Chuang SK, Hu CC, Chang CF, Huang YC. 2010. The synthesis of morusin as a potent antitumor agent.
Tetrahedron. 66:1335-1340.
Valant-Vetschera KM, Wollenweber E. 2006. Flavones and flavonols. Di dalam: Andersen OM, Markham KR..
Flavonoids: Chemistry, Biology, and Applications. Boca Raton: CRC Pr. hlm 679, 684-689, 692.
combinatorial libraries. J Comb Chem. 9: 668-676.
Wheeler TS. 1963. Flavone. Org Synth. 4:478.
10
Lampiran 1 Bagan alir penelitian
Penataan-ulang Baker-Venkataraman
o-BAP menjadi β-diketon (Anggraini 2012)
Prenilasi β-diketon (modifikasi Noguiera et al. 2000)
Pencirian spektroskopi produk prenilasi β-diketon Penataan-ulang fenil asetat menjadi o-HAP (Anggraini 2012)
Benzoilasi o-HAP menjadi o-BAP (Anggraini 2012) Asetilasi fenol
menjadi fenil asetat (modifikasi Septiani
2012)
12
Lampiran 2 Mekanisme reaksi setiap tahap sintesis
Sintesis Fenil Asetat
Sintesis
o
-HAP
Serangan orto
Serangan para
Sintesis
β
-diketon
14
Lampiran 3 Spektrum
1H-NMR hasil prenilasi
β
-diketon fraksi 3A
Geseran kimia (ppm)
Perbesaran sinyal di daerah B:
Geseran kimia (ppm)
A
B
D
E
C
Kel
im
pa
han
Kel
im
pa
han
Pengotor
Perbesaran sinyal di daerah A:
Geseran kimia (ppm)
Perbesaran sinyal di daerah C:
Geseran kimia (ppm)
Kel
im
pa
han
Kel
im
pa
han
16
Perbesaran sinyal di daerah D:
Geseran kimia (ppm)
Perbesaran sinyal di daerah E:
Geseran kimia (ppm)
Kel
im
pa
han
Kel
im
pa
Lampiran 4 Spektrum
1H-NMR hasil prenilasi
β
-diketon fraksi 3B dan 4B
Spektrum Fraksi 3B:
Geseran kimia (ppm)
Spektrum Fraksi 4B:
Geseran kimia (ppm)
Kel
im
pa
han
Kel
im
pa
han
3 sinyal pengotor yang ditemukan pada β‐diketon
terdiprenilasi (fraksi 4A)
3 sinyal pengotor yang ditemukan pada