ANALISIS KOMUNITAS AKTINOBAKTERI ENDOFIT
PEGAGAN (
Centella asiatica
L.
Urban) BERDASARKAN
GEN 16S rRNA DAN POTENSINYA SEBAGAI
ANTIDIABETES
MEI ERNAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Komunitas Aktinobakteri Endofit Pegagan (Centella asiatica L.Urban) Berdasarkan Gen 16S rRNA dan Potensinya sebagai Antidiabetes adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
RINGKASAN
MEI ERNAWATI. Analisis Komunitas Aktinobakteri Endofit Pegagan (Centella asiatica L. Urban) Berdasarkan Gen 16S rRNA dan Potensinya sebagai Antidiabetes. Dibimbing oleh YULIN LESTARI dan DEDY DURYADI SOLIHIN.
Aktinobakteri endofit tanaman obat memiliki potensi sebagai sumber beragam senyawa bioaktif termasuk antidiabetes. Pengetahuan tentang keragaman genetik aktinobakteri endofit Centella asiatica penting sebagai dasar untuk mengeksplorasi aktinobakteri endofit potensial dari tanaman tersebut. Analisis keragaman melalui pendekatan metagenomik (culture-independent) dengan teknik PCR-DGGE (Polymerase Chain Reaction - Denaturing Gradient Gel Electrophoresis), merupakan langkah yang efisien dalam mempelajari komunitas aktinobakteri endofit. Penelitian ini bertujuan mengkaji keragaman aktinobakteri tanah rizosfer dan endofit C. asiatica melalui pendekatan metagenomik dengan PCR-DGGE berdasarkan gen 16S rRNA dan gen inhibitor α-glukosidase.
DNA genom total tanah rizosfer dan jaringan tanaman diekstraksi menggunakan Soil DNA Isolation Kit dan Genomic DNA Mini Kit (Plant). Gen 16S rRNA aktinobakteri diamplifikasi menggunakan teknik nested-PCR (27F, 16Sact1114R dan P338F-GC, P518R). Keragaman aktinobakteri berdasarkan gen 16S rRNA dianalisis dengan DGGE pada gel poliakrilamida. Produk PCR hasil pemotongan pita DNA pada gel poliakrilamida disekuensing dan dianalisis menggunakan software bioinformatika untuk konstruksi pohon filogenetik. Gen
penyandi inhibitor α-glukosidase di amplifikasi menggunakan primer vldA-F dan vldA-R. Isolat Streptomyces sp. BWA 65 digunakan sebagai kontrol positif.
Hasil separasi produk gen 16S rRNA pada gel DGGE diperoleh 16 pita dominan dari tanah rizosfer dan jaringan tanaman C. asiatica. Pola distribusi pita menunjukkan bahwa komunitas aktinobakteri pada jaringan tanaman lebih beragam dibandingkan dengan tanah rizosfer meskipun tidak berbeda secara signifikan berdasarkan analisis Shannon-Wiener (2.176-2.57). Analisis BLAST.N menunjukkan 7 pita berkerabat dengan famili Streptomycetaceae (83-100%), 5 pita adalah famili Micromonosporaceae (99-100%), 1 pita adalah famili Gordoniaceae (99%), dan 3 pita lainnya masih dinyatakan sebagai unculturable (87-99%). Dari famili tersebut diperoleh 6 genus, yaitu genus Streptomyces, Micromonospora, Verrucosispora, Actinoplanes, Couchioplanes, dan Gordonia. Persentase kemiripan terhadap strain pembanding dalam database menunjukkan bahwa sebanyak 6, 5, 1, dan 4 spesies masing-masing sebesar 100, 99, 98, dan < 97%. Kemiripan < 97%, menarik untuk diungkap sebagai spesies aktinobakteri endofit baru dari C. asiatica. Amplifikasi PCR gen inhibitor α-glukosidase menunjukkan hasil positif pada sampel tanah rizosfer, akar dan daun C. asiatica. Hasil penelitian menunjukkan bahwa beragam aktinobakteri endofit dapat ditemukan berasosiasi dengan C. asiatica dan dapat dipelajari lebih lanjut terkait fungsinya dalam bidang kesehatan.
SUMMARY
MEI ERNAWATI. Community Analysis of Endophytic Actibacteria from Pegagan (Centella asiatica L. Urban)Based on 16s rRNA gene and Its Potential as an Antidiabetic. Supervised by YULIN LESTARI and DEDY DURYADI SOLIHIN.
Endophytic actinobacteria of medicinal plants have potential as a source of various bioactive compounds, including antidiabetic. The knowledge about the genetic diversity of endophytic actinobacteria in Centella asiatica is important as the basic information to explore potential endophytic actinobacteria from this plant. Diversity analysis by a metagenomic approach (culture-independent) with PCR-DGGE technique (Polymerase Chain Reaction - Denaturing Gradient Gel Electrophoresis), is an efficient method in the study of endophytic actinobacteria communities. This study aimed to assess the diversity of actinobacteria in rhizosphere and endophyte of C. asiatica based on metagenomic approach using PCR-DGGE of 16S rRNA and α-glucosidase inhibitor targeted-genes.
Total genomic DNA from the rhizosphere and plant tissue were extracted using the Soil DNA Isolation Kit and Genomic DNA Mini Kit (Plant), followed by PCR amplification of actinobacteria 16S rRNA gene using nested PCR technique (27F, 16Sact1114R and P338F-GC, P518R). The diversity of actinobacteria based on 16S rRNA gene was analyzed using the DGGE techniques on polyacrylamide gels. PCR products of excised bands result from polyacrylamide gel were sequenced and analyzed by bioinformatics software to construct phylogenetic tree. Gene encoding α-glucosidase inhibitor was amplified using vldA-F and vldA-R primers. Streptomyces sp. BWA 65 isolate was used as a positive control.
The results of separation in DGGE gel showed 16 major bands from rhizosphere and plant tissue. The bands distribution pattern showed that the community of actinobacteria in the plant tissue was slightly more diverse than rhizosphere , although it is not significantly different based on Shannon-Wiener analysis. The BLAST.N analysis showed that 7 bands related to the family Streptomycetaceae (83-100%), 5 bands related to Micromonosporaceae (99-100%), 1 bands related to family Gordoniaceae (99%), and 3 bands still belonged to unculturable (87-99%). There were 6 genera under those 3 families, i.e. Streptomyces, Micromonospora, Verrucosispora, Actinoplanes, Couchioplanes, and Gordonia. The percentage of strain similarity comparison to the database showed that there were 6, 5, 1, and 4 bands were 100, 99, 98, and <97%, respectively. The similarity <97% may be related to novel endophytic actinobacteria in C. asiatica. The PCR amplification of α-glucosidase inhibitor gene showed the positive results on samples of rhizosphere soil, roots and leaves. The results indicated that the diversity of endophytic actinobacteria can be found associated with C. asiatica and can be further studied for their medicinal function.
©
Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ANALISIS KOMUNITAS AKTINOBAKTERI ENDOFIT
PEGAGAN (
Centella asiatica
L.
Urban) BERDASARKAN
GEN 16S rRNA DAN POTENSINYA SEBAGAI
ANTIDIABETES
MEI ERNAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penyusunan karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2014 sampai Juli 2015 ini ialah keragaman komunitas aktinobakteri endofit asal tanaman Centella asiatica, dengan judul “Analisis Komunitas Aktinobakteri Endofit Pegagan (Centella asiatica L. Urban) Berdasarkan Gen 16S rRNA dan Potensinya sebagai Antidiabetes”.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Yulin Lestari dan Bapak Dr Ir Dedy Duryadi Solihin, DEA selaku pembimbing yang telah banyak memberikan ilmu, nasehat, motivasi, serta bimbingannya kapada penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada Ibu Dr Laksmi Ambarsari, MS selaku penguji luar komisi, dan Bapak Prof Dr Aris Tri Wahyudi, MSi yang mewakili Prof Dr Anja Meryandini, MS sebagai Ketua Program Studi Mikrobiologi IPB pada ujian tesis. Penulis juga mengucapkan terima kasih kepada seluruh staf pengajar atau Dosen pada Program Studi Mikrobiologi atas curahan ilmu selama menempuh studi di Program Studi Mikrobiologi SPs IPB.
Ucapan terima kasih juga diberikan kepada Bapak Jaka dan Ibu Heni selaku staf Laboratorium Mikrobiologi IPB, Sepriyadi selaku staf Labotarorium IPBCC, Ibu Retno selaku staf Laboratorium Terpadu Biologi IPB, yang telah banyak membantu penelitian ini, mbak Sari, kak Leni, Ibu Catur, Mona, Mahyarudin, Yeni, Randi, Hendri, Agessty, Cico, Mirza, Ni Putu, Anja, Dina, Nezharia, Asril, Wulan, Sipriyadi serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi dan bantuannya selama penelitian ini. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2012 Genap, teman-teman alumni Biologi FMIPA Universitas Riau di Bogor serta seluruh pihak yang telah memberikan doa dan dukungannya.
Ucapan terima kasih tak terhingga penulis ucapkan kepada Bapak, Ibu, Adikku tercinta Guntur Dwiki IW, dan Adie Setya K. serta keluarga besar tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
Aktinobakteri Endofit 3
Centella asiatica (L.) Urban (Pegagan) 6
Analisis Metagenomik 7
DGGE (Denaturing Gradient Gel Electrophoresis) 8
Diabetes Melitus 8
Inhibitor α-glukosidase (IAG) 9
METODE 11
Kerangka Penelitian 11
Waktu dan Tempat Penelitian 11
Pengambilan dan Sterilisasi Sampel 12
Ekstraksi DNA Total Jaringan Tanaman C.asiatica dan Tanah Rhizosfer 12 Amplifikasi Gen 16S rRNA Aktinobakteri Tanah dan Endofit 13
Amplifikasi Gen Penyandi Inhibitor α-glukosidase 14
Analisis DGGE 14
Sekuensing, Analisis Bioinformatika, dan Konstruksi Pohon Filogenetik 15
HASIL DAN PEMBAHASAN 16
Hasil 16
Pembahasan 26
SIMPULAN DAN SARAN 31
Simpulan 31
Saran 31
DAFTAR PUSTAKA 32
LAMPIRAN 41
DAFTAR TABEL
1 Aktinobakteri endofit tanaman obat 4
2 Daftar sekuen primer yang digunakan dalam penelitian 14 3 Nilai indeks alpha diversity (Shannon-Wiener) aktinobakteri tanah
rizosfer dan endofit C. asiatica 18
4 Nilai indeks beta diversity (Dice similarity coefficient) aktinobakteri
tanah rizosfer dan endofit C. asiatica 18
5 Homologi sekuen gen 16S rRNA aktinobakteri tanah rizosfer dan
endofit C. asiatica 19
6 Single Nucleotide Polymorphism pada 13 pita yang mengelompokkan
keseluruhan sekuen pita kedalam 3 famili 22
7 Homologi sekuen 9 pita DGGE dari analisis gen 16S rRNA aktinobakteri tanah rizosfer dan endofit C. asiatica 24 8 Single Nucleotide Polymorphism pada 5 pita dengan strain pembanding
Actinoplanes sp. SE50/110 25
9 Single Nucleotide Polymorphism pada 4 pita dengan strain pembanding S. hygroscopicus subsp. jinnggangensis 5008 26
DAFTAR GAMBAR
1 Tanaman Centella asiatica (L.) Urban (pegagan) 7
2 Struktur inhibitor α-glukosidase 9
3 Tahapan kerja penelitian 11
4 Elektroforegram hasil PCR gen 16S rRNA aktinobakteri 17 5 Profil pita DGGE gen 16S rRNA aktinobakteri hasil nested-PCR (~180
pb), pita DGGE dari program Phoretix ID, re-PCR 16 pita hasil DGGE 17 6 Kluster kemiripan komunitas aktinobakteri di tanah rizosfer dan
endofit Centella asiatica 19
7 Pohon filogenetik 16 sekuen pita berdasarkan gen 16S rRNA
aktinobakteri hasil analisis DGGE 20
8 Kelimpahan komunitas aktinobakteri 23
9 Elektroforegram hasil PCR gen inhibitor α-glukosidase 24 10 Ordinal sekuen basa 5 pita DGGE yang mirip dengan Actinoplanes
sp. SE50/110 25
11 Ordinal sekuen basa 4 pita DGGE yang mirip dengan S.
DAFTAR LAMPIRAN
1 Bagian organ dan tanah disekitar perakaran tanaman Centella
asiatica 41
2 Pengeditan sekuen gen 16S rRNA dengan software MEGA 5.00 41 3 Urutan sekuen nukleotida 16 pita DGGE hasil editing 43 4 Uji kontrol negatif air bilasan terakhir proses sterilisasi jaringan
tanaman Centella asiatica pada media HV 45 5 Konsentrasi dan kemurnian ekstrak DNA genom total 45 6 Intensitas pita (volume) menggunakan software Phoretix 1D 46 7 Single Nucleotide Polymorphism pada 13 pita yang mengelompokkan
keseluruhan sekuen pita kedalam 3 famili 46
8 Single Nucleotide Polymorphism pada 5 pita dengan strain
pembanding Actinoplanes sp. SE50/110 47
1
PENDAHULUAN
Latar Belakang
Centella asiatica (L.) Urban (pegagan) merupakan tanaman herba berkhasiat obat yang secara empiris telah diketahui mampu untuk mengobati berbagai penyakit termasuk diabetes (Rahman et al. 2012). Ekstrak tanaman C. asiatica mengandung sejumlah senyawa bioaktif termasuk brahmosida, brahminosida, kuersetin (Abdelmoaty et al. 2010), β-sitosterol (Karan et al. 2012) dan kaempferol (de Sousa et al. 2004) yang telah terbukti berkhasiat sebagai antidiabetes melalui penurunan kadar glukosa darah. Senyawa bioaktif dalam C. asiatica dapat memperbaiki kerusakan dari sel β-pankreas dan meningkatkan sintesis insulin, sehingga dapat menurunkan kadar glukosa darah (Rahman et al. 2011). Penelitian lain terhadap ekstrak air, etanol, dan metanol daun C. asiatica menunjukkan adanya aktivitas antidiabetes yang signifikan pada hewan uji (George et al. 2008; Gayathri et al. 2011; Haque et al. 2013). Hasil determinasi terhadap fraksi antihiperglikemik aktif menunjukkan bahwa ekstrak positif mengandung terpenoids, coumarins dan saponins (Gayathri et al. 2011). Penurunan kadar glukosa darah dapat dilakukan dengan memperlambat penyerapan glukosa melalui penghambatan pemecahan karbohidrat oleh α
-glukosidase dan α-amilase di saluran pencernaan. Inhibitor α-glukosidase seperti acarbose, miglitol dan voglibose sering digunakan dalam terapi pengobatan DM tipe 2 (Hanefeld et al. 2008).
Fungsi biologis C. asiatica sebagai agen antidiabetes diduga terkait dengan keberadaan dan keragaman mikroba endofit dalam jaringan tanaman tersebut. Mikrob endofit pada tanaman mampu menghasilkan senyawa bioaktif atau metabolit sekunder yang sama dengan tanaman inangnya. Kemampuan ini diduga sebagai akibat adanya transfer genetik dalam kurun waktu evolusi dari tanaman inang ke mikrob endofit (Tan dan Zou 2001). Mikrob endofit seperti aktinobakteri endofit C. asiatica belum banyak dikaji. Aktinobakteri endofit memiliki potensi sebagai sumber beragam senyawa bioaktif termasuk antidiabetes. Potensi senyawa aktif potensial berbasis mikrob dapat dilakukan dengan lebih cepat dan efisien dalam menjamin ketersediaan bahan baku. Hal ini dapat mengurangi eksploitasi tanaman obat untuk diambil sebagai simplisia dan bahan baku produksi senyawa bioaktif.
Aktinobakteri endofit Tinospora crispa (L.) Miers yang diidentifikasi sebagai Streptomyces sp. BWA 65 dilaporkan memiliki gen penyandi enzim
inhibitor α-glukosidase dan berpotensi sebagai antihiperglikemik (Pujiyanto et al. 2012). Streptomyces sp. endofit Leucas ciliata dan Rauwolfia densiflora
2
Biodiversitas mikrob di alam sangatlah besar, namun diduga sekitar 99% masih belum dapat dikulturkan, sehingga belum cukup data mengenai keragaman, serta potensi yang sebenarnya (Zeyaullah et al. 2009). Metode identifikasi melalui pendekatan isolasi dan pengkulturan mikrob (culture-dependent) yang banyak digunakan ternyata hanya dapat menganalisis sebagian kecil dari total mikrob yang ada. Terlebih beberapa genus aktinobakteri yang tumbuh lambat juga sulit untuk dikulturkan (Nimnoi et al. 2010), sehingga optimalisasi pemanfaatan aktinobakteri endofit membutuhkan teknologi yang bisa mengeksplorasi sejumlah besar aktinobakteri endofit yang belum dapat dikulturkan (unculturable).
Analisis keragaman komunitas aktinobakteri menggunakan pendekatan metagenomik (culture-independent) merupakan langkah yang relatif baru dalam mempelajari komunitas mikrob berdasarkan analisis DNA yang diambil secara langsung dari lingkungan (tanpa melalui tahap pengkulturan) (Jia et al. 2013). Aplikasi teknik PCR-DGGE (Denaturing Gradient Gel Electrophoresis) untuk menelaah keragaman aktinobakteri di alam telah banyak digunakan. Pada teknik ini setiap pita DNA yang muncul mewakili satu jenis spesies aktinobakteri yang berbeda (Shimano et al. 2012), sehingga dapat diperoleh gambaran keberadaan komunitas aktinobakteri endofit, serta kemungkinan untuk mendapatkan spesies aktinobakteri endofit baru. Dengan mengetahui keragaman aktinobakteri endofit C. asiatica, maka potensinya dalam menghasilkan senyawa antidiabetes melalui produksi inhibitor α-glukosidase dapat dikaji dan dikembangkan lebih lanjut.
Perumusan Masalah
Tanaman C. asiatica telah diketahui mengandung sejumlah senyawa bioaktif yang terbukti memiliki khasiat sebagai antidiabetes. Analisis keragaman genetik aktinobakteri endofit C. asiatica menjadi penting, untuk mengeksplorasi aktinobakteri endofit yang dapat menghasilkan metabolit sekunder yang sama tanaman inangnya. Namun, hanya 0.1–10% dari semua mikrob di alam yang dapat dikulturkan (culturable), sedangkan 90–99% lainnya termasuk aktinobakteri belum dapat dikulturkan (unculturable) sehingga informasi genom masih banyak yang belum terungkapkan. Hingga saat ini data mengenai keragaman aktinobakteri endofit secara keseluruhan dan aktinobakteri endofit penghasil inhibitor α-glukosidase pada tanaman C. asiatica belum dilaporkan.
Tujuan Penelitian
3 Manfaat Penelitian
Luaran yang diharapkan dari penelitian ini adalah memperoleh data mengenai keragaman aktinobakteri endofit secara keseluruhan dan penghasil inhibitor α-glukosidase pada tanaman C. asiatica, serta kemungkinan mendapatkan spesies aktinobakteri endofit baru. Informasi keragaman aktinobakteri endofit yang diperoleh secara metagenomik tersebut dapat dimanfaatkan potensinya untuk mendukung pengembangan produk obat antidiabetes secara mikrobiologis, serta sumber agen bioaktif berekonomis tinggi yang dapat digunakan secara luas dalam bidang kesehatan.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi pengambilan dan sterilisasi permukaan sampel, isolasi DNA genom dari tanah rizosfer dan jaringan tanaman C. asiatica, amplifikasi gen 16S rRNA dan gen inhibitor α-glukosidase menggunakan primer spesifik, analisis keragaman dengan menggunakan teknik PCR-DGGE, kemudian sekuensing dan konstruksi pohon filogenetik.
TINJAUAN PUSTAKA
Aktinobakteri Endofit
Mikrob endofit merupakan mikrob yang hidup dalam jaringan tanaman selama periode tertentu dari siklus hidupnya dan tanpa menimbulkan bahaya terhadap inangnya (Tan dan Zou 2001). Mikrob endofit masuk ke dalam jaringan tumbuhan dapat melalui bagian akar lateral, bagian tanaman yang terluka dan terbuka seperti bunga, batang, daun, kotiledon dan stomata, yang kemudian menyebar ke dalam ruang interseluler dan berkas pembuluh (Susilowati et al. 2010). Mikrob endofit yang terdapat pada beberapa tanaman tingkat tinggi mampu menghasilkan senyawa bioaktif atau metabolit sekunder yang sama dengan tanaman inangnya. Kemampuan tersebut diduga sebagai akibat adanya pertukaran genetik (genetic recombination) antara tanaman inang dan mikrob endofit secara evolusioner (Tan dan Zou 2001). Beberapa senyawa bioaktif yang mampu dihasilkan oleh bakteri endofit diantaranya berfungsi sebagai antitumor, antiinflamatori, antioksidan, antibiotik, antivirus, antikanker, bioinsektisida, imunosupresif, antidiabetik dan lain-lain (Strobel dan Daisy 2003). Tabel 1 menunjukkan beberapa hasil penelitian mengenai jenis-jenis aktinobakteri endofit tanaman obat dan senyawa bioaktif yang dihasilkannya.
4
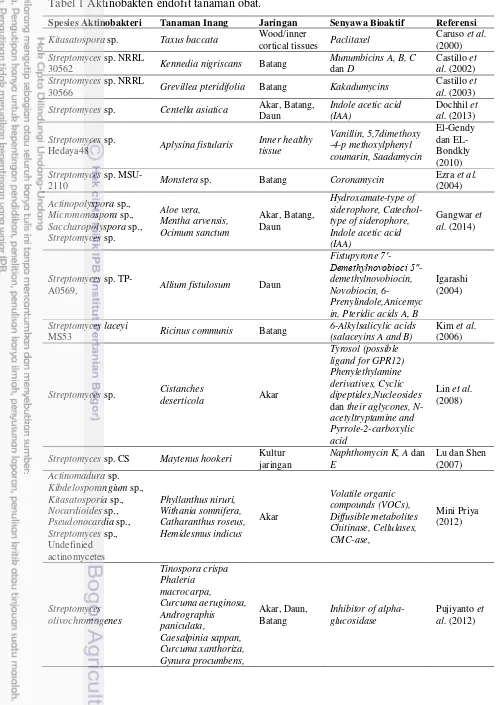
Tabel 1 Aktinobakteri endofit tanaman obat.
Spesies Aktinobakteri Tanaman Inang Jaringan Senyawa Bioaktif Referensi
Kitasatospora sp. Taxus baccata Wood/inner
cortical tissues Paclitaxel
Caruso et al.
(2000)
Streptomyces sp. NRRL
30562 Kennedia nigriscans Batang
Munumbicins A, B, C
dan D
Castillo et al. (2002)
Streptomyces sp. NRRL
30566 Grevillea pteridifolia Batang Kakadumycins
Castillo et al. (2003)
Streptomyces sp. Centella asiatica Akar, Batang, Daun
Hedaya48 Aplysina fistularis
Inner healthy
2110 Monstera sp. Batang Coronamycin
Ezra et al. (salaceyins A and B)
Kim et al.
(2006)
Streptomyces sp. Cistanches
deserticola Akar
dan their aglycones, N-acetyltryptamine and Pyrrole-2-carboxylic acid
Lin et al.
(2008)
Streptomyces sp. CS Maytenus hookeri Kultur jaringan
Phyllanthus niruri,
Withania somnifera,
Catharanthus roseus,
Hemidesmus indicus
Akar
Tinospora crispa
Phaleria macrocarpa,
Curcuma aeruginosa,
Andrographis paniculata,
Caesalpinia sappan, Curcuma xanthoriza, Gynura procumbens,
5 Physalis peruviana,
Hibiscus sabdariffa
Streptomyces aureofaciens
CMUAc130
Zingiber officinale Akar
5,7- dimethox
y-4-p-Streptomyces sp. Tc022
Alpinia galanga
Akar
Actinomycin D Taechowisan et al. (2006)
Jishengella endophytica
161111 Xylocarpus granatum
Akar
Aktinobakteri merupakan salah satu mikrob endofit yang digolongkan ke dalam bakteri Gram positif dengan kandungan guanin-sitosin (G+C) tinggi (75%) di dalam genomnya. Aktinobakteri adalah bakteri yang mirip cendawan, memiliki miselia, tetapi hifanya jauh lebih kecil, berukuran panjang 10-25 µm dan diameter 0.5-1 µm (Madigan et al. 2006). Aktinobakteri dengan hifa tumbuh cepat dan membentuk miselium aerial, tergolong Streptomyces. Streptomyces merupakan genus paling banyak (77%) dari kelompok streptomiset. Sedangkan aktinobakteri yang tidak membentuk miselium aerial tergolong non-streptomiset (rare actinomycetes), seperti genus Actinomadura, Actinoplanes, Mycobacterium, Nocardia, Saccharopolyspora, Microbispora, dan Micromonospora. Karakteristik umum lainnya adalah adanya bau musty, yaitu bau seperti tanah yang baru dibajak yang dihasilkan oleh metabolit geosmin (Madigan et al. 2006). Aktinobakteri saat ini banyak dikembangkan dalam bidang kesehatan. Hal tersebut karena aktinobakteri dikenal memiliki kemampuan menghasilkan metabolit sekunder seperti antibiotik, antitumor, antidiabetik, antivirus, antifungi dan lain-lain (Strobel dan Daisy 2003). Selain itu, bakteri ini juga dikenal sebagai bakteri penghasil antibiotik terbesar, dari 10000 antibiotik yang telah ditemukan lebih dari setengahnya dihasilkan oleh aktinobakteri. Hasil penelitian Lestari (2006), aktinobakteri yang diisolasi dari tanah menghasilkan senyawa antibakteri yang mampu menghambat pertumbuhan bakteri patogen seperti Bacillus subtilis dan Xanthomonas axonopodis.
Terkait dengan potensi aktinobakteri dalam produksi senyawa antidiabetes, hasil penelitian Zhang et al. (2003) telah ditemukan Actinoplanes sp.
6
mengisolasi aktinobakteri endofit yaitu Streptomyces sp. BWA 65 dari tanaman T. crispa yang memiliki gen penyandi enzim inhibitor α-glukosidase dan berpotensi sebagai antihiperglikemik. Streptomyces glaucescens juga diketahui menghasilkan
senyawa metabolit sekunder mirip dengan acarbose berfungsi sebagai inhibitor α -glukosidase yang dapat menurunkan kadar gukosa darah (Rockser dan Wehemeier 2008). Beberapa aktinobakteri lainnya yang dapat menghasilkan inhibitor α -glukosidase yaitu Micromonospora sp. VITSDK3 (EU55138) (Suthindiran et al. 2009) dan Actinoplanes sp. A56 (Wei et al. 2010). Ekstrak Streptomyces longisporoflavus (JX965948) endofit batang Leucas ciliata menunjukkan aktivitas antidiabetes dengan menghambat aktivitas enzim α-amilase, sedangkan Streptomyces sp. (JQ926174) endofit Rauwolfia densiflora menunjukkan aktivitas antidiabetes dengan meningkatkan kemampuan insulin untuk memindahkan glukosa ke hemidiafragma (Akshatha et al. 2013).
Centella asiatica (L) Urban (Pegagan)
C. asiatica (pegagan) merupakan tanaman herba tahunan yang tumbuh di daerah tropis pada dataran rendah sampai daerah dengan ketinggian 2.500 m dpl. Tanaman ini diklasifikasikan ke dalam ordo Monocotyledonae, famili Umbelliferae, genus Centella. Tinggi tanaman berkisar antara 5.39–13.3 cm, dengan batang yang pendek, berbentuk roset dan stolon yang menjalar hingga 1 meter. Pada tiap ruas stolon tumbuh akar dan daun yang berbentuk bulat seperti ginjal, dengan tepian bergerigi dan panjang tangkai daun sekitar 5–15 cm. Jumlah daun berkisar antara 5–8 helai untuk tanaman induk dan 2–5 helai daun pada anakannya. C. asiatica memiliki nama lokal yaitu daun kaki kuda (Melayu, Sumatera), kerok batok, pegagan (Jawa), kos tekosan (Madura), antanan rambat (Sunda), sedangkan nama asingnya adalah takip kohol (Filipina), paardevoet (Belanda) dan ji xue cao (Cina) (Kristina et al. 2009) (Gambar 1).
7
Gambar 1 Tanaman Centella asiatica (L.) Urban (pegagan)
Terkait dengan terapi penyakit diabetes C. asiatica telah terbukti memberi efek positif terhadap penurunan kadar glukosa darah dan secara ilmiah menghasilkan senyawa antidiabetes. Ekstrak tanaman C. asiatica diketahui mengandung sejumlah senyawa bioaktif termasuk brahmosida, brahminosida, kuersetin (Abdelmoaty et al. 2010), β-sitosterol (Karan et al. 2012) dan kaempferol (de Sousa et al. 2004) yang memiliki efek hipoglikemik dan berkhasiat sebagai antidiabetes melalui mekanisme penghambatan terhadap kerja
α-glukosidase. Pemberian ekstrak metanol daun C. asiatica secara oral menunjukkan pengurangan secara signifikan dalam kadar glukosa darah pada hewan uji (Haque et al. 2013). Penelitian lain oleh Gayathri et al. (2011) terhadap ekstrak etanol C. asiatica dengan dosis 200 mg/kg menunjukkan adanya aktivitas antidiabetes yang signifikan pada hewan uji dan hasil determinasi terhadap fraksi antihiperglikemik aktif menunjukkan bahwa ekstrak positif mengandung terpenoids, coumarins dan saponins. Berdasarkan uji toksisitas akut maupun subkronik pada hewan uji, ekstrak tanaman ini cukup aman untuk dikomsumsi.
Analisis Metagenomik
Biodiversitas mikrob di alam sangatlah besar, namun sekitar 99% masih belum dapat dikulturkan di laboratorium, sehingga belum cukup data mengenai keragaman, serta potensi yang sebenarnya (Zeyaullah et al. 2009). Metode konvensional dengan teknik pengkulturan yang sangat tergantung dari media dan kondisi kultur. Media buatan dan kondisi kultur tertentu hanya menguntungkan bagi sebagian jenis mikrob, sehingga hanya sebagian kecil dari jumlah mikrob saja yang mampu dikulturkan dilaboratorium dan dapat dianalisis (Furrie 2006).
8
bioaktif yang baru seperti enzim, karena kita dapat mengeksplorasi genom mikroba secara langsung dari lingkungan habitatnya (Jia et al. 2013). Teknik metagenomik telah digunakan oleh Wirajana et al. (2013), untuk mengeksplorasi informasi genom selulase yang dapat dimanfaatkan untuk mendegradasi biomassa menjadi produk berekonomis tinggi dalam bidang industri dari tanah hutan mangrove pantai Suwung, Bali.
DGGE (Denaturing Gradient Gel Electrophoresis)
Beberapa teknik berbasis molekuler yang dapat digunakan dalam menganalisis keanekaragaman mikrob secara metagenomik adalah Denaturing Gradient Gel Electrophoresis (DGGE), Fluorescent in-situ Hybridization (FISH), Terminal Restriction Fragment Length Polymorphism (TRFLP) dan Amplified Ribosomal DNA Restriction Analysis (ARDRA) (Marsh et al. 2000). Aplikasi teknik DGGE untuk menelaah keragaman aktinobakteri di alam telah banyak digunakan. Mahyarudin (2014), telah berhasil mendeteksi komunitas aktinobakteri pada tanah rizosfer dan akar tanaman padi asal Indonesia menggunakan DGGE.
Prinsip DGGE adalah elektroforesis dengan penggunaan gel denaturan bergradien, yang bertujuan untuk memisahkan DNA berdasarkan Tm (melting temperature) dan komposisi GC dari DNA suatu mikroba. Kelebihan lain dari teknik ini adalah dalam hal kesederhanaan dan kepraktisan, serta kemampuan dalam memisahkan fragmen DNA yang berukuran sama tetapi komposisi basa nitrogennya berbeda. Pada teknik ini perbedaan satu pasang basa nukleotida pada sekuen DNA, akan muncul sebagai pita pada posisi yang berbeda di dalam gel akrilamid (Muyzer dan Smalla 1998). Pemisahan tersebut didasarkan pada pengurangan mobilitas elektroforesis dari molekul DNA yang terdenaturasi secara parsial dalam gel poliakrilamid bergradien (Muyzer et al. 2004). Dengan menggunakan DGGE, sebanyak 50% dari variasi sekuen dapat dideteksi dalam fragmen DNA hingga 500 pb. Persentase ini dapat ditingkatkan menjadi hampir 100% dengan penambahan GC-clamps pada ujung 5’ primer forward (Muyzer dan Smalla 1998). Sekuen GC-clamps menyebabkan salah satu ujung untai DNA memiliki melting domain yang tinggi. Hal ini dapat mencegah DNA beruntai ganda terdenaturasi sepenuhnya menjadi DNA tunggal, sehingga untai DNA akan berbentuk seperti huruf Y pada gel poliakrilamid (Muyzer et al. 2004). Profil DGGE menunjukkan spesies yang dominan dan intensitas dari masing-masing pita menunjukkan kelimpahan relatif (Nimnoi et al. 2010).
Diabetes Melitus
9 9.1 juta dan diprediksi akan naik menjadi 14.1 juta pada tahun 2035. Penyakit DM
terbagi atas DM tipe 1 yang disebabkan kerusakan sel β-pankreas dan DM tipe 2 yang disebabkan oleh resistensi insulin (CDA 2008). Lebih dari 95% penderita diabetes merupakan penderita DM tipe 2 yang umumnya disertai dengan obesitas, hipertensi, dislipidemia, hiperinsulinemia dan disfungsi endotel. Strategi dasar dalam pengendalian DM tipe 2 adalah pemeliharaan kadar glukosa darah dalam kondisi normal.
Pemberian obat perlu dilakukan segera pada pasien dengan kadar glukosa darah melebihi kondisi normal (>80-120 mg/dl) (Pujiyanto dan Ferniah 2010), dengan tujuan mencegah DM berkembang menjadi komplikasi yang lebih parah. Meskipun penyakit ini bersifat degeneratif yang tidak dapat disembuhkan secara total, namun DM dapat dikendalikan. Pengobatan DM dapat dilakukan secara oral menggunakan obat antihiperglikemik atau antidiabetes. Golongan obat antidiabetes oral yang banyak digunakan adalah; sulfonylurea, biguanida (metformin), thiazolidinediones, miglitinida, inhibitor α-amilase dan inhibitor α -glukosidase (Rajalakshmi et al. 2009).
Inhibitor α-Glukosidase (IAG)
Enzim α-glukosidase merupakan enzim kunci yang berperan pada metabolisme akhir pemecahan karbohidrat. Enzim ini menghidrolisis secara sempurna laktosa, maltosa dan sukrosa menjadi unit monosakarida yang mampu di absorpsi dalam darah (Nashiru et al. 2001). Aktivitas enzim α-glukosidase
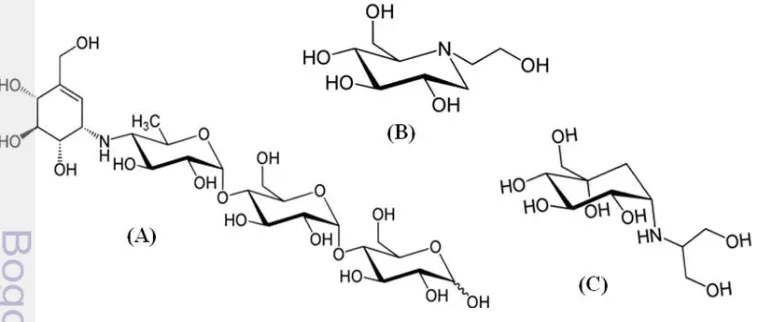
dapat dihambat oleh senyawa yang disebut inhibitor α-glukosidase (IAG). IAG telah secara luas digunakan dalam terapi pengobatan penyakit DM tipe 2 dan terbukti dapat mengurangi angka kematian yang disebabkan oleh penyakit tersebut. Obat golongan ini sangat efektif dalam menurunkan kadar glukosa darah dan secara kompetitif dapat menghambat pembentukan glukosa di usus halus sehingga absorpsi glukosa tertunda. Obat yang termasuk golongan IAG adalah acarbose, miglitol dan voglibose ((Scott dan Spencer 2000; Hyun et al. 2005; CDA 2008; Moritoh et al. 2009) (Gambar 2).
10
Beberapa ekstrak tanaman juga diketahui memiliki aktivitas inhibitor α -glukosidase antara lain: C. asiatica (senyawa bioaktif brahmosida, brahminosida, kuersetin) (Abdelmoaty et al. 2010), Tinospora Cordifolia (senyawa magnoflorine) (Patela dan Mishrab 2012), Callistephus chinensis (senyawa apigenin) (Zhang et al. 2013), Dioscorea bulbifera (senyawa diosgenin) (Ghosh et al. 2014). Selain tanaman, organisme lain seperti cendawan Aspergillus oryzae N159-1 (Kang et al. 2013), serta beberapa aktinobakteri seperti Actinoplanes sp. SE50/110 (Gown 2006), Micromonospora sp. (Suthindhiran et al. 2009).
Acarbose merupakan senyawa IAG yang telah sukses dikomersialkan dengan nama dagang Glucobay (di Eropa) dan Precose (di AS dan Kanada) oleh perusahaan Bayer, Jerman pada tahun 2004. Senyawa ini dihasilkan oleh aktinobakteri Actinoplanes sp. SE 50/110, yang diisolasi dari danau Ruiru di Kenya (Gown 2006). Sedoheptulosa 7-fosfat siklase (acbC) adalah enzim yang mengkatalisis siklisasi sedoheptulosa 7 fosfat menjadi 2-epi-5-epi-valiolone dalam biosintesis prekusor acarbose dan validamycin yaitu berupa C7N-aminocyclitol valienamine (Hyun et al. 2005). Hyun et al. (2005) telah berhasil mendesain primer untuk gen acbC (primer VOG-F dan VOG-R). Namun, amplifikasi gen acbC menggunakan primer tersebut terhadap isolat Streptomyces sp. BWA 65 tidak berhasil dilakukan (Pujiyanto 2012; Velina 2012). Velina (2012), kemudian mendesain ulang primer dari susunan nukleotida acbC di Actinoplanes sp. SE 50/110 dan amplifikasi terhadap isolat Streptomyces sp. BWA 65 berhasil dilakukan (Pujiyanto 2012; Velina 2012). Sigh et al. (2006), juga telah mendesain primer dari susunan nukleotida 2-epi-5-epi-valiolone sintase (gen vldA) di S. hygroscopicus var. limoneus KCCM 11405 (IFO12704). Hasil kloning gen vldA terhadap S. Lividans TK-23/ pJWS3001 menunjukkan adanya aktivitas inhibitor
11
METODE
Kerangka Penelitian
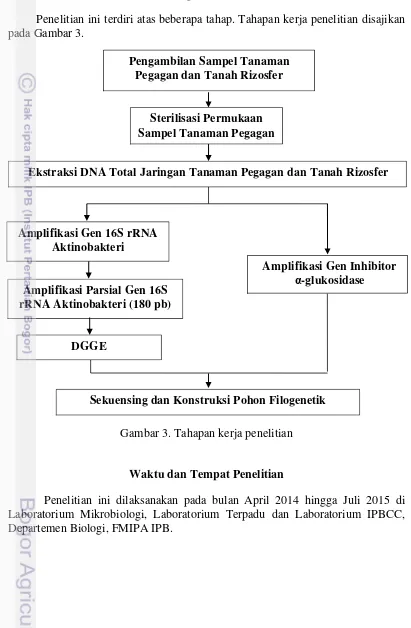
Penelitian ini terdiri atas beberapa tahap. Tahapan kerja penelitian disajikan pada Gambar 3.
Gambar 3. Tahapan kerja penelitian
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April 2014 hingga Juli 2015 di Laboratorium Mikrobiologi, Laboratorium Terpadu dan Laboratorium IPBCC, Departemen Biologi, FMIPA IPB.
Sterilisasi Permukaan Sampel Tanaman Pegagan
Ekstraksi DNA Total Jaringan Tanaman Pegagan dan Tanah Rizosfer
Amplifikasi Gen 16S rRNA Aktinobakteri
Amplifikasi Gen Inhibitor
α-glukosidase
DGGE
Sekuensing dan Konstruksi Pohon Filogenetik Pengambilan Sampel Tanaman
Pegagan dan Tanah Rizosfer
12
Pengambilan dan Sterilisasi Sampel
Sampel tanaman C. asiatica berasal dari area persawahan Desa Situ Gede, Bogor, Jawa Barat. Sampel diambil dari tanah rizosfer serta bagian tanaman seperti akar, stolon, dan daun (Lampiran 1). Proses sterilisasi permukaan sampel mengacu pada Coombs dan Franco (2003), dengan modifikasi (Sari 2011). Bagian tanaman yang telah dipotong direndam dalam alkohol 70% selama 1 menit, kemudian direndam dalam natrium hipoklorit (NaOCl) 1% selama 5 menit, selanjutnya direndam kembali dalam alkohol 70% selama 1 menit. Langkah terakhir potongan tanaman dibilas menggunakan akuades steril sebanyak 3 kali. Sebanyak 0.1 mL air bilasan terakhir disebar pada media HV (Humic Acid - Vitamin B Agar) sebagai uji kontrol negatif untuk membuktikan keberhasilan sterilisasi permukaan sampel.
Ekstraksi DNA Total Jaringan Tanaman Centella asiatica dan Tanah Rizosfer
Ekstraksi DNA dari sampel tanah dilakukan sesuai dengan protokol Power Soil® DNA Isolation Kit (Mobio Laboratories, Carlsbad, CA, USA) dengan
modifikasi. Sebanyak 0.25 g tanah dimasukkan ke dalam bead solution tubes 2 mL, kemudian divorteks selama 5-10 menit. Selanjutnya ditambahkan 60 µL Solution C1 dan divorteks dengan posisi horizontal pada kecepatan maksimum selama 10 menit. Bead solution tubes disentrifugasi pada kecepatan 13000 rpm (Sentrifuge Eppendorf Mini Spin dengan rotor F-45-12-11) selama 1 menit. Sebanyak 400-500 µL supernatan dipindahkan ke microtube 2 mL dan ditambahkan 250 µL Solution C2. Setelah itu, supernatan divorteks selama 1 menit dan diinkubasi pada suhu 4 oC selama 5 menit. Microtube disentrifugasi pada kecepatan 13000 rpm selama 1 menit, kemudian 600 µL supernatan dipindahkan ke collection tube 2 mL. Sebanyak 200 µL Solution C3 ditambahkan ke dalam collection tube dan divorteks selama 1 menit, setelah itu diinkubasi pada suhu 4 oC selama 5 menit. Collection tube disentrifugasi pada kecepatan 13000 rpm selama 1 menit, kemudian supernatan sebanyak 750 µL dipindahkan ke collection tube 2 mL yang baru. Selanjutnya ditambahkan 1200 µL Solution C4 dan divorteks selama 1 menit. Sebanyak 675 µL campuran dipindahkan ke spin filter dan disentrifugasi pada kecepatan 13000 rpm selama1 menit. Cairan yang terdapat pada collection tube dibuang dan sebanyak 675 µL dari sisa campuran ditambahkan lagi pada spin filter, kemudian disentrifugasi. Hal yang sama dilakukan hingga campuran habis. Setelah itu, ditambahkan 500 µL Solution C5 dan dan disentrifugasi pada kecepatan 13000 rpm selama 1 menit. Cairan yang terdapat pada collection tube dibuang dan disentrifugasi kembali pada kecepatan 13000 rpm selama 1 menit. Spin filter dipindahkan pada collection tube 2 mL yang baru dan ditambahkan 100 µL Solution C6 tepat dibagian membran filter yang berwarna putih, selanjutnya disentrifugasi pada kecepatan 13000 rpm selama 1 menit. Spin filter dikeluarkan dan hasil ekstraksi DNA disimpan pada suhu -20
oC hingga dilakukan analisis.
13 TPE, TW). Sebanyak 0.1 g dari setiap sampel jaringan tanaman yang sudah disterilisasi, digerus sampai halus dengan penambahan nitrogen cair. Sampel yang telah halus ditransfer ke dalam microtube 2 mL dan ditambahkan 400 µL bufer GP1 dan 5 µL RNAse A, kemudian divorteks selama 2 menit. Inkubasi pada suhu 60 °C selama 10 menit dan setiap 5 menit microtube di bolak-balik. Setalah itu ditambahkan 100 µL bufer GP2, divorteks dan inkubasi pada suhu dingin selama 5 menit. Filter column diletakkan pada collection tube 2 mL dan campuran dipindahkan ke filter column, sentrifugasi selama 90 detik pada 1300 rpm setelah itu filter column dibuang. Selanjutnya supernatan dipindahkan ke microtube 2 mL yang baru kemudian ditambahkan bufer GP3 (bufer GP3 + isopropanol (1:2)) sebanyak 1.5 x volume supernatan. Setelah itu campuran divorteks selama 30 detik. GD column diletakkan pada collection tube 2 mL, kemudian campuran sebanyak 700 µL dipindahkan ke GD column dan sentrifugasi pada 13000 rpm selama 3 menit. Cairan yang terdapat pada collection tube dibuang dan sisa campuran ditambahkan lagi pada GD column, disentrifugasi. Hal yang sama dilakukan hingga campuran habis. Setelah itu tambahkan 400 µL bufer W1 pada GD column dan sentrifugasi 13000 rpm selama 30 detik. Cairan yang terdapat pada collection tube dibuang dan ditambahkan 600 µL bufer pencuci (bufer pencuci + etanol absolut (1:4)) pada GD column kemudian sentrifugasi pada 13000 rpm selama 30 detik. Cairan yang terdapat pada collection tube dibuang dan disentrifugasi lagi selama 3 menit pada 13000 rpm untuk mengeringkan matriks column. GD column dipindahkan pada microtube 2 mL yang baru dan ditambahkan 30 µL bufer elusi yang sebelumnya telah dipanaskan pada suhu 60 °C, kemudian dikering anginkan selama 20 menit. Selanjutnya disentrifugasi kembali pada 13000 rpm selama 30 detik untuk mengelusi dan purifikasi DNA. GD column dikeluarkan dan cairan di microtube digunakan untuk pengamatan dengan elektroforesis pada gel agarosa 1% (0.25 g agarosa + 25 mL bufer TAE 1×). Kuantifikasi konsentrasi dan kemurnian DNA dievaluasi menggunakan NanoDrop 2000 (Thermo Scientific, Wilmington, DE,USA).
Amplifikasi Gen 16S rRNA Aktinobakteri
Gen 16S rRNA aktinobakteri diamplifikasi secara 2 tahap menggunakan primer spesifik aktinobakteri. Tahap pertama menggunakan primer 27F dan 16Sact1114R (Martina et al. 2008) (Tabel 2). Reaksi PCR untuk 25 µL mengandung 12.5 µL GoTaq Green Master Mix 2× (Promega, Madison, WI, USA), 0.2 µL masing-masing primer, 5 µL template dan 7.1 µL nuclease free water (NFW). Proses PCR dilakukan secara touch down dengan kondisi sebagai berikut; pre-denaturasi (suhu 94 oC, 5 menit), denaturasi (suhu 94 oC, 1 menit), annealing (suhu 65 oC dan berkurang 0.5 oC hingga 20 siklus, 10 siklus berikutnya pada suhu 55 oC selama 45 detik), proses ekstensi (suhu 72 oC, 2
menit), ekstensi akhir (suhu 72 oC, 7 menit) dan pendinginan (suhu 4 oC, 30 menit). Proses PCR berlangsung sebanyak 30 siklus.
masing-14
masing primer, 1 µL template dan 23.5 µL nuclease free water (NFW). Proses PCR berlangsung sebanyak 30 siklus dengan kondisi; pre-denaturasi (suhu 94 oC, 5 menit), denaturasi (suhu 92 oC, 1 menit), annealing (suhu 60 oC, 25 detik), ekstensi (suhu 72 oC, 25 detik), ekstensi akhir (suhu 72 oC, 3 menit) dan pendinginan (suhu 4 oC, 30 menit). Visualisasi produk PCR dilakukan dengan elektroforesis pada gel agarosa 1% (0.25 g agarosa + 25 mL bufer TAE 1×). Tabel 2 Daftar sekuen primer yang digunakan dalam penelitian.
Primer Sekuen (5’- 3’) Referensi
27F AGAGTTTGATCCTGGCTCAG Martina et al. 2008 16Sact1114R GAGTTGACCCCGGCRGT Martina et al. 2008 P338F ACTCCTACGGGAGGCAGCAG Overeas et al. 1997 P518R ATTACCGCGGCTGCTGG Overeas et al. 1997
GC clamp CGCCCGCCGCGCGCGGCGGGC
GGGCGGGGGCACGGGGGG
Overeas et al. 1997 vldA-F CTTGAGAATTCTGGACGCCTTCG
GTGT
Sigh et al. 2006
vldA-R ATTAAGCTTGCGAGCACCGAGCT
GAGC
Sigh et al. 2006 *Keterangan: F, forward; R: reverse; GC-clamp, sekuen yang ditambahkan di
ujung 5’ primer P338F.
Amplifikasi Gen Penyandi Inhibitor α-glukosidase
Gen penyandi inhibitor α-glukosidase di amplifikasi dengan menggunakan primer vldA-F dan vldA-R (Sigh et al. 2006) (Tabel 2). Reaksi PCR untuk 1× reaksi (20 µL) mengandung 10 µL AmpiTaq Gold 360 Master Mix (Applied Biosystems), 0.5 µL masing-masing primer (10 pmol), 2 µL template dan 7.5 µ L ddH2O. Proses PCR dilakukan dengan kondisi; pre-denaturasi (suhu 95 oC, 5
menit), denaturasi pada (suhu 95 oC, 1 menit), annealing (suhu 55 oC, 1 menit), ekstensi (suhu 72 oC, 2 menit), ekstensi akhir (suhu 72 oC, 7 menit) dan pendinginan (suhu 4 oC, 10 menit) yang berlangsung sebanyak 35 siklus.
Visualisasi produk PCR dilakukan dengan elektroforesis pada gel agarosa 1%.
Analisis DGGE
15 dengan merendamnya pada 30 mL larutan SYBR Safe (Molecular probes, Invitrogen, Carlsbad, CA, USA) dalam 270 mL bufer TAE 1× selama 1 jam dalam keadaan gelap dan dibilas dalam bufer TAE 1× selama 15 menit. Selanjutnya dicek dengan gel documentation G:BOX (Syngene, Frederick, MD, USA). Hasil foto DGGE dianalisis menggunakan ID Phoretix software (Total Lab) untuk mengestimasi total pita yang muncul.
Pita DNA pada gel poliakrilamid dipotong menggunakan pisau scalpel steril dan dimasukkan ke dalam tabung mikro berisi 100 µL ddH2O. Kemudian
disimpan pada suhu 4 oC selama overnight dan suhu 60 oC selama 2 jam. Selanjutnya DNA tersebut di amplifikasi kembali menggunakan primer gen 16S rRNA (P338F dan P518R) tanpa GC-clamps. Kondisi dan reaksi PCR sama seperti standar protokol sebelumnya.
Analisis statistik profil DGGE dilakukan dengan menggunakan analisis alpha dan beta diversity. Keragaman dalam setiap sampel dianalisis menggunakan alpha diversity (Shannon-Wiener/He). Kesamaan pola pita antar sampel dianalisis menggunakan beta diversity (Dice similarity coefficient/SD). Proses analisis
dilakukan dengan menggunakan software PAST (Paleontological Statistics) (Hammer et al. 2001), berdasarkan analisis estimasi intensitas pita menggunakan software Phoretix 1D. Rumus penghitungan nilai indeks:
(Han et al. 2015) s : Total jumlah pita pada setiap sampel(lane)
Pi : Proporsi pita i dalam sampel Na : Jumlah pita sampel a
Nb : Jumlah pita sampel b
Nc : Jumlah pita yang sama pada sampel a dan b
Sekuensing, Analisis Bioinformatika, dan Konstruksi Pohon Filogenetik
16
HASIL DAN PEMBAHASAN
Hasil
Evaluasi Sterilisasi Permukaan dan Profil DNA Genom Total
Uji kontrol negatif terhadap air bilasan terakhir dari proses sterilisasi menunjukkan bahwa tidak ada aktinobakteri yang tumbuh pada media HV (Humic Acid - Vitamin B Agar) (Lampiran 4). Hasil ini membuktikan bahwa proses sterilisasi permukaan berhasil dilakukan dan menguatkan dugaan bahwa DNA aktinobakteri yang berhasil diekstraksi berasal dari aktinobakteri yang hidup di dalam jaringan tanaman (endofit). Hasil evaluasi kuantifikasi konsentrasi dan kemurnian dari ekstrak DNA tanah rizosfer dan jaringan tanaman C. asiatica dapat dilihat pada Lampiran 5. Konsentrasi DNA dari hasil NanoDrop pada sampel tanah rizosfer sebesar 16.4 ng/µL, sedangkan pada sampel jaringan tanaman berkisar 31.1-35.2 µg/µL. Konsentrasi DNA tertinggi diperoleh pada sampel daun sedangkan yang terendah diperoleh pada sampel stolon. Tingkat
kemurnian DNA diketahui dengan mengukur absorbansi sampel pada λ 260 nm dan λ 280 nm, kemudian menghitung besar rasio A260 terhadap A280. Rasio A260/A280 dari ekstrak DNA total keseluruhan sampel yang diperoleh berkisar 0.77-1.86 dengan rasio terendah ditunjukkan oleh sampel tanah.
Profil Gen 16S rRNA Aktinobakteri Tanah dan Endofit Centella asiatica
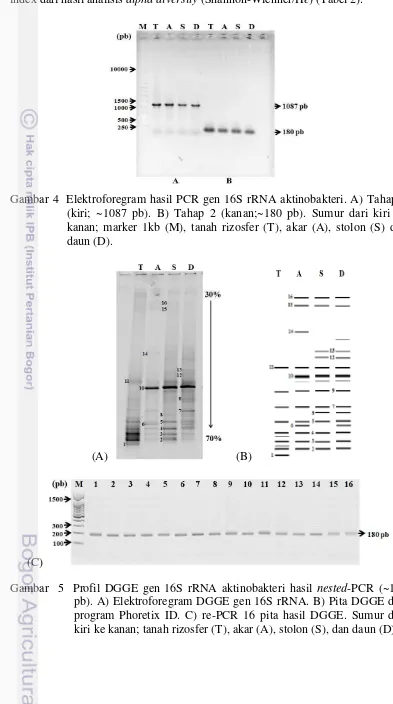
Analisis PCR gen 16S rRNA aktinobakteri dilakukan secara 2 tahap (nested-PCR) menggunakan 2 set primer spesifik untuk mendeteksi aktinobakteri. Produk PCR tahap pertama menggunakan primer 27F dan 16Sact1114R diperoleh ukuran target DNA ~1087 pb, hasil ini dijadikan cetakan DNA untuk proses PCR tahap kedua. Hasil tahap kedua menggunakan primer P338F-GC dan P518R diperoleh produk berukuran ~180 pb (Gambar 4).
Profil DGGE Gen 16S rRNA Aktinobakteri
17 bagian daun terdapat 16 pita, stolon 14 pita, akar 12 pita dan terendah terdapat pada tanah rizosfer yaitu 10 pita (Gambar 5B). Data ini juga didukung oleh nilai index dari hasil analisis alpha diversity (Shannon-Wienner/He) (Tabel 2).
Gambar 4 Elektroforegram hasil PCR gen 16S rRNA aktinobakteri. A) Tahap 1 (kiri; ~1087 pb). B) Tahap 2 (kanan;~180 pb). Sumur dari kiri ke kanan; marker 1kb (M), tanah rizosfer (T), akar (A), stolon (S) dan daun (D).
(A) (B)
(C)
18
Sebanyak 16 pita DNA yang dominan telah berhasil dipotong dari gel DGGE. Pita-pita tersebut dipurifikasi dan diamplifikasi menggunakan primer yang sama (P338F dan P518R) akan tetapi tanpa GC-clamps. Proses PCR ini menghasilkan produk berukuran ~180 pb (Gambar 5C). Hasil PCR tersebut kemudian disekuensing untuk mengetahui urutan basa nukleotida sehingga dapat dianalisis dan dibuat pohon filogenetiknya.
Analisis Diversitas Aktinobakteri Berdasarkan Gen 16S rRNA
Pada penelitian ini, analisis Shannon-Wiener (He) digunakan untuk memperkirakan keanekaragaman mikroba pada setiap sampel berdasarkan hasil analisis intensitas pita menggunakan software Phoretix 1D (Lampiran 6). Nilai indeks yang tinggi menunjukkan keragaman spesies (pita) yang tinggi dalam sampel. Meskipun, nilai indeks He tidak berbeda nyata (2.176-2.57) pada masing-masing sampel, tetapi keragaman aktinobakteri pada jaringan tanaman lebih tinggi dibandingkan dengan sampel tanah rizosfer. Nilai indeks He pada sampel daun, stolon dan akar secara berturut-turut adalah 2.57, 2.406, dan 2.261. Sementara, nilai indeks He tanah rizosfer adalah 2.176 (Tabel 3).
Tabel 3 Nilai indeks alpha diversity (Shannon-Wiener) aktinobakteri tanah rizosfer dan endofit Centella asiatica.
Nilai Indeks Tanah Rizosfer Jaringan Tanaman C. asiatica Akar Stolon Daun
Shannon He 2.176 2.261 2.406 2.57
Tabel 4 Nilai indeks beta diversity (Dice similarity coefficient) aktinobakteri tanah rizosfer dan endofit Centella asiatica.
Sampel Tanah Rizosfer Akar Stolon Daun Tanah Rizosfer
Akar 0.636
Stolon 0.583 0.846
Daun 0.538 0.786 0.933
Analisis beta diversity (Dice similarity coefficient/SD) digunakan untuk menjelaskan kemiripan komposisi spesies (pita) antar sampel. Nilai indeks SD yang mendekati 1 menunjukkan adanya kemiripan yang tinggi dari komposisi spesies (pita) antar sampel yang dibandingkan. Hasil untuk aktinobakteri endofit menunjukkan bahwa struktur komunitas antar sampel memiliki kemiripan yang relatif tinggi dengan nilai indeks SD yaitu, 0.786-0.933. Nilai indeks tertinggi ditemukan pada sampel daun dengan stolon (0.933). Sedangkan, struktur komunitas pada jaringan tanaman (daun, stolon, dan akar) dan tanah rizosfir memiliki kemiripan yang relatif rendah dengan nilai indeks SD 0.538-0.636 (Tabel 4). Data ini juga didukung oleh analisis kluster (Gambar 6).
19 pola sebaran pita DGGE menunjukkan bahwa aktinobakteri di tanah dan endofit memiliki kemiripan <75%. Hal tersebut mengindikasikan terdapatnya perbedaan pola komunitas antara endofit (jaringan tanaman) dengan non-endofit (tanah rizosfer). Pola komunitas aktinobakteri endofit pada daun memiliki kemiripan 95% dengan stolon dan keduanya berbeda 10% dengan akar (Gambar 6). Hasil ini juga dikonfirmasi oleh data analisis Dice similarity coefficient/SD (Tabel 4). Sampel akar berada pada kluster yang terpisah dari sampel daun dan stolon.
Gambar 6 Kluster kemiripan komunitas aktinobakteri di tanah rizosfer dan endofit Centella asiatica.
Pohon Filogenetik Berdasarkan Analisis Gen 16S rRNA
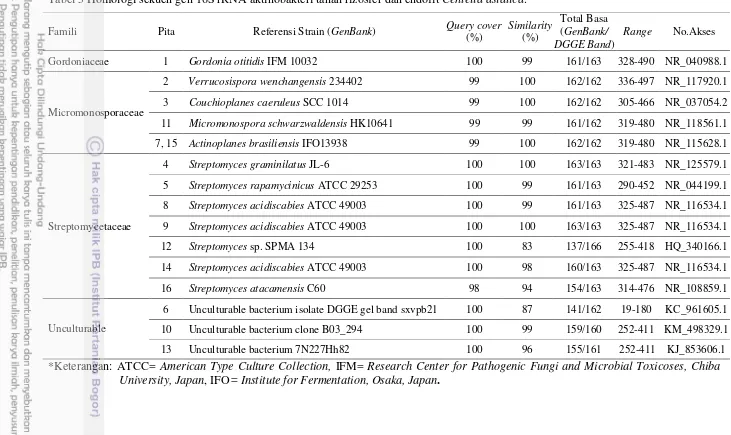
Hasil BLAST.N menunjukkan 16 pita memiliki hubungan kekerabatan dengan identitas maksimum berkisar 83-100% terhadap 3 famili dari aktinobakteri. Sebanyak 7 pita diketahui berkerabat dengan famili Streptomycetaceae, 5 pita adalah famili Micromonosporaceae dan 1 pita termasuk ke dalam famili Gordoniaceae. Tiga pita lainnya yaitu pita 6, 10, dan 13 masih dinyatakan sebagai unculturable (Tabel 5). Dari famili-famili tersebut diperoleh 6 genus, yaitu Streptomyces, Verrucosispora, Actinoplanes, Couchioplanes, Micromonospora, dan Gordonia. Streptomyces merupakan genus yang paling sering ditemukan pada hampir seluruh sampel baik tanah rizosfer maupun jaringan tanaman.
Famili Streptomycetaceae terdiri atas 5 spesies yaitu Streptomyces graminilatus JL-6, S. rapamycinicus ATCC 29253, S. acidiscabies ATCC 49003, S. atacamensis C60, dan Streptomyces sp. SPMA 134. Pada famili Micromonosporaceae terdapat 4 spesies dan genera yang diperoleh, diantaranya adalah Verrucosispora wenchangensis 234402, Couchioplanes caeruleus SCC 1014, Micromonospora schwarzwaldensis HKI0641, dan Actinoplanes brasiliensis IFO13938. Famili Gordoniaceae hanya ditemukan 1 spesies yaitu Gordonia otitidis IFM 10032. Tiga spesies yang masih dinyatakan sebagai Unculturable yaitu, Uncultured bacterium isolate DGGE gel band sxvpb21, Uncultured bacterium clone B03_294, dan Uncultured bacterium clone 7N227hH82 (Tabel 4).
18
Tabel 5 Homologi sekuen gen 16S rRNA aktinobakteri tanah rizosfer dan endofit Centella asiatica. Famili Pita Referensi Strain (GenBank) Query cover
(%)
Similarity (%)
Total Basa (GenBank/ DGGE Band)
Range No.Akses
Gordoniaceae 1 Gordonia otitidis IFM 10032 100 99 161/163 328-490 NR_040988.1
Micromonosporaceae
2 Verrucosispora wenchangensis 234402 99 100 162/162 336-497 NR_117920.1
3 Couchioplanes caeruleus SCC 1014 99 100 162/162 305-466 NR_037054.2
11 Micromonospora schwarzwaldensis HK10641 99 99 161/162 319-480 NR_118561.1
7, 15 Actinoplanes brasiliensis IFO13938 99 100 162/162 319-480 NR_115628.1
Streptomycetaceae
4 Streptomyces graminilatus JL-6 100 100 163/163 321-483 NR_125579.1
5 Streptomyces rapamycinicus ATCC 29253 100 99 161/163 290-452 NR_044199.1
8 Streptomyces acidiscabies ATCC 49003 100 99 161/163 325-487 NR_116534.1
9 Streptomyces acidiscabies ATCC 49003 100 100 163/163 325-487 NR_116534.1
12 Streptomyces sp. SPMA 134 100 83 137/166 255-418 HQ_340166.1
14 Streptomyces acidiscabies ATCC 49003 100 98 160/163 325-487 NR_116534.1
16 Streptomyces atacamensis C60 98 94 154/163 314-476 NR_108859.1
Unculturable
6 Unculturable bacterium isolate DGGE gel band sxvpb21 100 87 141/162 19-180 KC_961605.1
10 Unculturable bacterium clone B03_294 100 99 159/160 252-411 KM_498329.1
13 Unculturable bacterium 7N227Hh82 100 96 155/161 252-411 KJ_853606.1 *Keterangan: ATCC= American Type Culture Collection, IFM= Research Center for Pathogenic Fungi and Microbial Toxicoses, Chiba
University, Japan, IFO= Institute for Fermentation, Osaka, Japan.
19
Gambar 7 Pohon filogenetik 16 sekuen pita berdasarkan gen 16S rRNA aktinobakteri hasil analisis DGGE (metode Neighbour Joining, model Kimura 2-paramater (K2), nilai bootstrap 1000×).
22
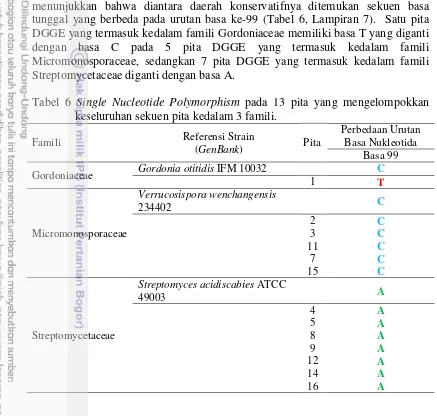
Analisis Single Nucleotide Polymorphism (SNP) Sekuen Basa dari 13 Pita DGGE yang Membagi Kedalam 3 Famili Aktinobakteri.
Tiga belas pita DGGE terbagi atas 3 kluster famili aktinobakteri yaitu Gordoniaceae, Micromonosporaceae dan Streptomycetaceae. Perbedaan kelompok famili dalam suatu komunitas mikrob dapat ditentukan oleh perbedaan sekuen basa nukleotidanya. Hasil analisis SNP dari 13 pita DGGE tersebut menunjukkan bahwa diantara daerah konservatifnya ditemukan sekuen basa tunggal yang berbeda pada urutan basa ke-99 (Tabel 6, Lampiran 7). Satu pita DGGE yang termasuk kedalam famili Gordoniaceae memiliki basa T yang diganti dengan basa C pada 5 pita DGGE yang termasuk kedalam famili Micromonosporaceae, sedangkan 7 pita DGGE yang termasuk kedalam famili Streptomycetaceae diganti dengan basa A.
Tabel 6 Single Nucleotide Polymorphism pada 13 pita yang mengelompokkan keseluruhan sekuen pita kedalam 3 famili.
Famili Referensi Strain
(GenBank) Pita
Perbedaan Urutan Basa Nukleotida
Basa 99
Gordoniaceae Gordonia otitidis IFM 10032 C
1 T
Kelimpahan Komunitas Aktinobakteri pada Tanah Rizozfer dan Endofit
Centella asiatica.
23 Uncultured bacterium isolate DGGE gel band sxvpb21 dan Uncultured bacterium clone B03_294 pada penelitian ini juga ditemukan hanya sebagai endofit yang tersebar pada bagian daun, stolon, dan akar C. asiatica. Tujuh spesies dari famili Micromonosporaceae dan Streptomycetaceae dapat ditemukan ditanah dan sebagai endofit pada penelitian ini (Gambar 8A dan 8B), diantaranya adalah C. caeruleus SCC 1014, M. schwarzwaldensis HKI0641, V. wenchangensis 234402T, A. brasiliensis IFO13938, S. graminilatus JL-6, S. acidiscabies ATCC 49003 dan S. rapamycinicus ATCC 29253.
(A) (B)
Gambar 8 Kelimpahan komunitas aktinobakteri. A) kelimpahan aktinobakteri tanah rizosfer (T) dan endofit Centella asiatica (E). B) Kelimpahan aktinobakteri endofit pada organ tanaman Centella asiatica. Stolon (S), akar (A), dan daun (D).
Profil Gen Penyandi Inhibitor α-Glukosidase.
Deteksi gen yang terlibat dalam biosintesis inhibitor α-glukosidase diamplifikasi menggunakan primer gen vldA (2-epi-5-epi-valiolone synthase) yang didesain oleh Sigh et al. (2006). Hampir semua sampel seperti tanah rizosfer, akar, dan daun C. asiatica serta isolat kontrol Streptomyces sp. BWA 65 memberikan hasil positif terhadap amplifikasi gen tersebut, kecuali stolon. Hal ini ditandai dengan adanya produk amplifikasi berukuran ~500 pb (Gambar 9).
Profil Pita DGGE Dibandingkan dengan Aktinobakteri yang Memiliki Gen
Penyandi Inhibitor α-Glukosidase Berdasarkan Analisis SNP.
Hasil BLAST.N dari analisis gen 16S rRNA ditemukan 5 pita DGGE (pita 2, 3, 7, 11, dan 15) yang memiliki kemiripan 98-99% dengan Actinoplanes sp. SE50/110 dan 4 pita DGGE (pita 4, 8, 9, dan 14) yang memiliki kemiripan 98-99% dengan S. hygroscopicus subsp. jinnggangensis 5008 (Tabel 7). Terkait dengan keberadaan gen yang terlibat dalam biosintesis inhibitor α-glukosidase (antidiabetes) Actinoplanes sp. SE50/110 diketahui memiliki gen acbC (sedoheptulosa-7-fosfat siklase) yang menyandikan senyawa acarbose (inhibitor
24
memiliki gen valA (2-epi-5-epi-valiolone synthase) yang homolog dengan gen vldA yang digunakan sebagai primer dalam penelitian ini.
Gambar 9 Elektroforegram hasil PCR gen inhibitor α-glukosidase. Sumur dari kiri ke kanan; marker 1kb, tanah rizosfer (T), akar (A), daun (D), Streptomyces sp. BWA 65 (Bw).
Tabel 7 Homologi sekuen 9 pita DGGE dari analisis gen 16S rRNA aktinobakteri tanah rizosfer dan endofit Centella asiatica.
Famili Pita Referensi Strain
25 Lima pita DGGE (pita 2, 3, 7, 11, dan 15) memiliki kemiripan dengan Actinoplanes sp. SE50/110 yang berada pada urutan basa 336-497 dari total 1505 pasang basa (Gambar 10). Analisis SNP pada lima pita DGGE terhadap Actinoplanes sp. SE50/110 mendeteksi adanya beberapa perbedaan basa pada urutan ke 30, 39, 105, 106, dan 137 (Tabel 8, Lampiran 8). Perbedaan basa tersebut dapat berpengaruh terhadap nilai persentase kemiripan strain pembandingnya. Pita 11 dengan perbedaan basa yang lebih banyak terlihat memiliki persentase kemiripan yang lebih rendah (98%) terhadap Actinoplanes sp. SE50/110 dibandingkan keempat pita lainnya (99%) (Tabel 7).
Gambar 10 Ordinal sekuen basa 5 pita DGGE yang mirip dengan Actinoplanes sp. SE50/110.
Tabel 8 Single Nucleotide Polymorphism pada 5 pita dengan strain pembanding Actinoplanes sp. SE50/110.
Keterangan Perbedaan Urutan Basa Nukleotida (Basa ke-)
30 39 105 106 137
Actinoplanes sp. SE50/110 G T C A C
Pita 2 G T T G C
Pita 3 G T T A C
Pita 11 A C T A C
Pita 7 G T C A T
Pita 15 G T C A T
26
Gambar 11 Ordinal sekuen basa 4 pita DGGE yang mirip dengan S. hygroscopicus subsp. jinnggangensis 5008.
Tabel 9 Single Nucleotide Polymorphism pada 5 pita dengan strain pembanding S. hygroscopicus subsp. jinnggangensis 5008.
Keterangan Perbedaan Urutan Basa Nukleotida (Basa ke-)
30 35 92 105 123 152
S. hygroscopicus A C C A G A
Pita 4 A C C C G A
Pita 8 G A T A G A
Pita 9 G C C A G A
Pita 14 G C C T T C
Pembahasan
Efektifitas Sterilisasi Permukaan dan Profil Ekstrak DNA Genom Total
Mikrob endofit dapat diisolasi dari jaringan tanaman yang telah disterilisasi permukaan. Sterilisasi ini bertujuan untuk menghilangkan mikrob epifit yang berada di permukaan tanaman (Coombs dan Franco 2003). Evaluasi sterilisasi permukaan dilakukan untuk memastikan bahwa DNA aktinobakteri yang terekstraksi berasal dari dalam jaringan tanaman. Uji kontrol negatif pada media HV telah menunjukkan bahwa protokol sterilisasi permukaan yang dilakukan efektif dalam menghilangkan semua mikrob epifit (Lampiran 4). Media HV mengandung antibiotik sikloheksamida yang dapat menekan pertumbuhan cendawan dan asam nalidiksat untuk menekan pertumbuhan bakteri Gram negatif. Sehingga media ini sangat efektif digunakan untuk mengkonfirmasi keberhasilan sterilisasi permukaan (Coombs dan Franco 2003). Selain itu, asam humat dalam media HV dapat digunakan oleh aktinobakteri sebagai sumber nutrisi untuk proses sporulasi (Seong et al. 2001).
27 tetapi hal tersebut tidak menjadi kendala dalam proses amplifikasi. Sampel tanah dengan kemurnian 0.77 dapat di amplifikasi dengan baik.
Komunitas Aktinobakteri Tanah Rizosfer dan Endofit Centella asiatica
Penerapan teknik biologi molekuler untuk mendeteksi dan mengidentifikasi mikroorganisme oleh penanda molekuler tertentu, seperti 16S rRNA atau gen pengkode lainnya, saat ini lebih sering digunakan untuk mengeksplorasi keragaman mikroba dan menganalisis struktur komunitas mikroba (Muyzer dan Smalla 1998). Gen 16S rRNA merupakan komponen ribosom prokariot subunit 30S yang umum digunakan untuk menentukan hubungan filogenetik antar spesies prokariot. Gen 16S rRNA aktinobakteri dari tanah rizosfir dan jaringan tanaman C. asiatica dianalisis menggunakan 2 set primer spesifik untuk mendeteksi aktinobakteri (Martina et al. 2008). Primer 27F di desain untuk mengamplifikasi seluruh domain bakteri dan primer 16Sact1114R didesain dari 202 aktinobakteri dengan misspriming sebesar 1.3%. Sedangkan primer P338F dan P518R didesain untuk mengamplifikasi seluruh daerah V3 dari bakteri (Overeas et al. 1997). Daerah V3 merupakan daerah hipervariabel pada gen 16S rRNA yang mampu menyediakan informasi filogenetik yang memadai mengenai bakteri yang terdapat pada sampel (Huse et al. 2008). Primer ini juga telah digunakan oleh Primanita et al. (2015) untuk mempelajari keragaman aktinobakteri endofit dari tanaman obat Tinospora crispa, dengan PCR-DGGE.
Berdasarkan analisis BLAST.N terdapat 4 pita yang diindikasikan sebagai novel spesies, karena keempat sekuen DNA tersebut memiliki homologi < 97.5% dengan sekuen strain pembanding yang terdapat pada GenBank database. Menurut Stackebrandt dan Goebel (1994), sekuen gen 16S rRNA yang memiliki homologi < 97.5% dapat dinyatakan sebagai spesies yang berbeda atau novel spesies. Adanya indikasi novel spesies membuka peluang besar untuk mendapatkan novel gen yang potensial, yang dapat dipelajari dan dikembangkan lebih lanjut.
28
Kluster kemiripan komunitas aktinobakteri dan hasil dari analisis beta diversity mengindikasikan bahwa terdapatnya perbedaan pola komunitas aktinobakteri pada setiap sampel (Tabel 3, Gambar 6). Meskipun demikian, beberapa komunitas aktinobakteri yang sama juga ditemukan pada sampel yang berbeda (Gambar 8A, B). Khususnya pada tanaman, mikrob endofit dapat bermigrasi ke bagian organ lain melalui ruang interseluler dan berkas pembuluh (Tian et al. 2007). Distribusi endofit dipengaruhi oleh kemampuan dalam mengkolonisasi dan ketersediaan sumber nutrisi dalam jaringan tanaman. Hal ini mengakibatkan komposisi komunitas endofit pada setiap jaringan tanaman berbeda (Zakria et al. 2007). Tingginya kolonisasi endofit pada jaringan daun C. asiatica diduga juga terkait dengan ketersediaan sumber nutrisi yang berupa fotosintat dalam jaringan tersebut. Hasil penelitian Surette et al. (2003) menunjukkan bahwa komposisi komunitas endofit pada area crown dari Daucus carota lebih tinggi dibandingkan pada area jaringan metaxylem. Keberadaan fotosintat yang lebih tinggi pada area crown, akan menyediakan lebih banyak sumber nutrisi bagi komunitas endofit untuk berkembang biak.
Perbedaan pola komunitas ternyata tidak memberikan pengaruh terhadap keragaman aktinobakteri, tetapi hanya memberikan pengaruh terhadap dominansi masing-masing komunitas aktinobakteri pada setiap sampel. Dominansi komunitas dan ketebalan setiap pita DGGE menunjukkan kelimpahan relatif suatu komunitas aktinobakteri (Nimnoi et al. 2010). Hasil penelitian ini, menunjukkan bahwa pita 10 (Uncultured bacterium clone B03_294 (99%)) memiliki kelimpahan tertinggi dan ditemukan pada seluruh jaringan tanaman (daun, akar, dan stolon) (Gambar 5A). Kemungkinan pita ini adalah komunitas aktinobakteri endofit yang mampu membentuk asosiasi dengan tanaman inangnya, yaitu C. asiatica. Adanya kompetisi yang kuat dengan mikrob rizosfer lainnya, diduga menjadi penyebab tidak ditemukannya komunitas tersebut di rizosfer. Mikrob Unculturable memiliki potensi besar sebagai sumber senyawa bioaktif yang penting di berbagai bidang (Zeyaullah et al. 2009).
29 asiatica mampu memproduksi indole asetic acid (IAA) yang dapat meningkatkan perkecambahan benih dan pertumbuhan bibit Phaseolus vulgaris. Streptomyces sp. endofit Leucas ciliata dan Rauwolfia densiflora mampu menghasilkan
senyawa inhibitor α-amilase yang juga dapat digunakan untuk mengobati penyakit diabetes melitus (Akshatha et al. 2013).
Komunitas famili Micromonosporaceae dapat ditemukan pada semua sampel baik tanah rizosfer maupun jaringan tanaman C. asiatica. Genus Micromonospora tersebar luas di alam termasuk tanah dan baru-baru ini diketahui bahwa genus tersebut mampu membentuk asosiasi dengan tanaman. Genus ini telah ditemukan sebagai endofit pada akar padi oleh Tian et al. (2007). Dalam bidang kesehatan spesies Micromonospora endofit juga dikenal mampu menghasilkan banyak antibiotik, seperti adalah antrakuinon dan lupinacidins A dan B yang memiliki aktivitas antitumor (Igarashi et al. 2007). M. schwarzwaldensis HKI0641yang terisolasi dari sampel tanah di Black Forest, Jerman juga diketahui mampu memproduksi antibiotik telomycin (Gurovic et al. 2013). Genus Verrucosispora dilaporkan dapat diisolasi dari sedimen laut dalam, rawa gambut, dan tanah bakau (Xie et al. 2012), dan sebelumnya tidak ada yang melaporkannya sebagai endofit. V. wenchangensis 234402T telah terisolasi dari tanah bakau di Wenchang, Cina (Xie et al. 2012). Genus tersebut berpotensi besar dalam menghasilkan sumber senyawa bioaktif baru, seperti senyawa proximicins yang bersifat antibakteri dan antitumor (Fiedler et al. 2008). Genus Actinoplanes juga banyak dilaporkan mampu memproduksi berbagai senyawa bioaktif penting yang berperan dalam bidang kesehatan seperti, antibakterial dan antifungal (Kasai et al. 2000). Spesies Actinoplanes sp. SE50/110 diketahui mampu menghasilkan
senyawa inhibitor α-glukosidase yang dapat digunakan untuk mengobati penyakit diabetes melitus (DM) tipe 2 (Zhang et al. 2003).
Single Nucleotide Polymorphism (SNP) pada Region V3 Sekuen Pita DGGE
Proses amplifikasi menggunakan primer P338F dan P518R pada tahap 2 menghasilkan amplikon berukuran ~ 180 pb. Amplikon ini merupakan region V3 dari gen 16S rRNA yang bersifat konservatif dan variatif (Overeas et al. 1997). Variasi sekuen DNA yang ada pada region V3 tersebut, dapat menentukan perbedaan famili, genus, dan spesies tertentu dari suatu komunitas mikrob. Analisis Single Nucleotide Polymorphism (SNP) merupakan tipe analisis yang umun digunakan untuk mendeteksi adanya variasi sekuen tersebut dan memberikan gambaran bagaimana perbedaan suatu sekuen basa berperan sebagai regulator pengelompokkan suatu komunitas mikrob.