SUPLEMENTASI LISIN PADA TEPUNG BUNGKIL BIJI
KARET
Hevea brasiliensis
DIFERMENTASI CAIRAN RUMEN
DOMBA DALAM PAKAN IKAN NILA
Oreochromis niloticus
DIDI HUMAEDI YUSUF
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Suplementasi Lisin pada Tepung Bungkil Biji Karet Hevea brasiliensis Difermentasi Cairan Rumen Domba dalam Pakan Ikan Nila Oreochromis niloticus adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Didi Humaedi Yusuf
RINGKASAN
DIDI HUMAEDI YUSUF. Suplementasi Lisin pada Tepung Bungkil Biji Karet
Hevea brasiliensis Difermentasi Cairan Rumen Domba dalam Pakan Ikan Nila
Oreochromis niloticus.
Dibimbing oleh MUHAMMAD AGUS SUPRAYUDI dan
DEDI JUSADI.Tepung bungkil biji karet yang difermentasi cairan rumen domba (TBBKF) hanya mampu digunakan hingga 50% menggantikan peranan tepung kedelai sebagai sumber protein. Peningkatan penggunaan TBBKF pada pakan menurunkan performa pertumbuhan ikan nila, hal ini disebabkan oleh ketersediaan lisin yang rendah pada pakan. Salah satu strategi dalam meningkatkan kualitas protein yaitu suplementasi asam amino esensial yang ketersediaannya rendah. Penelitian ini bertujuan untuk mengevaluasi suplementasi lisin pada tepung bungkil biji karet yang difermentasi cairan rumen domba sebagai sumber protein pada pakan ikan nila. Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan lima perlakuan dan tiga ulangan. Perlakuan yang digunakan memiliki perbedaan dalam persentase sumbangan protein TBBKF dengan dan tanpa suplementasi lisin yaitu 0% TBBKF; 50% TBBKF; 50% TBBKF dengan suplementasi lisin; 75% TBBKF dan 75% TBBKF dengan suplementasi lisin. Ikan uji yang digunakan berukuran 6,29±0,12 g dipelihara selama 40 hari dalam akuarium (100×50×50 cm) dan diberi pakan tiga kali dalam sehari secara atsatiation, yaitu pukul 08.00, 12.00 dan 16.00 WIB.
Parameter uji yaitu indeks hepatosomatik (IHS), glikogen (hati dan otot), dan lemak (hati dan otot), asam amino esensial pada tubuh setelah pemeliharaan, gambaran darah (jumlah sel darah merah, jumlah sel darah putih, hematokrit dan hemoglobin) dan kandungan HCN (pakan dan tubuh ikan) dianalisis secara deskriptif. Kolesterol, low density lipoprotein (LDL), high density lipoprotein
(HDL), protein plasma, retensi asam amino esensial, retensi protein, retensi lemak, jumlah konsumsi pakan, efisiensi pakan, laju pertumbuhan harian dan kelangsungan hidup dianalisis dengan one-way analysis of variance (ANOVA) menggunakan program SPSS (versi 16.0) pada selang kepercayaan 95% dan uji lanjut Tukey.
Hasil menujukkan bahwa suplementasi lisin pada 50% dan 75% TBBKF tidak mempengaruhi kolesterol, LDL, HDL dan protein plasma. Suplementasi lisin dapat meningkatkan retensi asam amino esensial yaitu lisin, arginin, histidin, valin, isoleusin, leusin, metionin, fenilalanin dan treonin. Peningkatan retensi asam amino juga meningkatkan retensi protein dan deposisi asam amino tubuh ikan setelah pemeliharaan. Nilai retensi protein pada 50% dan 75% TBBKF tanpa suplementasi lisin yaitu 30,28% dan 21,10% dan meningkat setelah diberikan lisin pada 50% dan 75% TBBKF yaitu hingga 35,34% dan 27,19%. Peningkatan retensi protein diikuti dengan peningkatan efisiensi pakan, bobot tubuh akhir dan laju pertumbuhan harian, tetapi lebih rendah dibandingkan kontrol. Hal ini mengindikasikan bahwa suplementasi lisin dapat meningkatkan kualitas protein 50% dan 75% TBBKF, tetapi penggunaan TBBKF dapat digunakan hingga 50% untuk menggantikan tepung kedelai sebagai sumber protein pada pakan ikan nila.
SUMMARY
DIDI HUMAEDI YUSUF. Lysine Supplementation of Rubber Seed Hevea brasiliensis Meal Fermented Using Sheep Rumen Liquor in Nile Tilapia
Oreochromis niloticus Diets. Supervised by MUHAMMAD AGUS SUPRAYUDI and DEDI JUSADI.
Rubber seed meal fermented using sheep rumen liquor (RSMF) can be used up to 50% to replace soybean meal as protein source in nile tilapia Oreochromis niloticus diets. The increasing of RSMF could decreased growth performance of nile tilapia, it was due to lower availability of lysine in the diets. One of strategy to improve the protein quality is amino acid supplementation wich lower availability in the diets. This research aimed to evaluate lysine supplementation in RSMF as protein source in nile tilapia diets. This research used completely randomized design with five treatments and three replications. The differentiation between treatments were the precentage protein of RSMF with and without lysine supplementation in the diets describe as follows: 0% protein of RSMF as control; 50% RSMF; 50% RSMF with lysine supplementation; 75% RSMF and 75% RSMF with lysine supplementation. The fish with initial body weight 6.29±0.12 g were reared for 40 days in aquaria (100×50×50 cm) and the fish were fed three times daily at satiation level, at 08.00 am, 12.00 and 16.00 pm.
Test parameters were hepatosomatic index (HSI), glicogen content (liver and muscle), lipid content (liver and muscle), essential amino acid in the whole body after reared, blood parameters (erythrocite, leucocyte, hematocrit and haemoglobin) and cyanide content (test diets and whole body) were analysed with descriptive. Cholesterol, lowdensitylipoprotein (LDL), highdensitylipoprotein (HDL), plasma protein, essential amino acid retention, protein retention, lipid retention, feed intake, feed eficiency, daily growth rate and survival rate were analysed with one-way analysis of variance (ANOVA) using SPSS software (16.0 version) with 95% confidence interval and tukey test for the post hoc test.
The results showed that lysine supplementation at 50% and 75% RSMF didn’t affected to cholesterol, LDL, HDL and plasma protein. Lysine supplementation could increased essential amino acid retention such as lysine, arginine, histidine, valine, isoleucine, leucine, methionine, phenilalanine and threonine. Increasing essential amino acid also increased protein retention and essential amino acid deposition of whole body fish after reared. Protein retention of 50% and 75% RSMF without lysine supplementation were 30,28% and 21.10% and increased after lysine supplementation at 50% and 75% RSMF as high as 35.34% and 27,19%. The increasing protein retention was followed increasing feed eficiency, final body weight and daily growth rate, but lower than control. This indicated that lysine supplementation could improved quality of 50% and 75% RMSF, but using RSMF can be used 50% to replace soybean meal as protein source in nile tilapia diets. Keywords: Lysine supplementation, rubber seed meal, amino acid retention, protein
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SUPLEMENTASI LISIN PADA TEPUNG BUNGKIL BIJI
KARET
Hevea brasiliensis
DIFERMENTASI CAIRAN RUMEN
DOMBA DALAM PAKAN IKAN NILA
Oreochromis niloticus
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Suplementasi Lisin pada Tepung Bungkil Biji Karet Hevea brasiliensis Difermentasi Cairan Rumen Domba dalam Pakan Ikan Nila Oreochromis niloticus
Nama : Didi Humaedi Yusuf NIM : C151130431
Disetujui oleh Komisi Pembimbing
Dr Ir Muhammad Agus Suprayudi, MSi Ketua
Dr Dedi Jusadi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MscAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Suplementasi lisin pada tepung bungkil biji karet Hevea brasiliensis
difermentasi cairan rumen domba dalam pakan ikan nila Oreochromis niloticus”
pada Program Studi Ilmu Akuakultur, Program Pascasarjana, Institut Pertanian Bogor.
Ucapan terimakasih penulis sampaikan kepada Bapak Dr Ir Muhammad Agus Suprayudi, MSi dan Bapak Dr Dedi Jusadi selaku dosen pembimbing atas waktu, tuntunan, masukan, kesabaran, nasehat, serta semangat yang telah diberikan hingga tesis ini dapat diselesaikan. Penulis juga mengucapkan terimakasih kepada Dr Nur Bambang Priyo Utomo, MSi sebagai dosen penguji luar komisi dan Dr Mia Setiawati, MSi sebagai komisi program studi yang telah memberikan saran dalam ujian sidang tesis ini.
Penulis juga mengucapkan terimakasih kepada orangtua tercinta, Bapak Ucup Sulaeman dan Ibu Uyinah yang telah tulus mendoakan, memberi kasih sayang serta semangat agar tidak mudah menyerah dan fokus dalam menyelesaikan studi. Selain itu, kepada saudara saya Usep Musta’in, Dede Haedar Yusuf, SP, Ipah Musripah, adek Yusuf Ilham Jalalul Anwar serta keluarga besar yang telah memberikan semangat serta doa.
Terimakasih juga kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) Kementerian Riset, Teknologi dan Pendidikan Tinggi (KEMENRISTEKDIKTI) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) sehingga penulis dapat menempuh program magister di Sekolah Pascasarjana Institut Pertanian Bogor.
Terimakasih kepada rekan-rekan yang telah membantu serta memberikan masukan dan ide yang membangun yaitu Nur Hikma Mahasu (kaka gadis), Putri Pratamaningrum Arifin, Andi Tiara Eka (ndi), Fahmi Akbar, Ardyen Saputra, Radhi Fadillah, Windu Sukendar, Sheny Permatasari, Ega Aditya Prama, Andre Rachmat Scabra, serta teman-teman mahasiswa Program Studi Ilmu Akuakultur Angkatan 2013 atas kebersamaan dan motivasinya selama menempuh studi. Selain itu ucapan terimakasih kepada laboran Laboratorium Nutrisi ikan yaitu Mba Retno, Bapak Wasjan, Kang Yosi, Pak Aam, Pak Henda yang telah membantu dalam kelancaran penelitian.
Akhir kata, semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan umumnya dan perikanan khususnya.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 2
Persiapan Biji Karet 2
Pakan Uji 3
Pemeliharaan Ikan 4
Parameter yang Diamati 5
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 11
4 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 19
3
DAFTAR TABEL
1 Komposisi Proksimat (% bobot kering) tepung bungkil biji karet yang difermentasi cairan rumen domba
2 Komposisi pakan dan proksimat pakan uji 3
3 Kandungan asam amino esensial pada pakan uji (% bahan) 4 4 Kolesterol, LDL, HDL dan protein plasma pada ikan nila 8 5 Kadar air, lemak dan glikogen pada hati dan otot serta nilai indeks
hepatosomatik (IHS) pada ikan nila 9
6 Retensi asam amino esensial dan retensi protein pada ikan nila 9 7 Kandungan asam amino esensial pada tubuh ikan nila setelah
pemeliharaan (% tubuh) 10
8 Biomassa awal (Bo), biomassa akhir (Bt), jumlah konsumsi pakan (JKP), efisiensi pakan (EP), laju pertumbuhan harian (LPH), tingkat kelangsungan hidup (TKH) dan retensi lemak (RL) pada ikan nila 10 9 Jumlah sel darah merah (SDM), jumlah sel darah putih (SDP), kadar
hematokrit (Ht) dan kadar haemoglobin (Hb) pada ikan nila 11 10 Kandungan asam sianida (HCN) pada tubuh ikan awal (sebelum
pemeliharaan) dan tubuh ikan akhir (setelah pemeliharaan) (mg/100g) 11
DAFTAR LAMPIRAN
1 Prosedur analisis proksimat 19
2 Prosedur analisis asam amino esensial 22
3 Prosedur pengamatan gambaran darah 23
1
PENDAHULUAN
Latar Belakang
Biji karet Havea brasiliensis merupakan salah satu bahan baku lokal potensial dari hasil samping agroindustri. Keberadaan biji karet di Indonesia cukup melimpah. Pada tahun 2013–2014, luas perkebunan biji karet yaitu 3,55–3,60 juta ha. Produksi biji karet diprediksi hingga 5,6 juta biji ton per tahun, sedangkan pemanfatan biji karet hanya 25% dan sisanya terbuang sia-sia (Direktorat Jenderal Perkebunan 2014). Biji karet terdiri dari 40–50% kulit biji dan 50–60% daging biji. Bungkil biji karet merupakan limbah industri minyak biji karet dengan presentase 55–60% dari daging biji karet. Bungkil biji karet memiliki nutrien cukup baik yaitu kandungan air 11,0%; protein 33,82%; lemak 15,07%; serat kasar 15,03% dan abu 5,06% (Suprayudi et al. 2014a), sehingga berpotensi sebagai pengganti tepung kedelai dalam pakan ikan (Suprayudi et al. 2014a; Suprayudi et al. 2015).
Permasalahan utama pada biji karet mengandung zat antinutrisi yaitu asam sianida (HCN) (Oyewusi et al. 2007), namun Rachmawan & Mansyur (2008) melaporkan bahwa perlakuan fisik seperti pengukusan, perebusan dan perendaman dalam air mengalir dapat menurunkan kandungan HCN pada biji karet. Biji karet mengandung serat kasar tinggi. Tingginya serat kasar dapat dikurangi dengan metode fermentasi menggunakan cairan rumen domba (Suprayudi et al. 2011). Cairan rumen domba merupakan salah satu sumber bahan suplemen alternatif yang dapat dimanfaatkan sebagai sumber enzim hidrolase dalam menghidrolisis tepung biji karet. Cairan rumen domba kaya akan kandungan enzim selulase, amilase, protease, fitase, dan lipase (Suprayudi et al. 2011), sehingga fermentasi dengan cairan rumen domba mampu menurunkan serat kasar, meningkatkan nilai nutrisi dan kecernaan bahan baku pakan (Fitriliyani 2010; Suprayudi et al. 2011; Pamungkas et al. 2011; Jusadi et al. 2013; Suprayudi et al. 2014b; Suprayudi et al.
2015). Suprayudi et al. (2015) melaporkan bahwa nilai nutrisi biji karet meningkat setelah difermentasi dengan cairan rumen domba yaitu kandungan protein 39,57%; lemak 13,92%; serat kasar 7,64%; kadar abu 6,07% dan BETN 32,79%.
Penggunaan tepung biji karet yang difermentasi cairan rumen domba sebagai bahan baku pakan ikan dilaporkan oleh Suprayudi et al. (2015) bahwa pemberian pakan berbahan dasar tepung bungkil biji karet yang difermentasi cairan rumen domba mampu menggantikan peranan tepung bungkil kedelai hingga 50% sebagai sumber protein pada pakan ikan nila Oreochromis niloticus. Penggunaan tepung bungkil biji karet lebih dari 50% pada pakan menurunkan kinerja pertumbuhan ikan nila, hal ini disebabkan oleh ketersediaan lisin yang rendah (asam amino esensial pembatas) pada biji karet (Suprayudi et al. 2015; Syamsunarno & Sunarno 2014). Lisin merupakan asam amino esensial pembatas pada bahan baku nabati yang umum digunakan pada pakan ikan dan udang. Suplementasi lisin dibutuhkan pada pakan berbahan dasar nabati untuk menyeimbangkan asam amino esensial sehingga dapat meningkatkan pertumbuhan ikan (Nunes et al. 2014).
2
protein (Furuya & Furuya 2010; Dalibard et al. 2014). Suplementasi asam amino esensial dilaporkan pada beberapa penelitian. Robinson et al. (1991) melaporkan bahwa suplementasi lisin dapat meningkatkan penggunaan tepung biji kapuk hingga 100% menggantikan tepung kedelai pada pakan ikan chanelcatfish. Wu et al. (1998), melaporkan ikan nila yang diberi pakan berbahan dasar corn gluten meal
39% dengan penambahan lisin, threonin dan tryptophan dapat meningkatkan kinerja pertumbuhan ikan nila. Suprayudi et al. (2000), melaporkan suplementasi asam amino arginin pada pakan berbahan baku 75% tepung kedelai menghasilkan peningkatan kualitas protein tepung kedelai yang ditandai peningkatan pertumbuhan pada ikan gurame. Oleh karena itu, pada penelitian ini dilakukan suplementasi lisin yang diharapkan dapat meningkatkan penggunaan tepung bungkil biji karet yang difermentasi cairan rumen domba dalam pakan ikan nila
Oreochromis niloticus.
Perumusan Masalah
Biji karet merupakan bahan baku pakan alternatif yang potensial. Biji karet tidak sepenuhnya dapat menggantikan tepung kedelai sebagai sumber protein. Salah satu penyebab tersebut yaitu ketersediaan lisin yang rendah. Oleh karena itu, penelitian ini dilakukan untuk mengevaluasi suplementasi lisin pada pakan berbasis tepung bungkil biji karet yang diharapkan dapat meningkatkan penggunaan tepung bungkil biji karet yang difermentasi cairan rumen domba pada pakan ikan nila.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi suplementasi lisin pada tepung bungkil biji karet yang difermentasi cairan rumen domba pada pakan ikan nila.
Manfaat Penelitian
Manfaat penelitian adalah meningkatkan pemanfaatan jumlah tepung bungkil biji karet yang difermentasi cairan rumen domba pada pakan ikan nila.
2
METODE PENELITIAN
Persiapan Biji Karet
Biji karet yang digunakan berasal dari perkebunan karet rakyat di Padang Sidempuan, Sumatera Utara. Biji karet dikupas atau dipisahkan dengan cangkangnya kemudian dilakukan proses penepungan menggunakan discmill
3 200 mL/kg bahan (Suprayudi et al. 2011), setelah itu dilakukan analisis proksimat. Hasil analisis proksimat tepung bungkil biji karet yang difermentasi cairan rumen domba pada penelitian ini disajikan pada Tabel 1.
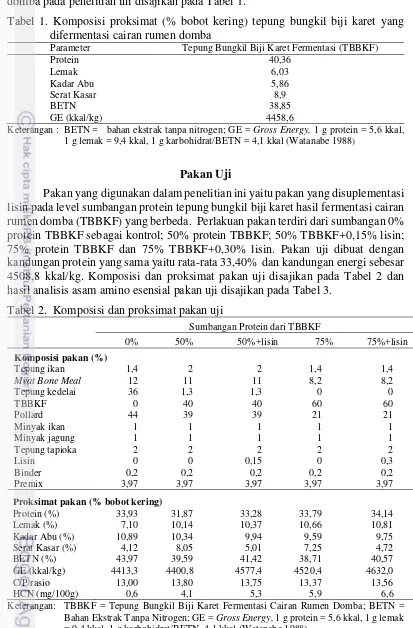
Tabel 1. Komposisi proksimat (% bobot kering) tepung bungkil biji karet yang difermentasi cairan rumen domba
Parameter Tepung Bungkil Biji Karet Fermentasi (TBBKF) Protein 1 g lemak = 9,4 kkal, 1 g karbohidrat/BETN = 4,1 kkal (Watanabe 1988)
Pakan Uji
Pakan yang digunakan dalam penelitian ini yaitu pakan yang disuplementasi lisin pada level sumbangan protein tepung bungkil biji karet hasil fermentasi cairan rumen domba (TBBKF) yang berbeda. Perlakuan pakan terdiri dari sumbangan 0% protein TBBKF sebagai kontrol; 50% protein TBBKF; 50% TBBKF+0,15% lisin; 75% protein TBBKF dan 75% TBBKF+0,30% lisin. Pakan uji dibuat dengan kandungan protein yang sama yaitu rata-rata 33,40% dan kandungan energi sebesar 4508,8 kkal/kg. Komposisi dan proksimat pakan uji disajikan pada Tabel 2 dan hasil analisis asam amino esensial pakan uji disajikan pada Tabel 3.
Tabel 2. Komposisi dan proksimat pakan uji
Sumbangan Protein dari TBBKF
Proksimat pakan (% bobot kering) Protein (%)
4
Tabel 3. Kandungan asam amino esensial pada pakan uji (% bahan)
Asam amino Sumbangan Protein dari TBBKF
0% 50% 50%+Lisin 75% 75%+Lisin Wanayasa, Jawa Barat. Ikan dipelihara selama 40 hari pada bulan Maret hingga Mei 2015 di Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Pemeliharaan menggunakan 15 akuarium berukuran 100×50×50 cm dengan volume air sebanyak 175 L/akuarium dan padat tebar sebanyak 15 ekor/akuarium. Pemberian pakan dilakukan secara at satiation (sekenyangnya)dengan frekuensi sebanyak tiga kali sehari, yaitu pada pukul 08.00, 12.00 dan 16.00 WIB.
Selama pemeliharaan, kualitas air dijaga dalam kisaran yang optimum untuk pertumbuhan dan kelangsungan hidup ikan nila yaitu suhu berkisar 28–31°C, kandungan oksigen terlarut berkisar 4,9–6,6 mg/L, pH berkisar 6,72–7,44 dan TAN berkisar 0,48–0,7 mg/L. Kualitas air dijaga dengan cara melakukan penyiponan setiap hari, serta melakukan pergantian air sebanyak 30% setiap 3 hari sekali. Setiap akuarium dilengkapi dengan termostat untuk menjaga suhu agar tetap stabil, aerasi untuk menjaga kelarutan oksigen dan top filter untuk mengurangi kekeruhan akibat bahan organik di dalam akuarium. Pengukuran suhu air dilakukan setiap hari, yaitu pada pagi dan sore hari, sedangkan pengukuran pH, oksigen terlarut, dan total ammonia nitrogen (TAN) dilakukan tiga kali selama pemeliharaan yaitu pada awal pemeliharaan, hari ke 15 dan hari ke 30.
5 Parameter yang Diamati
Jumlah Konsumsi Pakan
Jumlah konsumsi pakan (JKP) ditentukan dengan menimbang pakan yang diberikan selama masa pemeliharaan.
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (TKH) dihitung dengan rumus seperti berikut:
Laju Pertumbuhan Harian
Laju pertumbuhan harian ikan dihitung berdasarkan rumus yang dikemukakan oleh Huisman (1987) yaitu:
�� = √� ���� − ×
Keterangan :
LPH = Laju pertumbuhan harian (%) t = Periode pengamatan (hari)
Wt = Bobot rata-rata ikan pada akhir pemeliharaan (g) Wo = Bobot rata-rata ikan pada awal pemeliharaan (g) Efisiensi pakan
Efisiensi pakan dihitung menggunakan rumus sebagai berikut (Takeuchi 1988) :
EP = [ + − ]
F x 100
Keterangan:
EP = Efisiensi pakan (%)
Wt = Biomassa ikan pada akhir pemeliharaan (g)
W0 = Biomassa ikan pada awal pemeliharaan (g)
Wd = Biomassa ikan yang mati selama pemeliharaan (g)
F = Jumlah pakan yang diberikan selama penelitian (g) Retensi protein
Retensi protein dihitung melalui analisis proksimat protein tubuh ikan uji pada awal dan akhir penelitian. Rumus perhitungan retensi protein adalah sebagai berikut (Takeuchi 1988):
RP = F−I
P x 100
Keterangan:
RP = Retensi protein (%)
F = Jumlah protein ikan pada akhir pemeliharaan (g) I = Jumlah protein ikan pada awal pemeliharaan (g) P = Jumlah protein yang dikonsumsi ikan (g)
6
Retensi lemak
Retensi lemak dihitung melalui analisis proksimat lemak tubuh ikan uji pada awal dan akhir penelitian. Rumus perhitungan retensi lemak adalah sebagai berikut (Takeuchi 1988):
RL = F−I
L x 100
Keterangan:
RL = Retensi lemak (%)
F = Jumlah lemak ikan pada akhir pemeliharaan (g) I = Jumlah lemak ikan pada awal pemeliharaan (g) L = Jumlah lemak yang dikonsumsi ikan (g)
Retensi asam amino esensial
Retensi asam amino esensial dihitung melalui analisis asam amino esensial tubuh ikan uji pada awal dan akhir penelitian. Rumus perhitungan retensi asam amino esensial adalah sebagai berikut (Takeuchi 1988):
RAAE = F−I x 100 Keterangan:
RAAE = Retensi asam amino esensial (%)
F = Jumlah asam amino esensial ikan pada akhir pemeliharaan (g) I = Jumlah asam amino esensial ikan pada awal pemeliharaan (g) A = Jumlah asam amino esensial yang dikonsumsi ikan (g)
Analisis kadar air, lemak, glikogen pada hati dan otot serta nilai hepatosomatik index (IHS)
Keadaan organ hati sesudah diberi pakan perlakuan diukur melalui analisis kadar air, kadar lemak hati, glikogen hati dan indeks hepatosomatik (IHS). Rumus yang digunakan untuk menghitung IHS adalah sebagai berikut:
IHS =
x 100 Pengamatan Biokimia Darah
Pengamatan biokimia darah dilakukan untuk melihat efek dari suplementasi lisin pada tepung bungkil biji karet fermentasi rumen domba terhadap kolesterol,
high density lipoporotein (HDL), low density lipoporotein (LDL), dan protein plasma ikan nila.
Kolesterol
Pengukuran total kolestrol dilakukan menggunakan metode CHOD-PAP. Rumus yang digunakan untuk menghitung kandungan kolesterol adalah sebagai berikut:
7 Keterangan:
K = Kandungan kolesterol (mg/dL) Au = Absorbansi sampel
Cs = Konsentrasi standar kolesterol As = Absorbansi standar kolesterol
High density lipoprotein (HDL)
Pengukuran high density lipoprotein (HDL) menggunakan metode CHOD-PAP. Rumus yang digunakan untuk menghitung kandungan HDL adalah sebagai berikut:
HDL = x Keterangan:
HDL = Kandungan kolesterol-HDL (mg/dL) Au = Absorbansi sampel
Cs = Konsentrasi standar HDL As = Absorbansi standar HDL
Low density lipoprotein (LDL)
Pengukuran low density lipoprotein (LDL) menggunakan metode CHOD-PAP. Rumus yang digunakan untuk menghitung kandungan LDL adalah sebagai berikut:
LDL (mg/dL) = Kolesterol total–Kolesterol HDL– Analisis Kimia
Analisis kimia meliputi analisis proksimat dan analisis asam amino esensial pada pakan uji, tubuh ikan awal (sebelum pemeliharaan) dan tubuh ikan akhir (setelah pemeliharaan).
Analisis proksimat
Analisis proksimat meliputi kadar air, protein, lemak, serat kasar, abu dan BETN (bahan ekstrak tanpa nitrogen). Analisis kadar air dilakukan dengan metode Gravimetric, protein dengan metode Kjeldhal, lemak dengan metode Soxhlet, kadar abu dengan metode Gravimetric dan serat kasar dengan metode Vansus. Analisis proksimat ini sesuai dengan prosedur AOAC (1995) (Lampiran 1).
Analisis asam amino esensial
Asam amino esensial yang dianalisis yaitu arginin, histidin, threonin, valin, metionin, isoleusin, leusin, fenilalanin dan lisin. Analisis asam amino esensial pada pakan dan tubuh ikan dilakukan dengan metode AA-HPLC (AOAC 1995) (Lampiran 2).
Pengamatan Gambaran Darah
8
Analisis Asam Sianida (HCN)
Pada awal penelitian dilakukan analisis asam sianida (HCN) pada pakan dan ikan uji. Selain itu, untuk mengetahui akumulasi HCN maka dilakukan analisis HCN pada tubuh ikan setelah masa pemeliharaan. Analisis asam sianida dilakukan dengan metode titrasi (Lampiran 4).
Analisis Data
Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan lima perlakuan dan tiga ulangan. Parameter asam amino tubuh akhir, indeks hepatosomatik (IHS), lemak hati, glikogen hati, lemak otot, glikogen otot, asam amino tubuh ikan akhir, sel darah merah, sel darah putih, kadar hematokrit, hemoglobin, HCN pakan, dan tubuh dianalisis secara deskriptif. Parameter kolesterol, HDL, LDL, protein plasma, retensi asam amino, retensi protein, retensi lemak, jumlah konsumsi pakan, bobot tubuh akhir, efisiensi pakan, laju pertumbuhan harian, tingkat kelangsungan hidup dianalisis menggunakan program SPSS ver 16.0. Perbedaan antar perlakuan diketahui melalui analisis Anova One Way (ANOVA) dengan selang kepercayaan 95% dan dilanjutkan dengan uji Tukey.
3 HASIL DAN PEMBAHASAN
Hasil
Hasil penelitian suplementasi lisin pada TBBKF yang diberikan pada ikan nila selama 40 hari terhadap kolesterol, low density lipoprotein (LDL), high density lipoprotein (HDL) dan protein plasma disajikan pada Tabel 4. Suplementasi lisin tidak memberikan pengaruh nyata terhadap penurunan kolesterol, LDL, HDL dan protein plasma.
Tabel 4. Kolesterol, LDL, HDL dan protein plasma pada ikan nila Parameter Uji Sumbangan Protein dari TBBKF
0% 50% 50%+lisin 75% 75%+lisin
Kolesterol (mg/dL)
104,47±4,51b 137,91±8,14ab 118,67±5,84b 169,76±8,35a 162,89±24,52a
LDL (mg/dL) 14,65±6,10a 28,94,±6,77a 17,92±5,32a 32,78±8,61a 20,95±15,51a
HDL (mg/dL) 67,95±6,10b 70,70±6,30b 77,89±4,74ab 89,66±4,52a 90,49±8,22a
Protein Plasma
(%) 1,82±0,05a 2,09,±0,48a 1,93±0,30a 2,24±0,48a 2,22±0,19a
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan nilai setelah
± merupakan standar deviasi.
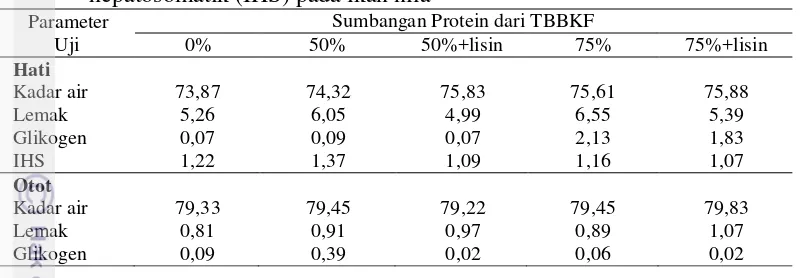
9 glikogen hati dan otot juga mengalami penurunan seiring dengan suplementasi lisin pada 50% TBBKF maupun 75% TBBKF.
Tabel 5. Kadar air, lemak dan glikogen pada hati dan otot serta nilai indeks hepatosomatik (IHS) pada ikan nila
Parameter
Suplementasi lisin memberikan pengaruh nyata terhadap retensi asam amino esensial dan protein (Tabel 6). Hasil menunjukkan bahwa suplementasi lisin pada 50% dan 75% TBBKF meningkatkan retensi arginin, histidin, threonin, valin, metionin, isoleusin, leusin, leusin, fenilalanin dan lisin dibandingkan dengan tanpa suplementasi lisin. Tren yang sama juga terlihat pada retensi protein. Suplementasi lisin pada 50% TBBKF meningkatkan retensi protein dari 39,28% hingga 35,34% dan pada 75% TBBKF meningkat dari 21,10% hingga 27,19%. Peningkatan retensi asam amino esensial dan protein pada 75% TBBKF+suplementasi lisin menunjukkan nilai tidak berbeda nyata dengan kontrol.
Tabel 6. Retensi asam amino esensial dan protein pada ikan nila Parameter
Uji
Sumbangan Protein dari TBBKF
0% 50% 50%+lisin 75% 75%+lisin
Retensi asam amino esensial (%)
Arginin 65,97±6,19a 38,16±1,52 c 51,08±1,78 b 31,01±5,36 c 50,81±5,53b
Histidin 41,22+3,70a 44,32±1,50 a 44,73±1,57 a 25,88±3,94b 42,21±4,00 a
Threonin 26,48±3,14 b 24,83±1,28 b 34,10±1,38 a 13,55±3,21 c 27,39±3,46 ab
Valin 8,17±3,28 ab 7,18±1,72 ab 12,19±1,35 a 1,92±4,19 b 5,70±3,39 ab
Metionin 22,50±2,23 b 21,29±0,87 b 32,22±1,11 a 15,39±2,47 c 24,56±2,53 b
Isoleusin 82,51±6,09 ab 83,02±2,19 a 84,10±2,45 a 61,23±7,18 b 87,34±6,81 a
Leusin 47,30±4,40 a 41,94±1,60ab 52,53±1,83a 35,32±5,27 b 50,76±5,00 b
Fenilalanin 45,28±4,64 a 40,17±1,58ab 47,04±1,87 a 19,61±4,18 c 32,99±4,57a
Lisin 35,00±3,61 ab 27,45±1,31bc 39,99±1,54 a 25,14±4,45 c 38,82±4,25 a Retensi protein (%)
Protein 30,00±0,85 b 30,28±0,67ab 35,34±1,04a 21,10±2,40c 27,19±3,16b
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan nilai setelah ± merupakan standar deviasi.
10
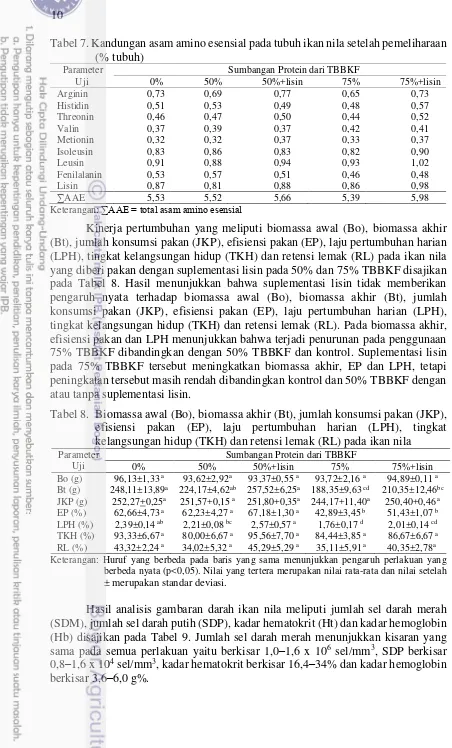
Tabel 7. Kandungan asam amino esensial pada tubuh ikan nila setelah pemeliharaan (% tubuh)
Keterangan: ∑AAE = total asam amino esensial
Kinerja pertumbuhan yang meliputi biomassa awal (Bo), biomassa akhir (Bt), jumlah konsumsi pakan (JKP), efisiensi pakan (EP), laju pertumbuhan harian (LPH), tingkat kelangsungan hidup (TKH) dan retensi lemak (RL) pada ikan nila yang diberi pakan dengan suplementasi lisin pada 50% dan 75% TBBKF disajikan pada Tabel 8. Hasil menunjukkan bahwa suplementasi lisin tidak memberikan pengaruh nyata terhadap biomassa awal (Bo), biomassa akhir (Bt), jumlah konsumsi pakan (JKP), efisiensi pakan (EP), laju pertumbuhan harian (LPH), tingkat kelangsungan hidup (TKH) dan retensi lemak (RL). Pada biomassa akhir, efisiensi pakan dan LPH menunjukkan bahwa terjadi penurunan pada penggunaan 75% TBBKF dibandingkan dengan 50% TBBKF dan kontrol. Suplementasi lisin pada 75% TBBKF tersebut meningkatkan biomassa akhir, EP dan LPH, tetapi peningkatan tersebut masih rendah dibandingkan kontrol dan 50% TBBKF dengan atau tanpa suplementasi lisin.
Tabel 8. Biomassa awal (Bo), biomassa akhir (Bt), jumlah konsumsi pakan (JKP), efisiensi pakan (EP), laju pertumbuhan harian (LPH), tingkat kelangsungan hidup (TKH) dan retensi lemak (RL) pada ikan nila
Parameter
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan nilai setelah ± merupakan standar deviasi.
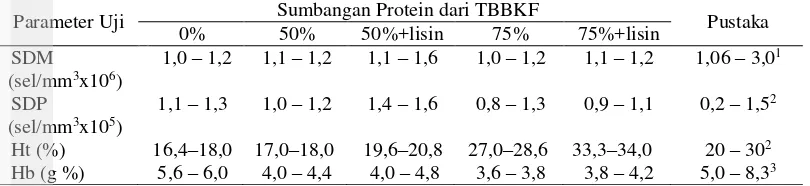
Hasil analisis gambaran darah ikan nila meliputi jumlah sel darah merah (SDM), jumlah sel darah putih (SDP), kadar hematokrit (Ht) dan kadar hemoglobin (Hb) disajikan pada Tabel 9. Jumlah sel darah merah menunjukkan kisaran yang sama pada semua perlakuan yaitu berkisar 1,0–1,6 x 106 sel/mm3, SDP berkisar
0,8–1,6 x 104 sel/mm3, kadar hematokrit berkisar 16,4–34% dan kadar hemoglobin
11 Tabel 9. Jumlah sel darah merah (SDM), jumlah sel darah putih (SDP), kadar
hematokrit (Ht) dan kadar hemoglobin (Hb) pada ikan nila
Parameter Uji Sumbangan Protein dari TBBKF Pustaka 0% 50% 50%+lisin 75% 75%+lisin
Keterangan = 1Robbert (1978); 2Rastogi (1977); 3Salasia (2001)
Hasil analisis kandungan asam sianida (HCN) pada tubuh ikan awal dan akumulasi asam siandia pada tubuh ikan setelah pemeliharaan selama 40 hari disajikan pada Tabel 10. Kandungan HCN pada tubuh ikan awal sama yaitu 0,4 mg/100g, sedangkan pada tubuh ikan akhir berkisar 0,8–1,8 mg/100 g.
Tabel 10. Kandungan asam sianida (HCN) pada tubuh ikan awal (sebelum pemeliharaan) dan tubuh ikan akhir (setelah pemeliharaan) (mg/100g) Parameter Uji Sumbangan Protein dari TBBKF
0% 50% 50%+lisin 75% 75%+lisin (TBBKF) mampu menggantikan peranan tepung bungkil kedelai hingga 50% sebagai sumber protein pada pakan ikan nila (Suprayudi et al. 2015). Peningkatan TBBKF lebih dari 50% menurunkan kinerja pertumbuhan yang disebabkan oleh ketidakseimbangan asam amino esensial pada TBBKF dengan ketersediaan lisin rendah. Salah satu strategi dalam pemenuhan keseimbangan asam amino esensial yaitu melalui suplementasi asam amino esensial yang ketersediaannya rendah (Dalibard et al. 2014), sehingga dalam penelitian ini dilakukan peningkatan kualitas protein TBBKF melalui suplementasi lisin. Pakan berbahan dasar 50% dan 75% TBBKF dengan dan tanpa suplementasi lisin tidak mempengaruhi jumlah konsumsi pakan (JKP) pada ikan uji. Pakan yang telah dikonsumsi oleh ikan dicerna, diabsorbsi dan ditransfer melalui pembuluh darah menuju hati untuk dimetabolisme. Di dalam pembuluh darah terdapat lipoprotein yang mengandung protein dan lemak untuk disirkulasi ke hati (Colpo 2005). High Density Lipoprotein (HDL) dan Low Density Lipoprotein (LDL) merupakan lipoprotein yang mengandung molekul gliserida dan protein (Affandi et al. 2009). Suplementasi lisin meningkatkan nilai HDL dan menurunkan nilai LDL. Penurunan LDL diikuti dengan menurunya kadar kolesterol darah. Kadar kolesterol darah ikan nila menurun seiring dengan penambahan lisin. Lisin merupakan prekursor biosintesis karnitin yang dapat merangsang proses β-oksidasi dari asam lemak rantai panjang yang terjadi di mitokondria (Harpaz 2005). Suplementasi lisin ke dalam pakan dapat meningkatkan terbentuknya karnitin dan proses β-oksidasi asam lemak meningkat yang mengakibatkan kadar lemak dan kolesterol rendah (Li et al. 2008).
12
75% TBBKF yang disuplementasi lisin tersebut mengakibatkan penurunan kadar lemak hati (Tabel 5). Penurunan lemak hati diikuti dengan penurunan nilai indeks hepatosomatik (IHS). Nilai IHS menunjukkan penimbunan lemak dan glikogen pada hati. Hal ini sejalan dengan penelitian Yang et al. (2010) bahwa suplementasi lisin menurunkan nilai IHS dari 1,85 menjadi 1,63 pada ikan grass carp
Ctenopharyngodon idella. Zhou et al. (2007) juga melaporkan bahwa peningkatan level lisin pada pakan menurunkan nilai IHS pada ikan cobia. Pada glikogen hati dan otot, terjadi penurunan glikogen pada ikan yang diberi pakan 50% dan 75% TBBKF dengan suplementasi lisin. Penurunan glikogen tersebut seiring dengan peningkatan kandungan HCN pada pakan (Tabel 2), sehingga penurunan glikogen tersebut diduga karena banyak glukosa yang dipakai sebagai sumber energi untuk proses detoksifikasi HCN. Hal ini yang menyebabkan penyimpanan glukosa dalam bentuk glikogen rendah (Suprayudi etal. 2014a).
13 meningkatkan pertumbuhan dan pemanfaatan nitrogen pada post larva ikan Solea senegalensis. Gaylord & Barrows (2008) juga melaporkan bahwa keseimbangan asam amino esensial melalui suplementasi asam amino esensial pada pakan dapat meningkatkan efisiensi retensi asam amino esensial. Suplementasi asam amino esensial meningkatkan retensi metionin, threonin, isoleusin dan leusin pada ikan rainbow trout Oncorhynchus mykiss.
Aragão et al. (2004) menyatakan bahwa retensi asam amino esensial merefleksikan retensi protein, sehingga peningkatan retensi asam amino esensial juga meningkatkan protein yang diretensi. Retensi protein pada 50% TBBKF terjadi peningkatan sebesar 16,70% setelah disuplementasi lisin dan pada 75% TBBKF terjadi peningkatan sebesar 28,86% setelah disuplementasi lisin. Peningkatan retensi protein pada 75% TBBKF dengan suplementasi lisin menunjukkan nilai tidak berbeda nyata dengan kontrol. Hal ini mengindikasikan bahwa suplementasi lisin dapat memperbaiki kualitas protein 75% TBBKF yang ditandai dengan peningkatan retensi protein, sehingga TBBKF dapat digunakan hingga 75% sebagai sumber protein. Hal ini sesuai dengan Yang et al. (2010) bahwa suplementasi lisin pada pakan dapat meningkatkan retensi protein dengan peningkatan sebesar 8,27% yaitu dari 28,52% menjadi 30,88% pada juvenil ikan grass carp Ctenopharyngodon idella. Sedangkan Suprayudi et al. (2000) melaporkan bahwa suplementasi asam amino arginin pada 75% protein tepung kedelai juga meningkatkan kualitas protein tepung kedelai pada pakan ikan gurame yang ditandai dengan meningkatnya retensi protein sebesar 19,14%.
Peningkatan retensi asam amino esensial pada 50% dan 75% TBBKF yang disuplementasi lisin diikuti dengan peningkatan kandungan asam amino esensial tubuh ikan akhir setelah pemeliharaan (Tabel 7). Hal tersebut dapat dilihat dari total asam amino esensial yang terjadi peningkatan dari 5,52% hingga 5,66% pada penggunaan 50% TBBKF setelah disuplementasi lisin dan pada 75% TBBKF meningkat dari 5,39% hingga 5,98% setelah disuplementasi lisin. Menurut Conceição et al. (2010), asam amino yang diabsorbsi akan disintesis menjadi protein fungsional dan struktural, sehingga peningkatan asam amino yang disintesis meningkatkan asam amino tubuh. Aragão et al. (2004) juga melaporkan bahwa keseimbangan asam amino esensial meningkatkan deposisi asam amino pada tubuh juvenil Solea senegalensis. Salama et al. (2013) juga melaporkan bahwa suplementasi lisin dan metionin+sistin dapat meningkatkan deposisi asam amino pada tubuh larva ikan sea bass Dentrarshus laborax.
14
meningkatkan kualitas pakan sehingga dapat meningkatkan pertumbuhan, tetapi peningkatan pertumbuhan pada 75% TBBKF yang disuplementasi lisin masih lebih rendah dibandingkan dengan kontrol, sehingga suplementasi lisin belum sepenuhnya dapat meningkatkan penggunaan TBBKF pada pakan ikan nila. Robinson (1991) yang melaporkan bahwa suplementasi lisin pada penggunaan 100% tepung biji kapuk dapat meningkatkan bobot akhir dan memperbaiki nilai FCR jika dibandingkan tanpa suplementasi lisin pada ikan Chanelcatfish. Yang et al. (2010) juga melaporkan bahwa suplementasi lisin meningkatkan biomassa akhir, menurunkan FCR pada juvenil ikan grasscarp. Hasil yang sama juga dilaporkan oleh Ovie & Eze (2013), bahwa suplementasi lisin meningkatkan biomassa akhir, rasio efisiensi pakan, protein efficiency ratio (PER) dan LPH pada ikan nila. Suprayudi et al. (2000) juga melaporkan bahwa kualitas pakan berbahan tepung kedelai meningkat setelah disuplementasi asam amino arginin yang ditandai dengan meningkatkan efisiensi pakan dan laju pertumbuhan harian pada ikan gurame
Osphronemus gouramy.
Biji karet mengandung zat anti nutrisi yaitu asam sianida (HCN). HCN ini bersifat toksik yang menimbulkan gangguan fisiologik, sehingga dilakukan pengamatan status kesehatan ikan melalui pengamatan gambaran darah. Menurut Rachmawan & Mansyur (2009), HCN terbentuk dari reaksi sianogenik glukosida bersama dengan enzim β-glukosidase yang membentuk aglikon kemudian bereaksi dengan hidroksinitrilliase. Keracunan HCN akan menyebabkan terjadinya oksigenasi karena sianida bereaksi dengan ferric (trivalent) iron dari cytochrome oxidase dan membentuk cyanide cytochrome oxidase yang tinggi. Pada akhirnya hemoglobin tidak mampu membebaskan oksigen (sistem transportasi elektron) sehingga warna darah menjadi merah terang. HCN juga dapat membentuk senyawa tiosianat bersama sulfur yang menghambat penyerapan yodium pada kelenjar tiroid, sehingga pertumbuhan akan terhambat. Hasil pengamatan jumlah sel darah merah (SDM), sel darah putih (SDP) dan hematokrit menunjukkan gambaran darah ikan nila masih dalam kisaran normal, kecuali kadar hemoglobin (Hb). Jumlah sel darah putih (SDP) berkisar 0,97–1,49x106 sel/mm3 dan masih dalam kisaran normal
sesuai dengan Rastogi (1977) yaitu jumlah sel darah putih pada ikan berkisar 20.000–150.000 sel/mm3 darah. Jumlah sel darah merah (SDM) ikan berkisar 1,06– 1,33x106 sel/mm3 dan masih dalam kisaran normal sesuai dengan Robert (1978) yaitu pada ikan yang normal, jumlah sel darah merah berkisar antara 1,05–3,00 x106
sel/mm3. Kadar Hb pada ikan yang diberi pakan 50% dan 75% TBBKF masih dibawah normal dibandingkan kontrol yaitu 3,8–4,8 g%. Menurut Salasia (2001) Hb normal pada ikan air tawar yaitu 5–8,3 g%. Rendahnya kadar Hb ini diduga karena ikan mengalami stres akibat paparan HCN dari TBBKF. Suprayudi et al.
(2014a), menyatakan bahwa paparan HCN dari tepung bungkil biji karet pada pakan dapat menurunkan kadar Hb pada ikan mas Cyprinus carpio.
Kandungan HCN pada pakan meningkat seiring pada peningkatan TBBKF yang ditambahkan (Tabel 2). Kandungan HCN pada pakan berkisar antara 0,6–6,6 mg/100g. Menurut Rachmawan & Mansyur (2009) bahwa dosis lethal HCN pada hewan ruminansia yaitu 2,4–2,4 mg/kg bobot badan. Sementara menurut Suprayudi
15 perbedaan dalam proses detoksifikasi HCN pada tubuh ikan. Menurut Rachmawan & Mansyur (2009) bahwa proses detoksifikasi HCN dilakukan oleh bantuan tiosulfat dan enzim rodanase (sulfurtransferase) menjadi tiosianat kemudian dibuang lewat urin. Kadar HCN pada tubuh ikan uji setelah pemeliharaan berkisar 0,8–1,8 mg/100g. Kadar tersebut termasuk kategori rendah untuk dikonsumsi oleh manusia. Menurut WHO (2003) batas maksimum kadar sianida untuk konsumsi manusia yaitu 1,2 mg/kg berat badan. Hal ini menunjukkan bahwa ikan nila yang diberi pakan dengan sumbangan protein 50% dan 75% TBBKF dalam penelitian ini termasuk dalam kategori aman untuk dikonsumsi oleh manusia.
4 SIMPULAN DAN SARAN
Simpulan
Suplementasi lisin dapat meningkatkan retensi asam amino esensial, retensi protein dan kinerja pertumbuhan ikan nila. Tetapi penggunaan 50% tepung bungkil biji karet difermentasi cairan rumen domba masih lebih baik dalam mengantikan peranan tepung kedelai sebagai sumber protein pada pakan ikan nila.
Saran
Suplementasi multi asam amino esensial yang menjadi faktor pembatas lainya perlu dilakukan untuk meningkatkan penggunaan tepung bungkil biji karet yang difermentasi cairan rumen domba hingga 75% dalam menggantikan peranan tepung kedelai sebagai sumber protein dalam pakan ikan nila.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 1999. Official Methods of Analysis of AOAC Intl . 16th ed. Maryland (US): Association of Official Analytical Chemists.
[WHO] World Health Organization. 2003. Guidelines for Drinking-Water Quality, 3rd ed. Vol. 1. Recommendations. Geneva: World Health Organization. Affandi R, Sjafei DS, Rahardjo MF, Sulistiono. 2009. Fisiologi Ikan: Pencernaan
dan Penyerapan Makanan. Bogor (ID): IPB Press.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health progs. Disease in Asian Aquaculture II 1993:185–202.
Aragão C, Conceição LEC, Martins D, Rønnestad I, Gomes E, Dinis MT. 2004. A Balanced Dietary Amino Acid Profile Improves Amino Acid Retention in Post-Larval Senegalese Sole Solea senegalensis. Aquaculture 233: 293–304.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. Journal Fish Biology 5:771–781.
Collier HB. 1944. The standardization of blood haemoglobin determination.
Canadian Medical Association Journal 50:550–552.
16
Conceição L, Aragao C, Ronnestad I. 2010. Protein Metabolism and Amino Acid Requirements in Fish Larvae. Avances en Nutrición Acuícola X - Memorias del Décimo Simposio Internacional de Nutrición Acuícola, 8-10 de Noviembre. Mexico: San Nicolás de los Garza, NL 2010:250–263.
Dalibard P, Hess V, Tutour LL, Peisker M, Peris S, Gutierrez AP, Redshaw M. 2014. Amino Acids in AnimalNutrition. Belgium (BE). Fevana Publication with Compliments from Evonik Industries.
Direktorat Jenderal Perkebunan. 2014. Statistik Perkebunan Indonesia Komoditas Karet 2013-2015. Jakarta (ID): Direktorat Jenderal Perkebunan, Kementerian Pertanian Indonesia.
Fitriliyani I. 2010. Evaluasi Nilai Nutrisi Tepung Daun Lamtoro Gung Leucaena Leucophala Terhidrolisis dengan Ekstrak Enzim Cairan Rumen Domba
Ovis Aries terhadap Kinerja Pertumbuhan Ikan Nila Oreochromis niloticus.
Jurnal Akuakultur Indonesia 9:30–37.
Furuya WM, Furuya VRB. 2010. Nutritional Innovations on Amino Acids Supplementation in Nile Tilapia Diets. Revista Brasileira de Zootecnia 39:88–94.
Gaylord TG, Barrows FT. 2008. Multiple Amino Acid Supplementations to Reduce Dietary Protein In Plant-Based Rainbow Trout Oncorhynchusmykiss feeds. Aquaculture 287:180–184.
Harpaz S. 2005. L-Carnitine and its Attributed Function in Fish Culture and Nutrition: A Review. Aquaculture 249:3–21.
Huisman EA. 1987. The Principles of Fish Culture Production. Netherland (NL): Departement of. Aquaculture. Wegeningen University.
Jusadi D, Ekasari J, Kurniansyah A. 2013. Efektivitas Penambahan Enzim Cairan Rumen Domba pada Penurunan Serat Kasar dan Nilai Kecernaan Kulit Buah Kakao sebagai Bahan Pakan Ikan Nila. Jurnal Akuakultur Indonesia
12(1):43–51.
Li P, Mai K, Trushenski J, Wu G. 2008. New Developments in Fish Amino Acid Nutrition: Towards Functional and Environmentally Oriented Aquafeeds.
Review Article Springer-Verlag 2008:1–11.
Nunes AJP, Sa MVC, Browdy CL, Vazquez-Anon M. 2014. Review : Practical Supplementation of Shrimp and Fish Feeds with Crystalline Amino Acids.
Aquaculture 431:20–27
Ovie SO, Eze SS. 2013. Lysine Requirement and its Effect on The Body Compostion of Oreochromis niloticus Fingerlings. Journal of Fisheries and Aquatic Science 8(1):94–100.
Oyewusi PA, Akintayo ET, Olaofe O. 2007. The Proximate and Amino Acid Composition of Defatted Rubber Seed Meal. Journal of FoodAgriculture and Environment 5(3&4):115–118.
Pamungkas W, Jusadi D, Utomo NBP. 2011. Uji Kecernaan Bungkil Kelapa Sawit yang Dihidrolisis dengan Enzim Cairan Rumen Domba sebagai Pakan Benih Ikan Patin Siam Pangasiushypophthalmus. Prosiding Forum Inovasi Teknologi Akuakultur 2011:795–800.
17 ____________________. 2009. Pemanfaatan Bungkil Karet sebagai Bahan Baku Pakan Potensial untuk Ruminansia. Prosiding Lokakarya Nasional Sistem Integrasi Tanaman-Ternak 2009:243–253.
Rastogi SC. 1977. Essential of Animal Physiology. Wiley Eastern Limited. New Delhi (IN): Belangmore, Calcutta P 1977:204–233.
Robert RJ. 1978. The Pathophysiology and Systematic Pathology of Theleost.
dalam: Roberts RJ (editor). Fish Pathology. London (GB): Balliere Tindall. Robinson EH. 1991. Improvement of Cottonseed Meal Protein with Supplemental
Lysine in Feeds for Channel Catfish. Journal of Applied Aquaculture
1(2):1–9.
Salama M, EL-Abed FH, El-Dahhar AA. 2013. Effect of Amino Acids (Lysine and Methionine+Cyctine) Supplementation Rate on Growth Performance and Feed Utilization of Sea Bass Dentrarshus laborax Larvae. Journal of the Arabian Aquaculture Society 8(1):37–52.
Salasia SIO, Sulanjari D, Ratnawati A. 2001. Studi Hematologi Ikan Air Tawar. Biologi 2(12):710–723.
Suprayudi MA, Dimahesa W, Jusadi D, Setiawati M, Ekasari J. 2011. Suplementasi Crude Enzim Rumen Domba pada Pakan Berbasis Sumber Protein Nabati dalam Memacu Pertumbuhan Ikan Nila Oreochromis niloticus. Jurnal Ikhtiologi Indonesia 11(2):177–183.
Suprayudi MA, Inara C, Ekasari J, Priyoutomo N, Haga Y, Takeuchi T, Satoh S. 2014a. Preliminary Nutritional Evaluation of Rubber Seed and Defatted Rubber Seed Meals as Plant Protein Sources for Common Carp Cyprinus carpio L. Juvenile Diet. AquacultureResearch 2004:1–10.
Suprayudi MA, Irawan WS, Utomo NBP. 2014b. Evaluasi Tepung Bungkil Biji Karet Difermentasi Cairan Rumen Domba pada Pakan Ikan Patin. Jurnal AkuakulturIndonesia 13 (2):146–151.
Suprayudi MA, Takeuchi T, Mokoginta I, Kartikasari T. 2000. The effect of Additional Arginine in The High Deffated Soybean Meal Diet on The Growth Giant Gouramy Osphronemus gouramy Lac.. Fisheries Science. 66(4):551–557.
Suprayudi MA, Alim S, Setiawati M, Ekasari J, Junior MZ. 2015 Desember. Evaluation of Rubber Seeds Hevea brasilliensis Fermented Meal using Rumen Liquour as a Protein Source in Diet of Nile Tilapia Oreochromis niloticus. Aquaculture Nutrition, siap terbit.
Syamsunarno MB, Sunarno MTD. 2014. Kajian Biji Karet Hevea brasiliensis
sebagai Kandidat Bahan Baku Pakan Ikan. Jurnal Ilmu Pertanian dan Perikanan Desember 3(2):135–142
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrition. p. 179–229. In Watanabe T. Fish Nutrition and Mariculture. Tokyo (JP): Kanagawa International Fisheries Training Center.
Watanabe T. 1988. Nutrition and Mariculture JICA Textbook the General Aquaculture Course. Tokyo (JP): University of Fisheries. Department of Aquatic Bioscience.
Wu YV, Rosatj RR, Brown PB. 1998. Effects of Lysine on Growth of Tilapia Fed Diets Rich in Corn Gluten Meal. CerealChern 75(6):771–774.
18
Grass Carp Ctenopharyngodon idella. American Journal of Agricultural and Biological Sciences 5(2):222–227.
Zhou Q, Zao-He Wu, Shu-Yan Chi, Qi-Hui Yang. 2007. Dietary Lysine Requirement of Juvenile Cobia Rachycentron canadum. Aquaculture
273:634–640.
Zhu X, Lemme A, Kobler C. 2013. Benefit of DL-Methionine Supplementation in Cyprinid Nutrition. Evonik Amino NewsInformation for The Feed Industry
19 DAFTAR LAMPIRAN
Lampiran 1. Prosedur analisis proksimat (AOAC 1999) Kadar Air
1) Cawan dipanaskan dalam oven pada suhu 105oC-110oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1).
2) Bahan ditimbang 2-3 g (A).
3) Cawan dan bahan dipanaskan dalam oven pada suhu 105oC-110oC selama
4 jam kemudian dimasukkan dalam desikator selama 30 menit dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1).
2) Bahan ditimbang 2-3 g (A).
3) Cawan dan bahan dipanaskan dalam tanur pada suhu 600oC sampai menjadi abu kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2).
Kadar abu (%) = X2− X1 A x 100
Kadar Serat Kasar
1) Kertas saring dipanaskan dalam oven selama 1 jam pada suhu 105oC-110oC
setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1).
2) Sampel ditimbang sebanyak 0,5 g (A) lalu dimasukkan ke dalam erlenmeyer 250 mL.
3) H2SO4 0,3 N sebanyak 50 mL ditambahkan ke dalam erlenmeyer lalu
dipanaskan di atas pembakar bunsen selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 mL ditambahkan ke dalam erlenmeyer dan dipanaskan kembali selama 30 menit.
4) Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5) Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara
berturut-turut dengan 50 mL air panas, 50 mL H2SO4 0,3 N, 50 mL air panas
dan 25 mL aseton.
6) Kertas saring dan isinya lalu dimasukkan ke dalam cawan porselin dan kemudian dipanaskan dalam oven 105-110oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
7) Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau
20
1) Sampel ditimbang sebanyak 0,5 g dan dimasukkan ke dalam labu Kjeldahl. 2) Katalis (K2SO4+CuSO4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 g
dan dimasukkan ke dalam labu Kjeldahl.
3) Sebanyak 10 mL H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan
kemudian labu tersebut dipanaskan dalam rak oksidasi pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4) Larutan didinginkan lalu ditambah 100 mL air destilasi. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 mL. Larutan sampel siap untuk didestilasi. - Tahap destilasi
1) Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan Aquades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit
2) Erlenmeyer diisi 10 mL H2SO4 0.05 N dan ditambahkan 2 tetes indicator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3) Sebanyak 5 mL larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan aquades dan ditambahkan 10 mL NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup. 4) Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10
menit hingga terjadi pengembunan pada kondensor.
5) Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu pada permukaan larutan. Kondensor dibilas dengan aquades selama 1-2 menit.
- Tahap Titrasi
1) Larutan hasil destilasi dititrasi dengan larutan NaOH 0,05 N. 2) Volume hasil titrasi lalu dicatat.
3) Prosedur yang sama juga dilakukan pada blanko Kadar protein = . ∗x − x , ∗∗x x Keterangan:
Vb = volume hasil titrasi blanko (mL) Vs = volume hasil titrasi sampel (mL) S = bobot sampel (g)
21 Kadar Lemak
- Metode ekstraksi Soxhlet
1) Labu ekstraksi dipanaskan dalam oven pada suhu 105oC-110oC dalam waktu 1 jam. Kemudian didinginkan dalam desikator selama 30 menit dan bobot labu ditimbang (X1).
2) Sampel ditimbang sebanyak 3-5 g (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan diletakkan pemberat di atasnya.
3) N-hexan 100-150 mL dimasukkan ke dalam soxhlet hingga selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4) Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath
hingga cairan yang merendam sampel di dalam soxhlet berwarna bening. 5) Labu lalu dilepaskan dan tetap dipanaskan hingga N-hexan menguap. 6) Labu dan lemak yang tersisa dipanaskan dalam oven selama 15-60 menit,
kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2).
- Metode Folch
1) Labu silinder dioven terlebih dahulu pada suhu 105oC-110oC selama 1 jam, lalu didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2) Sampel ditimbang sebanyak 2-3 g (A) dan dimasukkan ke dalam gelas homogen dan ditambahkan larutan kloroform/methanol (20 x A), sebagian disisakan untuk membilas pada saat penyaringan.
3) Sampel dihomogenkan selama 5 menit lalu disaring dengan vacuum pump. 4) Sampel yang telah disaring tersebut dimasukkan ke dalam labu pemisah yang telah diberi larutan MgCI2 0,03 N (0,2 x C) lalu dikocok dengan kuat
minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5) Lapisan bawah yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform/methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum lalu ditimbang (X2).
Kadar lemak (%) = X2− X1 A x 100
22
Lampiran 2. Prosedur analisis asam amino esensial (AOAC 1999) Prosedur kerja
- Sampel ditimbang 0,25-0,5 g
- Sampel dimasukan ke dalam tabung 25 mL - Ditambahkan HCL 6 N 5-10 mL
- Dipanaskan semala 24 jam pada suhu 1000C - Disaring
- Diambil 30 µL sampel dan ditambahkan larutan pengering* - Dikeringkan/ divakumkan
- Ditambahkan 30 µL larutan derivatisasi* - Diamkan selama 20 menit
- Ditambahkan 2 mL natrium acetat 1 M - Injek ke alat (HPLC)
Keterangan :
Larutan pengering : methanol, picolotiocianat, triethylamine Larutan derivatisasi : methanol, Na-acetat, triethylamine Kondisi alat
Panjang gelombang : 254 nm Perhitungan:
� % = ℎ × � × � × � ×
Keterangan:
BM = berat molekul
Asam amino Berat molekul
23 Lampiran 3. Prosedur pengamatan gambaran darah
1. Pengambilan sampel darah ikan
Pertama-tama syringe dibilas dengan menggunakan anti koagulan (Na-Sitrat 3.8%). Kemudian sampel darah ikan diambil dari pembuluh vena dekat caudal yaitu pembuluh di dekat ekor. Penyuntikan dilakukan di daerah caudal (di bawah vertebrae) dengan arah menuju cranial. Darah diambil secara perlahan, kemudian darah yang telah diambil dengan syringe ditampung dalam eppendorf.
2. Pengukuran hemoglobin (Hb) (Collier 1944)
Darah ikan dalam eppendorf diambil dengan menggunakan pipet Sahli sampai 20 mm3/0.2 ml. Sampel darah dimasukkan ke dalam tabung Hb-meter, kemudian
tambahkan HCl 0.1 N dan diamkan selama 1 menit. Selanjutnya tambahkan akuades pada Hb-meter secara perlahan hingga warnanya sama dengan kedua larutan (indikator) yang terdapat di samping tabung Hb-meter. Kadar hemoglobin ditunjukan dengan skala yang terbaca (gr per 100 ml darah).
3. Pengukuran hematokrit (Anderson & Siwicki 1993)
Darah dihisap dengan menggunakan tabung mikrohematokrit hingga ¾ bagian tabungnya, kemudian ujung tabung ditutup dengan cara ditancapkan ke crytoceal. Darah dalam mikrohematokrit disentrifuge dengan kecepatan 3000 rpm selama 5 menit. Banyaknya sel darah ditunjukan oleh persentase panjang endapan dengan panjang totalnya. Rumus perhitungan kadar hematokrit yang digunakan adalah:
Hk = �x 100%
Keterangan
a: Panjang endapan
b: Panjang total volume darah
4. Pengamatan sel darah merah (Blaxhall & Daisley 1973)
Darah ikan diambil pada tiap perlakuan. Darah dihisap menggunakan pipet hemositometer berbulir merah sampai skala 0.5 lalu diencerkan dengan larutan Hayem sampai skala maksimum 10.1. Kedua ujung ditutup sejajar kemudian digoyangkan membentuk angka delapan selama 3-5 menit. Selanjutnya, larutan pada bagian ujung pipet yang tidak teraduk dibuang sebanyak 1 tetes. Tetesan berikutnya dimasukkan ke dalam hemositometer yang telah dilengkapi dengan kaca penutup. Perhitungan dilakukan di bawah mikroskop dengan perbesaran 400x dan jumlah eritrosit dihitung pada 5 kotak besar hemositometer dengan faktor pengenceran 200 kali. Berikut ini adalah rumus perhitungan total eritrosit:
�� 5 = 5 × 5 × × �� /
Keterangan :
N : jumlah sel darah yang teramati
24
5. Pengamatan sel darah putih (Blaxhall & Daisley 1973)
Darah ikan diambil dari masing-masing perlakuan. Darah dihisap menggunakan pipet hemasitometer berbulir putih sampai skala 0.5 lalu diencerkan
dengan larutan Turk’s sampai skala maksimum 11. Kedua ujung ditutup sejajar
kemudian digoyangkan membentuk angka delapan selama 3-5 menit. Setelah itu, larutan pada bagian ujung pipet yang tidak teraduk dibuang sebanyak 1 tetes. Tetesan berikutnya dimasukkan ke dalam hemasitometer yang telah dilengkapi dengan kaca penutup. Perhitungan dilakukan di bawah mikroskop dengan perbesaran 400x dan jumlah leukosit dihitung pada 5 kotak besar hemasitometer dengan faktor pengenceran 20 kali. Berikut ini adalah rumus perhitungan total leukosit:
��� 5 = 5 × 5 × × �� /
Keterangan
N : jumlah sel darah yang teramati
25 Lampiran 4. Prosedur Analisis Asam Sianida (HCN)
Sianida dalam sampel diubah menjadi sianogen chloride (CNCl) karena bereaksi dengan chloramin T pada pH kurang dari 8 terhidrolisa menjadi sianat. Setelah bereaksi secara sempurna, CNCl membentuk warna merah biru dengan asam barbiturat dalam piridin dan warna yang terjadi dibaca pada λ 578 nm.
Alat dan Bahan
- Timbangan analitik - Sentrifuge
- Pipet Otomatis - Tabung reaksi - Rak tabung reaksi - Vortex
- Spektrofotometer - NaH2PO4.H2O
- Chloramin T - Pyridin - HCl 37% - Standar KCN Reagen/Pereaksi :
1) Buffer CN ( 138 gram NaH2PO4.H2O dilarutkan menjadi 1 liter aquadest)
2) Chloramin T 1% ( 1 gram dilarutkan menjadi 100 ml aquadest)
3) Asam Barbiturat – Pyridin ( 3 gram asam barbiturat ditambah 15 ml pyridin dan 3 ml HCl 37%, ditambahkan aquadest hingga volumenya 50 ml) Prosedur Kerja :
1) Sampel sebanyak ± 1 gram , dilarutkan dengan aquadest sebanyak 10 ml, ditutup dan didiamkan semalam.
2) Sampel disentrifuge dengan kecepatan 5000 rpm.
3) Supernatan sampel dipipet sebanyak 0.1 ml, lalu dimasukkan kedalam tabung reaksi dan ditambahkan aquadest sebanyak 1.9 ml.
4) Dimasukkan kedalamnya 2 ml larutan buffer CN dan 0.5 ml Chloramin T 1%.
5) Divortex/dihomogenkan dan didiamkan selama 2 menit. Setelah itu ditambahkan 0.5 ml larutan asam barbiturat-pyridin, kemudian dihomogenkan kembali.
6) Dibuat deret standar dari larutan standar KCN 10 ppm, dengan deret 0, 0.2, 0.4, 0.6, 0.8, 1 ppm.Dan dilakukan prosedur yang sama dengan sampel, yaitu tahap 3 sampai tahap 5.
26
RIWAYAT HIDUP
Penulis dilahirkan di Majalengka pada tanggal 29 Mei 1990 dari Bapak Ucup Sulaeman dan Ibu Uyinah. Penulis merupakan anak ke dua dari tiga bersaudara. Penulis menyelesaikan pendidikan akademik di SDN Sindangwangi 2 Kabupaten Majalengka, SMPN 1 Sindangwangi Kabupaten Majalengka, SMAN 1 Rajagaluh Kabupaten Majalengka, dan diterima di Unsoed (Universitas Jenderal Soedirman) melalui jalur PPSB tahun 2008 pada program studi Biologi, Fakultas Biologi.
Pada tahun 2013, penulis melanjutkan studinya dengan menempuh Program Magister pada program studi Ilmu Akuakultur, Sekolah Pascasarjana, IPB. Program Magister ditempuh melalui Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) yang diberikan oleh Direktorat Jendral Pendidikan Tinggi (Dikti) Kementerian Riset, Teknologi dan Pendidikan Tinggi (Kemenristek Dikti). Penelitian yang dilakukan penulis dalam menyelesaiakn studi magister berjudul “Suplementasi lisin pada tepung bungkil biji karet Hevea brasiliensis difermentasi cairan rumen domba dalam pakan ikan nila Oreochromis niloticus”. Artikel yang berjudul “Peningkatan kualitas pakan ikan nila Oreochromis niloticus berbahan tepung bungkil biji karet melalui suplementasi asam amino” dimuat pada Jurnal Akuakultur Indonesia volume 15 nomor 1 Bulan Januari 2016. Karya ilmiah tersebut merupakan bagian dari penelitian tesis penulis.