ABSTRAK
NURI IZZATIL WAFA. Uji Aktivitas Antibakteri Fraksi Air Daun Gambir
(
Uncaria gambir
Roxb) dengan Mikrodilusi dan Analisis Komponen
Penyusunnya. Dibimbing oleh LAKSMI AMBARSARI dan WARAS
NURCHOLIS.
Daun gambir (
Uncaria gambir
Roxb)
memiliki potensi sebagai obat
tradisional yang telah digunakan sejak lama oleh sebagian masyarakat. Hal ini
mendorong para peneliti untuk menguji aktivitas antibakteri daun gambir. Metode
yg umum digunakan yaitu difusi agar yang memiliki beberapa keterbatasan,
diantaranya membutuhkan waktu yang lama dan bahan yang lebih banyak.
Metode yang sedang dikembangkan yaitu metode cawan mikro (mikrodilusi) yang
menyediakan teknik penentuan konsentrasi hambat tumbuh minimum (KHTM)
dari sejumlah sampel yang berbeda dan membutuhkan sampel dalam jumlah yang
sedikit. Metode ini juga dapat digunakan untuk beragam jenis mikroorganisme,
murah, dan menghasilkan hasil yang yang dapat diulang. Penelitian ini bertujuan
menentukan konsentrasi hambat tumbuh minimum fraksi air daun gambir dengan
metode mikrodilusi dan melakukan analisis komponen yang terkandung di
dalamnya dengan GC-MS pirolisis. Daun gambir diekstraksi dengan
menggunakan metanol-air, lalu dipartisi dengan menggunakan n-heksana dan
kloroform. Ekstraksi daun gambir menghasilkan tiga jenis fraksi, yaitu fraksi
kloroform, n-heksana, dan air dengan masing-masing rendemen sebesar 0.048 %,
0.031 % , dan 3.033 %. Fraksi yang digunakan untuk analisis selanjutnya adalah
fraksi air. Konsentrasi hambat tumbuh minimum fraksi air daun gambir terhadap
pertumbuhan
E.coli
dan
S.aureus
sebesar 0.05 mg/mL, sedangkan konsentrasi
bunuh minimumnya belum dapat ditentukan karena tidak berada pada
range
konsentrasi 0.01-40 mg/mL. Hasil identifikasi dengan GC-MS pirolisis
menunjukkan bahwa fraksi air daun gambir mengandung senyawa pirokatekol
yang merupakan fragmen penyusun katekin.
ABSTRACT
NURI IZZATIL WAFA. Antibacterial Activities Assay of Aqueous Fraction of
Gambir Leaves (
Uncaria gambir
Roxb) by Microdilution and its Components
Analysis. Under the direction of LAKSMI AMBARSARI and WARAS
NURCHOLIS
The potency of gambir (
Uncaria gambir
Roxb) leaves as a traditional medicine
had known since long time ago. This is the reason for some researchers to
evaluate the antibacterial activities of gambir leaves. The method that usually used
for antibacterial assay is agar-diffusion which has some weakness, i.e. need more
time and materials. Nowadays, microdilution become antibacterial assay method
that has been developed in many countries. Microdilution gives a useful technique
to determine MIC of some different samples, and require only a little number of
the sample. This method also used for wide variety of microorganisms, not
expensive, and gives a reproducible result. This research aimed to determine
minimal inhibitory of aqueous fraction of Gambir leaves by microdilution method
and identified its components by pyrolisis GC-MS. Gambir leaves extracted with
methanol-water solution, and then being separated by using hexane and
chloroform. Gambir leaves extraction produce three fractions, i.e. chloroform,
hexane, and aqueous fraction which has yield 0.048 %, 0.031 % , and 3.033 %
respectively. Fraction which is used for further analysis is aqueous fraction. The
minimal inhibitory concentration of aqueous fraction of Gambir leaves toward
1
PENDAHULUAN
Tanaman gambir merupakan tanaman perdu dari famili Rubiaceae (kopi-kopian) yang memiliki nilai ekonomi tinggi karenamengandung asam kateku tannat (tanin), katekin, pirokatekol, florisin, lilin, dan fixed oil. Tanaman ini telah banyak digunakan sebagai obat tradisional, diantaranya untuk obat luka bakar, obat diare dan disentri serta obat kumur-kumur pada sakit kerongkongan (Nazir 2000).
Berbagai potensi gambir telah banyak diteliti, diantaranya sebagai anti nematode (Bursapeleucus xyphylus) dari ekstrak gambir (Alen et al. 2004), bahan infus untuk penyembuhan terhadap gangguan pada pembuluh darah (Sukati & Kusharyono 2004), dan obat tukak lambung (Tika et al. 2004). Penelitian telah dilakukan sehubungan dengan kemampuan ekstrak gambir sebagai anti mikroba (Rahayuningsih et al. 2004), anti bakteri (Lisawati 2004), serta sebagai bahan toksisitas terhadap organ ginjal, hati dan jantung (Armenia et al. 2004).
Potensi antibakteri yang dimiliki tanaman gambir mendorong penelitian aktivitas antibakterinya. Berbagai metode untuk mengukur nilai konsentrasi hambat minimum (KHTM) telah digunakan, seperti difusi agar dan dilusi (pengenceran) secara berseri. Metode difusi agar telah digunakan sejak lama untuk mengetahui aktivitas antibakteri ekstrak tanaman. Teknik difusi agar bekerja baik dengan inhibitor tertentu, tetapi akan menimbulkan masalah ketika menentukan ekstrak yang mengandung komponen yang tidak diketahui. Dampak antimikroba dapat dihambat atau ditingkatkan oleh kontaminan. Jenis agar, konsentrasi garam, suhu inkubasi, dan ukuran molekul senyawa antibakteri dapat mempengaruhi hasil yang diperoleh dengan teknik difusi agar. Teknik ini juga membutuhkan waktu yang lama dan bahan materi yang cukup banyak (Ellof 1998). Keterbatasan-keterbatasan tersebut menjadi alasan untuk mencari metode lain yang lebih baik dan ekonomis.
Metode yang dapat dijadikan alternatif untuk menentukan konsentrasi hambat tumbuh minimum ekstrak tanaman adalah metode dilusi yang mencakup makrodilusi dan mikrodilusi. Metode mikrodilusi sedang dikembangkan karena memiliki sensitivitas yang lebih tinggi dibandingkan dengan teknik difusi agar. Menurut Ellof (1998), sensitivitas mikrodilusi inimencapai 30 kali lebih sensitif. Teknik mikrodilusi dapat digunakan untuk
beberapa sampel yang berbeda dengan jumlah sampel yang sedikit. Hal ini sangat berguna jika jumlah senyawa antibakteri yang didapatkan sedikit dan terbatas. Teknik mikrodilusi juga dapat membedakan antara efek bakteriostatik dan bakterisidal serta dapat menentukan nilai konsentrasi hambat tumbuh minimum (KHTM) (Langfield et al. 2004).
Mikrodilusi tidak membutuhkan waktu yang lama karena pengujian dilakukan dalam waktu satu kali pada satu microplate dengan jumlah sumur yang banyak.Metode mikrodilusi ini dapat digunakan untuk berbagai macam mikroorganisme, murah, dan menghasilkan hasil dapat diulang.Mikrodilusi menggunakan sampel yang diencerkan secara berseri. Volume kultur bakteri yang dimasukkan ke dalam sumur seragam. Ukuran inokulum yang biasa digunakan yaitu 106 sampai 108 CFU/mL. Kultur bakteri yang digunakan memiliki optical density 0.4 pada 620 nm atau kultur yang telah distandardisasi dengan larutan standar McFarland 0.5 (Baris et al. 2006). Larutan McFarland 0.5 adalah larutan standar yang terdiri dari barium klorida dan asam sulfat. Volume dan ukuran sel sama untuk semua perlakuan, maka pengaruh konsentrasi sampel yang berbeda-beda dalam menghambat pertumbuhan bakteri uji dapat diamati.
Penelitian ini bertujuan menentukan konsentrasi hambat tumbuh minimum fraksi air daun gambir (Uncaria gambir Roxb) dengan metode mikrodilusi berdasarkan kekeruhan, serta mengidentifikasi senyawa yang terkandung di dalamnya dengan Pyrolysis Gas Chromatography and Mass Spectrometry (Py GC-MS). Hipotesis yang diajukan adalahkonsentrasi hambat tumbuh minimum fraksi air daun gambir dapat ditentukan dengan metode mikrodilusi. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai metode mikrodilusi sebagai metode alternatif yang memberikan banyak keuntungan untuk menguji aktivitas suatu senyawa antibakteri yang berasal dari suatu jaringan.
TINJAUAN PUSTAKA
GambirPENDAHULUAN
Tanaman gambir merupakan tanaman perdu dari famili Rubiaceae (kopi-kopian) yang memiliki nilai ekonomi tinggi karenamengandung asam kateku tannat (tanin), katekin, pirokatekol, florisin, lilin, dan fixed oil. Tanaman ini telah banyak digunakan sebagai obat tradisional, diantaranya untuk obat luka bakar, obat diare dan disentri serta obat kumur-kumur pada sakit kerongkongan (Nazir 2000).
Berbagai potensi gambir telah banyak diteliti, diantaranya sebagai anti nematode (Bursapeleucus xyphylus) dari ekstrak gambir (Alen et al. 2004), bahan infus untuk penyembuhan terhadap gangguan pada pembuluh darah (Sukati & Kusharyono 2004), dan obat tukak lambung (Tika et al. 2004). Penelitian telah dilakukan sehubungan dengan kemampuan ekstrak gambir sebagai anti mikroba (Rahayuningsih et al. 2004), anti bakteri (Lisawati 2004), serta sebagai bahan toksisitas terhadap organ ginjal, hati dan jantung (Armenia et al. 2004).
Potensi antibakteri yang dimiliki tanaman gambir mendorong penelitian aktivitas antibakterinya. Berbagai metode untuk mengukur nilai konsentrasi hambat minimum (KHTM) telah digunakan, seperti difusi agar dan dilusi (pengenceran) secara berseri. Metode difusi agar telah digunakan sejak lama untuk mengetahui aktivitas antibakteri ekstrak tanaman. Teknik difusi agar bekerja baik dengan inhibitor tertentu, tetapi akan menimbulkan masalah ketika menentukan ekstrak yang mengandung komponen yang tidak diketahui. Dampak antimikroba dapat dihambat atau ditingkatkan oleh kontaminan. Jenis agar, konsentrasi garam, suhu inkubasi, dan ukuran molekul senyawa antibakteri dapat mempengaruhi hasil yang diperoleh dengan teknik difusi agar. Teknik ini juga membutuhkan waktu yang lama dan bahan materi yang cukup banyak (Ellof 1998). Keterbatasan-keterbatasan tersebut menjadi alasan untuk mencari metode lain yang lebih baik dan ekonomis.
Metode yang dapat dijadikan alternatif untuk menentukan konsentrasi hambat tumbuh minimum ekstrak tanaman adalah metode dilusi yang mencakup makrodilusi dan mikrodilusi. Metode mikrodilusi sedang dikembangkan karena memiliki sensitivitas yang lebih tinggi dibandingkan dengan teknik difusi agar. Menurut Ellof (1998), sensitivitas mikrodilusi inimencapai 30 kali lebih sensitif. Teknik mikrodilusi dapat digunakan untuk
beberapa sampel yang berbeda dengan jumlah sampel yang sedikit. Hal ini sangat berguna jika jumlah senyawa antibakteri yang didapatkan sedikit dan terbatas. Teknik mikrodilusi juga dapat membedakan antara efek bakteriostatik dan bakterisidal serta dapat menentukan nilai konsentrasi hambat tumbuh minimum (KHTM) (Langfield et al. 2004).
Mikrodilusi tidak membutuhkan waktu yang lama karena pengujian dilakukan dalam waktu satu kali pada satu microplate dengan jumlah sumur yang banyak.Metode mikrodilusi ini dapat digunakan untuk berbagai macam mikroorganisme, murah, dan menghasilkan hasil dapat diulang.Mikrodilusi menggunakan sampel yang diencerkan secara berseri. Volume kultur bakteri yang dimasukkan ke dalam sumur seragam. Ukuran inokulum yang biasa digunakan yaitu 106 sampai 108 CFU/mL. Kultur bakteri yang digunakan memiliki optical density 0.4 pada 620 nm atau kultur yang telah distandardisasi dengan larutan standar McFarland 0.5 (Baris et al. 2006). Larutan McFarland 0.5 adalah larutan standar yang terdiri dari barium klorida dan asam sulfat. Volume dan ukuran sel sama untuk semua perlakuan, maka pengaruh konsentrasi sampel yang berbeda-beda dalam menghambat pertumbuhan bakteri uji dapat diamati.
Penelitian ini bertujuan menentukan konsentrasi hambat tumbuh minimum fraksi air daun gambir (Uncaria gambir Roxb) dengan metode mikrodilusi berdasarkan kekeruhan, serta mengidentifikasi senyawa yang terkandung di dalamnya dengan Pyrolysis Gas Chromatography and Mass Spectrometry (Py GC-MS). Hipotesis yang diajukan adalahkonsentrasi hambat tumbuh minimum fraksi air daun gambir dapat ditentukan dengan metode mikrodilusi. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai metode mikrodilusi sebagai metode alternatif yang memberikan banyak keuntungan untuk menguji aktivitas suatu senyawa antibakteri yang berasal dari suatu jaringan.
TINJAUAN PUSTAKA
Gambir2
Uncaria, dan spesies Uncaria gambir Roxb (Dhalimi 2006).
Tanaman gambir memiliki batang tegak, bulat, percabangan simpodial, warna cokelat pucat. Daunnya tunggal, berhadapan, bentuk lonjong, tepi bergerigi, pangkal bulat, ujung meruncing, dan berwarna hijau (Gambar 1). Bunganya merupakan bunga majemuk, memiliki mahkota sebanyak 5 helai yang berbentuk lonjong, terletak di ketiak daun, warna ungu, buah berbentuk bulat telur, panjang lebih kurang 1.5 cm, warna hitam (Soedibyo 1998).
Komponen utama tanaman gambir yaitu katekin dan asam kateku tannat (Hayani 2003). Menurut Amos et al. (2004), katekin termasuk ke dalam struktur flavonoid, tidak berwarna, dan dalam keadaan murni sedikit tidak larut dalam air dingin tetapi sangat larut dalam air panas, larut dalam alkohol dan etil asetat. Komposisi kimia ekstrak gambir adalah katekin 7-33%, asam kateku tannat 20-55%, pirokatekol 20-30%, gambir fluorensi 1-3%, kateku merah3-5%, kuersetin 2-4%, fixed oil 1-2%, lilin, dan sedikit alkaloid (Nazir 2000). Katekin dan asam kutekutannat merupakan komponen yang memiliki potensi sebagai zat antibakteri. Tanaman gambir berguna untuk zat pewarna dalam industri batik, industri penyamak kulit, ramuan makan sirih sebagai obat, dan digunakan pula sebagai bahan baku pembuatan permen dalam acara adat di India serta sebagai penjernih pada industri air (Susilobroto 2000).
Potensi tanaman gambir sebagai senyawa antibakteri membuat gambir banyak digunakan sebagai obat, diantaranya sebagai obat tukak lambung (Tika et al. 2004) dan sebagai bahan baku obat sakit perut dan sakit gigi (Nazir 2000). Penelitian yang dilakukan oleh Idris (1997) membuktikan bahwa patogen Fusarium sp sebagai penyebabpenyakit bercak daun tanaman klausena dapat dikendalikan dengan menggunakan pestisida nabati yang berasal dari ekstrak daun gambir.
Gambar 1 Tanaman Gambir.
Gambir juga banyak manfaatnya untuk dunia farmasi, diantaranya sebagai perangsang sistem syaraf otonom (Kusharyono 2004), bahan anti feedan terhadap hama Spodoptera litura Fab. (Handayani et al. 2004). Senyawa yang terkandung di dalam tanaman gambir kebanyakan adalah senyawa flavonoid dan senyawa fenolik lainnya. Flavonoid adalah suatu kelompok senyawa fenol terbesar yang ditemukan di alam. Senyawa-senyawa ini merupakan zat warna merah, ungu dan biru, dan sebagian zat warna kuning yang ditemukan dalam tumbuhan. Flavonoid memiliki kerangka dasar karbon yang terdiri atas 15 atom karbon, di mana dua cincin benzen (C6) terikat pada suatu rantai propan (C3) sehingga membentuk susunan C6-C3-C6 (Lenny 2006).
Flavonoid merupakan senyawa metabolit sekunder yang terdapat pada tanaman hijau, kecuali alga. Flavonoid yang banyak ditemukan pada tumbuhan tingkat tinggi adalah flavon, flavonol, isoflavon, flavanon, kalkon dan dihidrokhalkon, proantosianidin dan antosianin, serta auron dan dihidroflavonol.
Flavon, flavonol, dan antosianidin adalah jenis yang banyak ditemukan di alam sehingga sering disebut sebagai flavonoid utama. Banyaknya senyawa flavonoid ini disebabkan oleh berbagai tingkat hidroksilasi, alkoksilasi atau glikosilasi dari struktur utama (Lenny 2006). Flavonoid berfungsi sebagai antibakteri dengan cara membentuk senyawa kompleks terhadap protein ekstraseluler yang mengganggu integritas membran sel bakteri (Cowan 1999).
Antibakteri
Antibakteri adalah zat yang dapat mengganggu pertumbuhan atau bahkan mematikan bakteri dengan cara mengganggu metabolisme mikroba yang merugikan. Antibakteri hanya dapat digunakan jika mempunyai sifat toksik selektif, artinya dapat membunuh bakteri yang menyebabkan penyakit tetapi tidak beracun bagi penderitanya. Faktor-faktor yang berpengaruh pada aktivitas zat antibakteri adalah pH, suhu stabilitas senyawa, jumlah bakteri yang ada, lamanya inkubasi, dan aktivitas metabolisme bakteri.
pengangkutan aktif melalui membran sel, antibakteri yang menghambat sintesis protein, dan antibakteri yang menghambat sintesis asam nukleat sel. Aktivitas antibakteri dibagi menjadi 2 macam yaitu aktivitas bakteriostatik (menghambat pertumbuhan tetapi tidak membunuh patogen) dan aktivitas bakterisidal (dapat membunuh patogen dalam kisaran luas). Pengendalian mikroorganisme khususnya bakteri, dapat dilakukan secara kimia seperti pemberian antibiotik dan zat-zat kimia lainnya, ataupun pengendalian secara fisik seperti pemberian panas, pendinginan, radiasi, dan pengeringan (Brooks et al. 2001).
Metode Pengujian Aktivitas Antibakteri
Uji aktivitas antibakteri dapat dilakukan dengan metode difusi dan metode pengenceran (dilusi). Disc diffusion test atau uji difusi cakram dilakukan dengan mengukur diameter zona bening (clear zone) yang merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam ekstrak. Syarat jumlah bakteri untuk uji kepekaan (sensitivitas) yaitu 105-108 CFU/mL (Hermawan et al. 2007).
Metode difusi merupakan salah satu metode yang sering digunakan. Metode difusi dapat dilakukan dengan 3 cara yaitu metode silinder, metode lubang (sumuran) dan metode cakram kertas. Metode lubang (sumuran) yaitu membuat lubang pada agar padat yang telah diinokulasi dengan bakteri. Jumlah dan letak lubang disesuaikan dengan tujuan penelitian, kemudian lubang diinjeksikan dengan ekstrak yang akan diuji. Setelah dilakukan inkubasi, pertumbuhan bakteri diamati untuk melihat ada tidaknya daerah hambatan di sekeliling lubang (Kusmayati & Agustini 2007). Prinsip metode pengenceran adalah senyawa antibakteri diencerkan hingga diperoleh beberapa macam konsentrasi, kemudian masing-masing konsentrasi ditambahkan suspensi bakteri uji dalam media cair. Perlakuan tersebut akan diinkubasi pada suhu 37ºC selama 18-24 jam dan diamati ada atau tidaknya pertumbuhan bakteri, yang ditandai dengan terjadinya kekeruhan. Larutan uji senyawa antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan bakteri uji, ditetapkan sebagai Kadar Hambat Tumbuh Minimum (KHTM) atau Minimal Inhibitory Concentration (MIC). Selanjutnya biakan dari semua tabung yang jernih diinokulasikan pada media agar padat, diinkubasikan pada suhu 37ºC selama 18-24
jam, lalu diamati ada atau tidaknya koloni bakteri yang tumbuh. Media cair yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai Kadar Bunuh Minimal (KBM) atau Minimal Bactericidal Concentration (MBC) (Pratiwi 2008).
Metode Mikrodilusi
Metode mikrodilusi saat ini sedang dikembangkan karena metode difusi agar yang sering digunakan memiliki keterbatasan. Metode mikrodilusi memungkinkan penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM) dari beberapa macam sampel dan sampel yang dibutuhkan dalam jumlah sedikit.Hal ini penting jika senyawa antimikrob yang ingin diuji jumlahnya terbatas, seperti yang terjadi pada banyak bahan alam. Metode ini juga dapat digunakan untuk mikroorganisme yang beragam, tidak mahal, dan menghasilkan hasil yang dapat diulang (Ellof 1998). Selain itu, dengan menggunakan metode mikrodilusi, dapat dibedakan antara efek bakteriostatik dan bakterisidal, serta dapat menentukan nilai KHTM secara kuantitatif (Langfield et al. 2004). Mikrodilusi lebih sensitif dibandingkan dengan metode lain. Pengerjaan teknisnya tidak membutuhkan keahlian yang tinggi dan hemat waktu.
Metode mikrodilusi menggunakan microplate sebagai instrumennya. Setiap sumur pada microplate diisi oleh media pertumbuhan, ekstrak yang ingin diuji aktivitasnya, dan kultur bakteri.Jumlah kulturbakteri yang digunakan pada metode mikrodilusi biasanya 1x106CFU/mL (Basri & Fan 2005). Beberapa peneliti menggunakan kultur bakteri yang memiliki optical density 0.4 (fase log) pada panjang gelombang 620 nm atau kultur cair yang telah distandardisasi dengan larutan standar kekeruhan McFarland 0.5 (Baris et al. 2006). Larutan McFarland dibuat dari campuran barium klorida dan asam sulfat sehingga menghasilkan larutan yang keruh. Kultur cair bakteri disamakan absorbannya dengan absorban McFarland 0.5 (antara 0.08 sampai 0.1) sehingga dihasilkan bakteri dengan jumlah 1.5 x 108CFU/mL.
4
keberadaan pertumbuhan di microplate (Devienne & Raddi 2002). Penggunaan indikator kolorimetrik menghilangkan kebutuhan untuk plate reader dan mencegah keambiguan dengan pengamatan visual. Larutan indikator yang digunakan diantaranya adalah garam tetrazolium (Ellof 1998) dan diasetat fluorescein (Chand 1994). Namun, berdasarkan penelitian Kreander et al. (2005), larutan tersebut tidak sesuai sehingga mendorong pada pengendapan atau fluoresens non-spesifik.
Beberapa penelitian menggunakan larutan indikator pada metode mikrodilusi. Mothana et al. (2010) meneliti aktivitas antimikroba minyak atsiri dari kulit kayu tanaman Commiphora ornifolia dengan metode mikrodilusi dengan menggunakan larutan indikator p-iodonitro-tetrazolium violet. Perubahan warna kuning menjadi merah muda mengindikasikan reduksi larutan akibat pertumbuhan bakteri. Rakotoniriana et al. (2009) menguji aktivitas antibakteri 23 tanaman endemik di Madagaskar dengan metode mikrodilusi dengan menggunakan larutan indikator methylthiazoyltetrazolium chloride (MTT). Konsentrasi hambat tumbuh minimum ekstrak tanaman-tanaman tersebut adalah konsentrasi terkecil yang tidak menunjukkan adanya perubahan warna MTT.
Kelemahan penggunaan larutan indikator dalam mikrodilusi membuat Kreander et al. (2005) menemukan pengukuran absorbansi sederhana suspensi bakteri untuk menjadi pengukuran pertumbuhan yang terpercaya dan reproducible, yaitu metode mikrodilusi berdasarkan kekeruhan. Kekeruhan dijadikan sebagai indikator ada atau tidaknya pertumbuhan bakteri. Konsentrasi terkecil yang menunjukkan kejernihan ditetapkan sebagai konsentrasi hambat tumbuh minimum ekstrak.Beberapa penelitian menggunakan metode mikrodilusi ini. Zaenab et al. (2004) menguji aktivitas antibakteri siwak (Salvadora persica Linn.) terhadap bakteri Streptococcus mutans dan Bacteroides melaninogenicus dengan melihat kekeruhan yang terjadi. Basri &Fan (2005) menentukan nilai KHTM ekstrak air dan ekstrak aseton tanaman quercus infectoria dengan mengamati kekeruhan pada microplate setelah diinkubasi selama satu malam.Teknik ini juga digunakan oleh Darwish dan Aburjai (2010) untuk menentukan konsentrasi hambat tumbuh minimum ekstrak tanaman terhadap Escherichia coli.
Teknik mikrodilusi dengan pembacaan spektrofotometer menggunakan absorban
pada panjang gelombang 620 nm. Konsentrasi yang menunjukkan penurunan nilai absorban yang tajam (Devienne & Raddi 2002) atau konsentrasi terendah yang menunjukkan nilai absorban nol dianggap sebagai KHTM (Salie et al. 1996). Beberapa penelitianmenggunakan metode ini. Yogisha S&Koteshwara AR (2009) melakukan metode mikrodilusi berdasarkan metode turbidimetri, yaitu pengukuran absorban pada panjang gelombang 620 nm dengan plate reader. Pengujian aktivitas antibakteri kitosan terhadap bakteri Staphylococcus aureus yang dilakukan oleh Tin et al. (2010) menggunakan panjang gelombang 600 nm untuk pengukuran absorban, sama halnya dengan penelitian yang dilakukan oleh Tadtong et al. (2009) mengenai pengujian aktivitas minyak atsiri dari tanaman Etlingera punicea (Roxb.) yang juga menggunakan panjang gelombang 600 nm.
Kromatografi Gas-Spektrometri Massa (GC-MS)
Kromatografi adalah metode pemisahan secara fisiko-kimia senyawa yang terkandung di dalam suatu larutan, cair maupun gas. Kromatografi memisahkan sebuah sampel menjadi beberapa fraksi dan mengukurnya atau mengidentifikasi fraksi tersebut. Komponen yang akan dipisahkan didistribusikan di antara dua fase yang tidak bercampur. Salah satu komponen penting dalam kromatografi adalah fase diam, yang bisa berbentuk padatan atau cairan. Fase diam ditarik ke sebuah bahan pendukung yang inert. Sampel yang biasanya berbentuk uap atau terlarut dalam pelarut, digerakkan melalui fase diam dengan didorong oleh sebuah cairan atau gas, yang disebut sebagai fase gerak. Saat fase gerak bergerak melewati fase tetap, komponen sampel mengalami sejumlah pertukaran (partisi) di antara dua fase. Hal yang dimanfaatkan dalam kromatografi adalah perbedaan dalam sifat kimia dan fisik dari komponen sampel. Perbedaan ini menyebabkan perpindahan (migrasi) setiap komponen. Ketika sampel telah muncul dari corong kromatograf, hal itu dinamakan terelusi(Patnaik 2004).
cair berdasarkan bentuk fisik fase gerak yang digunakan (Patnaik 2004).
Sejak tahun 1952, kromatografi gas berkembang sangat pesat. Senyawa apapun, organik maupun anorganik, yang dapat mendapat tekanan uap sebesar 60 torr (suhu kolom dapat meningkat sampai 350°C) dapat dielusi dari kolom kromatografi gas. Keterbatasan kromatografi gas adalah sampel atau derivatifnya harus volatil pada suhu kolom yang terprogram. Komponen dasar sebuah kromatografi gas adalah gas pembawa dengan regulator tekanan dan pengontrol aliran, katup dan splitter, kolom pemisah, detektor, oven dengan suhu yang diatur, dan perekam data. Spektrofotometer massa memiliki komponen-komponen, yaitu sistem masuknya sampel, sumber ion, sistem akselarasi ion, penganalisis massa, sistem pengumpulan-ion (biasanya detektor pengganda elektron), sistem data, dan sistem vakum. Tekanan pada spektrofotometer harus kurang dari 10-6 torr untuk menghindari tabrakan ion pada jalannya (Patnaik 2004).
Instrumen GC-MS merupakan gabungan antara kromatografi gas dan spektrometri massa. Kromatografi gas dapat memisahkan senyawa volatil dan semi volatil dengan resolusi yang baik, tetapi tidak dapat mengidentifikasi senyawa-senyawa tersebut. Spektroskopi massa dapat menyediakan informasi struktur detail sebagian besar senyawa, tetapi tidak dapat memisahkan senyawa tersebut. Oleh karena itu, kombinasi antara kedua teknik tersebut disarankan (Jeffery et al. 1989).
Ada tiga syarat untuk GC-MS, yaitu: volume gas dari kromatografi gas harus dikurangi sehingga sesuai dengan katup spektrofotometer massa dan juga konsentrasi analit dikurangi, spektrum analit harus diperoleh dalam watu yang cepat, serta sistem data harus mampu mengatasi volume data yang dihasilkan oleh scanning cepat spektrofotometer massa. Penghubung langsung dengan kolom tabung terbuka adalah ujung yang dipanjangkan dari kromatografi gas ke sumber ion pada spektrometr massa.Aliran kromatografi gas cukup lambat dan pompa vakumnya cukup tinggi sehingga vakum yang dibutuhkan oleh spektrofotometer massa dapat dijaga tanpa penghubung apapun. Kerugian yang didapatkan dari GC-MS adalah semua buangan kolom tersimpan di sumber ion spektrofotometer massa sehingga terkontaminasi lebih cepat. Selain itu, kolom GC tidak bisa diubah tanpa menghentikan MS
karena tidak ada cara untuk memisahkan satu dengan yang lain. Penghubung split terbuka membuat jarak antara kolom GC dan katup MS yang dijaga pada tekanan atmosfer dengan menggunakan sumber gas sekunder dan vakum pemisah. Jumlah gas murni dapat dikontrol untuk mematikan kolom tanpa mematikan MS. Selain itu, komponen sampel yang tidak dinginkan dapat dihilangkan sebelum memasuki MS (Patnaik 2004).
Salah satu bentuk GC-MS adalah GC-MS pirolisis. GC-MS pirolisis adalah sebuah teknik untuk mempirolisis sampel yang non-volatil di bawah kondisi yang diatur, biasanya tanpa oksigen dan dekomposisi produk dipisahkan di dalam kolom kromatografi gas. Kromatogram yang dihasilkan (pirogram) digunakan untuk analisis kuantitatif dan kualitatif sampel. GC-MS pirolisis telah banyak digunakan untuk banyak macam sampel, tetapi kegunaan utamanya adalah untuk analisis polimer untuk investigasi polimer alami ataupun polimer sintetik (Jeffery et al. 1989).
Bakteri Uji
Staphylococcus aureus
Staphylococcus berasal dari kata staphyle yang berarti kelompok buah anggur dan kokus yang berarti benih bulat. Staphylococcus aureus berbentuk bola dengan diameter 1 µm yang tersusun dalam bentuk kluster yang tidak teratur. Stafilokokus bersifat nonmotil dan tidak membentuk spora. Staphylococcus aureus dapat menyebabkan pneumonia, meningitis, empiema, endokarditis atau sepsis dengan supurasi di tiap organ (Jawetz et al. 2001).
Bakteri S. aureus berbentuk seperti untaian buah anggur yang bulat sferis. Pada lempeng agar, koloninya berbentuk bulat, diameter 1-2 mm, cembung, buram, mengkilat dan konsistensinya lunak. Warna khasnya adalah kuning keemasan, hanya saja intensitas warnanya dapat bervariasi (Todar 2004). Bakteri S. aureus tidak bergerak, tidak berspora, dan merupakan bakteri Gram positif. Terkadang pada bakteri yang telah difagositosis dan pada biakan tua yang hampir mati dapat ditemukan bakteri Gram negatif pada bagian tengah gerombolan bakteri.
Klasifikasi S. aureus menurut Bergey dalam Brooks et al. (2001) adalah sebagai berikut:
6
Ordo : Bacillales
Famili : Staphylococcaceae Genus : Staphylococcus Spesies : Staphylococcus aureus Escherichia coli
Escherichia coli merupakan bakteri gram negatif yang termasuk dalam famili Enterobacteriaceae, bakteri ini merupakan flora normal yang terdapat dalam usus dan merupakan kelompok besar yang berbentuk batang, bersifat anaerob fakultatif dan habitat alaminya adalah saluran usus manusia dan hewan Morfologinya berupa koloni yang bundar, cembung, tipis dengan tepi yang nyata (Jawetz et al. 2001).
Klasifikasi E. coli menurut Brookset al. (2001) adalah sebagai berikut :
Kingdom : Procaryota Divisi : Gracilicutes Kelas : Scotobacteria Ordo : Eubacteriales Famili : Entobacteriaceae Genus : Escherichia Spesies : Escherichia coli
E. coli dapat menyebabkan berbagai penyakit, seperti infeksi saluran kemih (ISK) dan diare. Beberapa strain E. coli menyebabkan diare yaitu Enterophatogenic E. coli (EPEC), Enterotoxigenic E. coli (ETEC) merupakan penyebab penyakit diare. Enterohemoragic E. coli (EHEC) dihubungkan dengan hemoragic colitis, Enteroinvasive E. coli (EIEC) menyebabkan penyakit mirip shigellosis sedangkan Enteroagregative E. coli (EAEC) menyebabkan diare yang akut dan kronis (Brooks et al. 2001).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini terdiri atas bahan untuk ekstraksi daun gambir dan bahan untuk uji aktivitas antibakteri. Bahan-bahan untuk ekstraksi daun gambir terdiri atas daun gambir, metanol, akuades, n-heksana, dan kloroform. Bahan-bahan untuk penentuan (uji) aktivitas antibakteri terdiri atas fraksiair daun gambir, kultur cair bakteri uji (E.coli dan S. aureus), alkohol 70%, spirtus, media pertumbuhan bakteriNutrient Agar (NA) dan Nutrient Broth(NB) steril, larutan BaCl2 1 %,
dan larutan H2SO4 1%.
Alat-alat yang digunakan terdiri atas peralatan untuk ekstraksi daun gambir dan uji aktivitas antibakteri. Alat yang digunakan untuk ekstraksi daun gambir di antaranya gelas piala, blender, rotary evaporator, oven, pengaduk bergoyang, vakum, penangas air, corong pisah, neraca analitik, dan kertas saring. Alat-alat yang digunakan untuk uji antibakteri di antaranya tabung reaksi, lampu spiritus, labu Erlenmeyer, autoklaf, oven,
pipet mikro 10 dan 1000 μL, tips steril,
inkubator, vorteks, kuvet, spektrofotometer dan cawan mikro 96 sumur.
Metode
Persiapan Sampel (Harborne 1987)
Daun gambir yang digunakan diperoleh dari kebun gambir di Payakumbuh, Sumatera Barat. Daun yang dipilih adalah daun yang sudah tua (siap panen). Sebelum digunakan daun dikeringkan selama seminggu, pengeringan dilakukan sekitar jam 8-11 pagi. Kemudian daun dioven pada suhu 50°C sampai kadar air kurang dari 10% dan dilakukan penggilingan dengan blender lalu serbuk disaring sehingga diperoleh serbuk berukuran 80 mesh.
Ekstraksi Daun Gambir (Modifikasi Markham 1982 dan Sukadana 2010)
Ekstraksi daun gambir dilakukan dengan metode maserasi bertingkat, yaitu modifikasi dari metode Markham (1982). Selanjutnya dilakukan fraksinasi dengan menggunakan metode modifikasi Sukadana (2010). Serbuk daun gambir dimaserasi dengan 200 mL larutan metanol:air (9:1) selama 3 kali. Setelah itu dilakukan penyaringan. Residunya dimaserasi kembali dengan 200 mL metanol:air (1:1) selama tiga kali. Maserasi dilakukan selama 24 jam disertai dengan pengadukan yang teratur pada 200 rpm. Seluruh filtrat yang diperoleh dipekatkan dengan rotary evaporator. Selanjutnya ekstrak dilarutkan dengan campuran metanol-air (1:1), kemudian dipartisi dengan heksana 250 mL menghasilkan fraksi kental n-heksana dan fraksi metanol-air. Fraksi metanol-air diuapkan kandungan metanolnya sehingga diperoleh fraksi air. Fraksi air kemudian dipartisi dengan 250 mL kloroform dan dihasilkan fraksi kental kloroform dan air.
Pembuatan Media Nutrient Agar (NA)
Ordo : Bacillales
Famili : Staphylococcaceae Genus : Staphylococcus Spesies : Staphylococcus aureus Escherichia coli
Escherichia coli merupakan bakteri gram negatif yang termasuk dalam famili Enterobacteriaceae, bakteri ini merupakan flora normal yang terdapat dalam usus dan merupakan kelompok besar yang berbentuk batang, bersifat anaerob fakultatif dan habitat alaminya adalah saluran usus manusia dan hewan Morfologinya berupa koloni yang bundar, cembung, tipis dengan tepi yang nyata (Jawetz et al. 2001).
Klasifikasi E. coli menurut Brookset al. (2001) adalah sebagai berikut :
Kingdom : Procaryota Divisi : Gracilicutes Kelas : Scotobacteria Ordo : Eubacteriales Famili : Entobacteriaceae Genus : Escherichia Spesies : Escherichia coli
E. coli dapat menyebabkan berbagai penyakit, seperti infeksi saluran kemih (ISK) dan diare. Beberapa strain E. coli menyebabkan diare yaitu Enterophatogenic E. coli (EPEC), Enterotoxigenic E. coli (ETEC) merupakan penyebab penyakit diare. Enterohemoragic E. coli (EHEC) dihubungkan dengan hemoragic colitis, Enteroinvasive E. coli (EIEC) menyebabkan penyakit mirip shigellosis sedangkan Enteroagregative E. coli (EAEC) menyebabkan diare yang akut dan kronis (Brooks et al. 2001).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini terdiri atas bahan untuk ekstraksi daun gambir dan bahan untuk uji aktivitas antibakteri. Bahan-bahan untuk ekstraksi daun gambir terdiri atas daun gambir, metanol, akuades, n-heksana, dan kloroform. Bahan-bahan untuk penentuan (uji) aktivitas antibakteri terdiri atas fraksiair daun gambir, kultur cair bakteri uji (E.coli dan S. aureus), alkohol 70%, spirtus, media pertumbuhan bakteriNutrient Agar (NA) dan Nutrient Broth(NB) steril, larutan BaCl2 1 %,
dan larutan H2SO4 1%.
Alat-alat yang digunakan terdiri atas peralatan untuk ekstraksi daun gambir dan uji aktivitas antibakteri. Alat yang digunakan untuk ekstraksi daun gambir di antaranya gelas piala, blender, rotary evaporator, oven, pengaduk bergoyang, vakum, penangas air, corong pisah, neraca analitik, dan kertas saring. Alat-alat yang digunakan untuk uji antibakteri di antaranya tabung reaksi, lampu spiritus, labu Erlenmeyer, autoklaf, oven,
pipet mikro 10 dan 1000 μL, tips steril,
inkubator, vorteks, kuvet, spektrofotometer dan cawan mikro 96 sumur.
Metode
Persiapan Sampel (Harborne 1987)
Daun gambir yang digunakan diperoleh dari kebun gambir di Payakumbuh, Sumatera Barat. Daun yang dipilih adalah daun yang sudah tua (siap panen). Sebelum digunakan daun dikeringkan selama seminggu, pengeringan dilakukan sekitar jam 8-11 pagi. Kemudian daun dioven pada suhu 50°C sampai kadar air kurang dari 10% dan dilakukan penggilingan dengan blender lalu serbuk disaring sehingga diperoleh serbuk berukuran 80 mesh.
Ekstraksi Daun Gambir (Modifikasi Markham 1982 dan Sukadana 2010)
Ekstraksi daun gambir dilakukan dengan metode maserasi bertingkat, yaitu modifikasi dari metode Markham (1982). Selanjutnya dilakukan fraksinasi dengan menggunakan metode modifikasi Sukadana (2010). Serbuk daun gambir dimaserasi dengan 200 mL larutan metanol:air (9:1) selama 3 kali. Setelah itu dilakukan penyaringan. Residunya dimaserasi kembali dengan 200 mL metanol:air (1:1) selama tiga kali. Maserasi dilakukan selama 24 jam disertai dengan pengadukan yang teratur pada 200 rpm. Seluruh filtrat yang diperoleh dipekatkan dengan rotary evaporator. Selanjutnya ekstrak dilarutkan dengan campuran metanol-air (1:1), kemudian dipartisi dengan heksana 250 mL menghasilkan fraksi kental n-heksana dan fraksi metanol-air. Fraksi metanol-air diuapkan kandungan metanolnya sehingga diperoleh fraksi air. Fraksi air kemudian dipartisi dengan 250 mL kloroform dan dihasilkan fraksi kental kloroform dan air.
Pembuatan Media Nutrient Agar (NA)
7
magnetic stirer dengan pemanasan pada suhu 70°C. Kemudian 28 mL media ini ditempatkan ke dalam tabung reaksi masing-masing 7 mL untuk agar miring dan sisanya untuk agar cawan. Media selanjutnya di sterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit. Media untuk agar miring diletakan pada papan miring hingga beku dan diinkubasi selama 24 jam. Media agar cawan dituang secara aseptis ke dalam cawan Petri steril dan diinkubasi selama 24 jam.
Pembuatan Media Nutrient Broth (NB)
Media ini dibuat dengan konsentrasi 2%. Sebanyak 2 gram media NB dilarutkan dalam 100 mL akuades di dalam erlenmeyer. Kemudian diaduk dengan magnetik stirer disertai dengan pemanasan pada suhu 70°C. Erlenmeyer kemudian ditutup rapat dengan kapas dan aluminium foil. Media ini disterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit.
Pembuatan Larutan Baku McFarland 0.5 (Andrews 2008)
Larutan baku McFarland terdiri atas dua komponen, yaitu larutan BaCl2 1 % dan
H2SO4 1 %. Sebanyak 0,05 mL larutan BaCl2
1 % dicampurkan dengan 9.95 mL larutan H2SO4 1 % dan dikocok hingga homogen.
Kekeruhan larutan diukur pada panjang gelombang 620 nm dengan menggunakan akuades sebagai blangkonya. Nilai absorban larutan baku harus berada di kisaran 0,08 sampai dengan 0.13. Larutan baku McFarland 0,5 ekuivalen dengan suspensi sel bakteri dengan konsentrasi 1.5 × 108 CFU/mL.
Penentuan Aktivitas Antibakteri (Modifikasi Ellof 1998)
Peremajaan Bakteri Uji. Peremajaan dilakukan dengan menginokulasikan bakteri uji (Escherichia coli dan Staphylococcus aureus) ke dalam media nutrient agar (NA) dan diinkubasi selama 24 jam pada suhu 37 °C. Koloni yang tumbuh di media dipindahkan ke dalam 25 mL media NB secara aseptik dan disesuaikan serapannya dengan larutan baku McFarland 0.5 sehingga diperoleh suspensi dengan jumlah sel 1.5 × 108CFU/mL.
Pengujian Aktivitas Antibakteri.
Sebanyak 500 mg fraksi air daun gambir dilarutkan dalam 10 mL DMSO sehingga konsentrasinya menjadi50 mg/mL sebagai larutan stok. Larutan stok dimasukkan ke dalam sumur microplate kemudian diencerkan
dengan media NB steril sampai diperoleh konsentrasi 0.01, 0.05, 0.1, 0.5, 1, 10, 20, 30, dan 40 mg/mL. Sebanyak 5 µL suspensi bakteri uji yang telah distandardisasi jumlah selnya dimasukkan ke dalam sumur dan diinkubasi selama 24 jam pada inkubator 37 °C. Volume total campuran larutan ekstrak daun gambir, media NB, dan suspensi bakteri adalah 200 µL. Percobaan dilakukan triplo. Setelah 24 jam, cawan mikro diamati secara pengamatan visual dengan mata. Konsentrasi paling jernih (tidak keruh) ditetapkan sebagai konsentrasi hambat minimum. Konsentrasi bunuh minimum adalah konsentrasi ekstrak terkecil yang membunuh 99.9 % dari inokulum bakteri. Kontrol perlakuan dalam percobaan terdiri atas kontrol positif, yaitu antibiotik kloramfenikol 1mg/mL, media NB, danbakteri uji, kontrol negatif berupa media dan bakteri uji. Untuk menentukan konsentrasi bunuh minimum, subkulturkan 100 µL suspensi yang jernih masing-masing ke dalam medium NA lalu diamati setelah 24 jam.
Identifikasi kandungan daun gambir dengan GC-MS Pirolisis
Fraksi air daun gambir dengan konsentrasi 10 mg/mL dimasukkan ke dalam tabung kuarsa. Pyrolyzer dihubungkan dengan sebuah sistem GC-MS dengan alat GCMS-QP 2010 yang dihubungkan dengan detektor perangkap ion spektrometer massa.Suhu injektor GC adalah 280ºC dan pertemuan antara lubang dan GC diatur suhunya 300ºC. Suhu spektrometer massa dijaga pada suhu 270ºC dan discan dengan range m/z 35-425. Untuk pirolisis, GC diprogram suhu awal50ºCselama 5 menit, lalu dipanaskan pada suhu 600 ºCdengan laju 6.5ºC per menit sampai 250 ºC selama 5 menit. Spektrum massa direkam dengan menggunakan software detektor perangkap ion. Data yang dihasilkan berupa pirogram yang memberikan informasi berupa puncak senyawa hasil fragmentasi (pemecahan) senyawa utuh yang terkandung di dalam larutan tersebut.
HASIL DAN PEMBAHASAN
Fraksi Air Daun Gambir
magnetic stirer dengan pemanasan pada suhu 70°C. Kemudian 28 mL media ini ditempatkan ke dalam tabung reaksi masing-masing 7 mL untuk agar miring dan sisanya untuk agar cawan. Media selanjutnya di sterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit. Media untuk agar miring diletakan pada papan miring hingga beku dan diinkubasi selama 24 jam. Media agar cawan dituang secara aseptis ke dalam cawan Petri steril dan diinkubasi selama 24 jam.
Pembuatan Media Nutrient Broth (NB)
Media ini dibuat dengan konsentrasi 2%. Sebanyak 2 gram media NB dilarutkan dalam 100 mL akuades di dalam erlenmeyer. Kemudian diaduk dengan magnetik stirer disertai dengan pemanasan pada suhu 70°C. Erlenmeyer kemudian ditutup rapat dengan kapas dan aluminium foil. Media ini disterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit.
Pembuatan Larutan Baku McFarland 0.5 (Andrews 2008)
Larutan baku McFarland terdiri atas dua komponen, yaitu larutan BaCl2 1 % dan
H2SO4 1 %. Sebanyak 0,05 mL larutan BaCl2
1 % dicampurkan dengan 9.95 mL larutan H2SO4 1 % dan dikocok hingga homogen.
Kekeruhan larutan diukur pada panjang gelombang 620 nm dengan menggunakan akuades sebagai blangkonya. Nilai absorban larutan baku harus berada di kisaran 0,08 sampai dengan 0.13. Larutan baku McFarland 0,5 ekuivalen dengan suspensi sel bakteri dengan konsentrasi 1.5 × 108 CFU/mL.
Penentuan Aktivitas Antibakteri (Modifikasi Ellof 1998)
Peremajaan Bakteri Uji. Peremajaan dilakukan dengan menginokulasikan bakteri uji (Escherichia coli dan Staphylococcus aureus) ke dalam media nutrient agar (NA) dan diinkubasi selama 24 jam pada suhu 37 °C. Koloni yang tumbuh di media dipindahkan ke dalam 25 mL media NB secara aseptik dan disesuaikan serapannya dengan larutan baku McFarland 0.5 sehingga diperoleh suspensi dengan jumlah sel 1.5 × 108CFU/mL.
Pengujian Aktivitas Antibakteri.
Sebanyak 500 mg fraksi air daun gambir dilarutkan dalam 10 mL DMSO sehingga konsentrasinya menjadi50 mg/mL sebagai larutan stok. Larutan stok dimasukkan ke dalam sumur microplate kemudian diencerkan
dengan media NB steril sampai diperoleh konsentrasi 0.01, 0.05, 0.1, 0.5, 1, 10, 20, 30, dan 40 mg/mL. Sebanyak 5 µL suspensi bakteri uji yang telah distandardisasi jumlah selnya dimasukkan ke dalam sumur dan diinkubasi selama 24 jam pada inkubator 37 °C. Volume total campuran larutan ekstrak daun gambir, media NB, dan suspensi bakteri adalah 200 µL. Percobaan dilakukan triplo. Setelah 24 jam, cawan mikro diamati secara pengamatan visual dengan mata. Konsentrasi paling jernih (tidak keruh) ditetapkan sebagai konsentrasi hambat minimum. Konsentrasi bunuh minimum adalah konsentrasi ekstrak terkecil yang membunuh 99.9 % dari inokulum bakteri. Kontrol perlakuan dalam percobaan terdiri atas kontrol positif, yaitu antibiotik kloramfenikol 1mg/mL, media NB, danbakteri uji, kontrol negatif berupa media dan bakteri uji. Untuk menentukan konsentrasi bunuh minimum, subkulturkan 100 µL suspensi yang jernih masing-masing ke dalam medium NA lalu diamati setelah 24 jam.
Identifikasi kandungan daun gambir dengan GC-MS Pirolisis
Fraksi air daun gambir dengan konsentrasi 10 mg/mL dimasukkan ke dalam tabung kuarsa. Pyrolyzer dihubungkan dengan sebuah sistem GC-MS dengan alat GCMS-QP 2010 yang dihubungkan dengan detektor perangkap ion spektrometer massa.Suhu injektor GC adalah 280ºC dan pertemuan antara lubang dan GC diatur suhunya 300ºC. Suhu spektrometer massa dijaga pada suhu 270ºC dan discan dengan range m/z 35-425. Untuk pirolisis, GC diprogram suhu awal50ºCselama 5 menit, lalu dipanaskan pada suhu 600 ºCdengan laju 6.5ºC per menit sampai 250 ºC selama 5 menit. Spektrum massa direkam dengan menggunakan software detektor perangkap ion. Data yang dihasilkan berupa pirogram yang memberikan informasi berupa puncak senyawa hasil fragmentasi (pemecahan) senyawa utuh yang terkandung di dalam larutan tersebut.
HASIL DAN PEMBAHASAN
Fraksi Air Daun Gambir
8
bertingkat. Daun gambir dimaserasi dengan campuran metanol-air (9:1) sebanyak tiga kali, lalu dengan metanol-air (1:1) sebanyak tiga kali. Hal ini dilakukan karena flavonoid glikosida dan yang lebih polar seperti aglikon lebih baik diekstraksi dengan alkohol atau dengan campuran alkohol dan air (Marston dan Hostettmann 2006).
Prinsip maserasi adalah penyarian zat aktif yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari yang sesuai selama beberapa hari, cairan penyari akan masuk ke dalam sel melewati dinding sel. Larutan yang konsentrasinya tinggi akan terdesak keluar dan diganti oleh cairan penyari dengan konsentrasi rendah (proses difusi). Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selanjutnya ekstrak dipekatkan dengan rotary evaporator.
Setelah dilakukan maserasi dengan larutan campuran metanol-air, ekstrak yang dihasilkan kemudian dipekatkan. Selanjutnya ekstrak tersebut dilarutkan di dalam metanol-air (1:1) lalu dipartisi dengan n-heksana yang bersifattidak polar untuk memisahkan senyawa-senyawa non polar di dalam daun gambir. Senyawa-senyawa yang mungkin terkandung di dalam fraksi n-heksana adalah minyak atsiri dan pigmen tumbuhan yang bersifat nonpolar seperti kuinon isoterpenoid (Harborne 1993). Hasil partisi dengan heksana adalah fraksi n-heksana danfraksimetanol-air.
Fraksi metanol-air kemudian dipekatkan untuk menghilangkan kandungan metanolnya sehingga diperoleh fraksi air. Fraksi air ini kemudian dipartisi dengan kloroform yang bersifat semi polar. Hal ini dilakukan untuk memisahkan senyawa yang kurang polar. Menurut Marston dan Hostettmann (2006), flavonoid yang kurang polar (isoflavon, flavonon, flavon termetilasi, dan flavonol) diekstraksi dengan menggunakan kloroform, diklorometana, dietil eter, atau etil asetat. Selain itu, senyawa yang diduga terkandung di dalam fraksi kloroform adalah terpenoid. Lenny (2006) menyatakan bahwa terpenoid dapat terekstrak dengan baik pada eter dan kloroform. Senyawa yang tergolong ke dalam kelompok terpenoid diantaranya triterpenoid, sterol, serta pigmen tumbuhan. Hasil partisi dengan kloroform adalah fraksi air dan fraksi kloroform.
Metode fraksinasi yang digunakan pada penelitian ini adalah metode yang dilakukan oleh Sukadana (2010) dalam mengekstrak senyawa flavonoid dari buah belimbing
manis. Fraksinasi menghasilkan tiga fraksi, yaitu fraksi n-heksana, kloroform, dan air. Ketiga fraksi menunjukkan hasil yang positif pada pengujian fitokimia flavonoid. Fraksi air belimbing manis menunjukkan intensitas warna orange yang paling tinggi dan jumlah rendemen yang paling banyak, maka diduga bahwa fraksi air mengandung flavonoid yang lebih banyak daripada fraksi n-heksana dan kloroform. Fraksi air tersebut dipisahkan dengan teknik kromatografi kolom menghasilkan 8 jenis fraksi. Salah satu fraksi yang dihasilkan tersebut kemudian dimurnikan dengan kromatografi lapis tipis untuk selanjutnya dilakuakan identifikasi dengan spektrofotometerr UV-Vis. Hasil identifikasi isolat tersebut dengan UV-Vis menunjukkan adanya gugus hidroksil yang diduga sebagai struktur katekin. Oleh karena itu, metode Sukadana (2010) ini digunakan pada fraksinasi daungambir untuk memperoleh senyawa flavonoid, terutama senyawa katekin.
Ekstraksi 100 gram daun gambir dengan metode maserasi bertingkat dan fraksinasi menghasilkan tiga fraksi, yaitu fraksi kloroform, fraksi n-heksana, dan fraksi air dengan jumlah rendemen masing-masing dapat dilihat pada Tabel 1. Jumlah rendemen fraksi air merupakan yang paling banyak dibandingkan dengan fraksi yang lain. Hal ini menunjukkan bahwa senyawa flavonoid yang terkandung di dalam daun gambir lebih banyak larut di dalam air.
Tabel 1 Rendemen ekstraksi daun gambir Jenis fraksi Jumlah rendemen
(%) Air 3.033 Kloroform 0.048 n-heksana 0.031
Hal ini sesuai dengan teori bahwa flavonoid yang bersifat polar lebih mudah larut di dalam air karena adanya gula glikosida yang mengandung gugus hidroksil. Selain flavonoid, kemungkinan terdapat senyawa fenol lainnya yang juga terdapat pada fraksi air daun gambir, diantaranya hidrokuinon, katekol, dan kelompok asam fenolat (Grotewold 2005). Secara ilmiah telah diketahui bahwa keberadaan flavonoid di dalam daun gambir paling dominan yaitu sekitar 40-50% (Hayani 2003).
mengandung flavonoid, fraksi kloroform hanya mengandung triterpenoid, dan fraksi heksana hanya mengandung tannin. Uji alkaloid dan fenolik memberikan hasil negatif pada ketiga fraksi. Oleh karena itu, fraksi air yang mengandung flavonoid yang digunakan untuk analisis selanjutnya, yaitu penentuan KHTM (konsentrasi hambat tumbuh minimum).
Konsentrasi Hambat Tumbuh Minimum (KHTM) melalui Metode
Mikrodilusi
Konsentrasi hambat tumbuh minimum (KHTM) fraksi air daun gambir ditentukandengan metode mikrodilusi dan bakteri yang digunakan adalah Escherichia coli dan Staphylococcus aureus. Bakteri uji distandardisasi dengan larutan McFarland 0.5 sehingga jumlah sel yang digunakan sama yaitu1.5 × 108 CFU/mL. Fraksi air daun gambir dilarutkan dengan DMSO 1 % sehingga diperoleh konsentrasi 0.01, 0.05, 0.5, 1, 10, 20, 30, dan 40 mg/mL.Setiap sumur berisi media nutrient broth (NB), fraksi air
daun gambir, dan suspensi bakteri.Kontrol DMSO dibuat sesuai dengan konsentrasi fraksi air daun gambir. Setiap konsentrasi dilakukan secara triplo. Kontrol positif berisi kloramfenikol 1 mg/mL, media NB, dan suspensi bakteri. Kontrol negatif berisi media NB dan bakteri (Gambar 2).
Teknik yang digunakan adalah pengamatan kekeruhan setelah microplate diinkubasi selama 24 jam pada suhu 37ºC. Kontrol negatif menunjukkan kekeruhan. fraksi air daun gambir dibandingkan dengan kekeruhan kontrol negatif. Kekeruhanterlihat pada fraksi air daun gambir dengan konsentrasi 0.01 mg/mL dan 0.05 mg/mL, sedangkan pada konsentrasi 0.5 mg/mL sampai 40 mg/mL terlihat jernih (tidak keruh). Kontrol positif tidak menunjukkan kekeruhan karena kloramfenikol merupakan antibiotik yang memiliki kemampuan tinggi dalam membunuh bakteri dan mikroorganisme lain. Kontrol negatif menunjukkan kekeruhan karena ada pertumbuhan bakteri di dalam media.
Gambar 2 Uji aktivitas fraksi air daun gambir terhadap E.coli.
10
Menurut Irianto (2006), semakin keruh suatu kultur, semakin banyak jumlah selnya. Hal ini menunjukkan bahwa fraksi air daun gambir menghambat pertumbuhan E.coli dan S.aureus pada konsentrasi fraksi 0.5 mg/mL sampai 40 mg/mL. Oleh karena itu, disimpulkan bahwa nilai KHTM fraksi air daun gambir terhadap E.coli dan S.aureus adalah 0.5 mg/mL. Pengamatan terhadap microplate dapat dilihat pada Lampiran 3.
Kontrol DMSO menunjukkan kekeruhan pada konsentrasi 0.05 sampai konsentrasi 1 mg/mL. Hal ini mengindikasikan bahwa DMSO memiliki aktivitas dalam menghambat pertumbuhan bakteri E.coli pada konsentrasi 10 sampai 40 mg/mL. Deskripsi mengenai ada atau tidaknya pertumbuhan pada microplate dapat dilihat pada Tabel 2.
Hasil penelitian ini menunjukkan bahwa fraksi air daun gambir memiliki aktivitas antibakteri yang tinggi. Sebuah bahan alam dianggap memiliki aktivitas yang kuat jika memiliki KHTM antara 0.05 sampai 0.5 mg/mL, aktivitas sedang jika nilai KHTM 0.6 sampai 1.5 mg/mL, dan dikatakan memiliki aktivitas yang lemah jika di atas 1.5 mg/mL (Aligiannis et al. 2001).
Tabel 2 Pengaruh konsentrasi fraksi air daun gambir terhadap E.coli dan S.aureus
Konsentrasi
(mg/mL) E.coli S.aureus
Kontrol DMSO 0.05 + + + + + + + + + 0.01 + + + + + + + + + 0.5 - - + - - + - - + 1 - - + - - + - - + 10 - - - - - - - - - 20 - - - - - - - - - 30 - - - - - - - - - 40 - - - - - - - - -
Keterangan: + : ada pertumbuhan bakteri - : tidak ada pertumbuhan
Senyawa antibakteri yang terdapat di dalam fraksi air daun gambir didugaberspektrum luas karena dapat bekerja pada bakteri Gram positif dan Gram negatif. Dinding sel bakteri Gram positif memiliki lebih banyak peptidoglikan dibandingkan dengan bakteri Gram negatif. Oleh karena itu, pertahanan bakteri Gram positif lebih kuat. Hasil yang diperoleh pada penelitian ini adalah bahwa senyawa antibakteri fraksi air daun gambir menghambat pertumbuhan bakteri Gram positif dan negatif dalam konsentrasi yang sama. Oleh karena itu, diduga bahwa mekanisme kerja senyawa antibakteri fraksi air daun gambir tidak dalam penghambatan sintesis dinding sel.
Senyawa yang diduga terkandung di dalam fraksi air daun gambir adalah senyawa fenolik, yaitu senyawa yang mengandung cincin benzena dan gugus hidroksil. Senyawa fenolik dapat menyebabkan denaturasi protein melalui proses adsorpsi yang melibatkan ikatan hidrogen. Fenol dalam kadar rendah, membentuk kompleks protein-fenol dengan ikatan lemah dan segera mengalami peruraian, diikuti penetrasi fenol ke dalam sel dan menyebabkan presipitasi serta denaturasi protein. Fenol dalam kadar yang tinggi menyebabkan koagulasi protein dan sel membran mengalami lisis, mengubah permeabilitas membran bakteri (Soekardjo &Siswandono 2000).
Tahap lanjutan dari penentuan KHTM dengan metode mikrodilusi adalah menentukan konsentrasi bunuh minimum (KBM). Konsentrasi bunuh minimum (KBM) diperoleh dengan mengsubkulturkan 100 µL isi sumur yang tidak keruh (jernih) ke dalam nutrient agar (NA). Konsentrasi bunuh minimum adalah konsentrasi fraksi air daun gambir yang dapat menghambat 99.9% populasi bakteri. Fraksi yang disubkulturkan adalah fraksi yang tidak menunjukkan adanya kekeruhan, yaitu 0.5, 1, 10, 20, 30, dan 40 mg/mL.
semakin kuat aktivitas antibakterinya. Oleh karena itu, diperkirakan KBM fraksi air daun gambir lebih besar dari 40 mg/mL. Hasil penelitian Silvikasari (2010) menunjukkan bahwa fraksi air daun gambir memiliki KBM 9% atau setara dengan 90 mg/mL. Hasil uji KBM untuk E.coli dapat dilihat pada Lampiran 4 dan untuk S.aureus pada Lampiran 5.
Hasil penentuan KHTM berbeda dengan KBM. Konsentrasi hambat tumbuh minimum (KHTM) adalah konsentrasi terkecil ekstrak yang dapat menghambat pertumbuhan bakteri, sedangkan konsentrasi bunuh minimum (KBM) adalah konsentrasi ekstrak yang dapat membunuh 99.9% populasi bakteri. Hal ini serupa dengan hasil yang diperoleh oleh Acharyya et al. (2009) yang menentukan konsentrasi hambat tumbuh minimum (KHTM) dan KBM beberapa tanaman obat terhadap beberapa bakteri. Tanaman A.lebbeck diuji pada konsentrasi 0.05-32 mg/mL. Konsentrasi hambat tumbuh minimum A.lebbeck terhadap Baccilus subtilis adalah 32 mg/mL, tetapi konsentrasi bunuh minimumnya tidak dapat ditentukan pada konsentrasi 0.05-32 mg/mL. Oleh karena itu, nilai KHTM tidak berkaitan dengan KBM.
Komponen PenyusunFraksi air Daun Gambir
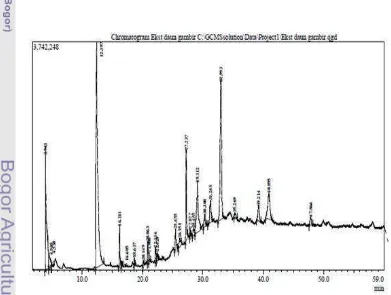
Hasil identifikasi dengan GC-MS pirolisis menunjukkan bahwa fraksi air daun gambir (Uncaria gambir Roxb.) mengandung 25 senyawa berbeda yang diekspresikan dalam bentuk puncak (peak) kromatogram (pirogram) (Gambar 3). Nama-nama senyawa yang dihasilkan dapat dilihat pada Lampiran 6.
Instrumentasi yang digunakan adalah GC-MS pirolisis sehingga dilakukan pembakaran sampel dengan suhu 600ºC tanpa oksigen sehingga semua senyawa yang terkandung di dalam sampel menjadi volatil dan terdekomposisi menjadi fragmen-fragmen penyusunnya. Hasil identifikasi pada pirogram menunjukkan adanya senyawa pirokatekol (1,2-Benzenediol) pada puncak ke-9 dengan konsentrasi 1.46%. Struktur pirokatekol dapat dilihat pada Gambar 4. Senyawa katekol (pirokatekol) merupakan fragmen utama di dalam pirogram yang merupakan hasil dekomposisi senyawa katekin (Galletti GC & James BR 1992). Hal ini dapat dilihat adanya struktur katekol pada struktur senyawa katekin (Gambar 5).
12
Menurut Nazir (2000), daun gambir mengandung katekin sebesar 7-33%. Hasil uji fitokimia fraksi air daun gambir (Silvikasari 2010) menunjukkan hasil yang positif untuk senyawa flavonoid yang ditunjukkan dengan adanya warna merah (Lampiran 7). Hal ini sesuai dengan hasil GC-MS pirolisis yang menunjukkan adanya senyawa flavonoid, yaitu katekin.
Gambar 4 Struktur pirokatekol.
Gambar 5 Struktur katekin. Penelitian ini termasuk di dalam Program Kreativitas Mahasiswa bidang penelitian (PKM-P). Senyawa yang ingin diperoleh di dalam PKM-P tersebut adalah katekin. Hasil identifikasi pada penelitian ini menunjukkan bahwa struktur katekin telah ditemukan terkandung di dalam fraksi air daun gambir berdasarkan adanya pirokatekol yang merupakan fragmen penyusun katekin. Namun, untuk memperoleh senyawa katekin, fraksi air daun gambir harus dimurnikan dengan menggunakan metode kromatografi kolom dan lapis tipis. Hal ini menjadi saran untuk penelitian selanjutnya.
SIMPULAN DAN SARAN
Simpulan
Fraksi air daun gambir memiliki nilai konsentrasi hambat tumbuh minimum 0.50 mg/mL terhadap pertumbuhan bakteri Escherichia coli dan Staphylococcus aureus. Konsentrasi minimum fraksi air daun gambir yang mampu membunuh bakteri uji belum dapat ditentukan karena tidak ada di dalam range konsentrasi fraksi air yang diujikan. Hasil identifikasi dengan GC-MS pirolisis menunjukkan bahwa fraksi air daun gambir mengandung pirokatekol (katekol) yang merupakan fragmen penyusun senyawa katekin.
Saran
Metode mikrodilusi yang disarankan adalah mikrodilusi dengan pengukuran absorbansi atau dengan menggunakan larutan indikator.Fraksi air daun gambir perlu ditingkatkan konsentrasinya agar dapat diperoleh nilai konsentrasi bunuh minimum (KBM).Identifikasi komponen penyusun fraksi air daun gambir disarankan menggunakan GC-MS, bukan GC-MS pirolisis agar dapat diketahui semua senyawa penyusun fraksi air daun gambir. Selain itu, perlu dilakukan pemurnian fraksi air daun gambir agar diperoleh senyawa katekin.
DAFTAR PUSTAKA
Acharyya Saurabh, Amarendra Patra, dan Prasanta K Bag. 2009. Evaluation of the antimicrobial activity of some medicinal plants against enteric bacteria with particular reference to multi-drug resistant Vibrio cholera. Tropical Journal of Pharmaceutical Research 8: 231-237.
Alen Y, E Rahmayuni dan A Bakhtiar. 2004.Isolasisenyawa bioaktif antinematodaBursaphelencchus xylophilus dari ekstrak gambir. Seminar Nasional TumbuhanTanamanObat Indonesia XXVI. Padang, 7-8 September 2004. Aligiannis N, Kalpotzakis E, Mitaku S,
Chinou IB. 2001. Composition and antimicrobial activity of the essential oils of two Origanum species.J Ag Food Chem 40: 4168-4170.
Amos, I Zaenudin, A Triputranto, B Rusmandra dan S Ngudiwaluyo. 2004. Teknologi Pasca Panen Gambir. Jakarta: BPPT Pr.
Andrews JM. 2008. BSAC standardized disc susceptibility testing method (version 7). J Antimicrob Chemother 56:60-76. [terhubung berkala] http://jac.oxfordjournals.org/cgi/repri nt/62/2/256 [27 Juni 2010].
Menurut Nazir (2000), daun gambir mengandung katekin sebesar 7-33%. Hasil uji fitokimia fraksi air daun gambir (Silvikasari 2010) menunjukkan hasil yang positif untuk senyawa flavonoid yang ditunjukkan dengan adanya warna merah (Lampiran 7). Hal ini sesuai dengan hasil GC-MS pirolisis yang menunjukkan adanya senyawa flavonoid, yaitu katekin.
Gambar 4 Struktur pirokatekol.
Gambar 5 Struktur katekin. Penelitian ini termasuk di dalam Program Kreativitas Mahasiswa bidang penelitian (PKM-P). Senyawa yang ingin diperoleh di dalam PKM-P tersebut adalah katekin. Hasil identifikasi pada penelitian ini menunjukkan bahwa struktur katekin telah ditemukan terkandung di dalam fraksi air daun gambir berdasarkan adanya pirokatekol yang merupakan fragmen penyusun katekin. Namun, untuk memperoleh senyawa katekin, fraksi air daun gambir harus dimurnikan dengan menggunakan metode kromatografi kolom dan lapis tipis. Hal ini menjadi saran untuk penelitian selanjutnya.
SIMPULAN DAN SARAN
Simpulan
Fraksi air daun gambir memiliki nilai konsentrasi hambat tumbuh minimum 0.50 mg/mL terhadap pertumbuhan bakteri Escherichia coli dan Staphylococcus aureus. Konsentrasi minimum fraksi air daun gambir yang mampu membunuh bakteri uji belum dapat ditentukan karena tidak ada di dalam range konsentrasi fraksi air yang diujikan. Hasil identifikasi dengan GC-MS pirolisis menunjukkan bahwa fraksi air daun gambir mengandung pirokatekol (katekol) yang merupakan fragmen penyusun senyawa katekin.
Saran
Metode mikrodilusi yang disarankan adalah mikrodilusi dengan pengukuran absorbansi atau dengan menggunakan larutan indikator.Fraksi air daun gambir perlu ditingkatkan konsentrasinya agar dapat diperoleh nilai konsentrasi bunuh minimum (KBM).Identifikasi komponen penyusun fraksi air daun gambir disarankan menggunakan GC-MS, bukan GC-MS pirolisis agar dapat diketahui semua senyawa penyusun fraksi air daun gambir. Selain itu, perlu dilakukan pemurnian fraksi air daun gambir agar diperoleh senyawa katekin.
DAFTAR PUSTAKA
Acharyya Saurabh, Amarendra Patra, dan Prasanta K Bag. 2009. Evaluation of the antimicrobial activity of some medicinal plants against enteric bacteria with particular reference to multi-drug resistant Vibrio cholera. Tropical Journal of Pharmaceutical Research 8: 231-237.
Alen Y, E Rahmayuni dan A Bakhtiar. 2004.Isolasisenyawa bioaktif antinematodaBursaphelencchus xylophilus dari ekstrak gambir. Seminar Nasional TumbuhanTanamanObat Indonesia XXVI. Padang, 7-8 September 2004. Aligiannis N, Kalpotzakis E, Mitaku S,
Chinou IB. 2001. Composition and antimicrobial activity of the essential oils of two Origanum species.J Ag Food Chem 40: 4168-4170.
Amos, I Zaenudin, A Triputranto, B Rusmandra dan S Ngudiwaluyo. 2004. Teknologi Pasca Panen Gambir. Jakarta: BPPT Pr.
Andrews JM. 2008. BSAC standardized disc susceptibility testing method (version 7). J Antimicrob Chemother 56:60-76. [terhubung berkala] http://jac.oxfordjournals.org/cgi/repri nt/62/2/256 [27 Juni 2010].
UJI AKTIVITAS ANTIBAKTERI FRAKSI AIR DAUN
GAMBIR (
Uncaria gambir
Roxb) DENGAN MIKRODILUSI
DAN ANALISIS KOMPONEN PENYUSUNNYA
NURI IZZATIL WAFA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Menurut Nazir (2000), daun gambir mengandung katekin sebesar 7-33%. Hasil uji fitokimia fraksi air daun gambir (Silvikasari 2010) menunjukkan hasil yang positif untuk senyawa flavonoid yang ditunjukkan dengan adanya warna merah (Lampiran 7). Hal ini sesuai dengan hasil GC-MS pirolisis yang menunjukkan adanya senyawa flavonoid, yaitu katekin.
Gambar 4 Struktur pirokatekol.
Gambar 5 Struktur katekin. Penelitian ini termasuk di dalam Program Kreativitas Mahasiswa bidang penelitian (PKM-P). Senyawa yang ingin diperoleh di dalam PKM-P tersebut adalah katekin. Hasil identifikasi pada penelitian ini menunjukkan bahwa struktur katekin telah ditemukan terkandung di dalam fraksi air daun gambir berdasarkan adanya pirokatekol yang merupakan fragmen penyusun katekin. Namun, untuk memperoleh senyawa katekin, fraksi air daun gambir harus dimurnikan dengan menggunakan metode kromatografi kolom dan lapis tipis. Hal ini menjadi saran untuk penelitian selanjutnya.
SIMPULAN DAN SARAN
Simpulan
Fraksi air daun gambir memiliki nilai konsentrasi hambat tumbuh minimum 0.50 mg/mL terhadap pertumbuhan bakteri Escherichia coli dan Staphylococcus aureus. Konsentrasi minimum fraksi air daun gambir yang mampu membunuh bakteri uji belum dapat ditentukan karena tidak ada di dalam range konsentrasi fraksi air yang diujikan. Hasil identifikasi dengan GC-MS pirolisis menunjukkan bahwa fraksi air daun gambir mengandung pirokatekol (katekol) yang merupakan fragmen penyusun senyawa katekin.
Saran
Metode mikrodilusi yang disarankan adalah mikrodilusi dengan pengukuran absorbansi atau dengan menggunakan larutan indikator.Fraksi air daun gambir perlu ditingkatkan konsentrasinya agar dapat diperoleh nilai konsentrasi bunuh minimum (KBM).Identifikasi komponen penyusun fraksi air daun gambir disarankan menggunakan GC-MS, bukan GC-MS pirolisis agar dapat diketahui semua senyawa penyusun fraksi air daun gambir. Selain itu, perlu dilakukan pemurnian fraksi air daun gambir agar diperoleh senyawa katekin.
DAFTAR PUSTAKA
Acharyya Saurabh, Amarendra Patra, dan Prasanta K Bag. 2009. Evaluation of the antimicrobial activity of some medicinal plants against enteric bacteria with particular reference to multi-drug resistant Vibrio cholera. Tropical Journal of Pharmaceutical Research 8: 231-237.
Alen Y, E Rahmayuni dan A Bakhtiar. 2004.Isolasisenyawa bioaktif antinematodaBursaphelencchus xylophilus dari ekstrak gambir. Seminar Nasional TumbuhanTanamanObat Indonesia XXVI. Padang, 7-8 September 2004. Aligiannis N, Kalpotzakis E, Mitaku S,
Chinou IB. 2001. Composition and antimicrobial activity of the essential oils of two Origanum species.J Ag Food Chem 40: 4168-4170.
Amos, I Zaenudin, A Triputranto, B Rusmandra dan S Ngudiwaluyo. 2004. Teknologi Pasca Panen Gambir. Jakarta: BPPT Pr.
Andrews JM. 2008. BSAC standardized disc susceptibility testing method (version 7). J Antimicrob Chemother 56:60-76. [terhubung berkala] http://jac.oxfordjournals.org/cgi/repri nt/62/2/256 [27 Juni 2010].
13
Baris O, Gulluce M, Sahin F, Ozer H, Kilic H, Ozkan H, Sokmen M, Ozbek T .2006. Biological activities of the essential oil and methanol extract of Achillea Biebersteinii Afan. (Asteraceae). Turk. J. Biol. 30: 65-73.
Basri DF dan Fan SH .2005. The potential of aqueous and acetone extracts of galls of Quercus infectoria as antibacterial agents. Indian J. Pharmacol. 37:26-29.
Brooks GF, Janet SB, Stephen AM. 2001. Mikrobiologi Kedokteran.Jakarta: Salemba Medika.
Chand S, Lusunzi I, Veal DA, Williams LR, Karuso P. 1994. Rapid screening of the antimicrobial activityof extracts and natural products.J. Antibiot 47: 1295-1304.
Cowan MM. 1999. Plant products as antimicrobial agents. Clinical Microbiology Reviews 12: 564–582. Dhalimi A. 2006. Permasalahan gambir di
Sumatera Barat dan alternatif pemecahannya. Journal of Education. 5: 46-59.
Darwish RM dan Talal A Aburjai. 2010. Effect of ethnomedical plants used in folklore medicine in Jordan as antibiotic resistant inhibitors on Escherichia coli. BioMed Central 10: 2-8.
Devienne KF dan Raddi MSG. 2002.Screening for antimicrobial activity of natural products using a microplate photometer.Braz. J. Microbiol. 33: 97-105.
Ellof JN. 1998. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Med 64:711-713.
Galletti GC & James BR. 1992. PY-GC_ion trap detection of polyphenols (vegetable tannins):preliminary result. J. Organic mass spectrometry 27:226-230.
Grotewold E. 2005. The Science of Flavonoids. USA: Sprinmger. Handayani D R, Ranova, Farlian, dan Arneti.
2