SINTESIS 7-HIDROKSIFLAVONOL DAN FISETIN
NISFIYAH MAFTUHAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis 7-Hidroksiflavonol dan Fisetin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Nisfiyah Maftuhah
ABSTRAK
NISFIYAH MAFTUHAH. Sintesis 7-Hidroksiflavonol dan Fisetin. Dibimbing oleh BUDI ARIFIN dan SUMINAR S ACHMADI.
Fisetin (7,3’,4’-trihidroksiflavonol) lazim ditemukan dalam buah-buahan dan sayuran. Fisetin berpotensi sebagai antioksidan, antiradang, dan antidiabetes. Dalam penelitian ini, fisetin disintesis mengikuti metode sintesis 7-hidroksiflavonol. 7-Hidroksiflavonol berhasil disintesis dari resasetofenon dan benzaldehida. Kedua bahan awal tersebut dilindungi oleh gugus tetrahidropiranil (THP), lalu dikondensasikan dengan katalis KOH 60% membentuk kalkon terproteksi-THP. Siklisasi kalkon menjadi 7-hidroksiflavonol terproteksi-THP dilakukan dengan metode siklisasi oksidatif Algar-Flynn- Oyamada. Deproteksi gugus pelindung THP dengan asam p-toluenasulfonat menghasilkan 7-hidroksiflavonol. Rendemen keseluruhan ialah 22% dengan waktu sintesis selama 7 hari, lebih cepat daripada proses isolasi dari bahan alam. Pengembangan metode tersebut untuk menyintesis fisetin dari bahan awal resasetofenon dan 3,4-dihidroksibenzaldehida baru menghasilkan rendemen 1%. Pengujian gugus pelindung lain untuk 3,4-dihidroksibenzaldehida serta peragaman komposisi pereaksi dan kondisi reaksi khususnya dalam tahap sintesis kalkon dianggap perlu untuk dapat meningkatkan rendemen tersebut. Semua produk sintesis dalam penelitian ini telah dicirikan titik lelehnya dan juga secara spektroskopi.
Kata kunci: fisetin, flavonol, 7-hidroksiflavonol, resasetofenon
ABSTRACT
NISFIYAH MAFTUHAH. Synthesis of 7-Hydroxyflavonol and Fisetin. Supervised by BUDI ARIFIN and SUMINAR S ACHMADI.
Fisetin (7,3’,4’-trihydroxyflavonol) is commonly found in fruits and vegetables. It is potential as antioxidant, anti-inflammation, and antidiabetic. In this study, fisetin was synthesized by following 7-hydroxyflavonol synthesis method. 7-Hydroxyflavonol was succesfully synthesized from resacetophenone and benzaldehyde. Both starting materials were protected by tetrahydropyranyl (THP) group and then condensed with 60% KOH as catalyst forming THP-protected chalcone. Cyclization of the chalcone into THP-THP-protected 7-hydroxyflavonol was carried out by using Algar-Flynn-Oyamada oxidative cyclization. Deprotection of the THP protecting group with p-toluenesulfonic acid resulted 7-hydroxyflavonol. The overall yield was 22% with total synthesis time of 7 days, faster than isolation from natural products. However, development of this method to synthesize fisetin from resacetophenone and 3,4-dihydroxybenzaldehyde as starting materials only gave 1% yield. Further study with other protecting groups for 3,4-dihydroxybenzaldehide as well as variation of
reactants’ composition and reaction conditions are necessary in order to increase
the fisetin yield. All synthetic products had been characterized by melting point and spectroscopy analysis.
SINTESIS 7-HIDROKSIFLAVONOL DAN FISETIN
NISFIYAH MAFTUHAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Program Studi Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis 7-Hidroksiflavonol dan Fisetin Nama : Nisfiyah Maftuhah
NIM : G44090003
Disetujui oleh
Budi Arifin, SSi, MSi . Pembimbing I
Prof Ir Suminar S Achmadi, PhD Pembimbing II
Diketahui
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Assalamu’alaikum Wr. Wb.
Segala puji dan rasa syukur ke hadirat Allah SWT penulis ucapkan atas nikmat dan karunia-Nya sehingga penulis mampu menyusun dan menyelesaikan karya ilmiah berjudul Sintesis 7-Hidroksiflavonol dan Fisetin yang dilakukan pada bulan Januari hingga Juli 2013 di Laboratorium Kimia Organik, Departemen Kimia, FMIPA, IPB, Bogor.
Penulis mengucapkan terima kasih kepada Bapak Budi Arifin dan Ibu Suminar S Achmadi selaku pembimbing yang senantiasa memberikan bimbingan, arahan, semangat, dan doa. Karya tulis ini merupakan wujud penghargaan untuk Ibunda dan Ayahanda tercinta, Yatmuni dan Kasmuji yang senantiasa memberikan semangat dan doa. Terima kasih juga penulis ucapkan kepada Kakak tercinta Bahtaria Rohmah, Ikbar Saifullah, dan Winny K Dzulkarnaen yang selalu memberikan semangat dalam berlangsungnya pembuatan karya ilmiah ini.
Penulis juga mengucapkan terima kasih kepada Bapak Sabur, Rika Kurnia, Febrina Miharti, Sity Adhitia Sarman, Ichsan Irwanto, dan teman-teman peneliti di Bagian Kimia Organik, FMIPA, IPB atas masukan, saran, kerja sama, dan kebersamaan dalam menjalankan penelitian. Semoga karya tulis ini bermanfaat untuk ilmu pengetahuan.
Wassalamu’alaikum Wr. Wb.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Langkah Percobaan 3
Proteksi THP pada Resasetofenon dan 3,4-Dihidroksibenzaldehida 3 Sintesis 2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon 3 Sintesis 7-(Tetrahidropiran-2-iloksi)flavonol 4
Pelepasan THP dari OH Fenolik 4
Sintesis Fisetin 1-Wadah 4
HASIL DAN PEMBAHASAN 4
2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)asetofenon 4
2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon 7
7-(Tetrahidropiran-2-iloksi)flavonol 10
7-Hidroksiflavonol 13
3,4-Dihidroksibenzaldehida-THP 15
Fisetin 18
SIMPULAN DAN SARAN 21
DAFTAR PUSTAKA 22
LAMPIRAN 24
DAFTAR TABEL
1 Rendemen hasil sintesis resasetofenon-THP 5
2 Analisis NMR resasetofenon-THP (pelarut CDCl3) 6
3 Rendemen hasil sintesis 2’-hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon 8
4 Analisis NMR kalkon-THP (pelarut CDCl3) 10
5 Rendemen hasil sintesis flavonol-THP dari kalkon-THP 12 6 Rendemen hasil sintesis 1-wadah flavonol-THP 12
7 Analisis NMR flavonol-THP (pelarut CDCl3) 13
8 Rendemen deproteksi flavonol-THP menjadi flavonol 14 9 Rendemen hasil sintesis 3,4-dihidroksibenzaldehida-THP 15 10 Analisis NMR benzaldehida mono-THP (pelarut CDCl3) 16 11 Analisis NMR benzaldehida di-THP (pelarut CDCl3) 17
12 Rendemen hasil sintesis fisetin 20
DAFTAR GAMBAR
1 Analisis retrosintesis fisetin 2
2 Reaksi sintesis resasetofenon-THP 5
3 Kromatogram KLT perbandingan resasetofenon (1) dan resasetofenon-
THP (2) 5
4 Mekanisme reaksi sintesis kalkon butein terproteksi-THP dengan metode
kondensasi Claisen-Schmidt berkataliskan-basa 7
5 Kromatogram KLT kalkon hasil sintesis, diamati pada 254 nm (a) dan 366 nm (b). Padatan kalkon hasil pemurnian dengan KLT preparatif (c) 8 6 Kromatogram KLT kalkon hasil pengasaman setelah disimpan 2 hari:
pada 254 nm (a) dan 366 nm (b) 9
7 Mekanisme siklisasi kalkon dengan metode AFO 11 8 Padatan flavonol-THP hasil sintesis dari kalkon-THP (a) serta
11 Produk kasar 3,4-dihidroksibenzaldehida-THP (kiri) dan dan kromatogram KLT-nya pada eluen n-heksana-etil asetat 8:2 (kanan) 15 12 Kromatogram KLT resasetofenon (a) dan 3,4-dihidroksibenzaldehida
(b) pada 254 nm 18
13 Campuran kalkon butein-THP hasil sintesis (a) serta kromatogram
KLT-nya pada 254 nm (b) dan 366 nm (c) 19
14 Campuran fisetin-THP hasil sintesis (a) serta kromatogram KLT-nya
pada 254 nm (b) dan 366 nm (c) 19
15 Fisetin hasil sintesis (a) dan kromatogram KLT-nya pada 366 nm (b) 19
DAFTAR LAMPIRAN
1 Bagan alir penelitian 24
2 Elusidasi produk resasetofenon-THP 25
3 Spektrum 1H NMR noda hasil sintesis kalkon pada Rf ~ 0.27 (500 MHz,
CDCl3) 28
4 Elusidasi produk kalkon-THP 29
5 Elusidasi produk flavonol-THP 32
6 Spektrum UV-Vis 7-hidroksiflavonol 35
7 Elusidasi produk 3,4-dihidroksibenzaldehida-THP 36
PENDAHULUAN
Flavonol merupakan salah satu kelompok dalam flavonoid yang potensial sebagai antioksidan dan mempunyai bioaktivitas sebagai obat. Berbagai substituen, terutama hidroksil dan metoksil, dapat terikat pada cincin benzena dan heterosiklik flavonol, menghasilkan beragam jenis flavonol, salah satunya adalah fisetin (7,3’,4’-tetrahidroksiflavonol). Senyawa ini lazim ditemukan dalam buah-buahan seperti stroberi (160.0 g/g), apel (26.λ g/g), kesemek (10.5 g/g), anggur (3.λ g/g), kiwi (2.0 g/g), dan persik (0.6 g/g). Selain itu, fisetin terdapat pada sayuran seperti akar teratai (5.8 g/g), bawang (4.8 g/g), tomat (0.1
g/g), dan mentimun (0.1 g/g) (Arai et al. 2000). Fisetin memiliki potensi sebagai antihiperlipidemik, antioksidan, antiradang, dan antidiabetes (Raygude et al. 2012). Akaishi et al. (2008) juga menyatakan bahwa fisetin memiliki bioaktivitas neurotropik, artinya mampu mengobati penyakit pada sistem saraf pusat, sehingga potensial sebagai obat alzheimer, parkinson, serta sebagai peningkat daya ingat.
Fisetin dapat diperoleh melalui proses isolasi dan pemurnian dari bahan alam. Namun, proses tersebut umumnya memerlukan waktu yang cukup panjang dan biaya yang besar. Selain itu, upaya menyintesis fisetin perlu dilakukan dalam rangka memenuhi kebutuhan obat dan pengembangan ilmu pengetahuan, di antaranya untuk sintesis turunan flavonol atau flavonoid lain yang lebih rumit.
Firmansyah (2009) telah melaporkan sintesis turunan fisetin 7,4’
-dialiloksi-3’-etoksiflavonol dari resasetofenon dan vanilin (3-etoksi-4-hidroksi-benzaldehida). Rendemen intermediet kalkon didapatkan sebesar 47.8% dan disiklisasi menjadi fisetin melalui reaksi Algar-Flynn-Oyamada (AFO) dengan rendemen 42.7%. Secara keseluruhan, turunan fisetin tersebut diperoleh dengan rendemen 17.9%.
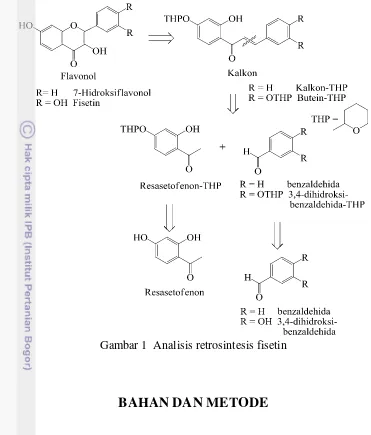
Penelitian ini didahului dengan sintesis 7-hidroksiflavonol sebagai struktur flavonol yang lebih sederhana daripada fisetin. Analisis retrosintesis yang digunakan diberikan pada Gambar 1. Resasetofenon dan benzaldehida diproteksi dengan gugus pelindung tetrahidropiran (THP). Kondensasi Claisen-Schmidt berkataliskan-basa kedua senyawa tersebut menghasilkan kalkon terproteksi (kalkon-THP). Siklisasi-AFO kalkon-THP dengan basa NaOH dan oksidator H2O2 (Elsa 2013) membentuk 7-hidroksiflavonol terproteksi (flavonol-THP), yang selanjutnya dideproteksi dengan katalis asam menjadi 7-hidroksiflavonol. Metode ini kemudian digunakan untuk sintesis fisetin dengan menggantikan benzaldehida dengan turunan 3,4-dihidroksi-nya.
Gambar 1 Analisis retrosintesis fisetin
BAHAN DAN METODE
Penelitian dilaksanakan pada bulan Januari sampai Juli 2013 di Laboratorium Kimia Organik, Departemen Kimia, IPB. Pengukuran spektroskopi ultraviolet-sinar tampak (UV-Vis) dilakukan di Laboratorium Bersama, Departemen Kimia, IPB dan spektroskopi resonans magnet inti (NMR) di Pusat Penelitian Kimia LIPI, Puspiptek, Serpong.
Alat dan Bahan
Alat-alat yang digunakan antara lain radas refluks, radas kromatografi kolom, pelat kromatografi lapis tipis (KLT) GF254, penguap putar, radas penentuan titik leleh, dan alat-alat kaca yang lazim di laboratorium serta instrumen untuk analisis spektroskopi.
tetrahidrofuran (THF), dan 3,4-dihidroksibenzaldehida), serta bahan-bahan teknis meliputi HCl 37%, etil asetat, n-heksana, metilena klorida (MTC), dan aseton. Semua bahan untuk analisis (p.a) digunakan tanpa praperlakuan. Semua pelarut teknis didistilasi 2 kali sebelum digunakan.
Langkah Percobaan
Penelitian diawali dengan proteksi resasetofenon dan 3,4-dihidroksi-benzaldehida dengan gugus THP, lalu keduanya direaksikan dengan KOH 60% dalam etanol membentuk kalkon butein terproteksi-THP. Siklisasi oksidatif kalkon tersebut dengan H2O2 30% dan NaOH dalam metanol-THF (1:1) membentuk fisetin terproteksi-THP yang melalui deproteksi THP dengan PTSA dalam metanol menghasilkan fisetin. Sebagai uji pendahuluan, rangkaian reaksi yang sama dilakukan dengan bahan awal resasetofenon dan benzaldehida, menghasilkan 7-hidroksiflavonol. Bagan alir sintesis ditunjukkan pada Lampiran 1. Hasil sintesis dicirikan berdasarkan titik lelehnya serta dengan spektrofotometer UV-Vis dan NMR.
Proteksi THP pada Resasetofenon dan 3,4-Dihidroksibenzaldehida (modifikasi Nakumura et al. 2002)
Sebanyak 10 mmol (2 ekuivalen) DHP dalam 30 mL MTC ditambahkan tetes demi tetes ke dalam campuran resasetofenon (5 mmol) dan PPTS (0.12 mmol) dalam 20 mL MTC. Campuran diaduk dengan pengaduk magnet pada suhu kamar selama 3 jam. Setelah itu, campuran dibilas dengan akuades sebanyak 3 kali, dikeringkan dengan Na2SO4 anhidrat, dan dipekatkan dengan penguap putar. Hasil resasetofenon-THP langsung digunakan tanpa dimurnikan lebih dulu. Proteksi 3,4-dihidroksibenzaldehida sama langkahnya, tetapi digunakan 15 mmol (3 ekuivalen) DHP. Produk kasar (campuran produk mono- dan diproteksi) juga langsung digunakan tanpa pemurnian.
Sintesis 2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon (modifikasi Elsa 2013)
Sintesis 7-(Tetrahidropiran-2-iloksi)flavonol (modifikasi Elsa 2013)
Ke dalam 1 mmol 2’-hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon ditambah-kan 1 mL H2O2 30% dan 1.5 mL NaOH 4 M yang dilarutditambah-kan dalam campuran metanol-THF 1:1 (20 mL/mmol kalkon). Pencampuran dilakukan pada suhu 0 oC, kemudian suhu dibiarkan naik ke suhu kamar dan diaduk selama 8 jam. Campuran hasil reaksi ditambahkan HCl 1 M hingga pH 6–7, padatan yang terbentuk disaring dengan kertas saring.
Pelepasan THP dari OH Fenolik (modifikasi Sogawa et al. 1993)
Sebanyak 1 mmol 7-(tetrahidropiran-2-iloksi)-flavonol dan 1 mmol PTSA dilarutkan dalam 10 mL metanol. Campuran diaduk selama 3 jam pada suhu kamar, lalu pelarut diuapkan dengan bantuan vakum (penguap putar). Padatan yang terbentuk dibilas dengan 10 mL akuades, kemudian dinetralkan dengan NaHCO3 5% dan diekstraksi beberapa kali dengan etil asetat hingga fraksi etil asetat tidak memunculkan noda lagi pada pelat KLT. Fase organik digabungkan, dicuci 3 kali masing-masing dengan 30 mL akuades, dikeringkan dengan Na2SO4 anhidrat, dan dipekatkan.
Sintesis Fisetin 1-Wadah
Sebanyak 5 mmol resasetofenon-THP dan 5 mmol 3,4-dihidroksibenzaldehida-THP dicampurkan dengan 20 mL etanol di dalam gelas piala. Setelah itu, ditambahkan tetes demi tetes KOH 60% sebanyak 20 mL pada suhu 0 oC. Setelah penambahan basa selesai, campuran diaduk selama 24 jam pada suhu kamar, kemudian langsung ditambahkan larutan 5 mL H2O2 30% dan 7.5 mL NaOH 4 M dalam campuran metanol-THF 1:1 (20 mL/mmol kalkon). Pencampuran dilakukan pada suhu 0 oC, kemudian suhu dibiarkan naik ke suhu kamar dan diaduk selama 8 jam. Campuran hasil reaksi ditambahkan HCl 1 M hingga pH 6–7, padatan yang terbentuk disaring dengan kertas saring, kemudian dideproteksi.
HASIL DAN PEMBAHASAN
2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)asetofenon
disebabkan resasetofenon-THP hanya berikatan hidrogen secara intramolekul, sedangkan resasetofenon juga berikatan hidrogen secara antarmolekul.
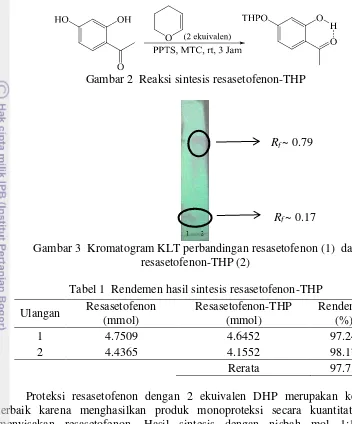
Gambar 2 Reaksi sintesis resasetofenon-THP
Gambar 3 Kromatogram KLT perbandingan resasetofenon (1) dan resasetofenon-THP (2)
Tabel 1 Rendemen hasil sintesis resasetofenon-THP Ulangan Resasetofenon
Proteksi resasetofenon dengan 2 ekuivalen DHP merupakan komposisi terbaik karena menghasilkan produk monoproteksi secara kuantitatif tanpa menyisakan resasetofenon. Hasil sintesis dengan nisbah mol 1:1 masih memunculkan noda resasetofenon dengan Rf ~ 0.17 (eluen: MTC) (Gambar 3).
Spektrum UV-Vis memperlihatkan 3 puncak serapan pada panjang gelombang 313.4, 271.8, dan 211.4 nm (Lampiran 2a) yang menunjukkan bahwa proteksi berlangsung selektif pada gugus OH para. Gugus OH orto tidak ikut terproteksi, dibuktikan dengan pergeseran batokromik puncak 313 nm ke 346 nm (Lampiran 2b) dengan penambahan NaOH serta ke 353 nm dengan penambahan AlCl3 yang relatif tidak berubah ketika ditambahkan HCl. Pola pergeseran ini khas untuk gugus OH fenolik yang berikatan hidrogen dengan gugus karbonil. Basa kuat NaOH mendeprotonasi gugus fenol sehingga meningkatkan delokalisasi elektron ke dalam cincin aromatik benzena, sedangkan AlCl3 membentuk kompleks segi enam tahan-asam Al3+ dengan gugus fenol dan karbonil yang bersebelahan sehingga tidak terurai dengan penambahan HCl (Markham 1988).
Spektrum 1H NMR resasetofenon-THP (Lampiran 1b) yang terangkum dalam Tabel 2 menunjukkan 13 sinyal. Sinyal singlet khas OH fenolik yang
Rf ~ 0.79
berikatan hidrogen intramolekul muncul di 12.59 ppm dan sinyal singlet khas proton asetil di 2.53 ppm. Tiga sinyal aromatik diidentifikasi, 2 sinyal di medan atas (upfield) karena sumbangan-elektron dari atom O di posisi orto atau para. Sinyal di 6.52 ppm berasal dari H-5’ dan sinyal di 6.58 ppm dari H-3’ berdasarkan nilai tetapan koplingnya. Pola doblet dari doblet dengan tetapan kopling (J) = 8.45 dan 2.6 Hz sesuai dengan H-5’ yang memiliki atom hidrogen tetangga di posisi
orto (H-6’) dan meta (H-3’), sedangkan pola doblet dengan J = 2.55 Hz sesuai dengan H-3’ yang berposisi meta terhadap H-5’. Satu sinyal lainnya di 7.60 ppm berasal dari H-6’, berada di medan bawah (downfield) karena tarikan-elektron dari gugus asetil di posisi orto. Gugus pelindung THP memunculkan sinyal triplet (1H) khas di 5.46 ppm hasil tarikan-elektron langsung dari 2 atom O serta sinyal multiplet (2H) di 3.81 dan 3.60 ppm hasil tarikan-elektron dari 1 atom O. Proton-proton metilena tersebut memunculkan 2 sinyal karena sifatnya yang diastereotopik. Sifat ini pula yang menyebabkan 6 atom H yang lain menghasilkan sinyal multiplet yang rumit di kisaran 1.57–1.96 ppm. Secara keseluruhan, terdapat 9H yang sesuai dengan jumlah H pada THP.
Tabel 2 Analisis NMR resasetofenon-THP (pelarut CDCl3)
H 500 MHz (ppm) (multiplisitas, J dalam Hz,
jumlah H)
metil di 26.34 ppm. Sinyal karbon di posisi orto dan para terhadap OH bergeser ke medan atas (104.04 dan 108.56 ppm), sedangkan sinyal karbon di posisi meta
tidak mengalami pergeseran tersebut dan muncul di 132.38 ppm. Karbon ipso
terhadap atom O (C-oksiaril) bergeser jauh ke medan bawah (163.63 dan 164.92 ppm). Karbon ipso terhadap gugus asetil berada di 114.58 ppm. Pergeseran ke medan atas terjadi karena atom tersebut juga berposisi orto terhadap OH. Sinyal karbon khas dari gugus pelindung THP diperoleh di 96.15 ppm (karbon asetal) dan di 62.24 ppm (C-5” yang mengikat atom O). Tiga sinyal karbon THP lainnya muncul di 18.58, 25.06, dan 30.05 ppm. Analisis spektroskopi telah membuktikan hasil sintesis sebagai resasetofenon-THP. Masih terdapat sejumlah puncak pengotor minor, tetapi tidak signifikan.
2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon
2’-Hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon (kalkon-THP) disintesis melalui kondensasi Claisen-Schmidt benzaldehida (fragmen C6-C1) dengan resasetofenon-THP (fragmen C2-C6) menggunakan katalis KOH 60%. Elsa
(2013) melaporkan bahwa katalis basa KOH 60% menghasilkan 2’
-hidroksikalkon dengan rendemen tertinggi dibandingkan dengan katalis-katalis lain yang diujikan, yaitu mencapai 56%. Basa akan mengambil hidrogen-α yang bersifat asam pada resasetofenon-THP sehingga mampu mengadisi benzaldehida dilanjutkan dengan eliminasi molekul air membentuk kalkon (Gambar 4). Gugus pelindung THP tahan terhadap kondisi basa yang digunakan dalam reaksi ini.
Kromatogram KLT hasil sintesis menunjukkan 3 noda dengan Rf ~ 0.77, 0.72, dan 0.29 (eluen: n-heksana-MTC 1:2), salah satunya adalah sisa resasetofenon-THP (Rf ~ 0.72) (Gambar 5a dan b). Noda kalkon (Rf ~ 0.77) bersifat khas, yaitu berwarna kuning yang bertahan lama pada pelat KLT serta berpendar di bawah sinar UV 254 dan 366 nm (ungu). Pemisahan dengan menggunakan KLTP menghasilkan kalkon berupa padatan kuning (Gambar 5c) dengan titik leleh 105–109 oC. Sogawa et al. (1993) melaporkan titik leleh 2’,4’ -dihiroksikalkon 145–146 oC. Dalam penelitian lain, Tran et al. (2008) menyebutkan titik leleh 2’-hidroksikalkon 78 oC. Kalkon hasil sintesis masih mengandung gugus pelindung THP sehingga bobot molekulnya lebih tinggi dan hanya berikatan hidrogen secara intramolekul.
Gambar 5 Kromatogram KLT kalkon hasil sintesis, diamati pada 254 nm (a) dan 366 nm (b). Padatan kalkon hasil pemurnian dengan KLT preparatif (c)
Rendemen kalkon-THP sangat rendah, yaitu 10% (Tabel 3). Senyawa sangat tidak stabil dan didapat berubah menjadi senyawa dengan Rf ~ 0.29 ketika diasamkan ke pH 6–7. Analisis dengan NMR tidak dapat menjelaskan struktur senyawa dengan Rf ~ 0.29 tersebut (Lampiran 3). Menghilangkan proses pengasaman hanya sedikit menaikkan rendemen kalkon menjadi 13%. Apabila kalkon hasil pengasaman disimpan selama kira-kira 2 hari, terbentuk noda baru di
Rf ~ 0.05 (Gambar 6), diduga merupakan hasil deproteksi gugus THP yang tidak tahan-asam. Noda sisa resasetofenon-THP juga selalu teramati meskipun benzaldehida ditambahkan berlebih. Faktor-faktor ini diduga menyebabkan rendemen kalkon menjadi rendah, jauh lebih rendah dibandingkan dengan laporan Sogawa et al. (1λλ3) yang berhasil menyintesis 2’,4’-dihidroksikalkon dengan rendemen 74%. Dahlen et al. (2006) telah menyintesis berbagai turunan kalkon dengan rendemen di atas 95%. Nisbah ekuivalen asetofenon-benzaldehida yang digunakan 1:1.05, menunjukkan bahwa pereaksi benzaldehida selalu dibuat agak berlebih.
Tabel 3 Rendemen hasil sintesis 2’-hidroksi-4’-(tetrahidropiran-2-iloksi)kalkon Perlakuan Resasetofenon-THP
(mmol) Kalkon (mmol) Rendemen (%)
Pengasaman 2.5137 0.2496 9.93
Tanpa pengasaman 2.5000 0.3341 13.36
Gambar 6 Kromatogram KLT kalkon hasil pengasaman setelah disimpan 2 hari:
pada 254 nm (a) dan 366 nm (b)
Spektrum UV-Vis kalkon-THP menunjukkan 3 puncak serapan pada panjang gelombang 339.0, 318.6, dan 255.4 nm (Lampiran 4a). Pola serapan ini serupa dengan yang dihasilkan oleh 2’-hidroksikalkon, yaitu pada 340.0, 316.5, dan 224.0 nm (Elsa 2013) (Lampiran 4b). Shin et al. (2001) juga menyatakan bahwa turunan kalkon memiliki puncak serapan UV yang khas di 340.0 dan 276.0 nm (Lampiran 4c). Pergeseran batokromik yang terjadi dibandingkan dengan 2’ -hidroksikalkon disebabkan oleh tambahan auksokrom O-THP di posisi C4’. Gugus hidroksil fenolik pada posisi orto dengan gugus karbonil keton juga menimbulkan pergeseran batokromik dengan AlCl3 seperti pada resasetofenon-THP (Lampiran 4d).
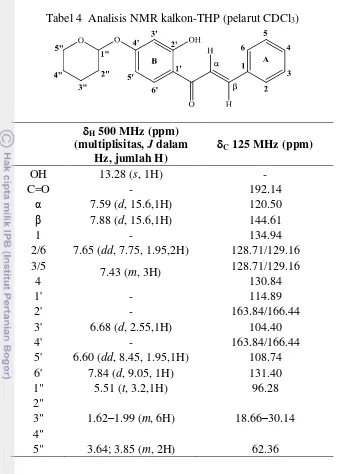
Spektrum 1H NMR kalkon-THP (Lampiran 4e) yang terangkum dalam Tabel 4 menunjukkan 14 sinyal. Sinyal khas OH-fenolik berikatan hidrogen intramolekul teramati di 13.28 ppm. Dua sinyal khas di 7.59 dan 7.88 ppm berturut-turut merupakan sinyal Hα dan Hβ. Keduanya memiliki tetapan kopling yang sama (J = 15.6 Hz) yang menunjukkan bahwa kalkon ini merupakan isomer
trans. Enam sinyal aromatik terbagi dalam cincin A dan B. Cincin A menghasilkan 2 sinyal yang masing-masing berasal dari 2 proton ekuivalen di posisi C2/6 dan C3/5, berturut-turut di 7.65 dan 7.43 ppm. Sinyal di 7.65 ppm ke medan bawah akibat efek tarikan-elektron dari sistem keton takjenuh-α,β. Sinyal proton C4 bertumpang tindih dengan sinyal proton C3/5 di 7.43 ppm. Cincin B memiliki 3 sinyal di 6.60, 6.68, dan 7.84 ppm, pola geseran kimia ini mirip dengan resasetofenon-THP. Selain itu, terdapat pula sinyal di 1.62–5.51 ppm yang berasal dari gugus THP.
Spektrum 13C NMR kalkon-THP (Lampiran 4f) menunjukkan 18 sinyal karbon (Tabel 4) yang mendukung analisis spektrum 1H NMR. Sinyal di 192.14 ppm merupakan sinyal karbon keton terkonjugasi dan 2 sinyal di 120.50 dan 144.61 ppm merupakan sinyal karbon-sp2 dalam sistem takjenuh-α,β. Karbon β
lebih tidak terperisai daripada karbon α karena efek resonans. Terdapat 10 sinyal
aromatik. Empat sinyal berasal dari cincin A. Dua sinyal dengan intensitas lebih tinggi di 128.71 dan 129.16 ppm dihasilkan oleh 2 atom karbon ekuivalen (C2/6 dan C3/5). Dua sinyal yang lain, salah satunya lebih ke medan bawah (134.94 ppm) karena tarikan-elektron langsung dari sistem keton takjenuh-α,β dan sinyal lainnya di 130.84 ppm. Cincin B memiliki 6 sinyal dengan geseran kimia yang serupa dengan resasetofenon-THP. Demikian pula dengan 5 sinyal THP di kisaran 18.66–96.28 ppm. Spektrum NMR telah membuktikan terbentuknya kalkon-THP.
Tabel 4 Analisis NMR kalkon-THP (pelarut CDCl3)
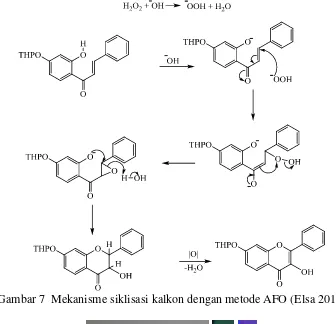
Gambar 7 Mekanisme siklisasi kalkon dengan metode AFO (Elsa 2013)
Gambar 8 Padatan flavonol-THP hasil sintesis dari kalkon-THP (a) serta kromatogram KLT-nya pada 254 nm (b) dan 366 nm (c)
Rendemen sintesis ini sangat tinggi, mencapai 82% (Tabel 5), tetapi karena rendemen kalkon-THP sangat rendah, secara keseluruhan flavonol-THP yang dihasilkan sangat sedikit, kurang dari 10%. Oleh karena itu, dilakukan sintesis flavonol-THP 1-wadah dari resasetofenon-THP dan benzaldehida. Kalkon-THP langsung disiklisasi menjadi flavonol-THP tanpa diasamkan dan dimurnikan. Sintesis 1-wadah ini meningkatkan rendemen flavonol-THP menjadi 2 kali lipat, yaitu 22% dari bobot resasetofenon (Tabel 6). Padatan flavonol-THP yang diperoleh berwarna cokelat, agak berbeda dari sebelumnya, tetapi memiliki nilai
Rf yang sama, yaitu 0.34 (eluen: n-heksana-MTC 1:2) (Gambar 9). Titik leleh flavonol-THP adalah 145–148 ˚C.
Tabel 5 Rendemen hasil sintesis flavonol-THP dari kalkon-THP
Tabel 6 Rendemen hasil sintesis 1-wadah flavonol-THP Ulangan Resasetofenon
Gambar 9 Padatan flavonol-THP hasil sintesis 1-wadah dari resasetofenon-THP dan benzaldehida (a) serta kromatogram KLT-nya pada 254 nm (b) dan 366 nm (c)
Spektrum UV-Vis flavonol-THP hasil sintesis dari kalkon-THP menunjukkan 3 puncak serapan khas pada panjang gelombang 337.6, 318.2, dan 251.8 nm (Lampiran 5a). Pola serapan ini serupa dengan yang dihasilkan oleh flavonol, yaitu pada 347.0, 320.0, dan 240.5 nm (Elsa 2013) (Lampiran 5b).
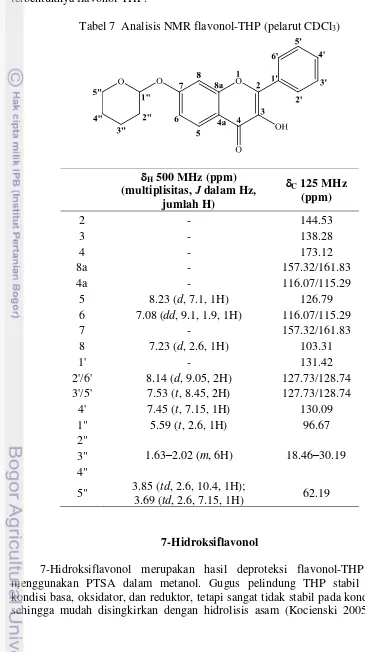
Spektrum 1H NMR flavonol-THP ini (Lampiran 5c) terangkum dalam Tabel 7 dan menunjukkan 13 sinyal. Enam sinyal berasal dari proton aromatik. Cincin A menghasilkan 3 sinyal yang serupa dengan pada resasetofenon-THP di 7.08, 7.23, dan 8.23 ppm. Cincin B memberikan 3 sinyal di 7.45, 7.53, dan 8.14 ppm yang khas untuk benzena monosubtitusi dengan gugus penarik-elektron. Sinyal proton OH-fenolik di C3 tidak teramati. Tujuh sinyal lainnya di 1.74–5.59 ppm merupakan sinyal proton khas THP.
Spektrum 13C NMR flavonol-THP (Lampiran 5d) menunjukkan 18 sinyal karbon (Tabel 7) yang mendukung analisis spektrum 1H NMR tersebut. Satu sinyal di 173.12 ppm berasal dari karbon keton terkonjugasi. Dua karbon kuaterner pada cincin C menghasilkan sinyal di 144.53 dan 138.28 ppm. Sinyal di 144.53 ppm menunjukkan C2 yang mengalami tarikan-elektron kuat dari atom O1 dan gugus keton dalam sistem keton terkonjugasi-α,β. Sinyal di 138.28 ppm yang lebih ke medan atas menunjukkan C3. Meskipun mengalami tarikan-elektron dari OH-fenolik, terjadi pemerisaian akibat sumbangan elektron dari atom O1. Cincin A menghasilkan 6 sinyal dengan pola geseran kimia yang serupa dengan
resasetofenon-THP. Cincin B menghasilkan 6 sinyal dengan pola yang khas untuk benzena monosubtitusi. Lima sinyal lainnya merupakan sinyal THP yang ditunjukkan di 18.46–96.67 ppm. Spektrum NMR telah membuktikan terbentuknya flavonol-THP.
Tabel 7 Analisis NMR flavonol-THP (pelarut CDCl3)
H 500 MHz (ppm) (multiplisitas, J dalam Hz,
jumlah H)
selain PTSA juga dapat digunakan dalam deproteksi gugus pelindung THP. Kuethe et al. (2009) telah mendeproteksi tert-butil amino-pirazolopiridina menggunakan berbagai macam katalis asam, seperti HCl, H2SO4, H3PO4 dalam pelarut asetonitril, DMF, dan toluena dengan rendemen mencapai 86%.
Deproteksi flavonol-THP menghasilkan padatan flavonol berwarna cokelat dengan titik leleh 244–249 oC. Titik leleh tersebut jauh lebih tinggi daripada flavonol-THP. Hal ini membuktikan bahwa gugus THP sudah berhasil dilepaskan dan menyisakan gugus OH-fenolik yang dapat berikatan hidrogen antarmolekul. Pemantauan dengan KLT menghasilkan noda tunggal pada Rf ~ 0.46 (eluen: n -heksana-etil asetat 9:1). Nilai Rf ini berbeda dengan flavonol-THP di Rf ~ 0.34 (eluen: n-heksana-MTC 1:2). Seperti halnya flavonol-THP, noda 7-hidroksiflavonol berwarna cokelat yang bertahan lama pada pelat KLT serta berpendar di bawah sinar UV 254 dan 366 nm (kuning) (Gambar 10). Rendemen proses deproteksi ini mencapai 98% (Tabel 8). Maiti dan Roy (1996) telah melaporkan deproteksi gugus pelindung THP dari beberapa senyawa alkohol/fenol dengan rendemen 80–92%.
Tabel 8 Rendemen deproteksi flavonol-THP menjadi flavonol Ulangan Flavonol-THP
Gambar 10 Padatan flavonol (a) serta kromatogram KLT-nya pada 254 nm (b) dan 366 nm (c)
Spektrum UV-Vis flavonol menunjukkan 3 puncak serapan khas pada panjang gelombang 337.8, 320.8 dan 253.0 nm (Lampiran 6a), serupa dengan flavonol-THP. Pergeseran batokromik ke panjang gelombang 397.6, 341.8, dan 279.8 nm (Lampiran 6b) pada penambahan NaOH membuktikan adanya
substituen OH di posisi C4’. Analisis menggunakan NMR tidak dilakukan, tetapi
senyawa ini diduga 7-hidroksiflavonol berdasarkan analisis di atas.
3,4-Dihidroksibenzaldehida-THP
3,4-Dihidroksibenzaldehida memiliki 2 gugus OH yang perlu diproteksi dengan THP. Metode proteksi sama seperti pada proteksi resasetofenon, tetapi nisbah 3,4-dihidroksibenzaldehida dengan pereaksi DHP diragamkan, demikian pula waktu reaksi. Hasil proteksi kasar berwarna kuning dan menunjukkan 2 noda pada pelat KLT dengan Rf ~ 0.47 dan 0.31 (eluen: n-heksana-etil asetat 8:2) (Gambar 11). Noda berwarna cokelat pada pelat KLT dan bertahan untuk waktu yang lama. Noda dengan Rf ~ 0.47 diduga 3,4-bis(tetrahidropiran-2-iloksi)benzaldehida (benzaldehida di-THP) dan Rf ~ 0.31 diduga 3/4-hidroksi-3/4-(tetrahidropiran-2-iloksi)benzaldehida (benzaldehida mono-THP). Benzaldehida di-THP lebih nonpolar daripada benzaldehida mono-THP sehingga menghasilkan
Rf lebih besar pada eluen nonpolar.
Semakin tinggi nisbah 3,4-dihidroksibenzaldehida dengan pereaksi DHP dan semakin lama waktu reaksi, rendemen total semakin kecil (Tabel 9). Seiring dengan itu, rendemen produk diproteksi cenderung meningkat, sedangkan rendemen produk monoproteksi menurun. Rendemen total maksimum diperoleh dengan nisbah 3,4-dihidroksibenzaldehida-DHP 1:3 dan waktu reaksi 3 jam. Nisbah tersebut sesuai dengan yang dilaporkan Sogawa et al. (1993). Penyebab turunnya rendemen total pada nisbah pereaksi yang lebih tinggi dan waktu reaksi yang lebih lama belum diketahui secara pasti.
Gambar 11 Produk kasar 3,4-dihidroksibenzaldehida-THP (kiri) dan dan kromatogram KLT-nya pada eluen n-heksana-etil asetat 8:2 (kanan)
Tabel 9 Rendemen hasil sintesis 3,4-dihidroksibenzaldehida-THP Nisbah 3,4-pada panjang gelombang 297.8, 271.0, dan 225.2 nm (Lampiran 7a). Tidak terjadi pergeseran dengan penambahan NaOH, yang menunjukkan bahwa kedua OH-fenolik telah terproteksi. Spektrum UV-Vis noda dengan Rf ~ 0.31 menunjukkan 3 puncak serapan pada panjang gelombang yang hampir sama, yaitu 300.6, 276.0,
Rf ~ 0.47
dan 229.0 nm (Lampiran 7b). Terjadi pergeseran batokromik ke panjang gelombang 343.6, 297.0, dan 248,6 nm (Lampiran 7c) dengan penambahan NaOH, menandakan masih ada OH fenolik.
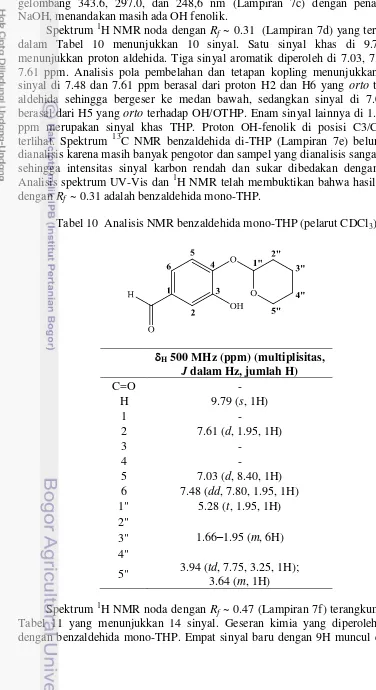
Spektrum 1H NMR noda dengan Rf ~ 0.31 (Lampiran 7d) yang terangkum dalam Tabel 10 menunjukkan 10 sinyal. Satu sinyal khas di 9.79 ppm menunjukkan proton aldehida. Tiga sinyal aromatik diperoleh di 7.03, 7.48, dan 7.61 ppm. Analisis pola pembelahan dan tetapan kopling menunjukkan bahwa sinyal di 7.48 dan 7.61 ppm berasal dari proton H2 dan H6 yang orto terhadap aldehida sehingga bergeser ke medan bawah, sedangkan sinyal di 7.03 ppm berasal dari H5 yang orto terhadap OH/OTHP. Enam sinyal lainnya di 1.66–5.28 ppm merupakan sinyal khas THP. Proton OH-fenolik di posisi C3/C4 tidak terlihat. Spektrum 13C NMR benzaldehida di-THP (Lampiran 7e) belum dapat dianalisis karena masih banyak pengotor dan sampel yang dianalisis sangat sedikit sehingga intensitas sinyal karbon rendah dan sukar dibedakan dengan derau. Analisis spektrum UV-Vis dan 1H NMR telah membuktikan bahwa hasil sintesis dengan Rf ~ 0.31 adalah benzaldehida mono-THP.
Tabel 10 Analisis NMR benzaldehida mono-THP (pelarut CDCl3)
H 500 MHz (ppm) (multiplisitas,
J dalam Hz, jumlah H)
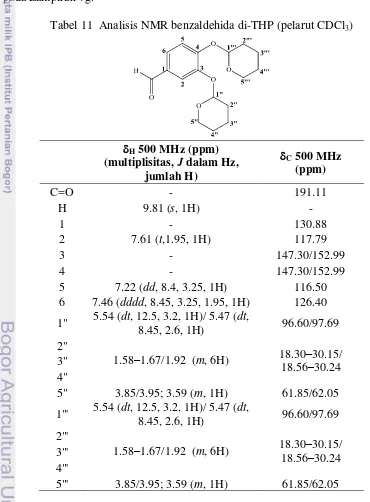
5.47 ppm sehingga total proton alifatik berjumlah 18, menunjukkan bahwa kedua OH-fenolik sudah terproteksi oleh THP. Puncak-puncak sinyal dalam spektrum 1
H NMR semuanya membelah menjadi doblet. Belum diketahui pasti penyebab hal tersebut, tetapi kemungkinan berhubungan dengan regangan sterik akibat interaksi 2 gugus OTHP yang berdekatan yang menyebabkan struktur cincin aromatik pada benzaldehida di-THP menjadi tidak planar (Lampiran 7g). Perhitungan dengan perangkat lunak Hyperchem versi 8.0 menunjukkan bahwa benzaldehida di-THP memiliki energi yang sangat tinggi, yaitu 220.81 kkal/mol. Energi berbanding terbalik dengan kestabilan molekul, maka molekul benzaldehida di-THP tidak stabil. Optimasi konformasi molekul ini secara mekanika molekul dengan medan gaya AMBER masih menghasilkan energi molekul yang tinggi, yaitu 27.78 kkal/mol. Konformasi optimum ini ditampilkan pada Lampiran 7g.
Tabel 11 Analisis NMR benzaldehida di-THP (pelarut CDCl3)
H 500 MHz (ppm) (multiplisitas, J dalam Hz,
Spektrum 13C NMR noda dengan Rf ~ 0.47 (Lampiran 7h) menunjukkan 17 sinyal karbon (Tabel 11) yang mendukung analisis spektrum 1H NMR. Satu sinyal di 191.11 ppm dihasilkan oleh karbon aldehida terkonjugasi. Enam sinyal aromatik terdiri atas 4 sinyal di medan bawah, yaitu 2 sinyal karbon ipso terhadap OTHP (147.30 dan 152.99 ppm), 1 sinyal karbon ipso terhadap asetil (130.88 ppm), dan 1 sinyal karbon orto terhadap aldehida (126.40 ppm) serta 2 sinyal di medan atas dari karbon orto terhadap OTHP, yaitu di 116.50 dan 117.79 ppm. Sepuluh sinyal dari gugus THP terdapat di 18.30–97.69 ppm. Puncak-puncak sinyal dalam spektrum 13C NMR juga membelah menjadi doblet. Analisis spektrum UV-Vis, 1H dan 13C NMR menunjukkan bahwa hasil sintesis dengan Rf ~ 0.47 adalah benzaldehida di-THP.
Fisetin
Fisetin disintesis dengan mengadaptasi metode sintesis 1-wadah 7-hidroksiflavonol. Fisetin tidak berhasil didapatkan ketika sintesis dilakukan tanpa menggunakan gugus pelindung. Sintesis tersebut mengahasilkan 4 noda, dengan 2 noda utama hasil pemisahan dengan kromatografi kolom dan KLTP bukan kalkon butein, melainkan bahan awal, yaitu resasetofenon dan 3,4-dihidroksibenzaldehida dengan Rf berturut-turut ~0.17 (eluen: MTC) dan 0.58 (eluen: MTC-etil asetat 1:1) (Gambar 12). Sogawa et al. (1993) pernah melaporkan sintesis berbagai turunan kalkon dengan dan tanpa gugus pelindung THP. Rendemen yang dihasilkan 10% tanpa gugus pelindung THP dan 40% dengan gugus pelindung THP.
Gambar 12 Kromatogram KLT resasetofenon (a) dan 3,4-dihidroksibenzaldehida
(b) pada 254 nm
Dalam sintesis 1-wadah fisetin, hasil kondensasi Cleisen-Schmidt berupa campuran berwarna merah darah yang menghasilkan 3 noda KLT pada Rf ~ 0.79, 0.69, dan 0.63 (eluen: MTC) (Gambar 13). Noda dengan Rf ~ 0.69 dan 0.63 diduga merupakan kalkon butein tri-THP dan di-THP yang berturut-turut berasal dari benzaldehida di-THP dan mono-THP. Hasil siklisasi AFO berupa campuran berwarna jingga yang menghasilkan 2 noda KLT dengan Rf ~ 0.79 dan 0.23 (eluen: MTC). Noda pada Rf ~ 0.23 mengekor dan diduga adalah 2 noda fisetin tri-THP dan di-THP yang hanya berpendar di bawah lampu UV 366 nm (Gambar 14). Noda dengan Rf ~ 0.79 merupakan sisa reaktan resasetofenon-THP.
Gambar 13 Campuran kalkon butein-THP hasil sintesis (a) serta kromatogram KLT-nya pada 254 nm (b) dan 366 nm (c)
Gambar 14 Campuran fisetin-THP hasil sintesis (a) serta kromatogram KLT-nya
pada 254 nm (b) dan 366 nm (c)
Deproteksi hasil siklisasi dilanjutkan pemurnian dengan KLTP menghasilkan fisetin berupa padatan kuning. Fisetin memberikan noda KLT tunggal dengan Rf ~ 0.68 (eluen: n-heksana-etil asetat 3:7) di bawah lampu UV 366 nm (putih cerah) (Gambar 15), tetapi tidak berpendar di bawah lampu UV 254 nm.
Gambar 15 Fisetin hasil sintesis (a) dan kromatogram KLT-nya pada 366 nm (b)
Rendemen fisetin secara keseluruhan hanya mencapai 0.98% dibandingkan dengan mmol awal resasetofenon yang digunakan (Tabel 12), jauh lebih rendah daripada rendemen 7-hidroksiflavonol. Sisa reaktan resasetofenon-THP pada campuran kalkon butein-THP dan fisetin-THP hasil sintesis didapati sangat dominan. Pendar yang sangat kuat dihasilkan di bawah lampu UV 254 nm.
a
b
c
a
b
c
Halangan sterik yang lebih besar pada benzaldehida mono- dan di-THP dibandingkan dengan benzaldehida diduga menurunkan reaktivitas dalam reaksi kondensasi dan siklisasi sehingga hanya sedikit kalkon yang terbentuk. Menurunkan komposisi resasetofenon-THP, memperlama waktu reaksi, atau meningkatkan suhu reaksi merupakan beberapa alternatif yang diperkirakan dapat meningkatkan rendemen.
Tabel 12 Rendemen hasil sintesis fisetin
Dosis (mmol) Resasetofenon (mmol) Fisetin (mmol) Rendemen (%)
1 1.1542 0.0025 0.22
5 4.6284 0.0448 0.98
Spektrum UV-Vis fisetin menunjukkan 3 puncak serapan khas flavonol di 343.6, 324.8, dan 253.4 nm (Lampiran 8a). Pola serapan fisetin ini serupa dengan 7-hidroksiflavonol, tetapi terjadi pergeseran batokromik akibat bertambahnya substituen OH pada fisetin. Penambahan NaOH menyebabkan pergeseran batokromik berturut-turut ke 401.8, 337.4, dan 282.4 nm (Lampiran 8b). Hal tersebut menunjukkan keberadaan gugus OH-fenolik pada fisetin dan keberhasilan proses deproteksi fisetin-THP. Menurut Roy et al. (2013), spektrum UV fisetin memiliki 3 puncak serapan di 362.0, 325.0, dan 250.0 nm (Lampiran 8c) yang hampir sama dengan spektrum fisetin hasil sintesis.
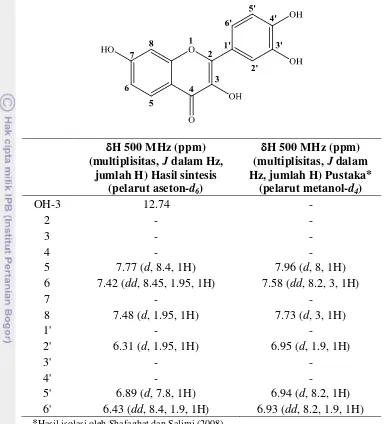
Tabel 13 Analisis NMR fisetin hasil sintesis dibandingkan dengan pustaka
H 500 MHz (ppm) (multiplisitas, J dalam Hz,
jumlah H) Hasil sintesis *Hasil isolasi oleh Shafaghat dan Salimi (2008)
SIMPULAN DAN SARAN
Senyawa 7-hidroksiflavonol berhasil disintesis melalui reaksi kondensasi Claisen-Schmidt dan siklisasi-oksidatif AFO dalam 1-wadah. Rendemen yang diperoleh mencapai 22% dengan waktu sintesis selama 7 hari, lebih cepat dibandingkan dengan isolasi dari bahan alam. Senyawa fisetin yang disintesis dengan metode yang sama jauh lebih rendah rendemennya, yaitu 1%.
menggunakan gugus pelindung fenol yang berukuran kecil, seperti metil (Me) dan metoksimetil (MOM).
DAFTAR PUSTAKA
Akaishi T, Morimoto T, Shibao M, Watanabe S, Sakai-Kato K, Utsunomiya-Tate N, Abe K. 2008. Structural requirement for the flavonoid fisetin in inhibiting formation of amyloid β protein. Neurosci Lett. 444(3):280-285. Arai Y, Watanabe S, Kimira M, Shimoi K, Mochizuki R, Kinae N. 2000. Dietary
intakes of flavonols, flavones and isoflavones by Japanese women and the inverse correlation between quercetin intake and plasma LDL cholesterol concentration. J Nutr. 130(9):2243-2251.
Dahlen K, Walln EAA, Grtli M, Luthman K. 2006. Synthesis of 2,3,6,8-tetrasubstituted chromone scaffolds. J Org Chem. 71(18):6863-6871.
Elsa L. 2013. Sintesis flavonol melalui 2’-hidroksikalkon [skripsi]. Bogor (ID):
Institut Pertanian Bogor.
Firmansyah D. 2009. Sintesis fisetin [tesis]. Bandung (ID): Institut Teknologi Bandung.
Jun N, Hong G, Jun K. 2007. Synthesis and evaluation of 2’,4’,6’
-trihydroxychalcones as a new class of tyrosinase inhibitors. Bioorg Med Chem. 15(6):2396-2404.
Kocienski PJ. 2005. Protecting Groups. Ed ke-3. Stuttgart (DE): Georg Thieme. Kuethe JT, Tellers DM, Weissman SA, Yasuda N. 2009. Development of a
sequential tetrahydropyran and tertiary butyl deprotection: high-troughput experimentation, mechanistic analysis, and DOE optimization. Org Proc Res & Development. 13(3):471-477.
Maiti G, Roy SC. 1996. A mild and efficient method for selective deprotection of tetrahydropyranyl ethers to alcohol. J Org Chem. 61(17):6038-6039.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung: ITB Pr. Terjemahan dari: Techniques of Flavonoid Identification.
Nakamura C, Kawasaki N, Miyataka H, Jayachandra E, Kim IH, Krik KL, Taguchi T, Takeuchi Y, Hori H, Satoh T. 2002. Synthesis and biological activities of fluorinated chalcone derivatives. Bioorg Med Chem Lett. 10(3):699-706.
Nay B, Arnaudinaud V, Vercauteren J. 2001. Total synthesis of asymmetric flavonoids: the development and applications of 13C-labelling. C R Chimie. 5:577-581.
Raygude KS, Kandhare AD, Ghosh P, Bodhankar SL. 2012. Anticonvulsant effect of fisetin by modulation of endogenous biomarkers. Biomed & Prevent Nutr. 2(3):215-222.
Roy AS, Pandey NK, Dasgupta S. 2013. Preferential binding of fisetin to the native state of bovine serum albumin: spectroscopic and docking studies.
Shafagat A, Salimi F. 2008. Extraction and determining of chemical structure of flavonoids in Tanacetum parthenium (L.) Schultz Bip. From Iran. J Sci I A U. 18(68):39-42.
Shin DM, Song DM, Jung KH, Moon JH. 2001. Photochemical transformation of chalcone derivatives. J Photosci. 8(1):9-12.
Sogawa S, Nihro Y, Ueda H, Izumi A, Miki T, Matsumoto H, Satoh T. 1993. 3,4-Dihydroxychalcones as potent 5-lipoxygenase and cyclooxygenase inhibitor. J Med Chem. 36(24):3904-3909.
Solovky DA. 2013. Sintesis 3-benzoil-7-hidroksiflavon dari resorsinol [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Tran T, Park H, Ecker GF, Thai K. 2008. 2’-Hydroxychalcone analogues:
synthesis and structure-PGE2 inhibitory activity relationship. Di dalam: Seijas BA, Tato MPV, editor. Proceedings of ECSOC-12.12th International Electronic Conference on Synthesis Organic Chemistry (ECSOC-12); 2008 Nov 1-30; Basel (CH). MDPI. hlm 1-7.
Lampiran 1 Bagan alir penelitian
A : 3,4-dihidroksibenzaldehida
B : 3,4-bis(tetrahidropiran-2-iloksi)benzaldehida (benzaldehida di-THP) C : resasetofenon
D : 2'-hidroksi-4'-(tetrahidropiran-2-iloksi)asetofenon (resasetofenon-THP) E : 2'-hidroksi-4'-(tetrahidropiran-2-iloksi)kalkon (kalkon-THP)
F : 2'-hidroksi-4',3,4-tris(tetrahidropiran-2-iloksi)kalkon (butein-THP) G : 7-(tetrahidropiran-2-iloksi)flavonol (flavonol-THP)
H : 7,3',4'-tris(tetrahidropiran-2-iloksi)flavonol (fisetin-THP) I : 7-hidroksiflavonol
Lampiran 2 Elusidasi produk resasetofenon-THP
a) Spektrum UV-vis
b) Pergeseran panjang gelombang (nm) (pelarut metanol) Puncak
Resasetofenon-THP + NaOH + AlCl3 + AlCl3 + HCl
1 313.4 346.0 353.6 358.0
2 271.8 272.6 295.0 295.0
3 211.4 211.8 211.8 212.0
Resasetofenon-THP + NaOH
+ AlCl
3
+ AlCl
3 + HCl
A
b
so
rb
an
s
c) Spektrum 1H-NMR (500 MHz, CDCl3).
K
el
im
p
ah
an
d) Spektrum 13C-NMR (125 MHz, CDCl3).
K
el
im
p
ah
an
Lampiran 3 Spektrum 1H NMR noda hasil sintesis kalkon pada Rf ~ 0.27 (500 MHz, CDCl3)
K
el
im
p
ah
an
Lampiran 4 Elusidasi produk kalkon-THP
Spektrum UV-Vis kalkon-THP hasil sintesis (a), 2’-hidroksikalkon (Elsa 2013) (b), dan turunan kalkon (Shin et al. 2001) (c)
Kalkon-e) Spektrum 1H NMR (500 MHz, CDCl3). THP
K
el
im
p
ah
an
f) Spektrum 13C NMR (125 MHz, CDCl3)
Ke
li
m
p
ah
an
Lampiran 5 Elusidasi produk flavonol-THP
Spektrum UV-Vis flavonol-THP hasil sintesis (a) dan flavonol (Elsa 2013) (b)
A
b
so
rb
an
s
Panjang Gelombang(nm)
A
b
so
rb
an
s
Panjang Gelombang(nm)
c) Spektrum 1H NMR (500 MHz, CDCl3) THP
K
el
im
p
ah
an
d) Spektrum 13C NMR (125 MHz, CDCl3)
K
el
im
p
ah
an
Lampiran 6 Spektrum UV-Vis 7-hidroksiflavonol
a) Spektrum UV-vis
b) Pergeseran panjang gelombang (nm) (pelarut metanol) Puncak
7-Hidroksi-flavonol + NaOH
1 337.8 397.6
2 320.8 341.8
3 253 279.8
Flavonol
Flavonol + NaOH
A
b
so
rb
an
s
Lampiran 7 Elusidasi produk 3,4-dihidroksibenzaldehida-THP
a) Spektrum UV-Vis benzaldehida di-THP
b) Spektrum UV-Vis benzaldehida mono-THP c) Pergeseran panjang gelombang (nm) (pelarut metanol)
Puncak Benzaldehida
mono-THP + NaOH
1 300.6 346.2
2 276.0 297.2
3 229.0 248.6
Sampel
Sampel + NaOH
Sampel
Sampel + NaOH
A
b
so
rb
an
s
Panjang Gelombang(nm)
A
b
so
rb
an
s
d) Spektrum 1H NMR (500 MHz, CDCl3)
K
el
im
p
ah
an
e) Spektrum 13C NMR (125 MHz, CDCl3)
K
el
im
p
ah
an
f) Spektrum 1H NMR (500 MHz, CDCl3)
K
el
im
p
ah
an diTHP
g) struktur 3 dimensi hasil optimalisasi dengan Hyperchem versi 8.0 tampak dari depan (kiri) dan tampak dari samping (kanan).
Optimalisasi dilakukan secara mekanika molekul dengan medan gaya AMBER.
h) Spektrum 13C NMR (125 MHz, CDCl3)
Ke
li
m
p
ah
an
Lampiran 8 Elusidasi produk fisetin
Spektrum UV-Vis fisetin hasil sintesis (a) dan fisetin (Roy et al. 2013) (b)
c) Pergeseran panjang gelombang (nm) (pelarut metanol) Puncak Fisetin + NaOH
1 343.6 401.8
2 324.8 337.4
3 253.4 282.4
A
b
so
rb
an
s
Panjang Gelombang(nm)
A
b
so
rb
an
s
Panjang Gelombang(nm)
Sampel
d) Spektrum 1H NMR (pelarut aseton-d6)
K
el
im
p
ah
an
RIWAYAT HIDUP
Penulis dilahirkan di Lamongan pada tanggal 1 April 1991 dari pasangan Kasmuji dan Yatmuni. Penulis merupakan putri kedua dari 2 bersaudara (saudara kembar).
Tahun 2009, penulis lulus dari SMA Unggulan BPPT Al-Fattah Lamongan dan pada tahun yang diterima di Mayor Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).