ADSORPSI
DAN
DESORPSI
ION
KROMIUM
(VI)
PADA
HDTMA.BENTONIT
ADSORPTTON
AND
DESORPTTON OF
CHROMTUM
(Vr)
rON
ON
HDTMA.BENTONITE
Eti
Rohaetir,,
Janti
Widyaningsihr, Iskandar2
-
tDepartemen
Kimia,
FMIPA-Institut
Pertanian Bogor
zDepartemen
ilmu
Tanah dan Sumberdaya Lahan, Fakultas Pertanian
Institut
Pertanian Bogor
Abstrak
Bentonit memiliki kematnpuan adsorpsi vang tinggi terhadap katior-r seperli dicenninkan oleh nilai kapasitas
tukar
kationnya(KTK)
yangtinggi.
Penelitianrni
bcrtujuan agar bentonitjuga memiliki
kernampuan adsorpsi yang tinggi terhadap anion kromir"rn-r 1\:l).
sebagar CrlO7r . melalui aktivasi dengan menggunakankation
heksadesiltrimetilamonium (l'IDTtvlA).
Bentonit asal
Leuwiliang-Bogor, direaksikan denganI-IDTMA' dengan jumlah setara 259lo.509/o dan 100 ?u
KTK
bentonit.Uji
adsorpsi Cr(VI) olehHDTMA-beutonit dilakukan pada pH, rvaktu kontak dan konsentrasi
Cr(VI)
berbeda. Hasil analisis menunjukkan bahwa KTK bentonit Ler,nvrliang menumn dari 54.3 rne 100g meniadi sekitar 20,7 sarnpai 45,1 me/100 g.Keasaman bentonit juga rnengalami penumnan dari 4.95 meig pada bentonit alami menjadi sekitar 0,60
-3,62 n-re/g.Kondisi optimun-r adsorpsi Cr(VI) oleh bentonit dan HDTMA-bentonitterjadi pada kisaran pH 2
sampai 5. rvaktu kontak 3 sampai 4 jarn dan konsentrasi
Cr(Vl)
200 sampai 500 ppm. Aktivasi bentonit dengan HDTMA'meningkatkan kapasitas adsorpsi bentonrt terhadapCr(VI)
dari 4,44 mg/g menjadi 11,96satnpai 22.09 mglg. Desorpsi Cr(VI) dari HDTMA-bentonitoleh akuades, HCI 0.1
N
dan CaCl2I
M
kecil, yaitu berkisar antara 0.89-4. 150A. yang menunjukkan bahwa Cr(VI) terikat kuat di dalam HDTMA-bentonit.Kata
kunci:
adsorpsi,bentonit,
desorpsi, heksadesiltrimetilamonium(HDTMA"), kromium
(VI), montmorillonit.Abstract
Bentouite has a high adsorption capacity tou,ards cations as shor','ed by the cation exchange capacity (CEC). This study aims to irnprove bentonite, soits has a high adsorption capability torvardchromium
(VI),
Cr2O72-,through activation by used hexadecyltrimethylarnmonium cation (HDTMA
t).
Bentonite fromLeuwiliang-Bogor, reacted
with
HDTMA'
u'ith
an equivalent nurnberof
25oA.50o/o and. 100% CEC bentonite. HDTlV{A-bentonite testedits
abiliryto
adsorps and desorpsCr
(VI)
anion. Testof
HDTMA-bentonite adsorption capability canied ondifferent pH. contact trrne and concentration of Cr (VI). The analysis showedthat the bentonite CEC Leuwiliang decreased fron-r 5-1.3 me 100g to about 20.7 to 45.1 me/100 g. The acidity
of bentonite also decreased from 4.95
me/g
to about 0.60 to 3.62me/g.
Optimum conditions of Cr (VI)adsorption by bentonite and HDTMA-bentonite occurs
in
pH range 2 to 5, contact time 3 to 4 hours andconcentration of Cr
(Vl)
200 to 500 ppm. Activation of bentonite with HDTMA*
increases the adsorption capacitl,of'bentonitc from 4.44 mg/g to 11.96 - 22.09rlg
e. Desorption of Cr (VI) of HDTMA-bentonite by distilled rvater, 0.1 N HCI and 1M
CaCl2 was small. rangirrg from 0.89-4.15%, which indicates that Cr (Vi)strongly bound in the HDTMA-bentonite.
1.
PENDAHULUAN
Salah
satu
logam berat
yang
merupakan sumberpolusi
adalahKromium
(Cr).
Logamberat
ini di
alam
terutama
sebagai bentukkromium
valensitiga
seperti dalam senyawaCrCl3,
dan
sebagai
kromium
heksavalen,yakni
sebagai anionkromat
CrO+- atau aniondikrornat
CrzOt2-.
Logam
ini
banyakdigunakan
dalam
industri
eiektroplating,penyamakan
kulit,
pulp
ser-ta pemurnianbijih
dan petroleum.Logam Cr dalam bentuk
Kromium
heksavalen(CrVI)
diketahui
dapat
menyebabkankeracunan
pada
konsentrasi
rendah
danrnenyebabkan
mutagen pada tumbuhan
danbinatang
(Ramoset
a1.,2008).Oleh
karenaitu,
kandungan
Cr
dalarn
limbah
industriharus
diminirnumkan
sebelum
limbahdibuang
ke
lingkungan,
dan untuk
itudiperlukan
adsorben
yang
mudah
didapatserta ekonomis. Salah satu
adsorben alami yang dapat dimanfaatkan dan cadangannya di Indonesiacukup
melimpah
adalah bentonit,yaitu batu liat yang
mengandungrnontmorillonit
dalam
jumlah
relatif
tinggi.Saat
ini
bentonit, terutama dalam bentukCa-bentonit,
lebih
banyak dirnanfaatkan sebagaibleaching
earth
dalam
proses
pengolahanminyak sawit mentah menjadi minyak goreng.
Montmorillonit
merupakan
mineral
liat
aluminosilikat berlapis tipe
2 :
1 yang mampumengembang
dan
mengkerut.
Permukaanmontmorillonit
ini
bermuatannegatif,
yangmuncul
akibat
substitusi
isomorfik
padalembar tetraeder dan lembar oktaeder. Selain
itu
montmorillonit
jugu
memiliki
luas permukaan spesifik yangtinggi
karena ukuranbutirnya
yang
sangat
halus
dan
adanya"permukaan
dalam". Oleh
sebabitu
bentonitmemiliki
kemampuan
yang
tinggi
dalamdapat
mengadsorpsi
zat
wama
tekstil.Carizosa
etal
(2004) melaporkan modihkasibentonit
oleh kation
organic
kuartener,HDTMA,
menjerap herbisida dicamba
dan betazonelebih
baik
dibandingkan modifikasioleh
alkil
ammonium.dengan
mengadsorpsi
kation-kation
dan
sangatrendah
dalam
mengadsorpi
anion.
Sifat permukaanbentonit
ini
dapat
dimodifikasimelalui
prosesaktivasi,
salah safunya yaitudengan
menggunakan
HDTMA+
yangmerupakan surfaktan
kationik. Melalui
prosespeftukaran
kation, HDTMA*
akanmenggantikan
kation-kation
dalam
ruang antarlapisan bentonit, seperti Ca2t, Mg2* danNa*, dan mengubah sifat permukaan bentonit
tersebut
yang
awalnya
hidrofilik
menjadihidrofobik
atauorganofilik (Boyd
etal
1988; Hohmuth dan Hofmann, 1993). Kation-kationorganik
tersebut
diikat
dalarn
ruangantarlapisan
bentonit
dengankuat,
sehinggasulit dipertukarkan kembali oleh kation-kation
anorganik (Lagaly, I 993 ).
Jaynes dan
Boyd
(1991)
menemukan bahwabentonit
yang telah
diaktivasi
denganHDTMA, yang
menghasilkan
jarak
basalsekitar
20 A
sangat
efektif
dalammengadsorpsi senya\\,a
organik
non-ionikyang
iamt
dalarn
atr.
Daya
adsorpsi
ini
meningkat
sejalan
dengan
meningkatnyakadar
HDTMA
danjarak
basal. SelanjutnyaStockmeyer
dan
Kruse (1991)
menemukanbahwa
senyawaHDTMA-bentonit
ini
juga
dapat
mengadsorpsi logam-logam
berat. Iskandar,Tasrifdan
Djajakirana (1998) sertaIskandar
dan Djajakirana (2006)
melakukanpenelitian daya
adsorpsi HDTMA-bentonit
terhadap
zat organik dan
anorganik
dalamiimbah
cair
industri tekstil,
pupuk, pestisida,sefta
pulp
dan kertas. Hasil penelitiau ini
menunjukkan bahwa
HDTMA-bentonit
dapatmenurunkan konsentrasi
krorn
secara nyata,menurunkan
pH,
warna,
turbiditas,
total padatan, COD danBOD
dalam cairan lirnbahtekstil.
Ceyhan
dan
Baybas (1999)
juga melaporkanbahwa
bentonit yang
diaktivasiHDTMA
CrzOt2-Rohaeti et al.,
Adsorpsi
dan Desorpsi2.
METODA
Penelitian
ini
menggunakanbentonit
asalLeuwiliang, Bogor. HDTMA-bentonit
dibuatdengan
cara
rnereaksikan
bentonit
lolosayakan
200
mesh
denganHDTMABT
yangjumlahnya
setara25%
KTK
(H825),
50%KTK
(H850)
dan
100%
KTK
(H8100).Perlakuan
HB100
atau
perlakuan
denganseratus
persen
KTK
artinya
jumlah
HDTMABT
yang
ditambahkan
ekivalendengan
nilai
KTK
bentonit, yaitLr
setiapmolekul
HDTMABT
dianggap bereaksi atau menggantikanposisi
satukation
dapat tukarmonovalen
pada
bentonit.
KTK
beutonitditentukan dengan metode NH+OAc
pH
7.Bentonit
dan
HDTMA-bentonit
yangdihasilkan dianalisis
keasamannya denganmetode titrir-netri. Masing-masing
sebanyak0.5 g
bentonit
dan
HDTMA-bentonit
direndam dengan
NaOH
berlebih
terukur selar.na24
jan.
KelebihanNaOH
selanjutnyadititrasi dengan HCl.
Kondisi
optimun'i
adsorpsi
Cr(VI)
olehHDTMA-bentonit
ditentukan pada
berbauaikondisi
pH,
waktu kontak dan
konsentrasiCr(Vi).
PenentuanpH
optimum
dilakukandengan mengaplikasikan
0.5
g
bahan denganlarutan
K2CI2O7200 ppm,
kernudian
pH larutan diaturmenjadi
1,2,
3,4,
5,
6,
dan 7.Setelah
itu
dikocok
selama24
jam.Hal
yangsalna dilakukan
untuk
mengetahui
waktu kontak optimum adsorpsiCr(VI).
Setelah pHcampuran
diatur
sesuai
pH
optimum,
lalu dikocok selama 1,2.3,4,
5, 6, dan 12 jam.Isotenn
dan
kapasitas
adsorpsi
Cr(VI)
dilakukan
dengan mengaplikasikan masing-rnasing0.5
g
bentonit danHDTMA-bentonit
pada lamtan K2Cr2O7 dengan konsentrasi 25,
sebelum
dimodifikasi.
KTK
bentonit
alami yan-e besamya54.5
me/100g
berturut-tr-rrutturun menj adi 45.1, 37
.4,
dan 20.7me/l00
g pada HB25,HB50
danH8100
(Tabel 1). Halini
menunjukkan
bahwa
HDTMA
telahmemblokir
sebagiansisi
pertukaran
dalambentonit.
Semakin
banvak
HDTMA
50,
100, 200,
300,
500
dan
70A
ppm.Selanjutnya
pH
campurandiatur
sesuai pH optirnum yang didapatkan,lalu
dikocok padawaktu optimum.
Desorpsi
Cr(VI)
dari
HDTMA-bentonirdilakukan dengan
cara
mengaplikasikansebanyak
I
gram bahan dengan 100
mL
larutan
K3C12O7 rnenggunakan konsentrasioptimurn
yang
didapat,
kernudian
pHcampurall
diatur pada
pH
optimum
dandiaduk dengan
alat
kocok
selama
r,vaktukontak
optimum.
Selanjutnya
campurandisaring dan residunya dirnasr.rkkan
ke
dalarnerlenmeyer
dan
direndarn dengan
akuades sebanyak 100rnl
pada erlenmeyer peftarna,HCI
0.1N
sebanyak 100mL
pada erlenmeyer kedua, dan CaCl2I M
sebanyak 100 mL padaerlentneyer
ketiga.
Carnpuran
kemudiandiaduk selama 14
jarl.
Pengr-rkulan konsentrasi
Cr(Vl)
setelah prosesadsorpsi
pada
penentuan
pH
dern
s,aktuoptimum,
isotenr-radsorpsi,
serta
desorpsimengikuti prosedur
pada
metode
standar(Clesceri
etal ."
2005).
Sebanyak
10
n'ri-larutan
dimasukkanke
dalam tabung reaksi,kemudian
ditarnbahkan
7
tetes
HzSOa-air(1:1)
dan 0.2
mL
DPC
0.25%,lalu
dikocokdan diukur
serapannya
denganspektrofotometer
pada panjang
gelombang540
nm.
Kurva
standardibuat
menggunakan larutan standar K2CI2O7 dengan konsentrasi 0,0.1
,0.2,0.4,
A.6, dan 0.8 ppm.3.
HASIL DAN PEMBAHASAN
Kapasitas
Tukar Kation
dan
KeasamanBentonit
HDTMA-Bentonit rnerniliki
KTK
yang lebih rendah dibandingkan denganbentonit
alamimenempati
sisi
pefiukaran,
maka
sernakin banyak sisi perlukaranyangdiblokir,
sehinggaKTK
sernakin berkurang.Nilai KTK
padaHB100
terlihat masihrelatif
tinggi.
Hal
ini
menunjukkan
belum
semuaTabel
1. Pengaruh PemberianHDTMA*
terhadap Kapasitas Tukar Kation(KTK)
dan Keasaman BentonitBentonit HB25 HB5O HBlOO
KTK
(me/l00g)
Keasaman (me/g)
54.50
4.95
45. 10
3.62
37.40
0.90
20.74
0.60
bentonit
dipertukarkan
oleh
HDTMA*.
Penyebabnya
diduga pada
saat pengadukansurfaktan dengan bentonit terdapat sejumlah
surfaktan
yang
membentuk busa,
sehingga proses pertukaran antarakation
dalarn ruang antarlapisan bentonit denganHDTMA'
tidakberlangsung sempurna.
Perlakuan
HDTMA
pada
bentonit
juga rnenurunkannilai
keasaman.Bentonit
alarniyang semula
memiliki
keasaman sebesar 4.95me/g
turun
berturut-furut rnenjadi 3.62, 0.90 dan 0.60 me/g padaH825,
HB50 dan H8100(Tabel
1).
Ramos
et al.
(2008)
jugamelaporkan
nilai
keasaman
HDTMA-Bentonit
sebesar
0.5
me/g.
KeasamanHDTMA-Bentonit
terlihat
semakin menurun dengan bertambahnya konsentrasiHDTMA*
yang
diberikan.
Kation
HDTMA'
yangterikat pada
bentonit
merupakan
gugusamonium kuaftener
yang
tidak
mernilikiproton
yang dapat bereaksi dengan gugus(-OH)
dari NaOH. Oleh karenanya jurnlah OHdari
NaOH
yang
dibutuhkan
untukmenetralkan
H*
pada
HDTMA-Bentonit
semakin kecil.
Kondisi
OptimumProses Adsorpsi
Cr(VI)
Tabel
2
menyajikan
kondisi
optimumadsorpsi
Cr(VI)
pada bentonit danHDTMA-pengocokan dengan
waktu
kontak
optirnumtersebut
jumlah Cr(VI) yang
diadsorpsiadalah 1.95 mglg pada bentonit dan berkisar
antara
8.80 dan 9.50
mg/g
pada
HDTMA-bentonit.
Waktu optimum
adsorpsiini
lebih pendek dibandingkan dengan adsorpsiCr(VI)
oleh rumput laut yang
memerlukan waktuadsorpsi
optimum
selama
12
jam
denganbentonit yang
dipengaruhioleh
pH
lamtan, konsentrasi larutan dan waktu kontak denganlarutan
Cr(VI)
yang akan
diadsorpsi.Adsorpsi optimum
bentonit alami
dan-HB25terjadi
padapH 4
dengan kapasitas adso,psiCr(VI)
masing-masing sebesar 2.54 dan 5.10rng/g,
sedangkan padapada
HB50
adsorpsioptimum terjadi pada
pH
5
dengan kapasitas adsorpsi 7.46nglg
dan padaH8100
adsorpsioptimurn terjadi pada
pH
2
dengar-r kapasitasadsorpsi
9.16
mg/g.
Menurut Ramos
et a1.(2008) anion paling dorninan yang terdapatdaiam larutan
padakisaran
pH
2
sampai 4adalah HCIO+-,
sedangkan
anion
CrOardominan
pada
pH 9
sampai
l2.Prosesadsorpsi
Cr(VI) oleh
HDTMA-bentonit
terjadi pada
pH
optimum2,4
dan 5, sehinggajenis
anion
Cr(VI)
yang paling
dominanterdapat
di
dalam larutan
dan
diadsorpsiHDTMA-bentonit
adalah HCrO+-.Tabel
2
juga
rnemperlihatkan
bahwakonsentrasi KzCrzOz
optimum
dalam prosesadsorpsi
Cr(VI)
oleh
bentonit dan
HB25masing-masing sebesar
200 dan 300
ppm, sedangkanuntuk
HB50
dan
HBl00
sebesar500 ppm.
Hasil
ini
menunjukkan
bahwadengan
bertambahnyakonsentrasi
adsorbatyangdiinteraksikan,
maka
jumlah
ionlogamCr(Vl)
yang
teradsorpsi
padaHDTMA-bentonit
semakin berlambah. Polaisoterm
ini
memperlihatkan
afinitas
yangrelatif tinggi
antara
adsorbat
(ion
logarnCr(VI))
dengan acisorbenpada tahap
awaldan
selanjutnya
konstan.
Sementara
itu [image:4.595.175.516.80.774.2]Rohaeti et al.,
Adsorpsi
dan Desorpsisebanyak
5.06
mglg
(Diantariani
er
ol., 2008).Tabel
2.
Kondisi
Optimum AdsorpsiCr(VI)
oleh Bentonit danHDTMA-Bentonit
Bentonit
HB25
HB50 HBlOO4t
Ph
Konsentrasi KzCrzO; (pprn)
Waktu kontak fiam)
5
500 500
300 200
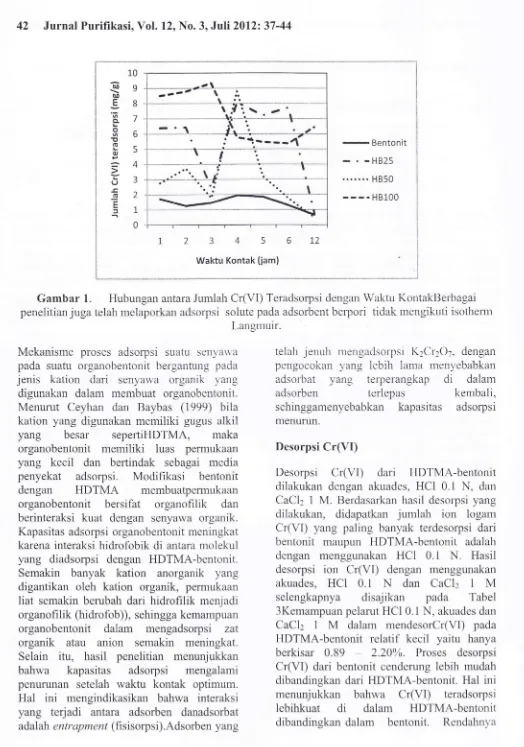
Setelah
meler,vatiwakru kontak
optirnumjumlah
Cr(VI)
yang
dapat diadsorpsi
olehbentonit
dan
HDTMA-bentonit
umluru.lyalrenurun (Gambar
l).
Turunnya
kapasitas adsorpsiCr(VI)
setelah pengocokan rnelebihiwaktu
optimum diduga
terjadi
karenaketidakstabilan
ikatan
antara
HDTMA-bentonit dengan
ion
logam
Cr(VI)
yangrlenyebabkan
terlepasnya
kernbali
ion-ionyang
sr-rdahdiadsorpsi.
Hal
ini
rnenjadiindikasi
awal
bahwa
mekanisrne
adsorpsiyang terjadi bLrkan rnelaiui proses pertukaran
ion,
melainkan
fisik,
misalnya akibat
terpe-terperangkapnya
ion-ion
Cr(VI)
diantaramolekul-rnolekul
HDTMA
dalam
ruang antarlapisanHDTMA-bentonit.
Pendapatini
didukung
pula oleh hasil
penelitian Iskandardan
Diajakirana (2006)
yang
melaportan bahu'aHDTMA-bentonit yang
diaplikasikanpada
limbah
cair
industri
tekstil,
pupuk,pestisida serta
pulp
dankerlas,
selain dapatmengadsorpsi logam-logam,
juga
dapatmengadsorpsi senyawa-senyawa
organik yang terdapat dalam limbah cair tersebut.Penentuan
isoterm
adsorpsidilakukan
untukmengetahui pengaruh konsentrasi
logamCI(VI)
yang direaksikan terhadapjumlah
ionlogam
Cr(Vl)
yang diadsorpsioleh
adsorbenpada suhu kamar.
Pada
kondisi
optirnum kapasitas adsorpsi bentonit,H825,
HB50 danHBl00
terhadapCr(VI)
berlurut-turut
adalah sebesar4.44,
11.96,22.09 dan 20.53
mglg.HB50
danH8100 terlihat
memiliki
kapasitasadsorpsi
lebih
yang
besar
dibandingkan dengan kapasitas adsorpsi adsorben lainnya.Dengan
meningkatnya
jurnlah
HDTMA"
yang digunakan untuk memodifikasi bentonit,diduga
rongga
yang tercipta dalam
ruang antarlapisanHDTMA-bentonit nienjadi
lebih banyak, sehingga dapat memerangkap lebihbanyak
ion
logarnCr(VI) dari
larutan.Nilai
ini
lebih
besar
dibandingkan
dengankemarlpuan adsorben
lain
yang
pentahdilaporkan. Ramos et
al.
(2008) menernukanbahwa
HDTMA-bentonit
memiliki
kapasitasadsorpsi terhadap
Cr(VI)
sebesar10
mglg,sedangkan
Diantariani
et al.
(2008)melaporkan
kapasitas adsorpsirumput
lautterhadap
ion
logam
CI(VI)
adalah
13.50 mg/g.lsoterm
dan KapasitasAdsorpsi
Optimum
Interaksi
yang
terladi
antara
ion
Cr(VI)
dengan
HDTMA-bentonit
berlangsungmelalui
adsorpsimultilayer.
Hal
ini
nampakdari
linearitas isoterm Freundlich yang lebih besar dibandingkan dengan linearitas isotermLangmuir
(Gambar
2
sampai
9).Nilai
linieritas,
R2 yang
mendekati
satumenunjukkan
bahwa
adsorpsi
Cr(VI)
olehHDTMA-bentonit
mengikuti
persamaanisoterm Freundlich.Isotem Langmuir
yangmengasumsikan
permukaan
sorben
yangseragam
dan
membentuk
lapisan
sorbat10 9 8
7
6
5
4
3
2
1 0
345
Waktu Kontak {jam)
[image:6.595.34.558.24.771.2]i-**_.-*
Gambar
1.
Hubungan antara JumlahCr(VI)
Teradsorpsi clengan Waktu KontakBerbagai peneiitian juga telah melaporkan adsorpsi solute pada adsorbentberpori
tidak n'rengikuti isothenr.iLangrnuir.
Mekanisme
proses adsorpsisuatu
senyau'apada
suafur organobentonit bergantung padajenis
kation
dari
senya\\'a
organik
yangdigunakan
dalam
membuat
organobentonit.Menumt
Ceyhan
dan
Baybas
(1999)
bila
kation yang
digunakanmemiliki
gugusalkil
yang besar
sepertiHDTMA,
makaorganobentonit
memiliki luas
permukaanyang
kecil
dan
bertindak
sebagai
mediapenyekat adsorpsi.
Modifikasi
bentonitdengan
HDTMA
membuatpermukaanorganobentonit
bersifat
organofilik
danberinteraksi
kuat
dengan senyawa organik. Kapasitas adsorpsi organobentonit meningkat karena interaksihidrofobik
di
antara molekulyang
diadsorpsi dengan
HDTMA-bentonit.Semakin
banyak
kation
anorganik
yangdigantikan
oleh kation
organik,
permukaanliat
semakin berubahdari
hidrofilik
menjadi organofilik
(hidrofob)), sehingga kemampuanorganobentonit
dalam
mengadsorpsi
zaI"organik
atau anion
semakin
meningkat.Selain
itu,
hasil
penelitian
menunjukkanbahwa
kapasitas adsorpsi
mengalamipenurunan
setelahwaktu kontak
optimum.Hal
ini
rnengindikasikan
bahwa
interaksiyang
terjadi
antara adsorben
danadsorbat adalah entrapment (fi sisorpsi).Adsorben yangBe nto n it
-
.-H825
...H850
HBlOO
telah
jenuh
rnenqadsorpsi K2Cr2O7. dengan pengocokar.I)'ang lebih
lan-ra menyebabkanadsorbat
yang
terperangkap
di
dalam adsorben terlepas kembali,sehinggamenyebabkan
kapasitas
adsorpsi lnenurun.Desorpsi
Crfff)
Desorpsi
Cr(VI)
dari
HDTMA-bentonit
dilakukan
dengan akuades,HCI
0.1
N,
danCaClz 1
M.
Berdasarkanhasil
desorpsr yangdilakukan,
didapatkan
iumlah
ion
loganrCr(VI)
yang
paling
banyak
terclesorpsi daribentonit
maupun
HDTMA-bentonit
adalahdengan
menggunakan
HCI
0.1
N.
Hasildesorpsi
ion
Cr(VI)
dengan
menggunakanakuades,
HCI 0.1
N
dan
CaClz
1M
selengkapnya
clisajikan
pada
Tabel 3Kemampuan pelarutHCI
0.1N,
akuades danCaClz
1 M
dalarn
mendesorCr(Vl)
padaHDTMA-bentonit
relatif kecil
yaitu
hanyaberkisar
0.89
2.20%. Proses
desorpsiCI(VI)
dari bentonit
cenderunglebih
mudahdibandingkan
dari HDTMA-bentonit.
Hal
ini
menunjukkan
bahwa
Cr(VI)
teradsorpsilebihkuat
di
dalam
HDTMA-bentonit
dibandingkan
dalam
bentonit.
Rendahnl'ab!
b0 E
o.
o 'o
(!
o
t
(.,
o
Rohaeti et aL.,,
Adsorpsi
dan Desorpsijumlah
C{V!
yang
terdesorpsi
dariHDTMA-bentonit
menunjukkan
bahwaHDTMA-bentonit merupakan
adsorben43
organobentonit
yang tidak
dapat
digunakankembali
bila
keadaannya sudahjenuh
oleh adsorbatCr(VI).
Tabel3.
DesorpsiCr(VI)
dari Adsorbenoleh
Akuades, HCI 0.1N,
danCaClzl
M
Crfff
terdesorpsi (%)Aquades
HCIOIN
CaCl2 I MBentonit HB25 HB5O
HBlOO
3.50
1.85
1.01
i.l0
4.l5
2.20
1.01
r.34
3.50
1.31
089
r.03
4.
KESIMPULAN
Kapasitas
tukar kation
bentonit
menuntnsetelah perlakuan dengan
HDTMA*,
yairu 54.53mell00 g
padabentonit
alarni menjadi45.14,
31.31,
dan20.12 me/100
g
bernrrut-turut
pada
perlakuan
HB25, HB50
danH8100.
Keasamanbentonit
juga
menurun setelah perlakuan,yaitu
dari 4.95
melg padabentonit alami menjadi 3.62, 0.90, dan
0.60 me/g padaH825,
HB50
dan HB100. Kondisioptimum
adsorpsiCr(VI)
oleh
bentonit
danHDTMA-bentonit
terjadi
pada kisaranpH
2sampai
5,
waktu kontak
3
sarnpai4
jam,konsentrasi
Cr(VI)
200 sampai 500 ppm, dan kapasitas adsorpsiberfurut-turut 4.44,
11.96,22.09
dan
20.53
mg/g untuk
bentonit
serlaH825,
HB50 danH8100. Modifikasi
bentonitdengan
HDTMA*
telah
meningkatkankemampuan bentonit dalam mengadsorpsi ion
Cr(VI).
Semakin besar konsentrasiHDTMA*
yang diberikan, semakin besar pula kapasitas
adsorpsinya terhadap
Cr(VI).
Kemampuandesorpsi
Cr(VI)
dari HDTMA-bentonit
olehHCI 0.1
N,
akuadesdan CaClz
1
M
relatif
kecil.
Hal
ini
menunjukkan
bahwa
Cr(VI)
Hexadecytrimethyl
ammonium
Bentonite.terperangkap
kuat
di
dalam
HDTMA-bentonit.REFERENCES:
Boyd, S,A, M.M. Mortland
dan
C.T.
Chiou(1988).
Sorption
characteristics of
organic
compounds
on
hexadecyl-trimethylammonium-smectite.
SoilSci. Soc. Am.
I.
52:652-657.Caniosa
M.J., W.
Koskinen
dan
M.
D.
C. Hennosin (2004).Interaction of
acidichertricida dicamba and
betazonelvith
organoclay. American
Journal
of
Soil Science SocieQ 68: 1863-1866.Ceyhan,
O and D.
Baybas
(1999).Adsorption
of
Some
Textile
f)yesbyHexadecytrimethyl
ammonium
Bentonite.
TurkeyJournal
of ChemisttT25: 193-200
Clesceri, I.S., E.G.
Amold,
and D.E,. Andrew(2005).
Standar
Methods
for
theExamination
of Water
andWastewater.
Ttrkey
Journal
o.lChemistry
25:
lg3-200.
20'h
Ed. Washington DC: AlphaAwwa
Wes.Diantariani,
N.P.,
LW.
Sudiarla dan
N.K.
Elantiani (2008). Proses
Biosorpsi
danRumput
Laut
Eucheuma
spinosum. JurnalKimia
2(l).
Hohmuth,
H.
und
H.
Hofmann
(1993).Umsetzung von
aktivierten
Schichtsilicaten
mit
ausgewaehltenTensiden
und
Farbstoffen.
Berichteder
DTTG e.V.,
Beitrage
zur
Jah-restagungHannover, 9-11
September1992.
Iskandar,
Tasrif
dan
G.
Djajakirana
(1998).Prospek
Pemanfaatan
Bentonit
setragai
Penyerap Polutan
Anorganik
dan Organik dalarn
ProsesPengolahan
Limbah
Cair.
LaporanRiset
RUT
IV
(1996-1998).
Kantor Menteri Negara Riset dan Teknologi.Iskandar,
I
and
G.
Djajakirana
(2006).Absorption
Capability
of
HDTMA-Activated
Bentonite
on Organic
andInorganic Pollutant
in
SomeIndustrial
Liquid
Waste.
Bogor:Departemen
Ilmu Tanah
danSumberdaya Lahan, IPB.
Jaynes,
W.F. and S.A. Boyd
(1991). Clay
mineral type and organic
compoundsorption
by
HDTMA-exchanged
clays.
Soil
Sci. Soc. Am. J. 55:43-48.Lagaly,
G.
(1993).Praktische
Verwendungund
Einsatzmoeglichkeiten
vonTonen.
ln
Tonminerale
und
Tone:Struktur,
Eigenschaften,Anwendung
und Einsatz in
Industrie
undUmwelt. K.
Jasmund/ G.Lagaly (Hrsg).Steinkopff Verlag, Darmstadt.
Ramos,
R.L.,
Azuara,
A.J.,
Rivera,
O.L.T.,Coronado,
R.M.G.,
Mendoza,
M.S.B. andDavila,
P.A. (2008).Adsorption of
Chromium
(VI)
from Water
solutiononto
Organotrentonite.
Journal
qf
Environment Engineering Mana-gement
18(s): 311-311.
Stockmeyer,
M
and
K.
Kruse.
(1991).Adsorption
of
zinc
and
nickel
ionsand
phenol
and
diethylketone
bybentonites
of
different