ABSTRAK
JANTI WIDYANINGSIH.
Adsorpsi dan Desorpsi Kromium(VI) pada Bentonit
yang Dimodifikasi Heksadesiltrimetilamonium Bromida. Dibimbing oleh ETI
ROHAETI dan ISKANDAR.
Bentonit merupakan sumberdaya mineral yang melimpah di Indonesia dan
berpotensi sebagai adsorben. Bentonit memiliki kemampuan adsorpsi yang tinggi
terhadap kation karena bermuatan negatif, namun kemampuan adsorpsinya rendah
terhadap anion. Penelitian ini bertujuan mengubah sifat bentonit dari hidrofilik
menjadi hidrofobik atau organofilik dengan memodifikasi bentonit asal
Leuwiliang dengan heksadesiltrimetilamonium bromida (HDTMABr), sehingga
dapat meningkatkan adsorpsi terhadap anion, seperti Cr(VI). Metode yang
diujikan pada penelitian ini adalah pembuatan organobentonit 25, 50 dan 100 %
KTK, penentuan kapasitas tukar kation (KTK), keasaman, dan kondisi optimum
adsorpsi Cr(VI) yang meliputi pH, waktu kontak, isoterm, serta desorpsi Cr(VI)
dari organobentonit. KTK bentonit, organobentonit 25, 50, dan 100 %
berturut-turut adalah 54.53, 45.14, 37.37, dan 20.72 me/100 g. Keasaman bentonit,
organobentonit 25, 50, dan 100 % berturut-turut adalah 4.95, 3.62, 0.90, dan 0.60
me/g.
Kondisi optimum adsorpsi Cr(VI) oleh bentonit, organobentonit 25 %,
organobentonit 50 %, dan organobentonit 100 % terjadi pada kisaran pH 2 sampai
5, waktu kontak 3 sampai 4 jam, konsentrasi Cr(VI) 200 sampai 500 ppm, dan
kapasitas adsorpsi berturut-turut 4.44, 11.96, 22.09, dan 20.53 mg/g. Kemampuan
desorpsi Cr(VI) dari organobentonit oleh HCl 0.1 N, akuades, dan CaCl
21 M
iii
ABSTRACT
JANTI WIDYANINGSIH. Chromium(VI) Adsorption and Desorption on
Bentonite Modified by Hexadecyltrimethylammonium Bromide. Supervised by
ETI ROHAETI and ISKANDAR.
Bentonite is abundant mineral in Indonesia and potentially as adsorbent.
Bentonite has negatively charge, so bentonite has high capability to adsorp
cations, while the capability of bentonite to adsorp anion was very low. This
research
was
modified
bentonite
from
Leuwiliang
with
hexadecyltrimethylammonium bromide (HDTMABr). The result of bentonite
modification was changes bentonite surface character from hidrofilic become
hidrofobic or organofilic, so that can adsorp anion, like Cr(VI). This research
made organobentonite 25, 50, and 100 % CEC. Some methodes were done in this
research, they were determination of CEC, acidity, and adsorption optimum
condition of Cr(VI) that covered determination of adsorption pH, contact time,
isotherm, and desorption of Cr(VI) from organobentonite. Capacity Exchange
Cation of bentonite, organobentonite 25 %, organobentonite 50 %, and
organobentonite 100 % were 54.53, 45.14, 37.37, and 20.72 me/100 g,
respectively. Acidity of bentonite, organobentonite 25 %, organobentonite 50 %,
and organobentonite 100 % were 4.95, 3.62, 0.90, and 0.60 mmol/g, respectively.
Optimum adsorption condition of Cr(VI) onto bentonite, organobentonite 25 %,
organobentonite 50 %, and organobentonite 100 % were consist of pH 2 until 4,
contact time 3 until 4 hours, on concentration 200 until 500 ppm. Adsorbtion
capacity of bentonite, organobentonite 25 %, organobentonite 50 %, and
organobentonite 100 %, respectively were 4.44, 11.96, 22.09, and 20.53 mg/g.
Ability of HCl, aquadest, and CaCl
2to desorbed Cr(VI) from organobentonite was
PENDAHULUAN
Dampak logam berat pada lingkungan semakin meningkat akhir-akhir ini, khususnya di lingkungan perairan. Logam berat tersebut pada umumnya diakibatkan oleh meningkatnya populasi, ketidakteraturan arus urbanisasi, pengembangan teknologi dan industri, serta peningkatan pemanfaatan industri (Igwe & Abia 2007). Salah satu logam berat yang merupakan sumber polusi adalah logam kromium (Cr). Logam ini banyak digunakan dalam industri elektroplating, penyamakan kulit, pulp, serta proses pemurnian bijih dan petroleum.
Kromium dapat membentuk tiga macam senyawa yang masing-masing berasal dari proses oksidasi CrO (kromium oksida), yaitu Cr2+ disebut kromium divalen, Cr3+ disebut
kromium trivalen, dan Cr6+ disebut kromium
heksavalen (Bastarache 2002). Kromium trivalen merupakan bentuk yang paling banyak berada di lingkungan. Kromium trivalen dibutuhkan oleh manusia karena bersama-sama dengan insulin menjaga kadar gula darah. Kromium heksavalen memiliki sifat yang lebih toksik jika dibandingkan dengan kromium trivalen. Kromium heksavalen dapat menyebabkan kerusakan hati, ginjal, pendarahan, kerusakan saluran pernapasan, dan kanker paru (Kusnoputranto 1996). Oleh karena itu, kandungan logam berat kromium dalam limbah industri harus diminimalkan sebelum limbah dibuang ke lingkungan.
Beberapa metode yang sudah berkembang untuk pembersihan logam Cr(VI) dari lingkungan perairan, antara lain secara kimia menggunakan koagulan, secara fisika dengan adsorpsi menggunakan arang aktif, dan secara biologi menggunakan mikroba (Forlink 2000). Namun, metode tersebut memiliki beberapa kekurangan. Pengolahan limbah secara kimia menggunakan koagulan akan menghasilkan lumpur dalam jumlah besar, sedangkan penggunaan arang aktif dalam pengolahan limbah meskipun sangat efektif, tetapi memerlukan biaya yang cukup tinggi (Manurung et al. 2004). Saat ini dicari adsorben yang mudah didapat serta ekonomis. Adsorben alami yang berasal dari liat atau sumber daya mineral menjadi alternatif dalam penanganan cemaran logam berat di lingkungan.
Bentonit merupakan sumber daya mineral yang melimpah di Indonesia, akan tetapi belum optimum pemanfaatannya. Cadangan bentonit di Indonesia sekitar 380 juta ton,
merupakan aset potensial yang harus dimanfaatkan sebaik-baiknya (Syuhada et al. 2009). Salah satu aplikasi bentonit yang saat ini banyak dikaji oleh institusi penelitian internasional dan nasional adalah pemanfaatan bentonit sebagai adsorben. Permukaan bentonit memiliki muatan negatif, sehingga bentonit memiliki kemampuan mengadsorpsi ion-ion logam yang bermuatan positif, sedangkan kemampuannya dalam mengadsorpsi anion sangat rendah. Oleh sebab itu, pengembangan pemanfaatan bentonit sebagai adsorben anion penting untuk diteliti.
Penelitian ini memodifikasi bentonit dengan HDTMABr yang merupakan surfaktan kationik. Kation HDTMA+ akan
menggantikan kation-kation pada ruang antarlapisan bentonit melalui pertukaran kation dan mengubah sifat permukaan bentonit yang awalnya bersifat hidrofilik menjadi hidrofobik atau organofilik sehingga bentonit hasil modifikasi tersebut dapat meningkatkan kemampuan adsorpsi anion logam, seperti CrO42- atau Cr2O72-.
Penelitian ini bertujuan menentukan kemampuan bentonit asal Leuwiliang yang dimodifikasi HDTMABr dalam mengadsorpsi Cr(VI) dan menentukan kondisi optimum adsorpsi Cr(VI) terkait dengan parameter serta sifat adsorpsi melalui persyaratan isoterm adsorpsi meliputi pH adsorpsi, waktu kontak adsorpsi, isoterm adsorpsi, serta dapat mengetahui kemampuan desorpsi Cr(VI) dari organobentonit.
TINJAUAN PUSTAKA
Bentonit
Bentonit merupakan istilah yang digunakan di dalam dunia perdagangan untuk sejenis batuliat yang mengandung lebih dari 85% montmorilonit. Bentonit mempunyai rumus kimia Al2O3.4SiO2.XH2O, yaitu
senyawa silikat dan alumina yang mengandung air terikat secara kimia (Sukandarrumidi 1999).
PENDAHULUAN
Dampak logam berat pada lingkungan semakin meningkat akhir-akhir ini, khususnya di lingkungan perairan. Logam berat tersebut pada umumnya diakibatkan oleh meningkatnya populasi, ketidakteraturan arus urbanisasi, pengembangan teknologi dan industri, serta peningkatan pemanfaatan industri (Igwe & Abia 2007). Salah satu logam berat yang merupakan sumber polusi adalah logam kromium (Cr). Logam ini banyak digunakan dalam industri elektroplating, penyamakan kulit, pulp, serta proses pemurnian bijih dan petroleum.
Kromium dapat membentuk tiga macam senyawa yang masing-masing berasal dari proses oksidasi CrO (kromium oksida), yaitu Cr2+ disebut kromium divalen, Cr3+ disebut
kromium trivalen, dan Cr6+ disebut kromium
heksavalen (Bastarache 2002). Kromium trivalen merupakan bentuk yang paling banyak berada di lingkungan. Kromium trivalen dibutuhkan oleh manusia karena bersama-sama dengan insulin menjaga kadar gula darah. Kromium heksavalen memiliki sifat yang lebih toksik jika dibandingkan dengan kromium trivalen. Kromium heksavalen dapat menyebabkan kerusakan hati, ginjal, pendarahan, kerusakan saluran pernapasan, dan kanker paru (Kusnoputranto 1996). Oleh karena itu, kandungan logam berat kromium dalam limbah industri harus diminimalkan sebelum limbah dibuang ke lingkungan.
Beberapa metode yang sudah berkembang untuk pembersihan logam Cr(VI) dari lingkungan perairan, antara lain secara kimia menggunakan koagulan, secara fisika dengan adsorpsi menggunakan arang aktif, dan secara biologi menggunakan mikroba (Forlink 2000). Namun, metode tersebut memiliki beberapa kekurangan. Pengolahan limbah secara kimia menggunakan koagulan akan menghasilkan lumpur dalam jumlah besar, sedangkan penggunaan arang aktif dalam pengolahan limbah meskipun sangat efektif, tetapi memerlukan biaya yang cukup tinggi (Manurung et al. 2004). Saat ini dicari adsorben yang mudah didapat serta ekonomis. Adsorben alami yang berasal dari liat atau sumber daya mineral menjadi alternatif dalam penanganan cemaran logam berat di lingkungan.
Bentonit merupakan sumber daya mineral yang melimpah di Indonesia, akan tetapi belum optimum pemanfaatannya. Cadangan bentonit di Indonesia sekitar 380 juta ton,
merupakan aset potensial yang harus dimanfaatkan sebaik-baiknya (Syuhada et al. 2009). Salah satu aplikasi bentonit yang saat ini banyak dikaji oleh institusi penelitian internasional dan nasional adalah pemanfaatan bentonit sebagai adsorben. Permukaan bentonit memiliki muatan negatif, sehingga bentonit memiliki kemampuan mengadsorpsi ion-ion logam yang bermuatan positif, sedangkan kemampuannya dalam mengadsorpsi anion sangat rendah. Oleh sebab itu, pengembangan pemanfaatan bentonit sebagai adsorben anion penting untuk diteliti.
Penelitian ini memodifikasi bentonit dengan HDTMABr yang merupakan surfaktan kationik. Kation HDTMA+ akan
menggantikan kation-kation pada ruang antarlapisan bentonit melalui pertukaran kation dan mengubah sifat permukaan bentonit yang awalnya bersifat hidrofilik menjadi hidrofobik atau organofilik sehingga bentonit hasil modifikasi tersebut dapat meningkatkan kemampuan adsorpsi anion logam, seperti CrO42- atau Cr2O72-.
Penelitian ini bertujuan menentukan kemampuan bentonit asal Leuwiliang yang dimodifikasi HDTMABr dalam mengadsorpsi Cr(VI) dan menentukan kondisi optimum adsorpsi Cr(VI) terkait dengan parameter serta sifat adsorpsi melalui persyaratan isoterm adsorpsi meliputi pH adsorpsi, waktu kontak adsorpsi, isoterm adsorpsi, serta dapat mengetahui kemampuan desorpsi Cr(VI) dari organobentonit.
TINJAUAN PUSTAKA
Bentonit
Bentonit merupakan istilah yang digunakan di dalam dunia perdagangan untuk sejenis batuliat yang mengandung lebih dari 85% montmorilonit. Bentonit mempunyai rumus kimia Al2O3.4SiO2.XH2O, yaitu
senyawa silikat dan alumina yang mengandung air terikat secara kimia (Sukandarrumidi 1999).
1
kapasitas penukar ion yang tinggi dengan pertukaran ion terutama diduduki oleh ion-ion Ca2+ dan Mg2+.
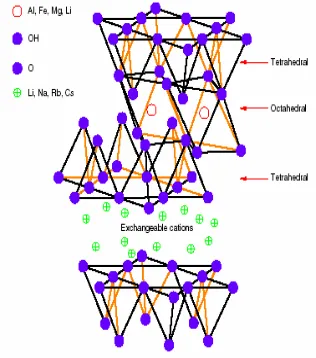
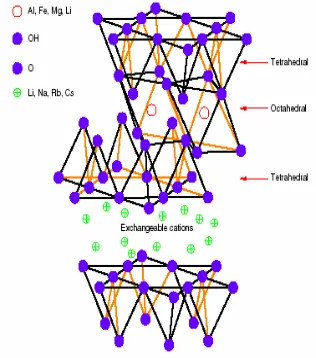
Struktur montmorilonit (Gambar 1) terdiri atas tiga lembar, yaitu satu lembar aluminol (AlO62-) berbentuk oktahedral pada bagian
tengah yang diapit oleh dua buah lembar silanol (SiO42-) berbentuk tetrahedral. Di
antara lapisan-lapisan silikat tersebut terdapat ruang antarlapisan yang berisi kation monovalen maupun bivalen yang dapat dipertukarkan, seperti Na+, Ca2+, dan Mg2+
(Syuhada et al. 2009).
Gambar 1 Struktur montmorilonit
Beberapa penelitian menunjukkan bahwa bentonit berpotensi sebagai adsorben senyawa non-kationik melalui proses aktivasi terlebih dahulu. Penelitian Ceyhan & Baybas (1999) menunjukkan bahwa bentonit yang dimodifikasi HDTMA dapat mengadsorpsi zat warna tekstil. Iskandar & Djajakirana (2006) melakukan penelitian terhadap absorpsi zat organik dan anorganik pada limbah cair di industri tekstil, pupuk, pestisida, pulp, dan kertas menggunakan bentonit yang diaktivasi dengan HDTMA. Penelitian ini melaporkan bahwa HDTMA-bentonit dapat menurunkan konsentrasi anion dikromat secara nyata pada cairan limbah. HDTMA-bentonit juga dapat menurunkan pH, warna, turbiditas, total padatan, Chemical Oxygen Demand (COD), dan Biology Oxygen Demand (BOD) pada limbah cair industri tekstil dan pupuk. Selain itu, Ramos et al. (2008) melaporkan bahwa bentonit yang dimodifikasi HDTMA mampu mengadsorpsi Cr(VI) dengan kapasitas adsorpsi maksimum terjadi pada pH 5.
Heksadesiltrimetilamonium (HDTMA) Heksadesiltrimetilamonium adalah suatu tetra substitusi kation amonium dengan pengikatan nitrogen bervalensi lima secara permanen dan rantai lurus panjang alkil (C16). Rumus molekulnya adalah C19H42N+ (Gambar
2). HDTMA merupakan garam amonium kuartener dengan kation organik yang dapat dipertukarkan dengan kation anorganik yang berada dalam ruang antarlapisan bentonit. Adsorpsi Cr(VI) di perairan menggunakan montmorilonit yang dimodifikasi dengan HDTMA telah diteliti oleh Majdan et al. (2006). Penelitian ini melaporkan bahwa Cr(VI) sebagian besar teradsorpsi dengan membentuk kompleks antara rantai alkil surfaktan dan anion bikromat atau kromat.
Gambar 2 Struktur HDTMABr
Organobentonit
Bentonit memiliki kemampuan adsorpsi yang rendah terhadap ion Cr(VI). Hal ini disebabkan bentonit memiliki permukaan yang bermuatan negatif, sedangkan ion Cr(VI) yang terdapat di dalam perairan biasanya dalam bentuk anion, sehingga terjadi tolak-menolak antara anion Cr(VI) dengan permukaan bentonit. Kapasitas adsorpsi dari bentonit ini dapat dinaikkan dengan mengubah sifat permukaan bentonit melalui modifikasi bentonit dengan HDTMABr.
Modifikasi bentonit dengan menggunakan senyawa organik membentuk organobentonit diawali tahap swelling. Sebelum ditambahkan surfaktan, bentonit murni dibiarkan mengembang di dalam air (swelling) untuk meningkatkan basal spacing (jarak basal) sehingga mempermudah pertukaran kation.
Surfaktan yang mengandung amonium kuartener seperti HDTMA memiliki muatan positif pada ion nitrogen yang berfungsi sebagai atom pusat yang berikatan dengan empat radikal organik. Pertukaran kation bertujuan untuk mengubah bentonit yang bersifat hidrofilik (menarik air) menjadi bersifat hidrofobik (menolak air), sehingga dapat dicampur dengan material yang bersifat hidrofobik juga seperti polimer (Syuhada et al. 2009).
Konsentrasi, waktu mengembang, dansifat surfaktan dapat mempengaruhi kualitas organobentonit yang dihasilkan (Syuhada et
1
al. 2009). Bentonit alam pada awalnya mengandung kation-kation seperti Na+, Mg2+,
atau Ca2+ yang terikat secara ionik dengan
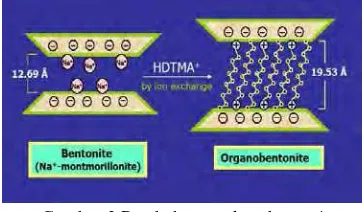
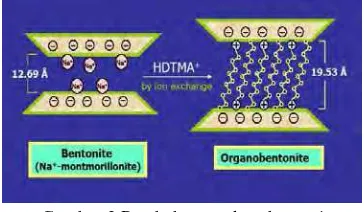
permukaan bentonit yang bermuatan negatif. Kation-kation yang terdapat pada ruang antarlapisan bentonit dapat dipertukarkan dengan kation lain, termasuk surfaktan yang bermuatan positif. Jarak basal bentonit bertambah besar dengan masuknya surfaktan, yaitu dari 12.69 Å menjadi 19.53 Å seperti terlihat pada Gambar 3 (AG 2009). Pertukaran kation anorganik dengan kation organik pada kerangka bentonit dapat meningkatkan daya adsorpsi bentonit terhadap anion.
Gambar 3 Perubahan struktur bentonit menjadi organobentonit.
Kromium
Kromium (Cr) merupakan salah satu logam berat yang termasuk dalam unsur transisi golongan VIB periode 4. Kromium mempunyai nomor atom 24 dan nomor massa 51.996 g/mol. Logam ini berwarna putih perak dan lunak jika dalam keadaan murni dengan massa jenis 7.9 g/cm3 dan mempunyai
titik didih 2658 ºC (Sugiyarto 2003). Kromium mempunyai konfigurasi elektron 3d54s1. Jika dalam keadaan murni, kromium
larut dengan lambat sekali dan dalam asam encer membentuk garam Cr(II) (Vogel 1990). Kromium termasuk logam yang mempunyai daya racun tinggi. Daya racun kromium ditentukan oleh valensi ionnya. Logam Cr6+ merupakan bentuk yang paling
banyak dipelajari sifat racunnya dikarenakan Cr6+merupakan racun yang sangat kuat dan
dapat mengakibatkan terjadinya keracunan akut dan keracunan kronis (Soemirat 2002).
Kromium dapat diukur dengan beberapa metode. Salah satunya adalah spektrofotometri sinar tampak. Kromium heksavalen bila ditambah larutan 1,5-difenilkarbazida (DPC) dalam larutan asam membentuk kompleks berwarna violet yang intensitasnya sebanding dengan banyaknya kromium heksavalen dalam contoh.
Pewarnaan dengan DPC cukup sensitif dengan nilai adsorptivitas molar berkisar 40.000 L/mol cm pada panjang gelombang 540 nm (Clesceri et al. 2005).
Pengukuran kromium total menggunakan metode spektrofotometri memerlukan suatu pengoksidasi kuat sehingga kromium dengan tingkat oksidasi lebih rendah dapat dianalisis dengan metode ini. Menurut Clesceri et al. (2005) beberapa oksidator yang dapat digunakan adalah KMnO4, K2S2O8, dan
HClO4. Selain itu, Noroozifar dan Khorasani
(2003) menyatakan bahwa serium(IV) juga efektif untuk mengoksidasi kromium trivalen menjadi kromium heksavalen.
Adsorpsi
Peristiwa terakumulasinya partikel pada suatu permukaan disebut adsorpsi (Atkins 1999). Partikel atau zat yang terakumulasi pada permukaan disebut adsorbat, sedangkan material tempat terjadinya adsorpsi disebut adsorben. Adsorpsi merupakan suatu proses pemisahan yang di dalamnya komponen-komponen tertentu dalam fase cair ditransfer ke suatu permukaan adsorben padat. Adsorpsi biasanya terjadi pada dinding-dinding pori atau pada sisi spesifik dalam partikel (Mc Cabe et al. 2001). Berdasarkan pada jenis gaya tarik, dikenal adsorpsi fisik (fisisorpsi) yang melibatkan gaya van der Waals, dan adsorpsi kimia (kemisorpsi) yang melibatkan reaksi kimia (Alberty & Silbey 1992).
Faktor-faktor yang mempengaruhi adsorpsi antara lain sifat fisik dan kimia adsorben (luas permukaan, ukuran pori, dan komposisi kimia), sifat fisik dan kimia adsorbat (ukuran, kepolaran, dan komposisi kimia molekul), konsentrasi adsorbat dalam fase cair, karakteristik fase cair (pH dan suhu), dan kondisi operasional adsorpsi. Kemampuan adsorben mengadsorpsi adsorbat ditentukan dengan menghitung isoterm adsorpsi.
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben, pada suhu tetap. Kesetimbangan terjadi saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya.
Ada tiga isoterm adsorpsi umum untuk adsorpsi gas atau cairan pada permukaan padatan, yaitu isoterm Langmuir, Freundlich, dan Brunaue-Emmett-Teller (BET). Isoterm Langmuir maupun Freundlich digunakan untuk tekanan gas atau konsentrasi larutan
1
yang rendah, sedangkan isoterm BET ialah modifikasi isoterm Langmuir pada tekanan tinggi (Alberty & Silbey 1992).
Isoterm Freundlich
Isoterm Freundlich merupakan isoterm yang paling umum digunakan dan dapat mencirikan proses adsorpsi dengan lebih baik (Jason 2004). Menurut Atkins (1999) pada proses adsorpsi zat terlarut oleh permukaan padatan diterapkan isoterm Freundlich yang diturunkan secara empiris dengan persamaan:
n kC m
x 1
=
Apabila dilogaritmakan, persamaan akan
menjadi: C
n k m x Log 1 Log
Log = +
dengan m
x
(µg/g) adalah jumlah adsorbat yang
teradsopsi per satuan bobot adsorben, C (ppm) adalah konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi, sedangkan k dan n adalah tetapan empiris yang menunjukkan ikatan antara adsorbat dengan adsorben.
Isoterm Langmuir
Isoterm Langmuir diturunkan berdasarkan pada persamaan berikut:
C C m x β αβ +
=
1Isoterm Langmuir dipelajari untuk menggambarkan pembatasan sisi adsorpsi dengan asumsi bahwa sejumlah tertentu sisi sentuh adsorben ada pada permukaannya dan semuanya memiliki energi yang sama, serta adsorpsi bersifat dapat balik (Atkins 1999). Konstanta α, β dapat ditentukan dari kurva hubungan
m x
C terhadap C dengan persamaan:
C m x C α αβ 1 1 + = Keterangan:
x = jumlah adsorbat teradsorpsi per m unit bobot adsorben
m = bobot adsorben
C = konsentrasi keseimbangan
adsorben dalam larutan k, n = konstanta empiris
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan adalah spektrofotometer UV-tampak Shimadzu 1700. Bahan yang digunakan dalam penelitian adalah bentonit asal Leuwiliang.
Metode
Penelitian meliputi empat tahap, yaitu penyiapan bentonit lolos ayakan 200 mesh, penentuan kapasitas tukar kation (KTK) bentonit, pembuatan organobentonit dengan memodifikasi bentonit menggunakan HDTMABr, dan analisis organobentonit (Lampiran 1). Modifikasi bentonit dengan HDTMABr menggunakan jumlah HDTMABr bervariasi berdasarkan nilai KTK bentonit, yaitu 100% KTK, 50% KTK, dan 25% KTK (Lampiran 2). Seratus persen KTK artinya jumlah HDTMABr yang ditambahkan ekivalen dengan nilai KTK bentonit, yaitu setiap molekul HDTMABr dianggap bereaksi atau menggantikan posisi satu kation dapat tukar monovalen pada bentonit.
Analisis organobentonit meliputi penentuan keasaman dengan metode Titrimetri, penentuan kondisi optimum adsorpsi Cr(VI) oleh organobentonit yang meliputi penentuan pH optimum, penentuan waktu kontak, penentuan isoterm dan kapasitas adsorpsi Cr(VI), serta desorpsi Cr(VI) dari organobentonit.
Pengukuran konsentrasi Cr(VI) mengikuti prosedur pada metode standar (Clesceri et al. 2005). Sebanyak 10 mL larutan dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 7 tetes H2SO4-air (1:1) dan 0.2
mL DPC 0.25%, lalu dikocok dan diukur serapannya pada panjang gelombang 540 nm dengan spektrofotometer (Lampiran 4). Kurva standar dibuat menggunakan larutan standar K2Cr2O7 dengan konsentrasi 0, 0.1, 0.2, 0.4,
0.6, dan 0.8 ppm.
1
yang rendah, sedangkan isoterm BET ialah modifikasi isoterm Langmuir pada tekanan tinggi (Alberty & Silbey 1992).
Isoterm Freundlich
Isoterm Freundlich merupakan isoterm yang paling umum digunakan dan dapat mencirikan proses adsorpsi dengan lebih baik (Jason 2004). Menurut Atkins (1999) pada proses adsorpsi zat terlarut oleh permukaan padatan diterapkan isoterm Freundlich yang diturunkan secara empiris dengan persamaan:
n kC m
x 1
=
Apabila dilogaritmakan, persamaan akan
menjadi: C
n k m x Log 1 Log
Log = +
dengan m
x
(µg/g) adalah jumlah adsorbat yang
teradsopsi per satuan bobot adsorben, C (ppm) adalah konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi, sedangkan k dan n adalah tetapan empiris yang menunjukkan ikatan antara adsorbat dengan adsorben.
Isoterm Langmuir
Isoterm Langmuir diturunkan berdasarkan pada persamaan berikut:
C C m x β αβ +
=
1Isoterm Langmuir dipelajari untuk menggambarkan pembatasan sisi adsorpsi dengan asumsi bahwa sejumlah tertentu sisi sentuh adsorben ada pada permukaannya dan semuanya memiliki energi yang sama, serta adsorpsi bersifat dapat balik (Atkins 1999). Konstanta α, β dapat ditentukan dari kurva hubungan
m x
C terhadap C dengan persamaan:
C m x C α αβ 1 1 + = Keterangan:
x = jumlah adsorbat teradsorpsi per m unit bobot adsorben
m = bobot adsorben
C = konsentrasi keseimbangan
adsorben dalam larutan k, n = konstanta empiris
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan adalah spektrofotometer UV-tampak Shimadzu 1700. Bahan yang digunakan dalam penelitian adalah bentonit asal Leuwiliang.
Metode
Penelitian meliputi empat tahap, yaitu penyiapan bentonit lolos ayakan 200 mesh, penentuan kapasitas tukar kation (KTK) bentonit, pembuatan organobentonit dengan memodifikasi bentonit menggunakan HDTMABr, dan analisis organobentonit (Lampiran 1). Modifikasi bentonit dengan HDTMABr menggunakan jumlah HDTMABr bervariasi berdasarkan nilai KTK bentonit, yaitu 100% KTK, 50% KTK, dan 25% KTK (Lampiran 2). Seratus persen KTK artinya jumlah HDTMABr yang ditambahkan ekivalen dengan nilai KTK bentonit, yaitu setiap molekul HDTMABr dianggap bereaksi atau menggantikan posisi satu kation dapat tukar monovalen pada bentonit.
Analisis organobentonit meliputi penentuan keasaman dengan metode Titrimetri, penentuan kondisi optimum adsorpsi Cr(VI) oleh organobentonit yang meliputi penentuan pH optimum, penentuan waktu kontak, penentuan isoterm dan kapasitas adsorpsi Cr(VI), serta desorpsi Cr(VI) dari organobentonit.
Pengukuran konsentrasi Cr(VI) mengikuti prosedur pada metode standar (Clesceri et al. 2005). Sebanyak 10 mL larutan dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 7 tetes H2SO4-air (1:1) dan 0.2
mL DPC 0.25%, lalu dikocok dan diukur serapannya pada panjang gelombang 540 nm dengan spektrofotometer (Lampiran 4). Kurva standar dibuat menggunakan larutan standar K2Cr2O7 dengan konsentrasi 0, 0.1, 0.2, 0.4,
0.6, dan 0.8 ppm.
1
Sebanyak 2.5 g bentonit ditimbang, dimasukkan ke dalam tabung. Selanjutnya ditambahkan dengan amonium asetat pH 7 sebanyak 2 x 25 mL dengan selang waktu 30 menit. Setelah itu tabung yang masih berisi contoh didiamkan selama 24 jam, lalu disentrifugasi selama 15 menit kemudian dicuci kembali dengan amonium asetat pH 7. Setelah itu disaring, residu yang mengandung bentonit dicuci dengan 100 mL etanol 96% untuk menghilangkan kelebihan amonium. Setelah itu, residu dimasukkan ke dalam labu Kjeldahl, lalu ditambahkan dengan 25 mL NaOH 0.1 N, Selanjutnya ditambahkan sedikit batu didih dan akuades sampai setengah volume labu.
Erlenmeyer yang berisi 10 mL H3BO3 1%
dan 3 tetes indikator Conway (larutan berwarna merah) disiapkan untuk menampung NH3 (yang dibebaskan dari proses destilasi),
kemudian dihubungkan dengan alat destilasi. Selanjutnya dilakukan proses destilasi sampai diperoleh 75 mL destilat (larutan berwarna hijau). Destilat dititrasi dengan HCl 0.05 N hingga warna merah muda dan volume titran dicatat. Disiapkan pula blangko dengan pengerjaan seperti contoh tetapi tanpa contoh bentonit (Peraturan Menteri Pertanian No.02/Pert/HK.060/2/2006. dalam Al-Jabri 2008). Kapasitas tukar kation (me/100 g) bentonit dihitung menggunakan rumus sebagai berikut: KTK = bentonit gram HCl N Vb) (Vc− ×
x 100
Keterangan:
Vb = volume HClyang dibutuhkan pada titrasi blangko (mL) Vc = volume HCl yang dibutuhkan
pada titrasi contoh (mL) N HCl = normalitas HCl
Penyiapan Organobentonit
Penyiapan organobentonit dilakukan dengan cara sebagai berikut: ke dalam tiga buah erlenmeyer dimasukkan masing-masing 100 gram bentonit, kemudian ditambahkan larutan HDTMABr sebanyak 100%, 50%, dan 25% KTK bentonit (Lampiran 2). Campuran tersebut diaduk menggunakan pengaduk magnet selama 24 jam pada suhu kamar. Campuran HDTMA-bentonit (organobentonit) dicuci dengan akuades sampai bebas Br- (diuji
dengan AgNO3 0.1 M, Lampiran 3).
Organobentonit dikeringkan pada suhu kamar dan disimpan di dalam botol (Ceyhan & Baybas1999).
Penentuan Keasaman Organobentonit (Diantariani et al. 2008)
Keasaman organobentonit diukur dengan cara titrasi asam basa tidak langsung. Ke dalam tiga buah erlenmeyer dimasukkan masing-masing 0,5 gram organobentonit dan ditambahkan 25 mL larutan NaOH 1 N. Erlenmeyer ditutup rapat dan diaduk selama 24 jam, setelah itu disaring dan residunya dibilas menggunakan akuades. Filtrat dan bilasan lalu ditambahkan indikator fenolftalein, kemudian dititrasi dengan larutan HCl 1 N yang telah distandardisasi terlebih dahulu sampai titik akhir tidak berwarna. Perlakuan yang sama dilakukan terhadap larutan blangko yang hanya mengandung 25 mL larutan NaOH 1 N. Keasaman bentonit ditentukan sebagai kontrol dengan prosedur yang sama. Keasaman organobentonit dihitung menggunakan rumus sebagai berikut: Keasaman organobentonit (me/g):
Keasaman =
g
HCl N Vc
Vb − ) ×
(
Keterangan:
Vb = volume HCl yang dibutuhkan pada titrasi blangko (mL)
Vc = volume HCl yang dibutuhkan pada titrasi organobentonit (mL) N HCl = normalitas HCl
g = bobot organobentonit yang ditimbang (g)
1
50 mL, kemudian diimpitkan dengan akuades. Setelah itu ditentukan konsentrasi Cr(VI) setelah adsorpsi. pH optimum bentonit tanpa modifikasi ditentukan sebagai kontrol dengan prosedur yang sama.
Selanjutnya dibuat kurva hubungan antara pH larutan sebagai sumbu x dengan jumlah Cr(VI) teradsorpsi (mg/g) sebagai sumbu y. Jumlah Cr(VI) teradsorpsi didapatkan dari hasil pengurangan antara jumlah Cr(VI) awal dengan jumlah Cr(VI) sisa pada erlenmeyer. Nilai pH yang memberikan adsorpsi Cr(VI) paling besar merupakan pH optimum dan digunakan sebagai acuan dalam penentuan isoterm adsorpsi.
Penentuan Waktu Kontak Optimum Proses Adsorpsi Cr(VI) pada Organobentonit
Waktu kontak proses adsorpsi Cr(VI) pada organobentonit merupakan parameter untuk mengetahui waktu minimum yang dibutuhkan oleh organobentonit dalam mengadsorpsi ion Cr(VI) sampai tercapai keadaan jenuh. Penentuan waktu kontak dilakukan dengan cara: ke dalam 7 buah erlenmeyer 25 mL dimasukkan masing-masing 0,5 gram contoh butiran organobentonit dan ditambahkan 25 mL larutan Cr(VI) 200 ppm dengan pH optimum yang diperoleh.
Campuran diaduk menggunakan pengaduk magnet selama 1, 2, 3, 4, 5, 6, dan 12 jam. Selanjutnya campuran disaring dan filtratnya dimasukkan ke dalam labu takar 50 mL, kemudian diimpitkan dengan akuades, kemudian ditentukan konsentrasi Cr(VI) setelah adsorpsi. Waktu optimum bentonit tanpa modifikasi ditentukan sebagai kontrol dengan prosedur yang sama.
Setelah itu dibuat kurva hubungan antara waktu (jam) sebagai sumbu x dengan jumlah Cr(VI) yang teradsorpsi (mg/g) sebagai sumbu y. Jumlah Cr(VI) teradsorpsi didapatkan dari hasil pengurangan antara jumlah Cr(VI) awal dengan jumlah Cr(VI) sisa pada erlenmeyer. Waktu yang memberikan adsorpsi Cr(VI) paling besar merupakan waktu kontak optimum dan digunakan sebagai acuan dalam penentuan isoterm adsorpsi.
Penentuan Isoterm dan Kapasitas Adsorpsi Organobentonit
Penentuan kapasitas adsorpsi Cr(VI) dilakukan untuk mengetahui konsentrasi K2Cr2O7 maksimum yang dapat diadsorpsi
oleh organobentonit. Ke dalam 7 buah erlenmeyer 250 mL dimasukkan masing-masing 0,5 gram contoh butiran
organobentonit dan ditambahkan 25 mL larutan K2Cr2O7 dengan konsentrasi
berturut-turut 25, 50, 100, 200, 300, 500, dan 750 ppm, kemudian diatur pH larutan sesuai dengan pH optimum, lalu dikocok menggunakan alat kocok selama waktu kontak optimum. Selanjutnya campuran disaring dan filtratnya dimasukkan ke dalam labu takar 50 mL, kemudian diimpitkan dengan akuades. Setelah itu, dilakukan pengukuran konsentrasi Cr(VI) setelah adsorpsi. Isoterm dan kapasitas adsorpsi bentonit ditentukan sebagai kontrol dengan prosedur yang sama. Kapasitas adsorpsi dengan satuan mg/g dihitung menggunakan persamaan:
Q =
m
akhir C awal C
V ( − )
Efisiensi adsorpsi dapat dihitung dengan menggunakan persamaan:
% E =
− awal C akhir C awal C x 100%Keterangan persamaan tersebut adalah % E merupakan efisiensi adsorpsi, Q adalah kapasitas adsorpsi per bobot adsorben (mg/g adsorben), V adalah volume larutan (L), C awal adalah konsentrasi awal larutan (ppm), C akhir adalah konsentrasi akhir larutan (ppm), dan m adalah massa adsorben (g).
Pola isoterm adsorpsi diperoleh dengan membuat persamaan regresi linier menggunakan persamaan Langmuir dan Freundlich (Atkins 1999). Kurva isoterm Langmuir merupakan kurva hubungan antara konsentrasi (ppm) kesetimbangan adsorbat dalam larutan setelah adsorpsi (C) sebagai sumbu x dan perbandingan konsentrasi kesetimbangan dengan jumlah adsorbat teradsorpsi per satuan bobot adsorben, C/(x/m) dengan satuan g/L sebagai sumbu y, sedangkan kurva isoterm Freundlich merupakan kurva hubungan antara logaritma konsentrasi (ppm) kesetimbangan adsorbat dalam larutan setelah adsorpsi (C) sebagai sumbu x dan logaritma jumlah adsorbat yang teradsobsi per satuan bobot adsorben (x/m) dengan satuan mg/g sebagai sumbu y.
Bila linearitas isoterm Langmuir lebih besar dari isotherm Freundlich, maka adsorpsi Cr(VI) oleh organobentonit mengikuti tipe isoterm Langmuir, sebaliknya bila linearitas isoterm Freundlich lebih besar dari isotherm Langmuir, maka adsorpsi Cr(VI) oleh
1
organobentonit mengikuti tipe isoterm Freundlich.
Desorpsi Cr(VI) dari Organobentonit Organobentonit diaplikasikan ke dalam larutan K2Cr2O7 untuk menentukan kondisi
optimum dan mengetahui kemampuan adsorpsi terhadap Cr(VI), kemudian diteliti mengenai kemampuan desorpsi Cr(VI) dari organobentonit. Desorpsi Cr(VI) dari organobentonit dilakukan dengan menimbang masing-masing 1 gram organobentonit, kemudian dimasukkan ke dalam 3 buah erlenmeyer 125 mL. Selanjutnya organobentonit direndam dengan 100 mL larutan Cr(VI) menggunakan konsentrasi optimum yang didapat, kemudian pH campuran diatur pada pH optimum dan diaduk dengan alat kocok selama waktu kontak optimum.
Selanjutnya campuran disaring dan residunya dimasukkan ke dalam erlenmeyer dan direndam dengan akuades sebanyak 100 mL pada erlenmeyer pertama, HCl 0.1 N sebanyak 100 mL pada erlenmeyer kedua, dan CaCl2 1 M sebanyak 100 mL pada erlenmeyer
ketiga. Campuran kemudian diaduk selama 14 jam, setelah itu diukur konsentrasi Cr(VI) yang terdesorpsi. Serapan yang terbesar menunjukkan bahwa konsentrasi Cr(VI) yang terdesorpsi oleh pelarut besar, sehingga pelarut tersebut dapat mendesorpsi Cr(VI) dari organobentonit.
HASIL DAN PEMBAHASAN
Penambahan HDTMABr pada pembuatan organobentonit merupakan modifikasi bentonit yang bertujuan meningkatkan kemampuan adsorpsi bentonit terhadap Cr(VI). Permukaan bentonit pada awalnya memiliki muatan negatif, sehingga mampu mengikat ion-ion yang bermuatan positif (kation), seperti Ca2+, Na+, dan Mg2+,
sebaliknya bentonit memiliki kemampuan adsorpsi yang rendah terhadap ion-ion bermuatan negatif (anion), seperti Cr2O72- dan
CrO42-.
Bentonit memiliki kation-kation yang dapat dipertukarkan. HDTMABr merupakan senyawa organik yang bermuatan positif. HDTMABr dapat larut di dalam air membentuk ion HDTMA+ dan Br-, sehingga
bila larutan HDTMABr dicampurkan ke dalam bentonit, akan terjadi pertukaran kation. Kation-kation yang terdapat di ruang
antarlapisan bentonit, seperti Ca2+, Na+, dan
Mg2+ dapat dipertukarkan dengan HDTMA+.
Petukaran kation Ca2+, Na+, dan Mg2+ dengan
HDTMA+ mengubah bentonit yang bersifat
hidrofilik menjadi hidrofobik atau organofilik, sehingga dapat mengadsorpsi zat-zat organik dan ion Cr(VI).
Kapasitas Tukar Kation (KTK) Kapasitas tukar kation bentonit setelah dimodifikasi dengan HDTMABr (organobentonit) lebih rendah dari KTK sebelum dimodifikasi. Nilai KTK bentonit sebelum dimodifikasi HDTMABr adalah 54.53 me/100 g, sedangkan KTK organobentonit 25%, 50%, dan 100% berturut-turut adalah 45.14, 37.37, dan 20.72 me/100 g. Hal ini menunjukkan adanya pemblokiran sebagian sisi pertukaran dalam bentonit oleh HDTMA. Semakin banyak HDTMA menempati sisi pertukaran, maka semakin banyak sisi pertukaran yang diblokir sehingga menyebabkan menurunnya KTK.
Nilai KTK organobentonit 100% masih tinggi. Hal ini menunjukkan belum semua kation-kation pada ruang antarlapisan bentonit dipertukarkan oleh HDTMA+ akibat waktu
pengocokan yang kurang lama atau kecepatan pengocokan yang kurang, sehingga pertukaran kation antara kation pada ruang antarlapisan bentonit dengan HDTMA+ tidak maksimal.
Penurunan KTK yang diperoleh pada penelitian ini lebih kecil dibandingkan dengan penelitian yang lain. Penelitian Iskandar & Djajakirana (2006) melaporkan bentonit yang dimodifikasi dengan HDTMA mengalami penurunan KTK dari 83.95 menjadi 19.40 me/100 g, sedangkan berdasarkan Syuhada et al. (2009), bentonit yang dimodifikasi menggunakan jenis surfaktan di-(hydrogenatedtallow)-dimetilamoniumklorida (DTDA) mengalami penurunan KTK dari 45.05 menjadi 16.43 me/100 g. Perbedaan hasil penurunan KTK dari penelitian-penelitian tersebut dikarenakan perbedaan asal bentonit serta jenis dan jumlah surfaktan yang digunakan dalam penelitian.
1
organobentonit mengikuti tipe isoterm Freundlich.
Desorpsi Cr(VI) dari Organobentonit Organobentonit diaplikasikan ke dalam larutan K2Cr2O7 untuk menentukan kondisi
optimum dan mengetahui kemampuan adsorpsi terhadap Cr(VI), kemudian diteliti mengenai kemampuan desorpsi Cr(VI) dari organobentonit. Desorpsi Cr(VI) dari organobentonit dilakukan dengan menimbang masing-masing 1 gram organobentonit, kemudian dimasukkan ke dalam 3 buah erlenmeyer 125 mL. Selanjutnya organobentonit direndam dengan 100 mL larutan Cr(VI) menggunakan konsentrasi optimum yang didapat, kemudian pH campuran diatur pada pH optimum dan diaduk dengan alat kocok selama waktu kontak optimum.
Selanjutnya campuran disaring dan residunya dimasukkan ke dalam erlenmeyer dan direndam dengan akuades sebanyak 100 mL pada erlenmeyer pertama, HCl 0.1 N sebanyak 100 mL pada erlenmeyer kedua, dan CaCl2 1 M sebanyak 100 mL pada erlenmeyer
ketiga. Campuran kemudian diaduk selama 14 jam, setelah itu diukur konsentrasi Cr(VI) yang terdesorpsi. Serapan yang terbesar menunjukkan bahwa konsentrasi Cr(VI) yang terdesorpsi oleh pelarut besar, sehingga pelarut tersebut dapat mendesorpsi Cr(VI) dari organobentonit.
HASIL DAN PEMBAHASAN
Penambahan HDTMABr pada pembuatan organobentonit merupakan modifikasi bentonit yang bertujuan meningkatkan kemampuan adsorpsi bentonit terhadap Cr(VI). Permukaan bentonit pada awalnya memiliki muatan negatif, sehingga mampu mengikat ion-ion yang bermuatan positif (kation), seperti Ca2+, Na+, dan Mg2+,
sebaliknya bentonit memiliki kemampuan adsorpsi yang rendah terhadap ion-ion bermuatan negatif (anion), seperti Cr2O72- dan
CrO42-.
Bentonit memiliki kation-kation yang dapat dipertukarkan. HDTMABr merupakan senyawa organik yang bermuatan positif. HDTMABr dapat larut di dalam air membentuk ion HDTMA+ dan Br-, sehingga
bila larutan HDTMABr dicampurkan ke dalam bentonit, akan terjadi pertukaran kation. Kation-kation yang terdapat di ruang
antarlapisan bentonit, seperti Ca2+, Na+, dan
Mg2+ dapat dipertukarkan dengan HDTMA+.
Petukaran kation Ca2+, Na+, dan Mg2+ dengan
HDTMA+ mengubah bentonit yang bersifat
hidrofilik menjadi hidrofobik atau organofilik, sehingga dapat mengadsorpsi zat-zat organik dan ion Cr(VI).
Kapasitas Tukar Kation (KTK) Kapasitas tukar kation bentonit setelah dimodifikasi dengan HDTMABr (organobentonit) lebih rendah dari KTK sebelum dimodifikasi. Nilai KTK bentonit sebelum dimodifikasi HDTMABr adalah 54.53 me/100 g, sedangkan KTK organobentonit 25%, 50%, dan 100% berturut-turut adalah 45.14, 37.37, dan 20.72 me/100 g. Hal ini menunjukkan adanya pemblokiran sebagian sisi pertukaran dalam bentonit oleh HDTMA. Semakin banyak HDTMA menempati sisi pertukaran, maka semakin banyak sisi pertukaran yang diblokir sehingga menyebabkan menurunnya KTK.
Nilai KTK organobentonit 100% masih tinggi. Hal ini menunjukkan belum semua kation-kation pada ruang antarlapisan bentonit dipertukarkan oleh HDTMA+ akibat waktu
pengocokan yang kurang lama atau kecepatan pengocokan yang kurang, sehingga pertukaran kation antara kation pada ruang antarlapisan bentonit dengan HDTMA+ tidak maksimal.
Penurunan KTK yang diperoleh pada penelitian ini lebih kecil dibandingkan dengan penelitian yang lain. Penelitian Iskandar & Djajakirana (2006) melaporkan bentonit yang dimodifikasi dengan HDTMA mengalami penurunan KTK dari 83.95 menjadi 19.40 me/100 g, sedangkan berdasarkan Syuhada et al. (2009), bentonit yang dimodifikasi menggunakan jenis surfaktan di-(hydrogenatedtallow)-dimetilamoniumklorida (DTDA) mengalami penurunan KTK dari 45.05 menjadi 16.43 me/100 g. Perbedaan hasil penurunan KTK dari penelitian-penelitian tersebut dikarenakan perbedaan asal bentonit serta jenis dan jumlah surfaktan yang digunakan dalam penelitian.
1
(2008) adalah 0.5 me/g. Perbedaan nilai keasaman ini disebabkan oleh perbedaan asal bentonit.
Keasaman bentonit dipengaruhi oleh kation yang dapat dipertukarkan, kemampuan hidrasi liat, dan muatan negatif di permukaan (Frenkel 1973). Menurut Alemdaroglu (2003) keasaman bentonit disebabkan oleh kelabilan proton yang berasal dari gugus (-OH) di sudut oktahedral.
Penentuan keasaman dilakukan dengan metode titrasi asam basa secara tidak langsung, yaitu bagian asam direaksikan dengan basa NaOH yang diberikan berlebih terukur. Sisa NaOH yang tidak bereaksi dengan contoh dititrasi dengan HCl yang telah distandardisasi (Lampiran 6), sehingga jumlah zat-zat yang bereaksi setara. Reaksi yang terjadi adalah sebagai berikut:
RH + NaOH → RNa + H2O + NaOH
NaOH + HCl → NaCl + H2O
R adalah makromolekul bentonit dan H adalah proton gugus (-OH) yang bersifat asam. Gugus (-OH) dari makromolekul bentonit akan melepaskan H+, kemudian H+ yang
dilepaskan akan berikatan dengan ion OH
-dari NaOH.
Keasaman organobentonit semakin menurun dengan bertambahnya konsentrasi HDTMABr. Kation HDTMA+ yang terikat
pada bentonit merupakan gugus amonium kuartener yang tidak memiliki proton yang dapat bereaksi dengan gugus (-OH) dari NaOH, sehingga semakin kecil jumlah OH
-dari NaOH yang dibutuhkan untuk menetralkan H+ pada organobentonit.
pH Optimum Proses Adsorpsi Cr(VI) pada Organobentonit
Kapasitas adsorpsi Cr(VI) pada bentonit dan organobentonit dipengaruhi oleh pH larutan Cr(VI) yang akan diadsorpsi. Kapasitas adsorpsi Cr(VI) juga semakin meningkat dengan meningkatnya konsentrasi HDTMABr yang ditambahkan ke dalam bentonit (Gambar 4). Kapasitas adsorpsi Cr(VI) tertinggi terdapat pada organobentonit 100%.
Bentonit yang belum dimodifikasi dan organobentonit 25% memiliki pH optimum 4 dengan kapasitas adsorpsi terhadap Cr(VI) masing-masing 2.54 dan 5.10 mg/g. Organobentonit 50% memiliki pH optimum 5 dengan kapasitas adsorpsi terhadap Cr(VI)
7.46 mg/g. Hasil yang sama juga diperoleh pada penelitian Ramos et al. (2008), bahwa organobentonit dapat mengadsorpsi Cr(VI) secara optimum pada pH 5, begitupula dengan hasil penelitian Diantariani et al. (2008) mengenai adsorpsi Cr(VI) menggunakan rumput laut juga melaporkan bahwa pH optimum adsorpsi pada pH 5. Organobentonit 100% memiliki pH optimum 2 dengan kapasitas adsorpsi terhadap Cr(VI) 9.16 mg/g (Lampiran 10). Kurva standar penentuan pH dapat dilihat pada Lampiran 7, 8, dan 9.
Jenis anion Cr(VI) yang paling dominan terdapat di dalam larutan yang memiliki pH 2 sampai 12 adalah anion HCrO4- dan CrO4
2-(Ramos et al. 2008). Anion HCrO4
-merupakan jenis yang paling dominan di dalam larutan pada kisaran pH 2 sampai 4, sedangkan anion CrO42- dominan terdapat di
dalam larutan pada pH 9 sampai 12 (Ramos et al. 2008). pH optimum yang dihasilkan adalah 2, 4, dan 5 sehingga jenis anion Cr(VI) yang paling dominan terdapat di dalam larutan dan diadsorpsi organobentonit adalah HCrO4-.
Pengaruh pH terhadap kapasitas adsorpsi dapat ditunjukkan dari interaksi elektrostatik antara permukaan organobentonit dengan Cr(VI) dalam larutan, yaitu permukaan organobentonit bermuatan negatif pada pH lebih dari 10 dan bermuatan positif pada pH kurang dari 10 (Ramos et al. 2008). Hal ini menunjukkan pada pH lebih dari 10 akan terjadi tolakan elektrostatik di permukaan antara organobentonit dan Cr(VI) yang sama-sama bermuatan negatif, sebaliknya pada pH kurang dari 10 terjadi interaksi elektrostatik antara organobentonit yang bermuatan positif dengan anion Cr(VI) yang bermuatan negatif. Muatan positif permukaan meningkat dengan menurunnya pH, hal ini menyebabkan kapasitas adsorpsi Cr(VI) oleh organobentonit optimum pada pH rendah.
Efisiensi adsorpsi Cr(VI) pada bentonit adalah 24.91% pada pH optimum 4, pada organobentonit 25% pada pH optimum 4 adalah 50.34%, pada organobentonit 50% pada pH optimum 5 adalah 73.22%, dan pada organobentonit 100% pada pH optimum 2 adalah 89.99% (Lampiran 10). Hal ini menunjukkan bahwa kapasitas adsorpsi Cr(VI) oleh bentonit atau organobentonit sejalan dengan efisiensi adsorpsi (Gambar 17, Lampiran 12), artinya semakin besar kapasitas adsorpsi Cr(VI) oleh adsorben, maka persen efisiensi akan semakin besar pula, sehingga proses adsorpsi akan semakin efisien.
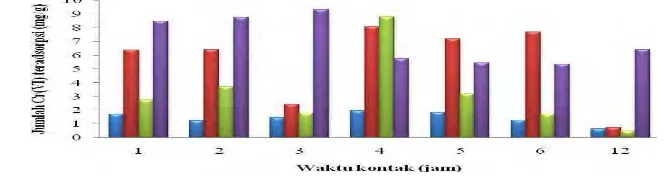
Waktu Kontak Optimum Proses Adsorpsi Cr(VI) pada Organobentonit Penentuan waktu optimum adsorpsi dilakukan untuk mengetahui waktu minimum yang dibutuhkan oleh adsorben dalam mengadsorpsi ion logam Cr(VI) secara maksimum sampai tercapai keadaan jenuh. Kapasitas adsorpsi bentonit semakin meningkat pada waktu kontak 1 sampai 4 jam, akan tetapi pada waktu kontak 5 sampai 12 jam kapasitas adsorpsi Cr(VI) mengalami penurunan (Gambar 5).
Kapasitas adsorpsi Cr(VI) oleh organobentonit 25% dan 50% mengalami kenaikan pada waktu 1 dan 2 jam, meskipun kemudian mengalami penurunan pada waktu 3 jam, kapasitas adsorpsi meningkat kembali pada waktu 4 jam, selanjutnya kapasitas adsorpsi menurun kembali (Gambar 5).
Turunnya jumlah ion logam Cr(VI) yang teradsorpsi setelah pengocokan lebih dari waktu optimum disebabkan oleh ketidakstabilan ikatan antara organobentonit
dengan ion logam Cr(VI), sehingga kemungkinan ada Cr(VI) yang terlepas kembali. Organobentonit 100% mengalami peningkatan kapasitas adsorpsi pada waktu 1 sampai 3 jam, kemudian kapasitas adsorpsi cenderung konstan. Hasil penelitian menunjukkan bahwa bentonit, organobentonit 25%, dan organobentonit 50% memiliki waktu kontak optimum 4 jam dengan kapasitas adsorpsi terhadap Cr(VI) masing-masing adalah 1.95, 8.80, dan 8.79 mg/g (Lampiran 11). Oleh karena itu, waktu kontak optimum digunakan sebagai acuan dalam penentuan isoterm adsorpsi Cr(VI) selanjutnya.
Penelitian Diantariani et al. (2008) mengenai adorpsi Cr(VI) menggunakan rumput laut melaporkan bahwa waktu optimum adsorpsi adalah 12 jam dengan kapasitas adsorpsi 5.06 mg/g. Hasil ini menunjukkan bahwa kapasitas adsorpsi Cr(VI) menggunakan organobentonit lebih tinggi dibandingkan menggunakan rumput laut.
Gambar 4 Hubungan antara jumlah Cr(VI) teradsorpsi dengan pH larutan.
Bentonit, Organobentonit 25%, Organobentonit 50%, Organobentonit 100%.
Gambar 5 Hubungan antara jumlah Cr(VI) teradsorpsi dengan waktu kontak.
1
Isoterm dan Kapasitas Adsorpsi Organobentonit
Penentuan isoterm adsorpsi dilakukan untuk mengetahui pengaruh konsentrasi ion logam Cr(VI) yang direaksikan terhadap jumlah ion logam Cr(VI) yang diadsorpsi oleh adsorben pada suhu kamar. Hasil penelitian menunjukkan dengan bertambahnya konsentrasi adsorbat yang diinteraksikan, maka jumlah ion logam Cr(VI) yang teradsorpsi pada organobentonit semakin bertambah. Pola isoterm ini memperlihatkan afinitas yang relatif tinggi antara adsorbat (ion logam Cr(VI)) dengan adsorben pada tahap awal dan selanjutnya konstan.
Organobentonit 100% memiliki kapasitas adsorpsi terbesar dibandingkan dengan kapasitas adsorpsi adsorben lainnya karena dengan meningkatnya HDTMABr yang digunakan untuk memodifikasi bentonit diharapkan ruang antarlapisan pada bentonit memiliki rongga yang lebih banyak, sehingga dapat memerangkap lebih banyak ion logam Cr(VI) dari larutan, sehingga dapat meningkatkan kapasitas adsorpsi.
Konsentrasi K2Cr2O7 optimum bentonit,
dan organobentonit 25% pada penelitian ini berturut-turut sebesar 200 dan 300 ppm, sedangkan konsentrasi K2Cr2O7 optimum
organobentonit 50% dan 100% adalah 500 ppm. Kapasitas adsorpsi Cr(VI) pada bentonit, organobentonit 25%, 50%, dan 100% pada penelitian ini berturut-turut sebesar 4.44, 11.96, 22.09, dan 20.53 mg/g (Lampiran 13 ). Nilai ini lebih besar dibandingkan dengan adsorben lain yang telah dilaporkan. Hasil yang diperoleh Ramos et al. (2008), organobentonit memiliki kapasitas adsorpsi terhadap Cr(VI) sebesar 10 mg/g, sedangkan hasil penelitian Diantariani et al. (2008) melaporkan kapasitas adsorpsi dari rumput laut terhadap ion logam Cr(VI) adalah 13.50 mg/g. Selain itu, berdasarkan penelitian Iskandar & Djajakirana (2006) kapasitas adsorpsi organobentonit terhadap Cr(VI) adalah 8.89 mg/g.
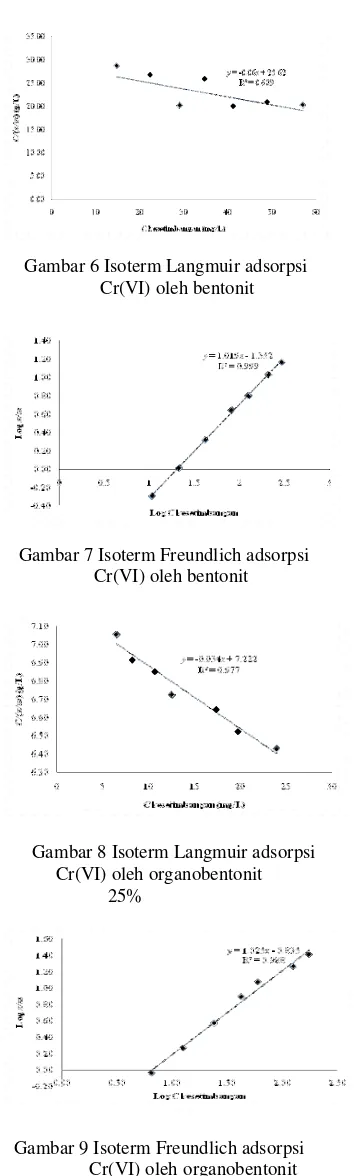
Proses adsorpsi anion dikromat oleh HDTMA-bentonit menurut Iskandar & Djajakirana (2006) diduga sebagai hasil dari mekanisme entrapment. Hal ini menunjukkan interaksi yang terjadi antara adsorben dan adsorbat adalah fisisorpsi. Pendugaan ini didukung dengan menggunakan pendekatan adsorpsi Langmuir dan Freundlich untuk mengetahui jenis ikatan yang terjadi antara organobentonit dengan Cr(VI).
Gambar 6 Isoterm Langmuir adsorpsi Cr(VI) oleh bentonit
Gambar 7 Isoterm Freundlich adsorpsi Cr(VI) oleh bentonit
Gambar 8 Isoterm Langmuir adsorpsi Cr(VI) oleh organobentonit 25%
Gambar 9 Isoterm Freundlich adsorpsi Cr(VI) olehorganobentonit 25%
1
Linearitas isoterm Freundlich lebih besar dibandingkan dengan linearitas isoterm Langmuir (Gambar 6 sampai 13). Hal ini menunjukkan bahwa adsorpsi Cr(VI) oleh adsorben bentonit maupun organobentonit mengikuti persamaan isoterm Freundlich.
Isoterm Freundlich disebut juga adsorpsi fisika yang terjadi bila gaya intramolekul lebih besar dari gaya tarik antarmolekul (Atkins 1999). Isoterm Freundlich menunjukkan bahwa interaksi yang terjadi antara organobentonit dan Cr(VI) adalah ikatan van der Waals (Atkins 1999). Selain itu, efisiensi adsorpsi Cr(VI) pada bentonit dan organobentonit semakin meningkat sampai pada konsentrasi optimum adsorben dapat mengadsorpsi Cr(VI) kemudian adsorbat yang teradsorpsi cenderung tidak bertambah dengan meningkatnya konsentrasi (Gambar 14,
HDTMA, maka organobentonit memiliki luas permukaan yang kecil dan bertindak sebagai media penyekat adsorpsi. Modifikasi bentonit dengan HDTMA membuat permukaan organobentonit bersifat organofilik dan berinteraksi kuat dengan senyawa organik.
Kapasitas adsorpsi organobentonit meningkat karena interaksi hidrofobik di antara molekul yang diadsorpsi dengan HDTMA-bentonit. Semakin banyak kation anorganik yang digantikan oleh kation organik, permukaan liat semakin berubah dari hidrofilik menjadi organofilik (hidrofilik), sehingga kemampuan organobentonit dalam mengadsorpsi zat organik atau anion semakin meningkat. Selain itu, hasil penelitian menunjukkan bahwa kapasitas adsorpsi mengalami penurunan setelah waktu kontak optimum. Hal ini mengindikasikan bahwa interaksi yang terjadi antara adsorben Lampiran 12).
Mekanisme proses adsorpsi suatu senyawa pada organobentonit bergantung pada jenis kation dari senyawa organik yang digunakan dalam membuat organobentonit (Ceyhan & Baybas 1999). Menurut Ceyhan & dan
adsorbat adalah entrapment (fisisorpsi). Adsorben yang telah jenuh mengadsorpsi K2Cr2O7, dengan pengocokan yang lebih lama
menyebabkan adsorbat yang terperangkap di dalam adsorben terlepas kembali, sehingga menyebabkan kapasitas adsorpsi menurun. Baybas (1999) bila kation yang digunakan
memiliki gugus alkil yang besar seperti
Gambar 12 Isoterm Freundlich adsorpsi Cr(VI) olehorganobentonit 50%
Gambar 13 Isoterm Freundlich adsorpsi Cr(VI) olehorganobentonit 100%
Gambar 11 Isoterm Langmuir adsorpsi Cr(VI) olehorganobentonit 100%
Gambar 10 Isoterm Langmuir adsorpsi Cr(VI) olehorganobentonit 50%
1
Desorpsi Cr(VI) dari Organobentonit Desorpsi Cr(VI) dari organobentonit dilakukan dengan akuades, HCl, dan CaCl2.
Berdasarkan hasil desorpsi yang dilakukan, didapatkan jumlah ion logam Cr(VI) yang paling banyak terdesorpsi dari bentonit maupun organobentonit adalah dengan menggunakan HCl 0.1 N. Hasil desorpsi dengan menggunakan akuades, HCl 0.1 N, dan CaCl2 1 M disajikan pada Tabel 1.
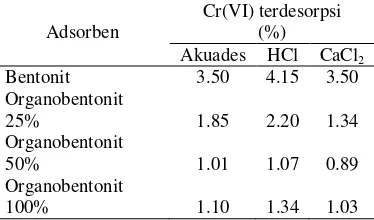
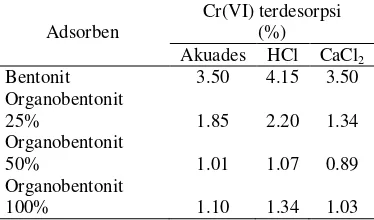
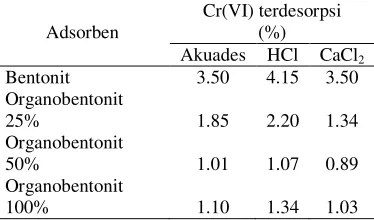
Tabel 1 Desorpsi Cr(VI) dari adsorben oleh akuades, HCl, dan CaCl2
Kemampuan pelarut HCl, akuades, dan CaCl2 dalam mendesorpsi Cr(VI) pada
organobentonit relatif kecil. Hal ini menunjukkan bahwa Cr(VI) terperangkap kuat di dalam organobentonit. Proses desorpsi Cr(VI) dari bentonit cenderung lebih besar daripada organobentonit. Hal ini menunjukkan bahwa Cr(VI) teradsorpsi lebih kuat di dalam organobentonit dibandingkan bentonit. Proses desorpsi Cr(VI) dari organobentonit disebabkan oleh jenuhnya organobentonit oleh Cr(VI) sehingga Cr(VI) dapat terdesorpsi kembali dan mencapai kesetimbangan.
Rendahnya jumlah Cr(VI) yang terdesorpsi dari organobentonit menunjukkan bahwa organobentonit merupakan adsorben yang tidak dapat digunakan kembali bila keadaannya sudah jenuh oleh adsorbat Cr(VI). Kemampuan organobentonit mempertahankan Cr(VI) menyebabkan organobentonit memiliki kemampuan adsorpsi yang tinggi sehingga kapasitas adsorpsinya besar. Selain itu, organobentonit merupakan adsorben yang baik karena adsorbat yang telah teradsorpsi tidak mudah lepas kembali sehingga dapat mengurangi migrasi logam berat seperti Cr(VI) dari adsorben ke perairan dangkal.
SIMPULAN DAN SARAN
Simpulan
Modifikasi bentonit oleh HDTMABr telah meningkatkan kemampuan bentonit dalam mengadsorpsi ion Cr(VI). Semakin besar konsentrasi HDTMABr yang diberikan, maka
kapasitas adsorpsi Cr(VI) juga semakin besar. Kapasitas tukar kation bentonit, organobentonit 25%, 50%, dan 100% berturut-turut adalah 54.53, 45.14, 37.37, dan 20.72 me/100 g. Keasaman bentonit, organobentonit 25%, 50%, dan 100% berturut-turut adalah 4.95, 3.62, 0.90, dan 0.60 me/g. Kondisi optimum adsorpsi Cr(VI) oleh bentonit, organobentonit 25%, organobentonit 50%, dan organobentonit 100% terjadi pada kisaran pH 2 sampai 5, waktu kontak 3 sampai 4 jam, konsentrasi Cr(VI) 200 sampai 500 ppm, dan kapasitas adsorpsi berturut-turut 4.44, 11.96, 22.09, dan 20.53 mg/g. Kemampuan desorpsi Cr(VI) dari organobentonit oleh HCl 0.1 N, akuades, dan CaCl2 1 M relatif kecil, hal ini
menunjukkan bahwa Cr(VI) terperangkap kuat di dalam organobentonit.
Saran
Penelitian selanjutnya perlu disarankan untuk mendapatkan nilai KTK organobentonit sekecil mungkin, sehingga semua kation dapat tukar pada bentonit dapat ditempati oleh kation HDTMA+ dan kapasitas adsorpsi
diharapkan dapat lebih besar. Disarankan juga untuk melakukan karakterisasi menggunakan Scanning Electron Microscopy (SEM) untuk menunjukkan mikrostruktur pada permukaan adsorben yang telah berhasil dimodifikasi oleh HDTMABr.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New York: J Wiley.
Alemdaroglu T, Akkus G, Onal M, Sarikaya Y. 2003. Investigation of the Surface Acidity of A Bentonite Modified By Acid Activation and Thermal Treatment. Turkey Journal of Chemistry 27:675-681.
Al-Jabri M. 2008. Kajian Metode Penetapan Kapasitas Tukar Kation Zeolit Sebagai Pembenah Tanah untuk Lahan Pertanian Terdegradasi. Jurnal Standardisasi 10(2): 56-59.
[AG]. 2009. Trichloroethylene removal using permeable reactive and immobilizing barrier.[terhubungberkala].http://www.mail archive.com/iaginet@iagi.or.id/msg15209. html. [29 Jan 2009].
Cr(VI) terdesorpsi
Adsorben (%)
Akuades HCl CaCl2
Bentonit 3.50 4.15 3.50 Organobentonit
25% 1.85 2.20 1.34
Organobentonit
50% 1.01 1.07 0.89
Organobentonit
1
Desorpsi Cr(VI) dari Organobentonit Desorpsi Cr(VI) dari organobentonit dilakukan dengan akuades, HCl, dan CaCl2.
Berdasarkan hasil desorpsi yang dilakukan, didapatkan jumlah ion logam Cr(VI) yang paling banyak terdesorpsi dari bentonit maupun organobentonit adalah dengan menggunakan HCl 0.1 N. Hasil desorpsi dengan menggunakan akuades, HCl 0.1 N, dan CaCl2 1 M disajikan pada Tabel 1.
Tabel 1 Desorpsi Cr(VI) dari adsorben oleh akuades, HCl, dan CaCl2
Kemampuan pelarut HCl, akuades, dan CaCl2 dalam mendesorpsi Cr(VI) pada
organobentonit relatif kecil. Hal ini menunjukkan bahwa Cr(VI) terperangkap kuat di dalam organobentonit. Proses desorpsi Cr(VI) dari bentonit cenderung lebih besar daripada organobentonit. Hal ini menunjukkan bahwa Cr(VI) teradsorpsi lebih kuat di dalam organobentonit dibandingkan bentonit. Proses desorpsi Cr(VI) dari organobentonit disebabkan oleh jenuhnya organobentonit oleh Cr(VI) sehingga Cr(VI) dapat terdesorpsi kembali dan mencapai kesetimbangan.
Rendahnya jumlah Cr(VI) yang terdesorpsi dari organobentonit menunjukkan bahwa organobentonit merupakan adsorben yang tidak dapat digunakan kembali bila keadaannya sudah jenuh oleh adsorbat Cr(VI). Kemampuan organobentonit mempertahankan Cr(VI) menyebabkan organobentonit memiliki kemampuan adsorpsi yang tinggi sehingga kapasitas adsorpsinya besar. Selain itu, organobentonit merupakan adsorben yang baik karena adsorbat yang telah teradsorpsi tidak mudah lepas kembali sehingga dapat mengurangi migrasi logam berat seperti Cr(VI) dari adsorben ke perairan dangkal.
SIMPULAN DAN SARAN
Simpulan
Modifikasi bentonit oleh HDTMABr telah meningkatkan kemampuan bentonit dalam mengadsorpsi ion Cr(VI). Semakin besar konsentrasi HDTMABr yang diberikan, maka
kapasitas adsorpsi Cr(VI) juga semakin besar. Kapasitas tukar kation bentonit, organobentonit 25%, 50%, dan 100% berturut-turut adalah 54.53, 45.14, 37.37, dan 20.72 me/100 g. Keasaman bentonit, organobentonit 25%, 50%, dan 100% berturut-turut adalah 4.95, 3.62, 0.90, dan 0.60 me/g. Kondisi optimum adsorpsi Cr(VI) oleh bentonit, organobentonit 25%, organobentonit 50%, dan organobentonit 100% terjadi pada kisaran pH 2 sampai 5, waktu kontak 3 sampai 4 jam, konsentrasi Cr(VI) 200 sampai 500 ppm, dan kapasitas adsorpsi berturut-turut 4.44, 11.96, 22.09, dan 20.53 mg/g. Kemampuan desorpsi Cr(VI) dari organobentonit oleh HCl 0.1 N, akuades, dan CaCl2 1 M relatif kecil, hal ini
menunjukkan bahwa Cr(VI) terperangkap kuat di dalam organobentonit.
Saran
Penelitian selanjutnya perlu disarankan untuk mendapatkan nilai KTK organobentonit sekecil mungkin, sehingga semua kation dapat tukar pada bentonit dapat ditempati oleh kation HDTMA+ dan kapasitas adsorpsi
diharapkan dapat lebih besar. Disarankan juga untuk melakukan karakterisasi menggunakan Scanning Electron Microscopy (SEM) untuk menunjukkan mikrostruktur pada permukaan adsorben yang telah berhasil dimodifikasi oleh HDTMABr.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New York: J Wiley.
Alemdaroglu T, Akkus G, Onal M, Sarikaya Y. 2003. Investigation of the Surface Acidity of A Bentonite Modified By Acid Activation and Thermal Treatment. Turkey Journal of Chemistry 27:675-681.
Al-Jabri M. 2008. Kajian Metode Penetapan Kapasitas Tukar Kation Zeolit Sebagai Pembenah Tanah untuk Lahan Pertanian Terdegradasi. Jurnal Standardisasi 10(2): 56-59.
[AG]. 2009. Trichloroethylene removal using permeable reactive and immobilizing barrier.[terhubungberkala].http://www.mail archive.com/iaginet@iagi.or.id/msg15209. html. [29 Jan 2009].
Cr(VI) terdesorpsi
Adsorben (%)
Akuades HCl CaCl2
Bentonit 3.50 4.15 3.50 Organobentonit
25% 1.85 2.20 1.34
Organobentonit
50% 1.01 1.07 0.89
Organobentonit
ADSORPSI DAN DESORPSI ION KROMIUM(VI) PADA
BENTONIT YANG DIMODIFIKASI
HEKSADESILTRIMETILAMONIUM BROMIDA
JANTI WIDYANINGSIH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
1
Desorpsi Cr(VI) dari Organobentonit Desorpsi Cr(VI) dari organobentonit dilakukan dengan akuades, HCl, dan CaCl2.
Berdasarkan hasil desorpsi yang dilakukan, didapatkan jumlah ion logam Cr(VI) yang paling banyak terdesorpsi dari bentonit maupun organobentonit adalah dengan menggunakan HCl 0.1 N. Hasil desorpsi dengan menggunakan akuades, HCl 0.1 N, dan CaCl2 1 M disajikan pada Tabel 1.
Tabel 1 Desorpsi Cr(VI) dari adsorben oleh akuades, HCl, dan CaCl2
Kemampuan pelarut HCl, akuades, dan CaCl2 dalam mendesorpsi Cr(VI) pada
organobentonit relatif kecil. Hal ini menunjukkan bahwa Cr(VI) terperangkap kuat di dalam organobentonit. Proses desorpsi Cr(VI) dari bentonit cenderung lebih besar daripada organobentonit. Hal ini menunjukkan bahwa Cr(VI) teradsorpsi lebih kuat di dalam organobentonit dibandingkan bentonit. Proses desorpsi Cr(VI) dari organobentonit disebabkan oleh jenuhnya organobentonit oleh Cr(VI) sehingga Cr(VI) dapat terdesorpsi kembali dan mencapai kesetimbangan.
Rendahnya jumlah Cr(VI) yang terdesorpsi dari organobentonit menunjukkan bahwa organobentonit merupakan adsorben yang tidak dapat digunakan kembali bila keadaannya sudah jenuh oleh adsorbat Cr(VI). Kemampuan organobentonit mempertahankan Cr(VI) menyebabkan organobentonit memiliki kemampuan adsorpsi yang tinggi sehingga kapasitas adsorpsinya besar. Selain itu, organobentonit merupakan adsorben yang baik karena adsorbat yang telah teradsorpsi tidak mudah lepas kembali sehingga dapat mengurangi migrasi logam berat seperti Cr(VI) dari adsorben ke perairan dangkal.
SIMPULAN DAN SARAN
Simpulan
Modifikasi bentonit oleh HDTMABr telah meningkatkan kemampuan bentonit dalam mengadsorpsi ion Cr(VI). Semakin besar konsentrasi HDTMABr yang diberikan, maka
kapasitas adsorpsi Cr(VI) juga semakin besar. Kapasitas tukar kation bentonit, organobentonit 25%, 50%, dan 100% berturut-turut adalah 54.53, 45.14, 37.37, dan 20.72 me/100 g. Keasaman bentonit, organobentonit 25%, 50%, dan 100% berturut-turut adalah 4.95, 3.62, 0.90, dan 0.60 me/g. Kondisi optimum adsorpsi Cr(VI) oleh bentonit, organobentonit 25%, organobentonit 50%, dan organobentonit 100% terjadi pada kisaran pH 2 sampai 5, waktu kontak 3 sampai 4 jam, konsentrasi Cr(VI) 200 sampai 500 ppm, dan kapasitas adsorpsi berturut-turut 4.44, 11.96, 22.09, dan 20.53 mg/g. Kemampuan desorpsi Cr(VI) dari organobentonit oleh HCl 0.1 N, akuades, dan CaCl2 1 M relatif kecil, hal ini
menunjukkan bahwa Cr(VI) terperangkap kuat di dalam organobentonit.
Saran
Penelitian selanjutnya perlu disarankan untuk mendapatkan nilai KTK organobentonit sekecil mungkin, sehingga semua kation dapat tukar pada bentonit dapat ditempati oleh kation HDTMA+ dan kapasitas adsorpsi
diharapkan dapat lebih besar. Disarankan juga untuk melakukan karakterisasi menggunakan Scanning Electron Microscopy (SEM) untuk menunjukkan mikrostruktur pada permukaan adsorben yang telah berhasil dimodifikasi oleh HDTMABr.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New York: J Wiley.
Alemdaroglu T, Akkus G, Onal M, Sarikaya Y. 2003. Investigation of the Surface Acidity of A Bentonite Modified By Acid Activation and Thermal Treatment. Turkey Journal of Chemistry 27:675-681.
Al-Jabri M. 2008. Kajian Metode Penetapan Kapasitas Tukar Kation Zeolit Sebagai Pembenah Tanah untuk Lahan Pertanian Terdegradasi. Jurnal Standardisasi 10(2): 56-59.
[AG]. 2009. Trichloroethylene removal using permeable reactive and immobilizing barrier.[terhubungberkala].http://www.mail archive.com/iaginet@iagi.or.id/msg15209. html. [29 Jan 2009].
Cr(VI) terdesorpsi
Adsorben (%)
Akuades HCl CaCl2
Bentonit 3.50 4.15 3.50 Organobentonit
25% 1.85 2.20 1.34
Organobentonit
50% 1.01 1.07 0.89
Organobentonit
1
Atkins PW. 1999. Kimia Fisika Jilid II. Kartohadiprodjo, penerjemah; Rohhadyan Utama T, editor. Oxford University Press. Terjemahan dari: Physical Chemistry.
Bastarache E. 2002. Chromium and Coumpounds. [terhubung berkala]. http://digitalefire.com/education/toxicity/c hromium.html [12 Feb 2009].
Ceyhan O, Baybas D. 1999. Adsorption of Some Textile Dyes by Hexadecytrimethyl ammonium Bentonite. Turkey Journal of Chemistry 25: 193-200.
Clesceri IS, Arnold EG, Andrew DE. 1989. Standar Methods for The Examination of Water and Wastewater. Ed ke-20. Washington DC: Alpha Awwa Wes.
Diantariani NP, Sudiarta IW, Elantiani NK. 2008. Proses Biosorpsi dan Desorpsi Ion Cr(VI) Pada Biosorben Rumput Laut Eucheuma spinosum. Jurnal Kimia 2(1).
Forlink. 2000. Paket terapan produksi bersih pada industri tekstil. [terhubung berkala]. http:www.Forlink.dml.or.id/pterabp/te.htm l. [28 Jan 2009].
Frenkel M. 1973. Surface Acidity of montmorillonites. Clay and Clay Minerals 22:435-441.
Igwe JC, Abia AA. 2007. Adsorption Isotherm Studies of Cd (II), Pb (II) and Zn (II) Ions Bioremediation from Aqueous Solution using Unmodified and EDTA-Modified Maize Cob. Ecliyica Quimica 32(1): 33-42.
Iskandar I, Djajakirana G. 2006. Absorption Capability of HDTMA-Activated Bentonite on Organic and Inorganic Pollutant in Some Industrial Liquid Waste. Bogor: Departemen Ilmu Tanah dan Sumberdaya Lahan, IPB.
Jason PP. 2004. Activated carbon and some application for the remediation of soil and groundwater pollution. [terhubung berkala].http://www.cee.vet.edu/program areas. [25 Jan 2009].
Kusnoputranto H. 1996. Toksikologi Lingkungan Logam Toksik dan B-3. Jakarta: Fakultas Kesehatan Masyarakat dan Pusat Penelitian Sumber Daya Manusia dan Lingkungan, UI.
Majdan M et al. 2006. Characteristics of chabazite modified by hexadecyltrimethyl ammonium bromide and its affinity toward
chromates. Journal of Molecular Structure 791(1-3): 53-60.
Manurung R, Hasibuan R, Irvan. 2004. Perombakan zat warna azoreaktif secara anaerob-aerob [Karya tulis]. Sumatera Utara: Fakultas Teknik, Universitas Sumatera Utara.
Mc Cabe WL et al. 2001. Unit Operation of Chemical Engineering. Edisi ke-6. New York: McGraw-Hill.
Noroozifar M, Khorasani-Motlagh M. 2003. Spesific Extraction of Cromium as Tetrabutylammonium-Chromate and Spectrophotometric Determination by Diphenylcarbazide: Speciaton of Chromium in Efluent Stream. Analytical Science 19:705-708.
Ramos et al. 2008. Adsorption of Chromium (VI) From Water Solution onto Organobentonite. Journal of Environtment Engineering Management 18(5): 311-317.
Soemirat J. 2002. Kesehatan Lingkungan. Yogyakarta: Gajah Mada University Press.
Sugiyarto HK. 2003. Dasar-dasar Kimia Anorganik Logam. Yogyakarta; UGM Press.
Sukandarrumidi. 1999. Bahan Galian Industri. Gajah Mada University Press, Yogjakarta.
Syuhada, Rahmat W, Jayatin, Saeful R. 2009. Modifikasi Bentonit (Clay) Menjadi Organoclay dengan Penambahan Surfaktan. Jurnal Nanosains dan Nanoteknologi 2:1.
Vogel AI. 1990. Buku Analisis Anorganik Kualitatif Makro dan Semimikro. Edisi ke-5. Penterjemah: Ir. L. Setiono, Dr. A. Hadyana Pudjatmaka, Perevisi: G. Svehla, Ph. D. D. Sc. FRIC. Terjemahan dari Textbook of Macro and Semimicro Qualitative Inorganic Analysis. Jakarta: PT Kalman Media Pustaka.
ADSORPSI DAN DESORPSI ION KROMIUM(VI) PADA
BENTONIT YANG DIMODIFIKASI
HEKSADESILTRIMETILAMONIUM BROMIDA
JANTI WIDYANINGSIH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN