ISOLASI DAN SELEKSI
Bacillus
sp. SEBAGAI AGEN
PENDEGRADASI AMONIA, NITRIT DAN NITRAT PADA
MEDIA PEMELIHARAAN IKAN LELE DAN IKAN MAS
RITA FITRIYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Seleksi
Bacillus sp. sebagai Agen Pendegradasi Amonia, Nitrit dan Nitrat dalam Media
Pemeliharaan Ikan Lele dan Ikan Mas adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Rita Fitriyanti
RINGKASAN
RITA FITRIYANTI. Isolasi dan seleksi Bacillus sp. sebagai agen pendegradasi amonia,
nitrit dan nitrat pada media pemeliharaan ikan lele dan mas. Dibimbing oleh Dr. MUNTI YUHANA dan Dr. KUKUH NIRMALA.
Budidaya ikan intensif dengan padat penebaran tinggi menuntut tingginya jumlah pakan sehingga mengakibatkan penumpukan bahan organik dan anorganik dalam wadah budidaya. Hal ini dapat menyebabkan peningkatan jumlah senyawa toksik amonia, nitrit dan nitrat. Salah satu jenis bakteri yang sering digunakan untuk bioremediasi senyawa toksik tersebut adalah campuran spesies Bacillus sp. karena
mampu melakukan proses nitrifikasi dan denitrifikasi secara aerobik sehingga dapat menggunakan amonia, nitrit dan nitrat sebagai substratnya dan mengubahnya menjadi gas nitrogen. Di samping itu, Bacillus sp. dapat membentuk s
Penelitian ini dilakukan dalam empat tahap, yaitu: (1) isolasi bakteri jenis
Bacillus sp. dari air, akar tanaman air dan sedimen pada kolam ikan air tawar, (2)
seleksi isolat bakteri dalam media basal heterotrof untuk nitrifikasi dan denitrifikasi, (3) seleksi isolat bakteri dalam media synthetic pond water dan (4) uji aktivitas Bacillus sp.
secara in vivo dalam akuarium pemeliharaan ikan lele dan ikan mas.
pora sehingga lebih stabil untuk waktu yang lama. Penelitian ini bertujuan untuk mengisolasi dan menyeleksi bakteri dari jenis Bacillus sp. yang berasal dari kolam ikan air tawar yang berpotensi
sebagai agen pendegradasi senyawa metabolit toksik amonia, nitrit dan nitrat.
Dari tujuh isolat bakteri yang berhasil diisolasi pada tahap satu, diperoleh dua isolat yaitu Bacillus cereus dan Bacillus subtilis yang menunjukkan penurunan amonia
paling tinggi pada media basal untuk nitrifikasi yaitu masing-masing sebesar 56,60% dan 63,18% dari konsentrasi awal 131 mg/l TAN (Total Amonia Nitrogen). Pada seleksi isolat dalam media untuk denitrifikasi, Bacillus cereus dan Bacillus subtilis juga mampu
mereduksi senyawa nitrat paling tinggi yaitu masing-masing sebesar 40,97% dan 26,51% dari konsentrasi awal 530 mg/l nitrat. Pada seleksi isolat bakteri dalam synthetic
pond water menunjukkan bahwa campuran Bacillus cereus dan Bacillus subtilis
memiliki kemampuan tertinggi dalam mengoksidasi amonia (66,32%) dari konsentrasi awal 30,2 mg/l TAN serta mereduksi nitrit (19,77%) dari konsentrasi awal 0,2263 mg/l nitrit dan nitrat (28,37%) dari konsentrasi awal 32,6 mg/l nitrat. Campuran Bacillus cereus dan Bacillus subtilis ini selanjutnya digunakan dalam uji in vivo.
Pada uji in vivo digunakan dua jenis ikan yaitu ikan mas dan lele (4-5 cm) yang
masing-masing terdiri kontrol (tanpa inokulasi bakteri) dan perlakuan (dengan inokulasi campuran B. cereus dan B. subtilis dosis 109 cfu/ml total isolat,3 ml/akuarium).
Berdasarkan uji statistik (p<0.05), pada konsentrasi amonia dan nitrat terdapat perbedaan yang nyata antar kontrol pada ikan mas (tanpa inokulasi bakteri) dengan perlakuan pada ikan mas (dengan inokulasi bakteri), demikian pula halnya pada ikan lele. Sedangkan konsentrasi nitrit pada kontrol dan perlakuan baik pada ikan mas maupun lele tidak menunjukkan perbedaan yang nyata. Penambahan B. cereus dan B.
subtilis ke dalam media dapat menurunkan konsentrasi amonia sebesar 30% dari
konsentrasi awal 6,12 mg/l TAN dan mempertahankan survival rate ikan lele sebesar
83,33% dan ikan mas sebesar 63,33%, dibandingkan dengan kontrol yang sudah mengalami kematian hampir 70% pada jam ke 12.
SUMMARY
RITA FITRIYANTI. Isolation and Selection of Bacillus sp. as the Microbial Agent for
Ammonia, Nitrite and Nitrate Degradation in Catfish dan Goldfish Rearing Environment. Supervised by Dr. MUNTI YUHANA and Dr. KUKUH NIRMALA.
Intensive fish farming which applying high stocking densities requires a high amount of feed input. This will result in accumulation of organic and inorganic materials (including ammonia, nitrite and nitrate compounds) which are toxic to fish. Those problems can be resolve by the application of probiotics which have the ability for bioremediation as Bacillus sp. The spores of Bacillus sp. have advantages because it
is more stable for a long time. The use of probiotic Bacillus sp. involved in nitrification
and denitrification processes in aerobic condition will reduce the accumulation of ammonia, nitrite and nitrate in the fish rearing environment, since the compounds will be converted into nitrogen gas. This study aimed to isolate and select Bacillus sp.
species as a potential microbial agent which will degradate the toxic metabolites such as ammonia, nitrite and nitrate
These research have four stages : (1) the isolation of Bacillus sp. from water,
waterplant’s root and sediment in freshwater fish ponds,(2) the selection of bacteria in basal media for nitrification and denitrification,(3) the selection of bacteria in synthetic pond water medium and (4) the selection of Bacillus sp. ability in the in vivo test (
.
in catfish and goldfish rearing environment).
Among collection of our isolates, Bacillus cereus and Bacillus subtilis showed the
highest ammonia degradation; as much as 56,60% and 63,18% respectively from the initial concentration of 131 mg/l TAN (Total Ammonia Nitrogen); and nitrate compound as much as 40,97% and 26,51% respectively from the initial concentration 530 mg/l. The mixed of two isolates designated by Bacillus cereus and Bacillus subtilis
in synthetic pond water showed the highest capability in oxidizing ammonia (66,32%) from the initial concentration of 30,2 mg/l TAN and the reduction of nitrite (19,77%) from the initial concentration of 0,263 mg/l nitrite and nitrate (28,37%) compounds from the initial concentration of 32,6 mg/l nitrate.
In the in vivo experiment, using carp and catfish (4-5 cm) in the aquaria (30 l).
Each fish exposed in the control water (without inoculation of bacteria) and treatment water (with a mixture of
Bacillus cereus and Bacillus subtilis inoculation, 109 cfu/ml
total isolate, 3 ml/aquaria). In the in vivo experiments, TAN and nitrate concentrations
in treatments inoculated by isolates were lower compared to that of control (without any isolate inoculation) (statistical tests P <0.05), whereas the nitrite concentration in the control and treatment were not significantly different. The inoculation of Bacillus cereus and Bacillus subtilis
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
ISOLASI DAN SELEKSI
Bacillus
sp. SEBAGAI AGEN
PENDEGRADASI AMONIA, NITRIT DAN NITRAT PADA
MEDIA PEMELIHARAAN IKAN LELE DAN IKAN MAS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Isolasi dan Seleksi Bacillus sp. sebagai Agen Pendegradasi
Amonia, Nitrit dan Nitrat pada Media Pemeliharaan Ikan Lele dan Ikan Mas
Nama : Rita Fitriyanti NIM : C151100111
Disetujui oleh Komisi Pembimbing
Ketua
Dr Munti Yuhana, SPi, MSi
Anggota
Dr Ir Kukuh Nirmala, MSc
Diketahui oleh
Ketua Departemen Budidaya Perairan
Dr Ir Sukenda, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2012 ini ialah Isolasi dan Seleksi Bacillus sp. sebagai Agen Pendegradasi Amonia, Nitrit dan Nitrat
dalam Media Pemeliharaan Ikan Lele dan Ikan Mas.
Terima kasih penulis ucapkan kepada Ibu Dr Munti Yuhana dan Bapak Dr Kukuh Nirmala selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Pemda Kabupaten Bogor yang telah memberikan beasiswa kepada penulis selama menempuh pendidikan S2 di IPB. Ungkapan terima kasih juga disampaikan kepada mami, papi (alm), suami, anak-anakku serta kakak dan adikku, atas segala doa dan kasih sayangnya. Semoga karya ilmiah ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
i
1. PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat penelitian 2
2. TINJAUAN PUSTAKA 3
Eksresi Produk Nitrogen pada Ikan 3
Toksisitas Amonia 4
Toksisitas Nitrit 6
Toksisitas Nitrat 7
Bacillus sp. sebagai Agen Pendegradasi Amonia, Nitrit dan Nitrat
8 Pemanfaatan Produk Nitrogen oleh Bakteri 11
3. METODOLOGI 14
Bahan 14
Alat 14
Prosedur Analisis data 14
4. HASIL DAN PEMBAHASAN 19
Hasil 19
Pembahasan 29
5. SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 35
LAMPIRAN 41
DAFTAR TABEL
1 Morfologi koloni dan sel isolat bakteri hasil isolasi dari kolam ikan air tawar
19
2 Kemampuan isolat bakteri dalam mereduksi nitrat serta nitrit dan gas N2
24 yang dihasilkan selama inkubasi 16 hari
DAFTAR GAMBAR
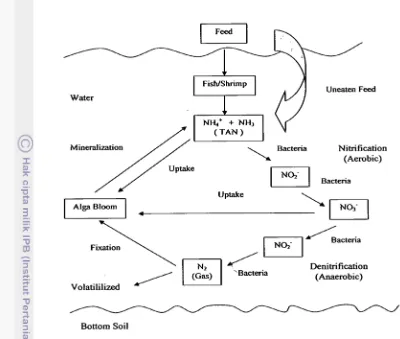
1 Siklus Nitrogen 4
2 Siklus biokimia nitrogen di alam pada kondisi aerobik dan anaerobik 8 3 Pertumbuhan isolat bakteri hasil isolasi pada media basal heterotrof
untuk nitrifikasi 20
4 Pola pertumbuhan isolat bakteri S1 dan S3 pada media basal
heterotrof untuk nitrifikasi 20
5 Penurunan TAN pada isolat bakteri pada media basal heterotrof
untuk nitrifikasi 20
6 Penurunan TAN oleh isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
21
7 Nitrit yang dihasilkan oleh isolat bakteri pada media basal heterotrof untuk nitrifikasi
21
8 Nitrat yang dihasilkan oleh isolat bakteri pada media basal heterotrof untuk nitrifikasi
21
9 Nitrit yang dihasilkan oleh isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
22
10 Nitrat yang dihasilkan oleh isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
22
11 Pertumbuhan isolat bakteri hasil isolasi pada media basal untuk denitrifikasi
22
12 Pola pertumbuhan isolat bakteri S1 dan S3 pada media basal untuk denitrifikasi
23
13 Penurunan nitrat pada isolat bakteri pada media basal untuk
denitrifikasi 23
14 Penurunan nitrat oleh isolat bakteri S1 dan S3 pada media basal
15 Nitrit yang dihasilkan oleh isolat bakteri pada media basal untuk denitrifikasi
24
16 Nitrit yang dihasilkan oleh isolat bakteri S1 dan S3 pada media basal untuk denitrifikasi
24
17 Pewarnaan spora isolat S1(Bacillus cereus) 25
18 Pewarnaan spora isolat S3 (Bacillus subtilis) 25
19 Data pertumbuhan populasi isolat bakteri pada media synthetic pond water
26
20 Profil TAN oleh isolat bakteri dalam media synthetic pond water 26
21 Profil nitrit oleh isolat bakteri dalam media synthetic pond water 26
22 Profil nitrat oleh isolat bakteri dalam media synthetic pond water 27
23 Perbandingan konsentrasi TAN antara kontrol dengan perlakuan pada ikan mas dan lele
27
24 Perbandingan konsentrasi nitrit antara kontrol dengan perlakuan pada ikan mas dan lele
28
25 Perbandingan konsentrasi nitrat antara kontrol dengan perlakuan
pada ikan mas dan lele 28
26 Pertumbuhan populasi Bacillis cereus dan Bacillus subtilis pada
ikan mas dan lele 28
27 Kelangsungan hidup ikan antara kontrol dengan perlakuan pada
ikan mas dan lele 29
DAFTAR LAMPIRAN
1 Bahan-bahan untuk pembuatan media basal heterotrof untuk nitrifikasi, media basal untuk denitrifikasi dan synthetic pond water
41
2 Prosedur kerja pengukuran total amonia nitrogen (TAN) nitrit, nitrat
dan kesadahan 42
3 Lokasi tempat pengambilan sampel air, akar tanaman air dan sedimen
43
4 Data kolam pengambilan sampel 43
6 Isolat-isolat bakteri hasil isolasi dan seleksi 44 7 Kemampuan isolat bakteri dalam mengoksidasi amonia,dan senyawa
nitrit dan nitrat yang dihasilkan selama inkubasi 6 hari
45
8 Kemampuan isolat bakteri dalam mengoksidasi amonia, menurunkan nitrit dan nitrat yang dihasilkan selama inkubasi 5 hari dalam synthetic pond water
45
9 Data amonia, nitrit, nitrat, oksigen terlarut, kesadahan, pH dan suhu pada uji coba in vivo
45
10 Tabel sidik ragam konsentrasi amonia, nitrit dan nitrat pada kontrol dan perlakuan (ikan mas) pada hari ke 4
46
11 Tabel sidik ragam konsentrasi amonia, nitrit dan nitrat pada kontrol dan perlakuan (ikan mas) pada hari ke 6
46
12 Tabel sidik ragam konsentrasi amonia, nitrit dan nitrat pada kontrol dan perlakuan (ikan lele) pada hari ke 4
46
13 Tabel sidik ragam konsentrasi amonia, nitrit dan nitrat pada kontrol dan perlakuan (ikan lele) pada hari ke 6
47
PENDAHULUAN
Latar Belakang
Peningkatan produksi perikanan dapat dilakukan secara intensif maupun ekstensif. Meskipun menguntungkan secara ekonomi, budidaya ikan secara intensif dengan padat penebaran tinggi menuntut tingginya jumlah pakan yang diberikan kepada ikan sehingga mengakibatkan penumpukan bahan organik dan anorganik yang berasal dari sisa pakan dan ekskresi metabolisme ikan dalam wadah budidaya (Djokosetiyanto et al. 2006). Pada budidaya ikan dengan sistem
sirkulasi air yang terbatas dan tanpa pergantian air (zero water exchange),
banyaknya sisa pakan, pupuk organik dan ekskresi ikan yang mengendap di dasar kolam akan menyebabkan penurunan daya dukung kolam. Hal ini akan memicu peningkatan produksi senyawa metabolit toksik dan mineralisasi nutrien dari bahan organik (protein dan asam amino) yang menjadi bahan anorganik (amonia, nitrit dan nitrat) (Komarawidjaja dan Ambarsari 2001; Djokosetiyanto et al. 2006;
Biswas et al. 2006; Widiyanto et al. 2008) dan dapat menyebabkan keracunan,
mortalitas ikan dan terjadinya blooming alga.
Untuk mempertahankan kualitas air kolam budidaya, diperlukan langkah antisipatif melalui aplikasi probiotik (bioremediasi). Bioremediasi merupakan salah satu upaya untuk memperbaiki kualitas air melalui aktivitas biologi oleh mikroorganisme (Rusmana 2003). Bioremediasi yang sukses mencakup beberapa persyaratan, di antaranya: mampu mengoptimalkan laju nitrifikasi untuk menjaga amonia agar tetap rendah, mampu mengoptimalkan laju denitrifikasi untuk mengeliminir kelebihan nitrogen sebagai gas nitrogen dari kolam dan memaksimalkan mineralisasi karbon menjadi karbondioksida untuk meminimalkan akumulasi lumpur (Antony dan Philip 2006; Badjoeri dan Widiyanto 2008; Khasani 2008). Agen bioremediasi tersebut harus memiliki kemampuan metabolisme untuk reaksi-reaksi oksidasi, amonifikasi, nitrifikasi, denitrifikasi, sulfurikasi dan fiksasi nitrogen, sehingga secara langsung dapat merombak bahan-bahan organik dan berbahaya di dalam air media (Yuhana 2010).
Dalam aplikasinya di dunia perikanan, probiotik sebagai agen pengurai dapat digunakan baik secara langsung dengan ditebarkan ke air atau melalui perantara pakan alami (live food). Verschuere et al. (2000) mendefinisikan
probiotik sebagai penambahan mikroba hidup yang memiliki pengaruh menguntungkan bagi inang melalui modifikasi bentuk asosiasi dengan inang atau komunitas mikroba lingkungan hidupnya, meningkatkan nilai nutrisi pakan dan meningkatkan kualitas air.
Hong et al. (2005) mengungkapkan spesies bakteri yang sering digunakan
sebagai komponen dari produk biokontrol dan bioremediasi terdiri dari campuran spesies Bacillus sp. Selama ini probiotik Bacillus sp. lebih sering digunakan untuk
memineralisasi bahan organik dalam wadah budidaya (Villasenor et al. 2011).
Namun penelitian yang dilakukan oleh Liu dan Han (2004), Kim et al. (2005) dan
Yang et al. (2011) menunjukkan bahwa Bacillus sp. merupakan bakteri heterotrof
menjadi gas nitrogen dalam kondisi aerobik. Selain itu kemampuan Bacillus sp.
untuk membentuk spora memiliki keuntungan tersendiri karena lebih stabil untuk waktu yang lama (
Lalloo et al. (2007) juga membuktikan bahwa pengunaan bakteri dari jenis Bacillus sp. mampu untuk menurunkan konsentrasi amonia, nitrat dan nitrit baik
melalui uji coba secara in vitro maupun in vivo pada media pemeliharaan ikan mas
(C. carpio). Berdasarkan hal tersebut, maka diharapkan dalam penelitian ini dapat
ditemukan bakteri jenis Bacillus sp. yang berasal dari kolam pemeliharaan ikan air
tawar yang mampu berperan sebagai agen pendegradasi metabolit toksik (amonia, nitrit dan nitrat) pada kegiatan budidaya ikan.
Hong et al. 2005).
Tujuan
Penelitian ini dilaksanakan untuk mengisolasi dan menyeleksi bakteri dari jenis Bacillus sp. yang berasal dari kolam ikan air tawar yang berpotensi sebagai
agen pendegradasi senyawa metabolit toksik amonia, nitrit dan nitrat. Rangkaian penelitian ini terdiri dari empat tahap kegiatan dengan tujuan masing-masing kegiatan sebagai berikut:
1. Penelitian tahap satu bertujuan untuk mengisolasi bakteri heterotrof jenis
Bacillus sp. yang berasal dari sedimen kolam ikan air tawar.
2. Penelitian tahap dua bertujuan untuk menyeleksi bakteri yang telah diisolasi pada penelitian tahap satu yang mampu mendegradasi amonia, nitrit dan nitrat tertinggi pada media basal heterotrof untuk nitrifikasi dan media basal untuk denitrifikasi.
3. Penelitian tahap tiga bertujuan untuk menganalisis kemampuan bakteri hasil seleksi pada penelitian tahap dua untuk mendegradasi amonia, nitrit dan nitrat pada media synthetic pond water.
4. Penelitian tahap empat bertujuan untuk menganalisis kemampuan bakteri hasil seleksi pada penelitian tahap tiga untuk mendegradasi amonia, nitrit dan nitrat secara in vivo di akuarium dengan kadar amonia air yang tinggi
dan jenis ikan yang berbeda (ikan lele dan mas). Manfaat
Manfaat yang diperoleh dari penelitian ini adalah tersedianya isolat lokal bakteri heterotrof pendegradasi amonia, nitrit dan nitrat dari jenis Bacillus sp.
untuk bioremediasi air budidaya ikan. Pemanfaatan Bacillus sp. ini merupakan
TINJAUAN PUSTAKA
Eksresi Produk Nitrogen pada Ikan
Perkembangan budidaya ikan yang mengarah ke basis industri, hampir semuanya mengadopsi teknologi intensif yang salah satu parameternya adalah penggunaan pakan buatan sebagai input untuk meningkatkan bobot ikan yang dipelihara. Pemberian pakan buatan yang intensif ternyata berdampak pada menurunnya kualitas air secara drastis akibat sisa pakan yang tidak termakan atau sisa kotoran (feses) (Boyd 1990). Menurut Eshchar et al. (2005), ikan
mengeksresikan dua metabolit toksik utama dalam air yaitu NH3 dan CO2
Hewan akuatik, termasuk ikan (teleost fish) pada umumnya adalah
amoniotelik (mengekskresikan amonia). Walaupun energi yang hilang melalui
ekskresi amonia tidak terlalu besar, hanya sekitar 4% dari total energi yang diterima, amonia merupakan bentuk utama dari ekskresi nitrogen pada ikan (Gomes et al. 1999). Amonia sebagai produk sisa nitrogen diekskresikan dengan
difusi melewati permukaan tubuh ikan,terutama insang, ke dalam lingkungan perairan (Wood 1993; Chew et al. 2005). Meskipun sebagian besar ikan
umumnya adalah hewan amoniotelik, terdapat beberapa jenis ikan yang mampu
mensintesa urea dalam jumlah tertentu melalui ornithine urea cycle (OUC) pada
kondisi tertentu. Beberapa jenis ikan ketika dalam kondisi kelaparan dan stress pada lingkungan (naiknya kadar amonia di perairan, kepadatan tinggi dan pH tinggi) akan terpicu untuk mensintesa urea (Saha dan Ratha 2007; Monzani dan Moraes 2008). Ikan lele dan mas mengekskresikan lebih banyak nitrogen dalam bentuk urea dan mengalami penurunan ekskresi amonia ketika dipelihara pada salinitas yang lebih tinggi (Altinok dan Grizzle 2004). Sementara pada kondisi temperatur yang lebih tinggi selain mengkonsumsi oksigen lebih banyak ikan akan mengekskresikan amonia lebih banyak pula (Gomes et al. 1999).
, yang beracun untuk ikan pada konsentrasi yang rendah. Ikan dapat mengekskresikan beberapa produk nitrogen, yang utama berupa amonia dan urea, di samping produk ekskresi nitrogen lainnya berupa asam amino, trimethylamine oksida, creatin, creatinin dan guanin (Wright 1995).
Nitrogen sebagai produk sisa metabolisme berasal dari degradasi oksidatif asam amino dalam proses metabolisme protein (Wrigth 1995). Terdapat berbagai faktor yang mempengaruhi ekskresi nitrogen pada ikan, di antaranya adalah ukuran tubuh atau massa ikan, sumber energi metabolik yang digunakan, salinitas, temperatur dan lain sebagainya. Penelitian yang dilakukan Feeley et al. (2007)
menunjukkan laju metabolisme pada juvenile cobia (Rachycentron canadum)
Gambar 1. Siklus Nitrogen ( Durborow et al. 1997a)
Toksisitas Amonia
Boyd (1990) menyatakan dari semua parameter kualitas air yang mempengaruhi ikan, amonia adalah yang terpenting setelah oksigen, karena dalam jumlah kecil amonia dapat menyebabkan stress dan kerusakan insang, menambah kerentanan terhadap infeksi bakteri dan memperlambat pertumbuhan, bahkan pada konsentrasi tinggi dapat menyebabkan kematian. Amonia nitrogen ada di air dalam dua bentuk yaitu ion amonia terionisasi (NH4+) dan amonia tidak terionisasi (NH3
Menurut Boyd (1990) dan Durborow et al. (1997a) amonia adalah produk
akhir utama dalam pemecahan protein dalam ikan. Jumlah amonia yang diekskresikan ikan bervariasi tergantung jumlah pakan yang masuk ke dalam kolam atau sistem budidaya. Amonia juga memasuki kolam akibat dari dekomposisi bahan organik oleh bakteri dekomposisi seperti pakan yang tidak dimakan atau ganggang dan tanaman air yang mati. Menurut Masser et al. (2005)
amonia diproduksi oleh bakteri yang mendekomposisi protein yang berasal dari sisa pakan, tumbuhan dan hewan yang mati. Sebanyak 0,99 kg amonia dihasilkan dari 45,36 kg pakan.
). Baik amonia maupun amonium sama-sama bersifat toksik namun amonia lebih bersifat toksik dibandingkan dengan amonium. Hal ini bisa terjadi karena bentuk amonia tidak terionisasi mudah larut dalam lipid dari membran sel dan cepat diambil oleh insang (Hargreaves dan Kucuk 2000 ; Barik
Amonia bisa diserap oleh alga atau bakteri. Alga menggunakan amonia sebagai nutrien untuk pertumbuhan dan reproduksinya. Beberapa bakteri aerobik juga menggunakan amonia sebagai sumber makanan dalam proses nitrifikasi (Masser et al. 2005). Barik et al. (2011) menyatakan faktor-faktor yang
bertanggung jawab untuk menurunkan tingkat amonia antara lain nitrifikasi dan konsumsi amonia oleh bakteri heterotrofik.
Menurut Boyd (1990), konsentrasi amonia yang mencapai sublethal akan
menyebabkan perubahan patologi pada organ dan jaringan ikan. Selain menurunkan pertumbuhan, amonia juga dapat menurunkan resistensi ikan terhadap penyakit. Hal ini antara lain disebabkan oleh:
- Pengurangan pengambilan oksigen karena kerusakan insang
- Penambahan kebutuhan energi karena digunakan untuk detoksifikasi - Gangguan pengaturan osmoregulasi
- Kerusakan fisik pada berbagai jaringan
Menurut Novotny dan Olem (1994), proporsi total amonia nitrogen (TAN) akan bersifat toksik saat terjadi kenaikan temperatur dan pH perairan. Pada pH ≤ 7, sebagian amonia akan mengalami ionisasi. Pada saat pH ≥ 7 justru amonia tidak terionisasi yang bersifat toksik akan lebih banyak. Untuk setiap kenaikan 1 unit pH maka akan terjadi kenaikan amonia sebesar 10 kali (Durborow et al.
1997a). Hargreaves dan Kucuk (2000) menyatakan bahwa pada kolam budidaya, konsentrasi NH3 berfluktuasi setiap hari karena pengaruh dari fotosontesis dan respirasi yang berpengaruh pada pH. Pada pagi hari, pH minimum dan TAN (total amonia nitrogen) banyak terdapat dalam bentuk amonium, pada siang hari pada saat pH maksimum, keseimbangan TAN bergeser ke arah NH3
Hargreaves dan Kucuk (2000) mengemukakan peningkatan konsentrasi NH
yang merupakan komponen TAN yang lebih toksik pada saat pH tinggi.
3 di lingkungan dibatasi oleh difusi NH3 dari darah ikan ke dalam air. Amonia harus dikeluarkan dari dalam tubuh karena akumulasi amonia bersifat toksik. NH3 diekskresikan melalui difusi pasif seluruh epitel insang dari darah ke dalam air. Jika tekanan parsial NH3 di lapisan batas epitel lebih besar dibandingkan dalam darah, ekskresi NH3 akan dihambat dan NH3 akan berdifusi dari air ke dalam darah. Paparan amonia pada ikan lele dapat menyebabkan kerusakan epitel, fusi dan edema pada lamela sekunder insang. Lesi ini dapat mengurangi fungsi permukaan insang untuk pertukaran gas dan merusak fungsi pernapasan (Miron et al. 2007). Selain itu amonia bisa mengakibatkan hipertrofi epitel filamen yang
merupakan respon adaptasi untuk meningkatkan penghalang guna mengurangi masuknya NH3
Menurut Miron et al. (2007) ikan lele/channel catfish adalah ikan yang
paling efektif mengeluarkan amonia secara cepat dari darahnya dibandingkan
Tilapia dan stripped bass. Schram et al. (2010) menyatakan konsentrasi amonia di
dalam air untuk ikan lele dumbo tidak boleh melebihi 0,34 mg/l NH (Weinstein dan Kimmel 1998; Schram et al. 2010).
3 di mana pada konsentrasi NH3 tersebut mempunyai risiko penurunan 10% dalam konsumsi pakan dan 5% terhadap pertumbuhan. Hargreaves dan Kucuk (2000) menambahkan bahwa paparan 0,12-0,40 mg/l NH3 pada ikan lele akan menghambat pertumbuhan. Pada konsentrasi kronis dan sublethal (0,517 mg/l
0,002 g, 0,296 ± 0,049 g, 3,516 ± 0,946 g dan 32,958 ± 5,748 g masing-masing adalah 0,37 mg/l, 0,54 mg/l, 0,71 mg/l dan 1,03 mg/l. Hasil ini menunjukkan bahwa kerentanan ikan terhadap amonia akan menurun seiring dengan bertambahnya ukuran.
Selama periode pertumbuhan untuk semua spesies, peningkatan konsentrasi amonia dapat menyebabkan penurunan pertumbuhan dan peningkatan konversi pakan. Konsentrasi amonia juga berpengaruh terhadap kecernaan protein dan sumber energi (Miron et al. 2007). Selain itu, detoksifikasi amonia membutuhkan
energi dan dapat menghasilkan pengurangan sebanyak 68% dalam laju produksi energi yang normal.
Perbedaan toleransi ikan terhadap konsentrasi amonia dapat terjadi karena perbedaan spesies ikan. Hargreaves dan Kucuk (2000) serta Schram et al. (2010)
menjelaskan bahwa lele dumbo (Clarias gariepinus) sangat toleran terhadap racun
amonia karena mampu secara aktif mengeksresikan NH4+ sebagai mekanisme pertahanan utama terhadap toksisitas amonia. Lele dapat mengurangi produksi amonia dengan cara mengurangi katabolisme asam amino. Jaringan dan sel pada lele juga mempunyai toleransi yang tinggi terhadap amonia. Selain itu, tampak bahwa lele ini mengurangi permeabilitas kulit dan membran terhadap NH3
Biswas et al. (2006) menyatakan bahwa nilai LC 50 amonia untuk ikan mas
selama 24 jam berkisar antara 1,39 - 2,36 mg/l dan untuk 96 jam antara 0,40 - 3,20 mg/l. Weinstein dan Kimmel (1998) juga menjelaskan bahwa pada ikan mas
C.carpio yang terpapar selama 48 jam pada konsentrasi amonia sublethal
(0,32-1,04 mg/l NH
sebagai respon terhadap konsentrasi amonia air yang tinggi (Schram et al. 2010).
3) menunjukkan perubahan signifikan dalam konsentrasi amonia, asam urea dan laktat dalam daging ikan. Pada ikan mas yang terpapar dalam jangka panjang dengan konsentrasi rendah (0,033 mg/l NH3) menyebabkan munculnya tanda-tanda stress pada sistem kekebalan tubuh dan perubahan komposisi darah dan jaringan hemopoietik, ginjal dan limpa setelah 5 minggu. Pada amonia tingkat tinggi (2,97-4,24 mg/l NH3), ikan menunjukkan tanda-tanda lincah namun diikuti oleh kelelahan dan biasanya kematian dalam waktu 18 jam.
Toksisitas Nitrit
Menurut Durborow et al. (1997b) nitrit memasuki sistem budidaya ikan
setelah pakan dicerna oleh ikan dan kelebihan nitrogen diubah menjadi amonia, yang kemudian dikeluarkan sebagai limbah ke dalam air. Nitrit merupakan senyawa hasil oksidasi amonia dan bentuk peralihan (intermediet) antara amonia
dan nitrat (nitrifikasi) dan antara nitrat dan gas nitrogen (denitrifikasi). Total amonia nitrogen (TAN; NH3 dan NH4+) kemudian diubah menjadi nitrit (NO2) yang di bawah kondisi normal dengan cepat dikonversi menjadi bentuk tidak beracun yaitu nitrat (NO3
Novotny dan Olem (1994) menyatakan nitrit (NO
) oleh bakteri alami. Senyawa nitrit oleh beberapa kelompok bakteri heterotrof digunakan sebagai penerima elektron terakhir dalam proses metabolismenya.
kecil karena segera dioksidasi menjadi nitrat. Di bawah kondisi normal nitrit tidak terakumulasi menjadi toksik (Hargreaves 1998), namun bisa menjadi toksik jika populasi bakteri dekomposisi terganggu (Masser et al. 2005).
Nitrit merupakan produk setengah jadi dari proses nitrifikasi yang juga dapat bersifat beracun pada ikan terutama dalam sistem budidaya lele secara intensif. Meskipun nitrit jarang mendatangkan masalah dalam sistem pertukaran air yang tinggi dan filtrasi yang baik, namun sistem budidaya harus selalu dipantau sepanjang tahun, dan dikelola bila perlu, untuk mencegah kerugian ekonomi parah akibat penyakit darah coklat.
Konsentrasi sublethal dari nitrit dapat meningkatkan kerentanan ikan
terhadap penyakit bakterial. Faktor-faktor yang mempengaruhi toksisitas nitrit antara lain konsentrasi klorida dalam air, pH, ukuran ikan, status nutrisi, dan konsentrasi oksigen terlarut (Song et al. 2011). Perbedaan dalam struktur dan
kemampuan fisiologis dalam setiap spesies dapat menyebabkan toksisitas nitrit berbeda. Lele yang memiliki organ pernapasan tambahan atau dendrit yang dapat mengambil oksigen langsung dari atmosfer, sehingga dapat mentolerir tingkat nitrit yang lebih tinggi dan pembentukan methemoglobin dibandingkan spesies
lainnya.
Durborow et al. (1997b) dan
Hargreaves (1998) menyatakan bahwa penyakit darah coklat terjadi pada ikan saat air mengandung konsentrasi nitrit tinggi. Nitrit memasuki aliran darah melalui insang dan mengakibatkan darah berwarna coklat. Hemoglobin yang mengangkut
oksigen dalam darah, bergabung dengan nitrit menjadi bentuk methemoglobin,
yang tidak mampu mengangkut oksigen sehingga ikan bisa mati lemas meskipun konsentrasi oksigen di air relatif tinggi. Penurunan aktivitas plankton di kolam (karena suhu rendah, deplesi nutrisi, cuaca berawan, perlakuan herbisida, dan lain-lain) dapat mengakibatkan kurangnya amonia yang diasimilasi oleh ganggang, sehingga meningkatkan beban pada dengan bakteri nitrifikasi.
Toksisitas Nitrat
Nitrat adalah hasil akhir dari nitrifikasi dan merupakan sumber makanan untuk bakteri denitrifikasi heterotrof. Nitrat tidak terlalu beracun dibandingkan dengan amonia dan nitrit. Nitrat baru akan menjadi racun dalam kegiatan budidaya jika konsentrasinya berada di atas 200 mg/l.
Kadar nitrat di perairan yang tidak tercemar biasanya lebih tinggi dari amonium. Kadar nitrat-nitrogen pada perairan alami biasanya jarang melebihi 0,1 mg/l. Kadar nitrat yang melebihi 5 mg/l menggambarkan terjadinya pencemaran antropogenik yang berasal dari aktivitas manusia dan tinja hewan. Kadar nitrat nitrogen melebihi 0,2 mg/l dapat mengakibatkan terjadinya eutrofikasi
(pengayaan) perairan yang selanjutnya menstimulir pertumbuhan alga dan tumbuhan air secara pesat (blooming) (Davis dan Cornwell 1991).
Pengurangan nitrat disebabkan karena konversinya menjadi nitrogen atau kembali menjadi amonia. Jalur yang mengarah pada pembentukan gas nitrogen, adalah yang paling ideal dalam sistem budaya (Barik et al. 2011). Menurut Hamlin (2005) kelebihan nitrat
dalam budidaya dapat dikurangi dengan pergantian air.
kematian, ketika natrium nitrat digunakan sebagai sumber nitrat. Nitrat biasanya tidak mencapai konsentrasi toksik dalam lingkungan alam atau sistem sirkulasi dengan pertukaran air yang tinggi. Ikan yang terpapar nitrat di atas ambang batas akan menunjukkan pergerakan insang yang cenderung cepat, penurunan kecepatan berenang, kemerahan di sekitar mulut dan noda merah di sepanjang tubuh terutama di dasar sirip dada.
Bakteri Bacillus sp. sebagai Agen Pendegradasi Amonia, Nitrit dan Nitrat
Umumnya bakteri nitrifikasi merupakan chemolithoautotrophic bacteria
(Nitrosomonas, Nitrobacter), yang mampu memenuhi kebutuhan karbonnya
Tabel 1. Laju nitrifikasi beberapa bakteri nitrifikasi autotrof dan heterotrof.
Bacillus sp. merupakan salah satu bakteri heterotrof yang memiliki
kemampuan dalam proses nitrifikasi dan denitrifikasi. Peningkatan produksi biomassa bakteri heterotrof 40 kali lebih besar dibandingkan biomassa yang dihasilkan dalam proses nitrifikasi bakteri autotrof (0,20 g) (Ebeling et al. 2006).
Menurut Woon (2007) pertumbuhan bakteri heterotrof mempengaruhi jumlah nitrogen dalam perairan melalui 3 hal yaitu: (1) proses asimilasi nitrogen menjadi sel; (2) diasimilasi nitrogen melalui proses respirasi; (3) denitrifikasi nitrit dan nitrat.
Hambatan utama dalam produksi probiotik komersial adalah retensi yang tinggi terhadap kelangsungan hidup bakteri selama persiapan dan penyimpanan Sebagian probiotik yang berhasil dipasarkan biasanya hanya kuat di alam. Budaya probiotik dalam bentuk cair/beku memerlukan pendinginan untuk penyimpanan dan distribusi, sehingga dapat menambah biaya untuk usaha budidaya ikan (Wang
et al. 2008). Untuk itu diperlukan probiotik yang dapat lebih tahan lama dan lebih
mudah dalam penyimpanan. Hong et al. (2005) menyatakan bahwa Bacillus sp.
banyak digunakan dalam bentuk spora sehingga dapat disimpan tanpa batas waktu.
Earl et al. (2008) menyatakan bahwa Bacillus sp. mempunyai adaptasi yang
luas untuk tumbuh dalam beragam biosfer. Bacillus sp. dapat membentuk
endospora aktif yang sangat tahan dalam menghadapi kekurangan nutrisi dan tekanan lingkungan lainnya. Menurut
Bacillus sp. umumnya digunakan untuk akuakultur, pakan hewan darat,
dan konsumsi manusia dalam bakterioterapi gangguan pencernaan dengan cara berasosiasi dengan makanan inang untuk masuk ke dalam saluran pencernaan (Nguyen et al. 2006). Penggunaan probotik yang mengandung Bacillus sp. juga
terbukti dapat meningkatkan pertumbuhan (berat badan) dari benih C. Carpio
(Sharma dan Bhukhar 2000) dan larva seabream (Avella et al. 2010).
Errington (2003), spora dapat bertahan hidup pada suhu tinggi (sampai 100°C), pelarut kimia, deterjen dan enzim hidrolitik serta efisien membunuh bakteri lainnya. Spora bisa tetap aktif untuk periode waktu yang lama, bahkan jutaan tahun. Dawes dan Mandelstam (1970) juga menjelaskan frekuensi sporulasi tertinggi pada Bacillus subtilis terjadi pada
sedangkan pembatasan sitrat, triptofan, Mg2+ atau ion fosfat menyebabkan kejadian pembentukan spora yang jauh lebih rendah (sekitar 1% atau kurang
Bacillus sp. merupakan bakteri yang berbentuk batang dapat dijumpai di
tanah dan air termasuk pada air laut. Beberapa jenis dapat menghasil enzim ekstraseluler yang dapat menghidrolisis protein dan polisakarida kompleks.
Bacillus sp. merupakan gram positif, bergerak dengan adanya flagel peritrikus,
dapat bersifat aerobik atau fakultatif anaerobik, bersifat katalase positif, dapat mencairkan gelatin, menghidrolisis pati, menghidrolisis kasein dan menfermentasi gula, sedangkan reaksi oksidase dan uji indole negatif (Madigan et al. 1997;Yang et al. 2010).
).
Nitrogen merupakan bahan yang dibutuhkan oleh bakteri terutama untuk proses sintesis asam amino dan nukleotida. Sumber nitrogen dapat berasal dari sumber organik dan anorganik. Sumber bahan organik yang biasanya diperoleh oleh bakteri dalam sistem budidaya adalah sisa pakan dan hasil metabolit organisme budidaya. Protein yang terdapat dalam sisa pakan akan didekomposisi oleh bakteri menggunakan enzim protease menjadi asam amino yang akhirnya diasimilasi ke dalam sel bakteri. Bakteri mampu memanfaatkan nitrogen dalam bentuk NH4+ dan NH3. Kecenderungan terjadinya pengurangan TAN yang berimplikasi juga pada pengurangan amonia disertai dengan peningkatan jumlah biomassa bakteri memberikan peluang terjadinya bioremediasi lingkungan dan penyediaan sumber nutrien alternatif untuk organisme budidaya (Sukenda et al.
2006).
Kim et al. (2005) menyatakan bahwa Bacillus sp. merupakan bakteri
heterorofik yang berperan dalam proses nitrifikasi dan denitrifikasi dengan jalur yang lebih sederhana dibandingkan bakteri autotrof, sehingga lebih efisien dan menguntungkan secara ekonomi. B.cereus, B. subtilis dan B. licheniformis dapat
menggunakan nitrogen dalam kondisi aerob melalui nitrifikasi. Pada saat nitrifikasi terjadi, produk nitrat mulai terakumulasi dan terjadi juga proses denitrifikasi secara simultan yang menghasilkan gas N2 tanpa adanya peralihan ke bentuk nitrit. Konversi ini merupakan perubahan bentuk amonia menjadi N2 dalam kondisi aerobik. Penelitian yang dilakukan oleh Yang et al. (2010)
memperkuat kenyataan bahwa Bacillus subtilis menunjukkan kemampuan untuk
mengubah NH4 menjadi biomassa (12,3%) dan sebagian lagi dikonversi menjadi produk nitirifikasi berupa NO2, NO3 dan N2.
Hoffmann (1997) dan Hong et al. (2005) menyatakan dalam kondisi yang
tepat Bacillus sp. mampu memanfaatkan nitrat atau nitrit sebagai akseptor
elektron atau dengan fermentasi dengan tidak adanya elektron akseptor. Menurut Marazioti et al. (2003), campuran bakteri Pseudomonas denitrificans dan Bacillus subtilis dapat melakukan proses denitrifikasi dalam kondisi anaerob dalam media
sintetis.
Namun, B. subtilis juga rentan
terhadap beban amonium tinggi. Pada konsentrasi lebih tinggi dari 536,21 mg /l,
B. subtilis tidak mampu secara efisien mengubah substrat.
B. subtilis dapat mereduksi nitrat dalam kondisi anaerobik. Nitrat dikonsumsi seluruhnya oleh bakteri dan menghasilkan sejumlah nitrit sebagai produk setengah jadi. Pertumbuhan bakteri juga dibatasi oleh konsentrasi nitrit, di mana dalam kondisi nitrit terbatas, nitrit dikonsumsi seluruhnya oleh bakteri. Pertumbuhan tidak terjadi lagi setelah nitrit dalam media habis digunakan. Kalkowski dan Conrad (1991) juga mengungkapkan bahwa Bacillus cereus juga
Pertumbuhan bakteri dibatasi oleh konsentrasi glukosa. Penambahan sumber karbon dapat meningkatkan denitrifikasi aerob oleh B. subtilis sekitar 30%.
Pertumbuhan B. subtilis akan berhenti setelah glukosa dalam media telah habis digunakan (Marazioti et al. 2003). Sukenda et a.l (2006) menambahkan
pertumbuhan bakteri mungkin dibatasi oleh ketidakseimbangan nutrisi dalam air budidaya karena dinamika pertumbuhan bakteri hidup terkait dengan kuantitas nutrisi yang tersedia. Ketika tingkat nutrisi tidak memadai dalam air budidaya, maka harus pertumbuhan bakteri probiotik akan terganggu. Secara umum, peningkatan jumlah biomassa bakteri dalam sistem budidaya dapat dilakukan dengan pemberian bahan berkarbon.Walapun begitu, pemberian probiotik saja dalam sistem budidaya juga berpotensi meningkatkan biomassa bakteri di perairan. Peningkatan tersebut diperoleh selain dari penambahan massa bakteri probion juga diduga akibat reaksi yang timbul antara bakteri probion dengan bakteri asli perairan di media budidaya. Liu dan Han (2004) juga menyatakan penambahan glukosa dan atau fosfat pada media kultur B. subtilis secara
signifikan mempengaruhi pengurangan TAN. Sedangkan penelitian Kim et al.
(2005) menunjukkan bahwa penambahan ion logam Mg2+, Fe 2+ dan Ca2+ dapat meningkatkan pertumbuhan Bacillus sp. dan meningkatkan pengurangan NH
Yan et al. (2006) menyatakan Bacillus sp. LY bisa memanfaatkan karbon
organik sebagai sumber asimilasi ketika itu ditumbuhkan pada glukosa dan amonium klorida. Setelah 24 hari inkubasi, efisiensi penghapusan TAN oleh
Bacillus sp. LY sebesar 71,7%. Perubahan konsentrasi TAN selama tiga hari awal
mencerminkan asimilasi ke dalam biomassa untuk batas tertentu, namun setelah inkubasi 3 hari, dengan penurunan kuantitas biomassa (tercermin nilai OD600), efek asimilasi pada penghapusan amonium dapat diabaikan, sehingga penghapusan nitrogen amonia sebagian besar disebabkan nitrifikasi. T
4.
idak adanya akumulasi produk nitrifikasi yang jelas menunjukkan adanya kemampuan denitrifikasi pada kondisi aerob oleh Bacillussp. LY
Hasil penelitian
.
Lalloo et al. (2007) menunjukkan efek sinergis positif dari Bacillus sp. dalam peningkatan kualitas air. Bakteri yang berasal dari genus Bacillus terbukti mampu menurunkan konsentrasi ion amonia, nitrit dan nitrat
dalam media synthetic pond water maupun dalam akuarium ikan mas. Bacillus
subtilis yang ditemukan dalam penelitian Lalloo et al. (2007) menunjukkan
kemampuannya dalam menurunkan konsentrasi amonia yang lebih cepat dari konsentrasi nitrit, sedangkan Bacillus lichineformis mampu menurunkan
konsentrasi ion nitrit lebih cepat daripada amonia sehingga dapat mencegah akumulasi nitrit.
Pemanfaatan Produk Nitrogen oleh Bakteri
Menurut Madigan et al. (1997), perubahan amonia menjadi nitrit (nitrifikasi)
berlangsung dalam dua langkah, yaitu :
1. Langkah pertama menghasilkan produk antara hidroksilamin.
Reaksi ini dikatalis oleh enzim amonia monooksigenase (AMO) 2. Langkah kedua menghasilkan nitrit hidroksilamin
Reaksi ini dikatalis oleh enzim hiroksilamina oksidoreduktase (HAO). Oksidasi satu gram amonia membebaskan energi sebesar 66 kilokalori. Sedangkan perubahan nitrit menjadi nitrat dikatalis oleh enzim nitrit oksidase (NO). Oksidasi dari satu gram nitrit membebaskan energi sebesar 18 kilokalori.
Sedangkan pada proses denitrifikasi, bakteri akan mereduksi senyawa nitrat menjadi nitrit, nitrit oksida (NO), nitrous oksida N2O) dan dinitrogen (N2
Nitrat dan nitrit berperan sebagai akseptor elektron dalam respirasi rantai transport elektron dengan cara yang sama seperti oksigen. Rantai transport ini menjadi mekanisme dasar di mana sel menghasilkan energi. Prosesnya meliputi transfer elektron dari donor elektron tereduksi (substrat organik) kepada akseptor elektron teroksidasi (oksigen, nitrit, nitrat dan sulfat). Nitrit dan nitrat dapat menggantikan oksigen dalam rantai ini dengan hanya modifikasi kecil terhadap sistem metabolik enzim bakteri (EPA 1993). Senyawa nitrat dalam kolam banyak digunakan oleh bakteri heterotrof untuk membentuk bahan organik sel. Kelompok tersebut dapat melakukan asimilasi nitrat dengan bantuan enzim nitrat dan nitrit reduktase pada kondisi aerobik. Sedangkan pada kondisi anaerobik, ion nitrit dan nitrat akan digunakan sebagai penerima elektron terakhir pada respirasi nitrat atau dismilasi nitrat (Madigan et al. 1997).
) dengan bantuan sistem enzim nitrat dan nitrit reduktase. Masing-masing enzim mempunyai sensitivitas terhadap oksigen yang berbeda (Atlas dan Bartha 1998). Menurut Richardson dan Watmough (1999), enzim-enzim yang berperan dalam aktivitas denitrifikasi adalah nitrat reduktase/NAR (mengubah nitrat menjadi nitrit), nitrit reduktase/NIR (mengubah nitrit menjadi nitrit oksida), nitrit oksidoreduktase/NOR (mengubah nitrit oksida menjadi nitrous oksida) dan nitrous oksidoreduktase/NOS (mengubah nitrous oksida menjadi gas nitrogen). Song et al. (2011) berhasil membuktikan bahwa bakteri dari jenis Bacillus sp.
memiliki gen penyandi enzim nitrit reduktase sehingga mampu untuk mereduksi nitrit di lingkungannya.
Mikroba memanfaatkan nitrogen anorganik dan nitrogen organik untuk pertumbuhan sel dan multiplikasi. Menurut Ebeling et al. (2006), amonia oleh
bakteri heterotrof disintesis menjadi protein, dengan penambahan senyawa karbon organik (seperti gula, molase, tepung terigu). Reaksi oksidasi amonia pada bakteri heterotrof adalah sebagai berikut:
NH4+ + 1,18C6H12O6 + HCO3- + 2,06O2 → C5H7O2N (biomassa) + 6,06H2O + 3,07CO2
Bakteri heterotrof menunjukkan kebutuhan oksigen sedikit lebih besar, memproduksi CO2
Menurut Liu dan Han (2004) B. subtilis memiliki kemampuan tinggi untuk
meremediasi limbah dari bakteri yang ada sebelumnya. Proses remediasi limbah oleh B subtilis ditampilkan dalam dua tahap berurutan yaitu degradasi nitrogen
organik terlarut dan pengurangan nitrogen anorganik terlarut. B
lebih besar (75%) serta membutuhkan alkalinitas yang lebih rendah dibandingkan bakteri autotrof (Ebeling et al. 2006).
asam dapat merangsang pertumbuhan populasi bakteri.
Detsch dan lke (2003) menjelaskan amonium merupakan salah satu sumber utama nitrogen untuk bakteri. Pada konsentrasi amonium tinggi, sebagian besar dari amonium hadir sebagai amonia, yang dapat masuk ke dalam sel melalui difusi. Asimilasi amonium dapat diatur pada berbagai tingkat, yaitu ekspresi dari gen yang sesuai dan kegiatan enzim.Dalam penelitian Detsch dan lke (2003) telah ditemukan dua protein yang dikodekan sebagai gen Nrg A dan Nrg B yang diperlukan untuk transportasi dan pemanfaatan amonium pada Bacillus subtilis.
Ketika nitrogen organik terlarut telah menipis atau habis, amonium akan diasimilasi oleh Bacillus sp.
Ogawa et al. (1994) menyatakan Bacillus subtilis dapat menggunakan
METODOLOGI
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Kelautan Institut Pertanian Bogor mulai bulan Juni-Desember 2012.
Bahan
Untuk mengisolasi bakteri digunakan bahan-bahan antara lain: alkohol analis 50%, media TSA, TSB, larutan fisiologis, antibiotik polimiksin B dan streptomisin. Untuk menganalisa kemampuan bakteri dalam proses nitrifikasi dan denitrifikasi digunakan dengan bahan-bahan sebagai berikut:
1. Media basal heterotrof untuk nitrifikasi terdiri dari: K2HPO4.3H2O; KH2PO4; MgCl2.6H2O; NaHCO3; Fe Cl3.6H2O; CaCl2.2H2O; NH4
2. Media basal untuk denitrifikasi terdiri dari: Na asetat, KNO
Cl; EDTA; Glukosa; Aquades (Widiyanto 2005).
3, (NH4)2SO4, K2HPO4.3H2O MgSO4.7H2O, KH2PO4, CaCl2.2H2
3. Synthetic pond water terdiri dari: KNO
O dan ekstrak ragi (Widiyanto 2005)
3; NaNO2; (NH4) 2SO4; H3PO4 Sedangkan bahan untuk analisa amonia, nitrit, nitrat adalah MnSO
; ekstrak ragi; glukosa (Lalloo et al. 2007)
4, clorox, sulfanilamide, brucine dan H2SO4 pekat. Untuk uji coba in vivo digunakan ikan lele dan mas berukuran 4-5 cm dan air bekas pemeliharaan ikan lele dengan kadar total amonia nitrogen 6,12 mg/l TAN.
Alat
Alat-alat yang digunakan dalam penelitian ini antara lain: mikroskop, spektrofotometer, sentrifuse, oven, inkubator, vortex, shaker, mikropipet, cawan petri, botol kaca ukuran 1,5 liter, akuarium dan aerator.
Prosedur Analisa data
Pengambilan Sampel Air, Akar Tanaman Air dan Sedimen
Isolasi dan Seleksi Bakteri Bacillus sp.
Isolasi dan seleksi bakteri dari genus Bacillus dilakukan berdasarkan
penelitian oleh Lalloo et al. (2007). Setiap sampel sebanyak 1 g disuspensikan ke
dalam 3 ml larutan NaCl (0,9%), kemudian dimasukkan ke dalam tabung reaksi yang berisi media TSB sebanyak 9 ml dan diinkubasi selama 24 jam pada suhu 300C, diikuti dengan inkubasi pada 450C selama 10 menit dalam oven untuk mengaktifkan proses sporulasi. Etanol (50%) ditambahkan sebanyak 20 ml pada setiap sampel,diinkubasi pada suhu 200C selama 1 jam, kemudian disentrifugasi pada 10.000 rpm, supernatan dituang dan pelet yang dihasilkan diinkubasi pada suhu 1050C dalam oven selama 5 menit. Pelet kering dilarutkan dalam 20 ml larutan garam fisiologis steril dan diencerkan secara serial sampai 10-4 dengan kenaikan secara bertahap 10-1. Sebanyak 0,1 ml dari setiap seri pengenceran disebar dalam cawan petri yang berisi TSA yang diberi polimiksin B (5 mg/l). Biakan tersebut kemudian diinkubasi selama 24 jam pada suhu 300C. Koloni tunggal yang terisolasi dari cawan dimurnikan dan dilakukan pewarnaan Gram
dan spora untuk selanjutnya dilakukan seleksi bakteri dalam media basal heterotrof untuk nitrifikasi dan media basal denitrifikasi.
Seleksi Bakteri dalam Media Basal Heterotof untuk Nitrifikasi dan Media Basal untuk Denitrifikasi
Untuk mengetahui kemampuan isolat bakteri dalam proses nitrifikasi maka dilakukan pengujian isolat dalam media basal heterotrof (glukosa sebagai sumber karbon) dengan amonia sebagai satu-satunya sumber nitrogen (Lampiran 1). Isolat-isolat bakteri yang diperoleh ditumbuhkan dalam 20 ml media pada erlenmeyer bervolume 100 ml, kemudian diinkubasi selama 3 hari di dalam shaker pada suhu 280C dengan kecepatan 130 rpm sebagai inokulan isolat uji. Masing-masing inokulan isolat uji diambil sebanyak 2 ml dan diinokulasikan ke dalam 50 ml media basal heterotrof untuk nitrifikasi pada erlenmeyer volume 250 ml dengan konsentrasi amonia nitrogen sekitar 130 mg/l. Inkubasi dilakukan selama 7 hari pada suhu 280
Untuk menyeleksi kemampuan bakteri dalam proses denitrifikasi, maka dilakukan pengujian isolat dalam media basal untuk denitifikasi dengan kalium nitrat sebagai sumber nitrogen (Lampiran 1). Isolat bakteri yang diperoleh ditumbuhkan pada 20 ml media dalam erlenmeyer bervolume 100 ml, kemudian diinkubasikan selama 5 hari di dalam shaker pada suhu 28
C di atas shaker dengan kecepatan 130 rpm. Pengukuran konsentrasi total amonia nitrogen (TAN), nitrit dan nitrat dan populasi bakteri dilakukan setiap 2 hari yaitu pada hari ke 0, 2, 4 dan 6. Sebagai kontrol digunakan media yang tidak dinokulasi isolat bakteri.
Uji Aktivitas Nitrifikasi dan Denitrifikasi Isolat Terpilih secara in Vitro pada Synthetic Pond Water
Isolat bakteri terpilih dengan kemampuan nitrifikasi dan denitrifikasi tertinggi selanjutnya diuji pada synthetic pond water (Lalloo et al. 2007).
Komposisi synthetic pond water dapat dilihat pada Lampiran 2. Air yang
digunakan adalah akuades yang telah disterilkan dan pH dipertahankan pada kisaran 7. Isolat-isolat bakteri terpilih pada tahap sebelumnya, ditumbuhkan dalam 20 ml synthetic pond water pada erlenmeyer bervolume 100 ml, kemudian
diinkubasi selama 3 hari di dalam shaker pada suhu 280C dengan kecepatan 130 rpm sebagai inokulan isolat uji. Masing-masing inokulan isolat uji diambil sebanyak 2 ml dan diinokulasikan ke dalam 50 ml synthetic pond water pada
erlenmeyer volume 250 ml kemudian diinkubasi suhu pada 300
Setelah itu setiap erlenmeyer yang berisi isolat bakteri diambil secara aseptik untuk dilakukan pengukuran pertumbuhan bakteri, konsentrasi TAN, nitrit dan nitrat. Pengukuran dilakukan sebelum inokulasi dan setelah inokulasi setiap hari sampai fase pertumbuhan stasioner tercapai. Laju pertumbuhan bakteri ditentukan dengan metode hitungan cawan. Media yang digunakan untuk hitungan cawan adalah media TSA yang telah diberi polimiksin B (5 mg/l TSA). Tingkat penurunan konsentrasi amonia, nitrat dan nitrit oleh masing-masing isolat dalam synthetic pond water ditentukan dari plot konsentrasi senyawa-senyawa tersebut
terhadap waktu. Isolat yang menunjukkan penurunan konsentrasi TAN, nitrit dan nitrat tertinggi akan digunakan selanjutnya dalam uji in vivo. Isolat bakteri terpilih
selanjutnya diidentifikasi dengan KIT API 20E dan API 50CHB untuk penentuan spesiesnya.
C pada shaker dengan kecepatan 130 rpm.
Uji Kemampuan Isolat Terpilih secara In Vivo
Isolat terpilih pada uji vitro diuji secara in vivo untuk mengetahui
kemampuan bakteri dalam menurunkan konsentrasi total amonia nitrogen (TAN), nitrat dan nitrit pada media pemeliharaan ikan. Percobaan dilakukan di akuarium kaca berukuran 60 x 30 x 30 cm yang berisi 30 liter air dengan ketinggian air 20 cm. Ikan yang digunakan adalah benih ikan lele dan mas berukuran 4-5 cm. Air yang digunakan adalah air kolam bekas pemeliharaan lele yang diberi pelet sampai kadar TAN melebihi ambang batas toleransi ikan (6,12 mg/l TAN). Percobaan ini terdiri dari dua perlakuan dan dua kontrol. Kontrol masing- masing berisi 30 ekor ikan mas dan 30 ekor ikan lele sebanyak 3 ulangan tanpa penambahan bakteri probiotik. Sedangkan perlakuan masing-masing berisi 30 ekor ikan mas dan 30 ekor ikan lele sebanyak 3 ulangan dengan penambahan bakteri probiotik (109 cfu/ml) sebanyak 3 ml per akuarium. Pemberian pakan dilakukan 2 kali sehari (secara ad satiation). Ikan dipelihara dengan sistem tidak
ganti air (zero water exchange). Sampel air diambil setiap hari sekali untuk
Parameter yang Diamati
Kemampuan Isolat Bakteri dalam Proses Nitrifikasi
Parameter yang diukur adalah parameter kualitas air meliputi konsentrasi senyawa TAN, nitrit dan nitrat. Persentase konsentrasi TAN yang teroksidasi dan senyawa nitrit dan nitrat yang terbentuk dapat dihitung dengan rumus di bawah ini (Widiyanto 2005) :
Keterangan:
AO : Persentase konsentrasi TAN yang teroksidasi AK : Konsentrasi TAN pada media kontrol
AP : Konsentrasi TAN pada media yang diinokulasi bakteri
Konsentrasi nitrat atau nitrit yang terbentuk adalah konsentrasi nitrat atau nitrit pada suspensi perlakuan dikurangi konsentrasi nitrit atau nitrat yang yang terdapat pada suspensi kontrol. Persentase konsentrasi nitrat yang terbentuk (PNT) atau persentase nitrit yang terbentuk (PNI) dihitung dengan rumus berikut :
Keterangan :
PNT : Persentase konsentrasi nitrat yang terbentuk
NTP : Konsentrasi nitrat pada suspensi perlakuan (diinokulasi bakteri) NTK :Konsentrasi nitrat pada kontrol
AK : Konsentrasi TAN pada media kontrol
AP : Konsentrasi TAN pada media yang diinokulasi bakteri
Sedangkan konsentrasi nitrit yang terbentuk dihitung dengan rumus :
Keterangan :
PNI : Persentase konsentrasi nitrit yang terbentuk
NIP : Konsentrasi nitrit pada suspense perlakuan (diinokulasi bakteri) NIK : Konsentrasi nitrit pada kontrol
AK : Konsentrasi TAN pada media kontrol
AP : Konsentrasi TAN pada media yang diinokulasi bakteri Kemampuan Isolat Bakteri dalam Proses Denitrifikasi
Persentase konsentrasi nitrit yang terbentuk dihitung dengan rumus sebagai berikut :
Persentase konsentrasi gas nitrogen yang terbentuk dihitung dengan rumus sebagai berikut :
Kualitas Air
Parameter kualitas air yang termasuk parameter fisika dan kimia yaitu suhu (thermometer), TAN (metode phenate), nitrit (metode sulfanilamide) dan nitrat (metode brusin), pH (pH meter), oksigen terlarut (DO meter) dan kesadahan diukur setiap hari. Prosedur kerja pengukuran parameter disajikan pada Lampiran 2.
Uji Statistik
HASIL DAN PEMBAHASAN
Hasil
Kondisi Kolam Tempat Pengambilan Contoh Air dan Sedimen
Secara umum keadaan parameter fisika dan kimia kualitas air pada kolam pengambilan sampel air dan sedimen cukup baik. Parameter kualitas air seperti pH, oksigen terlarut, konsentrasi amonia, nitrit dan nitrat pada kolam kondisinya masih relatif baik untuk pertumbuhan budidaya ikan lele. Nilai pH dari kolam pengambilan sampel berkisar antara 7-7,4, oksigen terlarut antara 5,0 – 5,5 mg/l, konsentrasi amonia tidak terionisasi antara 0,05 – 0,15 mg/l, konsentrasi nitrit antara 0,01 – 0,06 mg/l dan konsentrasi nitrat antara 0,81 – 1,35 mg/l. Nilai parameter tersebut masih dapat dianggap layak dalam budidaya perikanan. Gambaran fisik dan pola budidaya kolam dapat dilihat pada Lampiran 4 dan 5.
Isolasi dan Karakterisasi Bakteri
Dari sampel air, akar tanaman air dan sedimen yang diperiksa, hanya pada sampel sedimen diperoleh tujuh isolat yang diduga merupakan jenis bakteri
Bacillus sp. pendegradasi amonia, nitrit dan nitrat. Isolat yang telah berhasil
diseleksi dimurnikan kembali dengan metoda cawan gores kuadran untuk mendapatkan biakan murni bakteri. Morfologi sel dan koloni bakteri hasil isolasi dapat dilihat pada Tabel 2.
Tabel 2 Morfologi koloni dan sel isolat bakteri hasil isolasi dari kolam ikan air tawar
No Kode Isolat
Kenampakan Koloni Bentuk
sel
1 S1 bulat, diameter 2 mm, tepian tidak beraturan, krem batang panjang
2 S2 bulat, diameter 1 mm, tepian rata, oranye bening batang pendek
3 S3 bulat, diameter 1.5 mm, tepian rata, putih bening
transparan
batang panjang
4 S4 bulat, diameter 3,5 mm, tepian rata, krem bulat
5 S5 bulat, diameter 1 mm, tepian rata, krem tua, berinti batang pendek
6 S6 bulat, diameter 1,5 mm, tepian rata, putih bening batang pendek
7 S7 bulat, diameter 1,5 mm, tepian rata, putih susu batang panjang
Seleksi Aktivitas Bakteri dalam Media Basal Heterotrof untuk Nitrifikasi
Setelah dikultur dalam media basal heterotrof untuk nitrifikasi, terlihat bahwa semua isolat dapat memanfaatkan TAN (total amonia nitrogen) untuk aktivitas metabolismenya, baik sebagai sumber energi maupun sebagai sumber nitrogen untuk pembentukan biomassa sel. Hal ini dapat terlihat dari penurunan konsentrasi TAN pada media nitrifikasi menjadi nitrit, nitrat dan peningkatan biomassa bakteri.
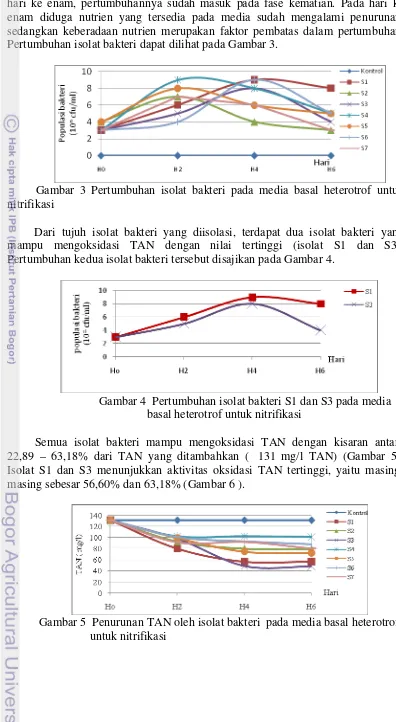
hari ke enam, pertumbuhannya sudah masuk pada fase kematian. Pada hari ke enam diduga nutrien yang tersedia pada media sudah mengalami penurunan, sedangkan keberadaan nutrien merupakan faktor pembatas dalam pertumbuhan. Pertumbuhan isolat bakteri dapat dilihat pada Gambar 3.
Gambar 3 Pertumbuhan isolat bakteri pada media basal heterotrof untuk nitrifikasi
Dari tujuh isolat bakteri yang diisolasi, terdapat dua isolat bakteri yang mampu mengoksidasi TAN dengan nilai tertinggi (isolat S1 dan S3). Pertumbuhan kedua isolat bakteri tersebut disajikan pada Gambar 4.
Gambar 4 Pertumbuhan isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
Semua isolat bakteri mampu mengoksidasi TAN dengan kisaran antara 22,89 – 63,18% dari TAN yang ditambahkan ( 131 mg/l TAN) (Gambar 5). Isolat S1 dan S3 menunjukkan aktivitas oksidasi TAN tertinggi, yaitu masing-masing sebesar 56,60% dan 63,18% (Gambar 6 ).
Gambar 6 Penurunan TAN oleh isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
TAN yang dioksidasi oleh isolat bakteri diubah menjadi senyawa nitrit dan nitrat (Gambar 7 dan 8) dan kemungkinan ada juga yang dikonversi menjadi gas nitrogen. Nitrit yang dihasilkan oleh semua isolat berkisar antara 0,016 – 0,209 mg/l. Nitrat yang dihasilkan berkisar antara 10,22-57,15 mg/l. Nitrit dan nitrat yang dihasilkan oleh isolat S1 dan S3 disajikan pada Gambar 9 dan 10.
Gambar 7 Nitrit yang dihasilkan oleh isolat bakteri pada media basal heterotrof untuk nitrifikasi
Gambar 9 Nitrit yang dihasilkan oleh isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
Gambar 10 Nitrat yang dihasilkan oleh isolat bakteri S1 dan S3 pada media basal heterotrof untuk nitrifikasi
Seleksi Aktivitas Bakteri dalam Media Denitrifikasi
Hampir semua isolat bakteri yang dikultur dalam media basal untuk denitrifikasi dapat mereduksi nitrat. Hal ini menunjukkan bahwa isolat- isolat bakteri yang terseleksi tersebut selain dapat mengoksidasi amonia juga mampu mereduksi senyawa nitrat dalam aktivitas metabolismenya. Pertumbuhan isolat bakteri dapat dilihat pada Gambar 11, sedangkan pertumbuhan isolat bakteri dengan reduksi nitrat tertinggi (isolat S1 dan S3) disajikan pada Gambar 12.
Gambar 12 Pola pertumbuhan isolat bakteri S1 dan S3 pada media basal untuk denitrifikasi
Kemampuan isolat bakteri dalam mereduksi senyawa nitrat berkisar antara 0,11-40,97% (Gambar 13) dari nitrat yang ditambahkan ke dalam media (530 mg/l nitrat). Isolat S1 dan S3 selain dapat mengoksidasi amonia, ternyata juga mampu mereduksi nitrat masing-masing sebesar 40,97% dan 26,51% (Gambar 14).
Gambar 13 Penurunan nitrat pada isolat bakteri pada media basal untuk denitrifikasi
Gambar 14 Penurunan nitrat oleh isolat bakteri S1 dan S3 pada media Basal untuk denitrifikasi
Gambar 15 Nitrit yang dihasilkan oleh isolat bakteri pada media basal untuk denitrifikasi
Gambar 16 Nitrit yang dihasilkan oleh isolat bakteri S1 dan S3 pada media basal untuk denitrifikasi
Selain mengkoversi nitrat menjadi nitrit dan biomassa, isolat bakteri juga memproduksi gas N2 (Tabel 3). Produksi gas N2 ini membuktikan bahwa isolat terlibat dalam proses denitrifikasi aerobik seperti yang telah dikemukakan oleh Kim et al. (2005).
Tabel 3 Kemampuan isolat bakteri dalam mereduksi nitrat serta nitrit dan gas N2 yang dihasilkan selama inkubasi 16 hari
No Kode Isolat
Nitrat tereduksi NitritTerbentuk TAN Terbentuk
Gas nitrogen Terbentuk
mg/L % mg/L % mg/L mg/L %
1 S1 21.65 40.97 0.87 0.40 0 216.26 99.60
2 S2 1.20 1.57 2.67 8.04 0 5.66 67.95
3 S3 10.72 26.51 0.55 0.29 1.53 138.43 98.52
4 S4 1.33 2.93 1.42 9.16 0 14.09 90.84
5 S5 6.50 22.12 4.74 4.04 1.99 110.53 94.26
6 S6 0.18 0.11 0.03 5.26 0 0.54 94.74
7 S7 10.07 15.97 8.39 9.91 2.43 73.82 87.22 Identifikasi Bakteri S1 dan S3
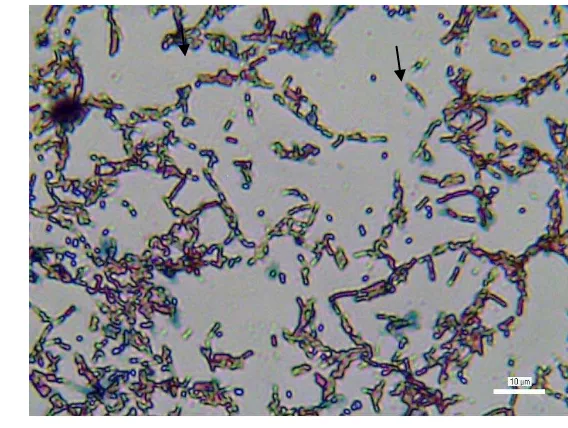
Bakteri S1 dan S3 yang telah diseleksi dan diuji secara in vitro
merupakan bakteri gram positif dan menghasilkan spora. Hasil pewarnaan spora pada isolat S1 memperlihatkan letak spora berada di tengah (sentral) atau parasentral, sedangkan pada S3 letak spora berada di bagian ujung (terminal) sel. Identifikasi dengan menggunakan KIT API ini menunjukkan bakteri S1 adalah
Bacillus cereus, sedangkan bakteri S3 diidentifikasi sebagai Bacillus subtilis.
Hasil identifikasi bakteri dapat dilihat pada Lampiran 14.
Gambar 17 Pewarnaan spora isolat S1 (Bacillus cereus)
Gambar 18 Pewarnaan spora isolat S3 (Bacillus subtilis)
Seleksi Aktivitas Nitrifikasi dan Denitrifikasi Bakteri dalam Synthetic Pond Water
Percobaan ini terdiri tiga perlakuan yaitu media synthetic pond water yang
masing-masing diinokulasikan oleh bakteri S1 (Bacillus cereus), S3 (Bacillus subtilis) dan campuran S1 (Bacillus cereus) dan S3 (Bacillus subtilis).
pada saat dikultur dalam media basal untuk nitrifikasi dan denitrifikasi. Hal ini disebabkan nutrien yang terdapat pada synthetic pond water tidak sebanyak pada
media basal untuk nitrifikasi dan denitrifikasi.
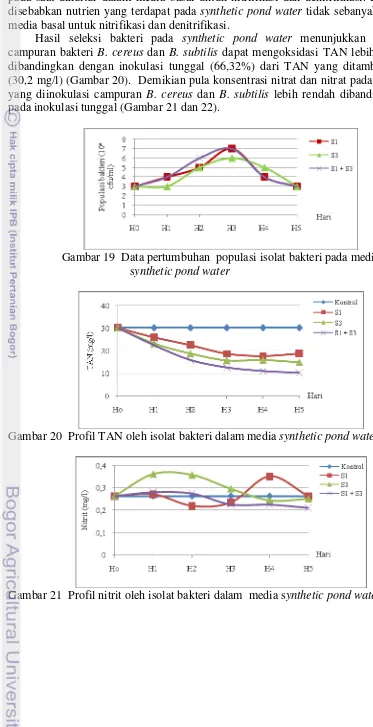
Hasil seleksi bakteri pada synthetic pond water menunjukkan bahwa
campuran bakteri B. cereus dan B. subtilis dapat mengoksidasi TAN lebih besar
dibandingkan dengan inokulasi tunggal (66,32%) dari TAN yang ditambahkan (30,2 mg/l) (Gambar 20). Demikian pula konsentrasi nitrat dan nitrat pada media yang diinokulasi campuran B. cereus dan B. subtilis lebih rendah dibandingkan
pada inokulasi tunggal (Gambar 21 dan 22).
Gambar 19 Data pertumbuhan populasi isolat bakteri pada media synthetic pond water
Gambar 20 Profil TAN oleh isolat bakteri dalam media synthetic pond water
Gambar 22 Profil nitrat oleh isolat bakteri dalam media synthetic pond water
Dari hasil seleksi isolat bakteri pada media synthetic pond water
menunjukkan bahwa campuran bakteri B. cereus dan B. subtilis memiliki
kemampuan tertinggi dalam mengurangi konsentrasi amonia, nitrit dan nitrat sehingga dapat digunakan untuk uji in vivo.
Uji Kemampuan Isolat Terpilih secara In Vivo
Hasil pada uji coba secara in vivo menunjukkan konsentrasi TAN pada
kontrol (tanpa inokulasi bakteri) lebih tinggi dibandingkan perlakuan (dengan inokulasi bakteri) baik pada ikan mas maupun ikan lele (Gambar 23). Hal ini menunjukan bahwa penambahan B. cereus dan B. subtilis ke dalam media dapat
menurunkan konsentrasi TAN.
Gambar 23 Perbandingan konsentrasi TAN antara kontrol dengan perlakuan pada ikan mas dan lele
Gambar 24 Perbandingan konsentrasi nitrit antara kontrol dengan perlakuan pada ikan mas dan lele
Gambar 25 Perbandingan konsentrasi nitrat antara kontrol dengan perlakuan pada ikan mas dan lele
Populasi bakteri selama percobaan in vivo pada perlakuan (ikan mas dan
ikan lele) menunjukkan bakteri mencapai fase stationer pada hari ke dua dan mulai menurun pada hari ke tiga (Gambar 26).
Gambar 26 Pertumbuhan populasi Bacillus cereus dan Bacillus subtilis
pada perlakuan ikan mas dan lele
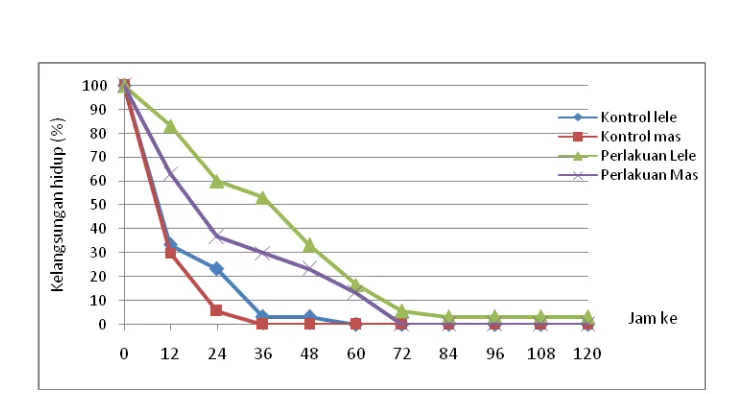
Data kelangsungan hidup ikan menunjukkan bahwa kelangsungan hidup ikan pada perlakuan dengan inokulasi bakteri lebih tinggi dibandingkan kontrol. Sedangkan jika dibandingkan antar jenis ikan, dapat dilihat bahwa kelangsungan hidup ikan lele lebih tinggi dibandingkan ikan mas (Gambar 27).
Gambar 27 Kelangsungan hidup ikan antara kontrol dengan perlakuan pada ikan mas dan lele
Pembahasan
Pengamatan morfologi sel dari ke tujuh isolat bakteri yang telah diseleksi memperlihatkan ciri yang berbeda. Hampir semua isolat berbentuk batang kecuali pada isolat S4. Hasil pewarnaan Gram menunjukkan semua isolat bersifat Gram
positif, hal ini dikarenakan adanya penambahan antibiotik polimiksin B pada media TSA sehingga mampu mengeliminir semua bakteri Gram negatif.
Penambahan etanol analis 50% dan pemanasan pada suhu 1050C dalam tahap seleksi bakteri juga bertujuan untuk membunuh sel vegetatif bakteri dan mengeliminir bakteri yang tidak dapat membentuk spora. Errington (2003) menyatakan s
Menurut Earl et al. (2008), Bacillus sp. adalah spesies bakteri yang
mampu tumbuh dalam berbagai lingkungan dan bersifat saprofitik (Hong et al.
2004). Genus Bacillus dapat membentuk endospora aktif yang sangat tahan dalam
menghadapi kekurangan nutrisi dan tekanan lingkungan lainnya. (Hong et al.
2004 dan Earl et al. 2008).
pora dapat bertahan hidup termasuk tahan terhadap suhu tinggi (bahkan 100°C) dan penambahan alkohol.
Errington (2003) menambahkan s
Setelah dilakukan pengujian kemampuan isolat bakteri dalam media basal heterotrof untuk nitrifikasi, maka diperoleh dua isolat bakteri yaitu B. cereus dan B. subtilis yang dapat mengoksidasi total amonia nitrogen (TAN) dalam jumlah
yang paling tinggi, yaitu masing-masing sebesar 56,60% dan 63,18%. TAN yang dioksidasi oleh isolat bakteri diubah menjadi biomassa bakteri, senyawa nitrit dan nitrat dan kemungkinan ada juga yang dikonversi menjadi gas nitrogen. Isolat bakteri B. cereus dan B. subtilis menghasilkan nilai konsentrasi nitrat yang paling
rendah yaitu masing- masing sebesar 10,22 mg/l dan 17,43 mg/l. Tingginya TAN yang teroksidasi dan rendahnya konsentrasi nitrat pada isolat B. cereus dan B. subtilis disebabkan kedua bakteri tersebut melakukan nitrifikasi dan denitrifikasi
sehingga mampu mengubah TAN menjadi N
pora Bacillus sp. bisa
tetap aktif untuk periode waktu yang lama, bahkan jutaan tahun sehingga sangat cocok digunakan sebagai probiotik karena lebih efisien dan ekonomis (Hong et al.
2004).
2. Hal ini sejalan dengan penelitian Kim et al. (2005) dan Yang et al. (2010) yang menyatakan bahwa Bacillus sp.