KAJIAN INFEKSI BRUCELLA ABORTUS PADA SAPI PERAH MENGGUNAKAN UJI SEROLOGIK DAN
POLYMERASE CHAIN REACTION (PCR)
AMANATIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Kajian Infeksi Brucella abortus
pada sapi perah menggunakan metode Serologik dan Polymerase Chain
Reaction (PCR) adalah karya saya dengan arahan komisi pembimbing dan
belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2012
Amanatin
AMANATIN. Study of Brucella abortus Infection Using Serological Test and
Polymerase Chain Reaction (PCR) in Dairy Cattle. Under Direction of DENNY W.
LUKMAN and SURACHMI SETIYANINGSIH.
Brucellosis is an important zoonotic disease for public and animal health that causes significant economic losses. Widely applied brucellosis detection method are Rose bengal test (RBT) and complement fixation test (CFT) as screening and confirmation tests, respectively. This study was aimed to detect of
Brucella abortus infection using serological and molecular tests, i.e., milk ring test (MRT), RBT, CFT, enzyme linked immunosorbant assay (ELISA), and polymerase chain reaction(PCR). Milk, blood and serum were collected from a total of 64 dairy cattle with history of decreased milk production, vaccination, abortion, hygroma and retentio secundinae. The result showed that 64%, 34%, 45% and 26% samples were positive tested by MRT, RBT, CFT, and ELISA, respectively. The Kappa analysis showed that the confirmation CFT has poor to good agreement of 0.249, 0.511, and 0.710 with MRT, ELISA and RBT, respectively. None of blood and milk samples from serologically positive cattle were tested positive by PCR that could be due to the absence of bacteremia and bacterial shedding in milk. This finding suggests the presence of chronic infection among the studied animals, which characterized by high antibody levels in the absence of bacteria in the blood. Application of MRT and ELISA tests in parallel would increase the test sensitivity, while application of CFT and ELISA test or RBT and CFT in serial would increase the test specificity.
AMANATIN. Kajian Infeksi Brucella abortus pada Sapi Perah Menggunakan Metode Serologik dan Polymerase Chain Reaction (PCR). Di bawah bimbingan DENNY W. LUKMAN and SURACHMI SETYANINGSIH.
Bruselosis merupakan zoonosis penting yang berdampak kepada kesehatan masyarakat dan menyebabkan kerugian ekonomi. Nama lain dari bruselosis adalah undulant fever, Mediterranean fever, Malta fever, keluron,
contagious abortion atau Bang’s disease. Brucella abortus (B. abortus)
merupakan penyebab dari Bovine brucellosis yang mengakibatkan kerugian ekonomi karena abortus, pedet lahir mati/lemah, sterilitas akibat gangguian reproduksi, turunnya produksi susu serta turunnya akses pasar baik skala nasional maupun internasional. Infeksi pada manusia disebabkan oleh konsumsi susu atau keju non-pasteurisasi yang terkontaminasi (foodborne transmission),
terpapar hewan terinfeksi, karkas atau sekresi uterus dan fetus abortus.
Program pengendalian dan pemberantasan memerlukan metode uji yang dapat mendeteksi penyakit secara dini dan akurat. Deteksi dini dengan melihat gejala klinis kurang efektif karena gejala klinis bruselosis tidak patognomonis, sehingga dibutuhkan pengujian laboratorium untuk mendeteksinya. Direktorat Jenderal Peternakan menerapkan kebijakan vaksinasi pada populasi dengan prevalensi di atas 2% sedangkan prevalensi dibawah 2% dengan kebijakan test and slaughter menggunakan metode Rose Bengal test (RBT) dan dikonfirmasi dengan complement fixation test (CFT). RBT merupakan metode yang sederhana, cepat dan praktis. Metode ini membutuhkan konfirmasi dengan CFT karena mempunyai spesifisitasnya rendah. RBT merupakan metode yang sederhana, cepat dan praktis dengan spesifisitas rendah, sedangkan CFT mempunyai spesifisitas tinggi akan tetapi kurang praktis.
Penularan melalui makanan sangat penting karena B. abortus mampu bertahan dalam susu dan produk olahannya dengan waktu yang cukup lama. Bakteri ini mampu bertahan dalam susu UHT, air mineral dan yogurt masing-masing selama 87 hari, 60 hari dan kurang dari 7 hari. Kelompok risiko tertinggi adalah pekerja di rumah potong hewan dan kandang, pemerah susu, dokter hewan, paramedik, inseminator dan analis laboratorium. Brucella. abortus
mempunyai konsentrasi yang tinggi pada plasenta dan fetus yang lahir, oleh karena itu risiko penularan ke pekerja kandang pada saat partus sangat besar.
Tujuan penelitian ini adalah mendeteksi infeksi B. abortus pada kelompok sapi perah dengan metode serologik dan PCR serta penerapannya dengan melihat kesesuaian masing-masing metode. Manfaat penelitian ini adalah memberikan gambaran metode yang dapat diterapkan dalam pelaksanaan tindak karantina hewan di seluruh Unit Pelaksana Teknis dalam lingkup Badan Karantina Pertanian.
Penelitian ini membandingkan metode uji dengan jenis sampel yang berbeda untuk deteksi B. abortus. Sebagai data pendukung dilakukan wawancara dengan dinas dan instansi terkait, pemilik dan penanggung jawab kandang tentang penyebaran, riwayat abortus, penurunan produksi susu dan vaksinasi. Sampel yang diambil sebanyak 64 sapi perah yang berupa darah, serum dan susu. Sampel susu dilakukan uji dengan metode MRT dan PCR, sedangkan serum dilakukan uji dengan metode RBT, ELISA dan CFT. Sampel darah dilakukan uji dengan metode PCR. Data hasil pengujian diolah dan dianalisi dengan nilai Kappa dan analisis deskriptif dengan program software
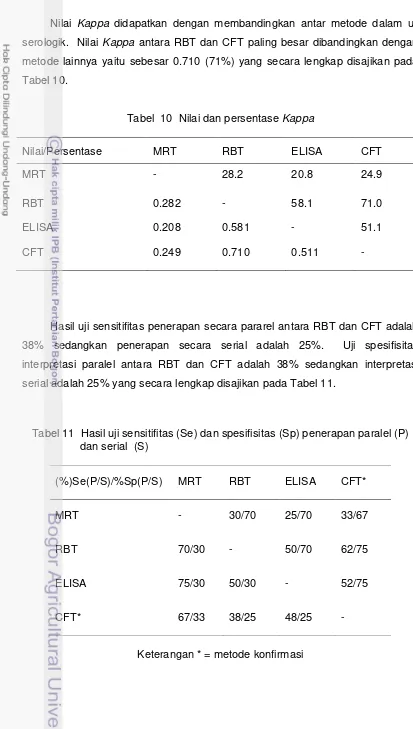
ELISA dan CFT masing-masing sebesar 0.581 dan 0.710, serta antara metode ELISA dengan CFT sebesar 0.511. Metode PCR darah negatif dapat disebabkan karena sapi dalam penelitian ini tidak mengalami bakteremia, sehingga tidak ditemukan adanya bakteri dalam sirkulasi darah. Metode PCR susu tidak terdeteksi, hal ini dimungkinkan bakteri tidak shedding di dalam susu. Sebagai simpulan dalam penelitian ini adalah sampel sapi perah terindikasi infeksi kronis yang ditandai dengan tingginya antibodi namun tidak terdeteksinya bakteri dalam darah. Kesesuain metode RBT dengan CFT baik, ELISA dengan RBT dan CFT sedang, MRT dengan RBT, ELISA dan CFT kurang. Penerapan metode MRT dan ELISA secara pararel akan meningkatkan sensitifitas. Penerapan metode ELISA dan CFT atau RBT dan CFT secara serial akan meningkatkan spesifisitas.
© Hak cipta milik IPB, tahun 2012 Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagain atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
POLYMERASE CHAIN REACTION (PCR)
AMANATIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Amanatin NIM : B251100134
Disetujui Komisi Pembimbing
Diketahui
Tanggal Ujian: Tanggal Lulus: Dr. drh. Denny Widaya Lukman, M.Si.
Ketua
drh. Surachmi Setiyaningsih, Ph.D. Anggota
Ketua Program Studi Kesehatan Masyarakat Veteriner
Dr. drh. Denny Widaya Lukman, M.Si.
Dekan Sekolah Pascasarjana IPB
Kupersembahkan tesis ini kepada:
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmad dan ridha-Nya serta shalawat dan salam kepada Nabi Muhammad saw. sehingga penulis dapat menyelesaikan tesis ini. Tema penelitian ini adalah Kajian Infeksi Brucella abortus pada Sapi Perah Menggunakan Metode Serologik
dan Polymerase Chain Reaction (PCR).
Penghargaan dan terima kasih penulis ucapkan kepada Dr. drh. Denny W. Lukman, MSi dan drh. Surachmi Setiyaningsih, Ph.D. sebagai ketua dan anggota komisi pembimbing, atas segala dukungan, bimbingan dan arahan terhadap penulis selama penelitian dan penulisan tesis. Terima kasih juga disampaikan kepada Prof. Dr. drh. I Wayan T. Wibawan, MS selaku penguji luar komisi. Penulis juga mengucapan terima kasih kepada Kepala Badan Karantina Pertanian dan Dr. drh. Syafril Daulay beserta jajarannya yang telah memberikan beasiswa S-2 dan penelitian sehingga penulis dapat menempuh program studi pascasarjana ini.
Ucapan terima kasih juga disampaikan kepada drh. Chaerul Basri, M.Epid serta pak Agus yang telah membantu kelancaran studi ini. Ucapan terima kasih disampaikan kepada drh. Susan M. Noor, Mphil, drh. Rahmat Setya Adji, M.Si. dan Ibu Sumirah yang telah membantu dalam proses pengujian sampel. Ucapan terima kasih disampaikan kepada drh. Ramilah, Maya Spt, dan pengurus koperasi susu serta peternak yang telah membantu dalam penyedianan sampel sapi perah. Ucapan terima kasih juga disampaikan kepada drh. Sri Yusnowati, drh. Nuryani Zainuddin, M.Si., Krisna Dwiharniati, SSi., M.Si., drh. Arum K, M.Si., drh. Mujiatun, M.Si., drh Desniwati, M.Si., drh. Haeriah, drh. Seruni, Ahmad MA, Amd, Ika Sih dan seluruh rekan-rekan di laboratorium Karantina Hewan BBUSKP serta rekan-rekan sejawat kelas khusus karantina program studi kmv (Wulan, Endah, Fitri, Ijah, Agus, Doni, Ali, Hari, Tika, Ari, Vera, Endang, Helmi dan Gatot) yang telah memberikan dukungan dan semangat.
Akhirnya ucapan terima kasih yang mendalam kepada ayahanda drs. H. Dulaji Alm, ibunda Hj Partun, ibu dan bapak mertua, serta kakak, adik, suami tercinta drh. Heru Setiyanto dan anak-anakku tersayang Sakura, Kayla dan Athaya yang telah memberikan dukungan moral dalam menyelesaikan tesis ini. Atas segala kebaikan yang telah penulis terima, semoga Allah swt berkenan melimpahkan rahmad dan ridha-Nya kepada kita semua. Harapan penulis semoga tulisan ini dapat bermanfaat dalam kegiatan perkarantinaan di Indonesia.
Bogor, Juni 2012
Penulis dilahirkan di Mojokerto pada tanggal 25 Februari 1977 dari ayah Drs. H. Duladji Alm dan ibu Hj. Partun. Penulis merupakan putri kelima dari lima bersaudara.
Tahun 1989 penulis lulus dari Sekolah Dasar Negeri Gunungan I dan tahun 1992 lulus dari Sekolah Menengah Pertama Negeri I Dawarblandong Mojokerto. Tahun 1995 penulis lulus dari Sekolah Menengah Farmasi Sekolah Kesehatan Angkatan Laut Surabaya dan lulus tahun 1995 dari Sekolah Menengah Atas 11 Maret Surabaya. Tahun 1997 lulus seleksi masuk Ujian Masuk Perguruan Tinggi Negeri Fakultas kedokteran Hewan Universitas Airlangga Surabaya.
xix Halaman
DAFTAR TABEL………. xxi
DAFTAR GAMBAR……… xxiii
DAFTAR LAMPIRAN………. xxv
PENDAHULUAN Latar Belakang………. 1
Rumusan Masalah……….. 2
Tujuan Penelitian………. 3
Manfaat Penelitian………... 3
Hipotesis……… 3
TINJAUAN PUSTAKA Karakteristik………... 5
Cara Penularan……….... 10
Patogenesis……….. 11
Gejala Klinis……….. 14
Gejala Klinis pada Sapi……… 14
Gejala Klinis pada Manusia……… 14
Metode Diagnostik………... 16
Penyebaran dan Kebijakan……… 20
Vaksinasi………... 22
BAHAN DAN METODE Rancangan Penelitian………. 25
Tempat dan Waktu Penelitian………... 25
Bahan dan Alat……….... 26
Jenis Sampel……… 27
Prosedur Pengujian Prosedur MRT……… 28
Prosedur RBT……… 28
Prosedur ELISA………. 28
Prosedur CFT………. 29
Prosedur PCR……… 31
Analisis Data………. 33
HASIL DAN PEMBAHASAN Hasil Pengambilan Sampel……… 35
Hasil Pengujian Sampel………. 36
Pembahasan……… 39
Pembahasan Uji Serologi………. 39
Pembahasan PCR………. 43
Penerapan Metode dan Lalu Lintas Hewan……… 45
Bruselosis pada Manusiadan Aspek Kesehatan Masyarakat……….50
xx
DAFTAR PUSTAKA……….. 57
LAMPIRAN………..
.
67
xxi DAFTAR TABEL
Halaman Tabel 1 Spesies dan potensi zoonosis Brucella spp………. 6 Tabel 2 Karakteristik biovar dan spesies dalam genus Brucella
spp……….. 8
Tabel 3 Daya tahan Brucella spp. dalam susu dan produk
susu……….. 9
Tabel 4 Daftar primer... 26 Tabel 5 Kekuatan kesepakatan………... 33 Tabel 6 Hasil pengambilan sampel... 35 Tabel 7 Hasil pengujian sampel... 36 Tabel 8 Confirmation rate dengan CFT... 36 Tabel 9 Hasil pengujian LOD... 37 Tabel 10 Nilai persentase Kappa ... 38 Tabel 11 Hasil uji sensitifitas dan spesifisitas penerapan secara pararel
xxiii DAFTAR GAMBAR
Halaman
xv DAFTAR LAMPIRAN
Latar Belakang
Bruselosis merupakan zoonosis penting yang masih menjadi permasalahan dunia terutama bagi negara berkembang. Nama lain dari bruselosis adalah
undulant fever, Mediterranean fever, Malta fever, keluron, contagious abortion
atau Bang’s disease. Penyakit ini menyebabkan gangguan kesehatan dan kerugian ekonomi serta berdampak kepada kesehatan masyarakat. Brucella
abortus merupakan penyebab dari bovine brucellosis yang menimbulkan
kerugian ekonomi karena abortus, pedet lahir mati/lemah, sterilitas akibat gangguian reproduksi, turunnya produksi susu serta turunnya akses pasar baik skala nasional maupun internasional (Abdoel et al. 2008; Corbel 1997; Noor 2006a). Apabila bruselosis tidak ditanggulangi, kerugian ekonomi mencapai 138,5 milyar rupiah setiap tahun meskipun mortalitas akibat penyakit ini relatif kecil (Noor 2006a).
Bruselosis pada manusia diperkirakan terjadi 500 000 per tahun yang menyebabkan kerugian ekonomi yang ditimbulkan dengan adanya biaya pengobatan dan turunnya produktifitas karena penyakit ini bersifat kronis dan melemahkan (Corbel 1997; Seleem et al. 2010; Xavier et al. 2010). Infeksi pada manusia disebabkan oleh konsumsi susu atau keju non-pasteurisasi yang terkontaminasi (foodborne transmission), terpapar hewan terinfeksi, karkas atau sekresi uterus, dan fetus abortus (Al-Majali 2005; Neta et al. 2010). Kelompok risiko tertinggi adalah pekerja di rumah potong hewan dan kandang, pemerah susu, dokter hewan, paramedik, inseminator, dan analis laboratorium (Surendran 2011). Dilaporkan oleh Wallach et al. (2008) sebanyak 30 karyawan yang menangani produksi vaksin S19 menunjukkan seropositif. Seropositif di Indonesia menurut Sudibyo (1998) terdapat pada pekerja kandang sapi perah, kandang babi dan RPH babi di wilayah DKI.
B. abortus digunakan sebagai senjata biologis karena dapat ditransmisikan
Rumusan Masalah
Indonesia saat ini dalam rangka pembebasan terhadap bruselosis (Noor 2006a). Penyebaran bruselosis sangat erat hubungannya dengan manajemen kandang, sumber pakan, kepadatan populasi, tipologi beternak yang berkaitan erat dengan faktor sosio-ekonomi peternak, serta lalu lintas sapi dari satu lokasi ke lokasi lainnya. Badan Karantina Pertanian mempunyai fungsi untuk melakukan pengawasan lalu lintas hewan sesuai dengan Undang-Undang RI Nomor 16 Tahun 1992 tentang Karantina Hewan, Ikan dan Tumbuhan serta fungsi pencegahan penyakit sesuai dengan Undang-Undang RI Nomor 18 Tahun 2009 tentang Peternakan dan Kesehatan Hewan termasuk peran dalam pencegahan dan penyebaran bruselosis. Program pengendalian dan pemberantasan memerlukan metode uji yang dapat mendeteksi penyakit secara dini dan akurat (Leal-Klevezas et al. 2000). Deteksi dini dengan melihat gejala klinis kurang efektif karena gejala klinis bruselosis tidak patognomonis, sehingga dibutuhkan pengujian laboratorium untuk mendeteksinya (Leary et al. 2006). Metode deteksi antibodi dengan Rose Bengal test (RBT) dan milk ring test (MRT) menggunakan sampel serum dan susu secara rutin digunakan sebagai uji tapis pada peternakan yang dicurigai (Romero et al. 1995).
Direktorat Jenderal Peternakan dan Kesehatan Hewan menerapkan kebijakan vaksinasi pada populasi dengan prevalensi di atas 2% sedangkan prevalensi di bawah 2% dengan kebijakan test and slaughter menggunakan metode Rose Bengal test (RBT) dan dikonfirmasi dengan complement fixation test (CFT). RBT merupakan metode yang sederhana, cepat dan praktis. Metode ini membutuhkan konfirmasi dengan CFT karena mempunyai spesifisitasnya rendah. RBT merupakan metode yang sederhana, cepat, dan praktis dengan spesifisitas rendah, sedangkan CFT mempunyai spesifisitas tinggi akan tetapi kurang praktis.
Isolasi merupakan metode gold standard dengan spesifisitas tinggi akan tetapi jarang digunakan karena kurang sensitif, rumit, mahal, membutuhkan
keberhasilan hanya sekitar 20-50% (Poester et al. 2010). Isolasi tidak selalu digunakan untuk melihat spesifisitas, karena beberapa kasus pada hewan menunjukkan kultur negatif meskipun faktanya hewan itu terinfeksi (Gal & Nielsen 2004). Oleh karena itu Badan Karantina Pertanian perlu mengembangkan metode deteksi dini, cepat, akurat, dan mudah diaplikasikan.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mendeteksi infeksi B. abortus pada kelompok sapi perah dengan metode serologik dan PCR dengan melihat kesesuaian masing-masing metode serta penerapannya.
Manfaat Penelitian
Memberikan gambaran metode yang dapat diterapkan dalam pelaksanaan tindak karantina hewan di seluruh Unit Pelaksana Teknis dalam lingkup Badan Karantina Pertanian.
Hipotesis
TINJAUAN PUSTAKA
Karakteristik Brucella spp.
Sir William Burnett pada tahun 1779 menemukan kasus demam pada tentara yang diakibatkan oleh adanya mikroorganisme. Penemuan ini dilanjutkan oleh Jeffery Allen Marston yang mendeskripsikan Malta fever secara lebih terperinci. Tahun 1855 Sir David Bruce seorang mikrobiologis dari tentara Inggris menemukan Micrococcus melitensis kemudian dilanjutkan oleh Bernhard Bang seorang veterinerian yang menemukan Bacterium abortus yang menginfeksi ternak, kuda, domba dan kambing. Alice Evans seorang bakteriologis dari Amerika telah menemukan persamaan morfologi dan patologi antara Bang’s Bacterium abortus dengan Bruce’s Micrococcus melitensis.
Berdasarkan penemuan di atas kemudian Sir David Bruce memberikan nomenklatur Brucella abortus dan Brucella melitensis. Klasifikasi B. abortus
menurut Ficht (2010), Godfroid et al. (2011) dan Moreno et al. (2002) sebagai berikut :
Kingdom : Bacteria
Phylum : Proteobacteria
Class : Alphaproteobacteria
Ordo : Rhizobiales
Family : Brucellaceae
Genus : Brucella
Spesies : Brucella Abortus
Bruselosis disebabkan oleh bakteri dari genus Brucella yang terdiri dari 10 spesies dengan induk semang yang berbeda beda. Komponen dinding sel
Brucella spp. baik pada strain halus (smooth) yaitu Brucella melitensis (B. melitensis), Brucella abortus dan Brucella suis (B. suis) maupun pada strain
2010). B. abortus menyerang sapi, bison (Bison spp.) kerbau (Bubalus bubalus),
[image:30.595.97.476.205.599.2]African buffalo (Syncerus caffer), rusa, dan unta. Brucella spp. strain kasar mempunyai virulensi lebih rendah pada manusia dan secara lengkap disajikan dalam Tabel 1.
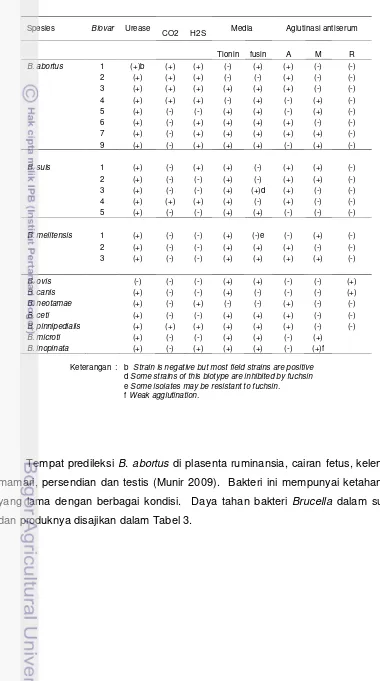
Tabel 1 Spesies dan potensi zoonosis Brucella spp. (Godfroid et al. 2010)
B. abortus termasuk gram negatif dan berbentuk coccobacilli atau batang
pendek dengan panjang 0.6-1.5 μm dan lebar 0.5-0.7 μm. Bakteri ini sering dijumpai single dan jarang berpasangan atau kelompok kecil. Karakteristik bakteri ini adalah fakultatif intraseluler dan mempunyai bentuk konstan kecuali pada kultur yang sudah tua kadang pleomorphic (lebih dari 1 bentuk). Bakteri ini bereplikasi di sel makrofag dari induk semang(Munir 2009). Secara mikroskopis dapat digambarkan sesuai dengan Gambar 1.
Spesies Biovar Morfologi Induk Patogenitas
Koloni Semang pada manusia
B. melitensis 1,2,3 smooth domba, kambing tinggi B. abortus 1-6, 9 smooth Ternak tinggi
B. suis 1,3 smooth Babi tinggi
2 smooth babi hutan, terwelu rendah 4 smooth rusa kutub, caribou tinggi 5 smooth tikus gurun sedang Brucella neotamae smooth rodensia tidak
B. ovis rough domba jantan tidak
B. canis rough Anjing sedang
Brucella pinnipedialis smooth anjing laut ?
Brucella ceti smooth Ikan paus ?
Gambar 1. Brucella spp. secara mikroskopik.
Suhu pertumbuhan optimum berkisar 36-38 °C yang mana sebagian besar
strain dapat tumbuh pada suhu 20 °C - 40 °C, sedangkan pH optimum 6.6-7.4, dan di media kultur berkisar 6.8. Suhu 63 °C selama 7–10 menit dapat membunuh bakteri ini (Adams & Moss 2008) Koloni berbentuk bulat, konvek, seperti mutiara putih dengan diameter 1-2 mm, garis pinggir yang halus
(smooth), transparan dan warnanya pucat madu. Koloni kasar berwarna kuning,
opak, friable dan sulit terlarut dalam cairan. Koloni mukoid mempunyai bentuk sama dengan koloni kasar kecuali kelarutannya, mukoid mudah larut (Walker 1999). Semakin lama di biakan kultur koloni akan semakin membesar dan cenderung berwarna gelap. Bentuk koloni halus pada subkultur akan mengalami perubahan ke bentuk kasar (rough) dan kadang-kadang ke bentuk mukoid (Garridino-Abellan et al. 2001).
Sifat biokimia bakteri ini secara umum dapat menghasilkan urease, oksidasi katalase positif dan dapat mereduksi nitrit menjadi nitrat. Perbedaan spesies dan biovar di dalam Brucella spp. pada kemampuan mengoksidasi karbon, memetabolisme asam glutamat, ornitin, lisin, dan ribosa. Perbedaan itu juga terletak pada kemampuan memproduksi H2S serta kerentanan terhadap
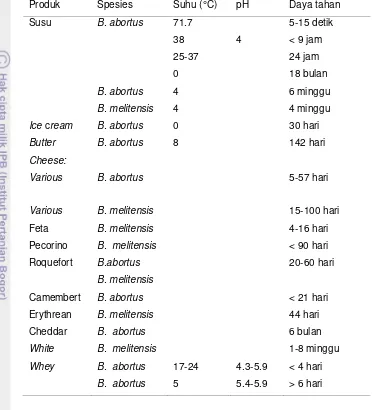
Tabel 2 Karakteristik biovar dan spesies dalam genus Brucella spp. (Whatmore 2009).
Spesies Biovar Urease
CO2 H2S Media Aglutinasi antiserum
Tionin fusin A M R
B. abortus 1 (+)b (+) (+) (-) (+) (+) (-) (-) 2 (+) (+) (+) (-) (-) (+) (-) (-) 3 (+) (+) (+) (+) (+) (+) (-) (-) 4 (+) (+) (+) (-) (+) (-) (+) (-) 5 (+) (-) (-) (+) (+) (-) (+) (-) 6 (+) (-) (+) (+) (+) (+) (-) (-) 7 (+) (-) (+) (+) (+) (+) (+) (-)
9 (+) (-) (+) (+) (+) (-) (+) (-)
B. suis 1 (+) (-) (+) (+) (-) (+) (+) (-) 2 (+) (-) (-) (+) (-) (+) (+) (-) 3 (+) (-) (-) (+) (+)d (+) (-) (-) 4 (+) (+) (+) (+) (-) (+) (-) (-)
5 (+) (-) (-) (+) (+) (-) (-) (-)
B. melitensis 1 (+) (-) (-) (+) (-)e (-) (+) (-) 2 (+) (-) (-) (+) (+) (+) (-) (-) 3 (+) (-) (-) (+) (+) (+) (+) (-)
B. ovis (-) (-) (-) (+) (+) (-) (-) (+)
B. canis (+) (-) (-) (+) (-) (-) (-) (+)
B. neotamae (+) (-) (+) (-) (-) (+) (-) (-)
B. ceti (+) (-) (-) (+) (+) (+) (-) (-)
B. pinnipedialis (+) (+) (+) (+) (+) (+) (-) (-)
B. microti (+) (-) (-) (+) (+) (-) (+)
B. inopinata (+) (-) (+) (+) (+) (-) (+)f Keterangan : b Strain is negative but most field strains are positive
d Some strains of this biotype are inhibited by fuchsin e Some isolates may be resistant to fuchsin.
f Weak agglutination.
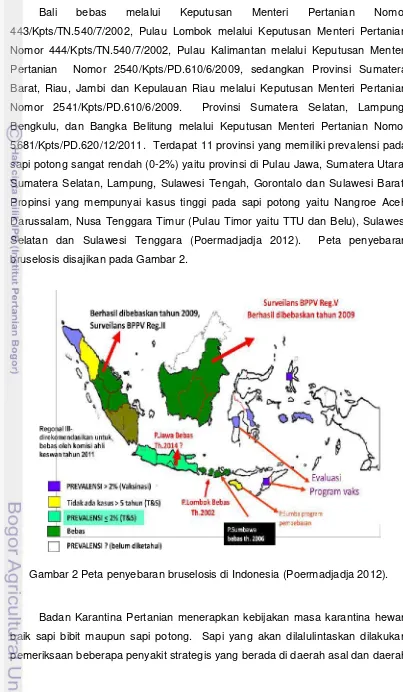
Tabel 3 Daya tahan Brucella spp. dalam susu dan produk susu (Garridino-Abellan et al. 2001)
Menurut Noor (2006) bakteri dapat bertahan selama 2 hari dalam kotoran/limbah kandang yang bagian bawah (suhu lebih tinggi dari pada bagian atas), 4 hari dalam tanah kering, 66 hari dalam tanah lembab, dan 15-185 hari dalam tanah becek. Bakteri ini juga mampu bertahan di air minum ternak 5-114 hari, air limbah 3-150 hari (Sudibyo 1998). Bakteri ini mampu bertahan pada suhu rendah terutama dibawah titik beku, oleh karena itu produk olahan dari susu segar yang terkontaminasi menjadi sumber penularan ke manusia yang mengonsumsinya. Daging, jerohan, dan organ seperti hati, paru-paru dan ginjal
Produk Spesies Suhu (°C) pH Daya tahan Susu B. abortus 71.7 5-15 detik
38 4 < 9 jam
25-37 24 jam
0 18 bulan
B. abortus 4 6 minggu
B. melitensis 4 4 minggu
Ice cream B. abortus 0 30 hari
Butter B. abortus 8 142 hari
Cheese:
Various B. abortus 5-57 hari
Various B. melitensis 15-100 hari
Feta B. melitensis 4-16 hari
Pecorino B. melitensis < 90 hari
Roquefort B.abortus 20-60 hari
B. melitensis
Camembert B. abortus < 21 hari
Erythrean B. melitensis 44 hari
Cheddar B. abortus 6 bulan
White B. melitensis 1-8 minggu
mempunyai risiko lebih kecil sebagai sumber penularan, karena biasanya dikonsumsi dalam kondisi matang (Corbel 2006).
Komponen LPS dari outer cell membranes Brucella spp berbeda baik secara struktur dan fungsi dari gram negatif yang lainnya. Perbedaan Brucella
spp. dibandingkan dengan bakteri patogen lainnya adalah tidak mempunyai faktor virulensi klasik seperti eksotoksin, kapsul, flagela, fimbre, plasmid, fase lisogenik, variasi antigenik, sitolisin atau sistem sekresi tipe I, II, atau III yang berperan dalam karakteristik mekanisme patogenik. Sekresi tipe IV dari B. abortus (T4SS) telah berhasil diidentifikasi dan menentukan ketahanannya di dalam sel fagositik mononuklear (Munir 2009; Purchell et al. 2007).
Cara Penularan
Penularan utama pada hewan terjadi melalui kontak dengan bahan yang terkontaminasi plasenta, fetus, cairan fetus, dan cairan vagina dari sapi abortus atau partus. Penularan yang lainnya juga terjadi melalui kontak dengan kulit, selaput konjungtiva, secara inhalasi (mukosa saluran pernafasan), per-oral (mukosa gastrointestinal/orofaring), vertikal, dan kontak dengan susu terkontaminasi. Penularan secara veneral tidak terlalu penting, yang lebih penting adalah penularan dari semen yang terkontaminasi melalui inseminasi buatan. Ruminansia lebih sering asimtomatik setelah abortus yang pertama, akan tetapi bersifat karier dan mengeluarkan bakteri melalui air susu. Selain melalui air susu bakteri juga dikeluarkan melalui urine, feses, cairan higroma, air liur, hidung dan okular. Bakteri dapat menyebar melalui cairan muntah termasuk padang rumput, pakan dan air yang tercemar (Neta et al. 2010; CFSPH 2009; Xavier et al.2010).
manusia jarang dilaporkan, meskipun pernah dilaporkan melalui transfusi darah, transplantasi sumsum tulang atau hubungan seksual. Infeksi pada bayi terjadi karena melalui transplasenta atau peroral dari konsumsi air susu ibu yang terinfeksi. Infeksi kongenital juga mungkin terjadi melalui sirkulasi darah atau infeksi pada waktu lahir dari urin maupun feses ibunya (CFSPH 2009; Corbel 2006; Xafier 2010).
Patogenesis
Bakteri masuk ke dalam tubuh melalui mukosa port entery kemudian masuk ke dalam sel limfoepitel dan difagositosis oleh sel neutrofil dan sel makrofag kemudian masuk ke dalam limfoglandula. Patogenisitas terkait dengan produksi lipopolisakarida yang tersusun oleh poly N-formyl perosamine O chain,
Cu- Zn superoxide dismutase, erythrulose phosphate dehydrogenase. Secara
umum fagositosisi gagal karena bakteri ini mempunyai zat antifagositosit yaitu protein 5 guanin monofosfat yang mampu bertahan dan bereplikasi di dalam sel neutrofil. Apabila sistem pertahanan tidak mampu mengatasi adanya infeksi maka akan muncul bakteriemia setelah 10-20 hari dan persisten selama 30 hari sampai 2 bulan pascainfeksi. Setelah bakteremia pada sapi bunting maka bakteri akan masuk kedalam plasenta sapi bunting dan daerah ambing. Infeksi pada sapi yang tidak bunting akan menuju ke daerah ambing dan sering tanpa gejala klinis ataupun lesi. Bakteri dalam makrofag akan bersirkulasi dalam jaringan limfoid dan terlokalisir dalam sistem retikuloendotel hati, limfa dan sumsum tulang belakang ginjal, persendian yang mengakibatkan adanya radang sendi dan higroma. Higroma terjadi karena adanya infeksi pada membran persendian sehingga berisi cairan jernih, fibrin, maupun nanah sehingga terlihat adanya benjolan yang sangat mencolok (Garradino-Abellan 2001; Munir 2009; Neta et al. 2010)
limfoplasmasitik interstisial (Adams 2002). Sapi yang ditransportasikan 80% telah positif mengandung Brucella spp. dalam nodus limfe supramamari dan kelenjar mamari serta mengsekresikan ke dalam cairan tubuhnya (Al-majali 2005).
Sistem pertahanan seluler yang paling berperan adalah sel makrofag dan limfosit T, meskipun antibodi spesifik juga berperan. Proses immunitas tergantung dari spesies yang terinfeksi, umur, status kekebalan, status kebuntingan, dan virulensi serta dosis infeksi (Corbel 1997; Neta et al. 2010). Respon serologik pasca infeksi pada infeksi alami akan muncul setelah 2 sampai 4 minggu, akan tetapi respon ini sangat bervariasi dan bahkan kadang-kadang tidak terjadi. Invasi bakteri pada uterus yang bunting akan menghasilkan antibodi dalam jumlah besar dan berlangsung terus menerus. Respon humoral pada awal infeksi akan diproduksi IgM diikuti IgG dan IgG2 serta IgA (Neta et al.
2010). Sapi dara lebih resisten terhadap paparan B. abortus, semakin rentan seiring dengan perkembangan seksual dan kebuntingan. Pedet terinfeksi di dalam uterus atau diberikan susu yang terkontaminasi, biasanya memiliki respon antibodi sementara setelah terinfeksi, namun, dapat terus mengeluarkan bakteri selama beberapa minggu setelah pemberian susu berhenti. Sebagian kecil tapi penting sapi dara yang terinfeksi sejak awal akan menunjukkan seronegatif namun dapat menginfeksi anaknya pada kebuntingan pertama (Munir 2009).
B. abortus di ruminansia dapat melewati pertahanan tubuh induk semang dan menuju target jaringan embrio dan trofoblas. Pertumbuhannya tidak hanya di dalam sel fagosom akan tetapi juga di sitoplasma dan rough reticulum endoplasmik yang menyebabkan kematian janin dan aborsi. Bakteri menghambat fusi fagosom dan lisosom dalam makrofag dan bereplikasi dalam retikulum endoplasma. Bakteri yang tidak di fagosit oleh makrofag akan merusak sel induk semang dan menyebar ke sel yang lainnya. Bakteri ini juga dapat bereplikasi di jaringan ekstraseluler induk semang. Gambaran histopatologis dari respon seluler dapat terlihat adanya pembentukan abses sampai infiltrasi limfositik dan selanjutnya pembentukan granuloma pada kondisi nekrosis (Munir 2009; Neta et al. 2010; Xefier et al. 2009).
sapi bunting sangat pesat dan pada saat abortus ditemukan 1010 bakteri per gram jaringan organ abortus (Purchel et al. 2007). Perkembangbiakan bakteri ini menyebabkan infiltrasi sel inflamasi, nekrosis trofoblas, vaskulitis, dan ulserasi pada alantokorion, sehingga menggangu metabolisme fetus dan mengakibatkan abortus. Selain faktor diatas peningkatan kortisol dengan estrogen dan progesteron akan meningkatkan jumlah prostaglandin F2 alfa yang akan meningkatkan kontraksi uterus sehingga mengakibatkan abortus (Munir 2009).
Plasentitis juga dapat mengakibatkan abortus, hal ini terjadi karena B.
abortus menyerang sel tropoblastik yang menekan respon mudulator pro
inflamasi selama tahap awal infeksi. Spesies dari Brucella ini mempunyai ferroselator yang menyebabkan bakteri ini mampu bertahan di intraseluler dan bermultireplikasi serta bertahan pada infeksi kronis dengan membentuk fosfotidilkolin. Selain itu spesies ini juga mempunyai enzim katalase sehingga menghasilkan H2O2 dan D-alanyl-D-alanine carboxypeptidase (DAP) yang
mengakibatkan resisten terhadap sel induk semang terutama oleh Nitrat Oksida. Kemampuan untuk membentuk urease membantu ketahananya dalam infeksi peroral. DAP banyak terdapat di sel eukariot dan jarang sekali di sel prokariot (Munir 2009).
Penularan sering terjadi secara peroral melalui saluran pencernaan. Bakteri diinternalisasi oleh M sel dalam peyer patch, kemudian menyebar ke dalam kelenjar getah bening regional dan berkembangbiak di dalam makrofag secara fakultatif intraseluler. Selanjutnya menyebar melalui aliran darah munuju ke jaringan yang lainnya, terutama di rahim sapi bunting (Xavier et al. 2010). Meskipun infeksi dapat terjadi melalui kulit, konjungtiva atau aerosol rute yang paling umum infeksi pada sapi adalah melalui saluran pencernaan dan infeksi menyebar ke dalam kelenjar getah bening lokal. Invasi ke dalam pembuluh limfatik diikuti dengan bakteremia yang menyebabkan infeksi berjalan sistemik (Neta et al. 2010).
Masa inkubasi B. abortus pada sapi berkisar 53-251 hari (Megid et al.
sampai beberapa bulan (Corbel 2006), sedangkan menurut CFSPH (2009) sulit ditentukan berkisar 5 hari sampai tiga bulan dan sebagian besar terlihat jelas dalam waktu dua minggu. Penularan melalui aerosol dari agen bioterorisme mempunyai masa inkubasi yang lebih pendek (CFSPH 2009).
Patogenesis penyakit pada manusia sangat mirip dengan ternak. Rute utama infeksi dari Brucella spp. melalui membran mukosa orofaring, saluran pernafasan atas dan konjungtiva. Rute potensial lainnya dari mukosa saluran reproduksi pria dan wanita. Bakteri secara umum mampu melewati sistem pertahanan seluler tubuh dari induk semang dan berhasil masuk ke dalam kelenjar getah bening terdekat melalui saluran getah bening (Seleem et al. 2010).
Brucella spp. masuk, bertahan dan berkembang dalam sel fagosit dan non
fagosit induk semangnya misalnya sel makrofag, sel dendrite (DCs), dan sel trofoblast. Karakteristik dari bruselosis pada manusia adalah infeksi persisten dalam jaringan limfoid dan menyebabkan lesi peradangan dalam saluran reproduksi wanita hamil (Munir 2009).
Gejala Klinis
Gejala Klinis pada Sapi
Tahap awal infeksi pada sapi terlihat gejala klinis utama yaitu abortus, still birth atau mati lemah dan gejala lainnya seperti orkitis, epididimitis, higroma, artritis, metritis, mastitis subklinis. Abortus terjadi pada usia kebuntingan 5-8 bulan. Gejala abortus pada sapi sebagian besar hanya sekali meskipun terjadi plasentitis dan kebuntingan kedua biasanya normal. Hewan yang mampu bertahan akan menjadi karier dan berpotensi mnegeluarkan bakteri. Tahap kedua akan terjadi infeksi persisten di kelenjar mamari dan supramamari, serta limfonodus genital (Ahmed et al. 2010; Garridino-Abellan et al. 2001; Megid et al.
2010; Seleem 2010). Mastitis menyebabkan terjadinya penurunan produksi susu sekitar 25% dan bakteri akan shedding secara terus menerus atau intermittent di dalam susu dan genital secretions. B. abortus juga dapat ditemukan dalam, urin, susu segar, air mani, tinja dan cairan higroma (Capparelli et al. 2008; Corbel 2006; Megid et al. 2010).
Gejala Klinis pada Manusia
Gejala klinis pada manusia sangat bervariasi. Bruselosis dimulai sebagai penyakit demam undulant yang bersifat intermittent dan reintermittent dengan tanda-tanda nonspesifik seperti flu, demam, malaise sakit kepala, nyeri punggung, mialgia dan keringat basah terutama di malam hari. Disebut dengan demam undulant karena terjadi variasi suhu, 37 °C di pagi hari dan 40 °C pada siang hari serta malam hari menggigil disertai kelemahan (Seleem et al. 2010). Gejala lain seperti splenomegali, hepatomegali, batuk dan nyeri dada pleuritik kadang-kadang terlihat. Gejala klinis pencernaan termasuk anoreksia, mual, muntah, diare, dan sembelit sering terjadi pada orang dewasa tapi jarang pada anak-anak. Jika penyakit ini tidak segera diobati maka akan persisten sampai beberapa minggu bahkan beberapa bulan. Faktor–faktor yang mempengaruhi timbulnya infeksi pada manusia sebenarnya banyak faktor antara lain status kekebalan individu, rute infeksi, dosis infeksi, dan jenis spesies Brucella
(Whatmore 2009).
Gejala klinis sebagian besar berlangsung selama dua sampai empat minggu dan dapat sembuh sendiri. Demam intermittent berselang 2 sampai 14 hari. Sebagian besar penderita dengan gejala klinis demam undulant dan dapat sembuh total dalam waktu 3 sampai 12 bulan, bahkan ada beberapa menjadi kronis. Komplikasi yang sering terjadi artritis, spondilitis, epididimo-orkitis dan malaise kronis. Tanda-tanda neurologis seperti meningitis, ensefalitis dan neuropati perifer terjadi sekitar 5% kasus. Gejala seperti insomnia, anoreksia, sakit kepala, impotensi dan depresi juga bisa terlihat.
Endokarditis adalah salah satu komplikasi yang paling serius, dan menyebabkan kematian pada kasus yang fatal. Organ dan jaringan lain juga dapat dipengaruhi, sehingga berbagai sindrom termasuk nefritis, dermatitis, vaskulitis, limfadenopati, trombosis vena dalam, hepatitis granulomatosa, kolesistitis, osteomielitis, anemia, leukopenia dan trombositopenia. Gejala umum termasuk berat badan lahir rendah, demam, pertumbuhan terhambat, sakit kuning, hepatomegali dan splenomegali. Beberapa bayi baru lahir dengan bawaan bruselosis mengalami gangguan pernapasan berat, hipotensi, muntah dan tanda-tanda sepsis. Demam pada bruselosis pada manusia mirip dengan demam enterik, malaria, demam rematik, tuberkulosis, kolesistik, tromboflebitis, infeksi jamur, penyakit autoimun dan tumor (Ashford et al. 2004; Seleem et al.
Metode Diagnostik
Pemeriksaan bakteriologi terhadap bruselosis dapat dilakukan dengan isolasi dan identifikasi bakteri penyebab dari isolasi susu segar, ulasan vagina, darah, membran fetus, fetus aborsi, dan limfoglandula. Identifikasinya dilakukan dengan metode pewarnaan gram dan uji biokimia. Metode kultur menggunakan media basal dan media selektif serta harus ditambahkan dengan antibiotik dan 2-5% serum bovine atau equine. Sampel yang digunakan dapat berupa organ fetus abortus (isi abdomen, limfa, dan paru-paru), membran fetus, sekeresi vagina, susu, semen, dan cairan radang sendi atau higroma. Selain itu juga dapat berasal dari karkas seperti sistem retikulo-endotelia dari kelenjar mamari, kelenjar getah bening, limfa dan uterus (OIE 2009). Rata-rata kultur dapat tumbuh mulai dari 3-4 hari akan tetapi tidak boleh disimpulkan negatif sebelum inkubasi 8-10 hari. Gold standard untuk bruselosis pada manusia adalah dengan kultur dari sampel darah, sumsum tulang, kelenjar getah bening atau cairan serebrospinal dengan spesifisitas tinggi namun sensitifitas rendah karena sulitnya tingkat pertumbuhan. Sensitifitas metode kultur pada fase akut sebesar 91% sedangkan fase kronis 74% (Seleem et al. 2010).
PCR adalah teknik yang didasari oleh penggunaan oligonukleotida pendek sebagai primer dan taq DNA polymerase sebagai enzim untuk menggandakan rangkaian DNA dengan target sekuen yang telah ditetapkan pada lokus yang spesifik terhadap Brucella. Metode PCR digunakan untuk identifikasi spesies dan biovar diantara Brucella spp. (Al-Dahouk & Tomasso 2005; Ocampo-Sosa et al. 2005). Metode PCR untuk deteksi bruselosis saat ini berkembang dengan pesat, baik dari pengembangan metode maupun pengembangan jenis sampel uji (Bricker 2002). BaSS PCR dapat membedakan hasil positif karena infeksi alam atau akibat vaksinasi S19 (Ewalt & Bricker 2003). Multipleks PCR yang pertama kali dikembangkan adalah AMOS PCR bertujuan untuk efisiensi waktu dan jumlah sampel dengan menggunakan banyak primer sehingga dalam satu kali uji dapat membedakan spesies dalam genus Brucella (B. abortus, B. melitensis, B. ovis dan B. suisi) dan vaksin S19 maupun RB51 (Bricker et al. 2003; Garcia-Yoldi
et al. 2006; Matope et al. 2009).
Pengembangan metode PCR yang lain seperti PCR – RFLP, AP (arbitrarily
primed)-PCR, RAPD (random amplified polymorphic DNA)-PCR, REP (repetitive
intergenic consensus sequences)-PCR, specific multiplexing (AMOS-PCR based on the repetitive DNA sequence IS711), multi-locus analysis of variable number tandem repeats (VNTRs) and PCR-RFLP (Bricker 2002; Al-Dahouk & Tomasso 2005). Metode deteksi brucellosis pada manusia saat ini dikembangkan light
cycler real-time polymerase chain reaction (PCR) assay dengan serum dan
PCR–enzyme-linked immunosorbent assay dengan sampel darah
(Queipo-ortuno et al. 2005). Multipleks PCR terbaru adalah Bruce-ladder dalam satu kali PCR dapat membedakan antara vaksin strain B. abortus S19, B. abortus RB51 dan B melitensis biovar 1. Selain itu dapat juga diguakan untuk membedakan DNA dari B. neotomae, B pinnipedialis, B ceti serta B abortus biovar 3, 5, 6, 7, 9, dan B. suis biovar 2, 3, 4, 5.
Pengujian secara serologik dapat dilakukan dengan fluorescence polarisation assay, ELISA enzyme-linked immunosorbent assay (ELISA), dan
complement fixation test (CFT), buffered Brucella antigen tests (BBATs) misalnya
Rose Bengal test (RBT) dan buffered plate agglutination test (BPAT). Metode
BBATs menggunakan spot aglutinasi yang simpel dengan antigen Rose Bengal dan buffered pada pH rendah sekitar 3.65 ± 0.05.
Metode CFT merupakan metode konfirmasi secara serologik (OIE 2009) dengan nilai spesifisitas yang lebih besar dibandingkan metode Serum
Aglutination Test (SAT). CFT merupakan reaksi pengikatan komplemen. Reaksi
yang berguna untuk mengukur kadar antibodi serum ataupun antigen. Prinsip reaksi ini adalah adanya kompleks antigen dan antibodi yang homolog, menarik komplemen untuk berikatan dengan bagian Fc dari antibodi sehingga melisiskan RBC. Reaksi pengikatan komplemen terdiri dari dua tahap.
terjadi aktivitas antikomplementer terutama pada sampel serum dengan kualitas rendah, sementara itu pada fiksasi hangat pada suhu 37 oC akan meningkatkan frekuensi dan intensitas prozon. Apabila sampel yang diuji menunjukkan aktivitas ini, harus dilakukan pengulangan dengan beberapa pengenceran untuk setiap sampel sebagai hasil uji.
Metode ELISA saat ini banyak digunakan untuk deteksi bruselosis. Berbagai jenis ELISA banyak dikembangkan misalnya ELISA IgM, indirect-
ELISA (i-ELISA), competitive ELISA (c-ELISA), serta kombinasi ELISA dengan uji serologik lain. Metode ELISA diperkenalkan pada tahun 1971 oleh Peter Perlmann dan Eva Engvall untuk menganalisis adanya interaksi antigen dengan antibodi dalam suatu sampel dengan menggunakan indikator enzim. Umumnya ELISA dibedakan menjadi dua jenis, yaitu competitive assay yang menggunakan konjugat antigen–enzim atau konjugat antobodi–enzim, dan non-competitive
assay yang menggunakan dua antibodi. Metode ELISA non-competitive assay,
mempunyai prinsip antibodi yang kedua dikonjugasikan dengan enzim sebagai indikator yang disebut dengan sandwich ELISA. Metode ELISA menggunakan monoklonal, poliklonal antiglobulin, protein G, AG pada enzim konjugat. Monoklonal antibodi spesifik untuk bovine IgG1 akan tetapi sensitifitasnya rendah. Protein G atau AG enzim konjugat sangat baik untuk uji pada berbagai spesies dari mamalia.
Competitive enzyme linked immunosorbent assay (C-ELISA) berfungsi
untuk mendeteksi antibodi serum terhadap B. abortus. Penerapan pada sapi, uji ini mampu membedakan antara hewan terinfeksi Brucella dengan hewan yang divaksin dengan S19 dan dapat terjadi cross reaction apabila hewan terinfeksi dengan gram negatif. Uji ini telah dikembangkan agar memiliki performa yang sebanding dengan CFT. Prinsip uji ini berdasarkan pada fase padat antibodi C-ELISA. Prosedur pengujian ini sampel dipaparkan dengan S-LPS. B. abortus
konjugat. Nilai optical density diukur dengan fotometer mikroplate (ELISA
reader) pada 450 nm.
Apabila antibodi anti-Brucella tidak dijumpai pada serum (negatif), mAb akan terikat pada epitop o-polysaccharida dari antigen S-LPS dan ditandai dengan pembentukan warna. Apabila serum yang diuji mengandung antibodi spesifik Brucella (positif), keduanya akan bersaing dengan mAb untuk menempati situs epitop dan menghambat mAb terikat pada o-polisakarida dari antigen S-LPS dan diikuti dengan pembentukan warna. Serum dari sapi yang divaksinasi dengan strain 19 tidak akan bersaing dengan mAb karena spesifisitas dan afinitasnya rendah sehingga menimbulkan reaksi negatif. Bagaimanapun juga, pada beberapa kasus sampel yang diambil sebelum 6 bulan pascavaksinasi mungkin akan bereaksi positif.
Abortus-Bang Ring-test atau milk ring test (MRT) merupakan deteksi direct
antibodi terutama IgA dalam susu (Aggad & Boukraa 2006). Metode ini mempunyai prinsip dasar aglutinasi cepat, antibodi yang melekat pada lemak globula akan naik ke permukaan susu dan terkonsentrasi di lapisan krim. Whole cell antigen B. abortus (antigen MRT) yang ditambahkan ke dalam susu akan berikatan dengan antibodi dan terkonsentrasi di lapisan krim membentuk Brucella agglutinins. Brucella agglutinins dalam susu diadsorbsi ke dalam globula lemak. Reaksi positif ditandai dengan terbentuknya cincin warna ungu dari
globule-agglutininstained brucella kompleks antigen (Nielsen 1996).
Rose Bengal test adalah uji aglutinasi pada slide secara cepat untuk mendeteksi adanya agglutinin spesifik Brucella. Antigen Brucella yang digunakan adalah larutan bakteri Brucella abortus yang digunakan untuk mendeteksi adanya agglutinin bakterial yang berhubungan dengan adanya infeksi atau paparan oleh B. abortus. Uji slide ini direkomendasikan hanya sebagai screening saja untuk memastikan ada atau tidaknya antibodi yang homolog. Sewaktu terjadi infeksi pada ruminansia oleh suatu agen mkrobiologi patogen, maka tubuh akan membentuk berbagai macam antibodi, diantara adalah aglutinin. Ketika agglutinin bereaksi dengan antigen yang homolog dalam pH yang yang sesuai maka dapat menyebabkan terjadinya aglutinasi.
agglutinasi sempurna, cairan jernih dan tampak jelas. Hasil dinilai positif(++) jika terjadi agglutinasi berupa pasir halus, cairan agak jernih dan batas cukup jelas. Sedangkan RBT dinilai positif (+) jika terjadi agglutinasi berupa pasir halus, cairan tidak jernih dan batas cukup jelas. Metode ini digunakan untuk mendeteksi secara dini terhadap aglutinin Brucella dengan menggunakan antigen Brucella yang diwarnai dengan Rose Bengal .
Uji lain yang dapat digunakan adalah ELISA dengan sampel susu,
interferon gamma test, brucellin skin test, serum aglutinin test (SAT). Deteksi antigen dengan uji biomolekuler dapat dilakukan PCR (OIE 2009). Positif palsu deteksi antibodi bruselosis dapat diakibatkan juga oleh adanya infeksi lain seperti
Yersinia enterocolitica serotype O:9, Francisella tularensi, E. coli serotype
O:157, O:116, Salmonella serotypes Kauffmann-White group N, Xanthomonas malthopilia, Vibrio cholera, Bordetella bronchiseptica (Ilhan et al. 2008; Gal & Nielsen 2004; Saegerman 2004). Negatif palsu dengan deteksi serologik dapat diakibatkan karena titer antibodi hewan yang terinfeksi belum cukup dan di bawah limit deteksi metode uji (Ilhan et al. 2008).
Penyebaran Penyakit dan Kebijakan
Bruselosis pada sapi perah di Pulau Jawa telah dikenal sejak tahun 1925 sebagai penyakit keluron ketika Kirschner berhasil mengisolasi Brucella dari janin sapi yang abortus di daerah Bandung, kemudian tahun 1927 di Aceh dan Sumatera Utara sampai akhirnya bruselosis semakin menyebar terutama di peternakan sapi perah di Jawa Barat, Jawa Tengah dan Jawa Timur (Noor 2006b). Penyakit ini bersifat endemis dan kadang-kadang muncul sebagai epidemi dibeberapa peternakan sapi perah di Jakarta, Bandung. Bruselosis menyebar hampir di seluruh wilayah Indonesia, kecuali Pulau Bali, Pulau Lombok dan Pulau Sumbawa (Putra 2005).
Spesies Brucella yang menginfeksi sapi di Indonesia adalah strain B.
abortus biovar 1. Biovar 1 merupakan isolat lokal yang paling patogen sehingga
Bali bebas melalui Keputusan Menteri Pertanian Nomor 443/Kpts/TN.540/7/2002, Pulau Lombok melalui Keputusan Menteri Pertanian Nomor 444/Kpts/TN.540/7/2002, Pulau Kalimantan melalui Keputusan Menteri Pertanian Nomor 2540/Kpts/PD.610/6/2009, sedangkan Provinsi Sumatera Barat, Riau, Jambi dan Kepulauan Riau melalui Keputusan Menteri Pertanian Nomor 2541/Kpts/PD.610/6/2009. Provinsi Sumatera Selatan, Lampung, Bengkulu, dan Bangka Belitung melalui Keputusan Menteri Pertanian Nomor 5681/Kpts/PD.620/12/2011. Terdapat 11 provinsi yang memiliki prevalensi pada sapi potong sangat rendah (0-2%) yaitu provinsi di Pulau Jawa, Sumatera Utara, Sumatera Selatan, Lampung, Sulawesi Tengah, Gorontalo dan Sulawesi Barat. Propinsi yang mempunyai kasus tinggi pada sapi potong yaitu Nangroe Aceh Darussalam, Nusa Tenggara Timur (Pulau Timor yaitu TTU dan Belu), Sulawesi Selatan dan Sulawesi Tenggara (Poermadjadja 2012). Peta penyebaran bruselosis disajikan pada Gambar 2.
Gambar 2 Peta penyebaran bruselosis di Indonesia (Poermadjadja 2012).
tujuan. Pemeriksaan importasi sapi perah maupun sapi bibit salah satu adalah uji terhadap bruselosis. Metode yang digunakan adalah RBT dan dilanjutkan dengan CFT dan beberapa Unit Pelaksana Teknis (UPT) menggunakan ELISA. Penanggulangan dan pencegahan bruselosis yang dilakukan oleh Direktorat kesehatan hewan (Dirkeswan) diantaranya dengan pemeliharaan sanitasi dan kebersihan, vaksinasi S19 usia 3 – 7 bulan, pemberian antiseptik dan antibiotika pada hewan yang sakit, penyingkiran reaktor (sapi terinfeksi sebagai sumber infeksi), isolasi, penjualan dan pemotongan sapi yang terinfeksi, pembakaran atau penguburan fetus dan plasenta abortus, dan karantian hewan yang baru diperiksa dan diuji. Ternak pengganti yang tidak mempunya "sertifikat bebas bruselosis" dapat dimasukkan dalam kelompok ternak apabila setelah dua kali uji serologik dengan waktu 30 hari memberikan hasil negatif. Ternak pengganti yang mempunyai "sertifikat bebas bruselosis" dilakukan uji serologik dalam selang waktu 60 sampai 120 hari setelah dimasukkan ke dalam kelompok ternak (Dirkeswan 2010).
Menurut Dirkeswan (2010) pengelompokan bruselosis pada suatu daerah diklasifikasikan menjadi tiga jenis yaitu daerah bebas, daerah tertular dan daerah tersangka. Syarat daerah bebas bruselosis adalah berada dibawah pengawasan dokter hewan berwenang, bebas reaktor, didalam kelompok ternak tersebut tidak terdapat gejala selama 6 bulan dan apabila ada pemasukan hewan baru, harus melalui 2 kali uji serologik dalam selang waktu 30 hari dan memberikan hasil negatif. Daerah tertular ringan mempunyai syarat adanya reaktor paling tinggi 2% dan berada dibawah pengawasan dokter hewan berwenang, tertular parah apabila didalam kelompok hewan ternak ini didapatkan reaktor diatas 2% dan berada dibawah pengawasan dokter hewan berwenang. Daerah tersangka mempunyai syarat pengujian serologik dilakukan untuk penentuan reaktor, reaktor-reaktor harus dikeluarkan dan dipotong (test and slaughter), pengeluaran reaktor diikuti oleh program vaksinasi pada sapi dara, hewan betina bunting dan hewan jantan tidak divaksinasi.
Vaksinasi
Vaksin live dan kill sangat berperan untuk program pemberantasan bruselosis pada sapi, kambing dan babi (Schurig et a. 2002). Vaksin live terbukti lebih unggul dibandingkan dengan vaksin kill karena menstimulasi terbentuknya
jangka panjang bakteri intraseluler. Pemberian vaksin live menghemat biaya karena harganya relatif lebih murah, meskipun dapat mengakibatkan abortus apabila diberikan pada sapi bunting. Penggunaan vaksin live lebih sesuai jika diberikan pada sapi dara usia 4-7 bulan. Pemberian vaksin pada sapi dewasa diperlukan untuk program pemberantasan terhadap reaktor bruselosis (Munir 2009).
Vaksin yang paling banyak digunakan untuk pencegahan bruselosis pada sapi adalah S19 dari B. abortus. Vaksin ini merupakan vaksin yang dilemahkan (live) dan biasanya diberikan untuk pedet betina berumur antara 3-6 bulan dengan dosis tunggal secara subkutan, sedangkan untuk sapi perah diberikan pada umur 4-12 bulan untuk menghindari adanya antibodi persisten yang menyebabkan adanya positif palsu pada pengujian serologik Vaksin dapat diberikan pada ternak berbagai umur dengan dua dosis melalui konjungtiva dan tanpa menghasilkan respon antibodi persisten respon. Vaksin S19 mampu menurunkan kejadian bruselosis pada sapi lebih dari 85%. Menurut Geong dan Robetson (2000) pemberian vaksin S19 pada sapi bali terbukti dapat menurunkan kejadian abortus dan still births. Titer antibodi yang dengan vaksin S19 mampu bertahan hingga 10 bulan. Pemberian vaksin S19 tidak terdeteksi pada sapi dara setelah 240 hari dan 90 hari pada pedet dengan menggunakan ELISA. Vaksinasi pada kerbau terdeteksi setelah 30 hari pascavaksinasi dan tidak terdeteksi setelah 300 hari dengan menggunakan RBT (Munir 2009).
Vaksin dari B. abortus strain 45/20 vaksin diberikan dengan dua dosis dengan respon imun lebih rendah dari S19. Vaksin dari strain RB51 dari mutant yang resisten terhadap rifampisin (Smith & Cutler 2004) merupakan vaksin live
(dilemahkan) yang berasal dari strain rough B.abortus dan mulai digunakan di Amerika Serikat pada tahun 1996 Vaksinasi dengan RB51 tidak menghasilkan titer antibodi yang dapat diukur oleh uji serologik konvensional. Dosis vaksin dari
smoth Brucella lebih tinggi dari pada vaksin yang berasal dari rough ( Barbier et al. 2011).
Saat ini telah ditemukan protein imunogenik dari B. abortus yang dapat digunakan sebagai material vaksinasi dan uji serologik. Protein 18 dari protein imunogenik B. abortus 1119-3 terbukti mempunyai spesifisitas tinggi apabila digunakan sebagai antigen dalam uji serologik serta sebagai material untuk vaksinasi yang tidak akan terdeteksi dengan metode serologik (Yuk Ko et al.
BAHAN DAN METODE
Rancangan Penelitian
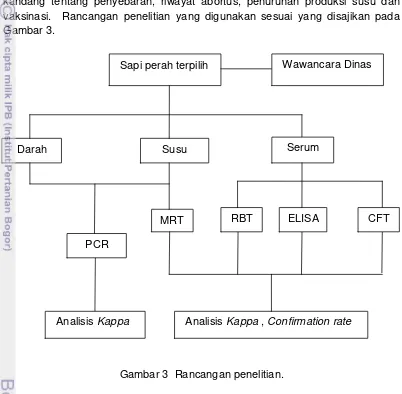
[image:49.595.110.512.202.596.2]Penelitian ini membandingkan metode uji dengan jenis sampel yang berbeda untuk deteksi B. abortus. Sebagai data pendukung dilakukan wawancara dengan dinas dan instansi terkait, pemilik dan penanggung jawab kandang tentang penyebaran, riwayat abortus, penurunan produksi susu dan vaksinasi. Rancangan penelitian yang digunakan sesuai yang disajikan pada Gambar 3.
Gambar 3 Rancangan penelitian.
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2011 sampai dengan bulan Maret 2012 bertempat di Laboratorium Karantina Hewan Balai Besar Uji Standar Karantina Pertanian (BBUSKP). Pengujian sampel dengan menggunakan metode CFT dilakukan di Balai Besar Penelitian Veteriner (BBalitvet) Bogor. Pengambilan sampel dilakukan di Propinsi Jawa Barat berdasarkan data penyebaran bruselosis.
Darah Susu Serum
Sapi perah terpilih
RBT MRT
PCR
Analisis Kappa , Confirmation rate
ELISA CFT
Analisis Kappa
Bahan dan Alat
Bahan yang digunakan untuk pengujian serologis dengan metode RBT adalah antigen RBT (Synbiotic), serum kontrol positif dan negatif, sedangkan metode MRT menggunakan antigen MRT (BBalitvet), sampel standar positif dan negatif. Bahan yang digunakan untuk metode ELISA adalah kit ELISA yang terdiri dari plat mikro dengan coating (lapisan) antigen, konjugat, serum kontrol positif dan negatif, wash solution (larutan pencuci), substrat, larutan penghenti (stop solution) dan adhesive film (film perekat). Bahan yang digunakan untuk metode CFT adalah saline water (air salin), komplemen, hemolisin, antigen CFT, serum standard, eritrosit domba dan microplate (plat mikro) dasar U.
Bahan yang digunakan untuk ekstraksi metode PCR adalah QIAamp DNA mini kit yang terdiri dari proteinase K, buffer AL, buffer AW1, buffer AW2, buffer
AE, mini spin column (kolom mini spin), dan collection tube, sedangkan bahan
mastermix yang digunakan adalah platinum PCR supermix high fidelity. Kontrol
positif dalam metode PCR digunakan kultur Brucella spp.dalam darah yang berasal dari koleksi BBalitvet Bogor. Bahan elektroforesis metode PCR yang digunakan terdiri dari PCR grade water, TAE, agarose gel , ethidium bromide,
blue loading dye, marker 100 bp. Bahan tambahan yang digunakan dalam
penelitian ini adalah alkohol absolute, alkohol 70%, aquabidesttilata, grade
biomolecular water dan tissue. Primer yang akan digunakan dalam penelitian ini
terdiri dari tiga pasang primer yang disajikan dalam Tabel 4.
Tabel 4 Daftar primer (Leal-Klevezas et al. 2000; Romero & Lopez-Goni 1999; Bailey et al. 1992)
Nama Sequence 5’-3’ Gen sequences Produk (bp) JPF GCG CTC AGG CTG CCG ACG CAA
Omp2 193
JPR ACC AGC CAT TGC GGT CGG TA F4 TCG AGC GCC CGC AAG GGG
16S rRNA 905 R2 AAC CAT AGT GTC TCC ACT AA
B4 TGG CTC GGT TGC CAA TAT CAA
Peralatan yang digunakan untuk pengujian serologik dengan metode RBT dan MRT adalah plat RBT, milk column, batang pengaduk kaca, pipet tunggal 50 µl. Pengujian serologik dengan metode ELISA menggunakan peralatan seperti ELISA reader, microshaker (pengocok mikro), gelas ukur 50 ml, erlemeyer 100 ml, multichannel pipette (pipet jamak) 300 µl, pipet tunggal 10-100 µl dan 50-200 µl. Peralatan yang digunakan dengan metode CFT adalah penangas air,
inkubator shaker (pengocok), sentrifuge cooler (sentrifus dingin) dan tabung falkon 15 ml. Peralatan yang digunakan untuk metode PCR adalah
thermacychler, biosafety cabinet Level II, PCR chumber, tabung mikrotub 1.5 ml, PCR tube 0.2 tutup datar, ART tips, sarung tangan bebas powder, sentrifus mikro, gel elektroforesis dan transiluminator. Sedangkat peralatan yang digunakan dalam pengambilan sampel adalah venoject plain, venoject dengan
ethylen diamin tetra acetic acid (EDTA), needle veno (jarum veno), ice box
(termos es), ice pack (es pendingin) dan tabung palstik 50 ml. Peralatan pendukung yang digunakan untuk pengujian adalah deep freezer (lemari pendingin) suhu -20 °C, yellow tip (tip kuning), blue tip, (tip biru) inkubator O2,
inkubator CO2 dan refrigerator (lemari pendingin).
Jenis Sampel
Sampel diambil dari sapi perah dengan minimal satu kriteria sebagai berikut, pernah mengalami keguguran, terlihat gejala radang persendian, higroma, penurunan produksi susu, retensi uterus atau conception rate lebih dari 3 kali. Jumlah sampel yang akan diambil sebanyak 60 menurut ISO:16140 (ISO 2003). Jenis sampel yang diambil adalah serum untuk mendeteksi antibodi dengan menggunakan metode RBT, ELISA dan CFT. Sedangkan sampel darah, dan susu segar untuk mendeteksi adanya antigen bakteri dengan metode PCR, selain untuk PCR susu segar juga digunakan untuk uji MRT. Sampel darah sapi diambil 10 ml, dimana 3 ml ditampung dalam tabung tanpa antikoagulan, sedangkan 7 ml ditampung dalam tabung dengan antikoagulan EDTA (Hafez et al. 2011). Darah tanpa antikoagulan diambill serumnya dengan cara didiamkan dengan posisi miring dan dijauhkan dari sinar matahari langsung selanjutnya disimpan pada suhu -20 °C. Darah dengan antikoagulan disimpan pada suhu 4 °C sebelum dilakukan preparasi.
menggunakan povidone idodida. Pancaran susu segar pertama kali dibuang baru kemudian ditampung untuk sampel (OIE 2009). Susu segar ditampung dalam tabung steril 15 ml dan tertutup rapat. Pemerahan untuk pengambilan sampel dilakukan pada keempat ambingnya (Longo et al. 2009). Pengujian MRT diambil sebanyak 5 ml, sedangkan untuk pengujian PCR diambil sebanyak 10 ml. Susu segar untuk pengujian MRT disimpan pada suhu 4 °C sedangkan untuk PCR pada suhu -20 °C sebelum dilakukan pengujian (Hamdy & Amin 2002).
Prosedur Pengujian
Prosedur MRT
Sampel susu segar dan antigen MRT sebelum dilakukan uji MRT diletakkan pada suhu ruang (22 ± 4 °C). Susu segar segar utuh dipipet sebanyak 1–2 ml dan dimasukkan dalam milk column. Antigen dikocok secara perlahan terlebih dahulu sebelum digunakan dan ditambahkan sebanyak 30-50 μl. Inkubasi pada suhu 37 °C selama 1 jam atau semalam pada 4 °C dengan sampel standard negatif dan positif. Pembacaan hasil positif kuat ditandai dengan adanya cincin biru gelap di atas diatas milk column (OIE 2009). Pembacaan hasil MRT positif kuat ditandai dengan adanya cincin biru gelap di atas milk column.
Prosedur RBT
Sampel serum dan antigen RBT sebelum dilakukan uji RBT diletakkan pada suhu ruang (22 ± 4 °C). Serum sampel dan kontrol positif serta negatif dipipet sebanyak 25–30 μl dan diletakkan pada plate RBT. Antigen dikocok secara perlahan terlebih dahulu sebelum digunakan dan ditambahkan sama banyak dengan serum. Campuran serum dan antigen dilakukan homogenisasi membentuk lingkaran atau oval dengan diameter 2 cm menggunakan batang pengaduk kaca pada masing-masing sampel. Inkubasi pada suhu ruang selama 4 menit. Pembacaan adanya aglutinasi RBT setelah 4 menit masa inkubasi, sampel dinyatakan positif apabila terjadi gumpalan seperti pasir (OIE 2009).
Prosedur ELISA
(pencuci pekat) dengan aqua bidestilata 1:10 untuk mendapatkan larutan pencuci. Larutan pencuci sebanyak 90 μl dipipet ke dalam plat mikro sesuai dengan jumlah sampel dan kontrol. Kontrol dan sampel masing-masing ditambahkan sebanyak 10 μl sehingga konsentrasi larutan menjadi 1:10. Campuran dihomogenkan secara perlahan dengan menggunakan pengocok mikro. Plat mikro ditutup dengan film perekat dan diinkubasi selama 60 ± 5 menit pada suhu 37 ± 2 °C pada inkubator. Campuran dalam plat mikro dibuang dan ditambahkan larutan pencuci pekat yang telah diencerkan dengan aqua
bidestilata dengan perbandingan 1:10 sebanyak 300 μl pada masing-masing
sumur dalam plat mikro. Larutan pencuci dibuang dan palt mikro dikeringkan dengan kertas penyerap.
Pencucian dengan lautan pecuci diulangi sebanyak tiga kali. Konjugat diencerkan dengan larutan pencuci dengan perbandingan 1:10 kemudian ditambahkan 100 μl pada tiap-tiap sumur. Inkubasi dilakukan pada suhu 37 °C selama 60 menit. Inkubasi selesai pencucian dilakukan kembali seperti prosedur pencucian sebelumnya. Tahapan selanjutnya ditambahkan substrat sebanyak 100 μl dan dilakukan homogenisasi secara perlahan. Inkubasi dilakukan selama 30 menit di tempat yang terlindung dari cahaya. Larutan penghenti ditambahkan sebanyak 100 μl dan dilakukan pembacaan dengan elisa reader pada panjang gelombang 450 nm. Interpretasi hasil ELISA didapatkan apabila hasil pembagian antara optical density (OD) sampel dikurangi OD kontrol negatif dengan OD kontrol positif dikurangi dengan OD kontrol negatif. Hasil di atas di buat dengan persentase, untuk sampel invidu hasil positif mengandung titer antibodi B. abortus apabila hasilnya lebih besar sama dengan 80%.
Prosedur CFT
Tahap pertama adalah reaksi Ag Brucella dan contoh serum dicampur sejumlah komplemen menggunakan serum marmut normal (komplemen) dengan konsentrasi 10%. Jika contoh serum mengandung antigen terhadap Brucella
adalah darah domba yang telah dilapisi antibodi terhadap B. abortus. Sistem indikator atau hemolisin terdiri dari sel darah domba (konsentrasi 3%) yang dilapisi antibodi terhadapnya. Penghancuran sel darah domba yang telah dilapisi hemolisin (sistem indikator) dengan menggunakan hemolisin (pengenceran 1:100) dan hemolisin (pengenceran 1:150).
Reaksi komplemen dan hemolisin dilakukan dalam tabung reaksi 10 ml. Titrasi hemolisintabung reaksi sebanyak dua belas disusun menjadi dua baris (A dan B). Baris A nomor ganjil yaitu 1, 3, 5, 7, 9 dan 11 dan baris B nomor genap yaitu 2, 4, 6, 8, 10 dan 12. Baris A dan baris B merupakan gambaran titrasi hemolisin. Larutan dari ke enam tabung dihomogenkan dengan cara menggoyang rak tabung reaksi, kemudian di inkubasikan dalam penangas air selama 30 menit pada suhu 37 oC. Pada masing-masing tabung kemudian ditambahkan 0,25 ml komplemen 10%, diikuti dengan menambahkan 0,25 ml sel darah domba 3%. Tabung reaksi disusun kembali menjadi satu baris dengan nomor yang berurutan (1-12), larutan dihomogenkan dan diinkubasikan kembali selama 30 menit pada suhu 37 oC.Sistem indikator atau hemolisin terdiri dari sel darah merah domba yang dilapisi antibodi terhadap B. abortus. Adanya antigen dan antibodi yang homolog, ditandai dengan pengendapan eritrosit dari sistem indikator (reaksi pengikatan komplemen positif).
Sebaliknya, tidak adanya kesesuaian antara antigen dan antibodi akan ditandai dengan lisisnya eritrosit dari sistem indikator (reaksi komplemen negatif). Tabung reaksi sebanyak enam buah disusun dalam satu baris dan diberi nomor berurut dari 1 sampai 6. Larutan dihomogenkan dengan cara menggoyang rak tabung reaksi, kemudian diinkubasikan dalam penangas air selama 10 menit pada suhu 37 oC. Pada reaksi pengikatan komplemen