METHOD VALIDATION AND VERIFICATION FOR LACTIC ACID
BACTERIA ANALYSIS IN MILK PRODUCTS
Iin Wahyuni, Harsi D. Kusumaningrum
Departement of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia.
Phone: +62 856 42203058, e-mail : iin.khumairah@gmail.com
ABSTRACT
Lactic acid bacteria (LAB) is a group of bacteria that capable converting carbohydrates (glucose) into lactic acid and mostly grow at facultatif anaerobic condition. At present, the most widely method used to enumerate LAB in some laboratory in Indonesia is incubation in aerob condition. In order to ensure that the method has a good performance, there is a need of method validation. Validation is the confirmation by examination and provision of objective evidence that particular requirements for specified intended use are fulfilled. The purpose of this study is to validate the quantitative method for enumeration of lactic acid bacteria. Two methods of enumeration of LAB in yoghurt were studied, i.e. ISO 7889-2003(E) as a reference method and SNI 2981-2009 as an alternative method. The principle of this method is to grow the facultative anaerobic bacteria in aerobic and anaerobic condition incubated for 3 days at 37 oC on MRSA media. The anaerobic condition was made using Anaxomat jar whose enrich with 10% CO2. The result obtained by these
two method were compared. Therefore several parameters such as precision (RSD), relative accuracy, linearity, limit of detection, and limit of quantification were evaluated. The results showed that RSD of these methods between 0.44% and 3.03%, percent recovery of these methods between 97% and 101%, and limit of detection are 3 cfu/mL. It can be concluded that these two methods have good performance characteristics.
IIN WAHYUNI. F24080078. Validasi dan Verifikasi Metode Analisis Bakteri Asam Laktat pada Produk Susu. Di bawah bimbingan : Dr. Ir. Harsi D. Kusumaningrum. 2013.
RINGKASAN
Bakteri asam laktat merupakan bakteri yang umumnya bersifat fakultatif anaerob. Bakteri ini umumnya mampu tumbuh dengan atau tanpa oksigen. Dalam menghitung jumlah bakteri tersebut diperlukan suatu metode yang valid, sehingga diperlukan adanya validasi metode. Pada penelitian ini dilakukan validasi metode analisis yaitu SNI 2981-2009 sebagai metode alternatif dan ISO 7889-2003(E) sebagai metode acuan. Kedua metode tersebut merupakan metode yang digunakan untuk menghitung jumlah bakteri kultur starter yogurt yang merupakan bakteri asam laktat. Prinsip dari kedua metode tersebut adalah pertumbuhan bakteri fakultatif anaerob pada media MRSA dengan suhu inkubasi 37 oC selama tiga hari. Berdasarkan metode SNI inkubasi dilakukan secara aerob sedangkan menurut metode ISO inkubasi dilakukan secara anaerob.
Penelitian ini bertujuan memperoleh data validasi metode analisis bakteri asam laktat pada susu, khususnya genus Lactobacillus dan membandingkan kedua metode pengujian bakteri asam laktat dengan parameter linieritas, presisi, relatif akurasi, dan limit deteksi. Penelitian dilakukan dengan beberapa tahapan yaitu tahap persiapan kultur inokulum, tahap validasi, dan tahap verifikasi terhadap beberapa sampel susu komersial. Penentuan relatif akurasi, presisi, dan linieritas dilakukan sebanyak lima kali ulangan dengan lima konsentrasi inokulum dari rendah hingga tinggi yaitu 0, 102, 104, 106,dan 108 cfu/mL. Tahap penentuan limit deteksi dan limit kuantifikasi dilakukan sebanyak enam kali ulangan dengan tiga tingkat konsentrasi inokulum rendah yaitu 3, 30, dan 60 cfu/mL. Tahapan terakhir yaitu penerapan metode tervalidasi untuk menganalisis beberapa sampel susu komersial yaitu susu cair, susu fermentasi, dan susu bubuk.
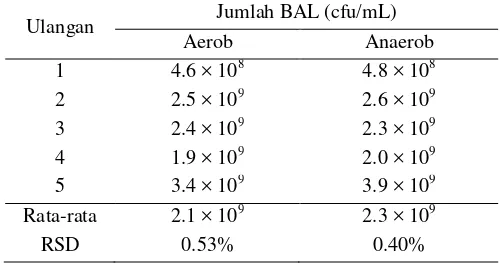
Penghitungan jumlah koloni bakteri didasarkan pada aturan SNI dan ISO. Berdasarkan metode ISO jumlah koloni yang masuk ke dalam perhitungan yaitu berkisar antara 15 sampai 300 koloni, sedangkan menurut SNI adalah 25 sampai 250 koloni. Berdasarkan hasil tahap penentuan jumlah kultur uji awal yaitu Lactobacillus bulgaricus yang dilakukan sebanyak lima kali ulangan diperoleh rata-rata sebesar 2.1 × 109 cfu/ml untuk inkubasi secara aerob dan 2.3 × 109 cfu/ml untuk inkubasi secara anaerob. Jumlah kultur awal ini yang dijadikan acuan pengenceran yang dilakukan. Berdasarkan hasil penghitungan jumlah kultur awal diketahui bahwa untuk metode aerob RSD hitung (0.53%) dan untuk metode anerob memiliki RSD hitung sebesar 0.40%.
Relatif akurasi dinyatakan dalam bentuk persen perolehan kembali (recovery). Nilai recovery untuk metode SNI dari keempat tingkatan yaitu 102, 104, 106,dan 108 cfu/mL berturut-turut 98%, 98%, 101%, dan 99%, sedangkan metode ISO 98%, 97%, 100%, dan 99%. Berdasarkan nilai persen recovery ini keakuratan dari kedua metode dapat diterima karena telah memenuhi persyaratan AOAC (2002) yaitu berada di rentang 80 hingga 120%.
Presisi dalam penelitian ini dinyatakan dalam nilai relative standard deviation (RSD). Pada penetuan nilai RSD dengan mengacu pada aturan SNI (25 sampai 250 koloni/cawan) diperoleh nilai RSD pada tingkat inokulum untuk metode SNI (aerob) berturut-turut 2.47%, 1.90%, 1.07%, dan 0.74%, sedangkan untuk metode ISO (anaerob) sebesar 2.09%, 1.31%, 1.38%, dan 0.44%. Dilihat dari nilai RSD, tiga dari empat tingkatan inokulum metode ISO memiliki RSD yang lebih kecil dari metode SNI. Hal ini menunjukkan bahwa ketelitian dari metode ISO lebih baik dari pada metode SNI.
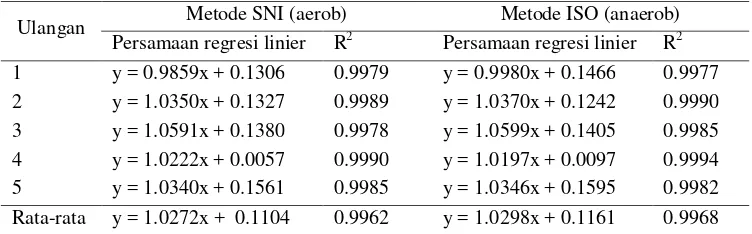
Analisis linearitas dilakukan dengan menggunakan kurva linear dan persamaan garis yang menggambarkan hubungan antara logaritma jumlah inokulum yang ditambahkan kedalam susu dan jumlah sel yang diperoleh dari kedua metode. Persamaan garis untuk metode SNI , y = 1.0272x + 0.1104 dan ISO y = 1.0298x + 0.1161. Rata-rata nilai koefisien determinasi (R2) dari metode aerob dan anerob secara berturut-turut yaitu sebesar 0.9962 dan 0.9968. Nilai R2 yang mendekati 1 menunjukkan hubungan linearitas yang sangat baik. Nilai koefisien determinasi ini telah memenuhi aturan yang dipersyaratkan AOAC (2002) yaitu 0.9900.
Limit deteksi yang diperoleh dari kedua metode mencapai konsentrasi yang sangat kecil yaitu pada konsentrasi 3 cfu/mL masih dapat terdeteksi adanya koloni. Setelah dilakukan enam kali ulangan pada konsentrasi inokulum terkecil masih terdeteksi adanya bakteri asam laktat. Berdasarkan hasil perhitungan limit deteksi dan limit kuantifikasi dari persamaan linier diperoleh nilai masing-masing sebesar 2 cfu/mL dan 5 cfu/mL.
Hasil verifikasi metode pada beberapa jenis susu fermentasi menunjukkan bahwa pada inkubasi secara anaerob memiliki jumlah koloni yang lebih tinggi. Akan tetapi setelah dilakukan uji lanjut kedua metode baik metode ISO maupun metode SNI tidak berbeda nyata pada taraf signifikansi 5%. Hasil verifikasi menunjukkan bahwa kedua metode memiliki presisi yang baik ditandai dengan nilai RSD yang sangat kecil yaitu berkisar antara 0.19 dan 0.66%. Hal ini menunjukkan bahwa walaupun validasi dilakukan pada media MRSA dengan Lactobacillus bulgaricus sebagai mikroorganisme uji, tetapi metode dapat digunakan untuk menguji total BAL pada susu fermentasi. Hasil pengujian menunjukkan metode SNI (aerob) memiliki perameter uji yang baik seperti halnya metode ISO (anaerob), tetapi rentan dengan kontaminasi kapang terutama untuk sampel yang kemungkinan mengandung kapang.
I.
PENDAHULUAN
1.1
LATAR BELAKANG
Susu merupakan bahan pangan yang bergizi tinggi karena mengandung zat-zat makanan yang lengkap dan seimbang seperti protein, lemak, karbohidrat, mineral, dan vitamin yang sangat dibutuhkan oleh manusia. Kandungan gizi yang sangat tinggi ini menjadikan susu sebagai media yang sangat baik untuk pertumbuhan mikroba. Mikroba yang umumnya ditemukan pada susu yaitu bakteri asam laktat. Selain itu, bakteri asam laktat dapat juga ditambahkan pada susu untuk menghasilkan susu fermentasi.
Bakteri asam laktat adalah kelompok bakteri yang mampu mengubah karbohidrat (glukosa) menjadi asam laktat. Pada umumnya bakteri asam laktat dihubungkan dengan habitat yang kaya akan nutrisi seperti susu, daging, sayuran, tetapi beberapa merupakan mikroflora mulut, usus, dan vagina dari mamalia (Axelsson 2004). Bakteri asam laktat pada umumnya merupakan bakteri fakultatif anaerob yang dapat tumbuh pada kondisi dengan atau tanpa oksigen (Ray dan Bunia 2008). Akan tetapi ada sebagian bakteri asam laktat yang bersifat anaerob obligat yaitu genus Bifidobacterium, seperti Bifidobacterium longum, Bifidobacterium infantis, dan Bifidobacterium bifidum (Ballongue 2004).
Sejauh ini diketahui bahwa bakteri asam laktat tidak bersifat patogen dan aman untuk dikonsumsi sehingga dapat dipakai untuk meningkatkan kesehatan. Asam laktat yang dihasilkan bakteri asam laktat dalam saluran pencernaan dapat mencegah pertumbuhan bakteri yang merugikan dan sebagai kontrol pembuangan kotoran dengan cara merangsang dinding saluran pencernaan. Asam-asam organik seperti Asam-asam laktat dan Asam-asam asetat yang diproduksi bakteri Asam-asam laktat sebagai hasil fermentasi laktosa dalam susu dapat membantu aktivitas usus dengan merangsang peristaltis, meningkatkan kecernaan dan penyerapan (Widyastuti dan Sofarianawati 1999)
Jumlah bakteri asam laktat umumnya dipersyaratkan pada produk fermentasi tertentu, sehingga untuk mengetahui jumlah bakteri asam laktat pada produk tersebut diperlukan suatu pengujian laboratorium. Pengujian ini harus dilakukan dengan menggunakan metode yang valid/baku, untuk itu diperlukan validasi sebelum metode digunakan. Menurut Sukarno (2005), validasi diperlukan untuk mendapatkan hasil analisis yang valid/absah, dapat dipercaya, dapat dipertanggungjawabkan secara ilmiah, dan kesesuaian dengan tujuan.
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk memenuhi syarat sesuai tujuan penggunaan atau konfirmasi melalui pengujian dan bukti syarat obyektif agar persyaratan untuk maksud khusus dipenuhi (Sac-Singlas 2002). Menurut ISO/IEC 17025-2005, laboratorium harus memvalidasi metode tidak baku, metode yang didesain/dikembangkan oleh laboratorium, metode baku yang digunakan di luar lingkup yang dimaksudkan, dan penegasan serta modifikasi dari metode baku untuk mengkonfirmasi bahwa metode itu sesuai dengan penggunaan yang dimaksudkan. Validasi primer dilakukan jika laboratorium menggunakan metode analisis baru hasil pengembangan, atau metode yang dimodifikasi terhadap suatu metode standar. Validasi sekunder dilakukan untuk verifikasi jika laboratorium menggunakan atau mengadopsi metode standar yang telah divalidasi.
2 Menurut ISO 16140-2003 parameter kinerja yang harus divalidasi adalah akurasi, presisi, penetapan batas terendah dari kisaran hitung (limit deteksi), limit kuantitasi, dan linieritas.
Pengujian jumlah bakteri asam laktat pada penelitian ini dilakukan dengan menggunakan metode yang mengacu pada ISO 7889-2003(E) dan SNI 2981-2009 tentang penghitungan jumlah bakteri kultur starter pada yogurt. Perbedaan dari kedua metode ini adalah pada kondisi inkubasi untuk ISO inkubasi dilakukan secara anaerob dan SNI secara aerob. Kedua perlakuan tersebut dibandingkan hasilnya sehingga didapatkan metode yang valid.
1.2
TUJUAN PENELITIAN
Penelitian ini bertujuan :
1. Melakukan validasi metode analisis pengujian bakteri asam laktat pada susu cair, khususnya Lactobacillus bulgaricus.
2. Membandingkan metode pengujian bakteri asam laktat metode SNI 2981-2009 dan ISO 7889-2003(E) dengan parameter relatif akurasi, presisi, linieritas, limit deteksi dan limit kuantifikasi. 3. Menerapkan metode uji tervalidasi untuk pengujian bakteri asam laktat pada produk susu.
1.3
MANFAAT PENELITIAN
II.
TINJAUAN PUSTAKA
2.1
SUSU DAN PRODUK SUSU
Susu adalah cairan yang berasal dari ambing sapi sehat dan bersih. yang diperoleh dengan cara pemerahan yang benar, kandungan alaminya tidak dikurangi atau ditambah sesuatu apapun dan belum mendapat perlakuan apapun kecuali proses pendinginan tanpa mempengaruhi kemurniannya (BSN 1998). Susu merupakan bahan pangan yang bergizi tinggi karena mengandung zat-zat makanan yang lengkap yaitu protein, lemak, karbohidrat, vitamin, dan mineral yang sangat diperlukan oleh tubuh manusia. Kandungan gizi susu secara lengkap seperti yang ditampilkan pada Tabel 1. Susu mempunyai peranan yang strategis dalam kehidupan manusia karena mengandung komponen gizi yang lengkap serta kompleks.
Tabel 1. Komposisi susu sapi segar
No. Komponen Konsentrasi (g/liter)
1. Lemak 37
Trigliserida 35.15-35.5
Digliserida 0.48-0.59
Asam lemak bebas 0.04-0.18
Total pospolipid 0.3-0.37
2. Protein 34
Casein 26
α S1 11.1
α S2 1.7
8.2
1.2
κ 3.7
Whey protein 0.7
α –lactalbumin 3.0
–lactoglobulin 0.3
serum albumin 0.6
Immunoglobulins 1.9
3. Non-Protein Nitrogen 1.9
4. Laktosa 45
5. Asam sitrat 1.75
6. Abu 7.0
7. Kalsium 1.25
8. Pospor 0.96
Sumber : Adams & Moss (2008)
4 Streptococcus, Lactobacillus, Microbacterium, Oerskavia, Propionibacterium, Micrococcus, Proteus, Pseudomonas, Bacillus, Listeria, dan sedikitnya satu jenis bakteri koliform (Jay 2000).
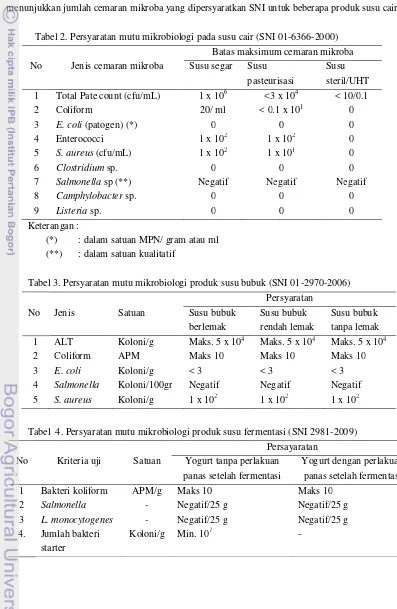
Susu memiliki water activity (aw) yang tinggi, pH netral (6.4-6.6), dan nutrien yang tinggi yang membuat susu menjadi media yang sangat baik untuk pertumbuhan mikroba (Adams dan Moss 2008). Kandungan nilai gizi yang tinggi pada susu merupakan media yang sangat disukai oleh mikroba untuk pertumbuhannya, sehingga apabila tidak dilakukan penanganan yang tepat susu akan mudah rusak oleh kehadiran mikroba. Untuk itu susu biasanya telah mengalami pengolahan seperti susu pasteurisasi, susu kental manis, susu UHT, susu fermentasi, maupun susu bubuk. Tabel 2, 3, dan 4 menunjukkan jumlah cemaran mikroba yang dipersyaratkan SNI untuk beberapa produk susu cair.
Tabel 2. Persyaratan mutu mikrobiologi pada susu cair (SNI 01-6366-2000)
No Jenis cemaran mikroba
Batas maksimum cemaran mikroba Susu segar Susu
pasteurisasi
Susu steril/UHT 1 Total Pate count (cfu/mL) 1 x 106 <3 x 104 < 10/0.1
2 Coliform 20/ ml < 0.1 x 101 0
3 E. coli (patogen) (*) 0 0 0
4 Enterococci 1 x 102 1 x 102 0
5 S. aureus (cfu/mL) 1 x 102 1 x 101 0
6 Clostridium sp. 0 0 0
7 Salmonella sp (**) Negatif Negatif Negatif
8 Camphylobacter sp. 0 0 0
9 Listeria sp. 0 0 0
Keterangan :
(*) : dalam satuan MPN/ gram atau ml (**) : dalam satuan kualitatif
Tabel 3. Persyaratan mutu mikrobiologi produk susu bubuk (SNI 01-2970-2006)
No Jenis Satuan
Persyaratan Susu bubuk berlemak Susu bubuk rendah lemak Susu bubuk tanpa lemak 1 ALT Koloni/g Maks. 5 x 104 Maks. 5 x 104 Maks. 5 x 104
2 Coliform APM Maks 10 Maks 10 Maks 10
3 E. coli Koloni/g < 3 < 3 < 3
4 Salmonella Koloni/100gr Negatif Negatif Negatif 5 S. aureus Koloni/g 1 x 102 1 x 102 1 x 102
Tabel 4. Persyaratan mutu mikrobiologi produk susu fermentasi (SNI 2981-2009)
No Kriteria uji Satuan
Persayaratan Yogurt tanpa perlakuan
panas setelah fermentasi
Yogurt dengan perlakuan panas setelah fermentasi
1 Bakteri koliform APM/g Maks 10 Maks 10
2 Salmonella - Negatif/25 g Negatif/25 g
3 L. monocytogenes - Negatif/25 g Negatif/25 g 4. Jumlah bakteri
starter
5
2.2
BAKTERI ASAM LAKTAT
Bakteri asam laktat adalah kelompok bakteri yang mampu mengubah karbohidrat (glukosa) menjadi asam laktat (Ray dan Bhunia 2008). Pada umumnya bakteri asam laktat dihubungkan dengan habitat yang kaya akan nutrisi seperti susu, daging, sayuran, tetapi beberapa merupakan mikroflora mulut, usus, dan vagina dari mamalia (Axelsson 2004). Bakteri asam laktat dapat disolasi dari saluran pencernaan atau air susu ibu hewan dan manusia dan atau buah terfermentasi. Salah satu yang berpontesi penghasil bakteri asam laktat adalah air susu ibu yang kaya akan nutrien yang menunjang untuk pertumbuhan bakteri asam laktat.
Bakteri asam laktat umumnya termasuk bakteri fakultatif anaerobik yang dapat tumbuh pada kondisi dengan atau tanpa oksigen. Bakteri asam laktat merupakan kelompok bakteri gram positif yaitu suatu mikroorganisme yang dapat menahan kompleks pewarna primer ungu kristal iodium. Bakteri asam laktat umumnya tidak membentuk spora, berbentuk bulat atau batang, tidak menghasilkan katalase, dan merupakan kemoorganotrof yang hanya bisa tumbuh pada media kompleks (Axelsson 2004).
Bakteri asam laktat erat kaitannya dengan fermentasi pangan secara tradisisonal dan termasuk golongan mikroorganisme yang aman untuk ditambahkan dalam pangan, karena sifatnya yang tidak toksik dan tidak menghasilkan toksin yang sering disebut dengan sebutan food grade microorganism atau disebut juga dengan mikroorganisme generally recognized as safe (GRAS) yaitu mikroorganisme yang tidak beresiko terhadap kesehatan (Holzapfel et al. 1995). Selain itu bakteri asam laktat juga termasuk bakteri probiotik yaitu mikroorganisme hidup yang bila diberikan dalam jumlah tertentu memberikan manfaat bagi inangnya seperti mencegah diare menjaga keseimbangan flora usus, mencegah kanker dan menurunkan kolesterol (Reid et al. 2003).
Sejauh ini diketahui bahwa bakteri asam laktat tidak bersifat patogen dan aman untuk dikonsumsi sehingga dapat dipakai untuk meningkatkan kesehatan baik manusia maupun ternak. Asam laktat yang dihasilkan bakteri asam laktat dalam saluran pencernaan dapat mencegah pertumbuhan bakteri yang merugikan dan sebagai kontrol pembuangan kotoran dengan cara merangsang dinding saluran pencernaan. Asam-asam organik seperti asam laktat dan asam asetat yang diproduksi bakteri asam laktat sebagai hasil fermentasi laktosa dalam susu dapat membantu aktivitas usus dengan merangsang peristaltis, meningkatkan kecernaan dan penyerapan (Widyastuti dan Sofarianawati 1999).
Terdapat 12 genus bakteri yang menunjukkan kemampuannya dalam menghasilkan asam laktat dari karbohidrat. Genus yang termasuk ke dalam grup bakteri asam laktat yaitu Lactococcus, Leuconostoc, Pediococcus, Lactobacillus, Streptococcus, Enterococcus, Aerococcus, Vagococcus, Tetragenococcus, Carnobacterium, Weisella, dan Oenococcus. Beberapa genus bakteri merupakan hasil pemisahan dari genus sebelumnya, sebagai contoh Lactococcus dan Enterococcus sebelumnya merupakan genus Streptococcus Grup N dan Grup D (Ray dan Bhunia 2008). Beberapa genus bakteri asam laktat yang umumnya dibahas diantaranya adalah Lactococcus, Lactobacillus, Streptococcus, Leuconostoc, Pediococcus, dan Bifidobacterium.
6 Lactobacillus merupakan bakteri yang berbentuk batang yang sangat beragam ukurannya ada yang berbentuk batang pendek maupun panjang dan merupakan bakteri fakultatif anaerob. Sebagian besar bakteri non-motil, mesofilik (tetapi ada sebagian yang psikotropik), dapat bersifat homo atau heterofermentatif. Bakteri dapat ditemukan pada tumbuhan, susu, daging, maupun feses. Ada beberapa spesies yang digunakan untuk menghasilkan produk pangan seperti Lactobacillus bulgaricus dan Lactobacillus plantarum, ada juga beberapa spesies yang merupakan probiotik seperti Lactobacillus casei, Lactobacillus reutei, dan Lactobacillus acidophilus. Sebagian ada yang menghasilkan bakteriosin yang dapat digunakan sebagai pengawet alami (Ray dan Bhunia 2008).
Streptococcus thermophilus merupakan bakteri asam laktat yang biasa digunakan untuk menghasilkan susu fermentasi. Bakteri ini merupakan bakteri Gram positif yang memiliki bentuk bulat dengan diameter 0.7 hingga 0.9 μm. Pertumbuhan optimum pada suhu 37 sampai 40 o
C, tetapi dapat juga tumbuh pada suhu 52 oC. Bakteri ini merupakan bakteri fakultatif anaerob dan pada larutan gula dapat menurunkan pH hingga 4.0 dan menghasilkan L(+)-lactic acid. Bakteri ini dapat memfermentasi manosa, fruktosa, dan laktosa, tetapi umumnya tidak dapat memfermentasi galaktosa dan sukrosa. Sel bakteri dapat bertahan pada suhu 60oC selama 30 menit. Habitat asli dari bakteri ini tidak diketahui tetapi bakteri ini dapat ditemukan secara alami di susu (Ray dan Bhunia 2008).
Leuconostoc merupakan bakteri Gram positif, berbentuk bulat, tidak membentuk spora, non motil, katalase negatif, dan bersifat fakultatif anaerob. Bakteri ini dapat tumbuh dengan baik pada suhu 20 sampai 30oC, dengan kisaran 1 sampai 37 oC. Glukosa difermentasi menjadi D(-)-lactic acid, CO2, ethanol atau asam asetat, dan menurunkan pH hingga 4.5 sampai 5.0. Jenis bakteri ini dapat tumbuh di susu tetapi tidak membuat susu mengental arginin tidak terhidrolisis. Sitrat dimanfaatkan untuk menghasilkan diasetil dan CO2. Leuconostoc ditemukan di tanaman, sayuran, susu, beberapa produk susu. dan daging segar atau yang sudah diolah (Axelsson 2004).
Pediococcus memiliki bentuk bulat dan membentuk tetrad tetapi ada yang berpasangan. Pediococcus tidak dijumpai dalam bentuk tunggal ataupun rantai. Bakteri ini termasuk bakteri Gram positif, non motil, tidak berspora, dan bersifat fakultatif anaerob. Bakteri tumbuh pada suhu 25 sampai 40oC, namun beberapa ada yang tumbuh pada suhu 50oC. Bakteri ini memfermentasi glukosa menjadi L(+)- atau DL-lactic acid dan beberapa dapat menurunkan pH hingga 3.6. Tergantung dari jenis bekteri, mereka dapat memfermentasi sukrosa, arabinosa, xilosa, dan ribosa. Laktosa umumnya tidak difermentasi, terutama pada susu dan tidak membuat susu menjadi mengental. Ada sebagian dari strain bakteri ini yang memiliki kemampuan hidrolisis laktosa yang lemah, terutama pada larutan yang berisi laktosa sebagai sumber karbohidratnya. Bakteri ini dapat ditemukan pada tanaman, sayuran, bir, silase, susu, sayuran fermentasi, daging, dan ikan tergantung dari jenisnya. Genus Pediococcus ini memiliki tujuh hingga delapan jenis bakteri (Ray dan Bhunia 2008).
7
2.3
METODE ANALISIS
Metode analisis dapat dikelompokkan menjadi lima kategori yaitu: (1) metode standar, (2) metode resmi, (3) metode pustaka, (4) metode yang dikembangkan oleh laboratorium, dan (5) metode yang dikembangkan oleh organisasi professional (Sukarno 2005).
Metode standar adalah metode yang dikembangkan oleh organisasi/badan standarisasi baik nasional maupun internasional. Metode ini dikerjakan oleh banyak ahli divalidasi oleh banyak laboratorium dan memiliki keakuratan tinggi. Contoh beberapa metode standar/baku/acuan antara lain: Standar Nasional Indonesia (SNI) yang dikembangkan oleh BSN, Bacteriological Analytical Manual (BAM) yang dikembangkan oleh US Food and Drug Administration, dan ISO yang dikembangkan oleh International Organization for Standarization.
Metode resmi adalah metode yang dipersyaratkan oleh undang-undang atau peraturan untuk digunakan oleh pemerintah atau organisasi/lembaga/ industri yang diatur oleh pemerintah. Metode yang dikembangkan oleh laboratorium adalah metode yang dirancang, diujicoba, dan divalidasi secara luas oleh suatu laboratorium sehingga metode tersebut dapat dipercaya dan memberikan hasil yang akurat. Laboratorium yang menggunakan metode baku acuan tidak perlu melakukan validasi primer (full validation) terhadap metode tersebut, tetapi cukup melakukan validasi sekunder (verifikasi). Validasi sekunder diperlukan dalam laboratorium yang hanya memverifikasi suatu metode agar dapat diterapkan untuk aplikasi analitik yang diinginkan (Sac-Singlas 2002).
Metode analisis dibedakan menjadi dua yaitu metode kualitatif dan metode kuantitatif. Metode kualitatif yaitu metode analisis yang responnya berupa ada atau tidaknya yang dideteksi baik secara langsung atau tidak langsung terhadap sejumlah sampel. Metode kuantitatif yaitu metode analisis yang responnya berupa jumlah analit, baik yang diukur secara langsung (misalnya : enumerasi jumlah mikroba) maupun secara tidak langsung (misalnya : nilai absorbans, intensitas warna ) terhadap sejumlah sampel (Feldsine et al. 2002). Beberapa contoh metode analisis mikrobiologi secara kualitatif antara lain: (1) uji langsung terhadap mikroba indikator, (2) metode alternatif ( Dye reduction, Electrical methods, ATP determination), (3) metode cepat deteksi mikroba spesifik dan toksinnya (metode imunokimia, metode biologi molekuler). Beberapa contoh metode analisis kuantitatif antara lain : (1) Angka Lempeng Total (Total Plate Count), (2) MPN (Most Probable Number), (3) uji potensi antibiotik, (4) uji sterilitas, (5) Uji koefisien fenol (uji disinfektan dan antiseptik), dan (6) uji efektifitas pengawet.
2.4
METODE ANALISIS BAKTERI ASAM LAKTAT
8 Media MRSA merupakan media selektif yang dikembangkan oleh de Man, Rogosa, dan Sharpe. Media ini sangat cocok digunakan untuk pertumbuhan bakteri asam laktat termasuk Lactobacillus, Pediococcus, dan Leuconoctoc (De Man 1960). Komposisi dari media MRSA yaitu pepton dari kasein, ekstrak daging, ekstrak yeast, D(+)-glukosa, dipotasium hidrogen fosfat, tween 80, diamonium hidrogen sitrat, sodium asetat, magnesium sulfat, mangan sulfat, dan agar. Pada pH rendah, amonium sitrat berfungsi untuk menghambat pertumbuhan sebagian besar mikroorganisme, namun memungkinkan pertumbuhan Lactobacillus. Dipotasium posfat dan sodium asetat adalah agen buffer yang mempertahankan pH rendah. Tween 80 merupakan emulsifier. Mangan dan magnesium sulfat adalah sumber ion dan sulfat. Pepton bakteriologis dan ekstrak daging sapi menyediakan nitrogen, vitamin, mineral, dan asam amino esensial untuk pertumbuhan. Ekstrak yeast merupakan sumber vitamin khususnya B kompleks. Meskipun media MRSA merupakan media selektif bagi bakteri asam laktat, tetapi ada sebagian kecil bakteri lain yang dapat tumbuh pada media tersebut seperti Escherichia coli (Tabel 5).
Tabel 5. Karakteristik kultur yang dapat tumbuh pada media MRSA
Organisme (ATCC) Pertumbuhan
Lactobacillus acidophilus (4356) ++ Lactobacillus fermentum (9338) ++
Bifidobacterium bifidum (11863) ++ (anaerob)
Escherichia coli (25922) -/+
Pseudomonas aeruginosa (27853) -/+
Dalam penelitian ini kondisi inkubasi bakteri dibuat secara anaerob dengan menggunakan jar anaxomat. Menurut penelitian Shahin et al (2002) bakteri yang bersifat anaerob memiliki pertumbuhan yang lebih optimum jika diinkubasi dalam jar anaxomat dari pada dengan jar anaerob konvensional. Bakteri dapat memiliki ukuran koloni yang lebih besar bila diinkubasi dalam suatu jar anaxomat. Jar anaxomat merupakan suatu jar yang dapat dikondisikan dengan kondisi mikroaerofilik maupun anaerob dengan komposisi gas yang dapat diatur.
Untuk mengisolasi bakteri asam laktat dari sampel biasanya digunakan media MRSA yang ditambahkan CaCO3. Isolasi bakteri asam laktat pada media MRSA yang mengandung CaCO3 sangat mudah karena ditandai dengan adanya zona terang di sekeliling koloninya. Adanya zona terang merupakan akibat diproduksinya asam yang menetralkan CaCO3 yang terdapat pada media selama pertumbuhan bakteri asam laktat tersebut (Widyastuti dan Sofarianawati 1999). Bakteri yang menunjukkan zona bening yang luas berarti memiliki efektifitas yang tinggi.
Penelitian ini menggunakan bakteri jenis Lactobacillus sehingga digunakan media MRSA dengan mengacu pada metode ISO 7889-2003(E) (kondisi anaerob) dan SNI 2981-2009 (kondisi aerob).
2.5
VALIDASI DAN VERIFIKASI METODE
9 luar lingkup yang dimaksudkan, dan (4) modifikasi dari metode baku, untuk mengkonfirmasi bahwa metode itu sesuai untuk penggunaan yang dimaksudkan. Validasi harus seluas yang diperlukan untuk memenuhi kebutuhan penerapan yang ditetapkan atau bidang penerapan. Laboratorium harus merekam hasil yang diperoleh, prosedur yang digunakan untuk validasi, dan pernyataan bahwa metode tersebut tepat untuk penggunaan yang dimaksud.
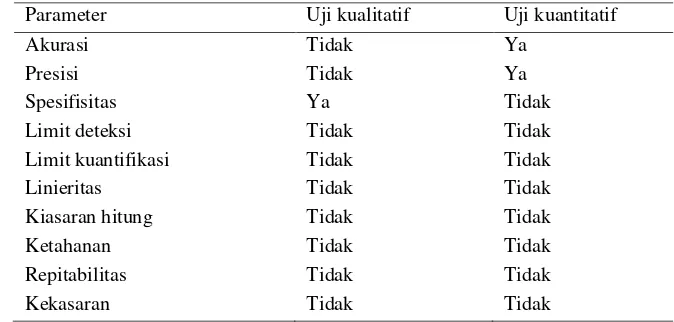
Verifikasi adalah proses konfirmasi kembali untuk menunjukkan metode sesuai dalam memenuhi kebutuhan laboratorium. Verifikasi diperlukan karena adanya perbedaan kondisi antara saat metode tersebut dibuat dengan metode tersebut diadopsi oleh suatu laboratorium. Tujuan verifikasi adalah untuk memastikan bahwa laboratorium atau personel penguji dapat menerapkan metode tersebut dengan baik ( ketersediaan peralatan, fasilitas pereaksi, penguji, keterampilan, dan kompetensi). Verifikasi juga bertujuan untuk menjamin mutu hasil pengujian. Menurut USP (2007) dalam Ismail (2009), dalam melakukan verifikasi terdapat beberapa parameter yang harus diukur, yaitu untuk pengujian kualitatif yang harus diukur adalah spesisfitas, sedangkan untuk pengujian kuntitatif yang harus diuji adalah akurasi dan presisi, seperti pada Tabel 6.
Tabel 6. Parameter verifikasi untuk uji mikrobiologi
Parameter Uji kualitatif Uji kuantitatif
Akurasi Tidak Ya
Presisi Tidak Ya
Spesifisitas Ya Tidak
Limit deteksi Tidak Tidak
Limit kuantifikasi Tidak Tidak
Linieritas Tidak Tidak
Kiasaran hitung Tidak Tidak
Ketahanan Tidak Tidak
Repitabilitas Tidak Tidak
Kekasaran Tidak Tidak
Sumber : USP (2007) dalam Ismail (2009)
Dalam ISO 16140-2003 disebutkan beberapa karakteristik kinerja yang harus diperhatikan dalam melakukan validasi metode kuantitatif yaitu akurasi, presisi, penetapan batas terendah dari kisaran hitung (limit deteksi), limit kuantifikasi, dan linieritas.
Akurasi adalah kemampuan suatu metode untuk mengukur suatu nilai yang aktual atau sebenarnya dari suatu analit, misalnya mikroba target. Apabila suatu analit (mikroba target) secara alami berada di dalam sampel atau di-spike ke dalam sampel sebagai bagian dari suatu tantangan atau uji profisiensi, metode tersebut harus mampu mendeteksi atau memunculkan kembali analit atau mikroorganisme tersebut dalam konsentrasi yang benar atau frekuensinya mendekati akurat. Akurasi biasanya dinyatakan sebagai persen recovery (Sac-Singlas 2002).
10 diperoleh dengan metode yang sama terhadap sampel uji yang identik dalam laboratorium yang berbeda dan peralatan yang berbeda atau dengan analis dan peralatan berbeda di dalam laboratorium yang sama. Untuk analisis dalam matriks biologis, presisi harus diukur pada minimum 5 kali pengukuran per konsentrasi (Sac-Singlas 2002).
Menurut ISO 16140-2003 batas terendah dari kisaran hitung (limit deteksi) adalah konsentrasi terendah dari mikroorganisme dalam contoh yang dapat terdeteksi, tetapi tidak terhitung sebagai nilai sebenarnya, di bawah kondisi pengujian yang disepakati. Limit kuantifikasi adalah konsentrasi terendah dari mikroorganisme yang dapat ditentukan dengan tingkat presisi dan akurasi yang dapat diterima di bawah kondisi pengujian yang disepakati.
Linieritas adalah kemampuan metode analisis yang menunjukkan bahwa larutan sampel yang berada dalam rentang konsentrasi memiliki respon analit yang proporsional dengan konsentrasi secara langsung atau melalui transformasi matematika. Linieritas biasanya dinyatakan dalam istilah variansi sekitar arah garis regresi yang dihitung berdasarkan persamaan matematik data yang diperoleh dari hasil uji analit dalam sampel dengan berbagai konsentrasi analit. Perlakuan matematik dalam pengujian linieritas adalah melalui persamaan garis lurus dengan metode kuadrat terkecil antara hasil analisis terhadap konsentrasi analit. Dalam beberapa kasus. untuk memperoleh hubungan proporsional antara hasil pengukuran dengan konsentrasi analit, data yang diperoleh diolah melalui transformasi matematik dulu sebelum dibuat analisis regresinya (Harmita 2004).
III.
METODOLOGI PENELITIAN
3.1
WAKTU DAN TEMPAT
Penelitian ini merupakan bagian dari kegiatan LDITP (Laboratorium Departemen Ilmu dan Teknologi Pangan). Salah satu syarat sebagai laboratorium terakreditasi ialah implemetasi metode uji yang sudah divalidasi sesuai dengan ketentuan pada ISO/IEC 17025:2005 butir 5.4. Penelitian dilaksanakan dari bulan Februari hingga September 2012. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Pangan, Departemen Ilmu dan Teknologi Pangan. IPB.
3.2
BAHAN DAN PERALATAN
Bahan utama yang digunakan dalam penelitian ini adalah susu sterilisasi UHT, susu bubuk, dan susu fermentasi komersil. Mikroba yang digunakan dalam validasi ini yaitu Lactobacillus bulgaricus FNCC 004P (koleksi Universitas Gadjah Mada). Media yang digunakan untuk pengujian adalah De Man Rogosa and Sharpe (MRS) agar (OXOID) dan MRSB. Larutan pengencer yang digunakan adalah Butterfields Phosphate-Buffered Dilution Water (BPB).
Peralatan yang digunakan dalam penelitian ini adalah cawan petri, pipet ukur 1 mL, 5 mL, dan 10 mL, pipet mikro, erlenmeyer, tabung reaksi, bunsen, vortex, inkubator 37±1 oC, otoklaf, oven/alat sterilisasi kering, dan jar anaxomat MARK II (MART® Microbiology BV).
3.3
METODE PENELITIAN
Pada penelitian ini akan dilakukan validasi metode alternatif terhadap metode baku. Metode alternatif yang digunakan yaitu metode SNI 2981-2009 bagian pengujian bakteri kultur strarter yogurt. sedangkan metode baku yang diacu adalah metode ISO 7889-2003(E) tentang penghitungan jumlah kultur starter pada yogurt.
3.3.1
Metode alternatif (SNI 2981-2009)
12
3.3.2
Metode acuan (ISO 7889:2003(E))
Pada metode ini terdapat dua prinsip pengujian jumlah bakteri kultur starter yogurt yaitu untuk Lactobacillus bulgaricus inkubasi dilakukan secara anaerob dengan media MRSA dan Streptococcus thermophilus secara aerob dengan media M17. Pada penelitian ini hanya dilakukan validasi bakteri genus Lactobacillus sehingga pengujian akan dilakukan secara anaerob dengan media MRSA.
Sebanyak 1 mL dari tiga tingkat pengenceran tertinggidimasukkan ke dalam cawan petri steril. Sebanyak 12 mL sampai dengan 15 mL media MRSA yang masih cair dengan suhu (45 ± 1) °C dituangkan ke dalam masing-masing cawan petri, kemudian semua cawan petri dimasukkan ke dalam suatu jar anaxomat dengan posisi terbalik. Jar anaerob yang telah diperkaya dengan gas CO2 kemudian diinkubasi ke dalam inkubator pada suhu 37 ± 1 °C selama 3 hari. Selanjutnya dilakukan pencatatan pertumbuhan koloni pada setiap cawan petri yang mengandung 15 koloni sampai dengan 300 koloni setelah 3 hari.
3.4
PROSEDUR VALIDASI METODE
3.4.1
Persiapan kultur uji (konfirmasi kemurnian kultur uji)
Kemurnian kultur stok acuan merupakan faktor penting yang harus diperhatikan dalam melakukan validasi metode analisis. Untuk memastikan kemurnian kultur stok acuan diperlukan konfirmasi. Dalam penelitian ini kultur murni yang digunakan adalah Lactobacillus bulgaricus FNCC 004P. Kultur stok yang digunakan perlu diperbaharui agar aktivitasnya tidak berkurang. Kultur stok dalam media MRSB yang yang disimpan terlalu lama dapat berkurang aktivitasnya karena habisnya substrat dan menumpuknya metabolit seperti asam.
Pemeliharaan kultur stok pada penelitian ini dilakukan dengan melakukan penusukan kultur pada media MRS agar semi solid, kemudian diinkubasi selama 24 jam pada suhu 37 oC. Setelah itu kultur yang telah diinkubasi tersebut dapat disimpan dalam lemari pendingin sebagai kultur stok dan dapat bertahan selama beberapa bulan.
Kultur yang akan digunakan terlebih dahulu harus disegarkan dalam media selektif. Sebanyak 1 ose dari kultur stok disegarkan ke dalam 10 mL MRSB, kemudian diinkubasi selama 18 sampai 24 jam pada suhu 37 oC. Kultur ini selanjutnya dikonfirmasi dengan pewarnaan Gram. Dengan pewarnaan Gram ini akan dipastikan bahwa bakteri merupakan bakteri Gram positif dan berbentuk batang.
3.4.2
Penghitungan jumlah bakteri asam laktat pada kultur uji
13 Kultur dalam MRSB yang sudah diinkubasi selama 24 jam selama 37oC kemudian diencerkan sampai 10-8. Selanjutnya dilakukan pemupukan pada tiga tingkat pengenceran tertinggi dengan media MRSA dengan kondisi aerob dan anaerob kemudian diinkubasi pada suhu 37°C selama 3 hari. Hasil yang diperoleh dalam tahap ini akan menentukan tingkat pengenceran yang akan digunakan dalam tahap validasi.
3.4.3
Persiapan sampel dan inokulasi kultur
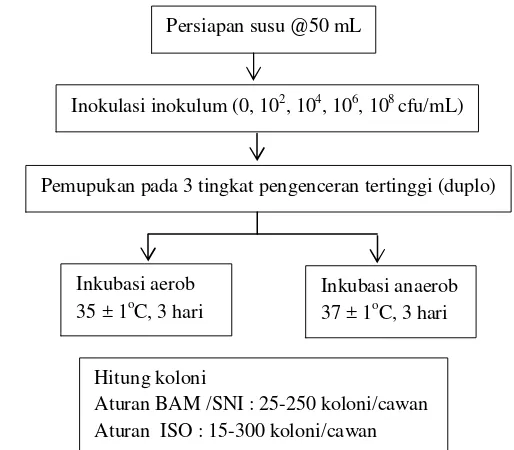
Tahap persiapan sampel dimulai dengan memasukkan sebanyak 50 mL contoh susu ke dalam erlenmeyer 100 mL steril dengan tutup aluminium. Selanjutnya dilakukan inokulasi kultur sehingga diperoleh konsentrasi sebesar 0, 102, 104, 106,dan 108 cfu/mL dan diaduk hingga homogen. Masing-masing sampel selanjutnya diencerkan sehingga diperoleh cawan yang memenuhi ketentuan untuk dihitung. Pemupukan dilakukan pada tiga tingkat pengenceran tertinggi dan masing-masing dilakukan duplo. Berdasarkan hasil perhitungan selanjutnya dapat ditentukan presisi, linieritas, dan relatif akurasi.
Persiapan susu @50 mL
Inokulasi inokulum (0, 102, 104, 106, 108 cfu/mL)
Pemupukan pada 3 tingkat pengenceran tertinggi (duplo)
Inkubasi aerob 35 ± 1oC, 3 hari
Inkubasi anaerob 37 ± 1oC, 3 hari
Hitung koloni
Aturan BAM /SNI : 25-250 koloni/cawan Aturan ISO : 15-300 koloni/cawan
14
3.4.4
Penerapan metode uji tervalidasi untuk analisis bakteri asam laktat
Kedua metode yang telah divalidasi selanjutnya digunakan untuk menghitung jumlah bakteri asam laktat dalam beberapa sampel susu. Jenis susu yang digunakan dalam verifikasi ini yaitu susu bubuk, susu cair steril, susu pasteurisasi, dan susu fermentasi.
Analisis untuk sampel padat dan semipadat yaitu contoh diaduk secara merata dengan menggunakan sendok steril atau alat lain sebelum pengambilan contoh uji. Sebanyak 10 gram contoh secara aseptis dan masukkan ke dalam erlenmeyer yang telah berisi 90 mL larutan pengencer sehingga diperoleh pengenceran 1 :10. Homogenkan dengan stomacher selama ± 2 menit. Ini merupakan larutan dengan pengenceran 10-1. Kemudian dibuat dengan pengenceran 10-2. 10-3 dan seterusnya sesuai kebutuhan dengan menggunakan larutan pengencer BPB.
Untuk sampel cair, contoh diaduk secara merata dengan menggunakan sendok steril atau alat lain sebelum pengambilan contoh uji. Contoh yang diuji dimulai dari pengenceran 100 (contoh tanpa pengenceran). Pengenceran dilakukan dengan mengambil 10 mL contoh dan diencerkan dengan 90 mL larutan pengencer BPB. Kemudian dibuat seri pengenceran 10-2, 10-3 dan seterusnya sesuai kebutuhan dengan menggunakan larutan pengencer BPB. Dari persiapan contoh, pipet 1 mL dari masing-masing pengenceran sesuai kebutuhan ke dalam cawan steril secara duplo. Tuangkan MRSA sebanyak 15 sampai 20 mL ke dalam cawan dan goyangkan cawan petri sedemikian sehingga campuran tersebar secara merata, biarkan sampai media memadat. Inkubasikan pada suhu 35 oC selama 3 hari pada posisi terbalik.
Hitung koloni
Aturan BAM /SNI : 25-250 koloni/cawan Aturan ISO : 15-300 koloni/cawan
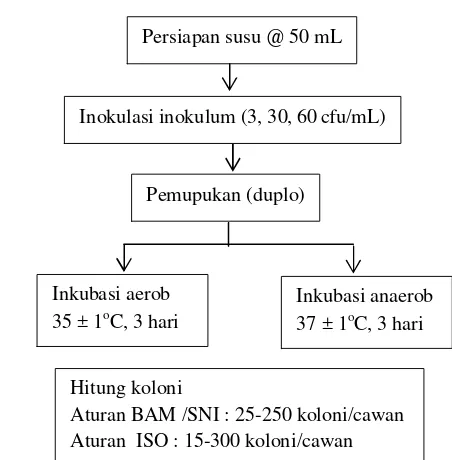
Persiapan susu @ 50 mL
Inokulasi inokulum (3, 30, 60cfu/mL)
Pemupukan (duplo)
Inkubasi aerob 35 ± 1oC, 3 hari
Inkubasi anaerob 37 ± 1oC, 3 hari
15
3.5
PENGOLAHAN DATA
3.5.1
Penghitungan jumlah koloni
Cawan yang masuk ke dalam perhitungan adalah cawan petri dengan jumlah koloni 25-250 koloni (SNI) dan 15-300 koloni (ISO) :
Rumus penghitungan jumlah koloni adalah sebagai berikut : N = ∑C/ [(1 × n1) + (0.1 × n2)] × d
Keterangan :
N = jumlah koloni per mL atau per gram ∑C = jumlah koloni dari tiap-tiap cawan
n1 = jumlah cawan petri dari pengenceran koloni yang bisa dihitung n2 = jumlah cawan petri dari pengenceran kedua
d = pengenceran pertama yang dihitung
3.5.2
Presisi
Presisi dapat ditentukan berdasarkan penghitungan standar deviasi relatif (RSD). Menurut Sac-Singlas (2002), standar deviasi relatif dihitung dengan rumus :
RSD = ∑ ( ( ) / ) ² Keterangan :
a1 = cawan 1 b1= cawan 2
(log a1- log b1)/x1 = perbedaan relatif antara hasil logaritma duplo i = 1, 2, 3, .... n
p = jumlah penentuan duplo (jumlah sampel uji)
Nilai RSD yang lebih dari 10% menandakan bahwa metode mengalami kesulitan tertentu (Sac-Singlas 2002).
3.5.3
Relatif akurasi
Akurasi diukur dengan persen perolehan kembali melalui uji komparatif. Persentasi perolehan kembali adalah banyaknya inokulum yang dapat diisolasi kembali dari sejumlah inokulum yang dimasukkan ke dalam sampel. Persen perolehan kembali dihitung dengan rumus berikut :
% recovery (R) = [(A-B)/C] x 100 Keterangan :
16
3.5.4
Linieritas
Linieritas dari kedua metode dinyatakan dalam bentuk persamaan garis linier y =a + bx. Peubah a menyatakan intersep dan b adalah kemiringan garis. Linearitas metode dilihat dari nilai koefisien determinasi (R2) yang diperoleh. Nilai R2 yang mendekati 1 menyatakan linieritas yang tinggi.
3.5.5
Limit deteksi dan limit kuantifikasi
Persamaan linier yang diperoleh pada uji linieritas selanjutnya digunakan untuk menghitung limit deteksi dan limit kuantifikasi. Limit deteksi dan limit kuantifikasi dihitung dari rerata kemiringan garis dan simpangan baku intersep kurva standar yang diperoleh dengan rumus berikut :
LOD = 3.3
LOQ = 10
dengan,
IV.
HASIL DAN PEMBAHASAN
4.1
KULTUR UJI
4.1.1
Kemurnian kultur
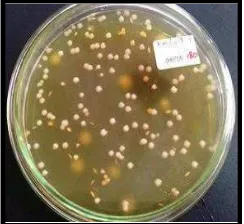
Kemurnian kultur uji merupakan faktor penting yang harus diperhatikan dalam melakukan validasi metode analisis karena dapat mempengaruhi hasil uji. Kultur uji yang akan digunakan dalam validasi harus diperiksa kemurniaannya dengan menggunakan media selektif dan pengamatan mikroskopik dengan pewarnaan Gram (Sac-Singlas 2002). Hasil konfirmasi kemurnian kultur dengan media selektif (MRSA) ditunjukkan dengan bentuk koloni yang seragam seperti yang terlihat pada Gambar 3. Koloni bakteri asam laktat yang tumbuh di permukaan media berbentuk bulat, berwarna putih, dan memiliki permukaan yang cembung. Beberapa koloni bakteri ada yang tumbuh di bagian tengah media dengan bentuk pipih seperti wijen dan ada sebagian kecil yang berada di dasar media.
Gambar 3. Koloni Lactobacillus bulgaricus pada media MRSA setelah inkubasi 3 hari pada suhu 37oC
Kultur uji yang digunakan pada penelitian ini adalah Lactobacillus bulgaricus yang merupakan bakteri Gram positif yang berbentuk batang. Dalam penelitian ini selain dilakukan konfirmasi kemurnian kultur dengan media selektif, dilakukan pula konfirmasi secara sederhana dengan pewarnaan Gram. Pada Gambar 4 terlihat bahwa hasil pewarnaan Gram menunjukkan bakteri berwarna ungu dan berbentuk batang. Bakteri Gram positif merupakan bakteri yang mampu mempertahankan warna ungu kristal sehingga ketika dilakukan pewarnaan Gram akan terlihat berwarna ungu.
18
4.1.2
Jumlah bakteri asam laktat pada kultur uji
Tabel 7. Jumlah awal kultur uji pada MRSB setelah inkubasi 24 jam pada suhu 37oC, dihitung pada media MRSA yang diinkubasi secara aerob dan anaerob
Ulangan Jumlah BAL (cfu/mL)
Aerob Anaerob
1 4.6 × 108 4.8 × 108
2 2.5 × 109 2.6 × 109
3 2.4 × 109 2.3 × 109
4 1.9 × 109 2.0 × 109
5 3.4 × 109 3.9 × 109
Rata-rata 2.1 × 109 2.3 × 109
RSD 0.53% 0.40%
Berdasarkan hasil pembuatan spike diketahui bahwa jumlah awal koloni bakteri Lactobacillus bulgaricus sebanyak 2.1 × 109 untuk inkubasi secara aerob dan 2.3 × 109 cfu/mL untuk inkubasi secara anaerob (Tabel 7). Jumlah koloni bakteri spike ini sukar dijaga konstan meskipun telah ditumbuhkan dengan kondisi yang sama. Akan tetapi setelah dilakukan lima kali ulangan diperoleh jumlah koloni bakteri yang berkisar pada angka 109 cfu/mL. Hasil yang didapat ini masih lebih tinggi dibandingkan dengan yang hasil penelitian dari Saccaro et al. (2011) yang hanya memperoleh 4.0 x 107 cfu/mL dengan media yang sama. Berdasarkan hasil penghitungan jumlah kultur awal diketahui bahwa untuk inkubasi aerob memiliki RSD hitung sebesar 0.53% dan untuk inkubasi anerob memiliki RSD hitung sebesar 0.40%. Jika RSD hitung lebih kecil dari 10%, maka metode tidak mengalami kesulitan-kesulitan yang artinya metode tersebut dapat diterima (Sac-Singlas 2002). Penghitungan jumlah koloni awal dapat dilihat pada Lampiran 1.
4.2
PARAMETER UJI TERVALIDASI
Validasi adalah konfirmasi melalui pengujian dan pengadaan bukti yang objektif bahwa persyaratan tertentu untuk suatu maksud khusus terpenuhi. Pada penelitian ini dilakukan validasi dua metode pengujian bakteri asam laktat, yaitu metode ISO 7889-2003(E) dan SNI 2981-2009. Kedua metode ini merupakan metode pengujian kultur strater pada yogurt. Metode ISO 7889:2003(E) menyebutkan bahwa pengujian bakteri kultur starter yogurt dilakukan dengan media MRSA, suhu inkubasi 37 oC, dan kondisi anaerob yaitu tanpa adanya oksigen. Untuk metode SNI 2981-2009 media yang digunakan adalah MRSA, suhu inkubasi 35 oC, dan kondisi aerob.
19
4.2.1
Akurasi
Akurasi adalah kemampuan suatu metode untuk mengukur suatu nilai yang aktual atau sebenarnya dari suatu analit, misalnya mikroba target (Sac-Singlas 2002). Akurasi biasanya dinyatakan dengan perolehan kembali atau persen recovery dari analit yang ditambahkan (Harmita 2004). Persentasi perolehan kembali adalah banyaknya inokulum yang dapat diisolasi kembali dari sejumlah inokulum yang dimasukkan ke dalam sampel.
Gambar 5. Jumlah koloni bakteri asam laktat yang diperoleh pada tiap tingkatan inokulum dengan perhitungan mengacu pada metode SNI (25-250 koloni/cawan), n = 5
Hasil perolehan jumlah koloni pada tiap tingkatan inokulum dapat dilihat pada Gambar 5. Dari empat tingkatan inokulum, tiga diantaranya menunjukkan bahwa inkubasi secara anaerob memiliki jumlah perolehan kembali yang lebih tinggi. Perolehan kembali yang tinggi ini menunjukkan bahwa bakteri lebih optimal pertumbuhannya pada kondisi anaerob. Hasil ini didukung dengan penelitian yang dilakukan oleh Mirlohi et al. (2008) yang menyatakan bahwa inkubasi secara anaerob menunjukkan hasil yang lebih tinggi dibandingkan dengan inkubasi secara aerob.
Gambar 6. Jumlah koloni bakteri asam laktat yang diperoleh pada tiap tingkatan inokulum dengan perhitungan mengacu pada metode ISO (15-300 koloni/cawan), n = 5
0.0 1.0 2.0 3.0 4.0 5.0 6.0 7.0 8.0 9.0
10² 10⁴ 10⁶ 10⁸
J
Inokulum (cfu/mL)SNI (aerob)
ISO (anaerob)
0.0 1.0 2.0 3.0 4.0 5.0 6.0 7.0 8.0 9.0
10² 10⁴ 10⁶ 10⁸
Jum
Inokulum (cfu/mL)SNI (aerob)
20 Perhitungan jumlah bakteri mengikuti aturan ISO diperoleh hasil yang tidak berbeda (Gambar 6) dengan penghitungan mengikuti aturan SNI. Pada Gambar 6 terlihat bahwa tiga dari empat tingkat inokulum yang dimasukkan dalam sampel juga menunjukkan bahwa cawan yang diinkubasi secara anaerob memiliki hasil yang lebih tinggi dibandingkan dengan yang diinkubasi secara aerob.
Hasil perhitungan persen recovery dari masing-masing tingkatan inokulum dapat dilihat pada Tabel 8 dan 9. Berdasarkan hasil perhitungan diketahui rata-rata nilai recovery tiap inokulum dari kedua metode berkisar antara 97 sampai 101%. Menurut AOAC (2002) nilai perolehan kembali ini masih berada pada kisaran yang ditetapkan yaitu 80-120%, sehingga dapat dikatakan bahwa metode ini mempunyai ketepatan yang baik. Dengan demikian kedua metode, ISO maupun SNI dapat diadopsi untuk keperluan analisis.
Tabel 8. Rata-rata persen perolehan kembali (n = 5) dengan perhitungan koloni mengacu pada metode SNI (25-250 koloni/cawan), pada kondisi aerob dan anaerob
No
Aerob Anaerob
Inokulum (log cfu/mL) Perolehan kembali (%) Inokulum (log cfu/mL) Perolehan kembali (%)
1 2.32 98 2.36 98
2 4.32 98 4.36 97
3 6.32 101 6.36 100
4 8.32 99 8.36 99
Tabel 9. Rata-rata persen perolehan kembali (n = 5) dengan perhitungan koloni mengacu pada metode ISO (15-300 koloni/cawan), pada kondisi aerob dan anaerob
No
Aerob Anaerob
Inokulum (log cfu/mL) Perolehan kembali (%) Inokulum (log cfu/mL) Perolehan kembali (%)
1 2.32 99 2.36 98
2 4.32 99 4.36 98
3 6.32 101 6.36 100
4 8.32 99 8.36 99
21
4.2.2
Presisi
Karakteristik kinerja metode yang ditentukan selanjutnya adalah presisi. Presisi adalah tingkat kesamaan antara hasil uji individual ketika metode tersebut diterapkan secara berulang sampai dengan penggandaan sampling dari suatu sampel yang homogen. Presisi dari suatu metode biasanya ditunjukkan dengan relative standard deviation (RSD) dari suatu seri pengukuran (Sac-Singlas 2002).
Gambar 7. Presisi metode, dinyatakan sebagai nilai relative standard deviation (RSD) pada tiap tingkatan inokulum dengan perhitungan mengacu pada metode SNI (25-250 koloni/cawan), n = 5
Gambar 7 menunjukkan nilai RSD pada tiap tingkatan inokulum dengan perhitungan mengacu pada metode SNI (25-250 koloni/cawan). Sebagaimana yang dapat dilihat pada Gambar 7 diketahui bahwa nilai RSD kedua metode, baik yang diinkubasi dengan kondisi aerob maupun anaerob kurang dari 2.50%. Dari keempat tingkatan inokulum yang dianalisis terlihat tiga di antaranya memiliki nilai RSD yang lebih kecil untuk inkubasi yang dilakukan secara anaerob. Hal ini berarti pada inkubasi secara anaerob memiliki presisi yang lebih baik daripada ketika cawan diinkubasi secara aerob.
Gambar 8. Presisi metode, dinyatakan sebagai nilai relative standard deviation (RSD) pada tiap tingkatan inokulum dengan perhitungan mengacu pada metode ISO (15-300 koloni/cawan), n = 5
2.47 1.9 1.07 0.74 2.09 1.31 1.38 0.44 0 0.5 1 1.5 2 2.5 3
10² 10⁴ 10⁶ 10⁸
R
Jumlah inokulum (cfu/mL)SNI (aerob) ISO (anaerob) 2.75 2.13 0.84 1.31 3.03 1.71 1.26 0.61 0 0.5 1 1.5 2 2.5 3 3.5
10² 10⁴ 10⁶ 10⁸
R
Jumlah inokulum (cfu/mL)SNI (aerob)
22 Nilai RSD tiap tingkatan inokulum dengan perhitungan berdasarkan metode ISO terlihat pada Gambar 8. Nilai RSD dari masing-masing tingkatan tidak terlihat adanya kecenderungan lebih tinggi ataupun rendah. Cawan yang diinkubasi secara anaerob dihasilkan RSD yang cenderung lebih tinggi yaitu pada inokulum 102 cfu/mL. Hal ini disebabkan jumlah koloni yang masuk ke dalam kisaran perhitungan lebih tinggi yaitu 15 sampai 300 koloni, sehingga data menjadi lebih bervariasi.
Selain dilakukan perhitungan RSD pada masing-masing tingkatan inokulum juga dilakukan perhitungan nilai RSD total untuk tiap metode. Berdasarkan hasil penghitungan RSD total untuk metode SNI 2981-2009 (inkubasi aerob) diperoleh nilai RSD sebesar 1.58% (SNI) dan 1.88% (ISO). Untuk metode ISO 7889-2003 (inkubasi anaerob) diperoleh RSD sebesar 1.39% (SNI) dan 1.97% (ISO). Menurut Sac-Singlas (2002) nilai RSD yang melebihi 0.1 atau 10% menunjukkan adanya masalah atau kesulitan tertentu atau dengan arti lain metode tersebut tidak dapat diterapkan. Dari hasil perhitungan RSD kedua metode diperoleh nilai jauh lebih kecil dibandingkan ketentuan maka metode ini masih memenuhi persyaratan.
Presisi yang diperoleh pada penelitian ini adalah presisi yang diukur dari tingkat repitabilitas. Selain dapat diukur dari tingkat repitabilitas, presisi juga dapat diukur dari tingkat reproduksibilitas dari metode analisis yang dilakukan pada kondisi normal (Sac-Singlas 2002). Tingkat repitabilitas dinyatakan dalam RSDr dan tingkat reproduksibilitas dinyatakan dalam RSDR. Sebagaimana penelitian validasi metode penghitungan bakteri probiotik pada beberapa media MRSA yang dimodifikasi yang dilakukan oleh Leuschener et al. (2002) diperoleh nilai RSDr sebesar 1.2% sampai 3.4% dan RSDR sebesar 2.2% hingga 5.2%. Apabila dibandingkan dengan nilai RSD yang diperoleh pada penelitian ini masih berada pada kisaran hampir yang sama dengan penelitian tersebut.
4.2.3
Linieritas
Linieritas adalah kemampuan metode analisis yang menunjukkan bahwa larutan sampel yang berada dalam rentang konsentrasi memiliki respon analit yang proporsional dengan konsentrasi, secara langsung atau melalui transformasi (Harmita 2004). Penetapan linieritas minimal dilakukan dengan lima level konsentrasi inkokulum (Chan 2004). Dari kelima konsentrasi inokulum yang ditambahkan dibuat kurva regresinya. Regresi linear yang diperoleh dinyatakan dalam persamaan y = bx + a. Selain itu juga akan diketahui nilai R2 yang menjelaskan hubungan antara inokulum yang ditambahkan dengan hasil yang diperoleh.
Tabel 10. Koefisien determinasi dan persamaan regresi linier (n = 5), dengan perhitungan mengacu pada metode SNI (25-250 koloni/cawan)
Ulangan Metode SNI (aerob) Metode ISO (anaerob)
23 Tabel 11. Koefisien determinasi dan persamaan regresi linier (n = 5), dengan perhitungan
mengacu pada metode ISO (15-300 koloni/cawan)
Ulangan Metode SNI (aerob) Metode ISO (anaerob)
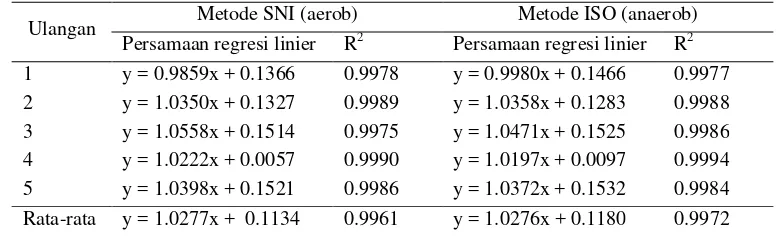
Persamaan regresi linier R2 Persamaan regresi linier R2 1 y = 0.9859x + 0.1366 0.9978 y = 0.9980x + 0.1466 0.9977 2 y = 1.0350x + 0.1327 0.9989 y = 1.0358x + 0.1283 0.9988 3 y = 1.0558x + 0.1514 0.9975 y = 1.0471x + 0.1525 0.9986 4 y = 1.0222x + 0.0057 0.9990 y = 1.0197x + 0.0097 0.9994 5 y = 1.0398x + 0.1521 0.9986 y = 1.0372x + 0.1532 0.9984 Rata-rata y = 1.0277x + 0.1134 0.9961 y = 1.0276x + 0.1180 0.9972
Parameter linieritas dari kedua metode ditentukan dengan cara membuat kurva hubungan antara jumlah inokulum yang ditambahkan pada sumbu x dan hasil yang diperoleh pada sumbu y. Tabel 10 menyajikan persamaan linier dan koefisien determinasi (R2) dari lima ulangan yang dilakukan, dengan penghitungan koloni mengikuti metode SNI (25-250 koloni/cawan). Berdasarkan hasil pengujian, diperoleh regresi linier rata-rata metode aerob dan anaerob secara berturut-turut, y = 1.0272x + 0.1104 dan y = 1.0298x + 0.1161. Rata-rata nilai koefisien determinasi (R2) dari metode aerob dan anerob secara berturut-turut yaitu sebesar 0.9962 dan 0.9968. Apabila dilihat dari nilai kedua nilai R2 tersebut metode anaerob memiliki nilai yang sedikit lebih tinggi dibandingkan metode aerob. Sebagaimana yang disebutkan AOAC (2002), nilai R2 dari kedua metode ini telah memenuhi syarat yang diterapkan yaitu 0.9900. Nilai R2 yang mendekati 1 menyatakan hubungan linieritas yang tinggi.
Gambar 9. Linieritas metode SNI 2981-2009 dan metode ISO 7889-2003 dengan penghitungan mengacu pada metode SNI (25-250 koloni/mL), n = 5
y = 1.0272x + 0.1104 R² = 0.9962
y = 1.0298x + 0.1161 R² = 0.9968
0 1 2 3 4 5 6 7 8 9
0 2 4 6 8 10
J
Inokulum (log cfu/mL)SNI (aerob)
24 Gambar 10. Linieritas metode SNI 2981-2009 dan metode ISO 7889-2003 dengan penghitungan
mengacu pada metode ISO (15-300 koloni/mL), n = 5
4.2.4
Limit deteksi dan limit kuantifikasi
Limit deteksi adalah konsentrasi terendah dari mikroorganisme dalam contoh yang dapat terdeteksi, tetapi tidak terhitung sebagai nilai yang sebenarnya di bawah kondisi pengujian yang disepakati. Untuk menentukan limit deteksi dari metode ini dilakukan inokulasi dengan konsentrasi inokulum yang rendah yaitu 3, 30, dan 60 cfu/mL. Penentuan limit deteksi ini dilakukan sebanyak enam kali ulangan. Seperti yang terlihat pada Lampiran 10, pada konsentrasi terendah yaitu 3 cfu/mL masih terdeteksi adanya koloni bakteri yang tumbuh. Sementara untuk sampel yang berbentuk padat atau semipadat pada konsentrasi 30 cfu/gram masih dapat terdeteksi adanya koloni. Namun, hasil limit deteksi yang diperoleh pada penelitian ini masih lebih tinggi dibandingkan dengan limit deteksi yang diperoleh oleh Bottini et al. (2011) yang memperoleh limit deteksi untuk metode analisis E.coli yaitu sebesar 1 cfu/mL.
Limit deteksi selain ditentukan dengan menambahkan inokulum dalam konsentrasi rendah pada sampel juga dapat ditentukan dari persamaan linier. Persamaan linier yang diperoleh pada uji linieritas selanjutnya digunakan untuk menghitung limit deteksi. Limit deteksi yang diperoleh dari hasil penghitungan dengan kurva linier sebesar 2 cfu/mL untuk sampel cair dan 20 cfu/gram untuk sampel padat atau semipadat.
Selain limit deteksi, parameter yang harus ditentukan dalam sebuah validasi metode kuantifikasi adalah limit kuantifikasi (LOQ). Limit kuantifikasi adalah konsentrasi terendah dari mikroorganisme yang dapat ditentukan dengan tingkat presisi dan akurasi yang dapat diterima di bawah kondisi pengujian yang disepakati. Berdasarkan hasil perhitungan diperoleh nilai LOQ sebesar 5 cfu/mL untuk sampel cair dan 50 cfu/gram untuk sampel padat atau semipadat. Hal ini berarti konsentrasi bakteri asam laktat yang terhitung di bawah nilai ini memiliki nilai presisi dan akurasi yang kurang baik. Perhitungan nilai limit deteksi dan limit kuantifikasi seperti yang tertera pada Lampiran 8.
y = 1.0277x + 0.1134 R² = 0.9961
y = 1.0276x + 0.118 R² = 0.9972
0 1 2 3 4 5 6 7 8 9
0 2 4 6 8 10
J
Inokulum (log cfu/mL)25
4.3
VERIFIKASI METODE PADA PRODUK SUSU
4.3.1
Susu fermentasi (yogurt)
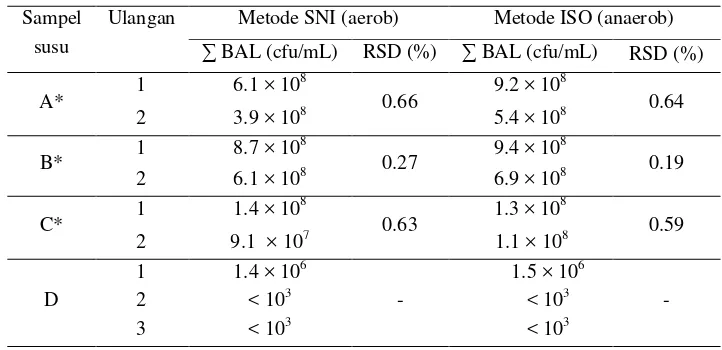
Empat jenis susu fermentasi komersial yang digunakan untuk verifikasi metode ini adalah susu merek A, B, C, dan D. Bakteri asam laktat yang mendominasi untuk sampel susu merek A adalah Lactobacillus casei, merek B adalah Lactobacillus bulgaricus, Streptococcus thermophilus, dan Bifidobacterium, sedangkan susu merek C dan D adalah Lactobacillus bulgaricus dan Streptococcus thermophilus. Hasil verifikasi pada susu fermentasi dapat dilihat pada Tabel 12. Berdasarkan hasil terlihat bahwa secara keseluruhan pada inkubasi secara aerob diperoleh jumlah bakteri asam laktat yang lebih sedikit jika dibandingkan dengan inkubasi secara anaerob, kecuali pada susu merek C ulangan 1. Hal yang serupa juga terjadi pada penelitian Mirlohi et al. (2008) yaitu inkubasi secara aerob menurunkan jumlah total koloni bakteri Gram positif. Dari hasil ini dapat dikatakan bahwa bakteri lebih optimum pertumbuhannya pada kondisi tanpa oksigen.
Untuk sampel merek B yang mengandung bakteri jenis Bifidobacterium jumlah koloni yang lebih tinggi pada inkubasi secara anaerob ini telah sesuai. Hal ini disebabkan bakteri Bifidobacterium merupakan bakteri obligat anaerob. Bakteri obligat anaerob yaitu bakteri yang hanya hidup dengan tanpa adanya oksigen (Ray and Bunia 2008). Susu merek A yang mengandung bakteri Lactobacillus casei juga terlihat memiliki jumlah koloni yang lebih tinggi dengan inkubasi secara anaerob. Lactobacillus casei termasuk golongan bakteri probiotik yaitu bakteri yang mampu bertahan hingga di usus manusia (Salminen et al. 2004). Bakteri probiotik biasanya lebih optimum apabila diinkubasi secara anaerob (Saccaro et al. 2011).
Secara keseluruhan dari ketiga produk yogurt komersial yang diuji, semuanya memiliki total BAL yang lebih tinggi dibandingkan dengan jumlah minimal yang dipersyaratkan SNI 2981-2009 yaitu sebesar 107 cfu/mL. Hanya sampel merek D yang berada di bawah syarat minimal tersebut. Hal ini diduga karena total BAL dalam produk D telah mengalami penurunan viabilitas selama penyimpanan akibat kondisi penyimpanan yang tidak sesuai.
Tabel 12. Perbandingan jumlah bakteri asam laktat dalam susu fermentasi
Keterangan :
* = hasil uji t menyatakan sampel tidak berbeda nyata pada taraf signifikansi 5% Sampel
susu
Ulangan Metode SNI (aerob) Metode ISO (anaerob) ∑ BAL (cfu/mL) RSD (%) ∑ BAL (cfu/mL) RSD (%)
A* 1 6.1 × 10
8
0.66 9.2 × 10 8
0.64
2 3.9 × 108 5.4 × 108
B* 1 8.7 × 10
8
0.27 9.4 × 10 8
0.19
2 6.1 × 108 6.9 × 108
C* 1 1.4 × 10
8
0.63 1.3 × 10 8
0.59
2 9.1 × 107 1.1 × 108
D
1 1.4 × 106
-
1.5 × 106
-
2 < 103 < 103
26 Uji t dilakukan terhadap logaritma jumlah koloni dari kedua metode untuk melihat apakah terdapat perbedaan yang nyata dengan taraf signifikansi 5%. Hasil uji t menunjukkan dari ketiga sampel susu fermentasi yang diuji tidak ada perbedaan yang nyata pada signifikansi 5%, meskipun apabila dilihat hasilnya secara langsung terdapat perbedaan. Ketiga sampel yang diuji umumnya mengandung bakteri genus Lactobacillus yang bersifat fakultatif anaerob. Bakteri fakultatif anaerob ini dapat hidup pada kondisi dengan atau tanpanya oksigen sehingga kemungkinan ini yang membuat tidak adanya perbedaan yang signifikan karena bekteri dapat tumbuh pada kondisi dengan atau tanpanya oksigen.
Dalam verifikasi ada parameter yang harus ditentukan salah satunya adalah presisi. Dari hasil verifikasi pada sampel susu fermentasi ini diperoleh nilai RSD yang berkisar antara 0.19 hingga 0.66% (Tabel 12). Nilai RSD ini masih sangat lebih rendah dari batas yang ditentukan yaitu 10%. Oleh karena itu kedua metode memiliki ketepatan yang dapat diterima. Hal ini menunjukkan bahwa walaupun validasi dilakukan pada media MRSA dengan Lactobacillus bulgaricus sebagai mikroorganisme uji, tetapi metode dapat digunakan untuk menguji total BAL pada susu fermentasi.
4.3.2
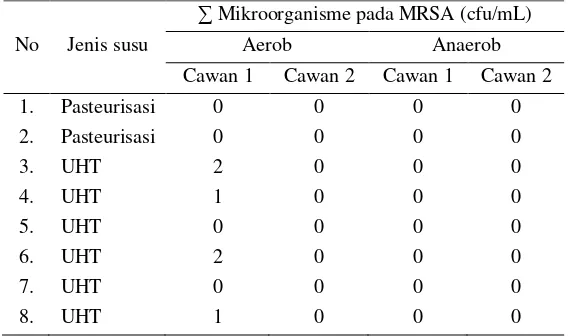
Sampel Negatif
Verifikasi metode dilakukan pada sampel negatif yaitu susu cair dan susu bubuk yang menurut SNI tidak dipersyaratkan adanya bakteri asam laktat. Jenis susu cair yang digunakan dalam verifikasi ini yaitu susu cair steril UHT dan susu pasteurisasi.
Tabel 13. Hasil verifikasi metode pada susu UHT dan pasteurisasi
No Jenis susu
∑ Mikroorganisme pada MRSA (cfu/mL)
Aerob Anaerob
Cawan 1 Cawan 2 Cawan 1 Cawan 2
1. Pasteurisasi 0 0 0 0
2. Pasteurisasi 0 0 0 0
3. UHT 2 0 0 0
4. UHT 1 0 0 0
5. UHT 0 0 0 0
6. UHT 2 0 0 0
7. UHT 0 0 0 0
8. UHT 1 0 0 0
27 Gambar 11. Hasil pewarnaan Gram koloni bakteri terduga false positif
Koloni yang tumbuh pada cawan yang diinkubasi secara aerob dikonfirmasi dengan pewarnaan Gram. Hasil pewarnaan Gram terlihat seperti pada Gambar 11. Hasil pengamatan di bawah mikroskop dengan perbesaran 1000 kali memperlihatkan jenis mikroorganisme yang diduga khamir karena ukurannya yang jauh lebih besar dari ukuran bakteri.
Verifikasi juga dilakukan terhadap beberapa sampel susu bubuk, baik susu skim ataupun full cream. Hasil uji menunjukkan pada sampel susu merek Q dan S tidak ditemukan adanya bakteri asam laktat pada sampel. Akan tetapi terdapat kontaminasi kapang pada sampel uji yang diinkubasi dengan kondisi aerob (Tabel 14). Kontaminasi kapang ini kemungkinan berasal dari susu bubuk yang digunakan sebagai sampel uji.
Tabel 14. Hasil verifikasi metode pada susu bubuk
U Jenis susu
Aerob Anaerob
Cawan 1 Cawan 2 C awan 1 Cawan 2
1 Merek P 2* 5* 0 0
2 Merek P 0 0 0 0
1 Merek Q 0* 0* 0 0
2 Merek Q 0 0 0 0
1 Merek R 3 4 1 3
2 Merek R 1* 3* 3 1
1 Merek S 0* 0* 0 0
2 Merek S 0* 0* 0 0
Keterangan : * = berkapang
[image:30.595.176.458.404.561.2]28 Gambar 12. Cawan yang terkontaminasi kapang
Adanya kontaminasi kapang hanya ditemukan pada cawan yang diinkubasi secara aerob, karena kapang membutuhkan oksigen untuk pertumbuhannya. Hal ini yang menyebabkan cawan yang diinkubasi dengan kondisi anaerob tidak terdapat kapang. Kehadiran kapang pada media ini tentunya akan mengganggu penghitungan koloni bakteri asam laktat dan kapang akan menggunakan nutrien yang seharusnya digunakan oleh BAL.
V.
KESIMPULAN DAN SARAN
5.1
KESIMPULAN
Hasil penelitian menunjukkan bahwa kedua metode baik metode SNI (aerob) maupun metode ISO (anaerob) memiliki presisi yang tinggi ditandai dengan nilai RSD yang sangat kecil yaitu kurang dari 10%. Hal ini berarti kedua metode tidak mengalami kesulitan-kesulitan atau masih memenuhi ketentuan yang dipersyaratkan. Bakteri Lactobacillus bulgaricus yang diinokulasikan pada susu dapat terisolasi kembali sehingga diperoleh persen recovery dari kedua metode berkisar antara 98 sampai 101% dan pada konsentrasi 3 cfu/mL masih dapat terdeteksi. Hasil plot garis kedua metode juga memiliki linieritas yang sangat baik dengan R2 yang melebihi 0.9970.
Hasil verifikasi metode pada beberapa jenis susu fermentasi menunjukkan bahwa pada inkubasi secara anaerob memiliki jumlah koloni yang lebih tinggi. Akan tetapi, setelah dilakukan uji lanjut kedua metode, baik metode ISO maupun metode SNI tidak berbeda nyata pada taraf signifikansi 5%. Hasil verifikasi menunjukkan bahwa kedua metode memiliki presisi yang baik ditandai dengan nilai RSD yang sangat kecil yaitu berkisar antara 0.19 dan 0.66%. Hal ini menunjukkan bahwa walaupun validasi dilakukan pada media MRSA dengan Lactobacillus bulgaricus sebagai mikroorganisme uji, tetapi metode dapat digunakan untuk menguji total BAL pada susu fermentasi. Hasil pengujian menunjukkan metode SNI (aerob) memiliki perameter uji yang baik seperti halnya metode ISO (anaerob), tetapi rentan dengan kontaminasi kapang terutama untuk sampel yang kemungkinan mengandung kapang. Oleh karena itu, untuk memperoleh hasil uji yang lebih baik analisis bakteri asam laktat sebaiknya menggunakan metode ISO (inkubasi anaerob).
5.2
SARAN
VALIDASI DAN VERIFIKASI METODE ANALISIS BAKTERI
ASAM LAKTAT PADA PRODUK SUSU
SKRIPSI
IIN WAHYUNI
F24080078
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
30
DAFTAR PUSTAKA
Adams MR dan Moss MO. 2008. Food Microbiology. 3rd ed. Cambridge : The Royal of Society Chemistry Publishing.
Axelsson LT. 2004. Lactic acid bacteria : clasification and physiology. Di dalam : Lactic Acid Bacteria : Microbiological and Functional Aspect Third Edition. Salminen S, von Wright A, dan Ouwehand A (Eds). New york: Marcel Dekker Inc.
[AOAC] Association of Official Analytical Chemists. 2002. AOAC International methods committee guidelines for validation of qualitative and quantitative food microbiological official methods of analysis. J AOAC Int. 85: 1–5.
[BSN] Badan Standarisasi Nasional. 1998. SNI 01-3141-1998. Susu segar. Jakarta : Badan Standarisasi Nasional.
[BSN] Badan Standarisasi Nasional. 2000. SNI 01-6366-2000. Batas cemaran mikroba maksimum pada pangan asal hewan. Jakarta : Badan Standarisasi Nasional.
[BSN] Badan Standarisasi Nasional. 2006. SNI 01-2970-2006. Susu bubuk. Jakarta : Badan Standarisasi Nasional.
[BSN] Badan Standarisasi Nasional. 2009. SNI 2981-2009. Yogurt. Jakarta : Badan Standarisasi Nasional.
Ballongue J. 2004. Bifidobacteria and probiotic action. Di dalam : Lactic Acid Bacteria : Microbiological and Functional Aspect Third Edition. Salminen S, von Wright A, dan Ouwehand A (Eds). New york: Marcel Dekker Inc.
Bottini G, Losito F, De Ascentis A, Priolisi FR, Mari A dan Antonini G. 2011. Validation of the micro biological survey method for totalviable count and E.coli in food sample. Am J Food Tech 6 (11): 951-962, ISSN 1557-4571.
Chan CC. 2004. Potency method Validation. Di dalam: Analytical Method Validation and Instrument Performance Verification. Chan CC, Lam H, Lee YC dan Zhang XM (Eds). New Jersey : John Wiley & Sons Publication Inc.
Cheriguene A, Chougrani F, Bekada AMA, El Soda M, dan Bensoltane A. 2007. Enumeration and identification of lactic microflora in algerian goats milk. Afr J Biotechnol Vol. 6 (15), pp. 1854-1861
De Man JC, Rogosa M, dan Sharpe ME. 1960. A medium for cultivation of lactobacilli. J Bacteriol 23:130
31 Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya. Majalah Ilmu
Kefarmasian, Vol. 1, No. 3 : 117-135. ISSN : 1693-9883
Holzapfel WH, Geisen R, dan Schillinger U. 1995. Biological preservation of food with reference to protective culture, bacteriocins and food grade enzyme. J Int Food Microbial. 24:343-362.
[ISO] Internasional Organisation for Standardisation. 2003. ISO 16140 :2003. Microbiology of food and animal feeding stuffs- Protocol for the validation of alternative methods. British Standard (BSI).
[ISO] Internasional Organisation for Standardisation. 2003. ISO 7889:2003(E). Yogurt- Enumaration of characteristic microorganism – colony-count technique at 37oC.
[ISO] Internasional Organisation for Standardisation. 2005. ISO/IEC 17025 : 2005. Persyaratan Umum Kompetensi Laboratorium Pengujian dan Laboratorium Kalibrasi.
Ismail T. 2009. Validasi sekunder metode analisa Campylobacter jejuni pada daging ayam [tesis].Bogor : Program Pasca Sarjana, Institut Pertanian Bogor.
Jay JM. 2000. Modern Food Microbiology. 6th ed. Maryland : Aspen Publisher Inc.
Leuschener RGK, Bew J, Coeuret V, Vernoux JP, dan Gueguen M. 2002. A collaborative study of a method for the enumeration of probiotic lactobacilli in animal feed. Food Micro 20 (2003) 57-66.
Mirlohi M, Soleimania-Zad S, Sheikh-zeiondin M, dan Fazeli Hossein. 2008. Enumeration of Lactobacilli in the Fecal Flora of Infant Using two different Modified de-man Rogosa Sharpe Media under Aerobic and Aerobic Incubation. Pakistan J. Biological Sciences 11 (6): 876-881
Ray B dan Bhunia A. 2008. Fundamental Food Microbiology. 4th ed. United State of America : CRC Press