SELEKSI DAN KARAKTERISASI BAKTERI ASAM LAKTAT
ASAL BEKASAM SEBAGAI PROBIOTIK
ASTRI NURNAAFI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Seleksi dan Karakterisasi Bakteri Asam Laktat Asal Bekasam sebagai Probiotik” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ASTRI NURNAAFI. Seleksi dan Karakterisasi Bakteri Asam Laktat Asal Bekasam sebagai Probiotik. Dibimbing oleh IRIANI SETYANINGSIH dan DESNIAR.
Bekasam merupakan salah satu produk fermentasi ikan Indonesia. Produk fermentasi mengandung bakteri asam laktat (BAL) dan beberapa diantaranya berpotensi sebagai probiotik. Bekasam terbuat dari ikan air tawar, misalnya ikan sepat dan nila, memiliki bentuk seperti ikan segar namun daging ikan lebih kenyal, rasa asam, asin dan aroma yang khas. Penelitian produk fermentasi ikan di Indonesia masih sangat kurang khususnya bekasam. Bakteri asam laktat telah diisolasi dari bekasam dan menghasilkan 62 isolat BAL, tiga isolat diantaranya telah diteliti potensinya sebagai probiotik, namun baru sebagai kandidat dan masih terdapat 59 jenis isolat yang belum diketahui potensinya sebagai probiotik. Berdasarkan hal tersebut maka perlu diteliti lebih lanjut mengenai BAL probiotik pada bekasam. Tujuan penelitian ini adalah menseleksi isolat BAL asal bekasam, menentukan karakteristik BAL yang berpotensi sebagai probiotik, dan identifikasi isolat BAL probiotik.
Penelitian dibagi menjadi dua tahap. Tahap pertama yaitu seleksi BAL sebagai probiotik. Lima isolat BAL asal bekasam yaitu BP(25), NS(5), SS(3), BP(8) dan NS(6) diseleksi berdasarkan pH lambung (pH 2.0), pH usus (pH 7.2), garam empedu (0.5% oxgal), aktivitas antibakteri, kemampuan penempelan pada usus tikus (ileum) secara in vitro. Tahap kedua yaitu karakterisasi BAL probiotik meliputi pewarnaan Gram dan spora, pengamatan sifat fisiologis meliputi motilitas, katalase, uji tipe fermentasi, amilolitik, lipolitik, serta pengamatan pertumbuhan pada suhu, pH dan kadar NaCl yang berbeda, dan identifikasi menggunakan API 50 CHL.
Hasil penelitian menunjukkan bahwa isolat NS(5), SS(3) dan BP(8) dapat bertahan pada pH 2.0, 7.2 dan garam empedu (oxgal), memiliki aktivitas antibakteri terhadap Salmonella typhimurium ATCC 14028 dan Escherichia coli, memiliki kapasitas penempelan pada permukaan usus (ileum) 10.43–15.40%. Pembuktian penempelan dengan pembuatan preparat histopat menunjukkan ketiga bakteri dapat melekat pada sel epitel usus. Ketiga isolat memiliki karakteristik bakteri Gram-positif, berbentuk batang (NS(5) dan SS(3)) dan bulat (BP(8)), non-endospora, katalase negatif, homofermentatif, non motil, memiliki aktivitas amilolitik dan lipolitik, dapat tumbuh pada 30oC
–
37oC, kadar NaCl 2%-7% dan pH 4.4–9.6. Isolat NS(5) adalah Lactobacillus plantarum 1 (99.9% ID), SS(3) adalah L. pentosus (99.9% ID), dan BP(8) adalah Pediococcus pentosaceus 1 (99.9% ID). Isolat BP(25) dan NS(6) tidak termasuk probiotik karena tidak dapat bertahan pada kondisi pH lambung, pH usus dan garam empedu (oxgal).SUMMARY
ASTRI NURNAAFI Selection and Characterization of Lactic Acid Bacteria from Bekasam as Probiotic. Supervised by IRIANI SETYANINGSIH and DESNIAR.
Bekasam is one of the fermented fish from Indonesia. The fermented products contain lactic acid bacteria (LAB) and several of them have potential probiotic with beneficial effects for human health. Bekasam is made from freshwater fish such as gouramy and tilapia, has a shape like of fresh fish with loamy meat, sour, salty and unique flavor. Lactic acid bacteria was isolated from bekasam and obtained as much as 62 of LAB isolates. Three out of those have been known as probiotic candidates and there are still 59 remaining isolates which potential probiotic is unknown. Based on this, it is necessary to conduct further research related to probiotic potential. The aims of this study were to select LAB isolate of bekasam, to characterize LAB isolate of bekasam as probiotic and to identify probiotic LAB isolate.
The research was divided into two stages. In the first stage selected LAB isolates as probiotic. Five LAB isolates of bekasam namely BP(25), NS(5), SS(3), BP(8) and NS(6) were tested based on the resistance to gastric pH (pH 2.0), intestinal pH (pH 7.2), and bile salts (0.5% oxgal), the antibacterial activity, and in vitro adhesion on intestinal (ileum). In the second stage consist of probiotic LAB characterization include Gram and spores staining, observation of physiological properties such as motility and catalase, observation of fermentation type, amylolytic and lipolytic, observation of growth on the different level of temperature, pH and NaCl, and identification of probiotic LAB isolate using API 50 CHL.
The result showed that NS(5), SS(3) and BP(8) isolates survived at pH 2.0, pH 7.2 and bile salts (oxgal), had antibacterial activity against Salmonella typhimurium ATCC 14028 and Escherichia coli and had adhesion capacity on the intestine (ileum) surface 10.43 to 15.40%. The adhesion verification using histopat preparat showed that those three isolates could adhere on intestinal epithelial cells.
The characteristics of the isolates were as follow: Gram-positive bacteria, rod-shaped (NS(5) and SS(3)), coccus (BP(8)), non-endospore producer, negative
catalase, homofermentative, non motil, have amylolytic and lipolytic activity, be able to grow at 30oC–37oC, NaCl 2%-7% and pH 4.4–9.6. NS(5), SS(3) and BP(8) isolates were Lactobacillus plantarum 1 (99.9% ID), L. Pentosus (99.9% ID), and Pediococcus pentosaceus 1 (99.9% ID). Otherwise BP(25) and NS(6) isolate were not probiotic candidate because they were not able to survive at gastric, intestinal pH and bile salts (oxgal) condition.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SELEKSI DAN KARAKTERISASI BAKTERI ASAM LAKTAT
ASAL BEKASAM SEBAGAI PROBIOTIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Seleksi dan Karakterisasi Bakteri Asam Laktat Asal Bekasam sebagai Probiotik
Nama : Astri Nurnaafi NIM : C351120141
Disetujui oleh Komisi Pembimbing
Dr Ir Iriani Setyaningsih, MS Ketua
Dr Desniar, SPi MSi Anggota
Diketahui oleh
Ketua Program Studi Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya kepada penulis sehingga karya ilmiah ini dapat diselesaikan dengan tema “Seleksi dan Karakterisasi Bakteri Asam Laktat Asal Bekasam sebagai Probiotik” dalam memperoleh gelar Master pada Program Teknologi Hasil Perairan Sekolah Pascasarjana IPB Bogor.
Penulisan tesis ini penulis banyak mendapat bantuan dari berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, perkenankan penulis menyampaikan rasa hormat dan terima kasih yang tidak terhingga kepada:
1 Dr Ir Iriani Setyaningsih, MS selaku ketua komisi pembimbing dan Dr Desniar, SPi MSi sebagai anggota komisi pembimbing yang telah membimbing penulis dengan penuh kesabaran dan telah memberikan bantuan dana penelitian melalui proyek program penelitian unggulan perguruan tinggi 2014 DIKTI. 2 Dr Tati Nurhayati, SPi MSi selaku wakil program studi sebagai gugus
pengendali mutu (GKM) yang telah meluangkan waktunya untuk memberikan kritik dan saran kepada penulis.
3 Dr Kustiariyah Tarman, SPi MSi selaku dosen penguji yang telah meluangkan waktunya untuk menguji dan memberikan masukan kepada penulis.
4 Dr Ir Wini Trilaksani, MSc selaku ketua Program Studi Teknologi Hasil Perairan yang telah memberikan kesempatan kepada penulis untuk menempuh pendidikan master.
5 Muh. Adam Saleh dan Hj. Nurwiah N orang tua penulis yang tak henti-hentinya mendo’akan, memberikan dukungan dan kasih sayangnya kepada penulis. 6 Robin Bahari, SPi MSi suami tercinta yang telah banyak memberikan bantuan,
dukungan dan kasih sayang, serta putriku Alifah Fauzya Bahari dan calon adiknya yang menjadi semangat dan pelita hati penulis.
7 Prof Okky S Dharmaputra selaku kepala bagian Laboratorium Mikologi Departemen Biologi yang telah mengizinkan penulis menggunakan alat laboratorium, Mas Sepri, Mas Aldi laboran IPBCC dan Ivan Permana, MSi yang telah banyak membantu penulis selama penelitian.
8 Aisyah Saridu SPi, Annisa Saskia, Titin, Tika dan Ahadiyah adik-adik S1 THP dan Biologi yang telah banyak memberikan bantuan.
9 Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam hal apapun selama penulis kuliah di Bogor, terima kasih semoga Allah SWT membalas kebaikan kalian semua.
Penulis menyadari masih banyak kekurangan dan keterbatasan dalam penyelesaian tulisan ini. Oleh karena itu sangat diharapkan kritik dan saran untuk penyempurnaan tesis ini. Semoga tesis ini dapat bermanfaat untuk Indonesia dan bagi yang membacanya.
DAFTAR TABEL
1 Ketahan hidup isolat BAL pada pH lambung dan pH usus 10
2 Ketahanan hidup BAL pada garam empedu 12
3 Aktivitas antibakteri isolat BAL NS(5), SS(3) dan BP(8) 14 4 Penempelan BAL pada usus tikus secara in vitro 16 5 Karakteristik isolat NS(5), SS(3) dan BP (8) 21 6 Hasil fermentasi gula isolat BAL asal bekasam 24
DAFTAR GAMBAR
1 Roadmap penelitian bakteri probiotik asal bekasam 3
2 Diagram alir tahapan penelitian 5
3 Penurunan populasi BAL pada pH lambung dan pH usus 11
4 Penempelan isolat BAL pada permukan ileum tikus
isolat A. NS(5), B. SS(3) dan C. BP(8) 19
5 Bentuk Isolat BAL: A. NS(5), SS(3) dan BP(8) 20
DAFTAR LAMPIRAN
1 Persetujuan perlakuan atas etik penggunaan tikus percobaan 33
2 Studi awal pengenalan ileum tikus 34
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki banyak produk tradisional fermentasi ikan. Proses fermentasi yang dilakukan umumnya untuk memperpanjang masa simpan karena sifat ikan yang cepat busuk. Salah satu produk tradisional fermentasi ikan adalah bekasam yang difermentasi dengan penambahan garam dan sumber karbohidrat dalam kondisi anaerob.
Bekasam yang dihasilkan memiliki karakteristik bentuk ikan seperti ikan segar namun daging ikan lebih kenyal, rasa asam, asin dan aroma yang khas. Bekasam mirip dengan beberapa produk fermentasi ikan yang dijumpai di beberapa
negara lainnya antara lain burong isda, burong bangus (Philipina), pla-ra, pla-chom, som-fak (Thailand), heshiko dan nakazuke (Jepang) (Wikandari et al.
2012). Bekasam pada awalnya diolah oleh penduduk yang bermukim di Muara Sungai Bengawan Solo dan Surabaya, kemudian menyebar ke Jawa Tengah, Sumatera Selatan dan Kalimantan Tengah (Irianto dan Giyatmi 2009).
Penggaraman dalam pembuatan bekasam membantu menyeleksi populasi bakteri penyebab pembusuk dan mencegah pembusukan. Bakteri yang dominan terdapat dalam produk fermentasi ikan adalah bakteri asam laktat (BAL) (Ostergaard et al. 1998). Desniar et al. (2011) menyatakan bahwa dalam bekasam mengandung banyak BAL yang menghasilkan senyawa organik yang berfungsi memperpanjang masa simpan bekasam.
Bakteri asam laktat merupakan bakteri Gram-positif penghasil asam laktat yang memiliki banyak manfaat bagi kesehatan manusia. Chandra et al. (2007) melaporkan bahwa BAL yang berkembang dalam produk fermentasi menghambat pertumbuhan mikroorganisme alam yang bersifat patogen. Bakteri tersebut juga memiliki sifat fungsional yang menguntungkan bagi kesehatan manusia yaitu sebagai probiotik. Collado et al. (2007) melaporkan bahwa probiotik yang biasa digunakan pada produk pangan adalah bakteri asam laktat (BAL) terutama galur Lactobacillus, Bifidobacterium, dan beberapa dari Propionibacterium.
Probiotik didefinisikan sebagai mikroorganisme hidup yang bila dikonsumsi dalam jumlah cukup, mampu memberikan manfaat kesehatan bagi inangnya (FAO/WHO 2006). Furrie et al. (2006) menjelaskan bahwa probiotik adalah suplemen dari mikroba hidup yang dapat mengganti komposisi dan atau mengganti aktivitas metabolik mikrobiota alami usus atau mengatur reaktivitas sistem imun yang bermanfaat bagi kesehatan.
Efek kesehatan probiotik bagi manusia diantaranya (1) menurunkan risiko lactose intolerance, (2) meningkatkan respon sistem imun, (3) melindungi dari inflamasi/arthritis, (4) mencegah hipertensi, (5) mencegah kanker (Parvez et al. 2006), (6) mencegah kejadian diare (Lu dan Walker 2001; Arief et al. 2010; Astawan et al. 2011).
2
dengan pertumbuhan tiap tahun sebesar 4.3% (compound annual growth rate (CAGR)) (Food Processing 2008). Transparancy Market Research (2015) melaporkan bahwa pertumbuhan pasar probiotik secara global diperkirakan meningkat sebesar 7.40% dari tahun 2014-2020 berdasarkan CAGR. Pasar global probiotik mencapai USD 62.6 Milyar pada tahun 2014 dan diperkirakan akan mencapai USD 96 Milyar pada tahun 2020, didorong oleh naiknya permintaan konsumen terutama dari Asia dan Eropa.
Seiring peningkatan permintaan konsumen terhadap probiotik mendorong para peneliti melakukan perluasan sumber BAL. Beberapa penelitian yang telah dilakukan terkait BAL asal bekasam yaitu starter BAL dalam pembuatan bekasam (Murtini et al.1997), bakteriosin dari BAL asal bekasam (Desniar et al. 2011b), bekasam sebagai sumber angiotensin I converting enzyme inhibitor (Wikandari et al. 2011), parameter kimia dan mikrobiologi serta isolasi BAL pada bekasam (Desniar et al. 2012a), antimikroba yang dihasilkan oleh BAL asal
bekasam (Desniar et al. 2012b), dan karakteristik BAL pada bekasam (Wikandari et al. 2012). Desniar et al. (2013) mengisolasi BAL asal bekasam dan
menghasilkan 62 isolat BAL, tiga isolat diantaranya telah diteliti potensinya sebagai probiotik oleh Syafiqoh (2014), namun baru sebagai kandidat dan masih terdapat 59 jenis isolat yang belum diketahui potensinya sebagai probiotik. Berdasarkan hal tersebut maka perlu diteliti mengenai BAL probiotik pada produk fermentasi bekasam guna mendapatkan BAL probiotik dengan karakteristik tertentu.
Perumusan Masalah
Bakteri asam laktat merupakan bakteri yang umum digunakan sebagai probiotik, namun tidak semua BAL termasuk bakteri probiotik. Umumnya bakteri tidak tahan terhadap kondisi pencernaan yang ekstrim dan bakteri harus dapat berkolonisasi pada bagian usus untuk dapat dikategorikan sebagai probiotik. Bakteri probiotik memiliki kemampuan dan karakteristik yang berbeda-beda. Berdasarkan hal tersebut dalam penelitian ini dilakukan pengujian BAL asal bekasam terhadap kondisi pencernaan, pengujian penempelan pada usus secara in vitro, karakterisasi dan identifikasi untuk mendapatkan dan mengetahui genus bakteri probiotik asal bekasam.
Tujuan Penelitian
Tujuan dilaksanakannya penelitian ini adalah :
3
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi bahwa bakteri asam laktat asal bekasam dapat dimanfaatkan sebagai probiotik, serta isolat BAL yang diperoleh dapat diaplikasikan pada bahan pangan sehingga meningkatkan nilai gizi dan nilai jual produk pangan, serta mengurangi ketergantungan impor bakteri probiotik.
Ruang Lingkup Penelitian
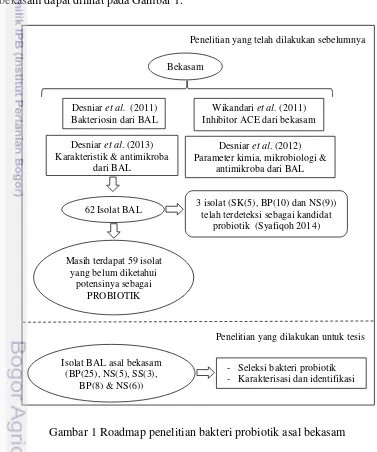
Penelitian BAL asal bekasam sebagai probiotik belum pernah dilakukan. Kajian yang dilakukan pada penelitian ini meliputi seleksi isolat BAL asal bekasam (BP(25), NS(5), SS(3), BP(8) dan NS(6)) yang memiliki kemampuan sebagai probiotik. Bakteri asam laktat yang terseleksi sebagai probiotik selanjutnya dikarakterisasi dan diidentifikasi. Roadmap penelitian bakteri probiotik asal bekasam dapat dilihat pada Gambar 1.
Penelitian yang telah dilakukan sebelumnya
Penelitian yang dilakukan untuk tesis
Gambar 1 Roadmap penelitian bakteri probiotik asal bekasam
4
2 METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2014 sampai Juli 2015, bertempat di Laboratorium Mikrobiologi Hasil Perairan Departemen Teknologi Hasil Perairan (THP) Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor (IPB), Laboratorium Mikologi Departemen Biologi IPB, Rumah Sakit Hewan IPB dan Laboratorium Histopatologi Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan IPB.
Bahan dan Alat
Bahan utama yang digunakan meliputi isolat BAL BP(25), NS(5), SS(3), BP(8) dan NS(6) koleksi Desniar et al. (2013) yang diisolasi dari bekasam asal pengolah lokal di Indralaya Kabupaten Ogan Ilir dan Desa Sungai Pasir, Kabupaten Ogan Komiring Ilir. Sumatra Selatan.
Bahan yang digunakan untuk pengujian BAL yaitu Escherichia coli, Salmonella typhimurium ATCC 14028, phosphate buffer saline (PBS) (Oxoid, England), HCl 0.1 N, NaOH 0.1 N (Merck, Germany), buffer pepton water (BPW) (Oxoid, England), de man rogosa sharp broth (MRSB) (Oxoid, England), de man rogosa sharp agar (MRSA) (Oxoid, England), oxgal (Merck, Germany), mueller hinton agar (MHA) (Oxoid, England), nutrient agar (NA) (Difco, USA), nutrient broth (NB) (Difco, USA), CaCO3 1 %, alkohol, kristal violet, lugol, safranin, minyak imersi, malachite, H2O2 3 %, spirtus, lemak nabati (mentega) 1% dan indikator neutral red.
Hewan percobaan yang digunakan adalah tikus putih konvensional (Rattus norvegicus) jenis Sprague Dawley berumur enam minggu berjenis kelamin jantan sebanyak 6 ekor dengan kisaran bobot 100-120 g per ekor yang diperoleh dari Biofarmaka IPB Bogor.
Alat-alat yang digunakan dalam penelitian ini antara lain alat-alat gelas, pH meter (Eutech, Singapore), mikro pipet (Gilson, France), jarum ose, inkubator (Yamato, Japan), sentrifus (Jouan, France), autoklaf (Yamato SM 52 Autoclave), spektrofotometer (Hitachi u-2800, Japan), wadah inkubasi kedap udara, laminaran, cling wrap, vortex (Velp scientifica, Europe), refrigerator, aluminium foil, plastik tahan panas, API 50 CHL, software API system (Bio-Mereux, France), timbangan analitik, penggaris, lilin dan korek api.
Prosedur Penelitian
5 pengamatan sifat fisiologis meliputi motilitas, katalase, oksidase, uji tipe fermentasi, amilolitik, lipolitik, pengamatan kondisi pertumbuhan pada suhu, NaCl dan pH yang berbeda dan identifikasi (API 50 CHL). Diagram alir tahapan penelitian dapat dilihat pada Gambar 2.
Gambar 2 Diagram alir tahapan penelitian
Seleksi BAL yang Berpotensi sebagai Probiotik
Ketahanan hidup isolat BAL pada pH lambung (pH 2.0) dan pH usus (pH 7.2) (Lin et al. 2006)
Ketahanan terhadap tingkat keasaman yang tinggi merupakan sifat yang pertama yang harus dipenuhi sebagai probiotik pada saat akan melakukan seleksi isolat probiotik (Tuomola et al. 2001).
Satu mL kultur BAL umur 24 jam dicampurkan ke dalam 9 mL phosphate buffer saline (PBS) steril pH 2.0 dan pH 7.2 dan diinkubasi (Yamato, Japan) pada suhu 37°C selama tiga jam. Bakteri asam laktat yang tumbuh dihitung dengan pengenceran pada buffer pepton water (BPW) dan media pemupukan pada media man rogosa sharpe agar (MRSA) dalam kondisi anaerobik pada suhu 37°C selama 48 jam. Populasi awal BAL umur 24 jam juga dihitung. Ketahanan terhadap pH rendah dihitung berdasarkan perbandingan populasi BAL yang tumbuh pada pH perlakuan dengan populasi awal. Percobaan ini dilakukan dengan dua kali ulangan secara duplo.
Isolat BAL
Tahap I. Seleksi BAL probiotik
1 Uji ketahanan pada pH 2.0 dan 7.2 2 Uji ketahanan terhadap garam empedu 3 Uji aktivitas antibakteri
4 Uji penempelan pada usus tikus (uji in vitro dan histopat)
Isolat BAL probiotik
Tahap II. Karakterisasi dan identifikasi 1 Karakterisasi (morfologi sel, koloni,
fisiologi dan pertumbuhan) 2 Identifikasi (API 50 CHL)
6
Pengujian ketahanan terhadap garam empedu (Modifikasi Argyri et al. 2013)
Satu mL kultur BAL umur 24 jam dimasukkan ke dalam 9 mL media man rogosa sharpe broth (MRSB) yang mengandung 0.5% garam empedu (oxgal) dan diinkubasikan pada suhu 37°C selama 4 jam. Populasi awal BAL dihitung sebelum diinokulasikan ke media MRSB dengan 0.5 % garam empedu. Jumlah BAL dihitung pada media MRSA dengan metode tuang dan diinkubasi pada kondisi anaerobik pada suhu 37°C selama 48 jam. Nilai ketahanan hidup ditunjukkan dengan persentase populasi yang tumbuh pada media garam empedu 0.5% dibandingkan dengan populasi awal. Percobaan ini dilakukan dengan dua kali ulangan secara duplo.
Pengujian aktivitas antibakteri (Modifikasi Savadogo et al. 2004)
Isolat BAL diinokulasikan ke dalam MRSB dan diinkubasikan pada suhu
37°C selama 20 jam. Supernatan bebas sel dipanen melalui sentrifugasi (Jouan, France) 10 000 rpm pada suhu 4°C selama 10 menit. Supernatan bebas sel
diuji aktivitas antimikrobanya menggunakan metode difusi agar. Bakteri uji yang digunakan, yaitu Salmonella typhimurium ATCC 14028 dan Escherichia coli. Dua ose bakteri uji diinokulasikan ke dalam tabung berisi media nutrient broth (NB) dan diinkubasi selama 24 jam. Kultur bakteri uji diukur kekeruhannya hingga mencapai OD 0.5-0.8. Bakteri uji dimasukkan ke dalam media MHA steril sebanyak 20 μL dan dibekukan dalam cawan petri. Dua puluh μL supernatan BAL dimasukkan ke dalam sumur yang telah dibuat pada media dalam cawan petri. Seluruh cawan diinkubasi pada suhu 37°C selama 24 jam. Zona hambat yang terbentuk di sekitar sumur diamati dan diukur diameternya dengan memakai penggaris. Percobaan ini dilakukan sebanyak dua kali ulangan secara duplo.
Pengujian penempelan BAL pada usus tikus secara in vitro (Modifikasi Kos et al. 2003 dan Anggraeni 2010)
Setelah bakteri dapat melewati kondisi lambung dan usus yang ekstrim, bakteri harus dapat berkolonisasi pada bagian usus untuk dapat dikategorikan sebagai probiotik (FHO/WHO 2002).
Penelitian ini telah mendapat persetujuan atas perlakuan etik terhadap hewan percobaan dari Rumah Sakit Hewan IPB (Lampiran 1). Hewan percobaan yang digunakan adalah tikus putih konvensional (Rattus norvegicus) jenis Sprague Dawley berumur enam minggu berjenis kelamin jantan sebanyak 6 ekor dengan kisaran bobot 100-120 g per ekor yang diperoleh dari Biofarmaka IPB Bogor. Studi awal pengenalan bagian usus halus tikus dilakukan untuk mengetahui bagian ileum usus yang akan digunakan dalam percobaan (Lampiran 2).
1) Pemeliharaan tikus
Tikus dipelihara dalam kandang individu dan diadaptasikan selama 10 hari dengan pemberian ransum standar. Tikus dianestesi lalu dibedah untuk memperoleh organ usus halus sebagai sampel pengujian penempelan bakteri asam laktat (Lampiran 3).
2) Persiapan suspensi BAL (Nitisinprasert et al. 2006)
7 3) Uji penempelan BAL pada usus tikus
Usus halus (Ileum) dipotong dengan ukuran ± 1 cm2. Sampel dicuci tiga kali lalu direndam dalam larutan PBS pada suhu 4oC selama 30 menit. Sampel usus
diinkubasi ke dalam cawan petri yang berisi 10 mL larutan suspensi bakteri (9 log cfu/mL) dalam PBS pada suhu 37 oC selama 60 menit kemudian dibilas
dengan PBS sebanyak dua kali. Kontrol dipersiapkan, yaitu usus tidak diinkubasi dengan suspensi BAL. Penghitungan populasi BAL yang menempel pada permukaan usus dengan metode tuang menggunakan media MRSA dengan 0.5% CaCO3. Jumlah BAL yang menempel pada permukaan usus dihitung dengan cara menghitung selisih populasi BAL yang menempel pada permukaan usus pada perlakuan inkubasi dengan suspensi BAL indigenus dibandingkan populasi BAL pada kontrol. Percobaan ini dilakukan secara duplo dan dua kali ulangan.
4) Pembuatan preparat histologis usus (Analisis histologis) (Suntoro 1983)
Pembuatan preparat histologis untuk membuktikan masing-masing isolat bakteri asam laktat yang dapat bertahan di jaringan usus halus dengan melihat kemampuan sifat penempelan bakteri asam laktat.
Kemampuan penempelan BAL pada mukosa usus halus dilakukan dengan analisa histologis. Semua sampel ileum ukuran 1 cm2 untuk evaluasi histologis difiksasi dalam paraformaldehid 4%. Sampel kemudian didehidrasi dengan larutan alkohol 70%, 80%, 90%, 95%, dan alkohol absolut I, II, III, kemudian dijernihkan dengan larutan xylol I, II, III, selanjutnya sampel diinfiltrasi dengan parafin I, II, III dan diblok dengan parafin. Proses selanjutnya blok dipotong dengan ketebalan 4-5 Sm menggunakan mikrotom dan diwarnai dengan pewarnaan Hematoxylin-Eosin (HE) dan siap dievaluasi.
Karakterisasi dan Identifikasi Isolat BAL Probiotik Karakterisasi isolat BAL
Karakterisasi isolat BAL terpilih meliputi morfologi koloni dan morfologi sel yang terdiri dari bentuk sel, pewarnaan Gram dan spora, pengamatan sifat fisiologis meliputi motilitas, katalase, uji tipe fermentasi, amilolitik, lipolitik, serta pengamatan pertumbuhan pada suhu, pH dan kadar NaCl yang berbeda.
1) Pewarnaan Gram (Waluyo 2010)
Bakteri terlebih dahulu difiksasi dengan cara sebagai berikut: 1 ose isolat bakteri disebarkan tipis dan merata diatas kaca objek dan dipanaskan pada api kecil secara tidak langsung (fiksasi) kemudian diangin-anginkan di udara hingga kering dan membentuk lapisan kultur yang kering dan merata.
8
2) Pewarnaan spora (Waluyo 2010)
Bakteri digoreskan pada gelas objek yang bersih dan difiksasi. Sampel diteteskan malachite green dan dipanaskan di atas bunsen tetapi tidak sampai mendidih atau mengering. Setiap kali pewarna menjadi kering meneteskan lagi pewarna baru lalu dibilas dengan air selama beberapa detik dan dikeringkan dengan menggunakan kertas tissue. Sampel diteteskan larutan safranin selama 30 detik dan dibilas dengan air mengalir/kran dengan cepat, lalu dikeringkan dengan kertas tissue. Hasil pewarnaan diamati, spora bakteri akan terlihat berwarna hijau sedangkan sel vegetatif akan berwarna merah.
3) Uji motilitas (Tiwari et al. 2009)
Bakteri diinokulasikan secara vertikal pada media sulfide indol motility (SIM) dan di inkubasi selama 24 jam. Moltilitas bakteri ditunjukkan dengan adanya pertumbuhan pada permukaan medium dan tidak ada bekas pada tusukan. Bakteri non motil tumbuh sepanjang tusukan.
4) Uji katalase (Fardiaz 1989)
Satu ose isolat diambil dari media pertumbuhan MRSA dan diletakkan pada gelas obyek yang bersih. Sampel diteteskan pereaksi H2O2 3% serta dibiarkan beberapa saat. Uji positif ditandai dengan terbentuknya gelembung. Hasil uji negatif menunjukkan ciri bakteri probiotik.
5) Uji tipe fermentasi (Suryani et al. 2010)
Pengujian tipe fermentasi dilakukan dengan uji produksi gas. Kultur isolat dimasukkan ke dalam media MRSB dalam tabung reaksi yang diberi tabung durham dalam keadaan terbalik untuk menangkap gas yang dihasilkan oleh BAL selama dalam pertumbuhannya. Inkubasi selama 2-3 hari pada suhu 30oC. Bakteri asam laktat tersebut dinyatakan sebagai heterofermentasi, sedangkan isolat yang tidak menghasilkan atau memproduksi gas disebut homofermentatif.
6) Uji aktivitas amilolitik (Fardiaz 1989)
Bakteri asam laktat yang telah ditumbuhkan pada media miring MRSA selama 24 jam diambil menggunakan jarum tanam lalu dititikkan ke dalam media NA yang mengandung 1% pati tapioka, dan diinkubasi selama 24 jam. Zona bening yang terbentuk diamati dengan menambahkan larutan iodin pada koloni bakteri. 7) Uji aktivitas lipolitik (Fardiaz 1989)
Bakteri asam laktat yang telah ditumbuhkan pada media miring MRSA selama 24 jam diambil menggunakan jarum tanam lalu dititikkan ke dalam media NA yang mengandung 1% lemak nabati (mentega) dan indikator neutral red sebagai substrat. Inkubasi dilakukan selama 24 jam.
Koloni yang dapat menghidrolisa lemak menjadi gliserol dan asam lemak menyebabkan penurunan pH medium sehingga menyebabkan terbentuknya warna merah pada bagian bawah koloni. Indikator neutral red akan tetap berwarna kuning jika lemak di dalam medium tidak dihidrolisa sehingga pH tetap mendekati netral. 8) Pertumbuhan BAL pada suhu, pH dan kadar NaCl yang berbeda (Tanasupawat et al. 1998)
9 30oC, 37oC dan 45oC untuk pengujian pertumbuhan pada suhu yang berbeda. Inkubasi pada suhu 37°C untuk pengujian pertumbuhan pada pH dan kadar NaCl. OD diukur pada panjang gelombang 660 nm.
Identifikasi isolat BAL terpilih
Identifikasi dilakukan dengan menggunakan API 50 CHL. Kultur BAL digores pada media MRSA dan diinkubasi selama 24 jam pada suhu 37oC. Kultur BAL dipanen dan dimasukkan ke dalam media API 50 CHL dan dihomogenkan dengan vortex. Penyiapan kit dilakukan dengan memasukkan air steril pada sumur kit dengan menggunakan mikropipet untuk mengkondisikan suasana tetap lembab. Memasukkan strips pada kit dengan urutan strip biru diletakkan pada baris pertama dan kedua pada kit, strips hijau baris ketiga dan keempat dan strips merah diletakkan pada baris terakhir pada kit. Media API 50 CHL yang telah dihomogenkan dengan BAL dimasukkan kedalam sumuran strips dengan mikropipet, menutup sumuran strips dengan mineral oil untuk memberikan lingkungan anaerob dan diinkubasi selama 48 jam pada suhu 37oC. Parameter uji adalah perubahan warna setelah diinkubasi selama 24 jam. Hasil pengamatan diolah menggunakan software ApiwebTM.
Analisis Data
Data kuantitatif yang diperoleh dari hasil pengujian disajikan dalam bentuk rata-rata dan standar deviasi. Data-data kualitatif diolah dengan melihat ada atau tidaknya suatu komponen dalam sampel. Data yang telah diolah selanjutnya dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Isolat probiotik harus dapat melewati kondisi ekstrim dengan keasaman yang tinggi di lambung serta mampu bertahan pada kondisi garam empedu di saluran pencernaan. Ketahanan terhadap tingkat keasaman yang tinggi merupakan sifat yang pertama yang harus dipenuhi sebagai probiotik pada saat akan melakukan seleksi isolat probiotik (Tuomola et al. 2001). Probiotik juga harus mampu menempel pada sel epitel usus, mampu membentuk kolonisasi pada saluran pencernaan, mampu menghasilkan zat antimikroba dan memberikan pengaruh yang menguntungkan inangnya. Syarat lainnya adalah tidak bersifat patogen dan aman jika dikonsumsi (Prado et al. 2008).
10
dan tidak terkontaminasi, maka diperoleh 5 isolat yang diteliti potensinya sebagai probiotik yaitu BP(25), NS(5), SS(3), NS(6) dan BP(8).
Bakteri Asam Laktat yang Berpotensi sebagai Probiotik Ketahanan BAL pada pH Lambung (pH 2.0) dan pH Usus (pH 7.2)
Faktor utama penentu ketahanan bakteri melewati lambung sampai dengan usus halus adalah pH lambung. Makanan yang masuk berperan sebagai bufer dan merupakan tekanan awal BAL masuk ke dalam tubuh manusia adalah terpapar asam lambung, dengan tingkat pH yang sangat rendah yaitu sekitar 2.0 pada kondisi lambung kosong dan sekitar 3.0 pada kondisi lambung berisi (Minellia et al. 2004). Hasil pengujian ketahanan BAL asal bekasam pada pH lambung (pH 2.0) dan pH usus (pH 7.2) dapat dilihat pada Tabel 1.
Tabel 1 Ketahanan hidup isolat BAL asal bekasam pada pH lambung (pH 2.0) dan pH usus (pH 7.2)
Keterangan: - = jumlah koloni <2.5×106 cfu/mL
Populasi awal semua isolat BAL, yaitu populasi setelah ditumbuhkan pada media MRSB pada suhu 37°C selama 24 jam, yang juga digunakan pada pengujian ketahanan pada pH, berkisar antara 7-9 log cfu/mL (Tabel 1). Kondisi kelima isolat pada pH 2.0 dan pH 7.2 mengalami penurunan populasi tidak lebih dari 2 log cfu/mL, dengan ketahanan hidup yang tinggi yaitu 84.67-94.68%. Lin et al. (2006) melaporkan bahwa ketahanan hidup BAL ≥50% pada kondisi pH 2.0 dinyatakan mempunyai ketahanan hidup yang tinggi.
Isolat BP(25) dikeluarkan dari uji seleksi probiotik selanjutnya karena jumlah populasi akhir <2.5×106 cfu/mL. Bakteri yang masuk ke dalam lambung akan mengalami penurunan populasi karena terpapar asam lambung (HCL) dengan tingkat pH yang sangat rendah yaitu sekitar 2.0 dan adanya garam empedu pada usus halus bagian atas, sehingga jumlah populasi bakteri probiotik memiliki standar minimal 106 cfu/mL agar ketika sampai pada usus halus jumlah populasi bakteri probiotik masih mendominasi dibanding bakteri patogen. Wahyudi et al. (2008) menyatakan bahwa mikroflora saluran pencernaan atau bakteri probiotik yang mendominasi pada usus halus akan mendominasi tempat penempelan pada usus sehingga bakteri patogen tidak dapat menempel dan fungsi usus akan berjalan optimal.
11 umumnya minimal sebesar 106-108 cfu/mL. Shah (2007) menambahkan bahwa jumlah minimal strain probiotik yang ada dalam produk makanan adalah sebesar 106 cfu/g atau jumlah strain probiotik yang harus dikonsumsi setiap hari sekitar 108 cfu/g, dengan tujuan untuk mengimbangi kemungkinan penurunan jumlah bakteri probiotik pada saat berada dalam jalur pencernaan.
Penurunan log yang terkecil menunjukkan ketahanan hidup yang paling besar, sebaliknya penurunan log yang paling besar menunjukkan ketahanan isolat BAL yang rendah. Isolat NS(5) dan SS(3) memiliki ketahanan terhadap kondisi asam lambung yang paling resisten dengan jumlah penurunan <1 log cfu/mL, sedangkan isolat BP(8) dan NS(6) memiliki ketahanan pada asam lambung yang resisten dengan jumlah penurunan populasi 1-1.12 log cfu/mL (Gambar 3). Evanikastri (2003) melaporkan bahwa ketahanan BAL pada asam lambung dikatakan paling resisten jika penurunan populasi <1 log, resisten 1.5-3.5 log dan tidak tahan terhadap asam jika penurunannya >3.5 log. Lin et al. (2006) menguji ketahanan BAL dari lima produk probiotik komersial pada kondisi asam lambung. Produk A, B dan E mengalami penurunan populasi 2.23-3.43 log cfu/mL dan produk D dan C menurun sebesar 1-1.52 log cfu/mL.
Gambar 3 Penurunan populasi BAL (log cfu/ mL) pada pH lambung (2.0) ( ) dan pH usus (7.2) ( ).
Getah lambung mengandung senyawa HCl yang berfungsi menurunkan nilai pH dalam lambung. Waktu yang dibutuhkan suatu materi untuk melalui lambung secara normal yaitu sekitar 15 menit hingga 3 jam untuk kemudian keluar dari lambung. Kondisi tersebut mengakibatkan bakteri yang diseleksi sebagai kandidat probiotik harus memiliki ketahanan hidup yang tinggi pada kondisi asam lambung dengan lama inkubasi 3 jam (Guerra et al. 2012).
Hutkins dan Nannen (1993) melaporkan bahwa bila bakteri terpapar oleh asam kuat, maka membran sel akan rusak sehingga beberapa komponen intraseluler akan keluar dari sel, diantaranya ion Mg, Ca, K, asam nukleat dan protein, akibatnya sel bakteri akan mengalami kematian dan menyebabkan terjadinya penurunan populasi isolat BAL. Beberapa isolat BAL mampu bertahan pada pH rendah karena
12
mempunyai sistem regulasi sel yang mampu mengatur kondisi pH intraselulernya sehingga mampu bertahan pada kondisi pH rendah. Enzim proton-translocating ATPase (H+-ATPase) yang terikat pada membran sel yang dapat melakukan reaksi reversible berperan sebagai pompa yang memindahkan ion. Enzim tersebut mengkatalisa gerakan proton (H+) melewati membran sel melalui hidrolisis atau sintesis ATP. Ketahanan isolat terhadap pH ekstraseluler yang rendah tergantung dari pengaturan pH internal bakteri.
Menurut Cotter dan Hill (2003) menyatakan bahwa BAL mempunyai tiga sistem pertahanan utama yang menyebabkan mampu bertahan pada kondisi pH rendah atau keasaman yang tinggi yaitu sistem arginin deiminasi (ADI), pompa proton H+ -ATPase dan sistem glutamat-dekarboksilase (GAD). Bakteri asam laktat mampu bertahan pada kondisi keasaman yang tinggi melalui salah satu sistem pertahanan tersebut. Sistem arginin deiminasi (ADI) yaitu BAL dapat mengkatabolisme arginin menjadi ornithin, amonia, dan CO2. Amonia (NH3) akan meningkatkan pH internal sitoplasma sehingga dapat menyesuaikan hidupnya pada kondisi pH yang rendah. Sistem pertahanan dengan sistem pompa proton ATPase umumnya dimiliki oleh bakteri Gram-positif, dimana pompa ATPase mampu memindahkan proton (H+), dan menciptakan lingkungan eksternal menjadi alkali.
Sistem glutamat-dekarboksilase (GAD) yaitu BAL mampu memproduksi γ-aminobutirat (GABA) dari dekarboksilasi glutamat di dalam sel, sehingga terjadi
peningkatan pH intraseluler yang dapat menyebabkan BAL dapat bertahan pada lingkungan asam.
Siegumfeldt et al. (2000) melaporkan bahwa perbedaan ketahanan membran sel bakteri terhadap kerusakan akibat terjadinya penurunan pH ekstraseluler menyebabkan keragaman ketahanan sel pada pH rendah. Bakteri asam laktat juga mampu mempertahankan pH sitoplasma lebih alkali dari pada pH ekstraseluler, tetapi penurunan pH intraseluler tetap berlangsung seiring dengan menurunnya pH ekstraseluler yang mendukung toleransinya terhadap asam. Untuk mempertahankan pH sitoplasma lebih basa, sel harus memiliki membran yang merupakan barier yang membatasi pergerakan senyawa/proton. Komposisi asam lemak dan protein penyusun yang beragam di antara spesies bakteri diduga mempengaruhi keragaman ketahanan bakteri terhadap pH rendah.
Ketahanan BAL pada Garam Empedu
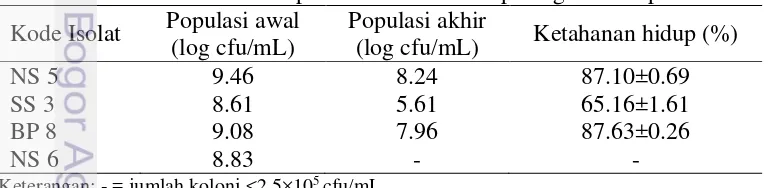
Bakteri yang mampu bertahan pada kondisi keasaman lambung akan dialirkan menuju ke usus bagian atas, didalam usus bakteri akan menghadapi tekanan yang berhubungan dengan ketersediaan O2 yang rendah dan garam empedu (Tuomola et al. 2001). Hasil pengujian ketahanan isolat BAL asal bekasam terhadap garam empedu (oxgal) dapat dilihat pada Tabel 2.
Tabel 2 Ketahanan hidup BAL asal bekasam pada garam empedu Kode Isolat Populasi awal
(log cfu/mL)
Populasi akhir
(log cfu/mL) Ketahanan hidup (%)
NS 5 9.46 8.24 87.10±0.69
SS 3 8.61 5.61 65.16±1.61
BP 8 9.08 7.96 87.63±0.26
NS 6 8.83 - -
13 Ketahanan terhadap garam empedu merupakan karakteristik penting bagi strain BAL untuk mampu bertahan dan berkembang pada kondisi kritis tersebut. Hasil pengujian BAL terhadap garam empedu menunjukkan ketahanan hidup semua isolat >50% atau termasuk dalam BAL yang berpotensi sebagai probiotik. Semakin tinggi persentase ketahanan BAL maka semakin baik karakteristiknya sebagai kandidat probiotik.
Isolat BAL yang memiliki penurunan log terkecil berarti memiliki ketahanan hidup terbesar terhadap garam empedu. Mitsuoka (1990) menyatakan bahwa ketahanan hidup bakteri kandidat probiotik dikatakan tinggi bila penurunannya tidak lebih dari 2 log cfu/mL. Isolat BP(8) dan NS(5) termasuk dalam kandidat probiotik yang memiliki ketahanan hidup tinggi atau paling resisten terhadap garam empedu karena penurunan jumlah populasinya tidak lebih dari 2 log. Isolat SS(3) termasuk kandidat probiotik yang memiliki ketahanan hidup resisten karena penurunan populasi mencapai 3 log cfu/mL. Isolat NS(6) dikeluarkan dari seleksi bakteri probiotik karena tidak dapat bertahan hidup pada kondisi garam empedu dengan jumlah yang cukup sebagai probiotik. Argyri et al. (2013) menguji ketahanan 12 strain BAL asal fermentasi minyak zaitun terhadap kondisi garam empedu 0.5% menghasilkan penurunan populasi tidak lebih dari 2 log.
Variasi spesies dan galur berpengaruh terhadap kemampuannya untuk bertahan hidup pada kondisi media yang mengandung garam empedu. Mourad dan Meriem (2008) melaporkan bahwa galur L. plantarum SH 12 mempunyai ketahanan terhadap garam empedu sebesar 75% yang lebih tinggi dibandingkan dengan galur L. plantarum SH 21 yaitu sebesar 65%. Susanti et al. (2007) menambahkan bahwa keragaman struktur asam lemak pada membran sitoplasma bakteri menyebabkan perbedaan sifat permeabilitas dan karakteristik sehingga mempengaruhi ketahannya terhadap garam empedu.
Populasi BAL yang diuji mengalami penurunan karena isolat BAL tidak tahan terhadap garam empedu. Leverrier et al. (2003) menyatakan bahwa garam empedu mengakibatkan perubahan morfologi sel bakteri yang disebabkan karena terjadinya pelepasan protein dari sel. Singhal et al. (2010) melaporkan bahwa garam empedu mampu menembus dan bereaksi pada sisi membran sitoplasma yang bersifat lipofilik sehingga membran sel menjadi rusak.
Keberadaan garam empedu merupakan kondisi kritis bagi bakteri dimana garam empedu dapat merusak dan bersifat toksit terhadap struktur membran sel bakteri (Morgolles et al. 2003). Pengujian ini menggunakan oxgal 0.5% dengan lama inkubasi 4 jam berlandaskan pada Argyri et al. (2013) yang menyatakan bahwa konsentrasi garam empedu pada lumen manusia adalah 0.5% dengan waktu penyerapan makanan di usus kecil selama 4 jam. Ketahanan beberapa strain pada garam empedu terkait dengan aktivitas hirolisis garam empedu yang dapat menghidrolisis garam empedu, mengurangi toksit dan efek samping garam empedu terhadap BAL.
14
terkonjugasi (berikatan) menjadi asam empedu tidak terkonjugasi (tidak berikatan) dan melepaskan asam amino glisin atau taurin.
Hasil pengujian ketahanan BAL asal bekasam terhadap kondisi pH lambung, pH usus dan garam empedu menunjukkan isolat BAL NS(5), SS(3) dan BP(8) memiliki ketahanan populasi >50%, sehingga termasuk dalam kategori kandidat probiotik yang memiliki ketahanan hidup yang tinggi. Ketiga isolat BAL ini digunakan untuk analisis selanjutnya.
Aktivitas Antibakteri
Salah satu cara kerja probiotik melalui mekanisme fungsi adalah fungsi protektif yaitu kemampuannya untuk menghambat patogen dalam saluran pencernaan (Collado et al. 2007). Hasil uji antibakteri BAL asal bekasam terhadap bakteri patogen dapat dilihat pada Tabel 3.
Tabel 3 Aktivitas antibakteri isolat BAL asal bekasam NS(5), SS(3), dan BP(8) Bakteri pathogen Rataan diameter zona hambat (mm)
NS(5) SS(3) BP(8)
E. coli 7.0±0.00 5.5±0.71 7.0±0.00
S. typhimurium ATCC 14028 7.0±0.00 9.0±0.00 6.5±0.71
Ketiga isolat BAL memiliki kemampuan menghambat pertumbuhan bakteri S. typhimurium ATCC 14028 dan E. coli yang ditunjukkan dengan terbentuknya zona bening (Tabel 3). Hal ini sesuai dengan hasil penelitian Desniar et al. (2013) yang menguji aktivitas antimikroba menggunakan isolat BAL yang sama. Isolat
yang diuji dapat menghambat lima jenis bakteri patogen yaitu E. coli, S. typhimurium ATTC 14028, Bacillus cereus, Staphylococcus aureus dan Listeria
monocytogenes.
Zona bening terbentuk karena adanya penghambatan senyawa antimikroba terhadap sel-sel mikroba. Secara umum mekanisme kerja dari suatu senyawa antimikroba dapat dilakukan dengan cara mengganggu atau merusak penyusun dinding sel, bereaksi dengan membran sel yang menyebabkan peningkatan permeabilitas seluler, inaktifasi enzim-enzim essensial, dan destruksi atau inaktifasi fungsi dari materi genetik (Sari 2013). Waluyo (2010) melaporkan bahwa antibiotik juga bekerja dengan cara mengganggu fungsi membran sel yang menyebabkan gangguan terhadap kehidupan sel, menghambat sintesis protein, dan sistesis asam nukleat.
15 Aktivitas antibakteri setiap isolat BAL berbeda terhadap bakteri patogen disebabkan oleh komponen antibakteri yang dihasilkan oleh setiap isolat yang juga berbeda. Aktivitas antibakteri BAL disebabkan terutama oleh asam organik yang diproduksi sebagai hasil metabolisme glukosa (Arief 2011). Hidayat (2006) menambahkan bahwa berbagai kultur bakteri dapat memproduksi hidrogen peroksida (H2O2) sebagai salah satu metabolit.
Hasil uji tipe fermentasi pada penelitian ini diketahui bahwa ketiga isolat BAL asal bekasam bersifat homofermentatif sehingga produk akhir fermentasinya adalah sebagian besar berupa asam laktat yang berfungsi sebagai antibakteri. Desniar et al. (2013) menyatakan bahwa BAL yang diisolasi dari produk fermentasi ikan berupa bekasam menghasilkan beberapa senyawa antibakteri berupa asam organik, hidrogen peroksida dan peptida, yang didominasi oleh asam organik yaitu asam laktat. Hutkins (2006) menyatakan bahwa BAL digunakan dalam makanan fermentasi karena kemampuannya untuk melakukan metabolisme gula dan membuat produk akhir asam laktat dan asam yang lainnya. Ada dua jalur fermentatif, yaitu homofermentatif dan heterofermentatif. Jalur homofermentatif, lebih dari 90% substrat gula diubah menjadi asam laktat. Berlawanan dengan jalur heterofermentatif menghasilkan kurang lebih 50% asam laktat dan 50% sebagai asam asetat, etanol dan karbondioksida. Bakteri asam laktat mempunyai satu atau dua jalur ini (obligat homofermentatif atau obligat heterofermentatif), meskipun ada beberapa spesies yang mempunyai metabolisme yang memerlukan keduanya (fakultatif homofermentatif).
Senyawa antibakteri lainnya yang diproduksi oleh BAL adalah bakteriosin yang merupakan molekul protein atau peptida ekstraseluler yang mempunyai aksi bakterisidal atau bakteriostatik terhadap bakteri yang mempunyai kekerabatan dekat (Albano et al. 2007). Nes et al. (2012) menyatakan bahwa probiotik dapat menghambat pertumbuhan bakteri patogen di dalam usus karena menghasilkan asam organik, komponen organik, hidrogen peroksida, dan bakteriosin.
Mekanisme penghambatan asam laktat terhadap sel bakteri karena asam laktat mempunyai sifat hidrofobik sehingga memudahkan difusi dalam bentuk proton ke dalam sel melalui membran sel. Akibatnya pH intraseluler lebih tinggi dibandingkan dengan pH ekstraseluler. Selanjutnya, di dalam sel, asam laktat terdisosiasi dan menurunkan pH intraseluler dengan melepaskan proton (Bogaert dan Naidu 2000). Pelepasan proton/ion hidrogen dapat mengganggu fungsi metabolik seperti translokasi substrat dan fosforilasi oksidatif sehingga menyebabkan sel bakteri tersebut terhambat pertumbuhannya (Arief 2011).
Penempelan BAL pada Usus Tikus Secara in Vitro
Bakteri probiotik dan produk probiotik berfungsi efektif jika viabilitasnya dapat dipertahankan sampai usus halus. Peran mikroba probiotik adalah menjaga keseimbangan mikroflora usus dengan cara memberikan proteksi pada membran mukosa terhadap mikroba patogen (Oyetayo dan Oyetayo 2005). Hasil penempelan BAL pada permukaan usus tikus dapat dilihat pada Tabel 4.
16
halus. Jumlah bakteri sepanjang usus halus pada tikus tidak berbeda nyata karena laju makanan yang lambat dan adanya multiplikasi bakteri.
Pertambahan jumlah BAL (Tabel 4) merupakan peningkatan jumlah BAL pada usus halus dibanding usus yang tidak diinkubasi dengan suspensi BAL selama 60 menit dengan pertambahan jumlah BAL 1.02-1.53 log cfu/cm2 pada usus yang diinkubasi dalam suspensi BAL. Hal ini mengindikasikan adanya penempelan BAL pada usus bagian ileum yang diinkubasi dalam suspensi BAL. Anggraeni (2010) melaporkan bahwa potongan usus yang diinkubasi pada suspensi BAL A29 selama 60, 90, dan 120 menit mengalami perubahan jumlah total BAL yang tidak berbeda nyata secara statistik (p>0.05), yaitu berturut-turut sebesar 0.3 cfu/cm2, 0.2 cfu/cm2, dan 0.3 cfu/cm2. Hasil penelitian ini diperkuat oleh Setyawardani (2012) melaporkan bahwa pada ileum tikus yang diinkubasi dalam suspensi BAL selama 60 menit menunjukkan kenaikan jumlah populasi BAL sebesar 1.39 – 1.58 log cfu/cm2.
Tabel 4 Penempelan BAL asal bekasam pada usus tikus secara in vitro Kode
Penempelan bakteri probiotik pada usus halus terutama bagian ileum (usus penyerapan) sangat bermanfaat untuk mencegah dominasi tempat penempelan bakteri patogen pada dinding usus sehingga fungsi penyerapan usus dapat berlangsung sempurna. Winarno et al. (2003) menyatakan bahwa koloni bakteri pada usus besar sangat tinggi tetapi pada usus halus jumlah mikroflora hanya sedikit yaitu jumlah bakteri dalam ileum sekitar 107/g dan dalam sekum 1010/g-1013/g, sehingga efek pertahanan pada usus halus terhadap patogen sangat terbatas dan menjadi target infeksi virus dan bakteri. Muchtadi (2012) menjelaskan bahwa setelah bakteri probiotik melewati lambung dan usus kecil, beberapa probiotik dapat bertahan hidup dan berkembang dengan cepat dalam usus besar.
Persentase penempelan BAL pada penelitian ini 10-15.40%. Ileum tikus sebelum diberi perlakuan dilakukan perendaman selama 30 menit dan pencucian sebanyak tiga kali menggunakan PBS untuk menghilangkan mukus agar penempelan BAL terjadi di dalam sel epitel sehingga mampu menginvasi patogen. Umumnya BAL yang melekat pada sel epitel lebih sedikit dibanding BAL yang dapat melekat pada lapisan mukus. Bakteri yang melekat pada mukus dikhawatirkan penempelannya bersifat sementara dan akan mudah tercuci dengan gerakan peristaltik usus. Nitisinprasert et al. (2006) melaporkan bahwa penempelan BAL pada mukus broiler >20% memiliki kemampuan penempelan yang tinggi.
17 musin merupakan sumber karbohidrat dan peptida, dan nutrisi eksogenik termasuk vitamin dan mineral juga terdapat dalam matriks mukus. Bakteri yang mampu berkolonisasi pada mukus dapat menghindari pelepasan lewat sifat hidrokinetik usus (gerakan cairan dalam lumen usus menuju anus). Hal ini berlaku pada bakteri komensal dan bakteri patogen (Deplancke dan Gaskin 2001). Penempelan bakteri pada mukus sangat penting untuk kolonisasi sementara dan merupakan syarat bagi probiotik untuk dapat mengontrol keseimbangan mikrobiota usus. Lapisan mukosa pada usus berfungsi untuk melindungi dari mikroorganisme tertentu tetapi sekaligus juga menyediakan tempat penempelan, sumber nutrisi, dan matriks sebagai tempat proliferasi bakteri. Mukus memiliki reseptor yang mirip dengan reseptor pada sel epitel dimana bakteri dapat menempel. Mukus terus-menerus dikeluarkan ke dalam lumen dan segera diganti oleh mukus baru yang dikeluarkan oleh sel goblet. Hal ini
yang menyebabkan kolonisasi pada mukus hanya bersifat sementara (Juntunen et al. 2001).
Penempelan bakteri pada permukaan usus dipengaruhi oleh sel epitel yang berada pada permukaan usus, matriks ekstraseluler dan lapisan mukus. Lapisan mukus yang menutupi sel epitel merupakan kontak pertama di usus bagi mikroorganisme untuk melakukan penempelan dan kolonisasi di usus. Jika mukosa rusak, maka sel epitel usus merupakan tempat penempelan bakteri. Permukaan sel epitel usus diselimuti oleh lapisan yang bersifat visko-elastik yang terdiri dari glikoprotein yang merupakan sisi tempat penempelan bakteri. Bakteri yang telah berhasil menempel dengan adanya interaksi antara adhesin dengan reseptor yang berupa glikoprotein di sel epitel usus, selanjutnya akan berkolonisasi dan memanfaatkan musin serta glikoprotein lainnya untuk pertumbuhannya (Adlerberth et al. 2000). Battacharya dan Majumdar (1983) menambahkan bahwa kemampuan menempel bakteri dalam saluran pencernaan dipengaruhi beberapa faktor. Faktor-faktor yang mempengaruhi kemampuan menempel dari bakteri tersebut adalah asal bakteri tersebut, polisakarida dan glikoprotein pada permukaan sel bakteri, adanya inhibitor pada permukaan epitel usus halus (saluran pencernaan) serta gerakan usus dalam saluran pencernaan.
Kemampuan penempelan BAL sangat berarti jika BAL dikonsumsi sebagai pangan fungsional ataupun suplemen, karena dengan adanya BAL yang menempel maka BAL tersebut mampu bertahan hidup lebih lama di saluran pencernaan yang selanjutnya dapat berkembangbiak. Bakteri asam laktat yang tidak mampu menempel dengan baik akan ikut gerakan peristaltik usus bersama sisa makanan untuk selanjutnya terbuang bersama feses. Implikasi selanjutnya adalah BAL yang mampu menempel di usus akan mampu memberikan efek pertahanan usus yang lebih baik untuk menolak adanya kemungkinan bakteri patogen yang mampu melakukan penempelan ke usus. Sifat penempelan yang lebih tinggi akan memberikan efek menguntungkan yang lebih tinggi (Arief 2011).
18
diisolasi. Selain itu Matarese et al. (2003) menyatakan bahwa penempelan bakteri pada mukosa usus juga dipengaruhi oleh beberapa faktor seperti konsentrasi bakteri yang masuk ke dalam usus, pH usus, waktu transit, dan jenis diet.
Bakteri asam laktat menjaga keseimbangan mikroflora saluran pencernaan dan meningkatkan respon sistem imun dengan cara: 1) berkompetisi dengan patogen enterik, 2) memicu sintesis sitokin dari enterosit, 3) memproduksi metabolit yang bersifat toksin (H2O2), 4) memproduksi asam butirat (meningkatkan turnover enterosit), 5) memulihkan mikroflora normal selama terapi antibiotik, dan 6) memproduksi bakteriosin (Kaur et al. 2002).
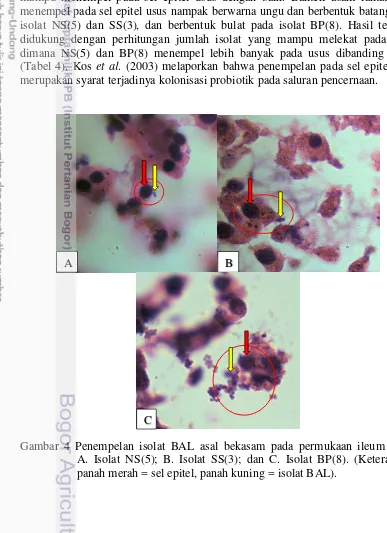
Penempelan BAL pada usus selain diamati dengan menghitung jumlah BAL juga berdasarkan hasil pewarnaan HE yang diamati menggunakan mikroskop (Gambar 4). Hasil pengamatan dengan pewarnaan HE menunjukkan ketiga isolat mampu menempel pada sel epitel usus dengan baik. Bakteri asam laktat yang menempel pada sel epitel usus nampak berwarna ungu dan berbentuk batang pada isolat NS(5) dan SS(3), dan berbentuk bulat pada isolat BP(8). Hasil tersebut didukung dengan perhitungan jumlah isolat yang mampu melekat pada usus, dimana NS(5) dan BP(8) menempel lebih banyak pada usus dibanding SS(3) (Tabel 4). Kos et al. (2003) melaporkan bahwa penempelan pada sel epitel usus merupakan syarat terjadinya kolonisasi probiotik pada saluran pencernaan.
Gambar 4 Penempelan isolat BAL asal bekasam pada permukaan ileum tikus. A. Isolat NS(5); B. Isolat SS(3); dan C. Isolat BP(8). (Keterangan: panah merah = sel epitel, panah kuning = isolat BAL).
A B
19 Penempelan BAL pada permukaan usus terutama pada sel epitel dapat memberikan manfaat kesehatan terhadap inangnya dan mencegah penempelan bakteri patogen pada permukaan usus. Oyetayo dan Oyetayo (2005) menjelaskan bahwa probiotik menjaga keseimbangan mikroflora usus dengan cara memberikan proteksi pada membran mukosa terhadap mikroba patogen dan mampu menstimulasi kekebalan spesifik (misalnya sistem imun humoral yaitu peningkatan Imunolobin A (IgA) dan non spesifik (misalnya pertahanan fisik yaitu dominasi penempelan pada permukaan usus). Mikroba probiotik juga berperan dalam mencegah infeksi usus, lactose intolerance, konstipasi, infeksi saluran urin, antikarsinogen, antikolesterol, immunostimulator, memperbaiki sintesis dan bioavabilitas zat gizi. Coconnier et al. (1993) melaporkan bahwa adhesi atau penempelan bakteri patogen pada permukaan mukosa menjadi tahap awal infeksi saluran usus. Penempelannya pada sel epitel usus akan mengakibatkan kolonisasi, kerusakan sel, gangguan mekanisme pengaturan sel, serta pertumbuhan dan perkembangbiakan interaseluler.
Ketiga strain BAL memiliki kemampuan penempelan yang berbeda-beda. Hal ini dipengaruhi oleh sifat BAL untuk melekat pada sel epitel mukosa dan hidrophobisitas, kedua faktor tersebut yang akan menentukan kemampuan strain BAL yang digunakan sebagai probiotik. Sifat adhesif akan menyebabkan probiotik tersebut mampu melakukan kolonisasi pada epitel mukosa dengan pembentukan bacterial film yang berperan dalam menyingkirkan bakteri patogen dari mukosa usus (Corcoran et al. 2005).
Semakin banyak BAL yang bertahan pada saluran pencernaan, maka kualitas serta kemampuan spesies BAL tersebut sangat baik. Bourlioux et al. (2003) membuktikan bahwa secara in vitro bakteri galur Lactobacillus dan Bifidobacteria dapat menghambat penempelan dan invasi bakteri enteropatogen penyebab diare.
Bakteri E.coli dapat menyebabkan erosi epitel permukaan dan banyak limfosit pada lamina propia dan muskularis mukosa sampai submukosa dan pelebaran pembuluh darah kapiler. Pemberian Lactobacillus bersamaan dengan atau setelah pemberian E.coli memberi efek yang baik berupa perbaikan sel epitel permukaan (regenerasi sel epitel dan bertambahnya sel goblet) dan tidak terlihat
denudasi epitel permukaan usus halus yang disebabkan oleh E. coli (Towoliu et al. 2013). Pemberian L. rhamnosus yang diisolasi dari air susu ibu
(ASI) selama 12 hari, menurunkan jumlah E. coli pada feses tikus Sprague Dawley dan menyembuhkan diare (Nuraida et al. 2012).
Karakteristik dan Identifikasi Isolat BAL Probiotik Karakteristik Isolat BAL Probiotik
Hasil karakterisasi ketiga isolat menunjukkan NS(5) dan SS(3) berbentuk batang dan BP(8) berbentuk bulat serta ketiganya merupakan bakteri Gram-positif (Gambar 5), tidak membentuk spora, katalase negatif, non motil dan homofermentatif (Tabel 5). Hal ini sesuai dengan yg dilaporkan Axelsson (2004) bahwa Bakteri asam laktat merupakan kelompok bakteri Gram positif, berbentuk bulat atau batang, tidak membentuk spora, mampu memfermentasi karbohidrat,
Gram-20
positif, tidak membentuk spora serta berbentuk batang dan bulat, BAL juga tidak memiliki alat gerak atau non motil.
Gambar 5 Bentuk isolat BAL: A. NS(5) berbentuk batang (basil) panjang agak ramping, B. SS(3) berbentuk batang pendek agak gemuk (basil-kokus), C. BP(8) berbentuk bulat (kokus)
Pewarnaan bakteri terdiri dari pewarnaan dengan kristal violet, yang terus diikuti dengan perlakuan pencelupan ke dalam suatu larutan lugol dan alkohol 99%. Bakteri Gram-positif tidak hilang warnanya bila tercuci alkohol dan tetap berwarna violet gelap, sedangkan bakteri Gram-negatif, warna akan luntur oleh pencucian alkohol dan baru diberi warna merah oleh safranin, yang dilakukan pada langkah akhir proses pewarnaan Gram. Yulistiani (2008) melaporkan bahwa dinding sel bakteri Gram-positif nampak lebih tebal dibanding bakteri Gram-negatif. Dinding sel bakteri Gram-positif mengandung 90% peptidoglikan dan lapisan tipis yang merupakan asam teikoat, sedangkan dinding sel bakteri Gram-negatif mengandung 5-20% peptidoglikan, lapisan lain terdiri dari protein, lipolisakarida, dan lipoprotein.
Hasil pengujian pewarnaan spora dari ketiga isolat BAL asal bekasam menunjukkan hasil yang negatif atau semuanya sel vegetatif. Waluyo (2008) menyatakan bahwa spora pada bakteri merupakan struktur yang tahan panas dan tahan bahan kimia. Spora dibentuk oleh bakteri tertentu untuk mengatasi lingkungan yang tidak menguntungkan bagi bakteri tersebut. Spora yang terbentuk di dalam sel disebut endospore dan spora yang terbentuk diluar sel disebut eksospora. Pada bakteri hanya terdapat satu spora. Spora pada bakteri tidak berfungsi untuk perkembangbiakan. Fardiaz (1989) menambahkan bahwa proses yang terjadi pada pewarnaan spora dimana spora bersifat tahan terhadap pewarnaan, akan tetapi sulit untuk melepas zat warna yang terserap didalamnya sehingga tidak dapat mengikat zat warna lain yang diberikan selanjutnya. Zat warna spora yang biasa diberikan adalah malachite green yang akan tetap diikat oleh spora bakteri setelah pencucian dengan air, Sebagai counterstrain digunakan safranin. Metode tersebut membuat endospora yang masih teradapat dalam sel vegetatif atau spora bebas akan berwarna hijau-biru, sedangkan sel vegetatif akan berwarna merah muda sampai merah. Prinsip pewarnaan ini untuk membedakan spora dari sel vegetatif.
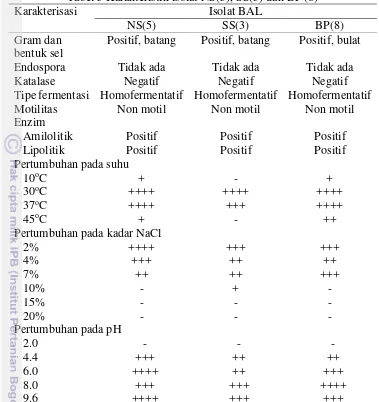
21 Tabel 5 Karakteristik isolat NS(5), SS(3) dan BP (8)
Karakterisasi Isolat BAL
NS(5) SS(3) BP(8)
Gram dan bentuk sel
Positif, batang Positif, batang Positif, bulat
Endospora Tidak ada Tidak ada Tidak ada
Katalase Negatif Negatif Negatif
Tipe fermentasi Homofermentatif Homofermentatif Homofermentatif
Motilitas Non motil Non motil Non motil
Enzim
Amilolitik Positif Positif Positif
Lipolitik Positif Positif Positif
Pertumbuhan pada suhu
Uji katalase bertujuan untuk mengetahui adanya enzim katalase pada isolat BAL. Katalase adalah enzim yang mampu mengkatalis penguraian hidrogen peroksida (H2O2) menjadi air dan O2. Hidrogen peroksida bersifat toksin terhadap sel karena bahan ini dapat menginaktifkan enzim dalam sel. Uji tersebut penting dilakukan untuk mengetahui sifat bakteri terhadap kebutuhan akan oksigen. Hidrogen peroksida terbentuk pada saat metabolisme aerob (Yulistiani 2008). Parameter yang menunjukkan adanya aktivitas katalase adalah adanya gelembung oksigen. Bakteri katalase negatif tidak menghasilkan gelembung-gelembung. Hal ini berarti H2O2 yang diberikan tidak dipecah oleh bakteri katalase negatif sehingga tidak menghasilkan oksigen.
22
dihasilkan. Ketiga isolat yang diujikan menunjukkan adanya aktivitas amilolitik dan lipolitik.
Waluyo (2007) menjelaskan bahwa enzim pada mulanya dihasilkan didalam sel, beberapa enzim diekspresikan melalui dinding sel dan dapat berfungsi di luar sel. Ada dua macam enzim berdasarkan tempat aktivitasnya, yaitu enzim ekstraseluler dan enzim intraseluler. Endoenzim atau enzim intraseluler mensintesis bahan seluler dan menguraikan nutrien untuk menyediakan energi yang dibutuhkan oleh sel, misalnya heksokinase mengkatalis fosforilasi glukosa dan heksosa (senyawa gula sederhana) di dalam sel. Eksoenzim atau enzim ekstraseluler merupakan enzim yang bekerja diluar sel, melangsungkan perubahan-perubahan pada nutrien di sekitarnya sehingga memungkinkan nutrien tersebut memasuki sel, misalnya enzim amilase menguraikan zat pati menjadi unit-unit gula yang lebih kecil, lipase mengkatalis hidrolisis lemak menjadi asam-asam lemak dan gliserol. Hidayat et al. (2006) menyatakan bahwa enzim yang berasal dari mikroba memiliki jumlah yang lebih besar melalui teknik fermentasi dan lebih mudah memperbaiki produktivitasnya dibanding enzim dari tanaman dan hewan.
Pertumbuhan mikroorganisme dipengaruhi oleh beberapa faktor, diantaranya yaitu suhu, pH dan konsentrasi garam. Rahayu dan Nurwitri (2012) menjelaskan bahwa suhu merupakan faktor dari luar bahan pangan yang sangat penting untuk pertumbuhan mikroba. Jenis maupun kelompok mikroba yang berbeda tumbuh pada kisaran suhu yang sangat luas dan berbeda-beda pula. Suhu dapat mempengaruhi lamanya fase lag, kecepatan pertumbuhan, kegiatan enzimatis dan penyerapan nutrisi oleh mikroba. Ketiga isolat BAL dapat tumbuh dengan baik pada suhu 30oC-45oC. Ketiga isolat termasuk mikroorganisme mesofil yaitu memiliki suhu optimum 20-40oC dengan kisaran suhu pertumbuhan 10-45oC. Hasil penelitian Setyawardani (2012) melaporkan bahwa berdasarkan suhu, BAL asal susu kambing termasuk dalam kelompok mesofilik dengan suhu 37oC (100 %), namun diantaranya dapat tumbuh pada suhu 45 oC (72.7%) dan pada suhu 10oC (54 %).
Ketiga isolat tergolong bakteri homofermentatif yang ditandai dengan tidak terbentuknya gelembung udara pada media uji tipe fermentasi. Hidayat et al. (2006) menyatakan bahwa BAL memfermentasi gula melalui jalur-jalur yang berbeda yaitu homofermentatif dan heterofermentatif atau fermentasi campuran. Homofermentatif hanya menghasilkan asam laktat sebagai produk akhir metabolisme glukosa. Bakteri heterofermentatif memecah gula menjadi asam laktat, CO2, etanol dan asetat. Bakteri asam laktat juga mampu membentuk produk-produk lain, misalnya aroma seperti diasetil dan asetoin.
Ketiga isolat BAL dapat tumbuh pada kadar NaCl 2%-7% dan tidak dapat tumbuh pada kadar NaCl 10%-20%, kecuali SS(3) dapat tumbuh pada kadar NaCl 10% namun kurang bagus atau peningkatan pertumbuhannya hanya sekitar 0.813 OD pada panjang gelombang 660 nm (Tabel 5).
23
Identifikasi Isolat BAL Probiotik
Identifikasi dilakukan untuk melihat kemiripan atau kekerabatan isolat BAL asal bekasam dengan spesies yang telah teridentifikasi. Penentuan tingkat spesies BAL juga dapat dilakukan dengan melihat pola fermentasi pada berbagai jenis gula, yaitu dapat menggunakan API KIT 50 CHL. Prinsip pengujian identifikasi menurut panduan Biomerieux Industry yaitu perbandingan profil terhadap database takson pada software. Perbandingan memperhitungkan profil yang diperoleh dengan cara mencari kesamaan typical profile dari setiap takson pada database. Persentase keterkaitan isolat bakteri dan takson dengan melihat % id (persentase kedekatan identitas) dan indeks T (kemiripan takson).
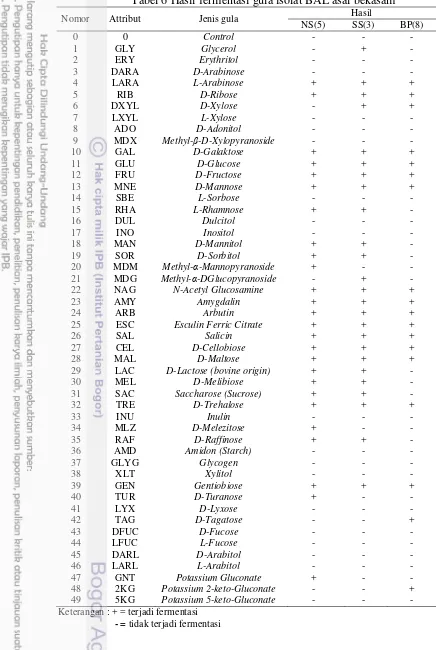
API 50 CHL digunakan untuk mengidentifikasi genus BAL hingga ke tingkat spesies. Test kit tersusun atas 49 tube yang terdiri dari 49 jenis gula yang akan difermentasi oleh isolat uji. Fermentasi ditandai dengan perubahan warna indikator bromkresol ungu menjadi hijau kekuningan hingga kuning, kecuali jenis gula nomor 25 (Esculin Ferric Citrate) fermentasi ditandai dengan perubahan warna menjadi hitam. Pembacaan hasil fermentasi menggunakan API WEB software (API bioMerieux). Hasil fermentasi menggunakan API KIT 50 CHL dapat dilihat pada Tabel 6 dan Lampiran 5.
Isolat BAL NS(5), SS(3), dan BP(8) dapat memfermentasi beberapa jenis gula. Isolat NS(5) dapat memfermentasi 26 jenis gula, SS(3) memfermentasi 25 jenis gula dan BP(8) memfermentasi 18 jenis gula (Tabel 6). Kaplan dan Hutkins (2000) menyatakan bahwa kemampuan isolat BAL memfermentasi oligosakarida merupakan salah satu sifat probiotik yang diinginkan karena kandungan monosakarida pada pencernaan akan berpengaruh terhadap kehidupan mikroba pada usus. Winarno et al. (2003) menjelaskan bahwa sifat terpenting dari bakteri asam laktat adalah kemampuannya untuk memfermentasi gula menjadi asam laktat. Sifat ini penting dalam pembuatan produk-produk fermentasi seperti fermentasi sayuran (sauerkraut, pikel dan sebagainya), fermentasi susu dan ikan, karena produksi asam oleh bakteri asam laktat berjalan secara cepat, maka pertumbuhan bakteri lain yang tidak diinginkan dapat dihambat.
Hasil identifikasi menggunakan API WEB software menunjukkan NS(5)
adalah Lactobacillus plantarum 1 dengan kemiripan 99.9%, SS(3) adalah L. pentosus dengan kemiripan 99.9% dan BP(8) adalah Pediococcus pentosaceus 1
dengan kemiripan 99.9%. Nilai % id 99.9% tergolong excellent identification. Hasil identifikasi ini memperkuat hasil karakterisasi sebelumnya yang menunjukkan bahwa ketiga isolat merupakan bakteri homofermentatif. Salminen et al. (2004) menyatakan bahwa Pediococcus dan L. plantarum termasuk bakteri homofermentatif.
24
Tabel 6 Hasil fermentasi gula isolat BAL asal bekasam
Nomor Attribut Jenis gula Hasil
NS(5) SS(3) BP(8)
Keterangan : + = terjadi fermentasi
25
4 SIMPULAN DAN SARAN
Simpulan
Lima isolat BAL asal bekasam yang diteliti, terdapat 3 isolat (60%) yaitu isolat NS(5), SS(3) dan BP(8) yang termasuk bakteri probiotik. Ketiga isolat memiliki karakteristik bakteri Gram-positif, non endospora, katalase negatif, homofermentatif, non motil, memiliki aktivitas amilolitik dan lipolitik, dapat tumbuh dengan baik pada suhu 30-37oC, kadar NaCl 2-7% dan pH 4.4-9.6. Isolat NS(5) berbentuk batang adalah Lactobacillus plantarum 1 dengan kemiripan 99.9%, SS(3) berbentuk batang adalah L. pentosus dengan kemiripan 99.9% dan BP(8) berbentuk bulat adalah Pediococcus pentosaceus 1 dengan kemiripan 99.9%.
Saran
Penelitian BAL yang perlu kajian mendalam yaitu: 1) Efektivitas BAL probiotik dalam mencegah bakteri patogen secara in vivo, 2) Produk bekasam
probiotik yang dapat langsung dikomsumsi dan waktu penyimpanannya, 3) Aplikasi probiotik asal bekasam dalam bidang biomedis ataupun produk lain.
DAFTAR PUSTAKA
Albano H, Todorov SD, van Reenen CA, Hogg T, Dicks LMT, Teixeira P. 2007. Characterization of two bacteriocins produced by Pediococcus acidilactici isolated from "alheira", a fermented sausage traditionally produced in Portugal. Int J Food Microbiol. 116:239-247.doi:10.1016/j.ijfoodmicro.2007. 01.011.
Adlerberth I, Cerquetti M, Poilane I, Wold A, Collignon A. 2000. Mechanisms of colonisation and colonisation resistanceof the digestive tract. Microb Ecol Health Dis. 11:223-239.
Anggraeni D. 2010. Studi penempelan bakteri asam laktat asal air susu ibu (ASI) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Arief II, Jenie BSL, Astawan M, Witarto AB. 2010. Efektivitas probiotik Lactobacillus plantarum 2C12 dan Lactobacillus plantarum 2B4 sebagai pencegah diare pada tikus percobaan. Med Pet. 33(3):137-134.doi:10.5398/ medpet.2010.33.3.137.
Arief II. 2011. Karakterisasi bakteri asam laktat indigenus asal daging sapi sebagai probiotik dan identifikasinya dengan analisis urutan basa gen 16S rRNA [disertasi]. Bogor (ID): Institut Pertanian Bogor.