PREBIOTIK DENGAN PEMANASAN SUHU TINGGI
DAN HIDROLISIS ENZIMATIK
DEVY NURUL NATHALIA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Produksi Xilooligosakarida dari Tongkol Jagung Sebagai Kandidat Prebiotik dengan Pemanasan Suhu Tinggi dan Hidrolisis Enzimatik adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
Devy Nurul Nathalia
DEVY NURUL NATHALIA. Xylooligosaccharide Production of Corncobs as Prebiotic Candidate by High Temperature Heating and Enzymatic Hydrolysis. Under direction of Prof. Dr. Ir Betty Sri Laksmi Jenie, MS., Dr. Dra. Suliantari, MS., and Dr. Ir Nur Richana, MSi.
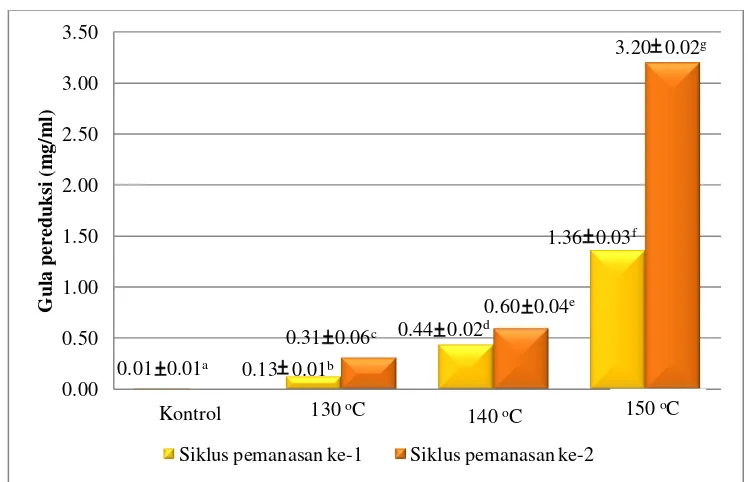
Corncob waste is a rich xylan source that can be utilized as raw material for xylooligosaccharides (XOS) production. XOS is a potential prebiotic and has high economic value. Two corn varieties i.e. Bisi and Pioneer were first analyzed for its hemicellulose, cellulose and lignin contents and xylan yield to choose the corn variety to be studied. Process technology for XOS production was studied using available equipment such as oven. Xylooligosaccharide (XOS) from corncob was produced in two stages i.e. xylan extraction by heating at high temperatures in oven or autoclave as comparison, followed by enzymatic hydrolysis. Analysis of two corncob varieties showed that Pioneer variety contained higher hemicellulose content (34.98%) and xylan yield (18.32%) than Bisi variety (12.28% and 10.22%, respectively), therefore Pioneer variety was chosen as raw material for XOS production. Corncob particles were soaked in dilute acid (1 g/l H2SO4) for 12 h at 60 oC, filtered and washed with tap water and then heated in oven or autoclave. Before oven heating, The corncobs were added with water at various ratios (1:1 – 1:5) and then heated in oven at various temperature (130 oC, 140 oC, 150 oC for 0.5 h) and autoclave at 121oC for 0.5, 1, 1.5 and 2 h with one and two heating cycles. During heating, the total sugar and reducing sugar were increase, while the degree of polymerization was decrease. The results showed that heating in oven to extract the xylan was affected by the ratios of corncobs and aquadest and heating temperatures. Oven heating (130-150 o
C) with optimum ratio of corncobs and aquadest (1:3) successfully increased the xylan content from 3.98% up to 18.21 – 19.46% while repeated heating cycle (two cycles) did not affect the xylan content. Heating the corncobs with aquadest (at the ratio of 1:3) in oven at 130 oC for 0.5 h produced 18.98% xylan and enzymatic conversion of the xylan by xylanase significantly increased the XOS content from 19.60% up to 44.06%. Heating the corncobs in autoclave (121 oC, 0.5 h) followed by enzymatic conversion produced higher XOS content (65.67%). The corncob XOS could stimulate the growth of Lactobacillus plantarum kik and Bifidobacterium longum ATCC 15707 by 1.2 until 1.7 unit log, indicating the prebiotic properties. Cookies prebiotic produced by addition of 5% (based on wheat flour) had higher hardness texture (1256 gf) than control without XOS (1067 gf).
DEVY NURUL NATHALIA. Produksi Xilooligosakarida dari Tongkol Jagung Sebagai Kandidat Prebiotik dengan Pemanasan Suhu Tinggi dan Hidrolisis Enzimatik. Dibimbing oleh Prof. Dr. Ir Betty Sri Laksmi Jenie, MS., Dr. Dra. Suliantari, MS., dan Dr. Ir Nur Richana, MSi.
Limbah tongkol jagung merupakan sumber xilan tinggi yang dapat dimanfaatkan sebagai bahan baku untuk produksi xilooligosakarida (XOS) yang berpotensi sebagai prebiotik dan memiliki nilai ekonomis yang tinggi. Dua varietas jagung yaitu Bisi dan Pioneer dianalisis kandungan hemiselulosa, selulosa dan lignin serta rendemen xilan untuk menentukan varietas jagung yang akan digunakan. Dalam penelitian ini dipelajari teknologi produksi XOS dari tongkol jagung menggunakan peralatan yang lebih mudah tersedia seperti oven. Produksi xilooligosakarida (XOS) dari tongkol jagung dilakukan dalam dua tahap yaitu ekstraksi xilan dengan perlakuan pemanasan kemudian dilanjutkan dengan konversi enzimatik xilan menjadi XOS. Hasil analisis menunjukkan bahwa tongkol jagung varietas Pioneer memiliki kadar hemiselulosa (34.98%) dan rendemen xilan (18.32%) yang lebih tinggi dari varietas Bisi (12.28% dan 10.22%). Dengan demikian dalam penelitian produksi XOS digunakan tongkol jagung varietas Pioneer. Ekstraksi xilan dari tongkol jagung dilakukan meliputi perendaman dalam larutan asam encer (1 g/l H2SO4) terlebih dahulu selama 12 jam pada suhu 60 oC, disaring dan dicuci dengan air keran. Selanjutnya tongkol jagung dalam kondisi terendam dalam air (rasio 1:1 – 1:5) dipanaskan dalam oven pada berbagai suhu (130 oC, 140 oC, dan 150 oC selama 0,5 jam) dan dalam otoklaf (121 oC selama 0.5, 1, 1.5 dan 2 jam) dengan satu dan dua siklus pemanasan. Selama pemanasan terjadi peningkatan total gula dan gula pereduksi serta penurunan derajat polimerisasi (DP). Perlakuan pemanasan dalam oven untuk mengekstraksi xilan dipengaruhi oleh rasio tongkol jagung dan akuades, serta suhu pemanasan. Pemanasan dalam oven pada suhu 130-150 oC berhasil meningkatkan kadar xilan dari 3.98% menjadi sekitar 18.21 – 19.46% (bk), sedangkan siklus pemanasan berulang (dua siklus) tidak mempengaruhi kadar xilan. Pemanasan pada suhu 130 oC dengan rasio tongkol jagung dalam akuades sebesar 1 : 3 dalam oven selama 0.5 jam menghasilkan kadar xilan sebesar 18.98%. Konversi xilan lebih lanjut oleh xilanase (oven, 130 oC, 0.5 jam) mampu meningkatkan kadar XOS secara signifikan dari 19.60% (kadar XOS sebelum hidrolisis) menjadi 44.06% (kadar XOS setelah dihidrolisis enzimatik). Pemanasan tongkol jagung dalam otoklaf (121oC, 0.5 jam) dilanjutkan dengan konversi xilan melalui hidrolisis enzimatis xilanase menghasilkan kadar XOS yang lebih tinggi daripada oven yaitu masing-masing sebesar 65.67% dan 44.06%.
Dua strain kandidat probiotik (L. plantarum kik dan B. longum ATCC 15707) dapat tumbuh baik dalam media yang mengandung XOS tongkol jagung sebesar 1.2 hingga 1.7 unit log, yang mengindikasikan sifat prebiotik. Aplikasi XOS tongkol jagung sebanyak 5% dalam pembuatan model pangan fungsional menghasilkan kukis prebiotik dengan tingkat kekerasan yang lebih tinggi (1256 gf) daripada kontrol (1067 gf).
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PREBIOTIK DENGAN PEMANASAN SUHU TINGGI
DAN HIDROLISIS ENZIMATIK
DEVY NURUL NATHALIA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Devy Nurul Nathalia
NIM : F251080131
Disetujui
Komisi Pembimbing
Prof. Dr.Ir. Betty Sri Laksmi Jenie, M.S Dr. Dra. Suliantari, M.S
Ketua Anggota
Dr. Ir. Nur Richana, M.Si Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana IPB
Dr. Ratih Dewanti-Hariyadi, M.Sc Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji syukur penulis panjatkan ke hadirat Tuhan YME atas berkat rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul
Produksi Xilooligosakarida dari Tongkol Jagung Sebagai Kandidat Prebiotik
dengan Pemanasan Suhu Tinggi dan Hidrolisis Enzimatik.
Pada kesempatan ini penulis ingin menyampaikan terima kasih yang
sebesar-besarnya kepada :
1. Ibu Prof. Dr. Ir Betty Sri Laksmi Jenie, MS selaku Ketua Komisi Pembimbing
dari Program Mayor Ilmu Pangan, Fakultas Teknologi Pertanian, Departemen
Ilmu dan Teknologi Pangan, IPB, atas segala kebaikan, bantuan, bimbingan,
motivasi, perhatian dan kepercayaannya untuk mengikutsertakan penulis dalam
proyek penelitian ini.
2. Ibu Dr. Dra. Suliantari, MS selaku Anggota Komisi Pembimbing dari Fakultas
Teknologi Pertanian, Departemen Ilmu dan Teknologi Pangan, IPB atas segala
kebaikan, bantuan, bimbingan, motivasi dan perhatian.
3. Ibu Dr. Ir. Nur Richana, M.Si selaku Anggota Komisi Pembimbing dari Balai
Penelitian dan Pengembangan Pascapanen, Cimanggu atas segala kebaikan,
bantuan, kesabaran, bimbingan, motivasi dan perhatian.
4. Bapak Dr.Ir. Sukarno, M.Sc selaku Dosen Penguji Luar Komisi atas
kesediannya, bantuan dan saran.
5. Ibu Dr. Ir. Harsi Dewantari Kusumaningrum, M.Sc selaku perwakilan dari
Program Mayor Ilmu Pangan, atas segala bantuan, arahan, dan saran. 6. Ibu Dr.Ir. Ratih Dewanti Hariyadi, M.Sc. selaku Ketua Mayor Ilmu Pangan.
7. Seluruh staff pengajar Program Mayor Ilmu Pangan, Fakultas Teknologi
Pertanian, Departemen Ilmu dan Teknologi Pangan, atas ilmu yang diberikan
selama menempuh studi di IPN.
8. Kedua orang tua, Bapak Soelinto SE, MM dan Ibu Sri Hendarti dan adik
tercinta Hesti Wulandari S.Des atas segala dukungan, motivasi, doa, kasih
atas segala dukungan dan kebersamannya berjuang di IPN.
10.Sahabat-sahabatku yaitu Rani, Eka, Tya, Mbak Rita, Mbak Nurha, Ibu Triana
dan Mbak Vita atas segala bantuan, motivasi dan kebersamaanya.
11.Para laboran dan teknisi di lingkungan Departemen ITP dan SEAFAST Center
(khususnya Pak Taufik, Mbak Ari, Bu Sri dan Pak Junaedi), terima kasih atas
segala bantuannya.
12.Para staff dan laboran di Balai Penelitian dan Pengembangan Pascapanen,
Cimanggu (khususnya Ibu Pia, Mbak Meli, Mbak Dewi, Mbak Citra, Pak Tri,
Pak Yadi, Pak Danu, Pak Afdan, Pak Ato dan Pak Yadi Mikro), terima kasih
atas segala bantuannya.
13.Semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu
persatu
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan. Oleh karena
itu, saran dan kritik yang membangun sangat penulis harapkan agar dapat
memberikan informasi dalam pengembangan karya tulis ilmiah ini lebih lanjut.
Semoga karya tulis ilmiah ini dapat bermanfaat bagi semua pihak.
Bogor, Agustus 2011
Penulis dilahirkan di Bekasi, Jawa Barat pada tanggal 2 Desember 1983 sebagai putri pertama dari 2 bersaudara dari pasangan Bapak Soelinto SE, MM
dan Ibu Sri Hendarti. Penulis menamatkan Sekolah Dasar (SD) dan Sekolah
Menengah Pertama (SMP) di Sekolah Katholik Pamardi Yuwana Bhakti, Bekasi
dan Sekolah Menengah Atas (SMA) di SMUN 42 Halim Perdana Kusuma ,
Jakarta Timur. Pada tahun 2001 penulis diterima di Jurusan Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam (FMIPA), Universitas Udayana, Bali
melalui jalur UMPTN (Ujian Masuk Perguruan Tinggi) dan lulus pada bulan
Oktober, 2005.
Pada tahun 2006- 2008, penulis bekerja di PT Bali Hai Brewery Indonesia,
Tambun-Bekasi sebagai Senior Supervisor Laboratory. Pada September 2008,
penulis diterima di Sekolah Pascasarjana Institut Pertanian Bogor (IPB), Program
DAFTAR TABEL ... xv
2.5 Pengaruh Asam Terhadap Rantai Xilan ... 10
2.6 Pengaruh Alkali Terhadap Rantai Xilan ... 12
2.7 Produksi XOS ... 13
2.8 Prebiotik ... 16
3. METODE PENELITIAN 3.1Waktu dan Tempat Penelitian ... 18
3.2Bahan dan Alat ... 18
3.3 Prosedur Penelitian ... 19
3.3.1 Seleksi Varietas Jagung ... 22
3.3.2 Ekstraksi Xilan dengan Pemanasan Tongkol Jagung dalam Oven dan Otoklaf ... 22
3.3.3 Produksi XOS Melalui Konversi Xilan Menggunakan Xilanase ... 23
3.4 Analisis Kimia ... 26
3.4.1 Penentuan Rendemen Ekstrak Xilan (modifikasi Yoshida et al., 1994) ... 24
3.4.2 Kadar Xilan (modifikasi Abreau et al., 2001 dan Ramos et al., 1999) ... 25
3.4.3 Kadar Hemiselulosa, Selulosa dan Lignin ... 26
3.4.4 Kadar XOS ... 28
3.4.5 Kadar Gula Pereduksi, Total Gula dan Derajat Polimerisasi ... 29
3.5 Analisis Mikrobiologi ... 31
3.5.1 Uji Sifat Prebiotik XOS ... 31
3.5.2 Total Bakteri Asam Laktat ... 32
3.6 Pembuatan Kukis (modifikasi Gustiar, 2009) Prebiotik dan Uji Kekerasan ... 33
3.7 Rancangan Percobaan ... 33
4.1.2 Rendemen dan Sifat Kelarutan Ekstrak Xilan ... 37
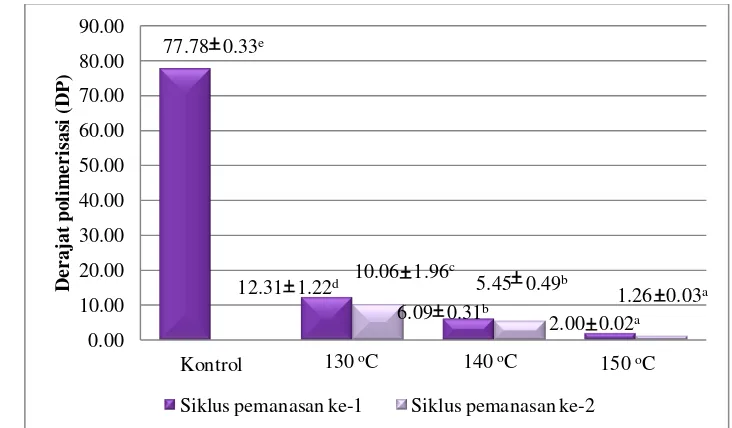
4.2 Pengaruh Suhu dan Siklus Pemanasan Dalam Oven ... 39
4.2.1 Total Gula Ekstrak Xilan ... 39
4.2.2 Gula Pereduksi Ekstrak Xilan ... 40
4.2.3 Derajat Polimerisasi Ekstrak Xilan ... 42
4.2.4 Kadar Xilan ... 45
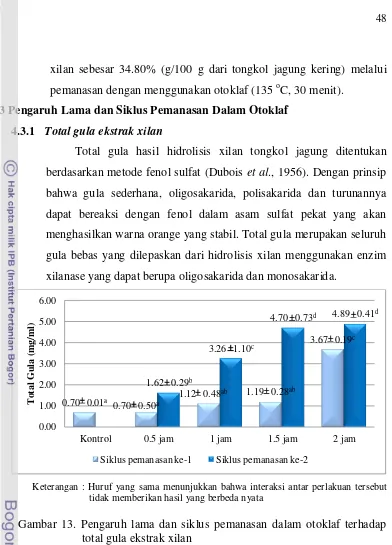
4.3 Pengaruh Lama dan Siklus Pemanasan Dalam Otoklaf 4.3.1 Total Gula Ekstrak Xilan ... 48
4.3.2 Gula Pereduksi Ekstrak Xilan ... 49
4.3.3 Derajat Polimerisasi Ekstrak Xilan ... 50
4.4 Produksi XOS dengan Konversi Enzimatik Xilan ... 51
4.5 Sifat Prebiotik XOS ... 54
4.6 Pembuatan Kukis XOS Prebiotik ... 56
5. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 59
5.2 Saran ... 59
DAFTAR PUSTAKA……….. ... 60
1. Komposisi kimia tongkol jagung ... 6
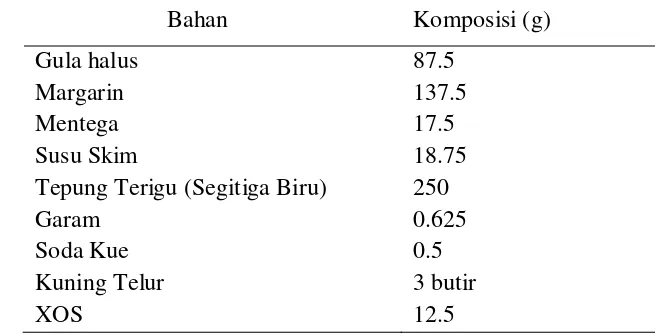
2. Formula kukis prebiotik XOS (Modifikasi Gustiar, 2009) ... 33
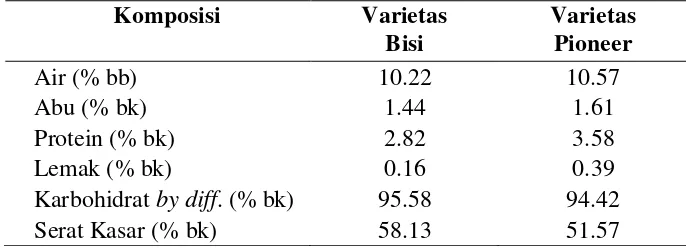
3. Hasil analisis proksimat komposisi kimia tongkol jagung (g/100g) ...35
4. Hasil analisis komposisi serat tongkol jagung ... ..35
5. Rendemen ekstrak xilan dari tongkol jagung Bisi dan Pioneer ... 37
6. Sifat kelarutan xilan dalam beberapa pelarut ... 38
7. Pengaruh suhu dan siklus pemanasan dalam oven terhadap derajat polimerisasi ekstrak xilan ... 44
8. Pengaruh suhu dan siklus pemanasan dalam oven terhadap kadar xilan... 47
1. Tanaman Jagung (Zea mays L.) ... 5 2. Struktur ligninselulosa material pada dinding sel tumbuhan
(Krafstoffe, 2008) ... 7
3. Struktur molekul xilan (Vazquez et al., 2006) ... 8
4. Struktur XOS (Akpinar et al., 2007) ... 10
5. Beberapa perlakuan untuk produksi XOS dari bahan baku
kaya xilan(Dominguez et al., 2003) ... 13
6. Prosedur produksi XOS melalui perlakuan dengan
pemanasan, air atau larutan asam (Vasquez et al., 2000) ... 15
7. Diagram alir penelitian (modifikasi Yang et al., 2005)... 21
8. Penampakan ekstrak xilan (basah) ... 38
9. Pengaruh suhu dan siklus pemanasan dalam oven terhadap
total gula ekstrak xilan ... 39
10. Pengaruh suhu dan siklus pemanasan dalam oven terhadap kadar gula
pereduksi ekstrak xilan ... 41
11. Pengaruh suhu dan lama pemanasan dalam oven terhadap
derajat polimerisasi ekstrak xilan ... 43
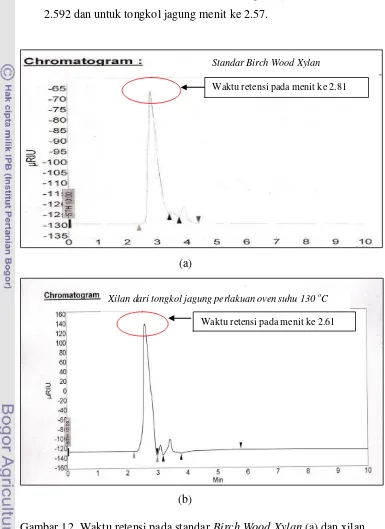
12. Waktu retensi pada standar Birch Wood Xylan (a) dan xilan tongkol
jagung (b) ... 46
13. Pengaruh lama dan siklus pemanasan dalam otoklaf terhadap total gula
ekstrak xilan ... 48 14. Pengaruh lama dan siklus pemanasan dalam otoklaf terhadap gula
pereduksi ekstrak xilan ... 49
15. Pengaruh lama dan siklus pemanasan pada perlakuan otoklaf terhadap
derajat polimerisasi ekstrak xilan ... 50
16. Viabilitas galur L.plantarum kik dan B. longum ATCC 15707
pada media mengandung XOS prebiotik 1% ... 54
17. Kukis kontrol dan prebiotik sebelum (a) dan
Halaman
1. Analisis Proksimat Karakteristik Bahan Baku ... 69
2. Diagram Analisis Rendemen Xilan dari Tongkol Jagung ... 72
3. Neraca Massa Rendemen Xilan ... 73
4. Komposisi Serat Tongkol Jagung ... 74
5. Kurva standar gula pereduksi xilosa (550 nm) ... 75
6. Kurva standar total gula (480 nm) ... 76
7. Analisa statistik pengaruh suhu dan siklus pemanasan dalam oven terhadap total gula ekstrak xilan ... 77
8. Analisa statistik pengaruh lama dan siklus pemanasan dalam otoklaf terhadap total gula ekstrak xilan ... 79
9. Analisa statistik pengaruh suhu dan siklus pemanasan dalam oven terhadap gula pereduksi ekstrak xilan ... 81
10. Analisa statistik pengaruh lama dan siklus pemanasan dalam otoklaf terhadap gula pereduksi ekstrak xilan ... 83
11. Analisa statistik pengaruh suhu dan siklus pemanasan dalam oven terhadap derajat polimerisasi ekstrak xilan ... 85
12. Analisa statistik pengaruh lama dan siklus pemanasan dalam otoklaf terhadap derajat polimerisasi ekstrak xilan ... 87
13. Data pengaruh suhu dan siklus pemanasan dalam oven terhadap kadar xilan ... 89
14. Analisa statistik viabilitas L.plantarum kik pada pengamatan 0 dan 24 jam ... 91
15. Analisa statistik viabilitas Bifidobacterium longum ATCC 15077 pada pengamatan 0 dan 24 jam ... 94
16. Kurva dan Profil standar xilan (Birch Wood Xylan) ... 97
sesudah hidrolisis enzimatik pada KCKT ... 100
19. Uji sifat prebiotik XOS terhadap pertumbuhan
Lactobacillus .plantarum kik……….101
20. Uji sifat prebiotik XOS terhadap pertumbuhan
1.1 Latar Belakang
Jagung (Zea mays L.) merupakan tiga kelompok besar makanan pokok
di Indonesia, selain beras dan terigu. Tanaman jagung merupakan salah satu
komoditas strategis dan bernilai ekonomis serta mempunyai peluang untuk
dikembangkan karena peranannya sebagai sumber utama karbohidrat dan
protein. Oleh karena itu produksi jagung selama dua dekade terakhir terus
mengalami peningkatan yang cukup tinggi. BPS (2010) melaporkan produksi
jagung dari tahun 2008, 2009 dan 2010 berturut-turut adalah 16.3 juta ton,
17.63 juta ton dan 18.36 juta ton pipilan kering. Varietas jagung yang
dikembangkan cukup beragam, seperti varietas unggul lokal, varietas hibrida
sampai varietas komposit (unggul dan lokal) yang dihasilkan oleh Badan
Litbang Pertanian maupun oleh instansi lain dan swasta. Varietas jagung
lokal yang banyak dikembangkan saat ini adalah Bisi, Bisma dan Pioneer
(Pulau Jawa), Lamuru dan Srikandi Putih (Maros) (Sudarno, 2003).
Seiring dengan peningkatan produksi jagung di Indonesia limbah
tongkol jagung yang dihasilkan juga mengalami peningkatan. Akan tetapi
pemanfaatan limbah tongkol jagung saat ini masih sangat terbatas dan belum
diolah secara optimal. Pada saat ini limbah tongkol jagung umumnya
digunakan sebagai pakan ternak, pengganti kayu bakar ataupun media untuk
budidaya jamur.
Tongkol jagung merupakan limbah pertanian yang dihasilkan dari
proses pemipilan jagung. Menurut Koswara (1991) bobot tongkol jagung
sekitar ± 30% dari bobot total yang besarnya dipengaruhi oleh varietas
jagungnya, sedangkan sisanya adalah kulit dan biji jagung. Jika dikonversi
terhadap produksi jagung maka ketersediaan tongkol jagung pada tahun 2009
sekitar 4.9 juta ton atau sekitar 5.1 juta ton, tahun 2010 (Richana et al.,
2004).
Tongkol jagung merupakan bahan berlignoselulosa (kadar serat
38.99%) yang mengandung xilan tertinggi dibandingkan limbah pertanian
(12.9%), kulit biji kapas (10.2%), bagas tebu (9.6%), sekam (6.3%) dan kulit
kacang (6.3%) (Richana et al., 2004). Hasil serupa dilaporkan oleh Parajo et
al. (2004) yang menggunakan alat parr reactor, dimana kandungan xilan
tertinggi diperoleh pada tongkol jagung (31.1 ± 0.3%) dibandingkan sekam barley (26.8 ± 0.14%), sekam padi (15.6 ± 0.4%), dan eucalyptus (16.6 ±
0.3%). Oleh karena itu, limbah tongkol jagung berpotensi sebagai sumber
bahan baku xilan untuk selanjutnya dikonversi menjadi xilooligosakarida
(XOS).
Xiloligosakarida (XOS) merupakan salah satu bentuk oligosakarida
yang dapat digunakan sebagai sumber prebiotik oleh probiotik (Pangsri,
2008). Oligosakarida dengan rantai sisi manosa dapat menghalangi pelekatan
mikroorganisme patogen (seperti Escherichia coli, Helicobacter pylori dan
Salmonella Typhimurium) pada dinding usus (Sheerman, 2008). Selain itu
manfaat XOS sebagai salah satu bentuk oligosakarida, berperan sebagai
prebiotik yang dapat menstimulasi secara selektif pertumbuhan dan atau
aktivitas probiotik didalam usus besar seperti Lactobacillus dan atau
Bifidobacterium.
Potensi limbah tongkol jagung sebagai sumber bahan baku xilan untuk
produksi XOS mendorong upaya pengembangan dan penelitian lebih lanjut untuk mendapatkan paket teknologi tepat guna produksi XOS yang dapat
diaplikasikan di industri dengan peralatan yang lebih mudah diperoleh.
Produksi xilan dari tongkol jagung dapat dilakukan melalui ekstraksi kimia.
Richana et al. (2007), melaporkan bahwa proses ekstraksi dan delignifikasi
tongkol jagung varietas Bisma dapat menghasilkan rendemen xilan sebesar
12%. Menurut Vazquez et al. (2000) produksi XOS dari tongkol jagung
dapat dilakukan melalui tiga tahap yaitu 1) perlakuan fraksinasi kimia
dengan menggunakan larutan alkali (NaOH, KOH, Ca(OH)2) sehingga
material lignoselulosa menjadi isolat xilan, 2) degradasi xilan secara
hidrolisis melalui pengukusan dengan air atau asam mineral, dan 3) konversi
xilan secara enzimatik. Yoshida et al. (1994) melakukan konversi xilan
menjadi XOS melalui perendaman tongkol jagung dengan larutan natrium
Penelitian Yang et al. (2005) menunjukkan bahwa xilan dari tongkol
jagung sebesar 34.80 (g/100 g) melalui pemanasan dengan menggunakan
otoklaf (135 oC, 30 menit) dan dilanjutkan dengan hidrolisis enzimatik
(xilanase 10 U/g tongkol jagung, 50 oC, 24 jam) menghasilkan XOS sebesar
67.70 (g/100 g) (67.70%). Produksi XOS yang lebih tinggi (78%)
dilaporkan oleh Vasquez et al. (2006) dari xilan tongkol jagung (30.60%
berat kering) yang dipanaskan dengan tekanan tinggi (proses hidrotermal)
menggunakan peralatan parr reactor (suhu 202 oC, tekanan 1900 bar).
1.2 Perumusan Masalah
Produksi jagung di Indonesia mengalami peningkatan, sehingga
limbah tongkol jagung menjadi tinggi, sementara pemanfaatan dan
pengolahan di tingkat petani masih sangat terbatas. Tongkol jagung
mengandung xilan yang tinggi dan berpotensi untuk ditingkatkan nilai
tambahnya dengan diproses lebih lanjut menjadi XOS yang bersifat
prebiotik.
Penggunaan peralatan parr reactor dapat mengkonversi xilan menjadi
XOS cukup tinggi (78%) (Vasquez et al., 2006), akan tetapi peralatan
tersebut masih kompleks, sehingga sulit diaplikasikan di industri pangan skala menengah maupun skala kecil. Dalam penelitian ini akan dipelajari
modifikasi proses dengan peralatan yang lebih sederhana yaitu produksi
XOS dari tongkol jagung dengan proses pemanasan menggunakan oven
yang dilanjutkan hidrolisis enzimatik. Proses ekstraksi xilan tongkol jagung
menggunakan oven dengan siklus pemanasan berulang (satu dan dua kali)
belum pernah dilaporkan, oleh karena itu perlu diteliti optimasi proses
pemanasan meliputi suhu dan siklus pemanasan yang dapat menghasilkan
kadar xilan yang tinggi.
1.3 Tujuan Penelitian
Tujuan penelitian adalah untuk :
1. Memperoleh suhu dan siklus pemanasan optimum dalam oven yang
2. Memperoleh lama dan siklus pemanasan dalam otoklaf yang optimal
untuk menghasilkan kadar xilan tinggi.
3. Memperoleh XOS dari hasil hidrolisis xilan oleh xilanase.
4. Menguji sifat prebiotik XOS berdasarkan viabilitas probiotik
5. Aplikasi XOS dalam pembuatan kukis prebiotik.
1.4 Hipotesis
Hipotesis pada penelitian ini adalah :
1. Suhu pemanasan tongkol jagung yang semakin tinggi (130, 140, 150 oC)
dan siklus pemanasan berulang dalam oven dapat meningkatkan kadar
xilan yang dihasilkan.
2. Pemanasan berulang tongkol jagung dalam otoklaf akan meningkatkan
kadar XOS.
3. XOS tongkol jagung berpotensi sebagai kandidat prebiotik dengan
meningkatkan viabilitas probiotik.
4. XOS tongkol jagung dapat diaplikasikan pada pembuataan kukis
prebiotik.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah memperoleh teknologi proses produksi
XOS yang dapat diaplikasikan dengan menggunakan peralatan yang lebih
mudah diperoleh seperti oven. Produksi XOS tongkol jagung yang
dihasilkan dapat diaplikasikan pada berbagai jenis produksi pangan
2. TINJAUAN PUSTAKA
2.1 Jagung dan Tongkol Jagung
Tanaman jagung (Zea mays L.) termasuk ke dalam famili
rumput-rumputan (graminae). Tanaman ini (Gambar 1) di Negara Indonesia sudah
dikenal sejak 400 tahun lalu.
Klasifikasi tanaman jagung (Zea mays L.)
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Monocotyledonae
Bangsa : Graminales
Suku : Graminae
Marga : Zea
Jenis : Zea mays L.
Tongkol jagung adalah tempat pembentukan lembaga dan gudang
penyimpanan makanan untuk pertumbuhan biji. Jagung mengandung kurang
lebih 30% tongkol jagung sedangkan sisanya adalah kulit dan biji (Koswara,
1991).
Pada saat ini jagung varietas Bisi dan Pioneer terus dikembangkan.
Jagung Bisi adalah jenis varietas hibrida, rata-rata produksinya 8.9 ton/ha
pipilan kering (Kuruseng, 2008). Jagung varietas hibrida merupakan hasil
perkawinan antara kedua jenis jagung yang terdiri dari galur murni,
sehingga terjadi perpaduan sifat unggul. Varietas hibrida mempunyai
potensi hasil tinggi, daya adaptasi luas, pertumbuhan dan hasil tanaman
yang lebih seragam, tahan penyakit bulai dan karat daun. Perbedaan
penampilan (fenotipe) dari berbagai varietas hibrida (perbedaan pada
beberapa komponen pengamatan) diakibatkan pengaruh genetik dan
lingkungan. Pengaruh genetik merupakan pengaruh keturunan yang dimiliki
oleh setiap galur sedangkan pengaruh lingkungan adalah pengaruh yang
ditimbulkan oleh habitat dan kondisi lingkungan (Kuruseng, 2008).
Tongkol jagung sebagian besar mengandung selulosa, hemiselulosa
dan xilan yang memiliki potensi untuk pengembangan produk masa depan.
Menurut Johnson (1991) limbah tongkol jagung merupakan limbah
pertanian yang mengandung selulosa (40-60%), hemiselulosa (20-30%) dan
lignin (15-30%) (Tabel 1). Komposisi kimia tersebut membuat tongkol
jagung dapat digunakan sebagai sumber energi, bahan pakan ternak dan
sebagai sumber karbon bagi pertumbuhan mikroorganisme. Komponen
penyusun hemiselulosa terbesar adalah xilan yang memiliki ikatan rantai
ß-1,4-xilosida, dan biasanya tersusun atas 150-200 monomer xilosa (Sunna
dan Antranikian, 1997). Xilan terdapat hampir pada semua tanaman,
khususnya limbah tanaman pangan seperti tongkol jagung, bagas tebu,
jerami padi, dedak gandum, dan biji kapas. Tongkol jagung memiliki
kandungan xilan yang lebih tinggi dibanding sekam, bekatul, ampas pati
garut, dan onggok (Richana et al., 2004).
Tabel 1. Komposisi Kimia Tongkol Jagung
2.2 Xilan
Struktur dinding sel tanaman terdiri dari material lignoselulosa yang
tersusun dari lignin, selulosa dan hemiselulosa. Xilan termasuk ke dalam
hemiselulosa (Gambar 2) (Vasquez et al., 2000). Xilan adalah komponen
utama yang terkandung dari tanaman hemiselulosa diantaranya batang
kapas, tongkol jagung, dan batang tebu. Diantara beberapa sumber biomassa
yang lain, tongkol jagung yang paling banyak dilaporkan sebagai sumber
xilooligosakarida yang potensial (Yang et al., 2005 ; Richana et al., 2004 ;
Pangsri, 2008). Kandungan xilan pada tongkol jagung dapat meningkat
sampai dengan 40g/100g (40%), jumlah tertinggi yang dapat dicapai
dibandingkan dari beberapa jenis tanaman pertanian lainnya (Yang et al.,
2005).
Gambar 2. Struktur lignoselulosa material pada dinding sel tumbuhan (Krafstoffe, 2008)
Xilan merupakan komponen penyusun hemiselulosa terbesar yang
merupakan polimer dari pentosa atau xilosa dengan ikatan ß-1,4 dan
tersusun atas 150-200 monomer xilosa dimana unit struktur sering
disubstitusi pada posisi C2 atau C3 dengan arabinofuranosil, asam
4-O-metilglukuronik, asetil atau fenolik (Moure et al., 2006). Hemiselulosa
merupakan polimer dari monomer gula (gula-gula anhidro) yang dapat
dikelompokkan menurut penyusunnya yaitu heksosa (glukosa, manosa, dan
galaktosa), pentosa (xilosa, arabinopirosa, arabinofuranosa), asam
heksuronat (glukoronat, metilglukoronat dan galakturonat) dan deoksi heksosa (rhamnosa dan fruktosa). Rantai utama hemiselulosa dapat terdiri
atas satu macam monomer saja (homopolimer), misalnya xilan atau dapat Selulosa
Lignin
Hemiselulosa
terdiri dari lebih monomer (heteropolimer), misalnya
4-O-metilglukoronoxilosa glukomanan (Kulkarni et al., 1999).
Xilan (Gambar 3) merupakan heteropolisakarida, yang dapat
dihidrolisis oleh enzim xilanase menjadi D-xilosa. Gugus utamanya terdiri
dari D-xilosa dan percabangannya terdiri dari rantai L-arabinofuranosa yang
dihubungkan oleh posisi 3 dari residu D-xilosa dan D-glukuronat atau
O-2-metil-D asam glukuronat yang dihubungkan ke posisi O-2. Beberapa
residu D-xilosa adalah asetil.
Gambar 3. Struktur molekul xilan (Vazquez et al., 2006).
Xilan sering ditemukan dalam keadaan berinteraksi antara lignin dan
komponen karbohidrat lainnya pada dinding sel tumbuhan. Xilan dapat larut
dalam larutan alkali (NaOH atau KOH 2-15%) dan air (Yang et al., 2005). Selain itu xilan merupakan komponen nonselulosa polisakarida terbanyak
yang terdapat pada kayu keras dan tumbuhan tahunan, dengan persentase
20-35 % dari total berat kering. Xilan digunakan oleh beberapa jenis fungi,
bakteri, khamir yang dapat memproduksi enzim xilanase untuk diubah
menjadi XOS.
Xilan mempunyai banyak kegunaan antara lain sebagai bahan baku
industri untuk campuran bahan pembuat resin dan nilon. Selain itu hidrolisis
xilan menghasilkan furfural yang digunakan sebagai bahan pelarut industri
minyak bumi, pelarut reaktif untuk resin fenol, disinfektan serta bahan awal
untuk memproduksi berbagai bahan kimia dan polimer lainnya (Richana et
al., 2007). Kemurnian xilan dapat dianalisis menggunakan KCKT
2.3 Xilanase
Xilanase berpotensi besar untuk diaplikasikan di industri, yang
utamanya digunakan untuk biokonversi lignoselulosa menjadi gula, etanol,
dan subtansi yang berguna, seperti jus dan wine untuk memperbaiki kualitas
nutrisi, makanan ternak dan untuk mengolah kembali limbah pada proses
pembuatan kertas menjadi lebih bermanfaat (Viikari et al., 2001). Gula
sederhana dapat dihasilkan melalui proses hidrolisis. Menurut Garrote et al.
(2007) hidrolisis enzimatik adalah suatu cara yang baik untuk memproduksi
gula dari bahan lignoselulosa karena tidak adanya hasil samping.
Xilanase merupakan enzim hidrolisis yang mendegradasi xilan.
Xilanase dapat dibagi menjadi tiga kelompok, yaitu β–xilosidase,
eksoxilanase dan endoxilanase. Xilosidase memiliki kemampuan untuk
menghidrolisis xilooligosakarida rantai pendek menjadi xilosa. Eksoxilanase
memutus rantai polimer pada ujung-ujung reduksi (Reilly, 1991). Enzim
xilanase contohnya adalah endoxilanase (1,4-ß-D-xilan xilanohidrolase,
E.C. 3.2.1.8) dan ß-xilosidase (1,4-ß-xylan xilohidrolase, E.C. 3.2.1.3.7)
yang merupakan hidrolisis xilooligomers (Liu et al., 2008). Beberapa faktor
yang mempengaruhi produksi xilanase antara lain komposisi media nutrisi,
karakteristik substrat sebelum diberi perlakuan dan kondisi fermentasi (Velkova et al., 2007). Pemilihan substrat dan komposisi nutrisi pada media
merupakan faktor penting untuk kesuksesannya dalam memproduksi enzim
xilanase. Komponen substrat yang sangat diperlukan adalah karbon dan
sumber energi agar menghasilkan xilanase yang tinggi (Velkova et al.,
2007).
Xilanase dapat dihasilkan dari bakteri, fungi maupun khamir antara
lain Aspergillus niger, Penicillium chrysogenum, Streptomyces, Bacillus,
Aureobasidium, Fusarium, Chaetomium, Phanerochaete, Rhizomucor,
Humicola, Talaromyces, Cryptococcus dan Trichoderma viridae (Velkova,
2.4 Xilooligosakarida (XOS)
Xilooligosakarida (XOS) secara alami terdapat dalam buah, sayuran,
bambu, madu dan susu. XOS dapat diproduksi pada skala industri dari
bahan baku yang kandungan xilannya tinggi. Xilooligosakarida adalah gula
oligomer (oligosakarida) yang disusun dari unit xilosa (Gambar 4)
(Dominguez et al. 2003). Produksi XOS dapat dihasilkan melalui hidrolisis
enzimatik xilan oleh enzim β-xilanase (Gambar 4) (Akpinar et al., 2007).
Xilooligosakarida mempunyai nilai jual tinggi yang umumnya
ditambahkan sebagai ingridien sehingga menjadi pangan fungsional, dan
berpotensi sebagai sumber prebiotik (Akpinar et al., 2007).
Xilooligosakarida merupakan oligosakarida yang tidak dapat dicerna yang
bermanfaat untuk kesehatan, karena memiliki efek karsinogenik yang
rendah, memperbaiki mikroflora di dalam usus dan mempunyai mekanisme
di dalam saluran pencernaan seperti serat pangan (dietary fiber) sehingga
dapat dijadikan sebagai sumber prebiotik (Dominguez et al., 2003 ; Yang et
al., 2005).
Gambar 4. Struktur XOS (Akpinar et al., 2007)
2.5 Pengaruh asam terhadap rantai xilan
Larutan asam berpengaruh terhadap kondisi rantai xilan. Asam adalah
katalis non spesifik yang akan memotong rantai selulosa secara acak
menjadi bentuk yang lebih sederhana (Tsao et al., 1978). Perendaman
H2SO4 encer di tahap awal (pretreatment) bertujuan sebagai proses
delignifikasi.Menurut Muawanah (2006) dan Shofiyanto (2008), kandungan Hidrolisis β-xilanase
utama penyusun tongkol jagung adalah lignoselulosa. Perendaman tongkol
jagung dalam asam encer (H2SO4) bertujuan untuk delignifikasi (proses
penghilangan lignin) sehingga dapat mempermudah pelepasan hemiselulosa
pada saat hidrolisis xilan dalam oven, agar nantinya dapat meningkatkan
efisiensi kerja enzim dalam menghidrolisis xilan. Hemiselulosa dapat rusak
dan larut dalam proses delignifikasi karena strukturnya yang amorf sehingga
mudah dimasuki pelarut (Fengel dan Wegener, 1995). Menurut Vazques et
al., (2000) delignifikasi merupakan perlakuan pendahuluan terhadap bahan
baku (pretreatments) yang tujuannya untuk menghilangkan bahan-bahan
lignin yang dapat menghambat proses ekstraksi xilan. Proses delignifikasi
dapat dilakukan secara kimiawi melalui proses pelarutan dengan alkali,
H2SO4 dan asam klorat. Disamping itu juga dapat dilakukan secara
enzimatik dengan mikroorganisme maupun secara fisik dengan pemanasan
uap, atau penggilingan (Fengel dan Wegener, 1995). Perendaman dengan
asam encer juga dapat menghidrolisis hemiselulosa menjadi
komponen-komponen monomernya yang terdiri dari glukosa, manosa,
D-galaktosa, D-xilosa, L-arabinosa dan sejumlah kecil L-ramnosa disamping
menjadi asam glukuronat, asam 4-O-metil-glukuronat dan asam
D-galakturonat, karena rantai ikatan hemiselulosa relatif mudah dihidrolisis oleh asam (Sjostrom, 1995). Menurut Richana (2006), rantai xilan
bercabang dan strukturnya tidak berbentuk kristal sehingga lebih mudah
dimasuki pelarut dibanding selulosa.
Menurut Vasquez et al. (2000) proses pretreatment dengan asam
encer bertujuan untuk melonggarkan ikatan glikosidik antara molekul
lignoselulosa sehingga pada saat pemanasan, memudahkan proses ekstraksi
xilan. Pemecahan molekul hemiselulosa khususnya xilan dihambat oleh
tingginya derajat polimerisasi dan kandungan lignin yang membungkus
molekul hemiselulosa. Hidrolisis xilan sulit terjadi selama derajat
polimerisasi dan kandungan lignin yang belum berkurang (Shofiyanto,
2.6 Pengaruh alkali terhadap rantai xilan
Pada umumnya larutan alkali (KOH, NaOH, atau NaOCl) digunakan
untuk proses delignifikasi maupun ekstraksi xilan. Larutan alkali
berpengaruh terhadap gugus-gugus ujung dalam polisakarida rantai xilan
sehingga membentuk asam karboksilat (Sjostrom, 1995). Menurut Fengel
dan Wegener (1995) hidrolisis alkali menyebabkan ikatan glikosida
terputus, dan menghasilkan gugus pereduksi baru dibagian ujung rantai
polisakarida. Jenis-jenis ikatan yang dapat diputus oleh larutan alkali adalah
ikatan ester (bersifat labil terhadap alkali) dan ikatan glikosida. Richana et
al. (2007) proses delignifikasi tongkol jagung varietas Bisma dilakukan
dengan menggunakan NaOCl. Menurut Fengel dan Wegener (1995) karena
pelarut tersebut mengandung ion-ion hipoklorit yang mampu memecah
ikatan eter dalam stuktur lignin.
Menurut Casey (1960) kelebihan menggunakan alkali aktif untuk
hidrolisis karena bersifat selektif dan bekerja aktif menghilangkan
bahan-bahan non selulotik terutama lignin pada suhu, tekanan, dan konsentrasi
yang sesuai. Hidrolisis dengan larutan alkali mempunyai fungsi menetralkan
suasana asam dan melarutkan hasil dekomposisi lignin yang telah terurai
pada tahap klorinasi (Siagian, 1965), namun menurut Fengel dan Wegener (1995) hidrolisis alkali prosesnya jauh lebih lambat daripada hidrolisis
asam.
Menurut Lee (2005) perlakuan dengan larutan alkali dapat
mengurangi kandungan lignin, dan memutus ikatan antara hemiselulosa dan
lignin. Larutan alkali yang sering digunakan adalah NaOH dan NaOCl.
Menurut Sjostrom (1995) NaOH merupakan alkali yang paling kuat dalam
mendegradasi struktur dinding sel.
Shofiyanto (2008) proses delignifikasi tongkol jagung dengan
menggunakan larutan NaOH 1% selama 5 jam pada suhu 28oC dapat
menurunkan kandungan lignin dari 12.57% b.k menjadi 11.25% b.k
sedangkan ekstraksi selulosa dengan menggunakan NaOH 15% selama 24
jam pada suhu 28 oC dapat meningkatkan kandungan selulosa dari 21.73%
terlarutnya hemiselulosa, dan lignin sehingga yang tersisa hanya selulosa
yang intrafibril mengembang sehingga luas permukaan spesifiknya
meningkat.
Anggraini (2003) delignifikasi dengan menggunakan NaOCl
menyebabkan lignin larut dalam larutan NaOCl sehingga yang tersisa adalah
selulosa dan hemiselulosa yang berupa padatan. Delignifikasi dilakukan
untuk meningkatkan efisiensi kerja enzim pada saat menghidrolisis xilan.
2.7 Produksi XOS
Produksi XOS dari xilan yang terdapat di dalam bahan yang
mengandung lignoselulosa, umumnya dapat dilakukan melalui metode
kimia, metode fisik, metode enzimatik atau kombinasi dari metode kimia,
fisik dan enzimatik (Gambar 8). Yoshida et al. (1994) melakukan produksi
XOS dari beberapa bahan yang mengandung lignoselulosa melalui metode
kimia dan enzimatik yaitu xilan diekstraksi dengan larutan asam mineral
atau larutan alkali seperti KOH atau NaOH dan dihidrolisis menjadi XOS
oleh enzim β-xilanase.
XOS
Bahan baku kaya xilan
Perlakuan kimiawi
Perlakuan enzimatik
Pemisahan dan Purifikasi
Asam, Alkali
Xilanase
Adsorpsi
Presipitasi Ion-exchange
Ekstraksi
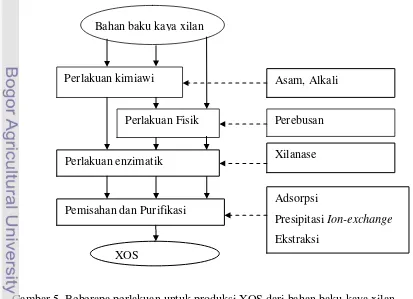
Gambar 5. Beberapa perlakuan untuk produksi XOS dari bahan baku kaya xilan (Dominguez et al., 2003)
Tahapan sebelum memproduksi XOS adalah ekstraksi xilan, secara
umum tahapan proses ekstraksi xilan dari tongkol jagung adalah sebagai
berikut (Richana et al., 2007) :
1. Tahap persiapan bahan
Tongkol jagung dikeringkan dibawah sinar matahari atau dioven hingga
mencapai kadar air 5%. Tongkol jagung yang telah kering digiling
dengan menggunakan mesin penggiling berukuran 40 mesh.
2. Delignifikasi
Proses delignifikasi adalah proses penghilangan lignin dari suatu bahan
baku tanaman. Proses delignifikasi dilakukan terhadap bubuk tongkol
jagung hasil penggilingan dengan NaOCl karena pelarut tersebut
mengandung ion-ion hipoklorit yang mampu memecah ikatan karbon
dalam struktur lignin. Proses delignifikasi dilakukan selama 5 jam pada
suhu ruang.
3. Ekstraksi xilan
Pada proses ekstraksi xilan, padatan hasil delignifikasi direndam dalam
larutan NaOH 10% selama 24 jam pada suhu 28oC. Kemudian dilakukan penyaringan. Filtrat yang dihasilkan diukur pH-nya dan diasamkan
dengan HCl 6N hingga pH 4.5-5. Setelah diasamkan, dilakukan
sentrifugasi selama 30 menit dengan kecepatan putaran 4000 rpm untuk
memisahkan endapan yang mengandung xilan dengan supernatan. Xilan
dalam endapan dipisahkan dengan disentrifugasi pada kecepatan putar
4000 rpm selama 30 menit. Proses ekstraksi xilan tongkol jagung dengan
metode diatas menghasilkan kadar xilan sebesar 12.9% (Richana et al.,
2007).
Menurut Yang et al. (2005) perlakuan pretreatment umumnya
dilakukan sebelum proses degradasi secara enzimatik, karena xilan yang
terdapat di dalam bahan baku terikat kuat di dalam rantai xilosa dan
dilakukan untuk memecah komponen polisakarida dilanjutkan hidrolisis
enzimatik antara lain ekstraksi alkali dengan menggunakan konsentrasi
tinggi atau rendah, dan perebusan (Gambar 9).
Gambar 6. Prosedur produksi XOS melalui perlakuan dengan pemanasan, air atau larutan asam (Vasquez et al., 2000)
Produksi XOS dapat dilakukan melalui ekstraksi cairan (aqueous
extraction method) dari xilan tongkol jagung sebesar 34.8% (suhu 135 oC,
30 menit) dilanjutkan hidrolisis enzimatik (10 U/g tongkol jagung, 50 oC, 24
jam) menghasilkan XOS sebesar 67.7% (Yang et al., 2005). Dominguez et
al. (2003) memproduksi XOS dari xilan tongkol jagung melalui perlakuan
autohidrolisis atau metode pengukusan dengan menggunakan air pada suhu
dan tekanan yang tinggi. Garrote et al. (2007) melaporkan metode
autohidrolisis menyebabkan pelarutan secara selektif dari hemiselulosa,
sehingga menghasilkan cairan yang mengandung gula oligomers, gula dan
produk dekomposisi-gula dan menjadi fase padat yang banyak mengandung
selulosa dan lignin, agar dapat dilanjutkan ke proses berikutnya. Produksi
XOS dapat dilakukan melalui degradasi hidrolisis xilan, yang dikenal
melalui autohidrolisis (Vasquez et al., 2006 ; Pangsri, 2008 ; Michelin et al.,
2009). Autohidrolisis adalah salah satu perlakuan untuk memisahkan gugus
xilan dari komponen lainnya, dimana bahan baku dikukus dengan
menggunakan media yang telah dikatalisasi dengan penambahan berupa
garam mineral dalam kondisi tertentu dan prosesnya dilakukan pada suhu
dan tekanan tinggi (198 oC – 210 oC, 1900 bar). Pangsri (2008) melaporkan
bahwa autohidrolisis xilan tongkol jagung (30.60% bk) menggunakan parr
reactor mampu memproduksi XOS hingga sebesar 78%.
Bahan baku yang
Pretreatment Degradasi xilan
secara Hidrolisis
Perebusan dengan
larutan air atau asam Pelarut untuk
Konversi xilan menjadi XOS secara enzimatik umumnya
menggunakan xilanase yang dihasilkan oleh kapang menggunakan jerami
gandum yang sudah dihidrolisis sebagai substrat kapang Aspergillus spp.
dan Trichodermae spp (Michelin et al. 2009). Pada skala besar, produksi
xilanase dilakukan dalam bioreaktor yaitu Stirred Tank Bioreactor (STB).
Untuk memudahkan kinerja xilanase pada proses konversi XOS, maka
susbtrat hemiselulosa dari jerami gandum harus melalui autohidrolisis
terlebih dahulu. Perlakuan hidrotermal ini dapat menyebabkan ikatan xilan
putus dari gugus hemiselulosa sehingga hasil produk akhir setelah di
autohidrolisis, umumnya adalah oligosakarida.
2.8 Prebiotik
Prebiotik merupakan bahan pangan yang tidak dapat dicerna yang
memberikan efek menguntungkan bagi inangnya dengan cara menstimulasi
pertumbuhan dan atau aktivitas dari satu atau beberapa bakteri di dalam
kolon sehingga dapat meningkatkan kesehatan inangnya (Fuller, 1997).
Xiloligosakarida merupakan prebiotik yang mampu menstimulasi
pertumbuhan selektif dari Bifidobacterium sp. dan akan menekan aktivitas
bakteri patogen usus serta memudahkan absorpsi nutrien (Alonso et al., 2003). Menurut Wells et al. (2008) kandidat prebiotik tidak dihidrolisis atau
diserap pada bagian atas saluran gastrointestinal dan secara selektif
difermentasi oleh salah satu atau sejumlah bakteri komersial yang
menguntungkan pada kolon seperti Bifidobacteria dan Lactobacilli.
Prebiotik umumnya adalah oligosakarida yang terdiri dari 2 sampai 20 unit
sakarida dengan berat molekul rendah (Manning et al., 2004).
Menurut Sheerman et al. (2008) definisi prebiotik adalah ingridien
pangan yang tidak dapat dicerna di bagian saluran pencernaan, dapat
difermentasi secara selektif sehingga memberikan perubahan spesifik, baik
dari komposisi dan atau aktivitas mikroflora gastrointestinal sehingga dapat
menstimulasi pertumbuhan probiotik di dalam usus, dan dapat memberikan
manfaat terhadap kesehatan inang. Xilooligosakarida bermanfaat terhadap
penyerapan kalsium, metabolisme lemak dan mengurangi risiko kanker
kolon melalui pembentukan asam lemak rantai pendek di dalam saluran
usus selama fermentasi dan memberikan efek prebiotik dengan
mempromosikan pertumbuhan bakteri yang menguntungkan di dalam
saluran pencernaan seperti Bifidobacteria dan Lactobacillus (Vazquez et al.,
2000 ; Grootaert et al., 2007 ; Kabel et al., 2002).
Pada saat ini XOS merupakan sumber oligosakarida prebiotik yang
mendapat perhatian besar untuk dikembangkan menjadi bahan pangan
fungsional antara lain sebagai ingredien pangan (Vazques et al., 2000).
Contoh aplikasi pada produk pangan dari XOS prebiotik antara lain permen
karet (Anonim, 2006) dan kukis prebiotik (Loo et al., 1999 dan Wang et al.,
2009). Kukis prebiotik dibuat dengan menambahkan XOS tongkol jagung
sebanyak 5% (FAO, 1999) ke dalam formula kukis (basis tepung terigu)
(Loo et al., 1999). Selain itu contoh aplikasi produk pangan lainnya yang
berbasis prebiotik adalah substitusi pati garut termodifikasi kedalam roti
manis.
Menurut Giantine (2007) substitusi pati garut termodifikasi dengan
kadar resisten starch 4.42% pada produk roti manis konsentrasi 5-20% dari
berat tepung terigu akan memberikan nilai tambah bagi kesehatan, yaitu sebagai serat pangan, namun tidak mengubah citarasa roti.
Menurut Loo et al. (1999) sebaiknya untuk aplikasi pada produk
pangan, XOS yang digunakan memiliki DP rendah yaitu 2-4, selain itu XOS
dalam aplikasinya sebagai bahan pangan fungsional harus stabil secara
kimia selama perlakuan pengolahan makanan, seperti pemanasan, pH
rendah, dan kondisi reaksi Maillard. Menurut Huebner (2008) salah satu
contoh prebiotik yang sudah memenuhi syarat adalah FOS karena sudah
3. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Mei 2010 hingga April 2011.
Penelitian dilakukan di Laboratorium Kimia Pangan, Departemen Ilmu dan
Teknologi Pangan, Fakultas Teknologi Pertanian; Laboratorium
(Mikrobiologi Pangan, Kimia Pangan, dan Pilot Plant) South East Asia Food
& Agricultural Science & Technology (SEAFAST) Centre Institut Pertanian
Bogor; Laboratorium Balai Besar Penelitian dan Pengembangan Pascapanen
Pertanian, Cimanggu Bogor.
3.2 Bahan dan Alat
Bahan baku yang digunakan adalah tongkol jagung varietas Bisi
berasal dari Sentra Petani di Jombang sedangkan Pioneer berasal dari BPTP,
Yogyakarta. Mikroorganisme yang digunakan untuk uji prebiotik adalah
isolat bakteri asam laktat yaitu Lactobacillus plantarum kik (koleksi pribadi
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS) dan Bifidobacterium longum
ATCC 15707 (koleksi PAU Universitas Gajah Mada Yogyakarta) yang
ditumbuhkan dalam media MRSB.
Bahan kimia yang digunakan meliputi asam asetat, sodium hipoklorit,
sodium hidroksida, buffer fosfat (pH 6.0), larutan buffer baku (pH 4 dan pH
7), HCl, H2SO4, protease pepton, MgSO4.7H2O, K2HPO4.3H2O, KH2PO4,
NaCl, susu skim, ekstrak ragi, ekstrak malt, Tween 80, glukosa, sukrosa,
standar xilosa, standar Birch Wood Xylan dan etanol 95% (teknis). Media
untuk uji mikrobiologi yang digunakan adalah Bacto Agar, MRSA, MRSB
(deMan Rogosa Sharpe Broth), modifikasi MRSB tanpa glukosa (m-MRSB)
dan modifikasi MRSB yang telah ditambahkan 1% XOS hasil dari konversi.
Enzim komersial yang digunakan dalam penelitian ini adalah xilanase
(Novozym) dengan aktivitas xilanase sebesar 24.5 x 106 U/ml, pH optimum
adalah 6.0 dan suhu optimum adalah 50oC.
Alat-alat yang digunakan dalam penelitian ini adalah mikropipet, neraca
vorteks, shaking orbital, vacuum gauze, spektrofotometer, KCKT dan
peralatan lainnya.
3.3 Prosedur Penelitian
Penelitian produksi XOS dilakukan dalam beberapa tahap yaitu
1) penentuan varietas jagung berdasarkan rendemen xilan tertinggi,
2) ekstraksi xilan dengan pemanasan tongkol jagung (oven dan otoklaf yang
dilakukan dengan satu dan dua siklus, 3) konversi xilan menjadi XOS secara
hidrolisis enzimatis (xilanase), 4) pengujian sifat prebiotik dari XOS, 5)
pembuatan kukis prebiotik dari XOS tongkol jagung.
Tahap pertama adalah penentuan varietas jagung berdasarkan
rendemen xilan tertinggi. Untuk menentukan varietas jagung yang akan
digunakan, maka dilakukan pengukuran rendemen xilan tongkol jagung
analisis proksimat, dan komposisi serat (serat kasar, selulosa, hemiselulosa
dan lignin) dari dua varietas jagung yaitu Bisi dan Pioner. Varietas jagung
terpilih yang akan digunakan pada penelitian selanjutnya adalah varietas
jagung yang mempunyai rendemen xilan lebih tinggi.
Tahap kedua adalah ekstraksi xilan dari tongkol jagung melalui
beberapa metode pemanasan oven dan otoklaf, yang dilakukan dengan satu dan dua siklus pemanasan. Ekstrak xilan yang diperoleh kemudian dianalisis
kadar xilan dengan menggunakan KCKT berdasarkan waktu retensi ke- 2.8
menit, total gula, gula pereduksi dan derajat polimerisasi.
Tahap ketiga adalah produksi XOS. Metode yang digunakan adalah
konversi xilan yang dihasilkan dihidrolisis secara enzimatis menggunakan
xilanase komersial (Novozym) dengan modifikasi metode Richana et al.
(2010) sebagai berikut 50 g xilan tongkol jagung kering dalam 250 ml
buffer fosfat pH 6, ditambah 1.25 ml xilanase dengan aktivitas xilanase
sebesar 24.5 x 106 U/ml, kemudian diinkubasi pada suhu 50 oC selama 6
hari. Setelah inkubasi, sampel dikeringkan pada suhu 60 oC selama 1 jam,
dan siap untuk dianalisis kadar XOS nya dengan menggunakan KCKT,
Tahap keempat adalah pengujian sifat prebiotik dari XOS tongkol
jagung, yang menggunakan dua galur kandidat probiotik yaitu L.plantarum
kik dan B. longum ATCC 15707.
Tahap terakhir adalah pembuatan kukis prebiotik dari XOS tongkol
jagung sebanyak 5% (basis tepung terigu yang digunakan). Pembuatan
kukis prebiotik, bahan-bahan diaplikasikan sesuai dengan formula Gustiar
(2009) dengan penambahan XOS sebesar 5% basis tepung terigu (FAO,
1999), kemudian dipanggang pada suhu 134-135 oC, selama 45 menit.
Produk kukis XOS prebiotik yang diperoleh diuji tingkat kekerasannya (gf :
gram force) menggunakan texture analyzer (Pro CT V1.2 Build 9;
Brookfield Engineering Labs; probeTA 39 dengan fixture TA-BT-KI)
dibandingkan dengan kukis tanpa XOS. Diagram penelitiannya dapat dilihat
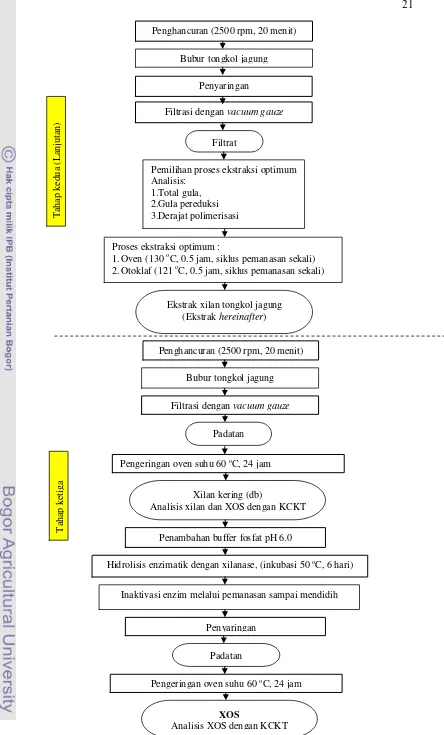
padaGambar 10, dibawah ini.
3. Kadar Hemiselulosa, Selulosa dan lignin
Pemanasan Perendaman dalam larutan 1.0 g/l H2SO4
(60 oC, 12 jam) (Delignifikasi) Pencacahan
Pencucian dan ditiriskan
Penambahan aquades dengan Rasio Tongkol Jagung : Aquades = (1:3)
Xilan kering (db)
Analisis xilan dan XOS dengan KCKT Filtrasi dengan vacuum gauze
1.Oven (130 oC, 0.5 jam, siklus pemanasan sekali) 2.Otoklaf (121 oC, 0.5 jam, siklus pemanasan sekali)
Penyaringan
Hidrolisis enzimatik dengan xilanase, (inkubasi 50 oC, 6 hari) Penghancuran (2500 rpm, 20 menit)
Gambar 7. Diagram alir penelitian (modifikasi Yang et al., 2005)
3.3.1 Seleksi Varietas Jagung
Untuk menentukan varietas jagung yang akan digunakan, maka
dilakukan pengukuran rendemen xilan tongkol jagung, analisis
proksimat, dan komposisi serat (hemiselulosa, selulosa, dan lignin)
dari dua varietas jagung yaitu Bisi dan Pioner. Varietas jagung terpilih
yang akan digunakan pada penelitian selanjutnya adalah varietas
jagung yang mempunyai rendemen xilan lebih tinggi.
3.3.2 Ekstraksi Xilan dengan Pemanasan Tongkol Jagung dalam Oven dan Otoklaf
Ekstraksi xilan dilakukan dengan dua metode pemanasan yaitu
pemanasan oven (partikel tongkol jagung dalam kondisi terendam air)
dan pemanasan otoklaf, kemudian kedua metode pemanasan
dilanjutkan dengan hidrolisis enzimatik.
Partikel tongkol jagung sebelumnya diberi perlakuan asam encer
(1.0 g/l H2SO4) kemudian diblender sampai halus, didiamkan pada
suhu 60 oC selama 12 jam (modifikasi metode Yang et al., 2005).
Partikel tongkol jagung selanjutnya ditiriskan dan dicuci dengan air
kran (pH 6), selanjutnya direndam kembali dalam aquades (rasio 1:3)
untuk dipanaskan dalam oven pada beberapa variasi suhu (130 oC, 140 o
C dan 150 oC) dengan masing-masing waktu pemanasan selama 0.5
jam dengan siklus pemanasan satu dan dua kali. Yang dimaksud
dengan siklus pemanasan dua kali adalah proses pemanasan diulang
setelah tongkol jagung dikeluarkan dari oven setelah pemanasan satu
siklus, kemudian tongkol jagung didinginkan, ditambahkan air
kembali sampai mencapai seperti volume awal (1:3) dan pemanasan
diulang kembali dalam oven. Setelah pemanasan partikel tongkol
jagung dalam oven selesai, sampel didinginkan dalam suhu ruang. Ekstrak xilan yang diperoleh dari metode ekstraksi optimum
dihancurkan dengan penambahan aquades (1:12) dalam blender (2500
rpm, 20 menit) hingga menjadi bubur. Bubur dari tongkol jagung yang
diperoleh, kemudian disaring dengan saringan (yang biasa digunakan
analisis kimia (total gula, gula pereduksi dan derajat polimerisasi).
Bubur difiltrasi menggunakan vacuum gauze untuk analisis kimia.
Filtrat dianalisis total gula, gula pereduksi dan derajat polimerisasi
untuk menetapkan metode ekstraksi xilan dalam oven yang optimum.
Pada metode pemanasan otoklaf, partikel tongkol jagung mentah
yang telah direndam dalam asam encer (1.0 g /l H2SO4), diblender
sampai halus. Diamkan pada suhu 60ºC selama 12 jam, disaring dan
dicuci dengan air kran (pH 6). Tongkol jagung yang telah diberi
perlakuan ini diletakkan dalam wadah gelas piala kemudian
dimasukkan ke dalam otoklaf. Perhitungan waktu proses (0.5, 1, 1.5
dan 2 jam) dimulai ketika suhu internal dari otoklaf mencapai suhu
yang ditetapkan (121 oC) dengan siklus pemanasan 1 dan 2 kali.
Setelah pendinginan, otoklaf dibuka dan tongkol yang telah dikukus
dikumpulkan. Selanjutnya ekstrak xilan yang diperoleh dari metode
ekstraksi optimum dihancurkan dengan penambahan air (1:12) dalam
blender (2500 rpm, 20 menit) hingga menjadi bubur. Bubur dari
tongkol jagung yang diperoleh kemudian disaring. Bubur ini
digunakan untuk hidrolisis enzimatik dan analisis kimia (total gula,
gula pereduksi dan derajat polimerisasi). Bubur difiltrasi menggunakan vacuum gauze untuk analisis kimia. Filtrat dianalisis
total gula, gula pereduksi dan derajat polimerisasi, untuk menetapkan
metode ekstraksi xilan yang optimal baik dalam oven maupun otoklaf.
Filtrat yang dihasilkan dinamakan sebagai ekstrak hereinafter, karena
mengandung gula pereduksi (xilosa dan XOS), total gula terlarut dan
furfural (Yang et al., 2005).
3.3.3 Produksi XOS Melalui Konversi Xilan Menggunakan Xilanase
Xilan tongkol jagung yang diperoleh dari metode ekstraksi
optimum (oven dan otoklaf) kemudian dikonversi secara enzimatik
menggunakan xilanase komersial (Novozym) mengacu dari
modifikasi metode Richana et al. (2010). Hidrolisis dilakukan dengan
larutan buffer fosfat pH 6 hingga kondisi sampel terendam sempurna,
lalu ditambah 1.25 ml xilanase dengan aktivitas xilanase 24.5 x 106
U/ml, kemudian diinkubasi pada suhu 50 oC selama 6 hari. Setelah
inkubasi, sampel diinaktivasi enzim melalui pemanasan sampai
mendidih. Selanjutnya disaring menggunakan kertas Whatman No. 4.
Lalu dikeringkan pada suhu 60 oC selama 1 jam, dan siap untuk
dianalisis kadar XOS nya atau digunakan lebih lanjut untuk membuat
kukis XOS prebiotik.
3.4 Analisis Kimia
3.4.1 Penentuan Rendemen Ekstrak Xilan (modifikasi Yoshida et al.,
1994)
Tahap ini tongkol jagung dicacah menjadi kecil-kecil direndam
dengan larutan NaOCl konsentrasi 0.5% pada suhu 28 oC selama 5
jam (proses delignifikasi) lalu diblender. Selanjutnya sampel direndam
kembali ke dalam larutan NaOCl 0.5% selama 24 jam. Sampel dibilas
dengan air dan disaring, kemudian di sentrifus (4000 rpm selama 30
menit), sehingga akan terbentuk endapan dan supernatan (lignin).
Hasil endapan dikeringkan pada suhu 35 oC selama 24 jam.
Selanjutnya lakukan perendaman dalam NaOH 10%, suhu 28 oC
selama 24 jam, lalu disentrifugasi 2500 rpm selama 30 menit. Tujuan
perendaman ini dilakukan untuk mengestraksi xilan. Supernatan
dinetralkan dengan HCl 6N hingga mencapai pH 7, kemudian
disentrifugasi dengan kecepatan putaran 2500 rpm selama 30 menit.
Supernatan yang dihasilkan dari proses ini mengandung xilan.
Pemisahan xilan yang larut dalam air dapat dilakukan dengan
menambahkan etanol 95%. Etanol ditambahkan pada supernatan dengan perbandingan supernatan-etanol 1 : 3, sentrifugasi pada 2500
rpm, 30 menit (Richana et al., 2007). Endapan yang terbentuk adalah
xilan. Rendemen xilan dihitung berdasarkan perbandingan berat
sampel akhir (supernatan/xilan) dan berat sampel awal (tongkol
Rendemen (%) = x 100%
3.4.2 Kadar Xilan (modifikasi Abreau et al., 2001 dan Ramos et al., 1999)
Analisis kadar xilan meliputi uji kelarutan, uji kualitatif dan
kuantitatif xilan yang diperoleh dari ekstraksi tersebut. Analisis
kadar xilan secara kualitatif dan kuantitatif menggunakan KCKT
(Khromatografi Cair Kinerja Tinggi). Sampel sebelum diinjeksikan
pada KCKT, disaring dengan filter 0.20 µ. Standar xilan yang
digunakan adalah xilan komersial (Birch Wood Xylan). Kondisi
analisis kadar xilan menggunakan KCKT varian 940–LC adalah
sebagai berikut : fase gerak asetonitril : air (80% : 20%), pelarutnya
adalah 2-butanol : asam asetat : aquades (3:2:2), kolom lichrospher
NH2 (5m), dan detektor refraktif index.
Selanjutnya dilakukan pengujian hasil rendemen ekstrak
xilan dari proses ekstraksi xilan. Rendemen adalah perbandingan
berat sampel akhir (supernatan/xilan) dan berat sampel awal (tongkol
jagung).
Penghitungan :
Uji Kelarutan Xilan (Gaman dan Sherrington, 1992)
Kelarutan xilan dilakukan dengan melarutkan xilan dalam
pelarut alkali (NaOH 1%), HCL 1N, air panas, air biasa dan air
dingin. Prinsipnya kelarutan suatu senyawa menunjukkan seberapa
(C-B)
(A)
3.4.3 Kadar Hemiselulosa, Selulosa dan Lignin
Kadar NDF (Neutral Detergen Fiber) (Van Soest, 1963)
Sampel sebanyak A g, dimasukkan ke dalam gelas piala
yang telah ditambahkan larutan NDS disaring dengan bantuan pompa
vakum, dibilas dengan air panas dan aseton. Hasil penyaringan
tersebut dikeringkan dalam oven 105 oC, Setelah itu dimasukkan ke
dalam desikator selama satu jam, kemudian dilakukan penimbangan
terakhir (C).
Keterangan :
A = Bobot sampel (g)
B = Bobot filter gelas (g)
C = Bobot filter gelas dan sampel setelah dioven
Kadar ADF (Acid Detergen Fiber) dan Hemiselulosa (Van Soest, 1963)
Sampel sebanyak A g, dimasukkan ke dalam gelas piala serta
ditambahkan dengan 50 ml larutan ADS (Acid Detergen Solvent).
Larutan ADS terdiri dari : H2SO4 ; CTAB (Cethyle Trimethyl
Ammonium Bromida). Sampel yang telah ditambahkan larutan
tersebut dipanaskan selama satu jam di atas penangas listrik.
Penyaringan dilakukan dengan bantuan pompa vakum dengan juga
menggunakan filter gelas yang ditimbang (B). pencucian dilakukan
dengan aseton dan air panas. Dilakukan pengeringan dan masukkan hasil penyaringan tersebut ke dalam oven (100 oC). Setelah itu
dimasukkan lagi ke dalam desikator untuk melakukan pendinginan
dan ditimbang (C).
C-B
A
Keterangan :
A = Bobot sampel (g)
B = Bobot filter gelas (g)
C = Bobot filter gelas dan sampel setelah dioven
Kadar Hemiselulosa = % NDF - % ADF
Kadar Selulosa (Van Soest, 1963)
Residu ADF (C) yang berada di dalam filter gelas diletakkan di
atas nampan yang berisi air setinggi kira-kira 1 cm. Kemudian
ditambahkan H2SO4 setinggi ¾ bagian filter gelas dan dibiarkan
selama 3 jam lalu diaduk-aduk. Penyaringan dilakukan dengan
bantuan pompa vakum dengan juga menggunakan filter gelas.
Pencucian dilakukan dengan aseton dan air panas. Dilakukan
pengeringan dan sampel hasil penyaringan tersebut dimasukkan ke
dalam oven (100 oC). Setelah itu dimasukkan ke dalam desikator dan
kemudian ditimbang (D).
D-C
A
Keterangan :
A = Bobot sampel (g)
D = Bobot filter gelas dan residu ADF setelah dioven (g)
C = Bobot filter gelas dan residu ADF awal (g)
Kadar Lignin (AOAC, 1995)
Sampel sebanyak 1 g ditimbang dalam labu Erlenmeyer 250 ml
kemudian ditambahkan H2SO4 20 ml. Selanjutnya didiamkan selama 2
jam dan dikocok perlahan-lahan. Sampel kemudian ditambahkan
aquades sebanyak 250 ml, dipanaskan dalam waterbath pada suhu
100 oC selama 3 jam. Selanjutnya dilakukan penyaringan dengan
% ADF = x 100%
menggunakan kertas saring yang telah diketahui bobotnya (A).
Erlenmeyer dan corong dibilas dengan aquades sebanyak 3 kali.
Kertas saring beserta residu diovenkan pada suhu 105oC selama 1-2
jam atau pada suhu 50 oC selama 24 jam. Kertas saring didinginkan
dan ditimbang bobotnya (B). Kertas saring dengan residu diabukan
dengan muffle furnace pada suhu 600 oC selama 3-4 jam. Kemudian
didinginkan dan ditimbang (C).
B-A-C
Bobot Contoh
Keterangan :
B = Bobot kertas saring dan residu setelah dioven (g)
A = Bobot kertas saring (g)
C = Bobot abu (g)
3.4.4 Kadar XOS
Analisis kadar XOS dilakukan secara kualitatif dan kuantitatif
menggunakan KCKT. Kondisi analisis kadar XOS menggunakan KCKT dengan kondisikolom yaitu sugar pak, fase geraknya aquades,
detektor refraktif index kode 2414, pelarut etanol 80%, dengan laju
alir 0.30 ml/min, dan volume injeksi 20 µL. Standar yang digunakan
adalah xilosa (Sigma). Sampel harus disaring dengan filter 0.20 µ,
selanjutnya aliquot dari sampel (20 µL) diinjeksikan ke dalam sistem
KCKT. Konsentrasi XOS (mg/mL) dapat dihitung dengan
menggunakan luas area sampel dibandingkan dengan luas area
standar.
Analisa kadar XOS dihitung sebagai berikut 2 g sampel
ditimbang, ditambahkan 50 ml alkohol 80% dikocok selama 1 menit.
Dipanaskan dengan water bath 85 oC selama 15 menit setelah itu
didinginkan, disaring dengan kertas saring Whatman No.4. Dicuci
dengan alkohol 80% sebanyak 5 ml. Larutan dikeringkan dengan
evaporator. Dilarutkan dengan 2 ml air, lalu dikocok. Sentrifus 3000
rpm selama 15 menit. Larutan disaring dengan Millipore (ukuran 0.2
mm). Larutan jernih dipipet 1 ml dan tambahkan aquades 4 ml,
selanjutnya dari larutan tersebut di ambil sebanyak 0.02 ml ditera
sampai dengan 5 ml. Larutan sampel diinjeksikan 20 µ l ke dalam
KCKT. Standar diinjeksikan dengan volume yang sama. Konsentrasi
standar xilosa 200 ppm.
x Konsentrasi. std x Volume akhir
Berat sampel
Keterangan :
std = Standar
FP = Faktor Pengenceran
3.4.5 Kadar Gula Pereduksi, Total Gula dan Derajat Polimerisasi
Analisis gula pereduksi dilakukan dengan metode DNS (Miller, 1959) sementara total gula diukur dengan menggunakan
spektrofotometer, dilakukan dengan metode fenol (Apriyantono et al.,
1989),
Kadar Gula Pereduksi (Metode DNS) (Miller, 1959)
Pereaksi DNS (3.5-dinitrosolisilat) dibuat dengan melarutkan
10.6 g asam 3.5-dinitrosalisilat dan 19.8 g NaOH ke dalam 1416 ml
aquades. Kemudian tambahkan ke dalam 306 g natrium kalium tartrat
(Na-k-tartarat), 8.3 g Na-metabisulfit dan 7.6 g fenol yang telah
dicairkan pada suhu 50oC. Bahan-bahan tersebut yang dicampurkan
hingga larut secara merata. Keasaman dari pereaksi DNS yang
dihasilkan ditentukan dengan cara mentitrasi sebanyak 3 ml larutan
DNS dengan HCl 0,1 N dan indikator fenoftalein. Banyaknya titran x FP Luas area sampel