PENGGUNAAN KARBOKSIMETIL KITOSAN DARI CANGKANG
BELANGKAS (Tachypleus gigas) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KONSENTRASI LOGAM Pb
SKRIPSI
FATYA ANANDA
110802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGGUNAAN KARBOKSIMETIL KITOSAN DARI CANGKANG
BELANGKAS (Tachypleus gigas) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KONSENTRASI LOGAM Pb
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
FATYA ANANDA
110802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Penggunaan Karboksimetil Kitosan Dari Cangkang Belangkas (Tachypleus Gigas) Sebagai Adsorben Untuk Menurunkan Konsentrasi Logam Pb
Kategori : Skripsi Nama : Fatya Ananda Nim : 110802016
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di, Medan, Mei 2015
Komisi Pembimbing :
Dosen Pembimbing 2, Dosen Pembimbing 1,
Prof. Dr. Zul Alfian,M.Sc. Prof. Dr. Harry Agusnar,M.Sc.,M.Phill. NIP. 195504051983031002 NIP.195308171983031002
Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGGUNAAN KARBOKSIMETIL KITOSAN DARI CANGKANG BELANGKAS (Tachypleus gigas) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KONSENTRASI LOGAM Pb
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing – masing disebutkan sumbernya.
Medan, Mei 2015
PENGHARGAAN
Puji dan syukur penulis ucapkan kehadirat Allah SWT karena dengan limpahan rahmat dan kasih sayang-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi ini sebagai salah satu persyaratan untuk meraih gelar Sarjana Sains di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Serta shalawat dan salam kepada Rasulullah Muhammad SAW yang telah membawa umatnya dari alam kegelapan menuju alam yang diterangi dengan lentera ilmu pengetahuan.
Ucapan terima kasih yang tak terhingga penulis persembahkan untuk Ayahanda tersayang, Idnedi dan Ibunda tercinta, Khairul Bariyah atas segala doa serta yang selama ini tak pernah berhenti memberikan kasih sayang, pengorbanan, motivasi dan bimbingan yang begitu berarti kepada penulis. Untuk adik-adikku, Fathurrahman Khalid dan Rusydi Rahman Khalid, semoga kelak kita bisa menjadi kebanggaan keluarga.
Dengan segenap kerendahan hati, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Harry Agusnar, M,Sc, M.Phill selaku dosen pembimbing 1 yang telah memberikan topik dan memberikan tunjuk ajar hingga terselesaikannya penulisan skripsi ini dan Bapak Prof. Dr. Zul Alfian, M.Sc selaku dosen pembimbing 2 yang dengan sabar telah membimbing penulis sehingga penulis mampu menyelesaikan penelitian dan penulisan skripsi dengan baik. Kepada Bapak Prof. Dr. Harlem Marpaung selaku Kepala Laboratorium Kimia Analitik FMIPA USU yang telah memberikan saran-saran kepada penulis. Kepada Ibu Dr. Rumondang Bulan Nst, MS dan Bapak Drs. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia FMIPA USU. Kepada Bapak dan Ibu dosen yang telah memberikan ilmunya kepada penulis selama mengikuti perkuliahan di FMIPA USU, terkhusus kepada Bapak Dr. Darwin Yunus Nasution, MS selaku dosen pembimbing akademik yang telah memberikan masukan dan arahan demi kelancaran studi penulis. Pada kesempatan ini, ucapan terima kasih juga penulis hadiahkan kepada laboran dan seluruh asisten laboratorium Kimia Analitik FMIPA USU, Kak Tiwi, Andy, Emi, Wiwi, Bella, Roberta dan adik-adik atas bantuan dan semangatnya selama ini. Kepada rekan-rekan stambuk 2011 khususnya Dewi Ratih atas bantuannya kepada penulis. Kepada Kak Meyrina dan Kak Anisa Maharani serta kepada seluruh pihak yang turut membantu penulis dalam menyelesaikan penulisan skripsi ini. Semoga Allah SWT membalas segala kebaikan yang telah diberikan secara tulus kepada penulis. Amin.
PENGGUNAAN KARBOKSIMETIL KITOSAN DARI CANGKANG BELANGKAS (Tachypleus gigas) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KONSENTRASI LOGAM Pb
ABSTRAK
Telah dilakukan penelitian mengenai penggunaan karboksimetil kitosan dari cangkang belangkas (Tachypleus gigas) sebagai adsorben untuk menurunkan konsentrasi logam Pb. Karboksimetil kitosan dibuat dengan mereaksikan kitosan dengan NaOH 40% dan asam monokloroasetat yang didispersikan dalam 2 -propanol selama 10 jam pada suhu ruangan sehingga terbentuk karboksimetil kitosan yang ditunjukkan dengan hasil analisis gugus fungsi menggunakan FTIR. Pada proses adsorpsi menggunakan larutan standar Pb dengan konsentrasi 5 mg/L dengan variasi pH adsorpsi adalah 2, 3, 4, 5 dan 6. Konsentrasi logam Pb yang diserap dari larutan ditentukan dengan menggunakan Spektrofotometer Serapan Atom (SSA). Hasil penelitian menunjukkan bahwa pH optimum penyerapan logam Pb adalah pada pH 5 dengan persentase penyerapan sebesar 92,61%.
THE USING OF CARBOXYMETHYL CHITOSAN FROM HORSESHOE CRAB’S SHELLS (Tachypleus gigas) AS ADSORBENT TO REDUCE
CONCENTRATION OF Pb METAL
ABSTRACT
Reaserch has been done on the using of carboxymethyl chitosan from horseshoe
crab’s shells (Tachypleus gigas) as adsorbent to reduce concentration of Pb metal.
Carboxymethyl chitosan was made by reacting chitosan sample with NaOH 40 % and monochloroacetic acid which dispersed in 2-propanol for 10 hours at room temperature that results in carboxymethyl chitosan shown by functional groups using FTIR. On the adsorption process using standard solution of Pb with concentration of 5 mg/L and variation of pH were 2, 3, 4, 5 and 6. The adsorbed Pb was measured by using Atomic Absorption Spectrophotometer (AAS). The results showed that the optimum pH of adsorption of Pb metal obtained at pH 5 with the percentage of reduced concentration of Pb was 92,61%.
DAFTAR ISI 2.2. Karboksimetil Kitosan 11
2.2.1. Sifat-Sifat Karboksimetil Kitosan 11 2.2.2. Penggunaan Karboksimetil Kitosan 12
3.2.2. Pembuatan Larutan Pereaksi 23 3.2.2.1. Larutan NaOH 40 % 23
3.2.2.2. Larutan 2-propanol/Asam Monokloroasetat 23 3.2.2.3. Larutan Etanol 80 % 23 3.3.1. Pembuatan Larutan 2-propanol/Asan Monokloroasetat 25 3.3.2. Pembuatan Larutan NaOH 40% 25 3.3.3. Pembuatan dan Karakterisasi Karboksimetil Kitosan 26 3.3.4. Pembuatan Larutan Seri Standar Timbal (Pb2+) 27
3.3.5. Pengukuran Absorbansi Larutan Blanko dan
Larutan Seri Standar Timbal (Pb2+) 28
dengan menggunakan Karboksimetil Kitosan 33
4.4. Pembahasan 34
4.4.1. Pembuatan Karboksimetil Kitosan 34 4.4.2. Analisa Spektrum FT-IR 34 4.4.3. Penentuan Derajat Deasetilasi 35 4.4.4. Penentuan pH Optimum pada Proses Adsorpsi Ion
Timbal (Pb2+) dengan menggunakan Karboksimetil Kitosan 37
4.5. Reaksi 39
Bab 5 Kesimpulan dan Saran 40 5.1. Kesimpulan 40
5.2. Saran 40
DAFTAR TABEL
Nomor Judul Halaman Tabel
4.1. Data Absorbansi Larutan Seri Standar Pb2+ dengan Spektrofotometer Serapan Atom pada λspesifik = 283,3 nm 30
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
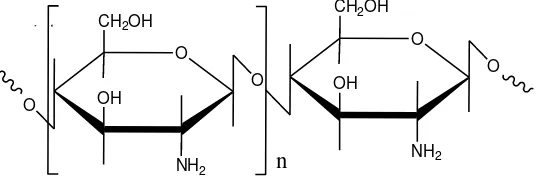
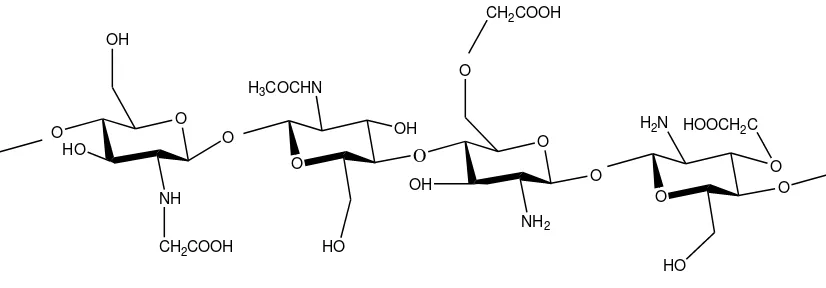
2.1. Struktur Kitosan 6 2.2. Struktur Karboksimetil Kitosan 11
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1. Serbuk Karboksimetil Kitosan 45 2. Perbandingan Spektrum FT-IR Kitosan yang digunakan
dalam penelitian dengan Standarnya 45
3. Spektrum FT-IR kitosan 46
4. Spektrum FT-IR Karboksimetil Kitosan 47 5. Data Hasil Pengukuran Absorbansi Larutan Seri Standar Pb
dengan Spektrofotometer Serapan Atom pada
λspesifik = 283,3 nm 48
6. Data Persen (%) Adsorpsi pada Penentuan pH Optimum
menggunakan Karboksimetil Kitosan 48 7. Spektrofotometer Serapan Atom Merk Shimadzu tipe
PENGGUNAAN KARBOKSIMETIL KITOSAN DARI CANGKANG BELANGKAS (Tachypleus gigas) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KONSENTRASI LOGAM Pb
ABSTRAK
Telah dilakukan penelitian mengenai penggunaan karboksimetil kitosan dari cangkang belangkas (Tachypleus gigas) sebagai adsorben untuk menurunkan konsentrasi logam Pb. Karboksimetil kitosan dibuat dengan mereaksikan kitosan dengan NaOH 40% dan asam monokloroasetat yang didispersikan dalam 2 -propanol selama 10 jam pada suhu ruangan sehingga terbentuk karboksimetil kitosan yang ditunjukkan dengan hasil analisis gugus fungsi menggunakan FTIR. Pada proses adsorpsi menggunakan larutan standar Pb dengan konsentrasi 5 mg/L dengan variasi pH adsorpsi adalah 2, 3, 4, 5 dan 6. Konsentrasi logam Pb yang diserap dari larutan ditentukan dengan menggunakan Spektrofotometer Serapan Atom (SSA). Hasil penelitian menunjukkan bahwa pH optimum penyerapan logam Pb adalah pada pH 5 dengan persentase penyerapan sebesar 92,61%.
THE USING OF CARBOXYMETHYL CHITOSAN FROM HORSESHOE CRAB’S SHELLS (Tachypleus gigas) AS ADSORBENT TO REDUCE
CONCENTRATION OF Pb METAL
ABSTRACT
Reaserch has been done on the using of carboxymethyl chitosan from horseshoe
crab’s shells (Tachypleus gigas) as adsorbent to reduce concentration of Pb metal.
Carboxymethyl chitosan was made by reacting chitosan sample with NaOH 40 % and monochloroacetic acid which dispersed in 2-propanol for 10 hours at room temperature that results in carboxymethyl chitosan shown by functional groups using FTIR. On the adsorption process using standard solution of Pb with concentration of 5 mg/L and variation of pH were 2, 3, 4, 5 and 6. The adsorbed Pb was measured by using Atomic Absorption Spectrophotometer (AAS). The results showed that the optimum pH of adsorption of Pb metal obtained at pH 5 with the percentage of reduced concentration of Pb was 92,61%.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Perkembangan industri yang begitu cepat di zaman sekarang ini seperti mata uang dengan dua sisi yang berbeda. Di satu sisi industri membawa manfaat yang sangat besar untuk memenuhi kebutuhan hidup manusia. Namun di sisi lain, ia ternyata juga menimbulkan masalah akibat limbah baik berupa zat padat, cair atau gas yang dihasilkan dari proses industri itu sendiri karena menggunakan material logam berat yang berbahaya. Pencemaran yang dihasilkan tidak hanya mengganggu tapi juga membahayakan orang yang tinggal di sekitar kawasan industri tersebut.
Timbal (Pb) adalah salah satu jenis polutan yang paling umum mencemari lingkungan. Hal ini terjadi karena sumber utama logam timbal dihasilkan dari gas buangan kendaraan bermotor. Sebagai tambahannya, logam timbal juga terdapat dalam limbah cair industri pada proses produksi yang menggunakan timbal, seperti industri baterai aki, industri cat, dan industri keramik. Keberadaan logam timbal dalam komponen lingkungan seperti air, tanah maupun udara menyebabkan perpindahannya menjadi semakin luas terhadap berbagai jenis makhluk hidup, termasuk manusia yang banyak menimbulkan masalah kesehatan, seperti gangguan pembentukan sel darah merah, anemia dan dapat menurunkan tingkat kecerdasan pada anak-anak (Naria, 2005).
pada interaksi ion-ion logam berat dengan gugus fungsi yang terdapat pada permukaan adsorben melalui interaksi dan pembentukan kompleks yang biasanya terjadi pada permukaan padat yang memiliki banyak gugus fungsi seperti –OH, NH, -SH, dan –COOH (Stumm, 1996).
Kitosan adalah poli (β-1,4)2-amino-2-deoxy-D-glukopiranosa yang dihasilkan
dari kitin, suatu biopolimer alam yang diekstraksi dari cangkang krustasea dengan cara mendeasetilasi sebagian gugus asetamidonya, umumnya lebih dari 60%, dengan menggunakan larutan basa kuat (Kumar et al., 2004). Kitosan memiliki sifat dan karakteristik yang unik dan berguna seperti biodegradable, kompatibel, dapat diperbaharui, dan tidak beracun. Kitosan dan turunannya digunakan dalam berbagai bidang meliputi farmasi, obat-obatan, pengolahan air, kosmetik, pertanian, dan industri makanan.
Akan tetapi, aplikasi kitosan masih sangat terbatas karena sifatnya yang tidak larut dalam larutan dengan pH netral ataupun basa karena struktur kristalinnya yang sangat stabil akibat adanya ikatan hidrogen yang kuat. Kelarutannya yang teramati hanya dalam larutan asam dibawah pH 6,5. Kelarutan kitosan dapat ditingkatkan dengan cara depolimerisasi dan modifikasi secara kimia (Cravotto et al, 2005). Beberapa penelitian telah dilakukan untuk meningkatkan daya larut kitosan, salah satunya dengan melakukan reaksi eterifikasi menghasilkan karboksimetil kitosan.
Karboksimetil kitosan adalah turunan dari kitosan yang diperoleh dengan menambahkan gugus karboksimetil pada gugus glukosamin dari rantai kitosan. Penambahan gugus karboksimetil ini diketahui selain memperbaiki kelarutan kitosan, juga mampu meningkatkan sifat fungsionalnya (Patale dan Patravele, 2011). Dengan begitu, aplikasinya menjadi semakin potensial terutama di bidang kedokteran, farmasi dan untuk pengolahan limbah buangan industri.
lebih selektif baik dalam larutan Pb tunggal maupun campuran Cu2+, Zn2+ dan Pb2+. Hastuti et al., (2013) telah membuat film CMC-Pektin yang digunakan sebagai adsorben logam Pb dengan variasi penyerapan adalah variasi massa adsorben, waktu kontak dan pH.
Berdasarkan uraian diatas, penulis tertarik untuk melakukan sintesis dan karakterisasi karboksimetil kitosan dari kitosan yang selanjutnya akan digunakan sebagai adsorben ion logam Pb2+ dari dalam larutan berair. Penelitian ini diharapkan dapat menghadirkan solusi alternatif untuk menanggulangi masalah pencemaran lingkungan yang disebabkan oleh logam berat Pb.
1.2 Permasalahan
1. Bagaimanakah pembuatan karboksimetil kitosan dari cangkang belangkas (Tachypleus gigas) dengan asam monokloroasetat?
2. Bagaimanakah pengaruh variasi pH terhadap kemampuan karboksimetil kitosan untuk menyerap ion Pb2+?
1.3 Pembatasan Masalah
1. Sampel yang digunakan adalah serbuk kitosan molekul tinggi yang diperoleh dari cangkang belangkas (Tachypleus gigas).
2. Proses reaksi eterifikasi kitosan dan asam monokloroasetat dilakukan selama 10 jam pada suhu ruangan.
1.4 Tujuan Penelitian
1. Untuk mengetahui kondisi reaksi yang tepat pada proses pembentukan karboksimetilkitosan dengan mereaksikan kitosan molekul tinggi dengan asam monokloroasetat.
2. Untuk mengetahui pengaruh variasi pH terhadap kemampuan karboksimetilkitosan untuk menyerap logam Pb dalam larutan.
1.5 Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan informasi ilmiah bahwa karboksimetil kitosan yang dibuat menggunakan kitosan yang berasal dari cangkang belangkas (Tachypleus gigas) dapat digunakan sebagai adsorben ion logam Pb2+ dari limbah berbagai industri yang sangat berbahaya karena disamping mencemari lingkungan juga mengganggu kesehatan makhluk hidup terutama manusia.
1.6 Lokasi Penelitian
1.7 Metodologi Penelitian
Penelitian ini dilakukan secara eksperimen di laboratorium. Adapun langkah-langkah yang dilakukan adalah sebagai berikut :
1. Pembuatan karboksimetilkitosan dari kitosan yang berasal dari cangkang belangkas.
2. Analisis gugus fungsi karboksimetil kitosan yang terbentuk dengan Fourier Transform Infra-Red (FTIR).
3. Penentuan pH optimum penyerapan adsorben terhadap ion Pb2+.
4. Penentuan kadar ion logam Pb2+ sebelum dan sesudah adsorpsi menggunakan Spektrofotometer Serapan Atom (SSA).
Adapun variable yang digunakan dalam penelitian ini adalah : 1. Ion logam yang diserap oleh adsorben adalah ion Pb2+. 2. Konsentrasi ion Pb2+ yang digunakan adalah 5 mg/L. 3. Volume larutan ion Pb2+ yang digunakan adalah 20 mL. 4. Berat adsorben yang digunakan adalah 0,1 gram.
5. Ukuran serbuk adsorben yang digunakan adalah 100 mesh.
BAB 2
TINJAUAN PUSTAKA
2.1 Kitosan
Kitosan adalah poli-(2-amino-2-deoksi-β-(1-4)-D-glokupiranosa) dengan rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin. Kitosan dijumpai
secara alamiah di beberapa organisme. Kitosan bukan merupakan senyawa tunggal, tetapi merupakan kelompok yang terdeasetilasi sebagian dengan derajat polimerisasi yang berbeda (Sugita, 2009).
Gambar 2.1 Struktur Kitosan (Sugita, 2009).
2.1.1 Sifat-Sifat Kitosan
Kitosan merupakan padatan amorf yang berwarna putih kekuningan dengan rotasi
spesifik [α]D 11 -3 hingga 10 (pada konsentrasi asam asetat 2%). Kitosan kebanyakan
larut dalam asam organik pada kisaran pH 4,0, namun tidak larut pada pH lebih besar dari 6,5, juga tidak larut dalam pelarut air, alkohol, dan aseton. Dalam asam mineral pekat seperti HCl dan HNO3, kitosan larut pada konsentrasi 0,15-1,1%, tetapi tidak
larut pada berbagai konsentrasi 10%. Kitosan tidak larut dalam H2SO4 pada berbagai
konsentrasi, sedangkan di dalam H3PO4 tidak larut pada konsentrasi 1% sementara
pada konsentrasi 0,1% sedikit larut.
Kitosan larut dalam pelarut organik, HCl encer, HNO3 encer, H3PO4 0,5%
dan CH3COOH 1%, tetapi tidak larut dalam basa kuat dan H2SO4. Dalam kondisi asam
berair, gugus amino (-NH2 ) kitosan akan menangkap H+ dari lingkungannya,
sehingga gugus aminonya terprotonasi menjadi –NH3+. Gugus –NH3+ inilah yang
menyebabkan kitosan bertindak sebagai garam, sehingga dapat larut dalam air. Selain itu, muatan positif –NH3+ dapat dimanfaatkan untuk adsorpsi zat warna anionik dan
kation logam yang memanfaatkan keberadaan pasangan elektron bebas pada gugus – OH dan –NH2 (Sugita, 2009).
Kitosan dalam bentuk terprotonasi menunjukkan kerapatan muatan yang tinggi dan bersifat sebagai polielektrolit kationik dan sangat efektif berinteraksi dengan biomolekul bermuatan negatif dan biomolekul permukaan. Sedangkan dalam bentuk netralnya, kitosan mampu mengkompleks ion logam berat berbahaya seperti Cu, Cr, Cd, Mn, Co, Pb, Hg, Zn, dan Pd. Perilaku aliran polielektrolit kitosan ditentukan oleh konformasi molekular keseluruhan dan tingkat ikatan hidrogen atau tolakan elektrostatik antar segmen rantai yang bersebelahan (Rha, 1984).
2.1.2 Penggunaan Kitosan
Saat ini, penggunaan kitosan di berbagai bidang berkembang sangat pesat karena telah banyak penelitian yang membuktikan bahwa kitosan dan turunannya bermanfaat bagi kehidupan manusia, diantaranya adalah di bidang lingkungan, biologi, medis, farmasi, industri pangan dan fotografi.
a. Bidang Lingkungan
Kitosan lazimnya disintesis dari deasetilasi kitin yang berasal dari limbah kulit udang atau kepiting. Oleh karena itu, penggunaan kitosan sejak awal telah berperan dalam mengurangi pencemaran lingkungan. Manfaat kitosan dalam bidang lingkungan adalah untuk menjerap logam maupun zat warna yang banyak dihasilkan dari industri tekstil atau kertas.
b. Bidang Biologi
Urea bersifat racun dan dihasilkan dalam proses pemurnian darah. Oleh karena itu, urea harus dihilangkan dari dalam tubuh. Menurut Liu et al., (2003) membran kitosan lebih baik bila dibandingkan dengan kitosan bentuk lainnya dalam hal menjerap urea karena memiliki permukaan yang luas, jalur difusi yang pendek, dan produktivitasnya yang tinggi.
c. Bidang Medis
d. Bidang Farmasi
Selain dapat menjerap zat organik, anorganik, atau logam berat, kitosan juga dapat menjerap golongan senyawa flavonoid. Penelitian Morsch et al., (2004) berhasil mengidentifikasi kitosan termodifikasi heptaldehida (Ch-Hp) sebagai adsorben untuk pemisahan kromatografi flavonoid dari A. moluccana. (Sugita, 2009).
e. Bidang Industri Pangan
Karena sifat kitin dan kitosan yang dapat mengikat air dan lemak, maka keduanya dapat digunakan sebagai media pewarnaan makanan, sebagai pengental dan pembentuk emulsi yang lebih baik daripada mikrokristalin selulosa.
f. Bidang Fotografi
Kitosan banyak digunakan terutama karena sifat resistansinya terhadap abrasi, karakteristik optik, kemampuan membentuk film dan interaksinya dengan kompleks perak sehingga ia dengan mudah ditembus oleh larutan yang membawa kompleks perak dari satu lapisan ke lapisan lain dari suatu film (Muzzarelli, 1977).
2.1.3 Modifikasi Kitosan
a. Dekanol EX841
Penautan silang dilakukan dengan menggunakan senyawa yang setidaknya memiliki 2 gugus fungsi. Salah satu contohnya ialah penautan silang serat kitosan dengan menggunakan dekanol EX841. Hasil penelitian tersebut menunjukkan bahwa kapasitas adsorpsi kitosan setelah penautan silang menurun dengan naiknya jumlah Dekanol EX841.
Glutaraldehid
Glutaraldehida merupakan agen penaut silang kitosan yang paling banyak digunakan. Glutaraldehid dapat menautsilangkan rantai kitosan melalui reaksi pembentukan basa Schiff (imina tersubstitusi, -CH=NR) antara gugus aldehida glutaraldehida dan gugus –NH2 kitosan. Kitosan tertaut silang
glutaraldehida telah diterapkan untuk menjerap berbagai logam berat.
b. Epikolorohidrin
Agen penaut silang epikolorohidrin telah digunakan oleh Vieira dan Beppu (2006) serta Chen et al., (2008). Hasil tautan silangnya juga digunakan untuk menjerap logam berat. Berbeda dengan glutaraldehida, epikolorohidrin tidak beraksi dengan gugus –NH2, tetapi berekasi dengan gugus –OH primer. c. Tripolifosfat
d. 1,6-Heksametilenadiisosianat
Agen 1,6-Heksametilenadiisosianat merupakan contoh lain penaut silang yang berikatan dengan gugus –OH primer kitosan. Agen tersebut digunakan
untuk menautkan kitosan dengan β-siklodekstrin yang telah diteliti dapat
mengikat kolesterol.
e. Asam Kloroasetat
Reaksi antara kitosan dan asam monokloroasetat akan menghasilkan N,O-karboksimetil kitosan (CMC) (Sun dan Wang, 2006). Pada penitian tersebut, CMC juga ditaut silangkan dengan glutaraldehida dan dilakukan pembuatan cetakan untuk Cu2+. Hasil yang diperolah menunjukkan bahwa kapasitas adsorpsi meningkat seiring dengan kenaikan derajat substitusi. Hal tersebut mengindikasikan bahwa gugus karboksil juga berperan dalam proses penjerapan (Sugita, 2009).
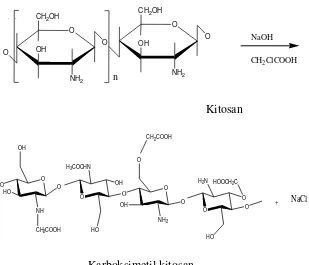
2.2 Karboksimetil Kitosan
Karboksimetil kitosan merupakan salah satu turunan kitosan yang dapat diperoleh melalui suatu reaksi eterifikasi (karboksimetilasi) antara kitosan dengan asam monokloroasetat dalam suasana alkalis. Gugus karboksimetil dari asam monokloroasetat menstubtitusi gugus hidroksil dan gugus amin pada rantai kitosan. Pada prinsipnya, reaksi pembentukan karboksimetil kitosan adalah reaksi asam-basa. Salah satu faktor yang berpengaruh dalam pembentukan karboksimetil kitosan adalah suhu eterifikasi (Basmal dkk., 2005).
O
Gambar 2.2 Struktur Karboksimetil Kitosan (Sugita, 2009)
2.2.1 Sifat – Sifat Karboksimetil Kitosan
Karboksimetil kitosan terdapat dalam bentuk serbuk yang berwarna putih kotor hingga putih bersih. Adanya gugus karboksil dalam rantai karboksimetil kitosan membuatnya dapat larut dalam media netral, asam maupun basa. Karboksimetil kitosan merupakan bahan polimer yang sangat mudah larut. Sifat lain dari karboksimetil kitosan adalah daya adsorpsi dan retensi kelembapannya sehingga senyawa ini sangat penting di bidang kosmetik dan obat-obatan (Mourya et al., 2010).
2.2.2 Penggunaan Karboksimetil Kitosan
2.3 Adsorpsi
Secara umum, adsorpsi adalah suatu proses pemisahan komponen-komponen tertentu dalam fasa cair atau gas melewati suatu permukaan padat yang disebut adsorben, sedangkan komponen yang diserap disebut adsorbat. Berkas selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk memisahkan bahan dengan konsentrasi yang kecil dari campuran yang mengandung bahan lain yang berkonsentrasi tinggi. Adsorbsi digunakan dalam air buangan industri, terutama untuk mengurangi komponen-komponen organik misalnya warna, fenol, detergen, zat toksik dan zat-zat organik yang susah diuraikan (Mc. Cabe dkk., 1999).
Ketika permukaan padatan dipaparkan pada molekul adsorbat, adsorbat akan membentur permukaan padatan, sehingga sebagian akan menempel di permukaan padatan dan terjerap, sedangkan yang lain terpantul kembali. Pada awalnya, laju adsorpsi cukup besar karena seluruh permukaan masih kosong. Namun, setelah waktu kontak semakin lama, permukaan yang terisi oleh molekul gas semakin banyak dan luas daerah kosong menyusut, sehingga laju adsorpsinya ikut menurun. Bersamaan dengan itu, laju desorpsi, yaitu laju pelepasan kembali molekul adsorbat, justru meningkat hingga tercapai suatu kesetimbangan dinamis adsorpsi-desorpsi.
Berdasarkan gaya yang terlibat, adsorpsi dapat dibedakan menjadi dua, yaitu adsorpsi fisik dan kimia. Adsorpsi fisik (fisisorpsi) hanya melibatkan gaya Van der Walls yang lemah antara adsorpsi, pertukaran atau pemakaian bersama elektron antara molekul adsorbat dan permukaan adsorben. Kekuatan interaksi adsorben-adsorbat berbanding lurus dengan kalor adsorpsinya. Kalor adsorbat proses kemisorpsi (40-400 kJ per mol) lebih besar hingga 20 kali lipat dibandingkan dengan gaya yang terdapat pada fisisorpsi, yaitu tidak lebih dari 10-20 kJ per mol (Sugita, 2009).
2.4 Pencemaran oleh Logam Berat
Toksisitas logam berat bisa dikelompokkan menjadi 3, yaitu bersifat toksik tinggi yang terdiri dari unsur-unsur Hg, Cd, Pb, Cu dan Zn; bersifat toksik sedang yang terdiri dari unsur-unsur Cr, Ni dan Co; dan bersifat toksik rendah yang terdiri atas unsur Mn dan Fe. Tingkat toksisitas logam berat terhadap hewan air, mulai dari yang paling toksik, adalah Hg, Cd, Zn, Pb, Cr, Ni dan Co. tingkat toksisitas terhadap manusia dari yang paling toksik adalah Hg, Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn (Widowati dkk. 2008).
Logam – logam tertentu sangat berbahaya jika ditemukan dalam konsentrasi tinggi dalam lingkungan, karena logam tersebut mempunyai sifat merusak tubuh makhluk hidup. Disamping hal tersebut, beberapa logam sangat diperlukan dalam proses kehidupan makhluk hidup. Dalam hal ini logam dapat dibagi menjadi dua bagian, yaitu logam esensial dan nonesensial. Logam esensial adalah logam yang sangat membantu di dalam proses fisiologis makhluk hidup dengan jalan membantu kerja enzim atau pembentukan organ dari makhluk yang bersangkutan. Sedangkan logam nonesensial adalah logam yang peranannya dalam tubuh makhluk hidup belum diketahui, kandungannya dalam jaringan hewan sangat kecil dan apabila kandungannya tinggi akan merusak organ – organ tubuh makhluk yang bersangkutan (Vogel, A.I., 1994).
2.5 Logam Timbal (Pb)
Logam ini sangat populer dan banyak dikenal oleh orang awam. Hal tersebut disebabkan oleh banyaknya timah hitam yang digunakan di pabrik dan paling banyak menimbulkan keracunan pada makhluk hidup (Darmono, 1995). Timbal memiliki nomor atom 82 dengan berat atom 207,20. Titik leleh timbal adalah 1740C dan memiliki massa jenis 11,34 g/cm3 (Widowati, 2008). Sifat-sifat dan kegunaan logam ini adalah :
- Mempunyai titik lebur yang rendah (327,46C) sehingga mudah digunakan dan murah biaya operasinya.
- Mudah dibentuk karena logam ini lunak
- Bila dicampur dengan logam lain membentuk logam campuran yang lebih bagus daripada logam murninya
Timbal adalah sejenis logam yang lunak dan berwarna coklat kehitaman, serta mudah dimurnikan dari pertambangan. Dalam pertambangan, logam ini berbentuk sulfida logam (PbS). Senyawa ini banyak ditemukan pada banyak pertambangan di seluruh dunia. Bahaya yang ditimbulkan oleh penggunaan timbal ini adalah sering menyebabkan keracunan ( Darmono, 1995).
2.5.1 Sumber Pencemaran Logam Pb
Timbal dapat masuk ke dalam sistem perairan melalui beberapa mekanisme di dalam daerah pertambangan dimana banyak ditemukan batu kapur (limestone) dan galena. Sistem perairan alami dapat mengandung timbal dengan konsentrasi sebesar 0,8 g l-1 , umumnya dihasilkan dari proses leaching dari cat yang menggunakan PbCrO4 atau
dari instalasi pipa.
Sumber masuknya Pb ke lingkungan yang paling penting zaman sekarang ini berasal dari emisi kendaraan bermotor. Penggunaan timbal dalam jumlah yang besar adalah sebagai senyawa antiketuk dalam bensin. Meskipun pemakaiannya kini sudah menurun, masih saja pencemaran utama logam Pb berasal dari sumber ini. Makhluk hidup yang berada atau tinggal disekitar jalan raya dapat mengandung kadar logam Pb yang tinggi (Waite, 1984).
Timbal digunakan sebagai bahan untuk solder dan untuk penyambung pipa air, sehingga air untuk rumah tinggi kemungkinan dapat kontak dengan timbal. Air yang tersimpan dalam alat-alat yang dibuat dari hasil pematrian, untuk jangka waktu lama dapat mengakumulasi sejumlah timbal yang sangat tinggi (Achmad, 2004).
2.5.2 Toksisitas Logam Pb
Gejala khas dari keracunan Pb ini pada anak berbeda dengan orang dewasa. Kerusakan saraf perifer (saraf tepi) lebih umum daripada kerusakan saraf pusat yang dialami oleh anak-anak. Pada awal keracunan sampai 4 – 6 minggu mungkin tidak memperlihatkan gejala sama sekali. Kemudian berlanjut dengan kelemahan, sakit kepala, nafsu makan menurun yang diikuti dengan sakit perut dan muntah-muntah. Jika keracunan terus berlanjut maka gejala khas berikutnya akan menyusul yang pada akhirnya akan menyebabkan kematian.
Pada tahun 1953 Bayers dan Lord melaporkan bahwa anak yang telah menderita toksisitas Pb cenderung menunjukkan adanya gangguan tingkah laku pada masa dewasanya nanti, termasuk gangguan neurologinya. Anak tersebut menjadi bodoh, kesulitan dalam berpikir, gangguan tingkah laku termasuk aktivitas sehari-hari. Gamgguan mental juga dapat terjadi dan kerusakan otak secara permanen dapat terjadi pada keracunan yang parah.
Keracunan Pb pada orang dewasa biasanya terjadi di tempat mereka bekerja. Prevalensi keracunan Pb di tempat kerja telah banyak dilaporkan dan hasilnya bervariasi tergantung pada jenis industrinya. Gejala khas keracunan Pb pada orang dewasa ialah kepucatan, sakit perut, konstipasi, muntah-muntah, anemia, dan yang
paling sering ialah terlihatnya warna biru “garis biru” pada gusi.
Di samping itu, hasil uji psikologi dan neuropsikologi menunjukkan terjadi penurunan daya ingat, kurang konsentrasi, sulit berbicara, kurang penglihatan, dan psikomotor. Neuropati saraf tepi tersebut dapat terlihat dengan adanya kelemahan otot dan gangguan sistem gerak, kelumpuhan pada berkas otot ekstensor pada tangan dan kaki. Kadang-kadang terjadi penurunan sistem daya sensor saraf yang mengakibatkan daya perasa berkurang ( Darmono, 1995).
2.6 Spektroskopi Infra-Red
panjang gelombang tersebut banyak kalor. Daerah spektrum tersebut selanjutnya disebut infra red. Spektroskopi infra merah ditujukan untuk maksud penentuan gugus-gugus fungsi molekul pada analisa kualitatif disamping untuk tujuan analisis kuantitatif (Mulja, 1995).
Spektrometer Infra-Red modern bekerja dengan menggunakan prinsip yang berbeda-beda. Susunan jalur optiknya menghasilkan suatu pola yang disebut dengan interferogram. Interferogram adalah sebuah sinyal yang kompleks tetapi polanya yang menyerupai gelombang memiliki semua bentuk frekuensi yang menyusun spektrum infra-red tersebut. Interferogram sebenarnya adalah plot intensitas versus waktu. Namun, ahli kimia lebih tertarik pada spektrum yaitu plot intensitas versus frekuensi. Suatu operasi matematika yang dikenal sebagai Fourier-Transform dapat memisahkan absorpsi frekuensi individual dari interferogram, sehingga menghasilkan spektrum yang identik dengan spektrum yang diperoleh dari spectrometer dispersive. Instrumen ini dikenal dengan Fourier Transform Infra-Red atau FT-IR. Kelebihan dari instrumen FT-IR adalah alat ini dapat memperoleh interferogram dalam waktu yang sangat cepat. Hal ini memungkinkan untuk memperoleh banyak interferogram dari sampel yang sama dan mengumpulkannya dalam memori komputer. Dengan demikian FT-IR dapat melakukan proses identifikasi dengan kecepatan dan sensitivitas yang lebih besar dari pada instrumen dispersi.
Instrumen FT-IR yang dihubungkan dengan komputer beropersi secara berkas-tunggal. Untuk mendapatkan spektrum dari suatu senyawa, peneliti awalnya
memperoleh interferogram “latar belakang” yang terdiri dari gas atmosfer infra-red
2.7 Spektrofotometer Serapan Atom
Penggunaan spektrofotometri serapan atom ke unsur-unsur lain semula merupakan akibat perkembangan spektroskopi pancaran nyala. Telah lama ahli kimia menggunakan pancaran radiasi oleh atom yang dieksitasikan dalam suatu nyala sebagai alat analitis. Pada tahun 1955, Walsh menekankan bahwa dalam suatu nyala yang lazim, kebanyakan atom berada dalam keadaan elektronik dasar bukannya dalam keadaan eksitasi. Misalnya untuk transisi yang menghasilkan garis natrium kuning pada 589 nm, rasio banyaknya atom tereksitasi terhadap keadaan dasar, pada 2700C, kira-kira adalah 6 × 10-4.. Selanjutnya ia mencatat bahwa fraksi atom-atom yang terekistasi berubah secara eksponensial dengan temperatur, dengan menaruh premium pada pengaturan nyala dalam studi pancaran, sedangkan dengan begitu sedikit atom yang tereksitasi, populasi keadaan dasar jauh kurang peka terhadap temperatur. Adsorpsi atom berkembang dengan cepat selama tahun 1960, instrumen komersial menjadi tersedia, dan teknik itu sekarang sangat meluas digunakan untuk penetapan sejumlah unsur, kebanyakan logam, dan sampel yang sangat beraneka ragam.
Sistem peralatan pada spektofotometer serapan atom adalah sebagai berikut : Tabung
katoda Pemotong Nyala berongga berputar
- + Monokromator Detektor Amplifier Recorder
Motor
Suplai daya Bahan bakar Sampel Oksigen
Gambar 2.3. Komponen-komponen spektrofotometer serapan atom (Day, 2002). 1. Sumber Sinar
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan gas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu :
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Pada cara spektrofotometri emisi atom, nyala ini berfungsi untuk mengeksitasikan atom dari tingkat dasar ke tingkat yang lebih tinggi.
Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas yang digunakan, misalnya untuk gas batubara-udara, suhunya kira-kira sebesar 18000C, gas alam-udara 17000C, asetilen-udara 22000C, dan gas asetilen-dinitrogen oksida (N2O) sebesar
30000C.
b. Tanpa nyala (Flameless)
Proses pengatoman tanpa nyala dapat dilakukan dalam tungku dari grafit seperti tungku yang dikembangkan oleh Masmann. Sistem pemanasan dengan tanpa nyala ini dapat melalui tiga tahap yaitu pengeringan (drying) yang membutuhkan suhu yang rendah, pengabuan (ashing) yang membutuhkan suhu yang lebih tinggi karena untuk menghilangkan matriks kimia dengan mekanisme volatilisasi atau pirolisis, dan pengatoman (atomizing).
3. Monokromator
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman. Biasanya digunakan tabung penggandaan foton (photomultiplier tube). Ada dua cara yang dapat digunakan dalam sistem deteksi yaitu yang memberikan respon terhadap radiasi resonansi dan radiasi kontinyu, dan yang hanya memberikan respon terhadap radiasi resonansi.
5. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai sistem pencatat hasil. Pencatat hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu angka transmisi atau absorbsi (Rohman, A. 2007).
Gangguan yang nyata pada SSA sudah dijelaskan oleh persamaan Boltzmann. Pada penentuan nilai serapan atom seringkali didapatkan suatu harga yang tidak sesuai dengan konsentrasi unsur sampel yang ditentukan. Penyebab dari gangguan ini adalah faktor matriks sampel, faktor kimia akibat adanya gangguan molekuler yang bersifat menyerap radiasi.
Ada beberapa usaha untuk mengurangi gangguan kimia pada SSA yaitu dengan jalan : - Menaikkan temperatur nyala agar mempermudah penguraian, untuk itu dipakai
gas pembakar campuran C2H2 + N2O yang memberikan nyala dengan
temperatur yang tinggi.
- Menambahkan elemen pengikat gugus atau atom penyangga, sehingga terikat kuat akan tetapi atom yang ditentukan bebas sebagai atom netral.
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat
− Fourier Transform-Infra Red Shimadzu
− Spektrofotometer Serapan Atom Shimadzu AA-7000-F
− Neraca analitis Shimadzu ATY224
− Beaker glass Pyrex
− Labu ukur Pyrex
− Gelas Ukur Pyrex
− Pipet tetes
− Pipet volume Pyrex
− Kertas saring no. 42 Whatman
− Botol aquadest
− Batang pengaduk
− Corong kaca
− Ayakan 100 Mesh
− Magnetic stirrer
− Spatula
− Indikator universal
− Sample cup
− Desikator
3.1.2 Bahan
− Kitosan molekul tinggi
− 2-propanol p.a (Merck)
− NaOH p.a (Merck)
− Asam monokloroasetat p.a (Merck)
− Metanol p.a (Merck)
− Asam asetat glacial p.a (Merck) − Etanol absolut p.a (Merck) − Pb(NO3)2 p.a (Merck)
− Aquadest
3.2 Prosedur Penelitian
3.2.1 Preparasi dan Karakterisasi Karboksimetil kitosan dari Kitosan Molekul
Tinggi
3.2.2 Pembuatan Larutan Pereaksi
3.2.2.1 Larutan NaOH 40%
Sebanyak 20 gram NaOH pellet dimasukkan ke dalam beaker glass dan dilarutkan dengan menggunakan aquadest kemudian dimasukkan ke dalam labu takar 50 ml dan diencerkan dengan aquadest hingga garis batas labu takar, lalu dihomogenkan.
3.2.2.2 Larutan 2-propanol / Asam Monoklorosasetat (1:1 w/w)
Sebanyak 14,4 gram asam monokloroasetat dimasukkan ke dalam beaker glass kemudian dilarutkan dengan 18,32 mL 2-propanol.
3.2.2.3 Larutan Etanol 80%
Sebanyak 80 mL etanol absolut dimasukkan ke dalam labu ukur 100 mL, kemudian diencerkan hingga garis batas labu takar, lalu dihomogenkan.
3.2.3 Pembuatan Larutan Standar Pb2+
3.2.3.1 Larutan Standar Pb2+ 1000 mg/L
Sebanyak 0,3995 gram kristal Pb(NO3)2 dimasukkan ke dalam gelas beaker yang telah
berisi aquadest, diaduk hingga seluruh kristal larut sempurna, dimasukkan ke dalam labu takar 250 mL, ditambahkan aquadest hingga garis batas lalu dihomogenkan.
3.2.3.2 Larutan Standar Pb2+ 100 mg/L
Dipipet sebanyak 5 mL larutan induk Pb2+ 1000 mg/L dan dimasukkan ke dalam labu takar 50 mL, kemudian ditambahkan aquadest hingga garis batas lalu dihomogenkan.
3.2.3.3 Larutan Standar Pb2+ 10 mg/L
3.2.3.4 Larutan Seri Standar Pb2+ 0,0; 0,2; 0,4; 0,6; 0,8 dan 1,0 mg/L
Dipipet 0,0; 1,0; 2,0; 3,0; 4,0 dan 5,0 mL larutan induk Pb2+ 10 mg/L dan dimasukkan ke dalam labu takar 50 mL, kemudian ditambahkan aquadest hingga garis batas dan dihomogenkan.
3.2.4 Pembuatan Kurva Kalibrasi Pb2+
Larutan blanko diukur absorbansinya dengan Spektrofotometer Serapan Atom (SSA) pada λ = 283,3 nm dan dilakukan hal yang sama untuk larutan seri standar Pb2+ 0,2; 0,4; 0,6; 0,8 dan 1,0 mg/L.
3.2.5 Penentuan pH Optimum Penyerapan Ion Pb2+ Menggunakan Serbuk Karboksimetil Kitosan
3.3. Bagan Penelitian
3.3.1 Pembuatan Larutan 2-propanol/Asam Monokloroasetat (1:1 w/w)
Dimasukkan ke dalam beaker glass Ditambahkan dengan 18,32 ml 2-propanol
Diaduk hingga larut
3.3.2 Pembuatan NaOH 40%
Dimasukkan ke dalam beaker glass
Dilarutkan dengan menggunakan aquadest Dimasukkan ke dalam labu takar 50 mL
Diencerkan dengan aquadest hingga garis batas labu takar
Dihomogenkan 14,4 gram Asam Monokloroasetat
Hasil
Hasil
3.3.3 Pembuatan dan Karakterisasi Karboksimetil Kitosan
Didispersikan dalam 65 mL 2-propanol Diaduk dengan magnetic stirrer selama 20 menit
Ditambahkan larutan NaOH 40% dan larutan asam monokloroasetat/2-propanol (1:1 w/w) Direaksikan selama 10 jam dengan
menggunakan magnetic stirrer Disaring
Disuspensikan dalam 150 mL methanol
Dinetralkan dengan asam asetat glacial hingga pH = 7 Disaring
Dicuci secara berulang-ulang dengan menggunakan etanol 80% Dikeringkan pada suhu ruangan
Dikarakterisasi dengan menggunakan FT-IR 3 gram Kitosan
Endapan Filtrat
Endapan Filtrat
Karboksimetil Kitosan
3.3.4 Pembuatan Larutan Seri Standar Timbal (Pb) (SNI.6989.08-2004)
Dipipet sebanyak 5 mL larutan standar timbal Dimasukkan ke dalam labu takar 50 mL
Diencerkan dengan aquadest sampai garis batas Dihomogenkan
Dipipet sebanyak 5 mL larutan standar timbal Dimasukkan ke dalam labu takar 50 mL
Diencerkan dengan aquadest hingga garis batas Dihomogenkan
Dipipet sebanyak 0,0; 1,0; 2,0; 3,0; 4,0; dan 5,0 mL larutan standar timbal
Dimasukkan ke dalam labu takar 50 mL
Diencerkan dengan aquadest hingga garis batas Dihomogenkan
Larutan Standar Pb2+ 1000 mg/L
Larutan Standar Pb2+ 100 mg/L
Larutan Standar Pb2+ 10 mg/L
3.3.5 Pengukuran Absorbansi Larutan Blanko dan Larutan Seri Standar
Timbal (Pb2+)
Diatur pada pH 3 dengan penambahan HNO3(p)
Diukur absorbansinya menggunakan
Spektrofotometer Serapan Atom pada λ
= 283,3 nm Hasil
3.3.6 Penentuan pH Optimum Penyerapan
Dimasukkan ke dalam labu
Erlenmeyer 250 mL Diatur pada pH 2
Ditambahkan 0,1 gram serbuk karboksimetil kitosan
Diaduk selama 30 menit dengan menggunakan magnetic stirrer Disaring menggunakan kertas saring Whatman No. 42
Diatur pada pH 3
Diukur absorbansinya pada panjang gelombang = 283,3 nm dengan menggunakan Spektrofotometer Serapan Atom
Catatan : Perlakuan yang sama dilakukan pada pH larutan 3, 4, 5, dan 6.
20 mL Larutan Standar Pb2+ 5 ppm
Filtrat Residu
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1 Pengukuran Ion Timbal (Pb2+)
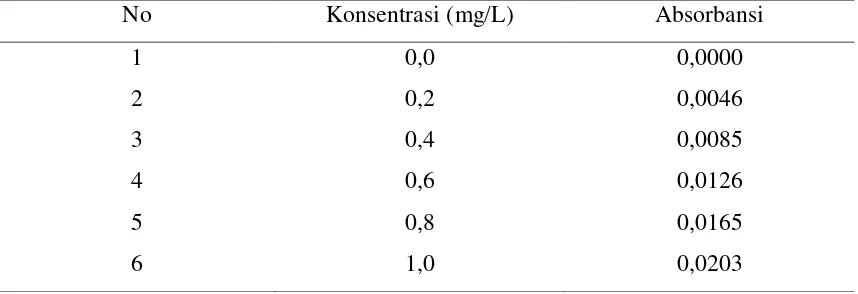
Hasil pengukuran absorbansi dari larutan seri standar ion timbal (Pb2+) dengan variasi konsentrasi yaitu 0,2 mg/L, 0,4 mg/L, 0,6 mg/L, 0,8 mg/L dan 1,0 mg/L yang diplotkan terhadap larutan blanko dengan konsentrasi 0 mg/L sehingga diperoleh kurva kalibrasi berupa garis linear. Data absorbansi untuk larutan standar ion timbal (Pb2+) dapat dilihat pada tabel 4.1 berikut ini :
Tabel 4.1 Data Absorbansi Larutan Standar Timbal (Pb)
No Konsentrasi (mg/L) Absorbansi
1 0,0 0,0000
2 0,2 0,0046
3 0,4 0,0085
4 0,6 0,0126
5 0,8 0,0165
6 1,0 0,0203
4.2. Pengolahan Data Logam Timbal (Pb)
4.2.1. Penurunan Persamaan Garis Regresi dengan Metode Least Square
Gambar 4.1 Kurva Kalibrasi Larutan Seri Standar Ion Timbal (Pb2+)
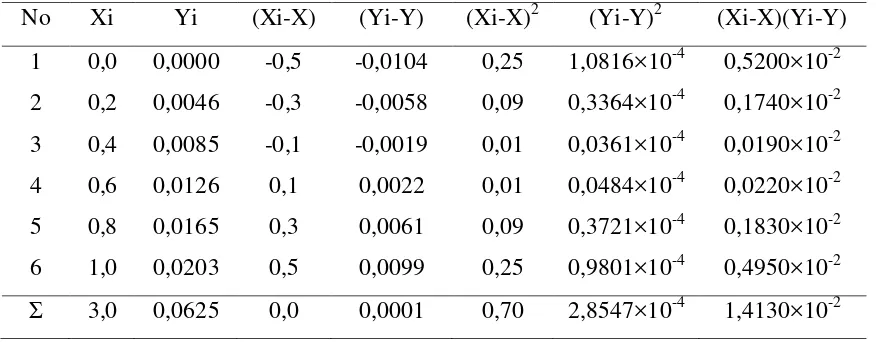
Persamaan garis regresi ini diturunkan dengan metode Least Square, dimana konsentrasi dari larutan standar dinyatakan sebagai Xi dan absorbansi dinyatakan sebagai Yi seperti pada tabel 4.2 berikut ini
Tabel 4.2. Data Hasil Penurunan Persamaan Garis Regresi untuk Larutan Seri Standar Pb2+
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
= +
Dimana : a = slope b = intersept Nilai slope dan intersept dapat ditentukan dengan menggunakan metode Least Square sebagai berikut :
=Ʃ � − � −
Ʃ � − =
, × −
, = ,
= − = , − , , = , Maka, persamaan garis regresi yang diperoleh adalah :
= , + ,
4.2.2. Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
=[Ʃ � −Ʃ � − � −� − ] /
Koefisien korelasi untuk logam timbal (Pb2+) adalah :
= , , ×× −− /
= ,, ×× −−
= ,
4.3 Persentase Penurunan Kadar Ion Timbal (Pb2+) dalam Larutan dengan menggunakan Karboksimetil Kitosan
Proses adsorpsi dilakukan berdasarkan pada penentuan pH optimum adsorpsi yang dilakukan mulai pada pH 2 hingga pH 6. Persentasi penurunan kadar ion Pb2+ dalam larutan sebelum dan setelah diadsorpsi dapat ditentukan dengan menggunakan persamaan berikut :
% � � =� �� � − �� � � � ℎ� × %
Dari data hasil pengukuran yang terdapat pada tabel 4.2 dan 4.3 maka penentuan % adsorpsi untuk pH optimum dengan menggunakan karboksimetil kitosan adalah :
% � � = , ,− , × % = , %
Data % adsorpsi pada penentuan pH optimum secara lengkap dapat dilihat pada tabel 4.3 berikut ini :
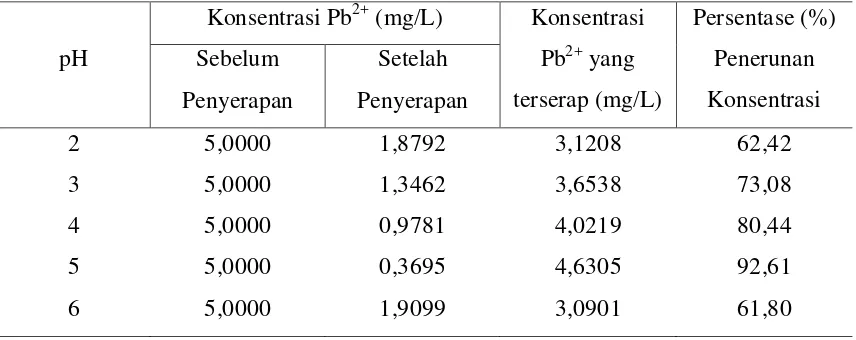
Tabel 4.3. Data Persentase (%) Penurunan Kadar Ion Timbal (Pb2+) dengan penambahan Karboksimetil Kitosan
pH
4.4 Pembahasan
4.4.1 Pembuatan Karboksimetil Kitosan
Pembuatan karboksimetil kitosan dilakukan dengan mendispersikan kitosan dalam 2 -propanol sebagai larutan media berlangsungnya reaksi karboksimetilasi. Lalu diaduk dengan menggunakan magnetic stirrer selama 20 menit. Kemudian ditambahkan larutan NaOH 40% dan larutan asam monokloroasetat/2-propanol (1:1 w/w) ke dalam larutan kitosan tersebut dan larutan direaksikan selama 10 jam pada suhu ruangan. Pada proses ini, penambahan NaOH bertujuan untuk membuat suasana alkalis pada larutan kitosan dimana kitosan akan mengikat ion Na+ sehingga ketika penambahan asam monokloroasetat akan terjadi reaksi pertukaran ion. Ion Na+ akan bereaksi dengan ion Cl- yang dilepaskan oleh asam monokloroasetat membentuk garam NaCl. Sedangkan kitosan yang telah melepaskan ion Na+ akan bersifat reaktif terhadap gugus karboksil dari asam monokloroasetat sehingga membentuk karboksimetil kitosan (Kurniasih dkk., 2012). Setelah itu, larutan disaring. Endapan yang terbentuk kemudian disuspensikan dalam 150 mL methanol untuk proses presipitasi karboksimetil kitosan yang kemudian dinetralkan dengan asam asetat glacial lalu disaring. Residu dicuci secara berulang-ulang dengan etanol 80% dan dikeringkan pada suhu ruang sehingga diperoleh endapan karboksimetil kitosan yang diinginkan. Serbuk karboksimetil kitosan yang diperoleh dianalisa dengan menggunakan FT-IR.
4.4.2 Analisa Spektrum FT-IR
Instrumentasi FT-IR digunakan untuk memberikan informasi mengenai adanya perubahan gugus fungsi yang terbentuk pada suatu senyawa tertentu yang menandakan telah terjadi interaksi secara kimia. Hasil analisa spektrum infra merah dari kitosan dan karboksimetil kitosan dapat dilihat pada lampiran.
menunjukkan adanya ikatan ulur C=O dari gugus asetamida yang terdapat pada rantai utama kitosan sedangkan pada daerah 1597,06 cm-1 menunjukkan adanya gugus N-H yang mengalami deformasi angular dari gugus amino kitosan. Perbandingan spektrum FT-IR antara kitosan yang digunakan pada penelitian dengan standarnya dapat dilihat pada lampiran.
Hasil analisa spektrum infra merah untuk karboksimetil kitosan menunjukkan munculnya puncak serapan gugus fungsi baru diantaranya adalah puncak serapan pada dearah panjang gelombang 3448,72 cm-1 yang merupakan serapan dari vibrasi ulur O-H yang tumpang tindih dengan vibrasi ulur N-H. Pita serapan dari ikatan ulur C-H alifatis bergeser dari 2877,79 cm-1 menjadi 2924,09 cm-1. Pada daerah serapan 1411,89 cm-1 menunjukkan adanya gugus karboksimetil yang telah terbentuk pada rantai kitosan. Serapan pada daerah 1072,42 cm-1 menunjukkan adanya ikatan glikosida ( ulur C-O-C dan ulur C-O ) yang menunjukkan bahwa terbentuk ikatan eter yang mendukung bahwa reaksi karboksimetilasi telah terjadi.
Berdasarkan hasil analisis diatas maka dapat ditarik kesimpulan bahwa reaksi karboksimetilasi kitosan menjadi karboksimetil kitosan telah terjadi yang ditandai dengan munculnya puncak-puncak serapan yang khas untuk senyawa karboksimetil kitosan.
4.4.3 Penentuan Derajat Deasetilasi
Derajat deasetilasi kitosan dapat diukur dengan berbagai metode dan yang paling lazim digunakan adalah metode garis dasar spektroskopi IR Transformasi Fourier (FTIR) yang pertama kali digunakan oleh Moore dan Robert pada 1977.
Kitin yang terdeasetilasi sempurna (100%) menghasilkan nilai A1655 = 1,33.
Dengan diperolehnya perbandingan absorbansi antara bilangan gelombang 1655 cm-1 (serapan pita amida I) dan 3450 cm-1 (serapan gugus hidroksil), maka % DD kitosan dapat dihitung sebagai berikut :
%�� = − [�
Maka, derajat deasetilasi kitosan dan karboksimetil kitosan yang digunakan dalam penelitian ini dapat ditentukan dengan menggunakan rumus diatas.
Derajat deasetilasi kitosan
%�� = − [ ,
, × , ] × %
= − [ ,
, × , ] × %
= − , × %
= , %
Derajat deasetilasi karboksimetil kitosan
%�� = − [ ,, × , ] × %
= − [ ,, × , ] × %
= − , × %
= , %
4.4.4 Penentuan pH Optimum pada Proses Adsorpsi Ion Timbal (Pb2+) dengan menggunakan Karboksimetil Kitosan
Salah satu parameter yang sangat penting dalam proses adsorpsi ion logam adalah derajat keasaman atau pH larutan. Hal ini terjadi karena setiap logam yang terkandung dalam limbah membutuhkan kondisi penyerapan yang berbeda-beda. Pada penelitian ini, adsorben ion Pb2+ yang digunakan adalah serbuk karboksimetil kitosan yang telah lolos ayakan 100 mesh. Variasi pH pada proses adsorpsi adalah 2, 3, 4, 5 dan 6. Konsentrasi ion Pb2+ yang digunakan adalah 5 mg/L sebanyak 20 mL dengan massa adsorben 0,1 gram dan dengan waktu pengadukan selama 30 menit.
Penentuan kadar logam berat timbal (Pb2+) dalam larutan standar sebelum dan setelah penambahan karboksimetil kitosan untuk menentukan pH optimum penyerapan dilakukan dengan mengukur nilai absorbansi dan konsentrasi ion Pb2+ menggunakan alat Spektrofotometer Serapan Atom.
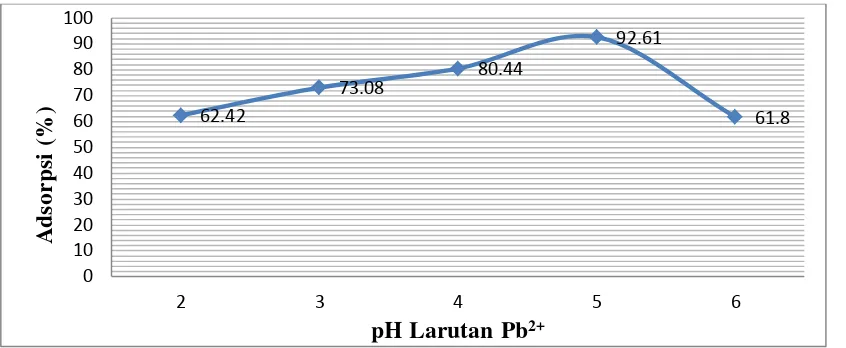
Gambar 4.2 Persen (%) Adsorpsi pada Variasi pH Larutan Pb2+
Berdasarkan gambar 4.2 diatas dapat kita lihat bahwa berawal dari pH 2, persen (%) adsorbsi ion Pb2+ terus mengalami kenaikan hingga mencapai titik optimum yaitu pada pH 5 dengan persen adsorbsi yang diperoleh sebesar 92,61%. Menurut Mc. Kay (1987) pH mempengaruhi daya adsorpsi dimana pH yang terlalu rendah akan mengurangi penyerapan ion logam ke dalam kitosan disebabkan terjadinya persaingan antara ion logam dengan H+ untuk menempati gugus amino bebas. Sedangkan pada pH 6, persen ion Pb2+ yang teradsorpsi mengalami penurunan yaitu sebesar 61,80%. Hal ini terjadi karena pada pH yang mendekati pH netral, ion-ion logam mengalami reaksi hidrolisis dalam larutan sehingga logam tersebut tidak stabil dalam bentuk ion logam semula dan kemampuan menyerap adsorben menjadi menurun.
Mekanisme yang terjadi adalah kitosan sebagai polimer kationik dapat mengikat logam Pb ataupun logam berat lainnya yang bertindak sebagai asam Lewis karena kitosan memiliki gugus fungsi amino (-NH2) sebagai basa Lewis yang sangat
reaktif dimana gugus amino tersebut akan berikatan dengan logam Pb membentuk ikatan kovalen. Karboksimetil kitosan adalah salah satu polimer organik yang paling cocok sebagai adsorben logam. Struktur kimianya yang fleksibel dan hidrofilik menyebabkan karboksimetil kitosan adalah zat yang tepat digunakan dalam mengkompleks logam. Gugus hidroksil sangat mudah terprotonasi dalam larutan asam menghasilkan gaya elektrostatik untuk menarik bagian yang bersifat anionik dari kompleks logam. Sedangkan gugus amino menyediakan sisi aktif untuk mengkelat
4.5 Reaksi
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan data yang diperoleh pada penelitian ini, maka dapat disimpulkan bahwa : 1. Karboksimetil kitosan dapat diperoleh dari kitosan yang berasal dari cangkang
belangkas (Tachypleus gigas) dengan cara mereaksikannya dengan asam monokloroasetat dan NaOH 40% dalam larutan 2-propanol pada suhu ruang yang dibuktikan dari hasil analisis spektrum FTIR dengan terbentuknya gugus fungsi karboksimetil pada bilangan gelombang 1411,89 cm-1.
2. pH optimum penyerapan karboksimetil kitosan terhadap ion Pb2+ terjadi pada pH = 5 dengan pengurangan konsentrasi ion Pb2+ sebanyak 4,6305 mg/L dari konsentrasi sebelumnya adalah 5 mg/L.
3. Karboksimetil kitosan mampu menurunkan kadar ion timbal sebanyak 92,61% pada pH = 5 dengan waktu kontak 30 menit. Hal ini membuktikan bahwa karboksimetil kitosan dapat dimanfaatkan sebagai adsorben untuk mengurangi kandungan logam berat terutama untuk logam Pb yang terdapat dalam larutan.
5.2 Saran
DAFTAR PUSTAKA
Achmad, R. 2004. Kimia Lingkungan. Penerbit ANDI. Yogyakarta.
Bailey, R. A. 1978. Chemistry of the Environment. Academic Press. New York. Basmal, J., Prasetyo A. dan Fawzya, Y. N. 2005. Pengaruh Konsentrasi Asam
Monokloroastetat dalam proses Karboksimetilasi terhadap Karboksimetil kitosan yang dihasilkan. Jurnal Penelitian Perikanan Indonesia. Vol. 11. Chen X., Jiahao L., Zhicheng F., Zhengzhong S. 2005. Macroporous
chitosan/carboxymethylcelluloce Blend Membranes and Their Application for Lysozyme Adsorption. J App Polym Sci 96:1267-1274.
Chiu SH., Chung TW., Giridhar R., Wu WT. 2004. Immobilization of β-cyclodextrin
in Chitosan Beads for Separation of Cholesterol from Egg Yolk. Food Res Int
37:217-223.
Cravotto, G., Taghapieta, S., Robaldo, B., Trotta, M. 2005. Ultrasonic Sonochemistry. 12. 95.
Darmono. 1995. Logam dalam Sistem Biologi Makhluk Hidup. UI Press. Jakarta. Day, R. A, dan Underwood. 2002. Analisis Kimia Kuantitatif. Edisi Keenam. Penerbit
Erlangga. Jakarta.
Denas, G. dan Sanza, I. 2000. Synthesis and Characterization of Chitosan-PHP Blends.
Effendi, H. 2000. Telaah Kualitas Air. IPB Press. Bogor.
Hu ZG., Zhang J., Chan WL., Szeto YS. 2006. The Sorption of Acid Dye onto Chitosan Nanoparticles. Polym47:5838-5842.
Jayakumar, R., M. Prabaharanb, S.V. Naira, S. Tokurac, H. Tamurac, N. Selvamurugand. 2010. Novel Carboxymethyl Derivatives of Chitin and Chitosan Materials and Their Biomedical Applications. Progress in Materials Science 55 (7): 675–709.
Kurniasih M., Kartika D., Riyanti. 2012. Sintesis dan Karakterisasi Karboksimetil Kitosan. Prosiding Seminar Nasional : 125-132.
Liu J., Xin C., Zhengzhong S., Ping Z. 2003. Preparation and Characterization of Chitosan/Cu(II) Affinity Membrane for Urea Adsorption. J App Polym Sci
90:1108-1112.
Mc Cabe W., Julian S., Harricot P. 1999. Operasi Teknik Kimia. Jilid 2. Erlangga. Jakarta.
Mourya, V., Inamdar N., Tiwari A. 2010. Carboxymethyl Chitosan and It’s
Applications. Review Article. Vol 1.
Mulja, M. 1995. Analisis Instrumental. Airlangga University Press. Surabaya. Muzzarelli R. A. 1977. Chitin. Pergamon Press. New York.
Naria, E. 2005. Mewaspadai Dampak Bahan Pencemar Timbal (Pb) di Lingkungan Terhadap Kesehatan. Jurnal Komunikasi Penelitian. Vol. 17. No. 4.
Patale, R. L. dan Patravale V. B. 2011. O,N-Carboxymethyl Chitosan–Zinc Complex: A Novel Chitosan Complex with Enhanced Antimicrobial Activity. Carbohydrate Polymers 85: 105–110.
Pavia, D. L. 2001. Introduction to Spectroscopy. Third Edition. Thompson Learning, Inc.
Rha. C. 1984. Chitosan as Biomaterial. John Wiley and Sons. New York. Rohman, A. 2007. Kimia Farmasi Analisis. Yogyakarta. Pustaka Pelajar.
Sugita, P., Wukirsari, T., Sjahriza A., Wahyono D. 2009. Kitosan Sumber Biomaterial Masa Depan. IPB Press. Bogor.
Tokura, S., Nishi N., Tsutsumi A., and Somorin, O. 1983. Studies on Chitin VIII. Some Properties of Water Soluble Chitin Derivative. Polymer Journal. 15. 485-498.
Vogel, A.I. 1994. Buku Teks Anorganik Kualitatif Makro dan Semimikro. Edisi Kelima. PT Kalman Media Pustaka. Jakarta.
Waite, T.D. 1984. Principles of Water Quality. Academic Press, Inc. Orlando.
Widodo, Agus, Mardiah dan Praseto, A. 2005. Potensi Kitosan dari Sisa Udang sebagai Koagulan Logam Berat Limbah Cair Industri Tekstil. Surabaya: ITS. Widowati, W., Sastiono, A., dan Jusuf, R. 2008. Efek Toksik Logam Pencegahan dan
Penanggulangan Pencemaran. Penerbit Andi. Yogyakarta.
Lampiran 1. Serbuk Karboksimetil Kitosan yang diperoleh dari penelitian
Lampiran 2. Perbandingan Spektrum FT-IR Kitosan yang digunakan dalam
penelitian dengan Standarnya
Gugus terkait Kitosan Standar (cm-!) Kitosan Ulur –OH 3446 3425,58
Ulur C-H 2916 2877,79
Ulur C-O 1650 1658,78
Tekuk N-H 1591 1597,06 Tekuk C-H 1380 1381,03 Ulur C-N 1312,50 1319,31
Ulur C-O 1089 1080,14
Lampiran 4. Spektrum FT-IR Karboksimetil Kitosan yang diperoleh dari
Lampiran 5. Data Hasil Pengukuran Absorbansi Larutan Seri Standar Pb dengan Spektrofotometer Serapan Atom pada λspesifik = 283,3 nm
No Konsentrasi A1 A2 A3 A
1 0,0 0,0000 0,0000 0,0000 0,0000 2 0,2 0,0047 0,0045 0,0046 0,0046 3 0,4 0,0084 0,0087 0,0085 0,0085 4 0,6 0,0125 0,0128 0,0125 0,0126 5 0,8 0,0163 0,0164 0,0168 0,0165 6 1,0 0,0206 0,0201 0,0203 0,0203
Lampiran 6. Data Persen (%) Adsorpsi pada Penentuan pH Optimum
menggunakan Karboksimetil Kitosan
No pH Larutan Konsentrasi Akhir (mg/L)
Absorbansi Rata-Rata
Lampiran 7. Spektrofotometer Serapan Atom Merk Shimadzu tipe AA-7000-F
dan Kondisi Alatnya
Element Timbal (Pb)
Lampu / Current Hallow cathode lamp / 12 mA Panjang gelombang Pb = 283,3
Slit 0,7 nm (low) Atomisation site Pyro / platform Tipe pengukuran Area grafik
Tipe signal Atomic absorption – Background absorption Waktu integrasi 4 menit
Waktu koreksi grafik 2 menit Volume sampel 20 µl Temperatur inject 20 0C
Tekanan gas Asetilen 3.6 bar atau 52 psig atau 360 kPa Kecepatan alir gas Asetilen 300 ml/min