ABSTRAK
KARAKTERISASI PROFIL PERTUMBUHAN DAN PRODUKSI ENZIM CGT-ASE (SIKLODEKSTRIN GLUKANOTRANSFERASE)
DARI ISOLAT P-2-2
Oleh
Adetia Fatmawati
Siklodekstrin telah digunakan secara luas di berbagai industri. Siklodekstrin digunakan sebagai bahan enkapsulasi, stabilisator oksidasi, bahan pengompleks dan lain-lain. Siklodekstrin diproduksi oleh enzim CGT-ase mikrobial. Eksplorasi mikroorganisme penghasil enzim CGT-ase penting dilakukan dalam upaya produksi siklodekstrin. Pada penelitian ini satu bakteri isolat P-2-2 telah diisolasi dari sampel limbah singkong asal Pesawaran, berdasarkan kemampuan membentuk zona bening pada sekitar koloninya. Isolat P-2-2 dipilih dari 15 isolat kandidat yang diperoleh. Pertumbuhan sel, waktu inkubasi optimum, dan aktivitas CGT-ase dari isolat P-2-2 dibandingkan dengan isolat LTi-3-A2 dan LTi-21-3 hasil isolasi pada penelitian sebelumnya. Pertumbuhan isolat P-2-2 berada diantara 2 isolat pembanding, yang ditunjukkan dengan nilai OD600 berturut- turut yaitu 7.83, 10.82, dan 5.74. Waktu inkubasi optimum isolat P-2-2 lebih lama (42 jam) dari 2 isolat pembanding (36 jam). Aktivitas CGT-ase isolat P-2-2 (343.21 U/ml) lebih kecil dari isolat LTi-3-A2 (416.31 U/ml) namun lebih besar dari isolat LTi-21-3 (307.62 U/ml). Morfologi isolat P-2-2 berbentuk batang pendek dan merupakan bakteri gram negatif. Hasil uji statistika ANOVA menunjukkan data pertumbuhan sel, aktivitas unit, dan aktivitas spesifik dari ketiga isolat berbeda signifikan (sig<0.05) berdasarkan waktu inkubasi dan jenis isolat. Untuk mengetahui perbedaan jenis spesies ketiga isolat bakteri pada level genetik disarankan untuk melakukan analisis lebih lanjut seperti 16S rDNA.
ABSTRACT
PROFILE OF GROWTH AND CGT-ASE (CYCLODEXTRIN GLUCANOTRANSFERASE) PRODUCTIONS
FROM ISOLATE P-2-2
By
Adetia Fatmawati
Cyclodextrins have been widely used in various industries. Cyclodextrins are used as encapsulation ingredients, oxidation stabilizators, complex materials and others. Cyclodextrins can be produced by microbial CGT-ase. Exploration of microorganisms-producing CGT-ase is important efforts for cyclodextrins production. Bacterial P-2-2 was isolated from the cassava waste of Pesawaran area, based on it’s ability to form halozone on solid medium. Isolate P-2-2 was selected among 15 candidate isolates. Cell growth, optimum incubation time, and activity of CGT-ase from isolate P-2-2 were compared with 2 reference isolates i.e. LTi-3-A2 and LTi-21-3 which isolated in previous work. Growth of isolates P-2-2 is between 2 reference isolates, which is indicated by the value of OD600 i.e. 7.83, 10.82, and 5.74. Optimum incubation time of isolate P-2-2 is longer (42 hours) than 2 reference isolates (both for 36 hours). CGT-ase activity of isolate P-2-2 (343.21 U/ml) is smaller than LTi-3-A2 (416.31 U/ml) but larger than LTi-21-3 (307.62 U/ml). Morphological determination showed that isolate P-2-2 was rod shaped and gram-negative. The result of statistical ANOVA test showed that data of cell growth, unit activity, and specific activity of these isolates significantly different (sig<0.05) based on time of incubation and types of isolates. In order for knowing the difference of these species on it’s genetic level, it is advised to perform further analysis such as 16S rDNA.
RIWAYAT HIDUP
Penulis dilahirkan di Gedong Tataan, Pesawaran pada tanggal 25 April 1994, sebagai anak kelima dari lima bersaudara, putri dari Adnan M. Nur dan Sarmunah, S.Pd.
Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SD Negeri 3 Bagelen Gedong Tataan diselesaikan pada tahun 2005. Sekolah Menengah Pertama (SMP) di SMP Negeri 1 Gedong Tataan diselesaikan pada tahun 2008, dan Sekolah Menengah Atas (SMA) di SMA Negeri 1 Gadingrejo Pringsewu diselesaikan pada tahun 2010. Tahun 2010, penulis terdaftar sebagai Mahasiswa Jurusan Kimia FMIPA Unila melalui jalur PKAB (Penelusuran Kemampuan Akademik dan Bakat).
PERSEMBAHAN
Kupersembahkan karya sederhana ini kepada :
Ayahanda Adnan M. Nur dan Ibunda Sarmunah, S.Pd. tercinta dan tersayang,
Kakak-Kakakku tersayang
Ade Novirina, S.Kep., Syahrial Rozadi, Ade Septriani, S.Pd. dan Ade Nurmalia
Segenap Keluarga besarku yang selalu mendoakan keberhasilanku,
Sahabat dan teman-temanku yang selalu berbagi kebahagiaan,
Seseorang yang kelak akan mendampingiku,
Moto
Maka apabila kamu telah selesai (dari suatu urusan), kerjakanlah dengan sungguh- sungguh (urusan yang lain). Dan hanya kepada Tuhanmulah hendaknya kamu
berharap.
(QS. Asy- syarh : 7-8)
Entah akan berkarir atau menjadi ibu rumah tangga, seorang wanita wajib berpendidikan tinggi karena ia akan menjadi ibu. Ibu-ibu cerdas akan menghasilkan
anak-anak cerdas. (Dian Sastrowardoyo)
Jadilah sebagaimana engkau ingin menjadi, bukan sebagaimana yang ingin mereka lihat.
(Mario Teguh)
Mimpimu harus lebih besar dari dirimu sendiri. (Adetia Fatmawati)
Succes is from Allah alone. So, go towards Allah and Allah will bring you closer to success.
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah puji dan syukur Penulis ucapkan atas kehadirat Allah SWT, karena atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul "Karakterisasi Profil Pertumbuhan dan Produksi Enzim CGT-ase (Siklodekstrin Glukanotransferase) dari Isolat P-2-2" adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir dikehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih setulus-tulusnya kepada :
2. Bapak Prof. Dr. Ir. Yandri A.S., M.S., selaku pembahas pertama yang telah memberikan kritik, saran, arahan yang diberikan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Ibu Dra. Aspita Laila, M.S., selaku pembahas kedua yang telah memberikan semangat, kritik, saran dan arahan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
4. Ibu Niluh Gede Ratna Juliasih, M.Si., Bapak Heri Satria, M.Si., dan Ibu Dr. Noviany, M.Si. selaku Pembimbing Akademik atas kesediaannya utuk memberikan bimbingan, bantuan, nasehat dan informasi yang bermanfaat kepada penulis.
5. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang sangat berguna kepada penulis selama kuliah.
6. Bapak Dr. Eng. Suripto Dwi Yuwono, selaku ketua Jurusan Kimia FMIPA Unila.
7. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
serta pengorbanan dan perjuangan yang tak kenal lelah untuk keberhasilanku. Terima kasih dengan sangat tulus dan ikhlas kuucapkan atas segala hal terbaik dan semua yang telah diberikan kepadaku yang takkan bisa aku ganti dengan apapun.
9. Keempat kakakku tersayang, Ade Novirina, S.Kep., Syahrial Rozadi, Ade Septriani, S.Pd., dan Ade Nurmalia, terima kasih atas kebahagiaan, kebersamaan, motivasi, keceriaan dan canda tawa yang tercipta selama ini. Kehadiran kalian adalah hal yang tak ternilai harganya dalam hidupku.
10. Keluarga besarku yang selalu memberikan motivasi, dukungan dan doa untuk keberhasilanku.
11. Sahabat-sahabat terbaikku: Rani Anggraeni, Desi meriyanti, Wynda Dwi Anggraini, Ariyanti, terima kasih atas persahabatan terhebat, segala dukungan, kebahagiaan, kesedihan, kasih sayang, rasa kebersamaan, keceriaan dan canda tawa yang selalu hadir disetiap hari-hari kita, aku sangat bersyukur dan bangga mengenal kalian, semoga Allah selalu memberikan rahmat-Nya untuk keberhasilan kita.
Hapin Afriyani, S.Si., Kristi Arina, Martha Selvina Gultom, S.Si., Rini Handayani, S.Si., Funda elisyia, S.Si., Leni Astuti, S.Si., Faradilla Syani, S.Si., dan Maria Anggraini terima kasih untuk kebersamaan dan keceriaan selama menjalankan perkuliahan, tetap semangat dan jangan menyerah, perjuangan kita masih panjang, sukses selalu untuk kita.
13. Kakak tingkat, Teman, dan Adik Tingkat seperjuangan di Laboratorium Biokimia : Mbak Putri Amalia, S.Si., Mbak Hade Sastra Wiyana, S.Si., Mbak Tyas Rosawinda Khairunnisa, S.Si., Mbak Miftahul Jannah, S.Si., Mbak Fatma Timur Iftiqoriyyah, S.Si., Mbak Fitriyanti, S.Si., Mbak Karlina Widiyanti, S.Si. (makasi mbak atas arahannya dan menjadi tempat bertanya), Ariyanti, Rani, Rina, Desi, Wynda, Hapin, Ayay, Ajeng, Aziz, Pandegani, April, Uswa, Ana, terima kasih atas kebersamaannya di Laboratorium tercinta, tetap semangat dan terus berjuang.
14. Teman-teman Kimia angkatan 2008, 2009, 2011, 2012, 2013 dan 2014 FMIPA Unila terima kasih atas segala dukungannya.
15. Induk semang Kuliah Kerja Nyata (KKN) (Alm. Bpk. Ustad Gus Wahid dan Ibu), Bapak dan Ibu Kepala Kampung, warga Kampung Penumangan Kec. Tulang Bawang Tengah Kab. Tulang Bawang Barat serta teman- teman satu kelompok : M. Kiki, Sonia Anggun Andini, S.E., Radi Birdayansyah, Fenny Sagita, Debora Septania Purba, Galih Prasiwanto, Sari Elviani, dan Dayu Eka Irawan.
Erlangga, Andika Septiana Suryaningsih, Mediska Arta Pramesti, S.Ked., Raeni Wulan Permata, S.Ked., Retno Anggraeni, S.Pt., Abimanyu Nur M.S., S.Ked., Dilla Fitria, S.Pd., Marisya Fitriyani, S.AG., Meyliana Astriyantika, S.Hut., Ratya Hapsari, Ade Anggraini K.D., S.Pd., dan Viska Nurisma. 17. Teman- teman sejawat : Bebi Teta Dertini salawangi, Firda Septia, Yulina
Anggraini, Ayu Andika Putri, Ayu Diah Novita, Mutiara Mustika, A.md., dan teman- teman lain yang tidak dapat disebutkan satu persatu.
18. Seseorang yang selalu menjadi semangat dan motivator dalam menjalankan hidupku. Terima kasih.
19. Semua pihak yang telah membantu dan mendukung penulis dalam penyusunan skripsi ini.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Bandar Lampung, 10 Desember 2014 Penulis
iii
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
A. Mikroorganisme ... 4
B. Bakteri ... 5
1. Dinding Sel Bakteri ... 6
2. Nutrien untuk Pertumbuhan Bakteri ... 7
3. Fase Pertumbuhan Bakteri ... 8
C. Pati ... 9
D. Enzim ... 11
E. Enzim CGT-ase ... 13
F. Siklodekstrin ... 14
G. ANOVA (Analysis of Variance) ... 18
1. Uji Masing- Masing Faktor ... 19
2. Uji Interaksi Antar Faktor ... 19
III. METODOLOGI PENELITIAN ... 21
A. Waktu dan Tempat Penelitian ... 21
B. Alat dan Bahan ... 21
C. Prosedur Penelitian ... 22
1. Tahap Persiapan ... 22
a. Persiapan alat ... 22
b. Pembuatan Medium Padat Horikoshi’s II ... 22
2. Isolasi Bakteri Amilolitik ... 23
3. Peremajaan Bakteri Amilolitik ... 24
4. Pembuatan Medium Cair untuk Kultur ... 24
5. Pembuatan Pereaksi ... 25
iv
b. Pereaksi Lowry ... 25
6. Produksi Enzim CGT-ase ... 25
7. Penentuan Pertumbuhan Sel ... 26
8. Uji Aktivitas Enzim CGT-ase... 26
9. Uji Kadar Protein Enzim CGT-ase ... 27
10.Uji Morfologi Isolat ... 27
11.Uji Statistika Anova ... 28
D. Diagram Alir Prosedur Penelitian ... 29
IV. HASIL DAN PEMBAHASAN ... 30
A. Isolat Amilolitik P-2-2 ... 30
B. Perbandingan Diameter Halozone Isolat P-2-2 dengan Isolat LTi-3-A24 ... 33
C. Profil Pertumbuhan dan Produksi Enzim CGT-ase ... 35
D. Morfologi Isolat P-2-2 ... 41
E. Uji Statistika ANOVA (Analysis of Variance) ... 42
1. Penentuan Hipotesis ... 42
2. Penentuan Kriteria Pengambilan Keputusan... 43
3. Penentuan Tingkat Kepercayaan ... 43
4. Statistika Uji ... 44
5. Interpretasi ... 45
6. Uji Post Hoc (Pasca ANOVA) ... 45
V. SIMPULAN DAN SARAN ... 47
A. Simpulan ... 47
B. Saran ... 48
DAFTAR PUSTAKA ... 49
iii
DAFTAR TABEL
Tabel Halaman
1. Sifat-sifat siklodekstrin ... 15
2. Jenis siklodekstrin utama yang dihasilkan berdasarkan asal enzim CGT-ase yang digunakan ... 17 3. Isolat bakteri hasil isolasi dari limbah singkong ... 30 4. Diameter koloni dan halozone isolat kandidat dari limbah singkong
skrining ke-2 sampel Pesawaran ... 31 5. Diameter koloni dan halozone isolat kandidat dari limbah singkong
skrining ke-3 sampel Lampung Timur ... 31 6. Diameter koloni dan halozone koloni tunggal dari skrining ke-2
sampel Pesawaran ... 32 7. Diameter koloni dan halozone koloni tunggal dari skrining ke-3
sampel Lampung Timur ... 32 8. Diameter koloni dan halozone isolat P-2-2 dan isolat LTi-3-A2 ... 34 9. Pertumbuhan sel, aktivitas unit, kadar protein, dan aktivitas spesifik
dari isolat P-2-2 LTi-3-A2, dan LTi-21-3 ... 39 10.Hasil ANOVA pertumbuhan sel dengan waktu sampling setiap
iv
12.Hasil ANOVA aktivitas spesifik dengan waktu sampling setiap
6 jam ... 44
13.Absorbansi BSA pada berbagai konsentrasi untuk menentukan kurva standar protein ... 54
14.%OD Decrease β-Siklodekstrin pada berbagai konsentrasi untuk menentukan kurva standar β-Siklodekstrin ... 55
15.Data deskriptif statistik pertumbuhan sel dengan waktu sampling setiap 6 jam ... 57
16.Data deskriptif statistik aktivitas unit dengan waktu sampling setiap 6 jam ... 58
17.Data deskriptif statistik aktivitas spesifik dengan waktu sampling setiap 6 jam ... 59
18.Hasil Post Hoc pertumbuhan sel faktor waktu inkubasi ... 61
19.Hasil Post Hoc pertumbuhan sel faktor jenis isolat ... 64
20.Hasil Post Hoc aktivitas unit faktor waktu inkubasi ... 65
21.Hasil Post Hoc aktivitas unit faktor jenis isolat ... 68
22.Hasil Post Hoc aktivitas spesifik faktor waktu inkubasi ... 69
v
DAFTAR GAMBAR
Gambar Halaman
1. Kurva Pertumbuhan Bakteri, (a) fase lag, (b) fase log, (c) fase
stasioner,(d) fase kematian ... 9
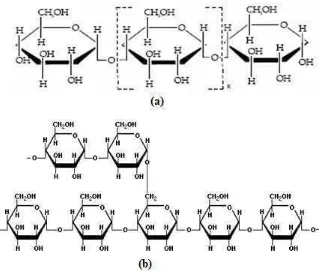
2. Struktur(a) amilosa dan (b) amilopektin ... 11
3. Struktur α-, β- dan -siklodekstrin ... 15
4. Diagram alir prosedur penelitian ... 29
5. Diameter koloni dan halozone isolat P-2-2 (a) Hari ke-1, (b) Hari ke-2, (c) Hari ke-3 ... 34
6. Diameter koloni dan halozone isolat LTi-A2 (a) Hari ke-1, (b) Hari ke-2, (c) Hari ke-3 ... 35
7. Profil pertumbuhan isolat P-2-2, LTi-A2, dan LTi-21-3 dengan Waktu sampling setiap 6 jam ... 36
8. Profil produksi enzim CGT-ase isolat P-2-2, LTi-A2, dan LTi-21-3 dengan waktu sampling setiap 6 jam ... 38
9. Morfologi isolat P-2-2 setelah pewarnaan gram ... 41
10.Morfologi isolat (a) LTi-3-A2 (b) LTi-21-3, setelah pewarnaan gram... 42
11.Kurva standar BSA ... 54
1
I. PENDAHULUAN
A.Latar Belakang
Penggunaan siklodekstrin telah dilakukan di berbagai industri. Pada Industri pangan, siklodekstrin digunakan sebagai bahan enkapsulasi untuk bahan yang beraroma, vitamin C, dan pewarna alami. Pada industri kosmetika, siklodekstrin digunakan untuk meningkatkan stabilitas minyak parfum terhadap oksidasi dan bau. Sedangkan pada industri farmasi, siklodekstrin digunakan sebagai bahan pengkomplek dengan vitamin A, E dan K agar stabil terhadap oksidasi. Selain itu, siklodekstrin digunakan di industri untuk memodifikasi aktivitas kimiawi suatu molekul dengan proteksi suatu gugus tertentu, sebagai penstabil emulsi, menutup bau dan rasa dari bahan makanan serta dapat mengurangi kadar kolesterol dan efek toksisitas suatu senyawa (Dziezak, 1988).
Bakteri amilolitik merupakan mikroorganisme yang mampu memecah pati menjadi senyawa yang lebih sederhana. Kebanyakan mikroorganisme amilolitik tumbuh subur pada bahan pangan yang banyak mengandung pati atau karbohidrat, misalnya pada berbagai jenis tepung. Bakteri amilolitik penghasil CGT-ase
2
1992). Beberapa spesies bakteri terutama Paenibacillus macerans (dahulu Bacillus macerans) (Kitahata et al., 1974), Bacillus circulans (Pongsawadi and
Yagiswa, 1987), Bacillus megaterium, Klebsiella sp ( Lee et al., 1992), serta species Bacillus alkalofilik (Nakamura and Horikoshi, 1976) diketahui sebagai penghasil enzim CGT-ase yang potensial.
CGT-ase dapat melakukan beberapa reaksi pada molekul pati sebagai substrat. CGT-ase selain dapat mengkatalisis reaksi transglikosilasi intramolekuler (siklisasi) dan reaksi transglikosilasi intermolekuler, CGT-ase juga mempunyai aktivitas hidrolisis pada molekul pati (Tonkova, l998). Oleh karena itu,
penggalian mikroorganisme penghasil CGT-ase penting dilakukan di Indonesia. Keragaman hayati yang tinggi memberikan peluang yang besar untuk
mendapatkan mikroorganisme yang potensial untuk dikembangkan sebagai penghasil enzim.
3
B.Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Mengetahui karakteristik profil pertumbuhan dan produksi enzim CGT-ase dari isolat bakteri P-2-2 hasil isolasi dari limbah singkong.
2. Mengidentifikasi morfologi dari isolat bakteri P-2-2.
3. Menganalisis perbandingan data pertumbuhan dan aktivitas enzim dari isolat P-2-2 dengan isolat LTi-3-A2 dan LTi-21-3 secara statistika.
C.Manfaat Penelitian
4
II. TINJAUAN PUSTAKA
A.Mikroorganisme
Mikroorganisme terdapat di berbagai habitat. Mereka terdapat pada tubuh kita, di dalam tubuh kita, dan di sekeliling kita. Mikroorganisme juga dapat diperoleh dari lingkungan air, tanah, udara, substrat yang berupa bahan pangan, tanaman dan hewan (Ferdiaz, 1992). Mereka merupakan komponen penting dalam ekosistem. Pada habitat alaminya, mereka hidup dalam suatu komunitas yang terdiri dari berbagai jenis mikroorganisme, bersama spesies-spesies biologi lainnya. Pada komunitas ini, satu spesies mikroba dapat mempengaruhi spesies lain, beberapa spesies dapat bersifat menguntungkan dan beberapa spesies dapat bersifat merugikan (Pelczar et al., 1988).
5
Mikroorganisme adalah sumber yang potensial sebagai bahan baku untuk produksi enzim. Hal ini disebabkan karena beberapa faktor yaitu: ekonomis, karena dapat dihasilkan dalam waktu yang cukup pendek dan media yang cukup murah, kondisi reaksi seperti pH dan temperatur mudah diatur, dan peningkatan produksi enzimnya dapat dikondisikan dengan cara penambahan induser tertentu (Wang et al., 1979).
B.Bakteri
Bakteri adalah organisme bersel satu yang terlalu kecil untuk dapat dilihat kecuali dengan bantuan mikroskop, dengan struktur sel yang relatif sederhana tanpa nukleus/inti sel, sitoskeleton, dan organel lain seperti mitokondria dan kloroplas. Mereka berukuran micron (1/1000 mm). Seperti juga makhluk hidup lain, bakteri membutuhkan makanan, air dan suhu yang sesuai untuk hidup dan berkembang biak. Untuk mendapatkan bakteri yang potensial dilakukan dengan penapisan mikroorganisme dari lingkungan (Dwijoseputro, 1986).
6
1. Dinding Sel Bakteri
Bakteri dibedakan atas dua kelompok berdasarkan komposisi dinding sel serta sifat pewarnaannya, yaitu bakteri gram positif dan bakteri gram negatif. Bakteri gram positif dinding selnya mengandung sebagian besar peptidoglikan, dan juga asam terikoat dan asam terikuronat, oleh sebab itu dinding sel bakteri positif sebagian adalah polisakarida. Pada beberapa bakteri asam terikoat merupakan antigen permukaan (antigen dinding sel) dan ada yang merupakan selaput pada selnya. Asam terikoat ini pada umumnya terdiri dari gula netral seperti galaktosa, manosa, ramnosa, arabinosa dan glukosamin. Lapisan yang demikian itu akan menyelimuti seluruh sel bakteri sehingga menyerupai selibung yang kuat dan dinamakan murein/ peptidoglikan. Sedangkan pada bakteri gram negatif terdapat peptidoglikan yang sedikit sekali dan berada diantara selaput luar dan selaput dalam dinding sel. Dinding sel bakteri gram negatif sebelah luar merupakan komponen yang terdiri dari fospolipid dan beberapa protein yang sering disebut sebagai auto layer (Klein et al., 1999).
7
merupakan 20% - 30% berat kering sel bakteri. Antigen dinding sel bakteri gram negatif bekerja sebagai indotoksin. Sintesis dinding sel dapat dihambat atau diganggu oleh berbagai faktor. Enzim lisozim pada berbagai macam cairan jaringan dapat menyebabkan lisis bakteri. Enzim lisozim bekerja dengan memecah ikatan mukopetida dinding sel, jika lisozim bekerja terhadap bakteri gram positif dalam lingkungan larutan hipertonik terjadilah bentuk protoplas yang terdiri dari membran sitoplasma dan isinya. Jika terjadi pada bakteri gram negatif hasilnya adalah sferoplas (Dwijoseputro, 1986).
2. Nutrien untuk Pertumbuhan Bakteri
Mikroorganisme tumbuh pada medium yang mengandung nutrisi. Nutrien untuk pertumbuhan bakteri mengandung substansi kimia organik atau anorganik. Substansi kimia organik dan anorganik diperoleh dari lingkungan dalam berbagai macam bentuk. Nutrien diambil dari lingkungan kemudian ditransformasikan melalui membran plasma menuju sel. Di sel beberapa nutrisi diolah menghasilkan energi yang digunakan dalam proses seluler. Mikroba yang tumbuh, misalnya pada makanan umumnya bersifat heterotrof, yakni menggunakan karbohidrat sebagai sumber energi dan karbon, walaupun komponen organik lainnya yang mengandung karbon mungkin juga dapat digunakan. Kebanyakan organisme heterotrof menggunakan komponen organik yang mengandung protein sebagai sumber N, tetapi beberapa mikroba dapat pula menggunakan sumber nitrogen anorganik. Oleh karena itu, beberapa organisme heterotrof yang tidak dapat atau kehilangan kemampuan untuk mensintesis berbagai komponen organik,
8
Ada dua macam mikronutrien yakni mikronutrien organik dan mikronutrien anorganik. Zat-zat yang bertindak sebagai mikronutrien organik yaitu beberapa asam amino (triptofan) dan pada beberapa komponen DNA dan RNA (purin dan pirimidin). Beberapa unsur logam yang termasuk dalam mikronutrien anorganik adalah Co, Mo, Cu, Zn. Unsur logam ini sangat diperlukan untuk kehidupan sel meskipun jumlahnya sangat sedikit. Ada tujuh komponen utama yang dibutuhkan semua makhluk hidup, yaitu karbon, oksigen, nitrogen, hidrogen, fosfor, sulfur, dan kalium. Untuk kebutuhan akan sumber karbon dipenuhi oleh adanya gula, pati, serta karbohidrat lainnya (Irianto, 2006).
3. Fase Pertumbuhan Bakteri
Fase pertumbuhan bakteri dapat dibagi menjadi 4 fase, yaitu fase lag, fase logaritma (eksponensial), fase stasioner, dan fase kematian. Fase lag merupakan fase penyesuaian bakteri dengan lingkungan yang baru. Lama fase lag pada bakteri sangat bervariasi, tergantung pada komposisi media, pH, suhu, aerasi, jumlah sel pada inokulum awal dan sifat fisiologis mikroorganisme pada media sebelumnya. Fase eksponensial ditandai dengan terjadinya periode pertumbuhan yang cepat.Variasi derajat pertumbuhan bakteri pada fase eksponensial ini sangat dipengaruhi oleh sifat genetik yang diturunkannya. Selain itu, derajat
9
Fase stasioner merupakan saat laju pertumbuhan bakteri sama dengan laju kematiannya, sehingga jumlah bakteri keseluruhan akan tetap. Keseimbangan jumlah keseluruhan bakteri ini terjadi karena adanya pengurangan derajat
pembelahan sel. Hal ini disebabkan oleh kadar nutrisi yang berkurang dan terjadi akumulasi produk toksik sehingga mengganggu pembelahan sel. Fase stasioner ini dilanjutkan dengan fase kematian yang ditandai dengan peningkatan laju kematian yang melampaui laju pertumbuhan (Volk and Wheeler, 1993). Gambaran fase- fase pertumbuhan bakteri dapat dilihat pada Gambar 1.
Gambar 1. Kurva pertumbuhan bakteri, (a) fase lag, (b) fase log, (c) fase stasioner, (d) fase kematian (Crueger,1984).
C.Pati
10
fraksi tidak larut disebut amilopektin (Winarno, 1986). Pada umumnya pati terdapat sebagai butiran yang dapat berwujud bola, lensa atau telur dan
11
Gambar 2. Struktur (a) amilosa dan (b) amilopektin
Pati telah lama digunakan sebagai bahan makanan maupun non-food seperti perekat dalam industri tekstil, polimer, atau sebagai bahan tambahan dalam sediaan farmasi. Penggunaan pati dalam bidang farmasi sebagai formula sediaan tablet, baik sebagai bahan pengisi, penghancur maupun sebagai bahan pengikat. Pati hasil isolasi yang sudah murni berupa padatan putih, amorf, relatif tidak mempunyai rasa dan bau serta tidak larut dalam air panas (Winarno, 1986).
D. Enzim
12
Menurut Page (1997), sebagai katalis, enzim lebih baik dibanding dengan katalis anorganik atau organik sederhana. Sifat-sifat katalitik dari enzim yaitu termasuk hal-hal berikut:
1. Enzim meningkatkan laju reaksi pada kondisi biasa (fisiologik) dari tekanan, suhu, dan pH. Hal ini merupakan keadaan yang jarang dengan katalis-katalis lain.
2. Enzim berfungsi dengan selektivitas dan spesifisitas bertingkat luar biasa tinggi terhadap reaktan yang dikerjakan dan jenis reaksi yang dikatalisasikan.
3. Enzim memberikan peningkatan laju reaksi yang luar biasa dibanding dengan katalis biasa.
Peranan enzim sebagai biokatalisator dalam industri semakin meningkat seiring dengan pesatnya perkembangan industri, khususnya industri makanan, minuman, industri tekstil, industri kulit dan industri kertas. Hal ini disebabkan karena enzim bersifat sangat spesifik dibandingkan dengan katalis anorganik. Selain itu, enzim bekerja sangat efisien, bekerja pada pH yang relatif netral, dan suhu yang relatif rendah, aman, mudah dikontrol, dapat menggantikan bahan kimia yang berbahaya, dan dapat didegradasi secara biologis (Page, 1997).
Klasifikasi enzim secara internasional berdasarkan atas reaksi yang dikatalisisnya yaitu :
13
2. Transferase, mengkatalisis berbagai jenis transfer kelompok seperti amino transferase, karnitin asil transferase, dan transkarboksilase.
3. Hidrolase, mengkatalisis pemecahan ikatan antara karbon dan beberapa atom lain dengan adanya penambahan air.
4. Liase, mengkatalisis pemecahan ikatan karbon-karbon, karbon sulfur dan karbon nitrogen tertentu.
5. Isomerase, mengkatalisis isomer optik dan geometrik dan oksidasi reduksi intramolekuler tertentu.
6. Ligase, mengkatalisis pembentukan ikatan antara karbon dan oksigen (Lehninger, 1997).
Semua enzim adalah protein dan aktivitas katalitiknya bergantung kepada integritas strukturnya sebagai protein. Enzim seperti protein lain, mempunyai berat molekul berkisar dari kira-kira 12.000 sampai 1 juta. Oleh karena itu, enzim berukuran sangat besar dibandingkan dengan substrat atau gugus fungsional targetnya. Penataan tertentu pada rantai samping asam amino suatu enzim di sisi aktifnya menentukan tipe molekul yang dapat terikat dan bereaksi. Biasanya ada sekitar lima rantai samping tersebut dalam enzim apapun. Selain itu, sebagian besar enzim memiliki molekul-molekul nonprotein kecil yang terhubung dengan sisi aktif atau didekatnya. Molekul-molekul enzim ini disebut kofaktor atau koenzim (Ngili, 2009).
E.Enzim CGT-ase
-14
amilase (Leemhuis et al., 2003). CGT-ase memiliki berat molekul yang bervariasi dari 60-110 kDa dan terdiri dari 700 asam amino. Sebagian memerlukan kalsium sebagai agen pelindung terhadap denaturasi panas (Bovetto et al., 1992) dan CGT-ase alkalofilik optimum pada pH 9-10 (Tao, 1991). Suhu maksimal untuk bakteri yang menghasilkan enzim CGT-ase antara 40ºC sampai 80ºC. Sebagian besar CGT-ase diinhibisi kuat oleh Zn2+, Cu2+, dan Fe2+ (Tonkova, 1998).
Enzim CGT-ase dapat mengkatalisis reaksi intramolekul (siklisasi) dan
antarmolekul (kopling, disproporsionasi), serta reaksi hidrolisis (Penninga, 1996). Reaksi siklisasi yaitu transfer residu gula akhir ke residu gula yang lain pada rantai oligosakarida yang sama untuk membentuk suatu senyawa siklik. Reaksi ini merupakan reaksi intramolekul dimana pati dihubungkan dengan ikatan α -1,4-glukan yang dikonversi kedalam siklodekstrin. Reaksi ini bersifat reversible dan cincin dapat dibuka oleh CGT-ase untuk reaksi lebih lanjut (Hedges, 1992). Siklisasi adalah reaksi utama dari CGT-ase untuk menghasilkan siklodekstrin (Salva et al., 1997).
F. Siklodekstrin
15
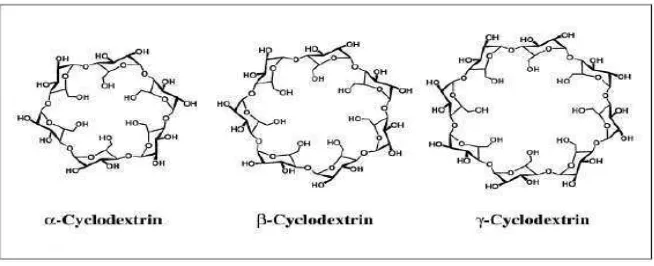
Gambar 3. Struktur α-, β- dan -siklodekstrin (Van der Veen et al., 2000).
Tabel 1. Sifat- sifat Siklodekstrin (Van der Veen et al., 2000)
Tipe Siklodekstrin
Karakteristik Alfa Beta Gamma
Berat molekul (g/mol) Monomer glukosa
Diameter rongga internal (Å)
Kelarutan dalam air (g/100mL:25°C) Tegangan permukaan (mN/m) Rentang lebur (°C)
Air kristalisasi
Molekul air dalam rongga
972
16
Produksi α-siklodekstrin, β-siklodekstrin dan -siklodekstrin oleh enzim CGT-ase tergantung pada beberapa faktor seperti pemilihan substrat pati untuk degradasi enzim, karakteristik enzim, komposisi medium dan kondisi yang digunakan pada proses reaksi katalisis pati oleh enzim CGT-ase (Salva et al., 1997).
17
Tabel 2. Jenis siklodekstrin utama yang dihasilkan berdasarkan asal enzim CGT-ase yang digunakan (Biwer et al., 2002).
Organisme Jenis Siklodekstrin
Bacillus macerans strain IAM1234 Bacillus macerans strain IFO 3490 Thermococcus sp. Strain B1001 Thermococcus kodakaraensis KOD1
Bacillus sp. E1 Bacillus circulans 251
Bacillus circulans 8 Bacillus firmus var. alkalophilus Bacillus licheniformis strain CGT-A
Thermoanaaerobacter sp.
Thermoanaaerobacter sp. ATCC 53627 Bacillus stearothermophilus NO2 T. thermosulfurigenes strain EM1
Alkalophilic Bacillus sp. 28-2 Alkalophilic Bacillus sp. 1011
Bacillus sp strain B1018 Bacillus sp strain KC201
Bacillus sp. A2-5a
Bacillus agaradhaerens strain LS-3C Bacillus ohbensis
Alkalophilic Bacillus clarkii 7364 Brevibacillus brevi CD162 Bacillus firmus/lentus strain 290-3
Nostoc sp. PCC 9229
α
18
serta untuk penanganan polusi (Bender, 1977; Kaneto and Fumithasi, 1996; Szetjli, 1982).
Pada bidang farmasi siklodekstrin berfungsi untuk mempermudah pembuatan obat-obatan dalam bentuk tablet dengan menghambat zat volatil, selain itu
siklodektrin juga meningkatkan stabilitas obat agar lebih tahan terhadap hidrolisis, oksidasi, panas, cahaya dan garam logam (Tonkova, 1998). Pada bidang pangan siklodekstrin berfungsi untuk menghaluskan tekstur kue dan daging, menstabilkan rasa bila makanan disimpan untuk waktu lama dan pembuatan susu yang rendah kolesterol (Szetjli, 1982).
G.ANOVA (Analysis of Variance)
Analisis of variance atau ANOVA merupakan salah satu uji parametrik yang
berfungsi untuk membedakan nilai rata-rata lebih dari dua kelompok data dengan cara membandingkan variansinya (Ghozali, 2009). Prinsip uji ANOVA adalah melakukan analisis variabilitas data menjadi dua sumber variasi yaitu variasi di dalam kelompok (within) dan variasi antar kelompok (between). Bila variasi within dan between sama (nilai perbandingan kedua varian mendekati angka satu),
berarti nilai mean yang dibandingkan tidak ada perbedaan. Sebaliknya bila variasi antar kelompok lebih besar dari variasi didalam kelompok, nilai mean yang dibandingkan menunjukkan adanya perbedaan. Uji ANOVA dapat dibagi menjadi 2 jenis berdasarkan jumlah variabel yang diamati, yaitu One Way ANOVA dan Two Way ANOVA. One Way ANOVA digunakan bila ada satu faktor yang ingin
19
Uji ANOVA dapat digunakan untuk menyelidiki apakah ada pengaruh faktor terhadap respon penelitian. Uji-uji yang dapat digunakan antara lain uji masing- masing faktor dan uji interaksi antar faktor.
1. Uji Masing-masing Faktor
Uji masing-masing faktor dilakukan untuk mengetahui apakah ada pengaruh pada masing-masing faktor secara terpisah terhadap respon.
Hipotesis:
H0: Faktor tidak memberi pengaruh pada respon H1: Faktor memberi pengaruh pada respon Pengambilan keputusan:
Jika nilai p>α, maka H0 diterima Jika nilai p<α, maka H0 ditolak
2. Uji Interaksi antar Faktor
Uji interaksi antar faktor dilakukan untuk mengetahui apakah ada pengaruh yang ditimbulkan oleh kombinasi faktor terhadap respon. Uji ini terdiri atas 2-way interactions dan 3-way interactions.
a. 2-Way Interactions Hipotesis:
H0: Faktor 2-way interactions tidak memberi pengaruh pada respon H1: Faktor 2-Way Interactions memberi pengaruh pada respon Pengambilan keputusan:
Jika nilai p>α, maka H0 diterima
20
b. 3-Way Interactions Hipotesis:
H0: Faktor 3-Way Interactions tidak memberi pengaruh pada respon H1: Faktor 3-Way Interactions memberi pengaruh pada respon Pengambilan keputusan:
Jika nilai p>α, maka H0 diterima
Jika nilai p<α, maka H0 ditolak
21
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Juli 2014 sampai dengan bulan September 2014 di Laboratorium Biokimia Jurusan Kimia, Laboratorium Mikrobiologi Jurusan Biologi, dan Laboratorium Botani Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Alat- alat yang digunakan pada penelitian ini adalah autoclave (model S-90N), laminar air flow (CURMA model 9005-FL), mikroskop, timbangan digital,
inkubator, sentrifuga, magnetic stirer, hotplate, tabung sentrifuga, mikropipet, waterbath, oven, spektofotometer UV-Vis (Ultrospec 4000 Pharmacia Biotech),
shaker, kasa, kapas, rak tabung, jarum ose dan alat-alat gelas lain seperti tabung
reaksi, cawan petri, Erlenmeyer, beaker gelas, gelas ukur, labu ukur, pipet tetes, batang pengaduk, spreader serta pemanas bunsen dan kompor gas.
22
starch, buffer asetat 0.1 M pH 5.5, fenolftalein 1 mM, pereaksi C, pereaksi D,
spiritus, alkohol serta isolat bakteri LTi-3-A2 dan LTi-21-3 sebagai kontrol.
C. Prosedur Penelitian
1. Tahap Persiapan
a. Persiapan Alat
Semua peralatan gelas yang akan dipakai dicuci bersih, dikeringkan dan dilakukan sterilisasi agar alat-alat tersebut terhindar dari mikroba yang tidak diinginkan. Sterilisasi alat dilakukan dengan menggunakan autoclave pada suhu 121°C dengan tekanan 1 atm selama 20 menit. Sebagian besar kegiatan dilakukan secara aseptik di dalam laminar air flow kecuali yang disebutkan secara khusus.
Seluruh alat-alat yang digunakan terlebih dahulu dikalibrasi, termasuk spektofotometer UV-Vis dengan cara memasukkan akuades ke dalam kuvet lalu di set absorbansinya hingga menunjukkan zero, setelah itu kuvet di set lagi dengan menggunakan sampel enzim, pada penelitian ini, kontrol enzim berupa kontrol negatif.
b. Pembuatan Medium Padat Horikoshi’s II
Medium Horikoshi’s II disiapkan dengan cara menimbang 1 g pati
23
Erlenmeyer, dilarutkan dengan akuades sebanyak 80 mL dan dipanaskan di atas bunsen yang disebut larutan (1). Kemudian sebanyak 0,25 gram Na2CO3 dimasukan ke dalam Erlenmeyer dan dilarutkan dengan akuades sebanyak 25 mL dan disebut larutan (2), disiapkan juga akuades sebanyak 5 mL yang telah dimasukkan ke dalam Erlenmeyer dan disebut larutan (3). Larutan (1), larutan (2) dan larutan (3) kemudian disterilisasi dengan menggunakan autoclave pada suhu 121ºC dengan tekanan 1 atm selama 15 menit. Medium Horikoshi’s II disiapkan di dalam laminar air flow dengan mencampurkan larutan I sebanyak 80 mL, Larutan II sebanyak 17 mL dan larutan III sebanyak 3 mL. Setelah medium Horikoshi’s II tercampur rata, medium di cek pH nya, yakni harus pH 10, kemudian medium Horikoshi’s II dimasukkan ke dalam cawan petri dan beberapa tabung reaksi dan
dibiarkan dalam posisi tabung yang sengaja dimiringkan hingga memadat pada suhu kamar.
2. Isolasi Bakteri Amilolitik
Isolasi bakteri amilolitik dilakukan menggunakan sampel endapan yang berasal dari lokasi industri pengolahan singkong. Sampel dilarutkan dalam larutan air salin 0,85% (w/v) NaCl dan dilakukan pengenceran secara bertingkat hingga 5 kali (10-5). Dari pengenceran 10-4 dan 10-5 diambil 200 µL, kemudian
24
37ºC. Uji terhadap isolat yang memiliki aktivitas CGT-ase dilakukan dengan mengukur diameter halozone yang berwarna keunguan atau kuning (Park et al., 1989). Terbentuknya halozone yang berdiameter besar menunjukkan koloni tersebut memiliki aktivitas CGT-ase. Isolat yang mampu menghasilkan halozone yang cukup besar ditumbuhkan kembali pada medium padat pada cawan petri. Kemudian isolat bakteri terpilih dilakukan penumbuhan berulang hingga diperoleh kultur tunggal dengan metode Streak Plate. Kultur tunggal tersebut kemudian disimpan pada medium agar miring sebagai stok.
3. Peremajaan Bakteri Amilolitik
Medium Horikoshi’s II padat pada tabung reaksi diinokulasi dengan isolat bakteri amilolitik hasil isolasi P-2-2, LTi-3-A2 dan LTi-21-3. Inokulasi dilakukan dengan metode zig-zag. Medium Horikoshi’s II kemudian diinkubasi di dalam inkubator selama 24 jam. Bakteri yang menghasilkan zona bening atau halozone berwarna keunguan atau kuning disekitar koloni merupakan bakteri yang menghasilkan enzim CGT-ase (Park et al., 1989).
4. Pembuatan Medium Cair untuk Kultur
25
5. Pembuatan Pereaksi
Pereaksi yang akan digunakan pada penelitian ini yaitu: pereaksi CGT-ase (Alves-Prado et al., 2008), pereaksi Lowry (Lowry et al., 1951). Pereaksi CGT-ase digunakan untuk menguji aktivitas ekstrak kasar enzim CGT-ase dan pereaksi Lowry digunakan untuk menguji kadar protein ekstrak kasar enzim CGT-ase.
a. Substrat untuk Uji Aktivitas Enzim CGT-ase.
Substrat yaitu larutan soluble starch 1% (w/v) disiapkan dengan cara melarutkan 1 gram soluble starch ke dalam 100 mL buffer asetat 0.1M pH 5.5, kemudian dipanaskan hingga larut.
b. Pereaksi Lowry
Pereaksi Lowry terdiri atas 4 macam, yang meliputi Pereaksi A, B, C, dan D. Masing-masing pereaksi tersebut disiapkan sebagai berikut: Pereaksi A: 2 g Na2CO3 dilarutkan dalam 100 mL NaOH 0,1N; Pereaksi B: 5 mL larutan CuSO4.5H2O 1% (w/v) ditambahkan 5 mL larutan Na(K)-tartarat 1% (w/v); Pereaksi C: 2 mL pereaksi B ditambah 100 mL pereaksi A; dan Pereaksi D: reagen Folin-Ciocelteau diencerkan dengan akuades 1:1.
6. Produksi Enzim CGT-ase
26
diinokulasikan ke dalam medium kultur. Sebanyak 1 mL starter diinokulasikan ke dalam medium kultur yang terlah disiapkan sebanyak 100 ml, kemudian
diinkubasi pada shaker dengan kecepatan 105 rpm selama 72 jam dan dilakukan sampling secara berkala setiap 6 jam. Proses produksi enzim dari setiap sampling
dilakukan pada sampel kultur dengan cara sentrifugasi selama 30 menit dengan kecepatan 5000 rpm untuk mendapatkan ekstrak kasar enzim yang kemudian dapat diukur pertumbuhan selnya dan diuji aktivitasnya.
7. Penentuan Pertumbuhan Sel
Penentuan pertumbuhan sel digunakan untuk mengetahui pertumbuhan dari sel bakteri dengan cara mengencerkan sampel kultur. Sebanyak 0,3 mL kultur dimasukan ke dalam tabung reaksi kemudian ditambahkan 2,7 mL akuades, kemudian diukur serapannya menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm.
8. Uji Aktivitas Enzim CGT-ase
Uji aktivitas enzim CGT-ase didasarkan pada terbentuknya 1 µmol siklodekstrin permenit. Aktivitas CGT-ase diukur berdasarkan metode Kaneko et al. (1987) dan dimodifikasi oleh Alves-Prado et al. (2008). Sebanyak 100 µL larutan enzim ditambahkan 800 µL soluble starch 1% yang disiapkan dalam buffer asetat 0.1 M pH 5.5 diinkubasi selama 10 menit pada suhu 55oC di dalam waterbath.
27
enzim yang dapat menghasilkan 1 µmol β-siklodekstrin permenit dan aktivitas spesifik didefinisikan sebagai besarnya aktivitas unit berbanding dengan kadar protein enzim. Aktivitas enzim CGT-ase yang akan diketahui dari isolat P-2-2 hasil isolasi ini kemudian dibandingkan dengan aktivitas enzim CGT-ase dari isolat bakteri LTi-3-A2 dan LTi-21-3 yang diperoleh dari penelitian sebelumnya.
9. Uji Kadar protein Enzim CGT-ase
Sebanyak 100 µL larutan enzim ditambahkan 0,9 ml akuades dan ditambah 0,5 ml pereaksi D, kemudian diaduk dan didiamkan selama 30 menit pada suhu kamar, lalu diukur absorbansinya pada λmaks 600 nm. Untuk kontrol, enzim diganti dengan akuades. Selanjutnya diperlakukan sama seperti sampel.
10. Uji Morfologi Isolat
28
11. Uji Statistika ANOVA (Analysis of Variance)
Uji statistika ANOVA dilakukan untuk membandingkan data pertumbuhan sel dan aktivitas enzim dari isolat P-2-2, LTi-3-A2, dan LTi-21-3 yang terdiri dari dua faktor yaitu waktu inkubasi dan jenis isolat. Sehingga pada penelitian ini digunakan uji ANOVA Two Way untuk melihat efek dari masing- masing faktor terhadap pertumbuhan sel dan aktivitas enzim menggunakan program Statistics SPSS 17.0. Uji statistika ANOVA dilakukan dengan langkah- langkah sebagai
berikut :
a. Menentukan Hipotesis
b. Menentukan Kriteria Pengambilan Keputusan c. Menentukan Tingkat Kepercayaan (α)
29
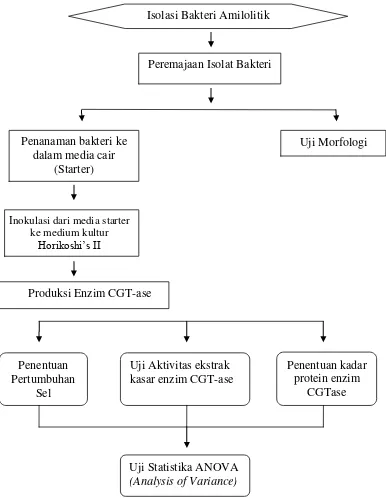
D. Diagram Alir Prosedur Penelitian
Gambar 4. Diagram alir prosedur penelitian Penanaman bakteri ke
dalam media cair (Starter)
Inokulasi dari media starter ke medium kultur
Horikoshi’s II
Uji Morfologi
Penentuan Pertumbuhan
Sel
Produksi Enzim CGT-ase
Uji Aktivitas ekstrak kasar enzim CGT-ase
Penentuan kadar protein enzim
CGTase Isolasi Bakteri Amilolitik
Uji Statistika ANOVA (Analysis of Variance)
47
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan maka dapat ditarik simpulan sebagai berikut :
1. Berdasarkan kemampuan membentuk zona bening (diameter halozone ≥ 2.0 cm) pada sekitar koloninya, isolat P-2-2 dipilih dan diseleksi dari 15 isolat kandidat.
2. Waktu inkubasi optimum produksi enzim CGT-ase dari isolat P-2-2 dicapai pada 42 jam sedangkan isolat pembanding LTi-3-A2 dan LTi-21-3 dicapai pada 36 jam dengan pertumbuhan sel (OD600) ketiga isolat berturut- turut yaitu 7.83, 10.82, dan 5.74.
3. Produksi enzim CGT-ase isolat P-2-2 lebih kecil dari isolat LTi-3-A2 namun lebih besar dari isolat LTi-21-3 berdasarkan besarnya aktivitas unit yang dihasilkan.
4. Isolat bakteri P-2-2 merupakan bakteri Gram negatif dan berbetuk batang pendek.
48
B.Saran
Data pertumbuhan sel, aktivitas unit, dan aktivitas spesifik dari isolat P-2-2, LTi-3-A2, dan LTi-21-3 yang menunjukkan perbedaan signifikan dari kedua faktor maka perlu dilakukannya analisis 16S rDNA untuk membuktikan ketiga isolat merupakan strain yang berbeda. Serta perlunya dilakukan pengambilan data pertumbuhan sel dan aktivitas enzim secara replikat untuk mengamati adanya interaksi dari kedua faktor dalam uji statistika.
49
DAFTAR PUSTAKA
Abdurakhman. 2007. Modul Metode Statistika II. Universitas Gadjah Mada. Yogyakarta.
Alves-Prado, H.F., A.A. Carneiro, F.C. Pavezzi, E. Gomes, M. Boscolo, C.M. Franco, and R. Silva. 2008. Production of Cyclodextrins by CGTase from Bacillus clausii Using Different Starches as Substrates. Appl Biochem Biotechnol. 146: 3–13.
Bender, L. 1977. Enzyme and Microbial Systems Involved in Starch Processing. Arch. Microbiol. 3: 272-282.
Biwer, A., G. Antranikian, and E. Heinzle. 2002. Enzymatic Production for Cyclodextrins. Applied Microbiology and Biotechnology. 59: 609-617 Bovetto, L.J., D.P. Backer, J.R. Villette, P.J. Sicard, and S.J.L. Bouquelet. 1992.
Cyclomaltodextrin Glucanotransferase from Bacillus circulans E 192. Biotechnology and Applied Biochemistry. 15: 48-58.
Cappucino, J.G. 1993. Microbiology : A Laboratory Manual. Addison Wesley Publishing Company.
Chakrabarty, S.L. and S. Sen. 1984. Amylase from Lactobacilus Isolate from Vegetables Wastes. Technol. 62: 407-413.
Crueger, W. 1984. Biotechnology; A Text Book on Industrial. Translate by T. D Book. Science Tech Inc. Toronto.
Dwijoseputro, D. 1986. Dasar- Dasar Mikrobiologi. Djambatan. Malang.
Dziezak, J.D. 1988. Microencapsulation and Encapsulated Ingeridients. Food. Technology (April): 135-151.
Ferdiaz, S. 1992. Mikrobiologi Pangan. Gramedia Pustaka Utama. Jakarta.
Freer, S.N. 1993. Purification and Characterication α-Amylase from
50
Ghozali, I. 2009. Aplikasi Analisis Multivariate dengan Program SPSS, Edisi Keempat, Penerbit Universitas Diponegoro. Semarang.
Hedges, A.R. 1992. Cyclodextrin : Production, Properties and Applications. In: Schenck, F.W. and Hebeda, R.E. Starch Hydrolysis Products. New York:
VCH Publishers. 319-334.
Irianto, K. 2006. Mikrobiologi: Menguak Dunia Mikroorganisme. Yrama Media. Bandung.
Jimmo. 2008. Dasar – Dasar Mikrobiologi. UI-Press. Jakarta.
Kaneto, U. and H. Fumitashi. 1996. Improvement of Drug Properties by Cyclodextrins. Pract. Med. Chem. 14: 793-825.
Khairunnisa, T. R. 2014. Pemurnian dan Karakterisasi Enzim CGT-ase (Siklodekstrin Glukanotransferase) dari Isolat LTi-A.24. Universitas Lampung. Lampung.
Kitahata, S., N. Tsuyama, and S. Okada. 1974. Purification and Some Properties of Cyclodextrin Glycosyltransferase from A Strain of Bacillus Species. Agric. Biot Chem. 38: 387-393.
Klein C.A., O. Schmidt-Kittler, J.A. Schardt, K. Pantel, M.R. Speicher, and G. Riethmüller. 1999. Comparative genomic hybridization, loss of heterozygosity, and DNA sequence analysis of single cells. Proc Natl Sci USA 96: 4494–4499.
Lee, J.H, K.J.L. Choi, J.Y. Choi, Y.S. Lee, I.B. Kwon, and J.H. Yu. 1992. Enzymatic Production of Cyclodextrin Glucanotransferase of Klebsiella oxytoca 19-1. Enzyme Microb. Technol. 14: 1017-1020.
Lehnninger, A.L. 1997. Dasar-Dasar Biokimia. Jilid 1. Diterjemahkan oleh Maggy Thenawidjaya. Erlangga. Jakarta. 369 halaman.
Leemhuis, H., H.J. Rozeboom, B.W. Dijkstra, and L. Dijkhuizen. 2003. The Fully Conserved Asp Residue in Conserved Sequence Region I of the α-Amylase Family is Crucial for The Catalytic Site Architecture and Activity. FEBS Letters. 541: 47-51.
Lim, D. 1998. Microbiology, 2nd Edition. McGrow-Hill Book. New York.
Lowry, C.H., N.J. Roseburgh, Y.L. Farr, and R.J. Randall. 1951. Protein Measurement with The Folin Phenol Reagent. J. Biol. Chem. 193: 365-275. Nakamura, N. and K. Horikhosi. 1976. Characterization and Some Cultural
51
Ngili, Y. 2009. Biokimia: Struktur dan Fungsi Biomolekul. Graha Ilmu. Yogyakarta.
Olympia, M., H. Fukuda, H. Ono, Y. Kaneko, and M. Takano. 1995. Characterization and Hydrolyzing Lactic Acid Bacteria Isolate from A Fermented Fish and Rice Food “Burog Isda” and It’s Amylolitic Enzyme. J. Ferment. Bioeng. 80: 124-130.
Page, D.S. 1997. Prinsip-Prinsip Biokimia. Erlangga. Jakarta.
Park, S.C., H.H. Park, and S.H. Kim. 1989. A Rapid Screening Method for
Alkaline β-Cyclodextrin Glucanotransferase Using Phenolphthalein-Methyl
Orange Containing Solid Media. Agriculural Biological Chemistry. 53: 1167-1169.
Pelczar, N. J., E.C.S. Chan, and N.S. Pelczar. 1988. Dasar-Dasar Mokrobiologi. Pemerjemah: R.S. Hadi Oetomo, Imas,S.F. Tjitrosomo, S.L. Angka. Ui press, Jakarta.
Penninga, D. 1996. Protein Engineering of Cyclodextrin Glycosyltransferase from Bacillus circulans strain 251. (Thesis). University of Groningen. Netherlands.
Poedjiadi, A. 1994. Dasar-Dasar Biokimia. UI Press. Jakarta.
Pongsawadi, P. and M. Yagiswa. 1987. Screening Anti Identification of Cyclodextrin Glucanotransferase Producing Bacteria. J. Fennent. Techno. 65: 463-467.
Salva, T.J.G., V.B. Lima, and A.P. Pagan. 1997. Screening of Alkaphilic Bacteria for Cyclodextrin Glycosyltransferase Production. Revista de Microbiologia. 28: 157-164.
Sastrawiyana, H. 2011. Isolasi dan Penapisan Bakteri Amilolitik Pendegradasi Pati Singkong Penghasil Enzim CGT-ase (Siklodekstrin Glukanotransferase). Universitas Lampung. Lampung.
Schlegel, H.G. and K. Schmidt. 1994. Mikrobiologi Umum. Gadjah Mada University Press. Yogyakarta.
Schmidt, A.K., S. Cottaz, H. Driguez, and G.E. Schulz. 1998. Structure of Cyclodextrin Glucosyltransferase Complexed with a Derivative of Its Main
Product β-Cyclodextrin. Journal of Biochemistry. 37: 5909-5915.
52
Szejtli, J. 1982. Cyclodexrtins in Food, Cosmetics and Toiletries. Starch/Starke. 34: 379-385.
Tao, B.Y. 1991. Cyclodextrin Glucanotransferases: Technology and Biocatalyst Design. In : Himmel, M. E. and Leatham, G. F. Enzyme in Biomass Conversion. Washington, D.C. : American Chemical Society. 372-383.
Tonkova, A. 1998. Bacterial Cyclodextrin Glucotransferase. Enzyme and Microbial Technology. 22: 678-686.
Van der Veen, B.A., J.C.M. Uitdehaag, D. Penninga, G.J.W.M. Van Aleebek, L.M. Smith, B.W. Dijkstra, and L. Dijkhuizen. 2000. Rational Design of Cyclodextrin Glycosyltransferase from Bacillus circulans Strain 251 to
Increase α-Cyclodextrin Production. Journal of Molecular Biology. 296:
1027-1038.
Volk, W.A and M.F. Wheeler. 1993. Mikrobiologi Dasar, Jilid 1, Edisi kelima. Alih bahasa oleh Soenarto Adisoemarto, Ph.D. Erlangga. Jakarta.
Wang, D.I.G., C.L. Cooney, A.L. Demain, P. Dunhill, A.E. Humprey, and M.D. Lilly. 1979. Fermentation and Enzymes Technology. Jhon Wiley and Sons. New York.