PENGARUH pH AIR TERHADAP TINGKAT PATOGENITAS
VIRAL NERVOUS NECROSIS
PADA BENIH IKAN KERAPU MACAN (Epinephelus fuscoguttatus)
SKRIPSI
HELMI KRISTINA SIMAMORA
070805019
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH pH AIR TERHADAP TINGKAT PATOGENITAS
VIRAL NERVOUS NECROSIS
PADA BENIH IKAN KERAPU MACAN (Epinephelus fuscoguttatus)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH
HELMI KRISTINA SIMAMORA
070805019
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGARUH pH AIR TERHADAP TINGKAT
PATOGENITAS VIRAL NERVOUS NECROSIS PADA BENIH IKAN KERAPU MACAN (Epinephelus fuscoguttatus)
Kategori : SKRIPSI
Nama : HELMI KRISTINA SIMAMORA
Nomor Induk Mahasiswa : 070805019
Program Studi : SARJANA(S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, September 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dedy Arief Hendriyanto, S. St.Pi, M.Si. Prof. Dr. Dwi Suryanto, M.Sc. NIP. 19780524 200003 1 002 NIP. 19640409 199403 1 003
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
PENGARUH pH AIR TERHADAP TINGKAT PATOGENITAS VIRAL NERVOUS NECROSIS
PADA BENIH IKAN KERAPU MACAN (Epinephelus fuscoguttatus)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan,
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas cinta kasih dan berkat penyertaan-Nya sehingga penulis dapat menyelesaikan Skripsi yang berjudul “Pengaruh pH Air Terhadap Tingkat Patogenitas Viral Nervous Necrosis Pada Benih Ikan Kerapu Macan (Epinephelus fuscoguttatus)” dibuat sebagai salah satu syarat untuk meraih gelar sarjana di FMIPA USU Medan.
Ucapan terima kasih penulis ucapkan kepada Bapak dan Ibu dosen terkasih: Prof. Dr. Dwi Suryanto, M.Sc selaku Dosen Pembimbing I dan Dedy Arief Hendriyanto, S.St.Pi, M.Si selaku Dosen Pembimbing II, Prof. Dr. Syafruddin Ilyas, M.Biomed dan Dra. Nunuk Priyani, M.Sc selaku Dosen Penguji serta kepada Dosen Penasehat Akademik, Drs. Arlen H.J., M.Si yang selama ini telah memberikan arahan, bimbingan dan masukkan demi kesempurnaan skripsi ini.
Ucapan terima kasih juga penulis sampaikan kepada Ibu Dr. Nursahara Pasaribu, M.Sc, selaku Ketua Departemen Biologi FMIPA USU dan Bapak Kiki Nurtjahja, M.Sc, selaku Sekretaris Departemen Biologi FMIPA USU, Ibu Roslina Ginting, Ibu Nurhasni Muluk dan Bang Ewin selaku Staf Pengawai Administrasi dan seluruh Dosen Pengajar di Departemen Biologi FMIPA USU.
Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada Bapak Ir. Viktor Immanuel selaku Kepala Balai Karantina Ikan Kelas I Polonia, Medan, Bapak Ramon Nasution, Ibu Ir. Barita Sriwanty Aritonang, Bapak Sahala Sianturi, S.Si, Ibu Marlina Dolok Saribu, S.Si, Bapak Drh. Sangkot SN dan Staf Pengawai BKI Polonia Medan atas kepercayaan dan kerjasama yang terbina selama ini.
Ucapan terima kasih yang tak ternilai penulis ucapkan kepada kedua orang tua, Ayah tercinta A. Simamora dan Ibunda tercinta J. Sihite atas doa, dukungan dan setiap tetesan keringat yang tercurah untuk anak-anaknya. Serta kepada Abang saya Jack Jones Simamora, Kakak terkasih Romauli Simamora dan Adik tersayang David Simamora atas dorongan semangat yang diberikan kepada penulis.
Penulis menyadari bahwa dalam pembuatan skripsi ini masih banyak kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik yang bersifat membangun demi kesempurnaan skripsi ini. Semoga skripsi ini bermanfaat. Tuhan memberkati kita semua.
Medan, September 2011
PENGARUH pH AIR TERHADAP TINGKAT PATOGENITAS VIRAL NERVOUS NECROSIS
PADA BENIH IKAN KERAPU MACAN (Epinephelus fuscoguttatus)
ABSTRAK
Penelitian tentang pengaruh pH air terhadap tingkat patogenitas viral nervous necrosis pada benih ikan kerapu macan (Epinephelus fuscoguttatus) telah dilakukan pada bulan Januari sampai April 2011. Tujuan dari penelitian ini untuk mengetahui pengaruh pH air terhadap tingkat patogenitas VNN pada benih kerapu macan. Adapun ikan yang digunakan yaitu benih kerapu macan ukuran ± 10 cm. Penelitian ini diawali dengan uji FID50 yaitu untuk mendapatkan konsentrasi virus VNN yang akan diinjeksikan
pada Uji Utama. Selanjutnya dilakukan uji konfirmatif yang meliputi Uji Hematologi, Uji Histopatologi dan Uji RT-PCR.
Hasil penelitian yang dilakukan memperoleh nilai FID50 sebesar 10-4/0,1 ml
yang diinjeksikan pada benih ikan. Pada Uji Utama diperoleh persentase kematian ikan tertinggi pada perlakuan pH 6,0 sebesar 96,67% dan terendah pada perlakuan pH 8,5 sebesar 63,33%. Dari hasil yang didapat, perlakuan pH 8,5 berbeda nyata terhadap perlakuan lainnya (p<0,05). Pada Uji Hematologi diperoleh bahwa jumlah leukosit pada masing-masing perlakuan mengalami penurunan dari jumlah leukosit normal sebesar 150.000-300.000 sel/mm 3. Jumlah eritrosit pada setiap perlakuan relatif normal dari jumlah eritrosit normal sebesar 1,3 juta -3 juta sel/mm 3. Nilai hematokrit pada masing-masing perlakuan menurun dari nilai hematokrit normal sebesar 12-14% dan jumlah Hemaglobin diperoleh juga mengalami penurunan dari jumlah hemoglobin normal sebesar 30,8-45,5 g/dl.
Pada uji histopatologi dampak infeksi VNN ditandai dengan adanya penggumpalan atau akumulasi sel-sel radang dan sel-sel glia yang berkelompok secara umum dan terjadinya vaskulitis. Hasil diagnosis PCR diperoleh bahwa terdapat perbedaan tingkat patogenitas yang berbeda pada masing-masing perlakuan.
Effect of pH Water Levels on the Pathogenicity of Viral Nervous Necrosis in Seed Tiger Grouper (Epinephelus fuscoguttatus)
ABSTRACT
A study on effect of pH on pathogenicity of viral nervous necrosis in seed tiger grouper (Epinephelus fuscoguttatus) has been carried out from January to April 2011. The purpose of this study was to investigate the effect of pH on the pathogenicity level of VNN in tiger grouper seed. The fish used was tiger grouper seeds of ± 10 cm. Study was initiated with FID50 test to get the concentration of virus VNN to be
injected in Main Test. Confirmative test included Hematology Test, Histopatology Test and RT-PCR.
The result showed that FID50 value was 10-4/0,1 ml to be injected to the fish.
The highest percentage of morbidity of fish was at pH 6.0 (96.67%) and the lowest occured at pH 8.5 (63.33%). pH 8.5 showed significantly different to the other treatments (p<0.05). The number of leukocytes in each treatment decreased from the normal (150.000-300.000 cells/mm3). The number of erythrocytes of all treatments was normal (1.3-3 million cells/mm3). The hematocrite decreased to 12-14%. The hemoglobin decreased to 30.8-45.5g/dl. The impact of VNN infection characterized by the accumulation of clotting or imflammatory cells, more glial cells revealed and the occurence of vasculitis. PCR results confirmed the different of pathogenicity of each treatment.
DAFTAR ISI
DAFTAR LAMPIRAN xii
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan Penelitian 3
1.3 Tujuan Penelitian 3
1.4 Hipotesis Penelitian 3
1.5 Manfaat Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1 Ikan Kerapu Macan (Epinephelus fuscoguttatus) 4
2.2 Viral Nervous Necrosis (VNN) 6
2.3 Kualitas air 7
BAB 3 BAHAN DAN METODE
3.1 Waktu dan Tempat 10
3.2 Alat dan Bahan 10
3.3 Prosedur Penelitian 10
3.3.1 Isolat Virus 11
3.3.2 Uji FID50 11
3.3.3 Pengaruh pH Terhadap Patogenitas VNN 12
3.3.4 Pengamatan Gejala Klinis 12
3.3.5 Uji Hematologi 13
3.3.6 Pemeriksaan Histopatologi 15
3.3.7 Uji Biologi Molekuler (RT-PCR) 16
3.3.8 Analisis Data 17
BAB 4 HASIL DAN PEMBAHASAN
4.1 Uji FID50 18
4.2 Pengaruh pH air Terhadap Tingkat Patogenitas VNN 19 4.3 Gejala Klinis Akibat Infeksi VNN 21
4.4 Uji Hematologi 22
4.5 Pemeriksaan Histopatologi 23
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 28
5.2 Saran 28
DAFTAR TABEL
Halaman
Tabel 4.1 Nilai FID50 18
Tabel 4.2 Pengaruh pH air terhadap tingkat patogenitas VNN 19
DAFTAR GAMBAR
Halaman
Gambar 4.3 Gejala klinis infeksi VNN 21
Gambar 4.5 Pemeriksaan histopatologi 25
DAFTAR LAMPIRAN
Halaman Lampiran A. Pengamatan Harian Pada Masing-masing Perlakuan 32 Lampiran B. Uji Normalitas, Non Parametrik Mann-Whitney 33 Lampiran C. Amplikasi Reverse Transcriptase Polimerase Chain Reaction 45
Lampiran D. Pembuatan Isolat Virus 46
Lampiran F. Alur kerja Uji FID50 47
Lampiran G. Pemeriksaan Hematologi 48
Lampiran H. Pemeriksaan Histopatologi 51
Lampiran I. Uji Reverse Trancriptase Polimerase Chain Reaction (RT-PCR) 53
Lampiran J. Dokumentasi penelitian 56
PENGARUH pH AIR TERHADAP TINGKAT PATOGENITAS VIRAL NERVOUS NECROSIS
PADA BENIH IKAN KERAPU MACAN (Epinephelus fuscoguttatus)
ABSTRAK
Penelitian tentang pengaruh pH air terhadap tingkat patogenitas viral nervous necrosis pada benih ikan kerapu macan (Epinephelus fuscoguttatus) telah dilakukan pada bulan Januari sampai April 2011. Tujuan dari penelitian ini untuk mengetahui pengaruh pH air terhadap tingkat patogenitas VNN pada benih kerapu macan. Adapun ikan yang digunakan yaitu benih kerapu macan ukuran ± 10 cm. Penelitian ini diawali dengan uji FID50 yaitu untuk mendapatkan konsentrasi virus VNN yang akan diinjeksikan
pada Uji Utama. Selanjutnya dilakukan uji konfirmatif yang meliputi Uji Hematologi, Uji Histopatologi dan Uji RT-PCR.
Hasil penelitian yang dilakukan memperoleh nilai FID50 sebesar 10-4/0,1 ml
yang diinjeksikan pada benih ikan. Pada Uji Utama diperoleh persentase kematian ikan tertinggi pada perlakuan pH 6,0 sebesar 96,67% dan terendah pada perlakuan pH 8,5 sebesar 63,33%. Dari hasil yang didapat, perlakuan pH 8,5 berbeda nyata terhadap perlakuan lainnya (p<0,05). Pada Uji Hematologi diperoleh bahwa jumlah leukosit pada masing-masing perlakuan mengalami penurunan dari jumlah leukosit normal sebesar 150.000-300.000 sel/mm 3. Jumlah eritrosit pada setiap perlakuan relatif normal dari jumlah eritrosit normal sebesar 1,3 juta -3 juta sel/mm 3. Nilai hematokrit pada masing-masing perlakuan menurun dari nilai hematokrit normal sebesar 12-14% dan jumlah Hemaglobin diperoleh juga mengalami penurunan dari jumlah hemoglobin normal sebesar 30,8-45,5 g/dl.
Pada uji histopatologi dampak infeksi VNN ditandai dengan adanya penggumpalan atau akumulasi sel-sel radang dan sel-sel glia yang berkelompok secara umum dan terjadinya vaskulitis. Hasil diagnosis PCR diperoleh bahwa terdapat perbedaan tingkat patogenitas yang berbeda pada masing-masing perlakuan.
Effect of pH Water Levels on the Pathogenicity of Viral Nervous Necrosis in Seed Tiger Grouper (Epinephelus fuscoguttatus)
ABSTRACT
A study on effect of pH on pathogenicity of viral nervous necrosis in seed tiger grouper (Epinephelus fuscoguttatus) has been carried out from January to April 2011. The purpose of this study was to investigate the effect of pH on the pathogenicity level of VNN in tiger grouper seed. The fish used was tiger grouper seeds of ± 10 cm. Study was initiated with FID50 test to get the concentration of virus VNN to be
injected in Main Test. Confirmative test included Hematology Test, Histopatology Test and RT-PCR.
The result showed that FID50 value was 10-4/0,1 ml to be injected to the fish.
The highest percentage of morbidity of fish was at pH 6.0 (96.67%) and the lowest occured at pH 8.5 (63.33%). pH 8.5 showed significantly different to the other treatments (p<0.05). The number of leukocytes in each treatment decreased from the normal (150.000-300.000 cells/mm3). The number of erythrocytes of all treatments was normal (1.3-3 million cells/mm3). The hematocrite decreased to 12-14%. The hemoglobin decreased to 30.8-45.5g/dl. The impact of VNN infection characterized by the accumulation of clotting or imflammatory cells, more glial cells revealed and the occurence of vasculitis. PCR results confirmed the different of pathogenicity of each treatment.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Ikan kerapu macan (Epinephelus fuscoguttatus) umumnya dikenal dengan istilah
"groupers" dan merupakan salah satu komoditas perikanan penting yang mempunyai
nilai jual cukup tinggi dan peluang ekonomi yang baik di pasaran domestik maupun
pasar internasional (Ibrahim, 2010). Jenis kerapu ini merupakan ikan asli Indonesia
yang hidup tersebar di berbagai perairan berkarang di nusantara (Anonim, 2001).
Kegiatan budidaya ikan laut di Indonesia khususnya ikan kerapu macan
merupakan budidaya laut yang memiliki prospek yang sangat baik untuk
dikembangkan, karena kegiatan ini berperan dalam hal memenuhi kebutuhan ikan
konsumsi, peningkatan penghasilan dan penyediaan lapangan kerja bagi masyarakat
petani ikan maupun nelayan serta dapat bermanfaat dalam pelestarian sumber daya
ikan laut yang mulai langka (Maghfirah, 2009).
Budidaya ikan kerapu macan pada umumnya dilakukan pada karamba jaring
apung (KJA) yang berada di perairan di lepas pantai. Ikan kerapu macan menyenangi
air laut berkadar garam 33 - 35 ppt. Menurut Chua & Teng (1978), kualitas perairan
yang optimal untuk pertumbuhan ikan kerapu, seperti suhu berkisar antara 24 - 31ºC,
salinitas antara 30-33 ppt, oksigen terlarut > 3,5 ppm dan pH berkisar antara 7,8 - 8,0.
Sementara itu Suprakto & Fahlivi (2007) melaporkan kualitas air pada lokasi
budidaya, yaitu kecepatan arus 15 - 30 cm/s, suhu 27 - 29ºC, salinitas 30 - 33 ppt, pH
8,0 - 8,2, oksigen >5 ppm dan kedalaman > 5 m (Langkosono, 2007).
Dalam pemeliharaan ikan kerapu masih terdapat kendala, diantaranya adalah
Necrosis (VNN). Virus ini umumnya menginfeksi stadia larva sampai yuwana dan
menyerang sistem organ syaraf mata dan otak (Yuasa et al., 2001 dalam Suratmi dan
Aryani, 2007). VNN menyerang secara akut pada ukuran ikan dibawah 50 g
(Sutarmat, 2004). Penyakit akibat infeksi virus masih merupakan masalah utama
dalam budidaya ikan kerapu karena dapat menyebabkan kematian ikan hingga 100%
dalam waktu yang relatif singkat (Suratmi, 2007).
Gejala yang tampak pada ikan yang terinfeksi VNN berbeda-beda sesuai dengan
stadia atau umur ikan. Ikan yang berumur kurang dari 20 hari apabila terinfeksi VNN
tidak menunjukkan gejala klinis kecuali kemauan makan yang menurun, ditandai
dengan banyaknya sisa rotifer pada air pemeliharaan. Ikan umur 20-40 hari
menunjukkan tingkah laku berenang yang abnormal yaitu ikan berenang di dekat
permukaan air dan selanjutnya terjadi kematian di dasar bak pemeliharaan. Pada ikan
yang berumur 2-4 bulan yang terinfeksi tampak diam/tidur di dasar jaring. Sedangkan
ikan umur lebih dari 4 bulan terlihat berenang mengampang di atas permukaan air
disertai adanya pembesaran gelembung renang (Sugianti, 2005).
Kualitas air dalam budidaya ikan adalah setiap peubah yang mempengaruhi
pengelolaan dan sintasan, perkembangbiakan, pertumbuhan, atau produksi ikan. Air
yang baik adalah yang mampu menunjang kehidupan ikan dengan baik (Purnamawati,
2002). Air laut normal selalu bersifat basa dan kondisi demikian diperlukan bagi
kehidupan biota laut (Romimohtarto, 2008). Perairan dengan pH rendah
mengakibatkan aktivitas tubuh ikan menurun dan kondisi ikan menjadi lemah,
sehingga ikan mudah terkena infeksi penyakit dan bahkan menyebabkan kematian pada
ikan. pH air yang tidak optimal berpengaruh terhadap pertumbuhan dan
perkembangbiakan ikan, menyebabkan tidak efektifnya pemupukan air di kolam dan
meningkatkan daya racun hasil metabolisme seperti NH3 dan H2S (Irawan et al.,
1.2Permasalahan
Usaha pembesaran ikan kerapu macan merupakan usaha perikanan laut yang layak
dikembangkan. Namun dalam pembudidayaannya, penyakit yang disebabkan oleh
virus dapat menyerang ikan dan menyebabkan kematian dalam jumlah besar sehingga
kerugian yang ditimbulkan sangat besar. Hingga kini penyakit akibat virus belum
dapat ditanggulangi secara pasti sehingga lebih ditekankan kepada upaya pencegahan
dan membatasi penularannya dengan cara memperhatikan kualitas air, salah satunya
menjaga pH air yang mendukung untuk kehidupan ikan. Oleh karena itu, perlu
dilakukan penelitian untuk mengetahui bagaimana pengaruh pH air terhadap tingkat
patogenitas VNN pada benih ikan kerapu macan.
1.3 Tujuan Penelitian
Adapun tujuan dari penelitian ini yaitu untuk mengetahui pengaruh pH air terhadap
tingkat patogenitas VNN pada benih ikan kerapu macan.
1.4 Hipotesis
Perbedaan pH air berpengaruh terhadap tingkat patogenitas VNN pada benih ikan
kerapu macan.
1.5Manfaat Penelitian
Adapun manfaat dari penelitian ini yaitu:
a. Sebagai bahan informasi untuk kegiatan budidaya ikan kerapu macan dalam
memahami penyakit yang disebabkan oleh VNN.
b. Mencengah dan membatasi penularan penyakit oleh VNN pada budidaya ikan
BAB 2
TINJAUAN PUSTAKA
2.1 Ikan Kerapu Macan (Epinephelus fuscoguttatus)
Ikan kerapu bernilai ekonomis tinggi, baik di dalam negeri maupun di luar negeri
sehingga penangkapan dan budidayanya bisa berkembang. Ikan ini mempunyai nilai
komersial yang tinggi karena rasa dagingnya yang enak. Namun saat ini untuk
memenuhi permintaan pasar masih didominasi hasil tangkapan di alam (Anonim,
2001). Sedangkan hasil budidaya masih terbatas dan hanya berasal pada
daerah-daerah tertentu saja terutama yang dekat dengan pusat pemasaran, seperti Bali,
Tanjung Pinang, Batam, Lampung, Sulawesi Selatan, Jawa Barat, Jawa Timur, Nusa
Tenggara dan lain-lain (Langkosono, 2007).
Menurut Wardana, 1994 dalam Sudirman (2008) ciri-ciri morfologi ikan
kerapu adalah sebagai berikut: bentuk tubuh pipih, yaitu lebar tubuh lebih kecil dari
pada panjang dan tinggi tubuh, rahang atas dan bawah dilengkapi dengan gigi yang
lancip dan kuat, mulut lebar, serong ke atas dengan bibir bawah yang sedikit menonjol
melebihi bibir atas, sirip ekor berbentuk bundar, sirip punggung tunggal dan
memanjang dimana bagian yang berjari-jari keras kurang lebih sama dengan yang
berjari-jari lunak, posisi sirip perut berada di bawah sirip dada, badan ditutupi sirip
kecil yang bersisik stenoid. Ikan kerapu genus Epinephelus tubuh ditutupi oleh
bintik-bintik berwarna cokelat atau kuning, merah atau putih, tinggi badan pada sirip
punggung pertama biasanya lebih tinggi dari pada sirip dubur, sirip ekor berbentuk
bundar.
Ikan kerapu macan masuk ke dalam ordo Perciformes; famili Serranidae,
Genus Epinephelus dan spesies Epinephelus fuscoguttatus. Ikan ini termasuk ikan
cahaya tetapi tidak langsung dari matahari, berenang di dasar air dengan temperatur
optimal 26oC, panjang rata-rata maksimal 90 cm. Tubuh kerapu macan dipenuhi sisik
yang berukuran kecil yang berbentuk sikloid. Nama kerapu diberikan biasanya untuk
empat genus Serranidae yaitu Epinephelus, Variola, Plectropampus dan Cromileptes.
Di Indonesia Epinephelus sendiri mempunyai 38 spesies. Sebagian besar famili
Serranidae hidup di perairan dangkal dengan dasar pasir berkarang, walaupun
beberapa jenis dapat ditemukan di perairan dalam (Burgess et al., 1990).
Ikan kerapu macan mempunyai ukuran tubuh yang relatif lebih besar dan
pertumbuhan lebih cepat dibandingkan dengan jenis ikan lain (Endrawati et al., 2008).
Ikan ini merupakan salah satu jenis ikan yang memiliki nilai ekonomi tinggi, menjadi
sumber devisa dan merupakan komoditi ekspor unggulan ke Singapura, Hongkong,
Jepang dan Amerika (Feliatra et al., 2004). Ikan kerapu macan sebagai komoditi
ekspor menyumbang devisa negara sebesar 580 juta US $ pada tahun 2003 (Anonim,
2004).
Ikan kerapu macan hidup di daerah karang sehingga biasa disebut kerapu
karang. Dalam dunia perdagangan internasional dikenal dengan nama flower atau
carped cod (Ghufran & Kordi, 2004). Ikan kerapu di Indonesia banyak ditemukan di
perairan Pulau Sumatera, Pulau Buru, Pulau Jawa, Sulawesi, dan Ambon. Salah satu
indikator adanya ikan kerapu adalah perairan karang. Indonesia memiliki perairan
karang yang cukup luas sehingga potensi sumber daya ikan kerapu sangat besar
(Sudirman, 2008).
Menurut Anonimous (2001) bahwa pertumbuhan dan kelangsungan hidup ikan
kerapu macan berlangsung baik pada suhu berkisar antara 25oC-32oC, salinitas
berkisar antara 20 ppt-32 ppt, oksigen terlarut (DO) berkisar antara 4 ppm - 8 ppm dan
pH berkisar antara 7,5-8,3. Sedangkan menurut Akbar & Sudaryanto (2001) bahwa
ada keterkaitan pertumbuhan dan kondisi lingkungan perairan pada lokasi budidaya
ikan kerapu, seperti suhu berkisar 27oC-29oC, salinitas 30-33 ppt, pH berkisar antara
8,0-8,2 dan oksigen terlarut (DO) lebih besar dari 5 ppm. Ikan kerapu macan bisa juga
hidup di perairan muara sungai dengan kisaran kadar garam 15-30 ppt, suhu air 24oC-
2.2 Viral Nervous Necrosis (VNN)
Viral Nervous Necrosis (VNN) yang juga dikenal sebagai virus encephalophaty dan
retinopathy (VER) adalah penyakit berbahaya yang menyerang larva dan juvenil ikan
budidaya di Asia, Australia, Eropa dan Amerika Utara (Yukio, 2004). Agen penyebab
VNN telah diindentifikasi sebagai anggota baru dari Nodaviridae dari karakter genom
dan proteinnya (Chi et al., 2001).
Keluarga Nodaviridae terdapat dua jenis yaitu jenis Alphanodavirus dan
Betanodavirus, kedua jenis ini sangat ganas dalam menginfeksi ikan. Betanodaviruses
(famili Nodaviridae) adalah agen penyebab serangan VNN pada budidaya ikan laut.
Betanodaviruses adalah virus kecil, berbentuk bola, tidak punya kapsid dengan genom
yang terdiri atas dua ikatan tunggal (Yukio, 2007). Virus ini terdiri dari dua segmen
(RNA1 dan RNA2) dari utas tunggal RNA (ssRNA) dengan segmen RNA2
mengandung segmen sebagai pembungkus protein virus. Segmen RNA2 dapat
diisolasi dan digunakan sebagai target deteksi RNA virus melalui metode molekular
dan pelindung protein virus pada metode imunitas (Moody & Herwood, 2008).
Gejala klinis umum VNN pada beberapa jenis ikan antara lain perilaku ikan
terserang berenang tak menentu dan ikan mengapung dengan perut di atas disebabkan
oleh pembengkakan selaput renang (swim bladder), warna tubuh terlihat lebih gelap
dan selera makan berkurang ikan yang terkena infeksi VNN biasanya memperlihatkan
keadaan gangguan saraf yang berhubungan dengan vakuolisasi (kerusakan) kuat
sistem saraf pusat dan retina (Thie´ry et al., 2006).
Virus dapat menjadi agensia penyakit atau agensia hereditas. Sebagai agensia
penyakit, virus dapat masuk ke dalam sel dan menyebabkan perubahan-perubahan
yang merugikan pada sel inang yang diinfeksinya, sehingga sel inang rusak atau
bahkan mati. Sedangkan sebagai agensia hereditas virus dapat masuk ke dalam sel
2.3 Kualitas air
Kualitas lingkungan perairan adalah suatu kelayakan lingkungan perairan untuk
menunjang kehidupan dan pertumbuhan organisme air yang nilainya dinyatakan
dalam suatu kisaran tertentu. Sementara itu, perairan ideal adalah perairan yang dapat
mendukung kehidupan organisme dalam menyelesaikan daur hidupnya (Irawan et al.,
2009).
Untuk menghindari terjadinya wabah penyakit akibat kualitas air yang tidak
baik, sebaiknya air yang akan dimanfaatkan untuk memelihara ikan dianalisis dahulu.
Dengan demikian, air yang digunakan benar-benar layak bagi kehidupan ikan yang
dipelihara. Pemeriksaan air ditujukan terhadap sifat fisika, kimia dan keadaan biota air
lainnya, khususnya makhluk hidup yang berpotensi mengganggu kehidupan ikan, baik
berupa pemangsa (predator), penyaing (kompetitor), ataupun jasad penyebab penyakit
(Daelami, 2002). Faktor-faktor lain yang mensifati kualitas air laut antaranya adalah
salinitas, suhu dan kandungan oksigen (Romimohtarto, 2008).
Derajat keasaman (pH) sangat penting sebagai parameter kualitas air karena
mengontrol tipe dan laju kecepatan reaksi beberapa bahan di dalam air. Selain itu
ikan dan mahluk-mahluk akuatik lainnya hidup pada selang pH tertentu, sehingga
dengan diketahuinya nilai pH maka kita akan tahu apakah air tersebut sesuai atau
tidak untuk menunjang kehidupan ikan (Effendi, 2003). Untuk nilai pH yang sesuai
untuk pertumbuhan ikan adalah 6,5-9,5, sedangkan nilai yang baik untuk oksigen yang
terlarut dalam air untuk menunjang kehidupan organisma di dalam air yaitu minimal 2
ppm dan nilai amoniak yang tidak berbahaya untuk kelangsungan hidup ikan yaitu
tidak melebihi dari 1 ppm (Setyadi, 2007).
pH di perairan penting untuk reaksi-reaksi kimia dan senyawa-senyawa yang
mengandung racun. Perubahan asam atau basa di perairan dapat mengganggu sistem
keseimbangan ekologi. pH air mempengaruhi tingkat kesuburan perairan karena
mempengaruhi kehidupan jasad renik (Ghufran & Kordi, 2004). Nilai pH juga
berkaitan erat dengan karbondioksida dan alkalinitas (Effendi, 2003). pH air
semakin tinggi kandungan CO2 perairan, maka pH akan menurun dan demikian pula
sebaliknya. Fluktuasi ini akan berkurang apabila air mengandung garam CaCO3
(Irawan, 2009).
Keputusan Menteri Negara Lingkungan Hidup (2004) tentang baku mutu air
laut untuk biota laut tertera pada Tabel 1 di bawah ini:
Tabel 1. Baku mutu air laut untuk biota laut
Fisika
Parameter Satuan Baku mutu
Kecerahan m coral: >5
mangrove: - lamun: >3
Kebauan - alami
Kekeruhan NTU >5
Padatan tersuspensi total mg/l coral: 20 lamun: 20
Senyawa Fenol total mg/l 0,002
PCB total (poliklor bifenil) μg/l 0,01 Surfaktan (deterjen) mg/l MBAS 1
Minyak & lemak mg/l 1
TBT (tributil tin) μg/l 0,01
Logam terlarut Raksa (Hg) mg/l 0,001
Kromium heksavalen (Cr(VI) mg/l 0,005
Arsen (As) mg/l 0,012
Kadmium (Cd) mg/l 0,001
Tembaga (Cu) mg/l 0,008
Timbal (Pb) mg/l 0,008
Seng (Zn) mg/ 0,05
Nikel (Ni) mg/l 0,05
Biologi Coliform (total) MPN/100 ml 1000
Patogen sel/100 ml nihil
Plankton sel/100 ml tidak bloom
Radio Nuklida Komposisi yang tidak diketahui
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai bulan Januari sampai April 2011 di Laboratorium
Biologi Molekuler Balai Karantina Ikan Kelas I Polonia Medan, Laboratorium
Patologi Anatomi dan Laboratorium Biokimia Balai Penyidikan dan Pengujian
Veteriner Regional I Medan Balai Veteriner, Medan.
3.2Alat dan Bahan
Adapun alat yang digunakan adalah akuarium 60x40x40 cm3, aerator, filtrasi, alat
diagnosis PCR, elektroforesis, sentrifugasi, transilluminator UV gelombang,
spektrofotometer, mikroskop, counter, timbangan analitik, vortex, termometer, heater
otomatis, pH meter, ember, sarung tangan, masker, serokan ikan, alat suntik, kamera
digital, disecting set, jarum suntik 1 ml, pipet tetes, batang pengaduk, autoklaf,
pinetip, dan micro tube. Bahan yang digunakan yaitu benih kerapu macan dengan
ukuran panjang ±10 cm sebanyak 310 ekor, inokulum baku virus VNN, air laut,
larutan Hank’ Balauced Salt Soluble (HBSS), CHCl3, RNA extraction, isopropanol,
etanol 75%, ddH2O, NaCI fisiologis, HCl 10%, NaOH 10%, akuades, bahan-bahan
pemeriksaan PCR: Kit VNN lengkap 1 set, parafilm, bahan-bahan pemeriksaan
3.3Prosedur penelitian
3.3.1 Isolat Virus
Isolat virus berasal dari Dr. Uun Yanuhar-UNIBRAW-Malang. Ikan kerapu positif
VNN hasil diagnosis PCR diambil organnya untuk digunakan sebagai bahan suspensi
organ 10%. Ekstraksi virus dilakukan dengan metode Malole et al., (2006) yaitu
dengan cara menggerus mata dan otak ikan dengan mortar dan ditambahkan larutan
NaCI fisiologis, sehingga menghasilkan konsentrat virus 10%. Pada pelaksanaan
penggerusan ini, mortar dan larutan NaCl fisiologis dalam kondisi dingin. Hasil
gerusan yang telah halus, disentrifugasi pada 3000 rpm selama 15 menit dengan suhu
5°C. Supernatan diambil dengan syringe kemudian disaring dengan kertas saring
miliphore 0,45 µm. Hasil saringan merupakan inokulan baku virus VNN dan
ditambahkan Penicillin 10.000 IU dan Streptomicyin 10.000 µg. Supernatan
diencerkan dengan larutan Hank's Balauced Salt Solution (HBSS). Untuk keperluan
selama penelitian bahan inokulan virus ini kemudian diawetkan dalam deep freezer
(suhu -40°C).
3.3.2 Uji Fish Infectious Dosis-50 (FID50)
Penelitian diawali dengan uji pendahuluan yaitu mencari nilai FID50 dengan metode
Reed and Muench dalam Amrullah (2004) yaitu dengan cara menginfeksikan virus
VNN 0,1 ml/ekor ikan kerapu macan dengan konsentrasi 10-2 sampai 10-7 pada
masing-masing akuarium. Kemudian akuarium diisi air laut 10 L dan 6 ekor ikan.
Gejala klinis penyakit ikan diamati dan dicatat tingkat kesakitan ikan selama 7 hari.
Nilai FID50 dihitung dengan menggunakan rumus Reed and Muech. Hasil yang
didapatkan kemudian dijadikan sebagai konsentrasi virus yang akan diinfeksikan ke
benih ikan kerapu macan pada uji utama.
Rumus Reed and Muench 1938 dalam Amrullah (2004):
>50% - 50% PD =
Keterangan :
P.D = Proportionate Distance
>50% = Prosentase pengamatan di atas mendekati 50%
<50% = Prosentase pengamatan di bawah mendekati 50%
3.3.3 Pengaruh pH Terhadap Patogenitas VNN
Uji utama dilakukan untuk mengkaji pengaruh konsentrasi pH media air terhadap
tingkat patogenitas virus VNN pada benih kerapu macan. Perlakuan perbedaan
konsentrasi pH terdiri dari 6 (enam) perlakuan + 1 (satu) kontrol. Masing-masing
akuarium percobaan diisi dengan 10 ekor ikan kerapu macan. Perlakuan diaplikasikan
dengan tiga ulangan. Penginfeksian virus positif VNN dilakukan secara intramuscular
(Dosis FID50-72 jam). Pengamatan dilakukan selama 6 hari. Adapun rancangan
perlakuannya adalah sebagai berikut:
Po = Pemeliharaan kerapu macan negatif VNN (kontrol)
Pi = Pemeliharaan kerapu macan diinfeksi virus (+) VNN FID50 pada pH 6,0
Pii = Pemeliharaan kerapu macan diinfeksi virus (+) VNN FID50 pada pH 6,5
Piii = Pemeliharaan kerapu macan diinfeksi virus (+) VNN FID50 pada pH 7,0
Piv = Pemeliharaan kerapu macan diinfeksi virus (+) VNN FID50 pada pH 7,5
Pv = Pemeliharaan kerapu macan diinfeksi virus (+) VNN FID50 pada pH 8,0
Pvi = Pemeliharaan kerapu macan diinfeksi virus (+) VNN FID50 pada pH 8,5
3.3.4 Pengamatan Gejala Klinis
Pengamatan kesakitan/moribund ikan kerapu macan setelah diinfeksi virus VNN
dievaluasi setiap 3 jam sekali berdasarkan gejala klinis khas VNN pada setiap
perlakuan secara visual dan dicatat di tabel pengamatan. Ikan mati/sekarat (moribund)
yang menunjukkan gejala klinis khas VNN adalah kelesuan, perilaku renang abnormal
(gerakan memutar dan menabrak kasar), pembesaran gelembung renang (swim
bladder), perubahan warna tubuh ikan menjadi gelap dan hilangnya selera makan
Hasil pengamatan yang dilakukan pada setiap perlakuan digambarkan secara
sistematis dan jumlah ikan mati/sakit karena infeksi virus VNN pada masing-masing
perlakuan dihitung dari awal infeksi sampai hari ke 7. Persentase ikan mati/sakit
dihitung berdasarkan rumus Reed and Muench dalam Amrullah (2004):
Nt
I = X 100% No
Keterangan : I = Persentase ikan sakit karena terinfeksi VNN (%)
Nt = Jumlah ikan sakit terinfeksi VNN (ekor)
No = Jumlah ikan tiap unit percobaan (ekor)
3.3.5 Uji Hematologi
Pemeriksaan hematologi ikan uji (kontrol dan perlakuan) dilakukan dengan metode
Benjamin (1978). Pemeriksaan ini dilakukan setelah penginfeksian virus dan
timbulnya gejala klinis VNN. Sampel darah yang telah diberi antikoagulan EDTA
diambil untuk pemeriksaan hemoglobin (Hb), hematokrit (PCV), eritrosit, dan
leukosit. Pengambilan darah dilakukan di bagian caudal pudancle karena dekat
dengan tulang yang mengarah ke jantung.
Penentuan hemoglobin dilakukan dengan cara memasukkan Working Reagent
ke dalam 2 cuvet sebanyak 2,5 ml. Sampel dimasukkan ke dalam cuvet pertama, dan
akuades ke dalam cuvet kedua sebagai blank masing-masing 10 µ l, lalu
dihomogenkan masing- masing campuran dan dibiarkan selama tiga menit pada suhu
kamar. Untuk menentukan jumlah haemoglobin digunakan alat spektrofotometer.
Terlebih dahulu diatur panjang gelombang spektrofotometer pada 540 nm dan diatur
standarnya, lalu dinolkan dengan blank. Sampel dimasukkan dan dibaca hasilnya.
Penghitungan hematokrit dilakukan dengan cara memasukkan darah ke dalam
disentrifugasi pada 11.000 rpm selama 5 menit. Supernatan yang dihasilkan pada
tabung ditempatkan pada microhaematocrite reader untuk melihat nilai hematokrit.
Penghitungan jumlah eritrosit dilakukan dengan cara sampel darah dihisap
menggunakan pipet eritrosit sampai mencapai angka 0,5. Ujung pipet dibersihkan
dengan tissue. Setelah bersih, larutan Hayem dihisap sampai tanda 101 dengan cepat
tanpa menimbulkan gelembung udara. Pipa penghisap dilepaskan, lalu diaduk sampai
bagian yang tercampur hanya bagian yang membesar dari pipet. Cairan pada ujung
pipet yang tidak ikut terkocok dibuang. Suspensi darah diteteskan pada bagian pinggir
gelas penutup kamar hitung, dimana tetes 1-2 dibuang terlebih dahulu. Perhitungan
jumlah sel darah merah dilakukan pada kotak di bagian tengah kamar hitung sebanyak
5 kotak dimana 4 kotak di bagian sudut dan 1 kotak di bagian tengah dengan
menggunakan mikroskop. Selanjutnya jumlah eritrosit yang didapat dihitung
dengan menggunakan Hasil Perhitungan Akhir (HPA) yaitu jumlah seluruh sel darah
merah dari lima kotak tersebut (n butir) dikalikan 10.000 per ml (HPA= n x 10.000).
Penghitungan jumlah leukosit dilakukan dengan cara sampel darah dihisap
dengan menggunakan pipet penghisap sampai mencapai angka 0,5. Terlebih dulu
ujung pipet dibersihkan dengan kapas. Setelah bersih, larutan Turk dihisap sampai
tanda 11 dengan cepat tanpa menimbulkan gelembung udara. Pipa penghisap
dilepaskan, lalu diaduk sampai bagian yang tercampur hanya bagian yang membesar
dari pipet. Cairan pada ujung pipet yang tidak ikut terkocok dibuang. Suspensi darah
diteteskan pada bagian pinggir gelas penutup kamar hitung, dimana tetesan pertama
dibuang. Perhitungan jumlah sel darah putih dilakukan pada 4 kotak besar pada bagian
pinggir kamar hitung dengan menggunakan mikroskop. Selanjutnya jumlah leukosit
yang didapat dihitung dengan menggunakan Hasil Perhitungan Akhir (HPA) yaitu
jumlah seluruh sel darah putih dari lima kotak tersebut (n butir) dikalikan 50 per ml
Keterangan: E: Eritrosit, L: Leukosit
Gambar 1. Kamar Hitung Improved Neubauer (Zaneveld et al., 1977)
3.3.6 Pemeriksaan Histopatologi
Pembuatan sediaan histologis menurut Suntoro (1983), dengan metode parafin adalah:
fiksasi, dehidrasi, penjernihan, infiltrasi parafin, penanaman, penempelan,
pemotongan, penempelan, deparafinasi, pewarnaan, penutupan serta pemberian label.
Organ otak dicuci dengan NaCl 0,9% lalu difiksasi menggunakan Buffer Neutral
Formalin (BNF) 10% selama 1 jam. Jaringan dimasukkan ke dalam alkohol 70, 80,
96% selama 1,5 jam. Dehidrasi dilakukan dengan merendam otak dalam alkohol
absolut I,II,III selama 1 jam dan xylol I,II,III se1ama 5 jam. Infiltrasi dilakukan
dengan merendam otak pada parafin I,II yang dilakukan di dalam oven dengan suhu
56ºC selama 2 jam. Embedding dilakukan dengan meletakkan otak pada kaset
berbentuk segi empat sebagai cetakan. Setelah itu, parafin yang telah cair dituang ke
dalam kaset tersebut, dan diberi label. Kemudian blok-blok parafin yang telah di
holder dipotong dengan mikrotum sehingga membentuk pita-pita parafin dengan
ukuran ketebalan 4 µ m. Pita parafin diambil dengan skapel, diletakkan pada gelas
objek, dan dicelupkan pada air dingin dan air hangat. Kemudian diletakkan di atas
waterbath beberapa detik untuk melekatkan pita parafin pada gelas objek.
Preparat dimasukkan ke dalam xylol I, II, III dilanjutkan dengan proses dealkoholisasi
dengan mencelupkan preparat ke dalam alkohol absolut I, II, III selama 3 menit.
Pewarnaan sediaan otak diwarnai dengan menggunakan Hematoksilin Eosin.
Pewarnaan dilakukan dengan cara gelas objek dimasukkan ke dalam larutan pewarna E
E E
E
E
L L
Hematoksilin Eosin selama 3 menit lalu dicuci dengan dengan air mengalir. Preparat
ditetesi canada balsem dan ditutup dengan gelas penutup lalu diamati strukturnya di
bawah mikroskop.
3.3.7 Uji Biologi Molekuler
Ekstraksi RNA dilakukan dengan Metode Reverse Transcription Polimerase Chain
Reaction IQ2000 yaitu dengan memasukkan 20 mg sampel otak ke dalam tabung
mikro 1,5 ml dan dilarutkan dengan 500 µ l RNA Extraction Solution. Sampel digerus
sampai hancur, didiamkan pada suhu kamar selama 5 menit. CHCl3 ditambahkan
sebanyak 100 µ l, kemudian divortex selama 20 detik dan dibiarkan pada suhu kamar
selama 3 menit, lalu disentrifugasi pada 12.000 rpm selama 15 menit. Fase atas
(bagian jernih) sebanyak 200 µ l dimasukkan ke dalam tabung mikro 0,5 ml berisi 200
µ l isopropanol, lalu divortex. Larutan disentrifugasi pada 12000 rpm selama 10 menit,
lalu dibuang isopropanol. Pelet dicuci dengan 0,5 ml etanol 75%, kemudian di spin
down pada 9000 rpm selama 5 menit untuk mendapatkan pelet RNA, kemudian etanol
dituang dan pelet dikeringkan. Pelet dilarutkan dengan 200 µ l ddH2O. Campuran
RT-PCR dan Nested RT-PCR disiapkan sesuai jumlah sampel yang akan diuji dan
dimasukkan 8 µ l campuran reaksi reagen RT-PCR ke masing-masing tabung mikro
0,2 ml dan diberi label. Ekstrak sampel sebanyak 2 µ l ditambahkan ke dalam
masing-masing campuran reaksi. Sampel dimasukkan ke dalam mesin PCR untuk proses
amplikasi tahap I. Setelah tahap pertama selesai, proses tahap kedua dapat dilakukan
yaitu dengan menambahkan 15 µ l campuran reagen Nested PCR ke dalam
masing-masing tabung sampel dan dilakukan running PCR.
Proses elektroforesis dimulai dengan menyiapkan gel agarose 2% ( 2 gram
agarose yang dilarutkan dengan 100 ml TAE 1x) dan dimasukkan ke dalam
erlenmeyer, lalu larutan dipanaskan menggunakan microwave sampai mendidih dan
berubah menjadi bening. Gel agarosa didinginkan pada suhu kamar sampai suhu
sekitar 50oC dan gel dituangkan ke dalam kotak gel dengan ketinggian gel agarosa
(comb) dimasukkan untuk membentuk sumur. Setelah gel agarose memadat diangkat
comb pada kedua sisi kotak. Kotak gel ditambahkan buffer elektroforesis 1X sampai
batas maksimum. Marker dimasukkan ke sumur pertama sebanyak 5 µ l, dan diikuti
kontrol positif, kontrol negatif, dan terakhir sampel sebanyak 8 µ l. Running
elektroforesis dilakukan pada tegangan 100-150 Volt. Elektroforesis dihentikan bila
pita mendekati 2/3 dari gel. Kemudian, gel dikeluarkan dari kotak gel untuk
mempersiapkan prosedur pewarnaan EtBr.
Gel agarose hasil running elektrophoresis direndam ke dalam larutan
Ethidium Bromida (EtBr) 10 µl yang dicampur dengan 100 ml akuades pada wadah
plastik selama 10 menit dan sesekali digoyang. Kemudian gel agarose dikeluarkan dan
dicuci dengan akuades steril. Untuk membaca hasilnya, gel agarose diletakkan pada
pertengahan transilluminator UV gelombang dan dilihat hasilnya.
3.3.8 Analisis Data
Data yang didapat akan dianalisis dengan Uji Normalitas, Uji Homogenitas dan Uji t
BAB 4
HASIL DAN PEMBAHASAN
4.1 Nilai FID50
Untuk mendapatkan konsentrasi inokulan VNN yang akan diinjeksikan pada uji utama
dilakukan uji awal yaitu uji FID50 dengan melakukan pengenceran inokulum VNN
dari 10-2 sampai 10-7. Sebanyak 0,1 ml inokulum virus diinjeksikan ke benih ikan
kerapu macan/ekor dalam akuarium. Persentase kesakitan dari masing-masing
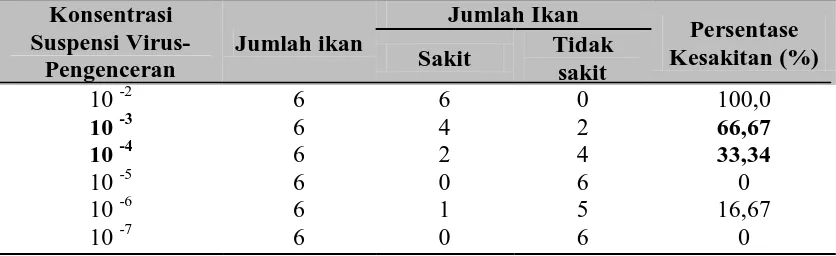
perlakuan dicatat dan hasilnya dapat dilihat pada Tabel 4.1 di bawah ini.
Tabel 4.1 Nilai FID50 selama 72 jam pada perlakuan benih ikan kerapu macan
SPF yang diinjeksi inokulan VNN
Berdasarkan hasil perhitungan FID50, konsentrasi suspensi virus VNN yang
akan digunakan pada uji utama memiliki nilai Proportionate Distance sebesar 0,50,
nilai FID50 suspensi virus VNN ekuivalen 10-4/0,1ml.
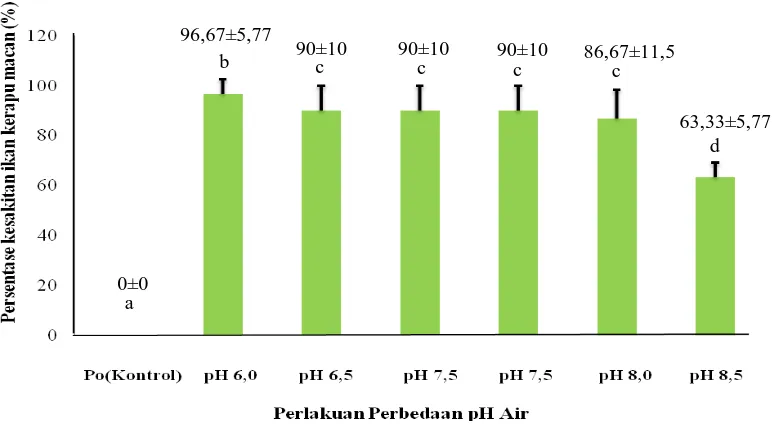
4.2 Pengaruh pH air Terhadap Tingkat Patogenitas VNN
Pengaruh nilai pH air pada penelitian ini dinilai berdasarkan persentase ikan terinfeksi
virus VNN yang sakit. Persentase kesakitan ikan selama penelitian pada
masing-masing perlakuan memiliki tingkat kesakitan yang tinggi rata-rata di atas 50%. Jumlah
persentase kesakitan ikan kerapu macan dapat dilihat pada Grafik 4.2 di bawah ini.
Gambar 4.2 Grafik Persentase Kesakitan Ikan Kerapu Macan Diinjeksi VNN
Dari Grafik 4.2 dapat dilihat bahwa tingkat kesakitan ikan yang tertinggi
terjadi pada perlakuan pH 6,0 sebesar 96,67% sedangkan tingkat kesakitan yang
terendah terjadi pada perlakuan pH 8,5 sebesar 63,33%. Perlakuan pH 6,5, pH 7,0 dan
pH 7,5 terjadi tingkat kesakitan yang sama yaitu sekitar 90% dan pada perlakuaan pH
8,0 terjadi kesakitan sebesar 86,67% selama 6 hari pengamatan, sedangkan Po
(kontrol) tidak terjadi kesakitan.
Data yang didapat tidak menyebar secara normal (p<0,05) dan tidak bervarians
homogen (p<0,05), oleh karena itu, dilakukan Uji Non Parametrik Mann-Whitney.
Dari uji yang dilakukan didapat bahwa perlakuan kontrol memiliki nilai yang berbeda
nyata terhadap perlakuan lainnya. Hasil yang tidak berbeda nyata didapat pada
a
b c c c c
d 96,67±5,77
90±10 90±10 90±10 86,67±11,5
63,33±5,77
perlakuan pH 6,5, pH 7,0 dan pH 7,5 sedangkan perlakuan pH 8,5 berbeda nyata
terhadap perlakuan lainnya. Menurut Yukio (2004), infeksi VNN secara alami bersifat
akut. Keparahan penyakit dipengaruhi oleh faktor-faktor stres seperti padat penebaran
tinggi dan suhu air yang tinggi di keramba budidaya. Kombinasi faktor-faktor ini
dapat menyebabkan kematian tinggi selama periode pemeliharaan. Perbedaan angka
kematian mungkin disebabkan oleh tahap perkembangan sistem kekebalan tubuh ikan
kerapu atau tingkat infeksi yang rendah.
Menurut Irawan et al., (2009), perairan dengan pH rendah mengakibatkan
aktivitas tubuh ikan menurun dan kondisi ikan menjadi lemah, sehingga ikan mudah
terkena infeksi penyakit dan bahkan menyebabkan kematian pada ikan. Hal ini dapat
dilihat dari persentase tingkat kesakitan tertinggi yang didapat pada perlakuan pH 6,0
yaitu pH asam, dibandingkan dengan persentase tingkat kesakitan terendah pada
perlakuan pH 8,5 atau pH basa. Nilai persentase kematian yang tinggi merupakan
salah satu gambaran ganasnya/kuatnya infeksi virus. Menurut Irianto (2005), tingkat
patogenitas suatu penyakit meliputi suatu interaksi yang kompleks antara tingkat
virulensi patogen, derajat imunitas inang, kondisi fisiologis dan genetik hewan.
Infeksi virus pada sel-sel inang akan merangsang sistem pertahanan tubuh inang. Pada
tingkat infeksi berat mekanisme pertahanan tubuh akan tertekan dan hewan inang
dalam hal ini ikan, akan mati
Menurut Gufran & Kordi (2004), ikan kerapu macan dapat hidup dengan baik
pada pH 7,8-8,3. Dari data tersebut, dapat diketahui bahwa pH air di bawah 7,8 akan
meyebabkan keadaan stres pada ikan kerapu macan sehingga menyebabkan kematian
yang cukup tinggi didukung dengan infeksi dari VNN. Stres juga akan mempengaruhi
faktor perlindungan alami ikan seperti mukus, sisik, kulit, lisozim, antibodi dan reaksi
4.3Gejala Klinis Akibat Infeksi VNN
Keasaman (pH) sangat penting sebagai parameter kualitas air karena dapat mengontrol
tipe dan laju kecepatan reaksi beberapa bahan di dalam air. Pengamatan harian yang
dilakukan setelah infeksi virus VNN menunjukkan bahwa awal terjadinya gejala klinis
pada ikan kerapu macan pada setiap perlakuan pH air adalah berbeda.
Ikan yang diinjeksikan virus pada perlakuan pH air yang berbeda mengalami
gejala klinis abnormal paling cepat yaitu terjadi mulai hari ke-3 hingga terjadi
kematian. Hal ini sesuai dengan studi yang dilakukan Chi (2001) yang menyatakan
bahwa kematian pada ikan kerapu yang diinjeksikan oleh VNN pada ikan sehat dapat
mencapai kematian hingga 100% dalam waktu 3 hari.
Pada hari ke-4 sampai hari ke-5 pada masing-masing ulangan, tanda-tanda
ikan terinfeksi semakin jelas terlihat adanya beberapa ikan berenang tak menentu dan
ikan mengapung dengan perut diatas disebabkan oleh pembengkakan gelembung
renang (swim bladder), perubahan warna (discolouration) tubuh terlihat lebih gelap.
Pada hari ke-6 mulai terlihat beberapa ikan yang lebih parah mengapung dengan
posisi kepala mengarah ke permukaan air dan ekor ke arah bawah. Gejala klinisnya
dapat dilihat dari Gambar 4.3 di bawah ini.
Gambar 4.3 a) Gerakan berenang ikan dengan posisi kepala di bawah. b) Gerakan berenang ikan tidak menentu. c) Pembengkakan gelembung renang pada ikan. d) Perubahan warna tubuh ikan menjadi lebih gelap.
4.4 Uji Hematologi
Pemeriksaan hematologi yang dilakukan dari masing-masing perlakuan menunjukkan
hasil yang berbeda. Terjadi penurunan jumlah sel darah dari keadaan normal pada
beberapa perlakuan. Hal ini disebabkan oleh pengaruh adanya serangan VNN pada
darah dan mempengaruhi jumlah sel darah. Hasil pemeriksaan hematologi ikan kerapu
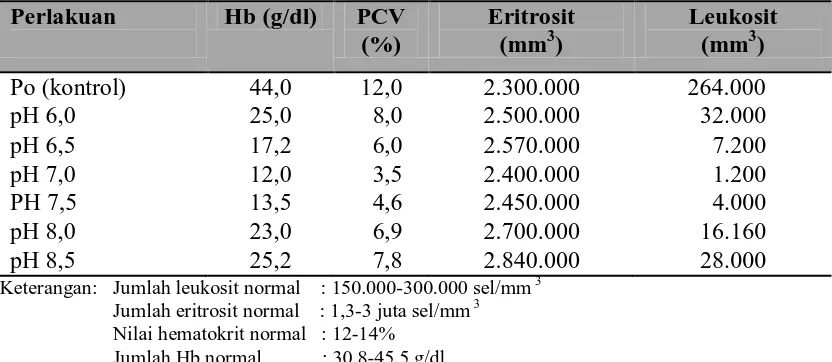
macan yang diinjeksi VNN dapat dilihat dari Tabel 4.4 di bawah ini.
Tabel 4.4 Hasil Uji Hematologi
Keterangan: Jumlah leukosit normal : 150.000-300.000 sel/mm 3 Jumlah eritrosit normal : 1,3-3 juta sel/mm 3 Nilai hematokrit normal : 12-14%
Jumlah Hb normal : 30,8-45,5 g/dl
Berdasarkan Tabel 4.4 di atas dapat diketahui bahwa pada masing-masing
perlakuan terjadi perubahan jumlah sel darah dari jumlah normal. Menurut Alamanda
et al., (2007), pada ikan yang terserang penyakit terjadi perubahan pada nilai
hematokrit, kadar hemoglobin, jumlah eritrosit dan jumlah leukosit. Penurunan jumlah
leukosit terendah didapat pada perlakuan pH 7,0 yaitu 1.200 sel/mm3 dan diikuti pada
perlakuan pH 7,5 sebesar 4.000 sel/mm3 dan pH 6,5 sebesar 7.400 sel/mm3, sedangkan
jumlah leukosit tertinggi didapat pada perlakuan pH 8,5 sebesar 28.000 sel/mm3.
Jumlah leukosit pada masing-masing perlakuan dibandingkan dengan jumlah leukosit
normal sebesar 150.000-300.000 sel/mm3. Penurunan ini sebagai akibat dari kuatnya
infeksi virus. Leukosit yang ada pada pembuluh darah sangat berkurang karena
sebagian besar leukosit bergerak menuju jaringan-jaringan yang terinfeksi.
Leukositosis terjadi apabila ada benda asing dalam darah. Jika virus terus menyerang,
maka kekebalan tubuh menurun sehingga terjadi leukopenia. Ketidakmampuan sistem
imunitas ikan dalam menghadapi infeksi virus, terlihat dari jumlah leukosit ikan yang
menurun. Hasil ini sesuai dengan studi yang dilakukan Hendriyanto et al., (2007),
mengenai infeksi KHV pada ikan mas dinyatakan bahwa kondisi ketidakmampuan
sistem imunitas ikan dalam menghadapi infeksi ditandai dengan semakin menurunnya
jumlah leukosit.
Jumlah eritrosit, pada masing-masing perlakuan didapat jumlah yang normal
berkisar antara 2,30-2,84 juta sel/mm3 dirujuk dari jumlah eritrosit normal sebesar
1,3-3 juta sel/ mm3. Kadar hematokrit normal didapat pada perlakuan Po (kontrol) sebesar
12% dirujuk dari nilai hematokrit ikan normal sekitar 12-14% sedangkan pada
perlakuan lainnya terjadi penurunan dengan kadar hematokrit berkisar antara
3,5-8,0%. Jumlah hematokrit terendah didapat pada perlakuan pH 7,0 sebesar 3,5%.
Menurut Anderson (1996), menurunnya kadar hematokrit dapat dijadikan petunjuk
mengenai rendahnya kandungan protein pakan, defisiensi vitamin atau ikan mendapat
infeksi, sedangkan meningkatnya kadar hematokrit, menunjukkan ikan ada dalam
keadaan stres. Apabila ikan terkena penyakit atau nafsu makannya menurun, nilai
hematokrit darahnya menjadi tidak normal. Jika nilai hematokrit rendah maka jumlah
eritrositpun rendah (Bastiawan et al., (2001) dalam Alamanda et al., 2007).
Jumlah hemoglobin tertinggi didapat pada perlakuan Po (kontrol) sebesar 44,0
g/dl dan terendah pada perlakuan pH 7,0 sebesar 12,0 g/dl. Jumlah normal
hemoglobin ikan yaitu sekitar 30,8-45,5 g/dl. Dapat dikatakan, bahwa pada perlakuan
kontrol jumlah hemoglobin normal sedangkan pada perlakuan yang diinjeksi virus
VNN mengalami penurunan nilai hemoglobin dari nilai normal. Menurut Bastiawan et
al., (2001) dalam Alamanda et al., 2007), kemampuan mengikat oksigen dalam darah
tergantung pada jumlah hemoglobin yang terdapat dalam sel darah merah. Rendahnya
kadar Hb menyebabkan laju metabolisme menurun dan energi yang dihasilkan
menjadi rendah. Hal ini membuat ikan menjadi lemah dan tidak memiliki nafsu makan
serta terlihat diam di dasar atau menggantung di bawah permukaan air. Menurut
Irianto (2005), sejumlah ikan pada pH rendah, maka kapasitas hemoglobin dalam
membawa oksigen juga rendah. Pada pH 7,4 laju oksigenasi empat kali lipat lebih
cepat daripada laju deoksigenasi di insang. Pada pH rendah pada jaringan yang aktif
4.5Pemeriksaan Histopatologi
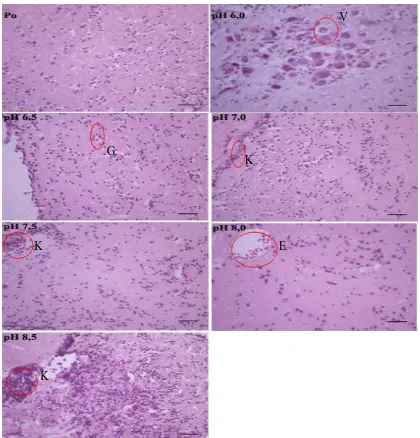
Gambaran histopatologi pada sampel otak masing-masing perlakuan memperlihatkan
kerusakan yang sama (Gambar 4.5). Namun kerusakan terparah terjadi pada perlakuan
pH 6,0 ditandai dengan adanya kongesti, peningkatan sel-sel glia, terbentuknya halo di
sekitar sel glia dan neuron yang menunjukkan adanya edema serta ditemukan adanya
vaskulitis. Dari pengamatan organ otak pada Po (kontrol) terlihat adanya sedikit
peningkatan sel-sel glia dan kongesti di beberapa bagian otak walaupun struktur otak
relatif masih terlihat normal. Pada perlakuan pH 6,5, pH 7,0, pH 7,5, pH 8,0 dan pH
8,5 tampak adanya kongesti yang disertai dengan adanya penggumpalan atau
akumulasi sel-sel radang dan sel-sel glia yang berkelompok secara umum dan
terjadinya vaskulitis.
Menurut Munday (1997), bahwa pada pengamatan mikroskop cahaya,
histopatologi serangan VNN ditandai dengan vakuolisasi dan nekrosis dari sistem
saraf pusat yang sangat konsisten pada berbagai spesies. Secara umum, anterior otak
lebih parah terkena dampak dari pada sumsum tulang belakang posterior dan stadia
larva lebih parah terkena dampak dari stadia remaja. Kerusakan yang paling khas
adalah adanya vakuolisasi pada otak menyebabkan intrasitoplasmik. Namun posisi
yang tepat tidak selalu dapat ditentukan. Kerusakan lainnya dicatat termasuk piknosis,
sel basophilia, kariorrhesis sel saraf, granularitas neuropil dan akumulasi bahan
eosinophilik dalam makrofag dan dinding pembuluh darah.
Menurut Moody & Horwood (2008), kerusakan biasanya kurang parah pada
ikan lebih tua dari ikan remaja dan tergantung pada umur ikan. Keparahan vakualisasi
bisa berkisar dari satu atau dua sel yang berpengaruh terhadap nekrosis ke seluruh
daerah di otak. Secara umum, vakuolasasi terjadi lebih sering pada tektum optik dan
otak kecil daripada di telencephalon dan medula oblongata. Infeksi virus pada sel-sel
inang akan merangsang sistem pertahanan tubuh inang. Pada tingkat infeksi berat
maka mekanisme pertahanan tubuh akan tertekan dan hewan inang dalam hal ini ikan
Gambar 4.5 Histopatologi Otak Ikan Kerapu Macan yang Diinjeksikan VNN pada Masing-Masing Perlakuan pH dengan Pewarnaan HE dan
Pembesaran 400x (V: Vasculitis, K: Kongesti, E:Edema, G:Sel glia, = 10 µm )
4.6Diagnosis Reverse Transcriptase-PCR
Tingkat patogenitas VNN pada benih ikan kerapu macan yang sakit dapat diketahui
dengan metode Reverse Transcriptase-PCR. Sampel otak dari masing-masing
perlakuan diambil dan dilakukan running PCR sehingga diketahui tingkat patogenitas
VNN. Hasil diagnosis RT-PCR dapat dilihat pada Gambar 4.6 di bawah ini. K
K K E
G
K E
K
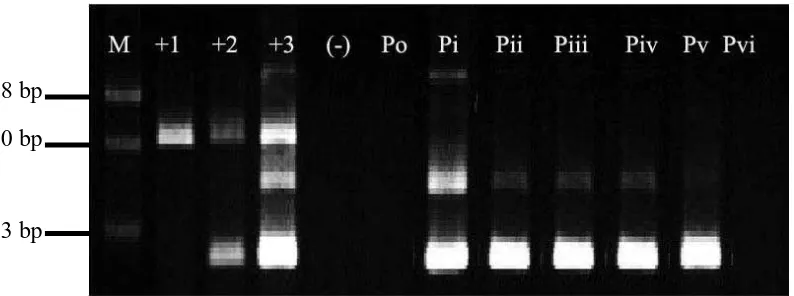
Gambar 4.6 Hasil Diagnosis RT-PCR
Po : Sampel kontrol negatif
Pi : Sampel pH 6,0 dengan tingkat infeksi berat Pii : Sampel pH 6,5 dengan tingkat infeksi sedang Piii : Sampel pH 7,0 dengan tingkat infeksi sedang Piv : Sampel pH 7,5 dengan tingkat infeksi sedang Pv : Sampel pH 8,0 dengan tingkat infeksi sedang Pvi : Sampel pH 8,5 negatif
Dari hasil diagnosis RT-PCR di atas dapat dilihat bahwa sampel ikan kerapu
macan diinfeksi virus VNN pada perlakuan konsentrasi pH yang berbeda adalah
positif VNN, ditunjukkan dengan adanya pita RNA virus pada pasangan basa yang
sejajar dengan kontrol positif. Namun pada perlakuan Pvi didapat hasil yang negatif.
Hal ini mungkin disebabkan oleh tingkat patogenitas virus yang cukup rendah
sehingga fragmen RNA virus tidak terdeteksi dalam proses Nested PCR. Tingkat
patogenitas yang berat didapat pada sampel perlakuan pH 6,0 ditandai dengan adanya
fragmen RNA pada 848 bp, 630 bp, 333 bp. Tingkat patogenitas yang sedang didapat
pada sampel perlakuan pH 6,5, pH 7,0, dan pH 7,5 ditandai dengan adanya fragmen
RNA pada 630 bp dan 333 bp.
Menurut Moody & Horwood (2008), hasil positif Nested RT-PCR dari
jaringan ikan mengindikasikan keberadaan RNA Nodavirus pada sampel. Hasil
negatif nested RT-PCR mengindikasikan ketidakberadaan RNA virus pada sampel.
Bagaimanapun juga, hasil positif Nested RT-PCR tidak mengindikasikan apakah
sampel menular. Amplikasi positif hasil nested RT-PCR yang tercatat sebelumnya 848 bp
630 bp
dari spesies atau lokasi geografi dimana infeksi Betanovirus menginfeksi belum
disekuensing, seharusnya dilakukan sekuensing sehingga dapat dibandingkan dengan
sekuens Betanovirus yang telah diketahui untuk mengkonfirmasi hasil. Hal ini penting
ketika test diagnosis lainnya telah digunakan. Seperti yang dilakukan oleh Munday &
Nakai (1997) pada larva dan juvenil ikan kembung (Pseudocaranx dentex), digunakan
metode ELISA (Enzyme Linked Immunosurbent Assay) dengan menggunakan
antiserum SJNNV (Stripe Jack Nervous Necrosis Virus) yang telah berkembang dan
cukup sensitif untuk mendeteksi virus ini. Namun sayangnya, uji ini tidak dapat
digunakan untuk jenis virus nekrosis lainnya. Berdasarkan data sekuens RNA2 dari
SJNNV, teknik RT-PCR telah berkembang untuk mendeteksi SJNNV. Teknik ini
dapat digunakan untuk mengaplikasikan sekitar 100 fragmen asam nukleat SJNNV
dan telah berhasil digunakan untuk mendeteksi awal infeksi SJNNV pada ikan kerapu
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil yang didapat dapat disimpulkan bahwa:
a. Persentase kematian tertinggi ikan kerapu macan yang diinjeksi VNN terjadi pada
perlakuan pada pH 6,0 sebesar 96,67% dan terendah pada perlakuan pH 8,5 sebesar
63,33%.
b. Kerusakan jaringan yang disebabkan oleh VNN pada perlakuan pH 6,0 lebih parah
dibandingkan dengan perlakuan pH lainnya.
c. Jumlah sel darah pada semua perlakuan yang diinjeksi virus VNN mengalami
penurunan.
d. Hasil diagnosis RT-PCR membuktikan bahwa ikan kerapu macan positif terserang
VNN dengan tingkat patogenitas yang berbeda.
5.2 Saran
Diharapkan adanya penelitian lanjutan untuk mengetahui tingkat kerusakan organ
bagian dalam dari ikan kerapu macan yang terserang VNN agar didapat data yang
DAFTAR PUSTAKA
Akbar S. & Sudaryanto. 2001. Pembenihan dan Pembesaran Ikan Kerapu Bebek. Jakarta: Penebar Swadaya. hlm. 103.
Alamanda, I.E., Hanjadani, N.S., dan Budiharjo, A. 2007. Penggunaan Metode Hematologi dan Pengamatan Endoparasit Darah untuk Penetapan Kesehatan Ikan Lele Dumbo (Clarias gariepinus) di Kolam Budidaya Desa Mangkubumen Boyolali. Biodiversitas. 8(1): 34-38.
Amrullah. 2004. Penggunaan Imunostimulan Spirulina platensis untuk Meningkatkan Ketahanan Tubuh Ikan Koi (Cyprinus carpio) terhadap Virus Herpes (Thesis). Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Anonim. 2001. Pembudidayaan dan Manajemen Kesehatan Ikan Kerapu SEAFDEC. Departemen Kelompok Kerja Perikanan APEC (Aquaculture Departemen Southeast Asia Fisheries Development Center).
---, 2004. Budidaya Laut. Departemen Kelautan dan Perikanan, Direktorat Jenderal Perikanan Budidaya. Balai Budidaya Laut Laut. Lampung.
---, 2004. Petunjuk Teknis Budidaya Laut Ikan Kerapu. Departemen Kelautan dan Perikanan, Direktorat Jenderal Perikanan Budidaya. Direktorat Pembudidayaan. Seri II/BDL/04. 42.
Bastiawan, D., Wahid, A., Malifudin, & Agustiawan, I. 2001. Gambaran Darah Lele Dumbo (Clarias spp.) yang Diinfeksi Cendawan Alphanomyces sp pada pH yang Berbeda. Jurnal Penelitian Indonesia. 7(3):44-47.
Benjamin, M.M. 1978. Outline of Veterinary Clinical Pathology. Third Edition. USA: The IOWA State University Press Ames. hlm. 48-55.
Burgess, W.E., Axelrod, H.R. & Raymond E.H. 1990. Marine Aquarium Fishes. T.F.H. Publications Inc. USA. 3rd edition.
Chua, T. E. & Teng, S. K. 1978. Effects of Feeding Frequency on The Growth of Young Estuary Grouper, Epinephelus tauvina Forskal, Culture in Floating Net Cages. Aquaculture. 14: 31–47.
Chi, S.C., Lo, B. J. & Lin, S. C. 2001. Characterization of Grouper Nervous Necrosis Virus (GNNV). Journal of Fish Diseases. 24. 3-13.
Daelami, D. 2002. Agar Ikan Sehat. Jakarta: Penebar Swadaya. hlm. 27.
Effendi. 2003. Telaah Kualitas Air bagi Pengelolaan Sumberdaya dan Lingkungan
Perairan. Yogjakarta: Kanisius. hlm. 17.
Endrawati, H., Zainuri, M., Kusdiyantini, E. & Kusumaningrum, H.P. 2008. Pertumbuhan Juvenil Ikan Kerapu Macan (Epinephelus fuscoguttatus) yang Dipelihara dengan Padat Penebaran Berbeda. Ilmu Kelautan. 13(3): 133-138.
Feliatra, Irwan, E. & Edwar, S. 2004. Isolasi dan Identifikasi Bakteri Probiotik dari Ikan Kerapu Macan (Ephinephelus fuscogatus) dalam Upaya Efisiensi Pakan Ikan. Jurnal Natur Indonesia. 6(2): 75-80.
Hendriyanto, D.A., Martono, Setyawan, D.A., Lilianti & Damayanti, R. 2007. Aplikasi Vitamin C pada Kasus Infeksi KHV Ikan mas (Cyprinus carpio) di Sumatera Utara. Uji Coba Balai Karantina Ikan Polonia. hlm. 1-34.
Ghufran, H. & Kordi, K. 2004. Budidaya Ikan Laut di Keramba Jaring Apung. Jakarta: Rineka Cipta. hlm. 28.
---, Penanggulangan Hama dan Penyakit Ikan. Jakarta: Bina Adiaksara. hlm. 175.
Irawan, A., Aminullah, Dahlan, Ismail, Bahri, S., & Fahdian, Y. 2009. Faktor –
Faktor Penting dalam Proses Pembesaran Ikan di Fasilitas Nursery dan Pembesaran. Makalah Bidang Kosentrasi Aquaculture Program Alih Jenjang
Diploma IV ITB. hlm 1-17.
Irianto, A. 2005. Patologi Ikan Teleostei. Yogyakarta: Gadjah Mada University Press. hlm. 117.
Ibrahim, E. S. 2010. Teknik Pemeliharaan Larva Kerapu Macan (Epinephelus
fuscoguttatus).
Jutono, H., Kabiru, S.S., Susanto, Judoro & Suhardi. 1975. Mikrobiologi untuk
Perguruan Tinggi. Yogyakarta: Fakultas Pertanian UGM. hlm. 78.
Langkosono. 2007. Budidaya Ikan Kerapu (Serranidae) dan Kualitas Perikanan.
Neptunus. 14(1): 61-67.
Maghfirah, H. Teknik Pemeliharaan Ikan Kerapu Macan (Epinephelus fuscoguttatus) di CV. Dewata Laut, Desa Penyabangan. Kecamatan Gerokgak, Kabupaten Buleleng, Bali.
Malole, M.B.M., Murtini, S. & Farida, C.Z. 2006. Modul Praktikum Penyakit Viral
Ikan. hlm. 7.
Munday, B.L. & Nakai, T. 1997. Special Topic Review: Nodaviruses as Pathogen in Larva and Juvenile marine Finfish. World journal of Microbiology and
Biotechnology. 13:375-381.
Purnamawati. 2002. Peranan Kualitas Air Terhadap Keberhasilan Budidaya Ikan di Kolam. Warta Penelitian Perikanan Indonesia. 8(1): 1-34.
Setyadi, I. 2007. Produksi Masal Larva Ikan Kerapu Pasir (Epinephelus Corallicola) dengan Ukuran Bak Berbeda. Jurnal Penelitian Perikanan Indonesia. 14: 42
-47.
Sudirman, H., Karim, M. Y. 2008. Ikan Kerapu. Biologi, Eksploitasi, Manajemen dan
Budidaya. Jakarta: Yarsif Watampone. hlm. 9.
Sugianti, B. 2005. Pemanfaatan Tumbuhan Obat Tradisional dalam Pengendalian Penyakit Ikan. 1-37.
Suratmi, S., Aryani, N.L.T. 2007. Kasus Infeksi Penyakit Viral Nervous Necrosis (VNN) pada Ikan Kerapu di Pulau Bali. Buletin Teknisi Litkayasa Akuakultur. 7(1):59-63.
Sutarmat, T. 2004. Beberapa Kunci Sukses pada Budidaya Kerapu di Keramba Jaring Apung. Warta Penelitian Perikanan Indonesia. 10(4): 1-3.
Romimohtarto, K. 2008. Kualitas Air Dalam Budidaya Laut.Freedom eLearning Of Open Source. 1-16.
Thie´ry, R., J. Cozien, J. Cabon, F. Lamour, M. Baud, and A. Schneemann. 2006. Induction of a Protective Immune Response against Viral Nervous Necrosis in the European Sea Bass Dicentrarchus labrax by Using Betanodavirus Virus-Like Particles. Jurnal of Virology. 80(20): 10201-10207.
Yuasa, K.I., Koesharyani, D. Roza, F. Jhony, and Zafran. 2001. Manual for PCR Procedure; Rapid diagnosis on Viral Nervous Necrosis (VNN) in Grouper. Lolitkanta-JICA Booklet. 13- 35.
Yukio, M., Leobert, D. D. & Erlinda, R. C. 2007. Susceptibility of Fish Species Cultured
in Mangrove. Japan Agricultural Research Quarterly. 41(1). 95-99.
---, 2004. Mass Mortalities Associated with Viral Nervous Necrosis in
Hatchery-Reared Sea Bass Lates calcarifer in the Philippines. Japan Agricultural
Research Quarterly. 38(1): 69-73.
Zaneveld, Polakoski (1977), Techniques of Human Andrology: 160 dalam Zaneveld L.J.D., Fulgham DL. 1986. Short course: Male Reproduction/Andrology and
Lampiran A. Data Persentase Kesakitan Ikan
Perlakuan
Ulangan
% Total Kesakitan % Rata-Rata Kesakitan
I II III
Po(Kontrol) 0 0 0 0 0
pH 6,0 100 90 100 290 96,67
pH 6,5 80 100 90 270 90,00
pH 7,0 90 100 80 270 90,00
pH 7,5 80 90 100 270 90,00
pH 8,0 100 80 80 260 86,67
pH 8,5 60 60 70 190 63,33
Keterangan:
a. Waktu pengamatan dilakukan selama 6 hari dan dicatat kesakitan ikan setiap hari.
Lampiran B. Data Uji Normalitas, Non Parametrik Mann-Whitney
Tests of Normality(b)
Perlakuan
Kolmogorov-Smirnov(a) Shapiro-Wilk Sig. Statistic df Sig. Statistic df a. Liliefors significance Correction
b. Kesakitan is contant when perlakuan = Po. It has been omitted
Npar Tests a. Kruskal Wallis Test
Npar Test (Mann-Whitney Test)
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Test Statisticb
Kesakitan
Mann-Whitney U 0
Wilcoxon W 6
Z -2,12132
Asymp. Sig. (2-tailed) 0,033895 Exact Sig. [2*(1-tailed
Sig.)] 0,1a
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Asymp. Sig. (2-tailed) 0,036904 Exact Sig. [2*(1-tailed
Sig.)] 0,1a
a. Not corrected for ties
Npar Test (Mann-Whitney Test) a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Asymp. Sig. (2-tailed) 0,036904 Exact Sig. [2*(1-tailed
Sig.)] 0,1a
a. Not corrected for ties
Npar Test (Mann-Whitney Test)
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Asymp. Sig. (2-tailed) 0,033895 Exact Sig. [2*(1-tailed
Sig.)] 0,1a
c. Not corrected for ties
d. Grouping Variable: Perlakuan Test Statistics(b)
Kesakitan
Mann-Whitney U 0
Wilcoxon W 6
Z -2,12132
Asymp. Sig. (2-tailed) 0,033895 Exact Sig. [2*(1-tailed
Npar Test (Mann-Whitney Test)
Asymp. Sig. (2-tailed) 0,345779 Exact Sig. [2*(1-tailed
Sig.)] 0,4a
a. Not corrected for ties b. Grouping Variable:
Npar Test (Mann-Whitney Test)
Rank
Asymp. Sig. (2-tailed) 0,345779 Exact Sig. [2*(1-tailed
Sig.)] 0,4a
a. Not corrected for ties
Npar Test (Mann-Whitney Test)
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Asymp. Sig. (2-tailed) 0,345779 Exact Sig. [2*(1-tailed
Sig.)] 0,400a
a. Not corrected for ties
Npar Test (Mann-Whitney Test)
Asymp. Sig. (2-tailed) 0,043114 Exact Sig. [2*(1-tailed
Sig.)] 0,100a
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Mann-Whitney U 4,500
Wilcoxon W 10,500
Z ,000
Asymp. Sig. (2-tailed) 1,000 Exact Sig. [2*(1-tailed
Sig.)] 1,000a
a. Not corrected for ties
Npar Test (Mann-Whitney Test)
Mann-Whitney U 4,500
Wilcoxon W 10,500
Z ,000
Asymp. Sig. (2-tailed) 1,000 Exact Sig. [2*(1-tailed
Sig.)] 1,000a
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Asymp. Sig. (2-tailed) 0,637352 Exact Sig. [2*(1-tailed
Sig.)] 0,7
a. Not corrected for ties
Npar Test (Mann-Whitney Test)
a. Not corrected for ties
b. Grouping Variable: Perlakuan
Npar Test (Mann-Whitney Test)
Rank
Mann-Whitney U 4,500
Wilcoxon W 10,500
Z ,000
Asymp. Sig. (2-tailed) 1,000 Exact Sig. [2*(1-tailed Sig.)] 1,000a a. Not corrected for ties
b. Grouping Variable: Perlakuan Test Statistics(b)
Kesakitan
Mann-Whitney U 0
Wilcoxon W 6
Z -1,99263
Asymp. Sig. (2-tailed) 0,046302 Exact Sig. [2*(1-tailed