PENGARUH KONSENTRASI DAN LAMA PERENDAMAN ASAM SULFAT (H2SO4) TERHADAP VIABILITAS BENIH DELIMA (Punica granatum L.)
SKRIPSI
OLEH:
ILHAM INDRA SATYA 110301051
AGROEKOTEKNOLOGI
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
PENGARUH KONSENTRASI DAN LAMA PERENDAMAN ASAM SULFAT (H2SO4) TERHADAP VIABILITAS BENIH DELIMA (Punica granatum L.)
SKRIPSI
OLEH:
ILHAM INDRA SATYA 110301051
AGROEKOTEKNOLOGI
Skripsi sebagai salah satu syarat memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
Judul Skripsi : Pengaruh Konsentrasi dan Lama Perendaman Asam Sulfat (H2SO4) Terhadap Viabilitas Benih Delima
(Punica granatum L.) Nama : Ilham Indra Satya
NIM : 110301051
Program Studi : Agroekoteknologi
Minat : Budidaya Pertanian dan Perkebunan
Disetujui Oleh :
(Ir. Haryati, MP) (Ir. Toga Simanungkalit, MP) Ketua Komisi Pembimbing Anggota Komisi Pembimbing
Diketahui Oleh
ABSTRACT
ILHAM INDRA SATYA : Effect of Concentration and Duration of Soaking
Sulphuric Acid (H2SO4) on The Viability of Pomegranate Seed (Punica granatum L.). Supervised by HARYATI and TOGA SIMANUNGKALIT.
Pomegranate seed requires dormancy breaking treatment to encourage germination. One of dormancy breaking treatments that can be done is setting the concentration and duration of soaking sulphuric acid (H2SO4) . This study aimed to determine the effect of concentration and duration of soaking sulphuric acid
(H2SO4) on the viability of pomegranate seeds. This research was conducted at the Laboratory of Seed Technology Faculty of Agriculture, University of North Sumatra, Medan with a height of ± 25 meters above sea level, in April 2015, using a completely randomized design with 10 degree factor dormancy breaking treatments that seed soaking treatment with H2SO4 (25%, 50%, 75%) with
duration of soaking (10 minutes, 15 minutes, and 20 minutes). Parameters measured were moisture content (%), experiment of tetrazolium(%), germination rate (day), normal seedling (%), abnormal seedling (%), seed that has not grown (%), vigor index (seedling in one day), fresh weight (gr), dry weight (gr).
The results showed that seed soaking treatment with 75% H2SO4 for 10
minutes increased the percentage of moisture content (%),germination rate (day), normal seedling (%),vigor index (seedling in one day), fresh weight (g), dry weight (g), but not to experiment of tetrazolium (%).
ABSTRAK
ILHAM INDRA SATYA : Pengaruh Konsentrasi dan Lama Perendaman Asam Sulfat (H2SO4) Terhadap Viabilitas Benih Delima (Punica granatum L.).
Dibimbing oleh HARYATI dan TOGA SIMANUNGKALIT.
Benih delima membutuhkan perlakuan pematahan dormansi untuk mendorong perkecambahannya. Salah satu perlakuan pematahan dormansi yang dapat dilakukan adalah dengan cara mengatur konsentrasi dan lama perendaman asam sulfat (H2SO4). Penelitian ini bertujuan untuk mengetahui pengaruh
perlakuan konsentrasi dan lama perendaman asam sulfat (H2SO4) terhadap
viabilitas benih delima. Penelitian ini dilaksanakan di Laboratorium Teknologi Benih Fakultas Pertanian Universitas Sumatera Utara Medan dengan ketinggian + 25 meter dpl, bulan April 2015 dengan menggunakan rancangan acak lengkap satu faktor dengan 10 taraf perlakuan pematahan dormansi yaitu perlakuan perendaman benih dengan H2SO4 (25%, 50%, 75%) dengan masing-masing
waktu perendaman (10 menit, 15 menit, dan 20 menit). Parameter yang diamati adalah kadar air (%), uji tetrazolium (%), laju perkecambahan (hari), kecambah normal (%), kecambah abnormal (%), benih yang belum tumbuh (%), indeks vigor (benih berkecambah/hari), bobot basah (g), bobot kering (g).
Hasil penelitian menunjukkan bahwa perlakuan perendaman benih dengan H2SO4 75% selama 10 menit berpengaruh meningkatkan kadar air, persentase laju
perkecambahan, persentase kecambah normal, indeks vigor, bobot basah, dan bobot kering, tetapi tidak untuk pengujian tetrazolium.
RIWAYAT HIDUP
Penulis dilahirkan di Galang pada tanggal 18 Oktober 1992. Anak ke enam dari enam bersaudara dari Bapak Rasimin dan Ibu Supinawaty.
Penulis menyelesaikan Sekolah Dasar di Negeri101891 Galang, pada tahun 2004, Sekolah Menengah Pertama di Negeri 1 Lubuk Pakam pada tahun 2007, Sekolah Menengah Atas di Negeri 1 Lubuk Pakam pada tahun 2010. Pada tahun 2011 penulis diterima di Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara melalui jalur ujian Seleksi Nasional Masuk Perguruan Tinggi Negeri.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa atas berkat dan Rahmat-Nyalah penulis dapat menyelesaikan skripsi ini.
Adapun judul dari skripsi ini adalah “Pengaruh Konsentrasi dan Lama Perendaman Asam Sulfat (H2SO4) Terhadap Viabilitas Benih Delima (Punica granatum L.)”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada kedua orang tua penulis yang telah berjuang dalam membimbing dan mengajarkan penulis sampai saat ini. Penulis juga mengucapkan terima kasih kepada
ibu Ir. Haryati, MP., selaku ketua komisi pembimbing dan bapak Ir. Toga Simanungkalit, MP., selaku anggota komisi pembimbing yang
telah banyak membatu penulis dalam memberikan saran dan arahan yang membangun dalam kesempurnaan skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak mengalami kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis mengucapkan terima kasih.
Medan, Juni 2015
DAFTAR ISI
Perlakuan Pematahan Dormansi ... 7
Pematahan Dormansi dengan Berbagai Konsentrasi Asam Sulfat (H2SO4) ... 9
Pematahan Dormansi dengan Lama Perendaman Asam Sulfat (H2SO4) ... 10
Viabilitas Benih ... 11
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 13
Bahan dan Alat ... 13
Metode Penelitian ... 13
PELAKSANAAN PENELITIAN Persiapan Benih ... 15
Persiapan Media Perkecambahan ... 15
Hal.
Uji Tetrazolium (%) ... 17
Laju Perkecambahan (hari) ... 17
Uji Daya Kecambah ... 18
Kecambah Normal (%)... 18
Kecambah Abnormal (%)... 18
Benih yang Belum tumbuh (%) ... 19
Indeks Vigor (benih berkeambah/hari) ... 19
Bobot Segar Kecambah (g) ... 20
Bobot Kering Kecambah (g) ... 20
HASIL DAN PEMBAHASAN Hasil ... 21
Kadar Air Benih (%) ... 21
Uji Tetrazolium (%) ... 22
Laju Perkecambahan (hari) ... 23
Uji Daya Kecambah ... 24
Kecambah Normal (%)... 24
Kecambah Abnormal (%)... 25
Benih yang Belum Tumbuh (%) ... 26
Indeks Vigor (benih berkecambah/hari) ... 27
Bobot Segar Kecambah (g) ... 28
Bobot Kering Kecambah (g) ... 29
DAFTAR TABEL
No Hal.
1. Rataan Persentase Kadar Air ... 21
2. Rataan Persentase Uji Tetrazolium ... 22
3. Rataan Laju Perkecambahan ... 23
4. Rataan Persentase Kecambah Normal... 24
5. Rataan Persentase Kecambah Abnormal... 25
6. Rataan Persentase Benih Yang Belum Tumbuh ... 26
7. Rataan Indeks Vigor Benih ... 27
8. Rataan Bobot Basah Benih ... 28
DAFTAR LAMPIRAN
No Hal.
1. Kebutuhan Bahan Kimia ... 41
2. Data Kadar Air ... 41
3. Sidik Ragam Kadar Air ... 41
4. Data Uji Tetrazolium ... 42
5. Sidik Ragam Uji Tetrazolium ... 42
6. Data Laju Perkecambahan ... 43
7. Sidik Ragam Laju Perkecambahan ... 43
8. Data Kecambah Normal ... 44
9. Sidik Ragam Kecambah Normal ... 44
10. Transformasi Arcsin Data Kecambah Normal ... 45
11. Transformasi Arcsin Sidik Ragam Kecambah Normal ... 45
12. Data Kecambah Abnormal ... 46
13. Sidik Ragam Kecambah Abnormal ... 46
14. Transformasi √(x + 0,5) Data Kecambah Abnormal... 47
15. Transformasi √(x + 0,5) Sidik Ragam Kecambah Abnormal ... 47
16. Data Benih yang Belum Tumbuh ... 48
17. Sidik Ragam Benih yang Belum Tumbuh ... 48
18. Transformasi Arcsin Data Benih yang Belum Tumbuh ... 49
19. Transformasi Arcsin Sidik Ragam Benih yang Belum Tumbuh... 49
20. Data Indeks Vigor ... 50
21. Sidik Ragam Indeks Vigor ... 50
Hal.
23. Sidik Ragam Bobot Basah... 51
24. Data Bobot Kering ... 52
25. Sidik Ragam Bobot Kering ... 52
26. Deskripsi Tanaman ... 53
27. Jadwal kegiatan ... 54
28. Bagan Penanaman ... 55
29. Bagan Penelitian ... 56
30. Gambar Bentuk Benih Setelah Aplikasi H2SO4 ... 57
31. Gambar Benih Setelah Aplikasi Tetrazolium... 57
32. Gambar Kecambah 14 Hari Setelah Tanam ... 58
ABSTRACT
ILHAM INDRA SATYA : Effect of Concentration and Duration of Soaking
Sulphuric Acid (H2SO4) on The Viability of Pomegranate Seed (Punica granatum L.). Supervised by HARYATI and TOGA SIMANUNGKALIT.
Pomegranate seed requires dormancy breaking treatment to encourage germination. One of dormancy breaking treatments that can be done is setting the concentration and duration of soaking sulphuric acid (H2SO4) . This study aimed to determine the effect of concentration and duration of soaking sulphuric acid
(H2SO4) on the viability of pomegranate seeds. This research was conducted at the Laboratory of Seed Technology Faculty of Agriculture, University of North Sumatra, Medan with a height of ± 25 meters above sea level, in April 2015, using a completely randomized design with 10 degree factor dormancy breaking treatments that seed soaking treatment with H2SO4 (25%, 50%, 75%) with
duration of soaking (10 minutes, 15 minutes, and 20 minutes). Parameters measured were moisture content (%), experiment of tetrazolium(%), germination rate (day), normal seedling (%), abnormal seedling (%), seed that has not grown (%), vigor index (seedling in one day), fresh weight (gr), dry weight (gr).
The results showed that seed soaking treatment with 75% H2SO4 for 10
minutes increased the percentage of moisture content (%),germination rate (day), normal seedling (%),vigor index (seedling in one day), fresh weight (g), dry weight (g), but not to experiment of tetrazolium (%).
ABSTRAK
ILHAM INDRA SATYA : Pengaruh Konsentrasi dan Lama Perendaman Asam Sulfat (H2SO4) Terhadap Viabilitas Benih Delima (Punica granatum L.).
Dibimbing oleh HARYATI dan TOGA SIMANUNGKALIT.
Benih delima membutuhkan perlakuan pematahan dormansi untuk mendorong perkecambahannya. Salah satu perlakuan pematahan dormansi yang dapat dilakukan adalah dengan cara mengatur konsentrasi dan lama perendaman asam sulfat (H2SO4). Penelitian ini bertujuan untuk mengetahui pengaruh
perlakuan konsentrasi dan lama perendaman asam sulfat (H2SO4) terhadap
viabilitas benih delima. Penelitian ini dilaksanakan di Laboratorium Teknologi Benih Fakultas Pertanian Universitas Sumatera Utara Medan dengan ketinggian + 25 meter dpl, bulan April 2015 dengan menggunakan rancangan acak lengkap satu faktor dengan 10 taraf perlakuan pematahan dormansi yaitu perlakuan perendaman benih dengan H2SO4 (25%, 50%, 75%) dengan masing-masing
waktu perendaman (10 menit, 15 menit, dan 20 menit). Parameter yang diamati adalah kadar air (%), uji tetrazolium (%), laju perkecambahan (hari), kecambah normal (%), kecambah abnormal (%), benih yang belum tumbuh (%), indeks vigor (benih berkecambah/hari), bobot basah (g), bobot kering (g).
Hasil penelitian menunjukkan bahwa perlakuan perendaman benih dengan H2SO4 75% selama 10 menit berpengaruh meningkatkan kadar air, persentase laju
perkecambahan, persentase kecambah normal, indeks vigor, bobot basah, dan bobot kering, tetapi tidak untuk pengujian tetrazolium.
PENDAHULUAN Latar Belakang
Delima merupakan salah satu tanaman buah-buahan yang hidup sangat adaptif terhadap berbagai iklim dan kondisi tanah, tanaman ini dapat juga ditanam di berbagai wilayah geografis yang berbeda termasuk daerah Mediterania dan California. Delima sendiri merupakan salah satu buah tertua yang memiliki peran penting dalam keamanan gizi, baik sebagai suplemen, makanan, dan obat-obatan. Buah delima juga memiliki prospek yang baik untuk pasar komersial lokal dan internasional (Holland et al., 2009).
Menurut Holland et al. (2009) temuan-temuan ilmiah baru-baru ini menguatkan penggunaan delima sebagai obat medis dan menunjukkan bahwa jaringan delima dari buah, bunga, kulit kayu, dan daun mengandung phytochemical bioaktif yang antimikroba, mengurangi tekanan darah, dan bertindak terhadap penyakit serius seperti diabetes dan kanker. Delima digunakan untuk pencegahan dan pengobatan sejumlah gangguan kesehatan seperti radang, diabetes, diare, disentri, dan plak gigi serta untuk memerangi infeksi usus dan parasit malaria (Ismail et al., 2012).
Berdasarkan hasil penelitian Olmez et al. (2007) untuk mencapai 8% persentase perkecambahan benih delima diperlukan waktu selama 71 hari.
Untuk mempercepat proses pemecahan dormansi pada tipe benih berkulit tebal dan keras harus dilakukan beberapa cara salah satunya dengan cara merendam benih dalam larutan kimia seperti asam sulfat (H2SO4), asam klorida
(HCl), dan hidrogen peroksida (H2O2) (Purnomosidhi et al., 2013).
Tujuan dari perlakuan skarifikasi kimia adalah menjadikan kulit benih lebih mudah dimasuki air pada waktu proses imbibisi. Perendaman pada larutan kimia yaitu asam kuat seperti H2SO4 dan HCl dengan konsentrasi pekat membuat
kulit benih menjadi lebih lunak sehingga dapat dilalui oleh air dengan mudah (Fahmi, 2012).
Larutan asam kuat seperti H2SO4 sering digunakan dengan konsentrasi
yang bervariasi sampai pekat tergantung jenis benih yang diperlakukan. Lamanya perlakuan larutan asam harus memperhatikan dua hal yaitu kulit biji atau pericarp yang bisa diretakkan untuk memungkinkan imbibisi serta larutan asam tidak mengenai embrio yang menyebabkan benih rusak total (Fahmi, 2012).
Perlakuan pematahan dormansi secara kimia pada benih delima dengan konsentrasi yang berbeda menghasilkan hasil yang berbeda pada perlakuan perendaman 70% H2SO4 selama 15 menit menghasilkan persentase
perkecambahan benih delima normal sebesar 90% dengan laju perkecambahan 14,04 hari sedangkan pada perlakuan perendaman 80% dan 90% H2SO4 selama 15
Perbedaan hasil persentase daya kecambah dan kecepatan tumbuh pada perlakuan lama perendaman di jelaskan pada penelitian Astari et al. (2014) dimana perlakuan pematahan dormansi pada perendaman 1% H2SO4 selama
10 menit menghasilkan persentase rataan perkecambahan benih mucuna tertinggi yaitu sebesar 91,67 % dengan rataan kecepatan tumbuh benih 7,26 %/etmal sedangkan dengan perendaman 1% H2SO4 selama 15 menit menghasilkan
persentase rataan perkecambahan benih mucuna terendah yaitu sebesar 31,67 % dengan rataan kecepatan tumbuh benih 2,66 %/etmal.
Informasi mengenai perlakuan pematahan dormansi dengan pemberian konsentrasi H2SO4 dan lama perendaman H2SO4 pada benih delima dibutuhkan
untuk pengujian viabilitas benih guna menghasilkan daya perkecambahan benih dalam waktu yang singkat. Oleh karena itu, penulis tertarik untuk melakukan penelitian tentang pengaruh konsentrasi dan lama perendaman asam sulfat (H2SO4) terhadap viabilitas benih delima (Punica granatum L.).
Tujuan Penelitian
Untuk memperoleh perlakuan pematahan dormansi yang terbaik pada benih delima (Punica granatum L.) dengan mengunakan beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4).
Hipotesis Penelitian
Ada pengaruh nyata perlakuan pematahan dormansi dengan pemberian beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4) terhadap
Kegunaan Penulisan
TINJAUAN PUSTAKA Botani Tanaman
Tanaman delima diklasifikasikan sebagai berikut kingdom: Plantae, divisio : Spermatophyta, subdivisio : Angiospermae, kelas : Dicotyledonae,
ordo : Myrtales, famili : Punicaceae, genus : Punica, spesies : Punica granatum L. (United States Department of Agriculture, 2011).
Sistem perakaran delima terbagi dua, yaitu perakaran yang tumbuh vertikal dan horizontal. Bagian akar yang aktif adalah pada kedalaman 20 - 90 cm, tergantung pada perbedaan kedalaman tanah dan kelembaban (Levin, 1999).
Cabang-cabang muda dari pertumbuhan vegetatif pada awal pertumbuhan berukuran kecil. Warna kulit cabang muda tergantung pada varietas. Beberapa tanaman delima memiliki warna cabang merah muda ke unguan, selain itu ada yang berwarna hijau muda dengan bintik-bintik merah muda-ungu atau garis-garis. Cabang muda kadang-kadang memiliki duri di ujung yang sudah terlihat pada saat muda. Batang yang muda memiliki cabang poligonal (segi empat). Daun muda cenderung memiliki warna kemerahan yang berubah menjadi hijau saat dewasa (Holland et al., 2009).
Delima merupakan tanaman menyerbuk sendiri sehingga pada satu bunga terdapat alat kelamin jantan dan betina. Bunga delima berbentuk pir, melengkung dan berdaging dengan kaliks yang berbentuk lonceng (mahkota). Terdapat 5-8 daun mahkota yang berkerut (Aston et al., 2006).
Buah delima tergolong dalam buah berry dengan pericarp luar kasar dan banyak biji. Bentuk buah kurang lebih bulat dengan diameter 8-18 cm (hingga 2 cm dalam bentuk kerdil). Buah kadang-kadang bisa lebih atau kurang bergaris. Warna kulit buah bervariasi dari kehijauan sampai merah tua, sangat jarang mendekati hitam. Warna kulit buah bervariasi tergantung pada varietas tanaman (Levin, 1999).
Dormansi Benih
Benih dikatakan dorman apabila benih tersebut sebenarnya hidup tetapi tidak berkecambah walaupun diletakkan pada keadaan yang secara umum dianggap telah memenuhi persyaratan bagi suatu perkecambahan. Dormansi pada benih dapat berlangsung selama beberapa hari, semusim, bahkan sampai beberapa tahun tergantung pada jenis tanaman dan tipe dari dormansinya (Sutopo, 2012).
Ahli fisiologi benih menyatakan ada empat tahap perkecambahan : (1) hidrasi atau imbibisi, selama periode tersebut air masuk ke dalam embrio dan
Lapisan itu pun bertindak sebagai penghalang mekanis agar radikula tidak muncul (Salisbury and Ross, 1992).
Dormansi pada beberapa jenis benih disebabkan oleh: 1) struktur benih, misalnya pada kulit benih, braktea, gluma, perikap, dan membran, yang mempersulit keluar masuknya air dan udara; 2) kelainan fisiologis pada embrio; 3) penghambat (inhibitor) perkecambahan atau penghalang lainnya; 4) gabungan dari faktor-faktor diatas (Justice and Louis, 1994).
Dormansi yang penyebabnya berada dalam benih, ada yang morfologis dan fisiologis, dimana: 1) morfologis yang disebabkan oleh embrio yang rudimenter dan 2) fisiologis dikarenakan misalnya kematangan benih tidak terjamin sehingga kemampuannya untuk membentuk zat-zat yang diperlukan bagi perkecambahan menjadi kurang efektif (Kartasapoetra, 2003).
Dipandang dari segi ekonomis terdapatnya keadaan dormansi pada benih dianggap tidak menguntungkan. Oleh karena itu diperlukan cara agar dormansi dapat dipecahkan atau sekurang-kurangnya lama dormansinya dipersingkat. Beberapa cara yang telah diketahui adalah perlakuan mekanis, perlakuan kimia, perlakuan perendaman dengan air, perlakuan pemberian temperatur tertentu dan perlakuan dengan cahaya (Sutopo, 2012).
Perlakuan Pematahan Dormansi
Dormansi dapat diatasi dengan melakukan perlakuan sebagai berikut : 1) pemarutan atau penggoresan (skarifikasi ) yaitu dengan cara menghaluskan
fisiologis dikarenakan rendah selama waktu tertentu agar benih dapat aktif kembali; 3) perubahan suhu (alternating) dengan tujuan untuk mempercepat perkecambahan dilakukan teknik dengan perubahan-perubahan suhu, artinya direndahkan derajatnya (5oC – 10oC) tergantung dari jenis benih atau ditinggikan derazatnya (20oC – 35oC); 4) penggunaan zat kimia dalam perangsangan perkecambahan benih (Kartasapoetra, 2003).
Faktor-faktor yang menyebabkan hilangnya dormansi pada benih sangat bervariasi tergantung pada jenis tanaman dan tentu saja tipe dormansinya, antara lain yaitu: menipisnya kulit biji. Perlakuan dengan menggunakan bahan-bahan kimia sering pula dilakukan untuk memecahkan dormansi pada benih. Tujuannya adalah menjadikan kulit biji lebih mudah dimasuki oleh air pada waktu proses imbibisi. Larutan asam kuat seperti asam sulfat dan asam nitrat dengan konsentrasi pekat membuat kulit biji menjadi lebih lunak sehingga dapat dilalui oleh air dengan mudah. Bahan kimia lain yang juga sering digunakan adalah : potassium hydroxide, asam hidrochlorit, potassium nitrat, dan thiourea (Sutopo, 2012).
Pematahan Dormansi dengan Berbagai Konsentrasi Asam Sulfat (H2SO4) Penyebab dan mekanisme dormansi merupakan hal yang sangat penting diketahui untuk dapat menentukan cara pematahan dormansi yang tepat sehingga benih dapat berkecambah dengan cepat dan seragam. Masa dormansi tersebut dapat dipatahkan dengan skarifikasi mekanik maupun kimia (Fahmi, 2012).
Perlakuan kimia seperti H2SO4 pada prinsipnya adalah membuang lapisan
lignin pada kulit biji yang keras dan tebal sehingga biji kehilangan lapisan yang permiabel terhadap gas dan air dapat berdifusi masuk sehingga senyawa-senyawa inhibitor perkecambahan seperti fluoride dan kaumarin larut ke dalam H2SO4
selama proses perendaman (Sadjad et al., 1975).
Perlakuan perendaman dengan H2SO4 tidak mempengaruhi panjang
hipokotil, panjang radikula, dan berat kering kecambah dikarenakan biji yang mampu berkecambah setelah perlakuan H2SO4 hanya terpengaruh pada pelunakan
kulit benih dan tidak sampai ke embrio sehingga embrio tetap dapat tumbuh dengan normal. Tetapi apabila perlakuan H2SO4 sampai pada embrio benih, maka
embrio tidak akan mengalami pertumbuhan sehingga tidak sampai terjadi perkecambahan (Suyatmi et al., 2011).
Penelitian pematahan dormansi secara kimia pada benih delima dengan konsentrasi yang berbeda menghasilkan perlakuan terbaik pada 70% H2SO4 yang
direndam selama 15 menit yang menghasilkan persentase perkecambahan benih delima normal sebesar 90% dengan laju perkecambahan 14,04 hari dibandingkan dengan perlakuan yang lainnya (Ramadhani, 2014).
Perendaman benih jati dalam H2SO4 pada konsentrasi 70%, 80%, dan 90%
tinggi dari kontrol. Hal ini dikarenakan kombinasi perlakuan ini lebih optimal dan lebih cepat untuk melunakkan kulit benih dari pada benih yang hanya direndam dalam air pada lama perendaman yang sama (Suyatmi et al., 2011).
Pematahan Dormansi dengan Lama Perendaman Asam Sulfat (H2SO4)
Secara kimia pemecahan dormansi dapat dilakukan dengan cara merendamkan benih pada larutan asam kuat dengan waktu perendaman yang berbeda tergantung pada bentuk benih, dimana asam kuat sangat efektif untuk mematahkan dormansi pada biji yang memiliki struktur kulit keras dan tebal, asam sulfat (H2SO4) sebagai asam kuat dapat melunakkan kulit biji sehingga dapat
dilalui oleh air dengan mudah (Gardner, 1991 dalam Hedty et al., 2014).
Perlakuan konsentrasi asam sulfat yang dikombinasikan dengan lama perendaman akan mempengaruhi banyaknya larutan H2SO4 yang terserap kedalam
benih. Semakin pekat asam sulfat yang digunakan maka perendaman sebaiknya dilakukan semakin cepat karena dapat menyebabkan kerusakan pada benih itu sendiri (Harjadi, 1979).
Perbedaan hasil persentase daya kecambah dan kecepatan tumbuh pada perlakuan lama perendaman H2SO4 di jelaskan pada penelitian Dewir et al. (2011)
dimana perlakuan pematahan dormansi pada benih Sabal palmetto dalam perendaman 97% H2SO4 selama 5 menit menghasilkan persentase rataan
perkecambahan benih tertinggi yaitu sebesar 85 % dengan rataan kecepatan tumbuh benih 4,44 %/etmal sedangkan dengan perendaman 97% H2SO4 selama
15 menit menghasilkan persentase rataan perkecambahan benih Sabal palmetto
persentase rataan perkecambahan benih Sabal palmetto terendah yaitu sebesar 60 % dengan rataan kecepatan tumbuh benih 3,67 %/etmal.
Pada pematahan dormansi benih angsana dengan perlakuan perendaman dengan H2SO4 1% selama 10 menit memiliki nilai perkecambahan terbesar yaitu
sebesar 1,13 (%/hari)atau sekitar 2 kecambah setiap hari selama pengamatan. Hal ini menunjukkan bahwa pematahan dormansi perendaman dengan H2SO4 1%
selama 10 menit paling efektif dalam mematahkan dormansi benih angsana, yaitu dengan melunakkan kulit benih, sehingga air dapat dengan mudah masuk ke dalam benih. Namun, apabila berlebihan dalam hal konsentrasi dan lama waktu pematahan dormansi dapat menyebabkan kerusakan kulit benih atau jaringan embrio seperti halnya nilai perkecambahan pada pematahan dormansi benih angsana pada perendaman H2SO4 1% selama 15 menit yaitu hanya sebesar 0,55
(%/hari) atau sekitar 1 kecambah setiap hari selama pengamatan (Lensari, 2009). Viabilitas Benih
Viabilitas benih atau daya hidup benih dicerminkan oleh dua informasi masing-masing daya kecambah dan kekuatan tumbuh dapat ditunjukkan melalui gejala metabolisme benih dan atau gejala pertumbuhan. Uji viabilitas benih dapat dilakukan secara tak langsung, misalnya dengan mengukur gejala-gejala metabolisme ataupun secara langsung dengan mengamati dan membandingkan unsur-unsur tumbuh penting dari benih dalam suatu periode tertentu. Struktur
pertumbuhan yang dinilai terdiri dari akar, batang, daun dan daun lembaga (Sutopo, 2012).
sesudah panen, namun berdasarkan dari penelitian yang mendalam diketahui bahwa biji bisa berkecambah jauh sebelum tercapai kemasakan fisiologis (Physiologicalmaturity) atau sebelum tercapai berat kering maksimum (maximum dry weigth). Daya kecambah (viability) ini kian meningkat dengan bertambah tuanya biji dan mencapai berat kering maksimum jauh sebelum masak fisiologis. Sampai masak fisiologis tercapai “maximum germination” (100%) ini konstan, tetapi sesudah itu akan menurun dengan kecepatan yang sesuai dengan keadaan yang tidak menguntungkan di lapangan (Kamil, 1993).
Berdasarkan pada kondisi lingkungan pengujian viabilitas benih dapat dikelompokkan ke dalam viabilitas benih dalam kondisi lingkungan sesuai (favourable) dan viabilitas benih dalam kondisi lingkungan tidak sesuai (unfavourable). Pengujian viabilitas benih dalam kondisi lingkungan tidak sesuai termasuk kedalam pengujian vigor benih. Perlakuan dengan kondisi lingkungan sesuai sebelum benih dikecambahkan tergolong untuk menduga parameter vigor daya simpan benih sedangkan jika kondisi lingkungan tidak sesuai diberikan selama pengecambahan benih maka tergolong dalam pengujian untuk menduga parameter vigor kekuatan tumbuh benih (Mugnisjah et al., 1994).
PELAKSANAAN PENELITIAN Persiapan Benih
Buah delima yang telah dipanen kemudian dikupas dan biji dikeluarkan. Biji yang digunakan adalah biji yang ukurannya seragam dan tidak terserang cendawan patogen. Biji dibersihkan dari aril dengan menggunakan air.
Persiapan Media Perkecambahan
Media perkecambahan yang digunakan adalah media pasir dengan ketebalan ± 4 cm. Sebelum digunakan, terlebih dahulu pasir diayak dengan ayakan yang berukuran 20 mesh dan disterilkan dengan cara digongseng selama + 30 menit untuk menghilangkan kontaminasi dari cendawan patogen dan bakteri. Pengukuran Kadar Air
Sebelum diberi perlakuan, benih diukur kadar air awalnya. Pengukuran kadar air dilakukan dengan cara beberapa benih ditumbuk dengan menggunakan mortal untuk dihaluskan dan kemudian ditimbang bobot basahnya. Setelah itu benih dimasukkan ke dalam oven pada suhu 1000C selama 24 jam sampai berat benih konstan. Kadar air benih dihitung dengan menggunakan rumus sebagai berikut :
Bobot basah – Bobot kering
Kadar Air = X 100% (Mugnisjah et al.,1994) Bobot basah
Aplikasi Perlakuan
Aplikasi perlakuan pematahan dormansi dilakukan dengan membuat larutan H2SO4 dengan cara mengencerkan H2SO4 (aq) pekat dengan pelarut air pada
Benih direndam sesuai urutan perlakuan yaitu : K0 : Kontrol (tanpa perlakuan)
K1 : perendaman benih dengan H2SO4 25 % selama 10 menit
K2 : perendaman benih dengan H2SO4 25 % selama 15 menit
K3 : perendaman benih dengan H2SO4 25 % selama 20 menit
K4 : perendaman benih dengan H2SO4 50 % selama 10 menit
K5 : perendaman benih dengan H2SO4 50 % selama 15 menit
K6 : perendaman benih dengan H2SO4 50 % selama 20 menit
K7 : perendaman benih dengan H2SO4 75 % selama 10 menit
K8 : perendaman benih dengan H2SO4 75 % selama 15 menit
K9 : perendaman benih dengan H2SO4 75 % selama 20 menit
Imbibisi Benih
Imbibisi benih dilakukan setelah semua masing - masing perlakuan selesai, kemudian dilakukan perendaman dengan aquades selama 12 jam untuk memacu perkecambahan benih.
Pengecambahan Benih
Pengecambahan benih dilakukan pada bak kecambah dengan ukuran 25 cm x 22 cm x 4 cm sebanyak 30 benih per bak kecambah dengan kedalaman
lubang tanam pada media pasir sedalam 2 cm. Benih dikecambahkan setelah benih melakukan proses imbibisi selama 12 jam.
Pemeliharaan
Penyiraman dilakukan pada pagi dan sore hari dengan menggunakan
Pengamatan Parameter Kadar Air Benih (%)
Pengamatan kadar benih (%) ini dilakukan pada setiap taraf perlakuan dilakukan setelah aplikasi. Dengan cara diambil 15 benih setiap perlakuan untuk dihaluskan kemudian di timbang bobot basahnya dan dimasukkan ke dalam oven yang dipanaskan pada suhu 1000C selama 24 jam untuk mendapatkan bobot keringnya. Kadar air benih (%) dihitung dengan menggunakan rumus sebagai berikut :
Bobot basah – Bobot kering
Kadar Air = X 100% (Mugnisjah et al.,1994) Bobot basah
Uji Tetrazolium (%)
Uji tetrazolium (warna) dilakukan dengan memasukan benih kedalam larutan tetrazolium, dimana benih yang dimasukan adalah benih yang telah diberi perlakuan ataupun tidak diberi perlakuan (kontrol). Untuk mengetahui benih yang akan di uji itu sudah mati atau masih hidup, benih tersebut akan memperlihatkan perubahan warna. Benih yang sudah mati (tidak berkecambah sama sekali) tidak terjadi perubahan warna (putih) pada embrio dan hidup sangat aktif berkecambah yang ditandai dengan warna merah muda pada embrio.
PWE (merah) – TPWE (putih)
DBAB = X 100%
Total benih yang diuji
Keterangan : DBAB : Dugaan benih yang aktif berkecambah PWE : Perubahan warna embrio
Laju Perkecambahan (hari)
Laju perkecambahan diukur dengan menghitung jumlah hari yang diperlukan untuk munculnya radikula atau plumula. Perhitungan laju perkecambahan menggunakan formulasi Sutopo (2012) sebagai berikut :
N1T1 + N2T2 + … … … + NxTx Rata- rata hari =
Jumlah total benih berkecambah
Keterangan : N : Jumlah benih yang berkecambah pada satuan waktu tertentu T : Menunjukkan jumlah waktu antara awal pengujian sampai dengan akhir dan interval tertentu suatu pengamatan
Uji Daya Kecambah
Analisa daya kecambah atau daya tumbuh dilakukan setelah benih dikecambahkan selama 30 hari dengan kondisi optimum. Menurut Sutopo (2012) untuk evaluasi kecambah digunakan kriteria sebagai berikut :
a. Kecambah normal (%).
Kriteria kecambah normal adalah :
1. Kecambah yang memiliki perkembangan sistem perakaran yang baik terutama akar primer dan untuk tanaman yang secara normal menghasilkan akar seminal maka akar ini tidak boleh kurang dari dua. 2. Perkembangan hipokotil yang baik dan sempurna tanpa ada kerusakan
pada jaringan-jaringannya.
3. Pertumbuhan plumula yang sempurna dengan daun hijau dan tumbuh baik, di dalam atau muncul dari koleoptil atau pertumbuhan epikotil yang sempurna dengan kuncup yang normal.
Perhitungan persentase kecambah normal sebagai berikut : Jumlah kecambah normal
Kecambah normal = X 100% Jumlah contoh benih yang diuji
b. Kecambah abnormal (%)
Kriteria kecambah abnormal adalah :
1. Kecambah yang rusak, tanpa kotiledon, embrio yang pecah, dan akar priemernya yang pendek.
2. Kecambah yang bentuknya cacad, perkembangannya lemah atau kurang seimbang dari bagian-bagian yang penting. Plumula yang terputar, hipokotil, epikotil, kotiledon yang membengkok, akar yang pendek, koleoptil yang pecah atau tidak mempunyai daun, dan kecambah yang kerdil.
3. Kecambah yang tidak membentuk klorofil serta kecambah yang lunak 4. Untuk benih pohon-pohonan bila dari microphyl keluar daun dan
bukannya akar.
Perhitungan persentase kecambah abnormal sebagai berikut : Jumlah kecambah abnormal
Kecambah abnormal = X 100 %
Jumlah contoh benih yang diuji c. Benih yang belum tumbuh
Kriteria ini ditujukan untuk benih-benih yang belum berkecambah setelah jangka waktu pengujian yang telah ditentukan.
Perhitungan persentase benih yang belum tumbuh sebagai berikut : Jumlah benih yang belum tumbuh
Indeks Vigor (benih berkecambah/hari)
Indeks vigor (IV) dihitung berdasarkan rumus L. O. Copeland (1977)
dalam Kartasapoetra (2003) : IV = G1 + G2 + G3 + .... + D1 D2 D3 Dn
Gn
Keterangan : IV : Indeks Vigor
G : Jumlah benih yang berkecambah pada hari tertentu D : Waktu yang bersesuaian dengan G
n : Jumlah hari pada perhitungan terakhir Bobot Segar Kecambah (g)
Bobot segar kecambah (g) diperoleh dengan cara menimbang masing-masing kecambah normal setiap perlakuan pada hari ke 30 dengan menggunakan timbangan analitik. Kecambah yang digunakan masih dalam keadaan segar dan bersih dari pasir yang melekat.
Bobot Kering Kecambah (g)
HASIL DAN PEMBAHASAN
Hasil
Berdasarkan hasil sidik ragam, diketahui bahwa pengaruh konsentrasi dan lama perendaman asam sulfat pada benih delima berpengaruh nyata terhadap parameter pengamatan kadar air benih (%), laju perkecambahan (hari), kecambah normal (%), kecambah abnormal (%), benih yang belum tumbuh (%), indeks vigor benih (benih berkecambah/hari), bobot basah kecambah (g), dan bobot kering kecambah (g).
Kadar Air Benih (%)
Dari hasil pengamatan diperoleh kadar air benih sebelum diberi perlakuan adalah 12,59 %. Data pengamatan dan sidik ragam kadar air benih dapat dilihat pada Lampiran 2 dan 3. Sidik ragam menunjukkan bahwa pengaruh bebaerapa konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata
terhadap kadar air benih delima.
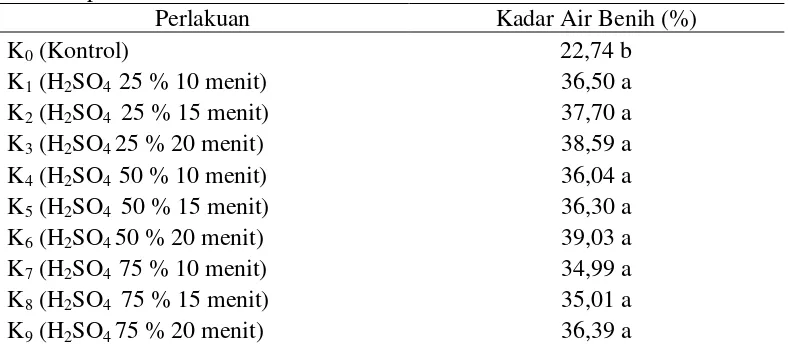
Rataan kadar air pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 1.
Tabel 1. Kadar air benih delima pada beberapa perlakuan konsentrasi dan lama perendaman asam sulfat
Perlakuan Kadar Air Benih (%)
K0 (Kontrol) 22,74 b
Tabel 1 menunjukkan bahwa kadar air benih delima tertinggi pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan H2SO4 50 % 20 menit (K6) sebesar 39,03 % yang berbeda nyata dengan
perlakuan K0, namun tidak berbeda nyata dengan perlakuan lainnya. Rataan kadar
air benih terendah pada perlakuan Kontrol (K0) sebesar 22,74 % yang berbeda
nyata dengan perlakuan lainnya. Uji Tetrazolium (%)
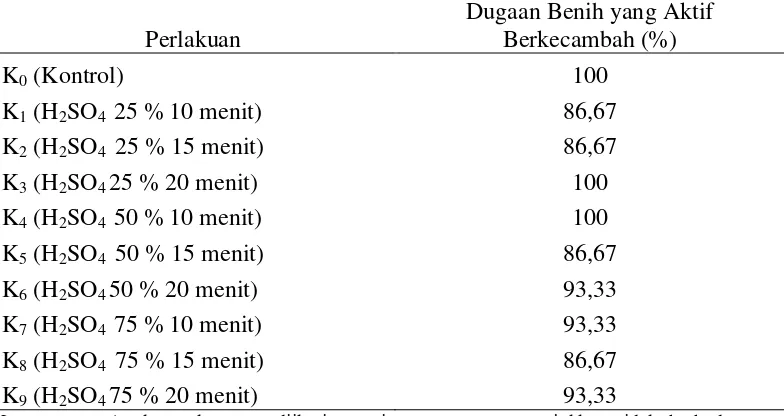
Data hasil pengamatan dan sidik ragam uji tetrazolium benih delima dapat dilihat pada Lampiran 4 dan 5. Berdasarkan sidik ragam diketahui bahwa perlakuan beberapa konsentrasi dan lama perendaman asam sulfat tidak berpengaruh nyata terhadap hasil uji tetrazolium benih delima.
Rataan tetrazolium benih delima pada beberapa perlakuan konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 2.
Tabel 2. Hasil uji tetrazolium benih delima pada beberapa perlakuan konsentrasi dan lama perendaman asam sulfat
Perlakuan
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
perlakuan kontrol (K0), H2SO4 25 % 20 menit (K3), dan H2SO4 50 % 10 menit
(K4) sebesar 100 % dan rataan hasil uji tetrazolium benih delima terendah
terdapat pada perlakuan K1, K2, K5, dan K8 sebesar 86,67 %.
Laju Perkecambahan (hari)
Data hasil pengamatan dan sidik ragam laju perkecambahan dapat dilihat pada Lampiran 6 dan 7. Hasil sidik ragam menunjukkan bahwa perlakuan beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh
nyata terhadap laju perkecambahan benih delima.
Rataan laju perkecambahan benih delima terhadap beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 3.
Tabel 3. Laju perkecambahan benih delima pada beberapa perlakuan konsentrasi dan lama perendaman asam sulfat
Perlakuan Laju Perkecambahan (hari)
K0 (Kontrol) 17,83 a
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 3 menunjukkan bahwa laju perkecambahan tercepat terdapat pada perlakuan H2SO4 75 % 10 menit (K7)sebesar 6,31 hari yang tidak berbeda nyata
dengan perlakuan K6, K8, dan K9 namun berbeda nyata dengan perlakuan lainnya.
Rataan laju perkecambahan terlama pada perlakuan Kontrol (K0)sebesar 17,83
Uji Daya Kecambah Kecambah Normal (%)
Data hasil pengamatan dan sidik ragam kecambah normal dapat dilihat pada Lampiran 8 dan 9. Hasil sidik ragam menunjukkan bahwa pengaruh beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh
nyata terhadap laju perkecambahan benih delima.
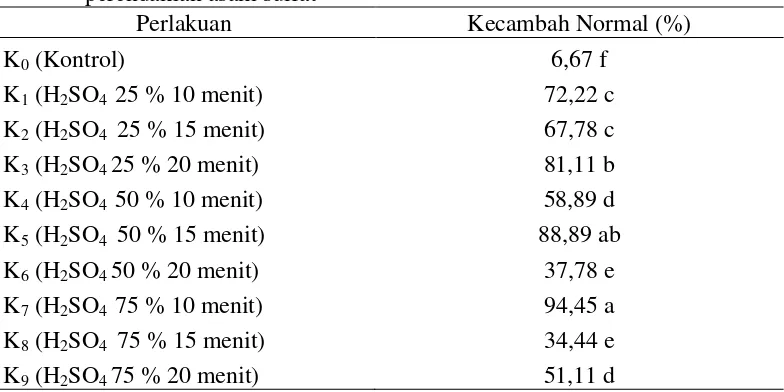
Rataan kecambah normal delima terhadap beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 4.
Tabel 4. Kecambah normal pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan Kecambah Normal (%)
K0 (Kontrol) 6,67 f
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 4 menunjukkan bahwa kecambah normal tertinggi pada beberapa
konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan H2SO4 75 % 10 menit (K7) sebesar 94,45 % yang tidak berbeda nyata dengan
perlakuan K5 namunberbeda nyata dengan perlakuan lainnya. Rataan kecambah
normal terendah pada perlakuan kontrol (K0) sebesar 6,67 % yang berbeda nyata
Kecambah Abnormal (%)
Data hasil pengamatan dan sidik ragam kecambah abnormal dapat dilihat pada Lampiran 12 dan 13. Hasil sidik ragam menunjukkan bahwa pengaruh beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh
nyata terhadap laju perkecambahan benih delima.
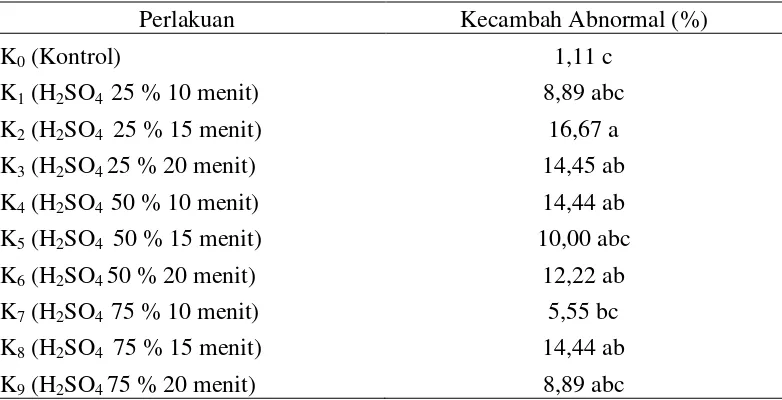
Rataan kecambah abnormal delima terhadap beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 5.
Tabel 5. Kecambah abnormal pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan Kecambah Abnormal (%)
K0 (Kontrol) 1,11 c
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 5 menunjukkan bahwa kecambah abnormal tertinggi pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan H2SO4 25 % 15 menit (K2) sebesar 16,67 % yang tidak berbeda nyata dengan
perlakuan lainnya namun berbeda nyata dengan perlakuan K0 dan K7. Rataan
kecambah abnormal terendah pada perlakuan Kontrol (K0) sebesar 1,11 % yang
tidak berbeda nyata dengan perlakuan K7 namun berbeda nyata dengan perlakuan
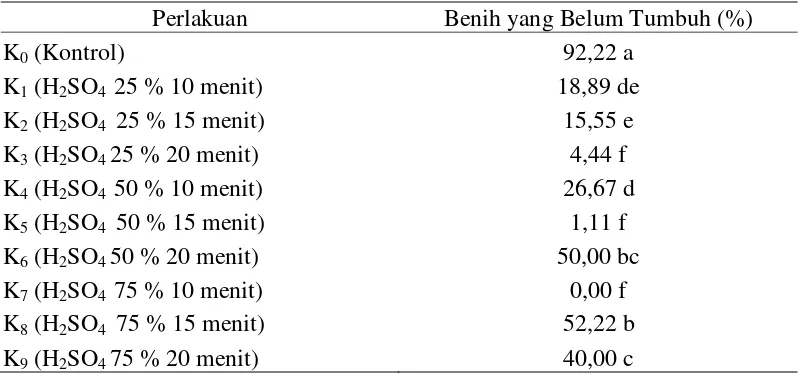
Benih yang Belum Tumbuh (%)
Data hasil pengamatan dan sidik ragam benih delima yang belum tumbuh dapat dilihat pada Lampiran 16 dan 17. Hasil sidik ragam menunjukkan bahwa pengaruh beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4)
berpengaruh nyata terhadap benih delima yang belum tumbuh.
Rataan benih delima yang belum tumbuh terhadap beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 6.
Tabel 6. Benih delima yang belum tumbuh pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan Benih yang Belum Tumbuh (%)
K0 (Kontrol) 92,22 a
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 6 menunjukkan bahwa rataan benih delima yang belum tumbuh tertinggi pada konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan kontrol (K0) sebesar 92,22 % yang berbeda nyata dengan perlakuan
lainnya. Rataan benih delima yang belum tumbuh terendah terdapat pada
perlakuan H2SO4 75 % 10 menit (K7) sebesar 0 % yang tidak berbeda nyata
Indeks Vigor (benih berkecambah/hari)
Data hasil pengamatan dan sidik ragam indeks vigor benih delima dapat dilihat pada Lampiran 20 dan 21. Hasil sidik ragam menunjukkan bahwa pengaruh beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4)
berpengaruh nyata terhadap benih delima yang belum tumbuh.
Rataan indeks vigor benih delima terhadap beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 7.
Tabel 7. Indeks vigor benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan Indeks Vigor (benih berkecambah/hari)
K0 (Kontrol) 0,13 d
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 7 menunjukkan bahwa rataan indeks vigor benih delima tertinggi pada beberapa konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan H2SO4 75 % 10 menit (K7) sebesar 5 benih berkecambah/hari yang
berbeda nyata dengan perlakuan lainnya. Rataan indeks vigor benih delima yang
terendah terdapat pada perlakuan kontrol (K0) sebesar 0,13 benih
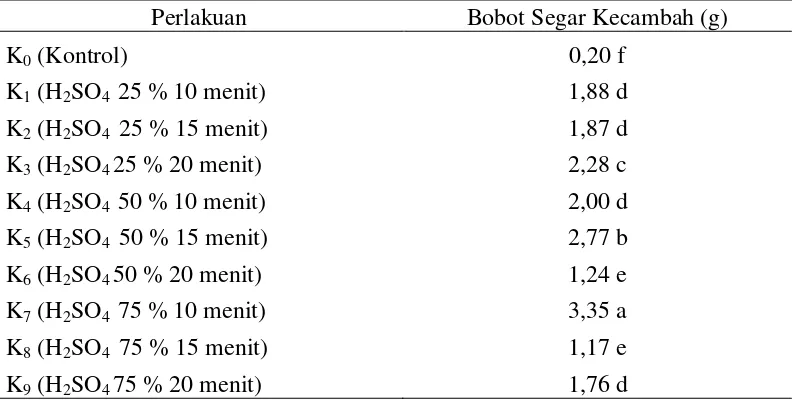
Bobot Segar Kecambah (g)
Data hasil pengamatan dan sidik ragam bobot segar kecambah dapat dilihat pada Lampiran 22 dan 23. Berdasarkan sidik ragam diketahui bahwa perlakuan beberapa konsentrasi dan lama perendaman asam sulfat (H2SO4)
berpengaruh nyata terhadap bobot segar kecambah.
Rataan bobot segar kecambah pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 8.
Tabel 8. Bobot segar kecambah delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan Bobot Segar Kecambah (g)
K0 (Kontrol) 0,20 f
K1 (H2SO4 25 % 10 menit) 1,88 d
K2 (H2SO4 25 % 15 menit) 1,87 d
K3 (H2SO4 25 % 20 menit) 2,28 c
K4 (H2SO4 50 % 10 menit) 2,00 d
K5 (H2SO4 50 % 15 menit) 2,77 b
K6 (H2SO4 50 % 20 menit) 1,24 e
K7 (H2SO4 75 % 10 menit) 3,35 a
K8 (H2SO4 75 % 15 menit) 1,17 e
K9 (H2SO4 75 % 20 menit) 1,76 d
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 8 menujukkan bobot segar kecambah tertinggi pada beberapa
konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan H2SO4 75 % 10 menit (K7)sebesar 3,35 g yang berbeda nyata dengan perlakuan
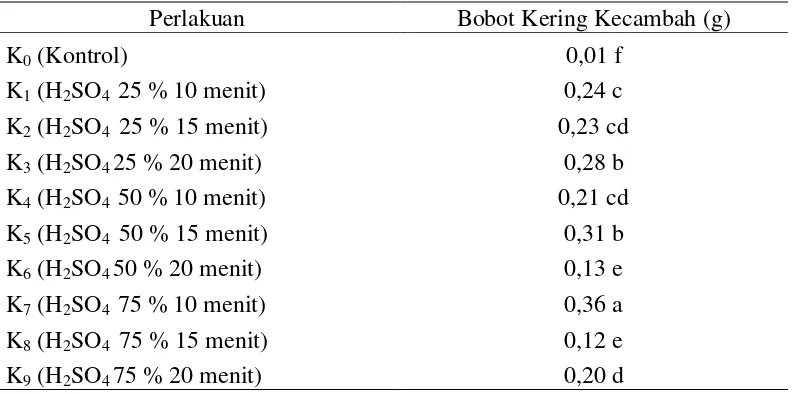
Bobot Kering Kecambah (g)
Data hasil pengamatan dan sidik ragam bobot segar kecambah dapat dilihat pada Lampiran 24 dan 25. Berdasarkan sidik ragam diketahui bahwa perlakuan beberapa konsentrasi dan lama perendaman asam sulfat berpengaruh nyata terhadap bobot kering kecambah.
Rataan bobot kering kecambah pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat dapat dilihat pada Tabel 9.
Tabel 9. Bobot kering kecambah delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan Bobot Kering Kecambah (g)
K0 (Kontrol) 0,01 f
K1 (H2SO4 25 % 10 menit) 0,24 c
K2 (H2SO4 25 % 15 menit) 0,23 cd
K3 (H2SO4 25 % 20 menit) 0,28 b
K4 (H2SO4 50 % 10 menit) 0,21 cd
K5 (H2SO4 50 % 15 menit) 0,31 b
K6 (H2SO4 50 % 20 menit) 0,13 e
K7 (H2SO4 75 % 10 menit) 0,36 a
K8 (H2SO4 75 % 15 menit) 0,12 e
K9 (H2SO4 75 % 20 menit) 0,20 d
Keterangan : Angka-angka yang diikuti notasi yang sama menunjukkan tidak berbeda nyata menurut Uji Jarak Berganda Duncan pada taraf α = 5%.
Tabel 9 menujukkan bobot kering kecambah tertinggi pada perlakuan
beberapa konsentrasi dan lama perendaman asam sulfat terdapat pada perlakuan H2SO4 75 % 10 menit (K7) sebesar 0,36 g yang berbeda nyata dengan perlakuan
lainnya. Rataan bobot segar kecambah terendah pada perlakuan kontrol (K0)
Pembahasan
Dari hasil pengamatan dan sidik ragam dapat diketahui bahwa perlakuan pematahan dormansi dengan mengunakan konsentrasi dan lama perendaman H2SO4 berpengaruh nyata terhadap parameter kadar air benih (%), laju
perkecambahan benih (hari), kecambah normal (%), benih yang belum tumbuh (%), kecambah abnormal (%), indeks vigor (kecambah/hari), bobot basah kecambah (g), dan bobot kering kecambah (g).
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata terhadap kadar air benih.
Kadar air tertinggi terdapat pada perlakuan perendaman benih dengan H2SO4 50 % 20 menit (K6) sebesar 39,03 % yang tidak berbeda nyata dengan
perlakuan lainnya tapi berbeda nyata dengan perlakuan kontrol (K0) (Tabel 1).
Perlakuan perendaman benih dengan H2SO4 menyebabkan kulit benih melunak,
sehingga air dapat mudah masuk dan kadar air dalam benih meningkat (Lampiran 30). Hal ini sesuai dengan literatur Sutopo (2012) yang menyatakan bahwa larutan asam kuat seperti asam sulfat dan asam nitrat dengan konsentrasi pekat membuat kulit biji menjadi lebih lunak sehingga dapat dilalui oleh air dengan mudah.
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) tidak berpengaruh nyata terhadap uji
tetrazolium. Hal ini dapat dilihat dari persentase uji tetrazolium tertinggi terdapat
pada perlakuan kontrol (K0), H2SO4 25 % 20 menit (K3), dan H2SO4 50 %
10 menit (K4) sebesar 100 % dan rataan hasil uji tetrazolium benih delima
menunjukan bahwa benih delima yang dipakai layak digunakan untuk uji viabilitas benih yang mana syarat benih yang baik memiliki persentase daya kecambah diatas 80 %. Uji tetrazolium bertujuan dalam mengaktifkan sel/jaringan benih dan membedakan antara sel atau jaringan yang hidup atau mati. Uji tetrazolium ini merupakan salah satu cara untuk membuktikan bahwa viabilitas tanaman itu baik, dan secara tidak langsung uji ini dapat mempermudah untuk mengetahui kondisi embrio apakah benih itu hidup dengan perubahan warna merah pada embrio dan mati tanpa perubahan (warna putih) pada embrio (Lampiran 31). Perlakuan perendaman asam sulfat dengan beberapa konsentrasi dan lama perendaman bukan untuk mengaktifkan sel/jaringan pada benih, melainkan hanya untuk melunakan kulit benih lebih cepat sehingga memudahkan air masuk kebenih dan memudahkan benih untuk berkecambah (Lampiran 30).
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata terhadap peningkatan laju
perkecambahan, dimana laju perkecambahan tercepat terdapat pada perlakuan H2SO4 75 % 10 menit (K2) sebesar 6,31 hari yang tidak berbeda nyata dengan
kombinasi perlakuan K6, K8, dan K9 namun berbeda nyata dengan perlakuan
lainnya (Tabel 3). Laju perkecambahan dapat diukur dengan menghitung jumlah hari yang dibutuhkan untuk munculnya radikula atau plumula. Hal ini menunjukkan bahwa waktu yang dibutuhkan benih delima untuk munculnya radikula atau plumula pada perlakuan konsentrasi dan lama perendaman H2SO4
75 % selama 10 menit, lebih cepat dibanding perlakuan lainnya
menyerap air, kemampuan embrio untuk keluar dan berkecambah, serta konsentrasi yang tepat pada perlakuan ini. Hal ini sesuai dengan literatur Kartasapoetra (2003) menyebutkan bahwa kerasnya kulit benih dapat menyebabkan resistensi mekanis dan ini menyebabkan embrio yang memiliki daya untuk berkecambah tidak dapat menyobek kulit yang berarti pula tidak dapat keluar untuk tumbuh sebagaimana mestinya. Fahmi (2012) juga menyebutkan larutan asam kuat seperti H2SO4 sering digunakan dengan konsentrasi yang
bervariasi sampai pekat tergantung jenis benih yang diperlakukan. Lamanya perlakuan larutan asam harus memperhatikan dua hal yaitu kulit biji atau pericarp yang bisa diretakkan untuk memungkinkan imbibisi serta larutan asam tidak mengenai embrio yang menyebabkan benih rusak total.
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata dalam meningkatkan
kecambah normal. Hal ini dapat dilihat dari kecambah normal tertinggi yang dihasilkan oleh perlakuan perendaman benih dengan H2SO4 75% 10 menit (K7)
sebesar 94,45 % yang tidak berbeda nyata dengan perlakuan H2SO4 50% 15
menit (K5) namun berbeda nyata dengan perlakuan lainnya (Tabel 4). Kulit benih
yang keras menghalangi embrio keluar dan menyebabkan benih mengalami dormansi. Persentase kecambah normal yang tinggi pada perlakuan H2SO4 75%
10 menit (K7) diduga karena struktur kulit benih mengalami kerusakan yang
sesuai, sehingga air dengan mudah masuk dan embrio dapat keluar dan berkecambah. Sesuai dengan literatur Ali et al. (2011) yang menyebutkan bahwa mekanisme perkecambahan biji yang mungkin dipengaruhi oleh H2SO4 adalah
penyerapan air dan imbibisi benih. Fahmi (2012) juga menyebutkan larutan asam kuat seperti H2SO4 sering digunakan dengan konsentrasi yang bervariasi sampai
pekat tergantung jenis benih yang diperlakukan. Lamanya perlakuan larutan asam harus memperhatikan dua hal yaitu kulit biji atau pericarp yang bisa diretakkan untuk memungkinkan imbibisi serta larutan asam tidak mengenai embrio yang menyebabkan benih rusak total.
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata terhadap kecambah
abnormal. Hal ini dapat dilihat dari kecambah abnormal tertinggi yang dihasilkan oleh perlakuan perendaman benih dengan H2SO4 25% 15 menit (K2) sebesar
16,67 % yang tidak berbeda nyata dengan perlakuan lainnya namun berbeda nyata dengan perlakuan K0 dan K7 (Tabel 5). Kecambah abnormal pada perlakuan K2
ditandai dengan terputusnya koleoptil kecambah dan bentuk kecambah yang berbeda dengan kecambah yang lain atau kecambah yang normal, hal ini disebabkan oleh faktor konsentrasi dan lama perendaman yang tidak sesuai sehingga dapat merusak embrio dan atau kulit benih yang keras sehingga menyulitkan kecambah untuk tumbuh dan memaksa tumbuh kearah kecambah abnormal. Hal ini sesuai dengan literatur Utomo (2006) yang menyatakan bahwa perlakuan larutan asam umumnya dilakukan pada benih yang memiliki dormansi ganda (fisik dan mekanis), dimana kecepatan perkecambahan meningkat secara nyata dibanding dengan kontrol. Fahmi (2012) juga menyebutkan larutan asam kuat seperti H2SO4 sering digunakan dengan konsentrasi yang bervariasi sampai
untuk memungkinkan imbibisi serta larutan asam tidak mengenai embrio yang menyebabkan benih rusak total.
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata terhadap benih delima yang
belum tumbuh. Hal ini dapat dilihat dari benih delima yang belum tumbuh tertinggi yang dihasilkan oleh perlakuan perendaman benih tanpa perendaman H2SO4 (Kontrol) sebesar 92,22 % yang berbeda nyata dengan perlakuan lainnya
(Tabel 6). Persentase terendah pada perlakuan H2SO4 75 % 10 menit (K7) dan
H2SO4 50 % 15 menit (K5) rata-rata sebesar 0 % dan 1,11% diduga karena
perlakuan tersebut dapat mendorong perkecambahan benih. Benih delima memiliki kulit yang keras sehingga air sulit masuk ke dalam benih (dormansi fisik) dan embrio tidak dapat keluar untuk berkecambah (dormansi mekanis). Untuk mengatasi benih yang berdormansi ganda (dormansi fisik dan mekanis) dibutuhkan perlakuan awal pada benih berupa perlakuan asam. Hal ini sesuai dengan literatur Utomo (2006) yang menyatakan bahwa perlakuan larutan asam umumnya dilakukan pada benih yang memiliki dormansi ganda (fisik dan mekanis), dimana kecepatan perkecambahan meningkat secara nyata dibanding dengan kontrol. Ramadhani (2014) juga menyebutkan bahwa perendaman benih delima dalam H2SO4 pada konsentrasi 70%, 80%, dan 90% selama 15 menit
menghasilkan persentase perkecambahan lebih tinggi dibanding kontrol. Hal ini dikarenakan perlakuan perendaman dengan H2SO4 lebih optimal dan lebih cepat
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata meningkatkanindeks vigor
benih dibanding perlakuan kontrol. Hal ini dapat dilihat dari indeks vigor tertinggi
terdapat pada perlakuan H2SO4 75% selama 10 menit (K7) sebesar
5,00 benih berkecambah/hari yang berbeda nyata dengan perlakuan yang lain. Indeks vigor terendah terdapat pada perlakuan kontrol (K0) sebesar 0,13 benih
berkecambah/hari yang berbeda nyata dengan perlakuan yang lain (Tabel 7). Indeks vigor sendiri berhubungan erat dengan kecepatan tumbuh benih (laju perkecambahan) yang mana kecepatan tumbuh akan berbanding lurus dengan indeks vigor benih. Hal ini sesuai dengan literatur Kartasapoetra (2003) indeks vigor berhubungan erat dengan kecepatan berkecambah dari suatu kelompok benih. Indeks vigor yang tinggi menunjukkan kecepatan berkecambah benih juga tinggi dan lebih tahan terhadap keadaan lingkungan yang kurang menguntungkan. Perlakuan perendaman benih dengan H2SO4 efektif mematahkan dormansi pada
benih sehingga mampu meningkatkan kecepatan berkecambah dan indeks vigor benih dibanding perlakuan kontrol.
Perlakuan pematahan dormansi mengunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) berpengaruh nyata terhadap bobot segar
kecambah dan bobot kering kecambah. Hal ini dapat dilihat dari rataan bobot segar kecambah tertinggi dan bobot kering kecambah tertinggi terdapat pada perlakuan perendaman H2SO4 75% selama 10 menit (K7) yang masing - masing
KESIMPULAN Kesimpulan
1. Perlakuan pematahan dormansi dengan menggunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) terhadap benih delima menunjukkan
pengaruh yang berbeda nyata terhadap persentase kadar air, laju perkecambahan, kecambah normal, kecambah abnormal, benih yang belum tumbuh, indeks vigor, bobot segar kecambah, dan bobot kering kecambah, tetapi menunjukan pengaruh yang tidak berbedanyata pada perlakuan uji tetrazolium.
2. Perlakuan pematahan dormansi dengan menggunakan konsentrasi dan lama perendaman asam sulfat (H2SO4) terhadap benih delima yang terbaik untuk
meningkatkan persentase laju perkecambahan, kecambah normal, indeks vigor benih, bobot segar kecambah, dan bobot kering kecambah adalah perlakuan perendaman dengan H2SO4 75% selama 10 menit.
Saran
DAFTAR PUSTAKA
Ali H. H., H. Tanveer, M. A. Nadeem, and H. N. Asghar. 2011. Scientific Note:
Methods to Break Seed Dormancy of Rhynchosia capitata a Summer Annual Weed. J. Chilean Journal 0f Agricultural Research
71(3).
Astari R. P., Rosmayati, and E. S. Bayu. 2014. Pengaruh Pematahan Dormansi Secara Fisik Dan Kimia Terhadap Kemampuan Berkecambah Benih
Mucuna (Mucuna Bracteata D.C.). J. Online Agroekoteknologi. 2 (2) : 803 – 812.
Aston R., B. Baer., and D. Silverstein. 2006. The Incredible Pomegranate.
Copeland, L.O and M. B. McDonald. 2001. Principles of Seed Science and Technology. Kluwer Academic Publishers, London.
Dewir Y. H., M. E. El-Mahrouk, and Y. Naidoo. 2011. Effects of some mechanical and chemical treatments on seed germination of Sabal
palmetto and Thrinax morrisii palms. Australian Journal of Crop Science
5 (3) : 248-253.
Fahmi Z. I. 2012. Studi Perlakuan Pematahan Dormansi Benih Dengan Skarifikasi Mekanik dan Kimiawi. J. Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Surabaya. hlm : 3.
Gardner. 1991. Fisiologi Tanaman Budidaya, dalam Hedty, Mukarlina, dan Masnur T. 2014. Pemberian H2SO4 dan Air Kelapa pada Uji Viabilitas Biji
Kopi Arabika (Coffea arabika L.) J. Protobiont, 3 (1) : 7-11. Harjadi S. S. 1979. Pengantar Agronomi. Penerbit PT Gramedia. Jakarta.
Holland D., K. Hatib, and I. Bar-Ya’akov. 2009. Pomeganate: Botany, Horticulture, Breeding. Jules Janick (ed). Horticultural Reviews, Vol : 35. John Wiley & Sons, Inc., Israel.
Ismail T.,and
Review Of Potential Anti-Inflammatory and Anti-Infective Effects.
143 (2) : 397-405.
Justice O. L. and Louis N. B. 1994. Prinsip dan Praktek Penyimpanan Benih. PT Raja Grafindo Persada. Jakarta.
Kamil K. 1993. Teknologi Benih. Angkasa Raya Padang. Padang.
Kartasapoetra A. G. 2003. Teknologi Benih Pengolahan Benih dan Tuntunan Praktikum. Rineka Cipta. Jakarta.
Lensari D. 2009. Pengaruh Pematahan Dormansi Terhadap Kemampuan Perkecambahan Benih Angsana (Pterocarpus Indicus Will). Skripsi. Institut Pertanian Bogor. Bogor.
Levin G. M. 1999. Pomeganate. Turkmen Experimental Station of Genetic Resources of Plants, Turkmenistan. Diakses dari tanggal 26 Februari 2015.
Mungnisjah W. Q., A. Setiawan, Suwarto, and C. Santiwa. 1994. Panduan Praktikum dan Penelitian Bidang Ilmu dan Teknologi Benih. Gafindo Persada. Jakarta.
Pomegranate (Punica ganatum L). J. Asian Journal of Plant Science
6 (2) : 427-430.
Purnomosidhi P., J. M. Roshetko, A. Prahmono, A. Suryadi, I. N. Ismawan, and
M. Surgana. 2013. Perlakuan benih sebelum disemai untuk beberapa jenis tanaman prioritas kehutanan, multiguna, buah-buahan, dan perkebunan. Pre-sowing treatments for some priority timber and multipurpose tree species, fruit species, and estate crops. Lembar Informasi AgFor no. 4 Februari. Bogor, Indonesia: World Agroforestry Centre (ICRAF) Southeast Asia Regional Program.
Ramadhani S. 2014. Pengaruh Perlakuan Pematahan Dormansi Secara Kimia Terhadap Viabilitas Benih Delima (Punica granatum L.). Skripsi. Universitas Sumatera Utara. Medan.
Sajad S., Hari S., Sri S. H., Jusup S., Sugihharsono, and Sudarsono. 1975. Dasar-Dasar Teknologi Benih. Biro Penataran. Institut Pertanian Bogor. Bogor. Salisbury F. B. and C. W. Ross. 1992. Fisiologi Tumbuhan. Jilid 2. Terjemahan
oleh Lukman dan Sumaryono. ITB, Bandung.
Sastrosupadi A. 2000. Rancangan Percobaan Praktis Bidang Pertanian. Kanisius. Yogyakarta.
Sutopo L. 2012. Teknologi Benih. Edisi Revisi. Rajawali Pers. Jakarta.
Suyatmi, E. D. Hastuti., and S. Darmanti. 2011. Pengaruh Lama Perendaman dan Konsentrasi Asam Sulfat (H2SO4) Terhadap Perkecambahan Benih
Jati (Tectona gandis Linn.). Laboratorium Biologi Struktur dan Fungsi Tumbuhan Jurusan Biologi Fakultas MIPA UNDIP, Semarang.
United States Department of Agriculture. 2011. Punica granatum L. Diakses dari http://plants.usda.gov/java/ pada tanggal 26 Februari 2015.
Lampiran 1. Kebutuhan bahan kimia dalam larutan 100 ml
No Bahan Kimia Konsentrasi Bahan Kimia
1 H2SO4 97% 25% 25,7 ml
2 50% 51,5 ml
3 75% 77,3 ml
Lampiran 2. Data kadar air benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Lampiran 3. Sidik ragam kadar air benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Lampiran 4. Data uji tetrazolium benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Ulangan
Total Rataan
1 2 3
....%....
K0 (Kontrol) 100,00 100,00 100,00 300,00 100,00
K1 (H2SO4 25 % 10 menit) 80,00 100,00 80,00 260,00 86,67
K2 (H2SO4 25 % 15 menit) 80,00 100,00 80,00 260,00 86,67
K3 (H2SO4 25 % 20 menit) 100,00 100,00 100,00 300,00 100,00
K4 (H2SO4 50 % 10 menit) 100,00 100,00 100,00 300,00 100,00
K5 (H2SO4 50 % 15 menit) 80,00 80,00 100,00 260,00 86,67
K6 (H2SO4 50 % 20 menit) 80,00 100,00 100,00 280,00 93,33
K7 (H2SO4 75 % 10 menit) 80,00 100,00 100,00 280,00 93,33
K8 (H2SO4 75 % 15 menit) 100,00 80,00 80,00 260,00 86,67
K9 (H2SO4 75 % 20 menit) 100,00 100,00 80,00 280,00 93,33
Lampiran 5. Sidik ragam uji tetrazolium benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
SK db JK KT F Hitung F Tabel 0,05 Perlakuan 9 920,00 102,22 1,10 tn 2,39
Galat 20 1866,67 93,33
Total 29 2786,67
FK = 257613,33
KK = 10%
Keterangan
Lampiran 6. Data laju perkecambahan benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Ulangan
Total Rataan
1 2 3
....hari....
K0 (Kontrol) 17,00 17,50 19,00 53,50 17,83
K1 (H2SO4 25 % 10 menit) 15,13 11,70 11,27 38,09 12,70
K2 (H2SO4 25 % 15 menit) 9,81 11,12 10,80 31,73 10,58
K3 (H2SO4 25 % 20 menit) 9,89 9,72 9,52 29,13 9,71
K4 (H2SO4 50 % 10 menit) 10,50 10,86 10,19 31,55 10,52
K5 (H2SO4 50 % 15 menit) 9,93 10,21 10,07 30,21 10,07
K6 (H2SO4 50 % 20 menit) 6,85 7,21 8,27 22,34 7,45
K7 (H2SO4 75 % 10 menit) 6,03 6,37 6,53 18,93 6,31
K8 (H2SO4 75 % 15 menit) 7,07 6,38 7,08 20,53 6,84
K9 (H2SO4 75 % 20 menit) 7,31 6,05 6,53 19,89 6,63
Lampiran 7. Sidik ragam laju perkecambahan benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
SK Db JK KT F Hitung F Tabel 0,05 Perlakuan 9 331,79 36,87 50,05 * 2,39
Galat 20 14,73 0,74
Total 29 346,52
FK = 37442,73
KK = 9%
Keterangan
Lampiran 8. Data kecambah normal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Ulangan
Total Rataan
1 2 3
....%....
K0 (Kontrol) 6,67 6,67 6,67 20,01 6,67
K1 (H2SO4 25 % 10 menit) 76,67 70,00 70,00 216,67 72,22
K2 (H2SO4 25 % 15 menit) 70,00 66,67 66,67 203,34 67,78
K3 (H2SO4 25 % 20 menit) 83,33 76,67 83,33 203,34 81,11
K4 (H2SO4 50 % 10 menit) 63,33 60,00 53,33 243,33 58,89
K5 (H2SO4 50 % 15 menit) 90,00 93,33 83,33 176,66 88,89
K6 (H2SO4 50 % 20 menit) 46,67 40,00 26,67 113,34 37,78
K7 (H2SO4 75 % 10 menit) 96,67 96,67 90,00 283,34 94,45
K8 (H2SO4 75 % 15 menit) 33,33 36,67 33,33 103,33 34,44
K9 (H2SO4 75 % 20 menit) 46,67 56,67 50,00 153,34 51,11
Lampiran 9. Sidik ragam kecambah normal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
SK Db JK KT F Hitung F Tabel 0,05
Perlakuan 9 17690,24 1965,58 3,78 * 2,39
Galat 20 10386,82 519,34
Total 29 28077,06
FK = 98235,30
KK = 38%
Keterangan
Lampiran 10. Transformasi Arcsin data kecambah normal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Lampiran 11. Transformasi Arcsin sidik ragam kecambah normal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Lampiran 12. Data kecambah abnormal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Lampiran 13. Sidik ragam kecambah abnormal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Lampiran 14. Transformasi √(x + 0,5) data kecambah abnormal delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Lampiran 16. Data benih delima yang belum tumbuh pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Ulangan
Total Rataan
1 2 3
....%....
K0 (Kontrol) 93,33 93,33 90,00 276,66 92,22
K1 (H2SO4 25 % 10 menit) 20,00 23,33 13,33 56,66 18,89
K2 (H2SO4 25 % 15 menit) 13,33 16,67 16,67 46,67 15,56
K3 (H2SO4 25 % 20 menit) 6,67 3,33 3,33 13,33 4,44
K4 (H2SO4 50 % 10 menit) 20,00 30,00 30,00 80,00 26,67
K5 (H2SO4 50 % 15 menit) 0,00 3,33 0,00 3,33 1,11
K6 (H2SO4 50 % 20 menit) 33,33 53,33 63,33 149,99 50,00
K7 (H2SO4 75 % 10 menit) 0,00 0,00 0,00 0,00 0,00
K8 (H2SO4 75 % 15 menit) 56,67 46,67 53,33 156,67 52,22
K9 (H2SO4 75 % 20 menit) 46,67 36,67 36,67 120,01 40,00
Lampiran 17. Sidik ragam benih delima yang belum tumbuh pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
SK Db JK KT F Hitung F Tabel 0,05
Perlakuan 9 22788,05 2532,01 69,05 * 2,39
Galat 20 733,36 36,67
Total 29 23521,41
FK = 27199,57
KK = 20%
Keterangan
Lampiran 18. Transformasi Arcsin data benih delima yang belum tumbuh pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Lampiran 20. Data indeks vigor benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Lampiran 21. Sidik ragam indeks vigor benih delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Lampiran 22. Data bobot segar kecambah delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Ulangan
Total Rataan
1 2 3
....g....
K0 (Kontrol) 0,21 0,22 0,18 0,61 0,20
K1 (H2SO4 25 % 10 menit) 1,80 1,95 1,88 5,63 1,88
K2 (H2SO4 25 % 15 menit) 1,94 1,90 1,77 5,61 1,87
K3 (H2SO4 25 % 20 menit) 2,25 2,10 2,50 6,85 2,28
K4 (H2SO4 50 % 10 menit) 2,05 2,13 1,82 6,00 2,00
K5 (H2SO4 50 % 15 menit) 2,84 2,80 2,66 8,30 2,77
K6 (H2SO4 50 % 20 menit) 1,52 1,25 0,94 3,71 1,24
K7 (H2SO4 75 % 10 menit) 3,29 3,40 3,37 10,06 3,35
K8 (H2SO4 75 % 15 menit) 1,16 1,26 1,08 3,50 1,17
K9 (H2SO4 75 % 20 menit) 1,71 1,90 1,66 5,27 1,76
Lampiran 23. Sidik ragam bobot segar kecambah delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
SK Db JK KT F Hitung F Tabel 0,05
Perlakuan 9 20,63 2,29 113,86 * 2,39
Galat 20 0,40 0,02
Total 29 21,0275
FK =102,82
KK = 8 %
Keterangan
Lampiran 24. Data bobot kering kecambah delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
Perlakuan
Ulangan
Total Rataan
1 2 3
...g....
K0 (Kontrol) 0,01 0,02 0,01 0,04 0,01
K1 (H2SO4 25 % 10 menit) 0,24 0,25 0,23 0,72 0,24
K2 (H2SO4 25 % 15 menit) 0,23 0,23 0,23 0,69 0,23
K3 (H2SO4 25 % 20 menit) 0,30 0,26 0,29 0,85 0,28
K4 (H2SO4 50 % 10 menit) 0,20 0,22 0,20 0,62 0,21
K5 (H2SO4 50 % 15 menit) 0,34 0,29 0,30 0,93 0,31
K6 (H2SO4 50 % 20 menit) 0,17 0,14 0,09 0,40 0,13
K7 (H2SO4 75 % 10 menit) 0,37 0,37 0,35 1,09 0,36
K8 (H2SO4 75 % 15 menit) 0,13 0,14 0,10 0,37 0,12
K9 (H2SO4 75 % 20 menit) 0,21 0,22 0,16 0,59 0,20
Lampiran 25. Sidik ragam bobot kering kecambah delima pada perlakuan beberapa konsentrasi dan lama perendaman asam sulfat
SK db JK KT F Hitung F Tabel 0,05
Perlakuan 9 0,28 0,03 66,51 * 2,39
Galat 20 0,01 0,00
Total 29 0,2866
FK = 1,32
KK = 10 %
Keterangan
Lampiran 26. Dekripsi buah delima Nama Tanam : Delima
Warna Buah : Kuning ke merah-merahan
Ukuran Buah : Panjang = 10,8 - 13,5cm; Lebar = 12,2 – 13 cm Berat Buah : 821,16 – 950,22 gr
Bentuk Buah : Bulat Warna daging buah : Merah
Warna Biji : coklat keputihan Berat 100 Biji : 3,40 - 3,69 gr
Ukuran Biji : Panjang = 0,8 - 1 cm; Lebar = 0,4 - 0,5 cm Total Biji dalam Buah : 710 - 827 biji
Asal Negara : Arab Saudi
Lampiran 27. Jadwal Kegiatan
Kecambahan Abnormal (%) x