KHUSUS PADA KARAKTERISTIK PERKEMBANGAN
FOLIKEL DAN DISTRIBUSI KARBOHIDRAT
PADA OVARIUM
AIDELL FITRI RACHMAWATI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ii AIDELL FITRI RACHMAWATI. Morphological study on the Female Reproductive Organ of Malayan Pangolin (Manis javanica) with Special Refferences on the Characteristic of Follicular Development and Distribution of
Carbohydrates in the Ovary. Under direction of CHAIRUN NISA’ and ITA
DJUWITA
The study was aimed to acquire data on the morphology and morphometry of the female reproductive organ of Malayan pangolin and to identify characteristic of follicular development and distribution of carbohydrates in the follicle of ovary. The female reproductive organs were observed macroscopically and their histological characteristic were investigated by general histological procedure. The division of follicular development performed based on the shape and layers of granulosa cells in follicle, the tickness of zona pellucida, and the present of antrum folliculi. The identification of acid and neutral carbohydrates distribution in the follicle was performed using alcian blue (AB) pH 2.5 and periodic acid Schiff (PAS) staining respectively. The collected datas were analyzed descriptively. The result of the study showed that Malayan pangolin have a bicornuate uterus. Their mucosa of the cervix devided into primary, secondary and tertiary folds. Both ovaries have ovoid/ellipsoidal in shape and their medula filled with the large amount of interstitial secretory cells. Follicular development in the ovary is devided into 10 stages. Stages 1-2 is primordial follicle, stages 3-4 is primary follicle, stages 5-7 is secondary follicle, and stages 8-10 is tertiary follicle. The amount of developed follicle in the left ovary is higher than in the righ ovary. Acid carbohydrate begin to appear in zona pelucida of follicle type 5 and the neutral carbohydrate begin to appear in extracelluler matrix of follicle type 4 with the very low intensity of positive reaction.
iii AIDELL FITRI RACHMAWATI. Morfologi Organ Reproduksi Betina Trenggiling Jawa (Manis javanica) dengan Tinjauan Khusus pada Karakteristik Perkembangan Folikel dan Distribusi Karbohidrat pada Ovarium. Dibimbing oleh
CHAIRUN NISA’ dan ITA DJUWITA.
Trenggiling merupakan salah satu mamalia unik yang dilindungi. Terdapat delapan spesies trenggiling di dunia yang tersebar di wilayah hutan tropis Asia dan daerah tropis hingga subtropis Afrika. Trenggiling Jawa (Manis javanica) merupakan jenis yang dapat ditemukan di Indonesia. Persebaran trenggiling Jawa di Indonesia adalah mencakup pulau Sumatera, Kalimantan, Jawa, Bali dan beberapa pulau kecil di sekitarnya. Keberadaan trenggiling Jawa di alam mengalami penurunan akibat perburuan liar dan kerusakan habitat sehingga trenggiling Jawa dimasukkan ke dalam daftar satwa terancam punah (endangered species) dan golongan Apendix II. Risiko kepunahan trenggiling Jawa yang tinggi dapat didukung pula oleh kemampuan reproduksinya yang hanya dapat menghasilkan 1-2 anak dalam satu periode kebuntingan. Salah satu upaya konservasi yang dapat dilakukan untuk melestarikan jenis trenggiling Jawa adalah dengan meningkatkan pemahaman tentang organ reproduksi betina trenggiling Jawa khususnya pada bagian ovarium.
Penelitian dilakukan terhadap morfologi dan morfometri serta gambaran mikroskopis ovarium (n=4), dan saluran reproduksi yang terdiri dari tuba uterina, kornua uteri, korpus uteri, serviks uteri, vagina (n=2); karakteristik perkembangan folikel dalam ovarium; dan distribusi karbohidrat pada perkembangan ovarium. Ovarium dan salurannya difiksasi dengan larutan Bouin dan diproses sesuai dengan standar pembuatan preparat histologi. Preparat diwarnai dengan pewarnaan hematoksilin eosin dan Masson’s trichome untuk mengamati gambaran mikroskopis organ reproduksi secara umum, serta pewarnaan alcian blue (AB) pH 2.5 untuk mendeteksi keberadaan karbohidrat asam dan periodic acid Schiff (PAS) untuk mendeteksi keberadaan karbohidrat netral.
Perhitungan jumlah folikel dilakukan dengan metode estimasi, yaitu dengan terlebih dahulu mencari faktor pengali untuk masing-masing tipe folikel. Faktor pengali dihitung dengan cara menjumlahkan setiap tipe folikel pada 25 sayatan serial pertama, kemudian dibagi dengan jumlah folikel pada setiap kelipatan lima. Estimasi jumlah folikel pada setiap tahapan diketahui dari hasil perkalian faktor pengali dengan jumlah folikel pada setiap tahap yang ditemukan pada sayatan ke-1, 5, 10, 15, 20, dan 25 pada setiap ovarium.
iv bagian tunika albuginea. Bagian medula didominasi oleh se-sel sekretori interstisial.
Trenggiling Jawa memiliki uterus dengan tipe bikornua. Secara mikroskopis, bagian endometrium pada trenggiling Jawa dilapisi oleh epitel silindris sebaris yang membentuk lipatan mukosa longitudinal. Bagian lamina propria endometrium yang merupakan lapisan fungsional memiliki kelenjar uterin dalam jumlah yang banyak.
Serviks uteri pada trenggiling Jawa memiliki mukosa yang berlipat. Lipatan ini terbagi menjadi lipatan primer, sekunder dan tersier. Epitel yang menutupi mukosa serviks uteri adalah epitel silindris sebaris bersilia yang memiliki sel goblet. Sel goblet berfungsi untuk menyediakan mukus karena pada daerah lamina propria serviks sangat sedikit ditemukan kelenjar.
Perkembangan folikel dapat ditemukan di lapisan korteks pada bagian superfisial ovarium. Folikel dalam ovarium dikelompokkan ke dalam 10 tipe berdasarkan perkembangannya. Pengelompokan dilakukan berdasarkan pada bentuk dan lapisan sel granulosa pada folikel, ketebalan zona pelusida dan keberadaan antrum folikuli. Masing-masing tahap perkembangan diwakili oleh 1 tipe folikel yang memiliki karakteristik tersendiri.
Folikel tipe 1 memiliki ciri oosit yang dikelilingi oleh satu lapis sel pregranulosa yang berbentuk pipih. Folikel tipe 2 yang merupakan perkembangan lanjutan dari folikel tipe 1. Folikel ini memiliki karakteristik oosit yang dikelilingi oleh sel pregranulosa yang berbentuk peralihan antara pipih dan kuboid. Folikel tipe 3 memiliki ciri oosit yang dikelilingi oleh satu lapis sel granulosa berbentuk kuboid. Folikel tipe 4 memiliki ciri oosit yang dikelilingi oleh lebih dari satu sampai dua lapis sel granulosa berbentuk kuboid. Folikel tipe 5 memiliki ciri oosit yang dikelilingi oleh tiga sampai lima lapis sel granulosa. Pada folikel ini zona pelusida sudah mulai terbentuk sebagai suatu lapisan tipis disekeliling oosit.
Folikel tipe 6 memiliki karakteristik yang tidak jauh berbeda dengan folikel tipe 5. Perbedaan dengan folikel tipe 5 terletak pada jumlah sel granulosa yang mengelilingi oosit. Pada folikel tipe 6 sel granulosa berkembang hingga mencapai 6-12 lapis. Selain itu zona pelusida terlihat jelas sebagai lapisan tipis di antara oosit. Folikel tipe 6 berkembang menjadi folikel tipe 7 yang memiliki karakteristik yang hampir sama dengan folikel tipe 6. Ciri khas folikel tipe 7 adalah zona pelusida yang terlihat semakin menebal. Antrum folikuli mulai terbentuk pada folikel tipe 8. Antrum folikuli tersebut semakin membesar sehingga folikel berkembang menjadi folikel tipe 9. Oosit pada folikel tipe 9 mulai bergerak ke tepi folikel. Folikel tipe 10 merupakan tahap akhir perkembangan tipe folikel sebelum diovulasikan. Oosit pada folikel tipe 10 berada di tepi folikel dengan antrum folikuli yang membesar.
v Distribusi karbohidrat diamati pada oosit, matriks ekstraseluler, zona pelusida, dan cairan folikuli setiap folikel. Hasil pengamatan memperlihatkan adanya perbedaan distribusi karbohidrat asam dan karbohidrat netral pada setiap tahap perkembangan folikel. Pewarnaan AB pH 2.5 menunjukkan hasil positif mulai dari folikel tipe 5. Reaksi positif pewarnaan PAS mulai terlihat pada folikel tipe 4, yaitu pada matriks ekstraseluler dengan intensitas reaksi positif yang sangat lemah (±).
vii
KHUSUS PADA KARAKTERISTIK PERKEMBANGAN
FOLIKEL DAN DISTRIBUSI KARBOHIDRAT
PADA OVARIUM
AIDELL FITRI RACHMAWATI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
i Dengan ini saya menyatakan bahwa skripsi Morfologi Organ Reproduksi Betina Trenggiling Jawa (Manis javanica) dengan Tinjauan Khusus pada Karakteristik Perkembangan Folikel dan Distribusi Karbohidrat pada Ovarium adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
Aidell Fitri Rachmawati
vi
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan wajar IPB.
viii Nama : Aidell Fitri Rachmawati
NRP : B04070023
Disetujui
Dr. Drh. Chairun Nisa’, MSi, PAVet. Ketua
Dr. Drh. Ita Djuwita, MPhil, PAVet (K) Anggota
Diketahui
Dr. Dra. Nastiti Kusumorini Wakil Dekan Fakultas Kedokteran Hewan
ix Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul ”Morfologi Organ Reproduksi Betina Trenggiling Jawa (Manis javanica) dengan Tinjauan Khusus pada Karakteristik Perkembangan Folikel dan Distribusi Karbohidrat pada Ovarium”.
Penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada: 1. Dr. drh. Chairun Nisa’, MSi, PAVet. selaku ketua komisi pembimbing dan Dr.
drh. Ita Djuwita, MPhil, PAVet (K) selaku anggota komisi pembimbing atas segala bimbingan, masukan, serta nasihat sehingga penulis dapat menyelesaikan penelitian dan skripsi ini.
2. Ayahanda Odang Surachmat, Ibunda Tati Haryati, serta kedua adik tercinta: M. Khairul Andika dan M. Khairul Gemilang atas semua dukungan yang telah diberikan selama ini kepada penulis.
3. drh. Herwin Prisestiyani, MSi dan drh. Ni Wayan Kurniani Karja, PhD atas kerelaan waktunya menjadi dosen penguji dalam sidang, serta drh. Wahono Esthi P, MSi dan drh. Koesdiantoro Muhammad, MSi atas kerelaan waktunya menjadi dosen penilai dan moderator dalam seminar skripsi penulis.
4. Dr. drh. Elok Budi Retnani, MS selaku pembimbing akademik atas segala dukungan dan semangat yang diberikan kepada penulis dalam proses penyelesaian skripsi.
5. Dr. drh. Nurhidayat PAVet; drh. Sri Wahyuni; Drh. Srihadi Agungpriyono, Ph.D. PAVet (K); drh. Supratikno, M.Si; Dr. drh. Heru Setijanto PAVet (K); dan drh. Savitri Novelina, M.Si atas bimbingan dan bantuan literatur dalam melakukan penelitian.
6. Teknisi laboratorium riset anatomi: mas Rudi, pak Kholid dan mas Bayu atas semua bantuan yang diberikan kepada penulis pada saat penelitian.
x 8. Rekan angkatan Giannuzi 44 khususnya Auliya Indiarti Zen, Risma Adelia,
Megasari Kusuma, Nurida Dessalma S, Yeni Setiorini yang telah banyak memberikan semangat dan dukungan kepada penulis.
9. Rekan UKM Uni Konservasi Fauna khususnya Hanna Mery A, Yudia Putri A, Dini Herlina, Ika Kartika, M. Angga Saputra, Agung Kurniawan, Bagus Chandra, Wahyu Iskandar, Erry Kurniawan, dan Sasi Kirono yang telah membantu penulis secara tidak langsung dalam penyusunan skripsi.
Semoga skripsi ini bermanfaat.
Bogor, Oktober 2011
xi Penulis merupakan anak pertama dari tiga bersaudara, dari pasangan Bapak Odang Surachmat dan Ibu Tati Haryati.
Pendidikan formal penulis dimulai dari Taman Kanak-kanak PGRI Tunas 83 yang diselesaikan pada tahun 1996. Kemudian dilanjutkan pendidikan dasar di SDN Karang Tengah 4 Sukabumi hingga tahun 2002. Tahun 2005 penulis berhasil menyelesaikan pendidikan di SMPN 1 Cibadak dan dilanjutkan dengan pendidikan di SMAN 3 Sukabumi hingga tahun 2007.
xii Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Manfaat ... 3
TINJAUAN PUSTAKA Trenggiling ... 4
1. Klasifikasi dan Persebaran ... 4
2. Anatomi Tubuh ... 5
3. Perilaku Alami ... 6
Sistem Reproduksi Betina ... 7
1. Ovarium ... 8
2. Tuba Uterina ... 9
3. Uterus ... 10
4. Vagina ... 12
5. Vestibula ... 13
6. Vulva dan Klitoris ... 14
Proses Perkembangan Folikel (folikulogenesis) dalam Ovarium ... 15
Peran Karbohidrat dalam Proses Fertilisasi ... 17
MATERI DAN METODE Lokasi dan Waktu ... 19
Materi ... 19
Metode ... 20
1. Pengamatan Makroskopis Organ Reproduksi ... 20
2. Karakteristik Histologi Organ Reproduksi ... 20
3. Karakteristik Histologi Perkembangan Folikel dalam Ovarium.. ... 22
4. Distribusi Karbohidrat dalam Perkembangan Folikel ... 22
HASIL Struktur Makroskopis ... 23
Karakteristik Histologi Saluran Reproduksi ... 27
Karakteristik Histologi Perkembangan Folikel dalam Ovarium ... 30
Distribusi Karbohidrat dalam Perkembangan Folikel ... 36
PEMBAHASAN ... 40
SIMPULAN DAN SARAN Simpulan ... 49
Saran ... 49
DAFTAR PUSTAKA ... 50
xiii 1 Pengukuran ovarium kanan dan kiri dari dua sampel
organ reproduksi betina trenggiling Jawa ... 24 2 Pengukuran panjang saluran reproduksi betina trenggiling
Jawa ... 25 3 Jumlah folikel pada berbagai tahapan perkembangan
folikel ovarium trenggiling Jawa ... 36 4 Distribusi karbohidrat pada setiap tahap perkembangan
folikel ovarium trenggiling Jawa dengan metode pewarnaan
xiv
1 Perkiraan wilayah persebaran trenggiling Jawa ... 5
2 Trenggiling Jawa (Manis javanica) ... 5
3 Skema organ reproduksi betina pada domba (A) dan anjing (B). ... 7
4 Gambaran histologi tuba uterina sapi. ... 10
5 Gambaran mikroskopis organ kornua uteri sapi ... 11
6 Gambaran histologis vagina kucing pada fase estrus (A) dan anjing pada fase anestrus (B). ... 13
7 Perbandingan bentuk vulva dari berbagai jenis hewan. ... 14
8 Perkembangan folikel dalam ovarium ... 16
9 Skema perkembangan folikel dalam ovarium ... 17
10 Skematis organ kelamin betina yang menunjukkan bagian yang diambil sebagai sampel penelitian ... 21
11 Gambaran makroskopis organ reproduksi betina trenggiling Jawa yang difiksasi dalam larutan Bouin ... 23
12 Gambaran makroskopis ovarium dan tuba uterina trenggiling Jawa dengan kode MJ-1. ... 25
13 Skema interior organ reproduksi betina trenggiling Jawa ... 26
14 Lapisan endometrium kornua uteri. ... 28
15 Gambaran mikroskopis serviks trenggiling Jawa ... 29
16 Gambaran mikroskopis vagina. ... 30
17 Gambaran histologi ovarium trenggiling Jawa. ... 31
18 Ovarium trenggiling Jawa (A) dengan perbesaran gambaran bagian medula (a) ... 31
19 Folikel tipe 1 dengan ciri oosit dikelilingi oleh satu lapis sel pregranulosa berbentuk pipih (tanda panah). ... 32
20 Folikel tipe 2 dengan ciri oosit dikelilingi oleh satu lapis sel pregranulosa berbentuk transisi antara pipih dan kuboid (tanda panah). ... 32
21 Folikel tipe 3 dengan ciri oosit dikelilingi oleh satu lapis sel granulosa berbentuk kuboid (tanda panah) ... 32
22 Folikel tipe 4 dengan ciri oosit dikelilingi oleh 1-2 lapis sel granulosa berbentuk kuboid (tanda panah) ... 33
23 Folikel tipe 5 dengan ciri oosit dikelilingi oleh 2-5 lapis sel granulosa. ... 33
24 Folikel tipe 6 dengan ciri oosit dikelilingi oleh lebih dari 5 lapis sel granulosa. ... 33
25 Folikel tipe 7 dengan ciri oosit dikelilingi oleh lebih dari 5 lapis sel granulosa berbentuk kuboid. ... 33
26 Folikel tipe 8 dengan ciri oosit dilapisi oleh lebih dari lima lapis sel granulosa berbentuk kuboid. ... 34
xv Antrum folikuli membesar hingga ukuran maksimal ... 34 29 Distribusi karbohidrat asam pada tahapan perkembangan
folikel ovarium trenggiling Jawa ... 38 30 Distribusi karbohidrat netral pada tahapan perkembangan
xvi
1 Proses Dehidrasi Jaringan ... 54
2 Prosedur Pewarnaan Hematoksilin Eosin ... 55
3 Prosedur Pewarnaan Masson’s Trichome... 56
4 Prosedur Pewarnaan Alcian Blue (AB) pH 2.5... 57
5 Prosedur Pewarnaan Periodic Acid Schiff (PAS) ... 59
PENDAHULUAN
Latar Belakang
Trenggiling merupakan salah satu mamalia unik yang dilindungi. Hewan ini memiliki morfologi yang lebih menyerupai reptil dibandingkan dengan mamalia. Hal ini dikarenakan seluruh tubuh trenggiling ditutupi oleh sisik yang merupakan modifikasi rambut (Nowak 1991). Keunikan lain dari mamalia pemakan semut dan rayap ini terdapat pada sistem pencernaannya. Selain tidak memiliki gigi, lambung trenggiling memiliki kekhususan yaitu seluruh permukaan mukosa lumennya ditutupi oleh epitel pipih banyak lapis yang mengalami keratinisasi untuk melindungi permukaan tersebut dari abrasi. Selain itu, pada bagian antrum pilorus trenggiling terdapat penebalan otot yang menyerupai gizzard pada sistem pencernaan unggas, serta pada permukaan mukosanya terdapat tonjolan-tonjolan berbentuk konikal dan disebut “pyloric teeth”. Karakteristik morfologi lambung yang memiliki keistimewaan tersebut diduga terkait dengan ketiadaan gigi (toothless) sebagai percerna mekanik makanan trenggiling (Nisa’ 2005).
Terdapat delapan spesies trenggiling di dunia yang tersebar di wilayah hutan tropis Asia dan daerah tropis hingga subtropis Afrika. Empat spesies trenggiling yang tersebar di wilayah Asia adalah Manis crassicaudata (trenggiling India), M. pentadactyla (trenggiling Cina), M. culionensis (trenggiling Palawan) dan M. javanica (trenggiling Jawa) yang dapat ditemukan di Indonesia. Persebaran trenggiling Jawa di Indonesia meliputi pulau Sumatera, Kalimantan, Jawa, Bali dan beberapa pulau kecil di sekitarnya (Corbert dan Hill 1992).
Risiko kepunahan trenggiling Jawa yang tinggi didukung pula oleh kemampuan reproduksinya yang hanya dapat menghasilkan 1-2 anak dalam satu periode kebuntingan. Aktivitas reproduksi merupakan salah satu upaya yang dilakukan makhluk hidup untuk melestarikan jenis (Tartaglia dan Waugh 2002). Hewan vertebrata pada umumnya melakukan reproduksi dengan cara seksual atau perkawinan. Sel gamet jantan (spermatozoa) dideposisikan ke dalam saluran reproduksi betina pada saat kopulasi. Sel-sel tersebut kemudian akan bergerak menuju sel gamet betina (oosit) dan melakukan fertilisasi sehingga terbentuk zigot. Proses fertilisasi pada hewan mamalia biasa terjadi di dalam saluran reproduksi betina. Hal ini menyebabkan organ reproduksi betina pada mamalia memiliki peranan penting untuk perkembangan embrio dan fetus selanjutnya (Kobayashi dan Behringer 2003).
Informasi mengenai karakteristik anatomi organ reproduksi pada trenggiling Jawa telah dilaporkan oleh Kimura et al. (2006). Berdasarkan hasil penelitian tersebut dilaporkan bahwa trenggiling Jawa memiliki bentuk ovarium oval atau
ellipsoidal. Ovarium tersebut tidak memiliki bursa ovari seperti pada tikus (Sztein et al. 1998) dan kancil (Hamny 2006). Selain itu trenggiling Jawa memiliki tipe uterus bikornua dan tipe plasenta difusa dengan kategori
epitheliochorial (Kimura et al. 2006).
Tujuan
Penelitian ini bertujuan untuk mengetahui struktur morfologi makroskopis dan mikroskopis serta morfometri organ reproduksi betina trenggiling Jawa (M. javanica) yang meliputi ovarium, tuba uterina, kornua uteri, korpus uteri, serviks uteri, vagina dan vulva. Selain itu penelitian ini secara khusus bertujuan untuk mengetahui karakteristik tahapan perkembangan folikel (folikulogenesis) dalam ovarium, serta perubahan distribusi karbohidrat selama tahapan perkembangan ovarium.
Manfaat
TINJAUAN PUSTAKA
Trenggiling
1. Klasifikasi dan Persebaran
Trenggiling merupakan salah satu mamalia yang dilindungi. Lekagul dan McNeely (1977) menyebutkan bahwa terdapat 7 spesies trenggiling yang tersebar di daerah Asia dan daerah tropis dan subtropis Afrika. Berdasarkan penelitian Gaubert dan Antunes pada tahun 2005 tentang karakteristik morfologi, terdapat penambahan satu spesies trenggiling baru di daerah Asia, sehingga jumlah spesies trenggiling di dunia saat ini adalah 8 spesies (IUCN 2011).
Trenggiling yang tersebar di daerah Asia adalah Manis crassicaudata (trenggiling India), M. pentadactyla (trenggiling Cina), M. javanica (trenggiling Jawa), dan M. culionensis (trenggiling Palawan). Empat spesies trenggiling yang terdapat di daerah tropis dan subtropis Afrika adalah M. tricuspis (trenggiling perut putih Afrika), M. temminckii (trenggiling Afrika Selatan), M. tetradactyla (trenggiling perut hitam) dan M. gigantea (trenggiling raksasa).
Manis javanica merupakan spesies trenggiling yang dapat ditemukan di Indonesia. Persebarannya adalah di hutan Sumatera, Kalimantan, Jawa, Bali, dan beberapa pulau kecil di sekitarnya (Corbert dan Hill 1992). Berikut ini adalah taksonomi trenggiling Jawa.
Kingdom : Animalia Filum : Chordata Kelas : Mamalia Ordo : Pholidota Famili : Manidae Genus : Manis
Gambar 1. Perkiraan wilayah persebaran trenggiling Jawa. (Modifikasi dari sumber; www.savepangolins.org)
2. Anatomi Tubuh
Trenggiling adalah satwa mamalia yang unik karena satwa tersebut secara morfologi menyerupai reptil daripada mamalia. Seluruh tubuh trenggiling ditutupi oleh sisik berwarna kuning kecokelatan yang merupakan modifikasi dari rambut. Trenggiling memiliki dua pasang kaki pendek yang kokoh. Kaki tersebut dilengkapi oleh kuku kuku panjang yang menyerupai cakar. Kuku tersebut dapat berfungsi sebagai alat bantu untuk memanjat dan menggali (Vaughan 1978).
Gambar 2. Trenggiling jawa (Manis javanica). (sumber: www.savepangolins.org)
dengan panjang ekor sekitar 45-65% dari panjang total tubuh. Kepala trenggiling kecil dan memiliki bagian moncong yang sempit, sedangkan bagian telinganya tidak berkembang terletak di bagian caudodorsal (Grzimek 1975).
Trenggiling memiliki keunikan pada sistem pencernaannya. Hewan ini memiliki sistem pencernaan yang mirip dengan unggas. Pada rongga mulutnya tidak ditemukan gigi. Gigi geligi tersebut sebenarnya dapat ditemukan pada masa prenatal, kemudian menghilang sesuai dengan perkembangan trenggiling. Nisa’ (2005) menyebutkan bahwa penampakan lambung secara eksterior tidak berbeda dengan lambung mamalia monogastrik pada umumnya, yaitu berbentuk menyerupai kacang mede atau kacang merah. Perbedaan terlihat pada bagian internal lambung yaitu bagian berdinding otot tebal yang mirip gizzard pada sistem pencernaan unggas.
Lidah pada trenggiling dapat menjulur panjang dan dihubungkan oleh otot-otot yang berkembang subur. Lidah trenggiling berbentuk ramping dan panjang. Lidah ini akan semakin menipis dan menyempit pada bagian apex (Sari 2007). Bentuk tersebut membuat lidah trenggiling menyerupai cacing (vermiform). Lidah yang panjang ini dan bersifat lengket, sehingga memudahkan trenggiling untuk mencari pakan (Amir 1978).
3. Perilaku Alami
Yasuma (1994) menyebutkan bahwa trenggiling merupakan hewan nokturnal dan bersifat soliter. Aktivitas yang biasa dilakukan trenggiling pada siang hari adalah beristirahat atau tidur di lubang-lubang di bawah tanah atau di pohon. Makanan utama hewan ini adalah semut, rayap dan serangga lainnya. Daya penciuman yang berkembang baik menjadi salah satu faktor pendukung bagi trenggiling dalam mencari makanan (Lekagul dan McNeely 1997).
kelenjar perianal yang menghasilkan sekreta berbau tajam. Sekreta ini berbau menyerupai urin menyengat dan biasa digunakan untuk menandai teritori trenggiling (Vaughan 1978).
Spesies trenggiling Afrika biasanya melahirkan satu anak dalam sekali kebuntingan. Masa kebuntingan trenggiling belum diketahui dengan pasti. Diduga bahwa masa kebuntingan pada trenggiling relatif singkat, yaitu 2-3 bulan (Lekagul dan McNeely 1977). Setelah melahirkan trenggiling betina akan membawa anaknya di pangkal ekor sebagai bentuk pengasuhan.
Sistem Reproduksi Betina
Organ reproduksi betina tersusun terdiri dari ovarium, tuba uterina, uterus (kornua dan korpus), serviks uteri, vagina dan organ reproduksi eksternal (Hafez dan Hafez 2000; Samuelson 2007). Masing-masing organ reproduksi tersebut dapat memiliki perbedaan antar spesies mamalia (Kobayashi dan Behringer 2003). Gambar 3 menunjukkan gambaran organ reproduksi betina pada domba dan anjing.
A B
Gambar 3 Skema organ reproduksi betina pada domba (A) dan anjing (B). a. ovarium, b. bursa ovari, c. tuba uterina, d. kornua uteri, e. korpus uteri, f. serviks uteri, g. vagina, h. jaringan penggantung (Modifikasi dari sumber: Constantinescu 2007).
b
a c
d
e
f
g h
a
d
e
f
1. Ovarium
Ovarium merupakan organ penting dalam sistem reproduksi. Organ ini memiliki fungsi eksokrin karena menghasilkan sel telur (ovum) dan juga memiliki fungsi endokrin karena menghasilkan hormon reproduksi seperti estrogen dan progesteron (Frandson 1992; Hafez dan Hafez 2000). Setiap hewan memiliki sepasang ovarium yang letaknya berbeda pada setiap jenisnya, namun pada umumnya, ovarium kanan terletak di caudal ginjal kanan dan ovarium kiri terletak di caudal ginjal kiri (Frandson 1992).
Bentuk ovarium bervariasi bergantung pada jenis hewan dan siklus birahi (Samuelson 2007; Pineda dan Dooley 2003), tetapi secara umum bentuk ovarium dapat dideskripsikan sesuai dengan jenis kebuntingan pada hewan. Ovarium pada hewan politokosa (menghasilkan banyak keturunan dalam sekali kebuntingan) seperti anjing, kucing dan babi, memiliki beberapa folikel dan korpus luteum sehingga bentuk yang dihasilkan mirip dengan buah anggur dengan berbagai ukuran. Hewan monotokosa (menghasilkan satu keturunan dalam sekali kebuntingan) seperti sapi, memiliki ovarium yang berbentuk oval menyerupai telur. Kuda memiliki bentuk ovarium menyerupai ginjal karena pada kuda terdapat fossa ovulatori (Pineda dan Dooley 2003).
Secara histologis, ovarium terdiri dari bagian korteks dan medula yang dibungkus oleh lapisan epitel kubus sebaris yang disebut germinal epithelium. Bagian medula terdiri dari jaringan ikat fibroelastik, jaringan saraf dan pembuluh darah. Menurut Samuelson (2007), serabut saraf yang berada pada bagian medula tidak dibungkus oleh serabut myelin dan cenderung memiliki fungsi vasomotorik, tetapi beberapa diantaranya ada yang memiliki kemampuan sensorik. Pembuluh darah ini memberikan vaskularisasi untuk folikel dan perkembangan serta regresi korpus luteum.
mesovarium memberikan tempat bagi pembuluh darah dan saraf untuk masuk ke dalam ovarium (Samuelson 2007). Bagian korteks ovarium yang merupakan bagian superfisial terdiri dari jaringan ikat, berbagai fase perkembangan folikel ovarium dan/atau korpus luteum dalam berbagai fase regresi (Hafez dan Hafez 2000).
2. Tuba Uterina
Tuba uterina (tuba Fallopii) merupakan saluran tempat terjadinya fertilisasi. Sel telur yang dilepaskan ovarium ditangkap oleh infundibulum dan masuk ke dalam tuba uterina dan digerakkan menuju uterus oleh sel epitel tuba uterina yang bersilia. Tuba uterina memiliki tiga bagian, yaitu infundibulum, ampulla dan isthmus (Samuelson 2007).
Infundibulum adalah bagian dari tuba uterina yang letaknya paling dekat dengan ovarium. Infundibulum berbentuk seperti corong yang memiliki bagian penangkap sel telur yang diovulasikan oleh ovarium yang disebut fimbrae. Fimbrae akan bergabung menjadi stuktur tubular tunggal pada bagian akhir distal infundibulum, sebelum akhirnya bergabung menjadi ampulla (Samuelson 2007).
Ampulla merupakan daerah tempat berlangsungnya fertilisasi. Pada bagian ini terdapat banyak lipatan mukosa. Ampulla kemudian menjadi isthmus yang memiliki lapisan muskular yang lebih tipis dibandingkan dengan ampulla. Selain itu, bagian isthmus memiliki percabangan yang lebih pendek pada lipatan mukosanya.
Gambar 4 Gambaran histologi tuba uterina sapi. Bagian ampulla (A) dan infundibulum (B) menunjukan adanya lipatan mukosa (1), tunika muskularis (2) yang tebal pada bagian ampulla, dan tipis pada bagian infundibulum, serta keberadaan jaringan lemak (3) pada bagian ampulla. Serosa (4) melapisi seluruh bagian superfisial organ (Modifikasi dari sumber; Bacha dan Bacha 2000).
Epitel silindris pada bagian tuba uterina memiliki kinosilia dan mikrovili, atau hanya memiliki mikrovili saja. Sel-sel yang bersilia terdapat pada bagian infundibulum. Sel-sel tersebut membantu pergerakan sel telur yang diovulasikan menuju uterus. Sel epitel yang tidak bersilia pada bagian mukosa tuba uterina berfungsi untuk mensekresikan dan menyediakan nutrisi pendukung untuk perpindahan gamet. Sekresi tersebut juga membantu pematangan spermatozoa atau proses kapasitasi (Samuelson 2007).
Lapisan submukosa merupakan lapisan di bawah mukosa. Lapisan ini terdiri dari jaringan ikat longgar yang tersusun oleh kolagen, serat elastin, sel limfoid, dan kadang terdapat sel mast. Lapis muskular, atau tunika muskularis, merupakan lapis otot polos di bawah lapis submukosa. Bagian tersebut terdiri atas otot polos melingkar pada bagian dalam dan otot polos longitudinal pada bagian luar. Otot polos ini makin menebal mulai dari daerah isthmus hingga mendekati uterus. Bagian superfisial tunika muskularis dilapisi oleh serosa yang tersusun dari jaringan ikat longgar dan epitel kubus sebaris.
3. Uterus
Uterus terbagi menjadi tiga bagian yaitu tanduk uterus (kornua uteri), badan uterus (korpus uteri), dan leher uterus (serviks uteri). Akers dan Denbow (2008) menyebutkan bahwa terdapat tiga tipe uterus. Tipe dupleks
A B
1
4
2 2
3 1
memiliki sepasang korpus, serviks dan kornua uterus, yaitu bagian kanan dan kiri. Tipe bikornua memiliki sepasang kornua di bagian kanan dan kiri dan hanya memiliki satu korpus yang kecil dan serviks. Tipe simpleks memiliki sebuah korpus uteri yang besar dan serviks. Trenggiling Jawa memiliki uterus dengan tipe bikornua (Kimura et al. 2006)
Setiap bagian uterus terdiri dari beberapa lapisan. Lapisan mukosa pada uterus disebut endometrium, lapis tunika muskularis disebut miometrium dan lapis tunika serosa atau visceral peritoneum yang disebut perimetrium (Constantinescu 2007). Endometrium disusun oleh tunika mukosa dan submukosa yang mengelilingi lumen uterus. Epitel yang menutupi endometrium adalah epitel silindris selapis pada kuda, kucing dan anjing, sedangkan pada babi dan sapi adalah epitel silindris banyak lapis (Samuelson 2007).
Lapisan endometrium mengandung kelenjar uterin atau kelenjar endometrium yang letaknya menyebar (Frandson 1992). Hafez dan Hafez (2000) menyebutkan bahwa kelenjar uterin memiliki fungsi sebagai penghasil cairan uterus. Bentuk kelenjar uterin adalah tubulus yang memiliki cabang dan menggulung. Struktur tubulus kelenjar uterin dilapisi oleh epitel kubus. Kelenjar ini dikelilingi oleh jaringan ikat dan pembuluh darah (Samuelson 2007).
Gambar 5 Gambaran mikroskopis organ kornua uteri sapi. Kelenjar uterin (1) tersebar dalam jumlah yang banyak pada lapisan endometrium. Lapisan miometrium terdiri dari lapisan otot sirkuler pada bagian profundal (2), dan otot longitudinal pada bagian superfisial (3). Preparat menunjukkan adanya bagian yang mengalami hemoragi (4) (Modifikasi dari sumber; Bacha dan Bacha 2000).
1 4
2
3
Ruminansia memiliki struktur khusus pada lapisan mukosa di bagian kornua uteri dan korpus uteri yang disebut karunkula (Constantinescu 2007). Karunkula dapat memiliki bentuk membulat (sapi) atau seperti lekukan mangkuk (domba). Karunkula mendapatkan suplai darah yang cukup baik, tetapi pada daerah ini kelenjar tubular yang dapat ditemukan sangat sedikit (Samuelson 2007).
Miometrium merupakan bagian tunika muskularis dari korpus dan kornua uteri. Bagian ini terdiri dari tiga lapis otot polos. Lapisan dalam yang lebih tipis merupakan otot polos melingkar (sirkular) dan otot polos yang berjalan miring (oblique). Lapisan luar merupakan otot polos longitudinal (Constantinescu 2007). Perimetrium merupakan tunika serosa pada bagian korpus dan kornua uteri. Lapisan ini tersusun oleh jaringan ikat longgar yang dilapisi epitel kubus sebaris di bagian eksternal (Samuelson 2007).
Bagian kaudal uterus adalah serviks uteri yang berhubungan langsung dengan vagina. Bagian ini memiliki struktur menyerupai sphincter karena bagian lumen yang pada umumnya selalu berkontraksi. Penyusun serviks uteri didominasi oleh jaringan ikat yang mengandung sedikit otot polos (Hafez dan Hafez 2000). Kelenjar penghasil mukus sangat sedikit ditemukan pada bagian serviks uteri. Mukus yang dihasilkan, berasal dari sel epitel penghasil mukus seperti sel goblet (Samuelson 2007).
4. Vagina
Vagina merupakan saluran reproduksi yang terletak di dalam rongga pelvis. Organ ini menghubungkan uterus dengan vestibula. Vagina memiliki beberapa fungsi dalam sistem reproduksi, diantaranya adalah sebagai organ kopulatoris. Semen yang dikeluarkan organ kelamin jantan pada saat kopulasi dideposisi di dalam vagina sebelum bergerak menuju sel telur.
Gambar 6 Gambaran histologis vagina kucing pada fase estrus (A) dan anjing pada fase anestrus (B). Epitel vagina kucing pada fase estrus merupakan epitel pipih banyak lapis (1) yang berkeratinisasi sehingga menjadi lebih tebal. Sel berkeratinisasi (2) dapat ditemukan dibagian lumen. 3: Lamina propria (Modifikasi dari sumber; Bacha dan Bacha 2000).
Tunika muskularis vagina bagian kaudal dibungkus oleh tunika adventisia. Lapisan ini terdiri dari jaringan ikat yang mengandung pembuluh darah dan saraf untuk daerah vagina. Adapun pada bagian kranial vagina, tunika muskularis dibungkus oleh tunika serosa yang memiliki lapisan otot polos longitudinal yang tipis (Samuelson 2007).
5. Vestibula
Vestibula merupakan bagian tubular antara vulva dan vagina. Batas antara vestibula dengan vagina ditandai dengan adanya orificium urethralis externa (Hafez dan Hafez 2000). Frandson (1992) menyebutkan bahwa di bagian kranial dari orificium tersebut terdapat hymen vestigial yang sering mempengaruhi proses kopulasi.
Menurut Samuelson (2007), epitel yang melapisi vestibula adalah epitel kubus banyak baris. Pada hewan ruminansia dan kucing, epitel tersebut dibasahi oleh sekresi mukus dari kelenjar tubuloasinar, yaitu kelenjar vestibula mayor. Kelenjar ini memiliki fungsi yang homolog dengan kelenjar bulbourethralis pada organ kelamin jantan. Lokasi kelenjar ini adalah pada lapisan submukosa di dasar vestibula. Pada saat coitus, kelenjar ini berfungsi membasahi vestibula dan bagian kaudal vagina.
A B
1
1 2
3
6. Vulva dan Klitoris
Vulva dan klitoris merupakan bagian eksternal dari organ kelamin betina. Vulva terentang dari batas vestibula hingga mencapai eksternal organ kelamin betina. Vulva terdiri dari dua pasang labia, commisura, dan
fisura pudenda. Labia tersebut terdiri dari labia mayor dan labia minor. Letak labia mayor lebih lateral dibandingkan dengan labia minor. Setiap jenis hewan memiliki bentuk, ukuran dan ketebalan labia yang berbeda beda. (Constantinescu 2007).
(a) (b) (c) (d)
Gambar 7 Perbandingan bentuk vulva dari berbagai jenis hewan. (a) Sapi, (b) Domba (c) Kuda, (d) Babi (Sumber; Constantinescu 2007).
Menurut Constantinescu (2007) anjing memiliki labia yang tipis dengan commisura dorsal yang membulat dan commisura ventral yang lancip. Babi juga memiliki labia yang tipis, dan commisura ventral yang lancip dan terdapat sedikit rambut. Pada hewan ruminansia, labia pada vulva juga tipis, di bagian commisura ventralnya yang lancip terdapat rambut halus. Labia pada kuda biasanya berpigmen serta memiliki kelenjar
sebaceous dan kelenjar keringat. Commisura dorsal pada kuda lancip sedangkan commisura ventralnya membulat.
(Constantinescu 2007). Menurut Frandson (1992) klitoris terdiri dari jaringan erektil yang tertutup oleh epitel kubus banyak baris dan mendapat inervasi dari ujung ujung syaraf sensoris.
Proses Perkembangan Folikel (folikulogenesis) dalam Ovarium
Perkembangan folikel ovarium atau folikulogenesis terjadi pada masa
prenatal dan postnatal. Proses awal perkembangan folikel terjadi pada masa
prenatal (Wandji et al. 1996). Sel benih primordial bermigrasi dari kantung
kuning telur menuju ovarium, kemudian berdiferensisi menjadi oogonia. Sebagian
besar oogonia melakukan mitosis sedangkan sebagian lainnya berdiferensiasi
menjadi oosit primer. Oosit primer yang dikelilingi oleh epitel pipih selapis
dikenal dengan nama folikel primordial.
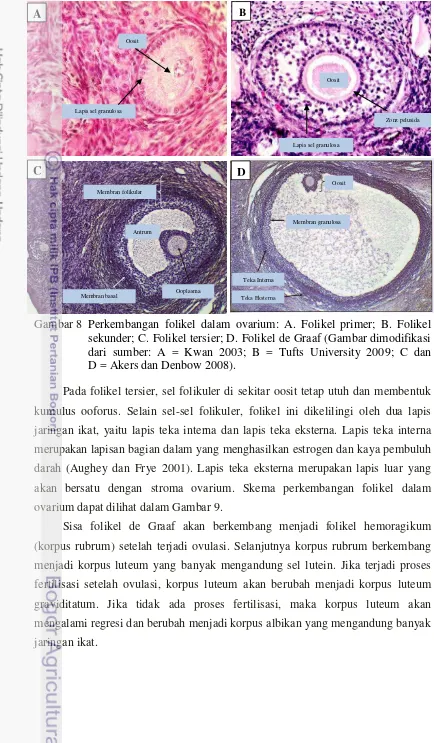
Folikel primordial mengandung oosit yang berada dalam tahap profase I, namun belum menyelesaikan pembelahan meiosis pertamanya sampai mencapai masa pubertas. Folikel primordial pada beberapa mamalia seperti rodensia dan kelinci, melanjutkan proses meiosis pada periode neonatal (Fortune 1994). Folikel yang mengandung oosit mengalami perkembangan ketika hewan mencapai masa pubertas. Sel epitel yang mengelilingi oosit berubah menjadi epitel kubus sebaris (Wandji et al. 1996; Fortune 1994) dan disebut dengan folikel primer (Gambar 8). Folikel primer berkembang menjadi folikel sekunder dengan karakteristik telah bertambahnya sel epitel yang mengelilingi oosit sampai dengan 5 lapis sel. Zona pelusida mulai terbentuk pada folikel sekunder, sebagai suatu lapisan tipis di sekeliling oosit.
Folikel tersier merupakan folikel antral yang akan berkembang menjadi folikel de Graaf. Folikel ini memiliki karakteristik telah terbentuknya antrum folikuli, yaitu ruangan yang terbentuk akibat perkembangan sel sel folikuler. Antrum folikuli pada awalnya terpisah, tetapi kemudian bersatu menjadi suatu ruangan berbentuk bulan sabit. Antrum folikuler terus membesar hingga mendesak sel telur menuju tepian folikel hingga akhirnya terjadi proses ovulasi.
Gambar 8 Perkembangan folikel dalam ovarium: A. Folikel primer; B. Folikel sekunder; C. Folikel tersier; D. Folikel de Graaf (Gambar dimodifikasi dari sumber: A = Kwan 2003; B = Tufts University 2009; C dan D = Akers dan Denbow 2008).
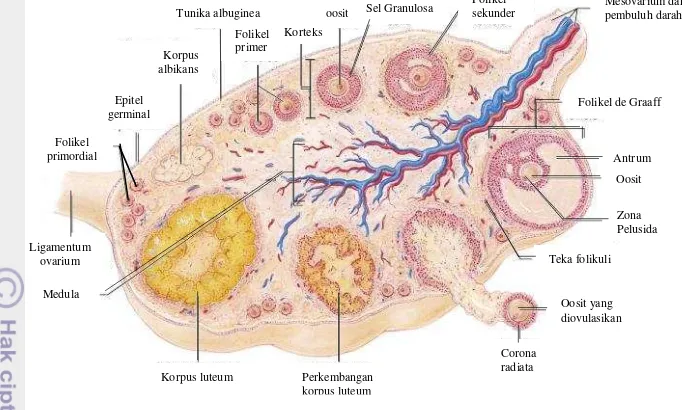
Pada folikel tersier, sel folikuler di sekitar oosit tetap utuh dan membentuk kumulus ooforus. Selain sel-sel folikuler, folikel ini dikelilingi oleh dua lapis jaringan ikat, yaitu lapis teka interna dan lapis teka eksterna. Lapis teka interna merupakan lapisan bagian dalam yang menghasilkan estrogen dan kaya pembuluh darah (Aughey dan Frye 2001). Lapis teka eksterna merupakan lapis luar yang akan bersatu dengan stroma ovarium. Skema perkembangan folikel dalam ovarium dapat dilihat dalam Gambar 9.
Sisa folikel de Graaf akan berkembang menjadi folikel hemoragikum (korpus rubrum) setelah terjadi ovulasi. Selanjutnya korpus rubrum berkembang menjadi korpus luteum yang banyak mengandung sel lutein. Jika terjadi proses fertilisasi setelah ovulasi, korpus luteum akan berubah menjadi korpus luteum graviditatum. Jika tidak ada proses fertilisasi, maka korpus luteum akan mengalami regresi dan berubah menjadi korpus albikan yang mengandung banyak jaringan ikat.
A
C D
B
Oosit
Lapis sel granulosa
Oosit
Membran granulosa
Teka Interna
Teka Eksterna Ooplasma
Membran basal Membran folikular
Antrum
Zonz pelusida Oosit
Gambar 9 Skema perkembangan folikel dalam ovarium (Modifikasi dari sumber; Cummings 2001).
Peran Karbohidrat dalam Proses Fertilisasi
Fertilisasi pada mamalia merupakan proses interaksi spesifik antara spermatozoa dan oosit (Boldt et al.1989). Tahapan yang cukup penting dalam proses fertilisasi pada mamalia adalah perlekatan antara sperma dengan membran ekstraseluler sel telur yang dinamakan zona pelusida (Tulsiani et al.1997). Zona pelusida, cairan folikuli, dan matriks ekstraseluler dari lapisan granulosa mengandung kompleks karbohidrat (Tadano dan Yamada 1978 diacu dalam Hamny 2006).
Secara umum, distribusi karbohidrat dalam zona pelusida berperan dalam proses perlekatan antara spermatozoa dengan oosit (Loeser dan Tulsiani 1999). Konsentrasi karbohidrat pada permukaan zona pelusida pada setiap hewan berbeda. Hal ini berkaitan dengan spesifisitas masing-masing spesies terhadap ikatan spermatozoa dengan sel telur dan sebagai salah satu proteksi hewan terhadap terjadinya fertilisasi interspesies (Hamny 2006).
Karbohidrat kompleks dapat dibagi menjadi dua macam, yaitu kelompok karbohidrat asam yang mengandung gugus asam yaitu sulfat dan gugus monoksil, serta karbohidrat netral yang tidak memiliki ikatan dengan gugus asam. Karbohidrat asam dalam perkembangan folikel, dapat dideteksi dengan menggunakan pewarna alcian blue (AB) pH 2.5. Pewarna ini mengikat gugus karboksil dan sulfat-ester sehingga semua mukosubstansi asam akan terwarnai
Folikel primer Tunika albuginea
Korteks
oosit Sel Granulosa
Folikel sekunder
Mesovarium dan pembuluh darah
Folikel de Graaff
[image:34.595.129.470.95.300.2]MATERI DAN METODE
Lokasi dan Waktu
Penelitian dilaksanakan di Laboratorium Riset Anatomi; Bagian Anatomi, Histologi, dan Embriologi; Departemen Anatomi, Fisiologi dan Farmakologi; Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Waktu penelitian dimulai dari bulan Februari hingga Agustus 2011.
Materi
Sampel yang digunakan dalam penelitian ini adalah organ reproduksi betina yang berasal dari dua ekor trenggiling Jawa (M. javanica) yang diperoleh dari wilayah Jawa Barat. Kondisi trenggiling pertama (MJ-1) adalah baru melahirkan dan trenggiling kedua (MJ-2) belum pernah melahirkan (dara). Pengamatan karakteristik perkembangan folikel dalam ovarium dilakukan dengan menggunakan 4 buah (2 pasang) ovarium dari organ reproduksi tersebut. Organ yang digunakan berasal dari hewan penelitian disertasi Nisa’ (2005), dan telah mendapatkan izin dari Direktorat Jenderal Perlindungan Hutan dan Konservasi Alam, Departemen Kehutanan Republik Indonesia. Sampel telah difiksasi dalam larutan Bouin (campuran asam pikrat : formalin : asam asetat glasial = 15 : 5 : 1) selama 78 jam dan disimpan di dalam alkohol 70% sebagai stopping point.
Metode
Penelitian bersifat eksploratif dan dilakukan dengan empat tahap pengerjaan, yaitu pengamatan makroskopis organ reproduksi, karakteristik histologi organ reproduksi, karakteristik histologi perkembangan folikel, dan distribusi karbohidrat dalam perkembangan folikel.
1. Pengamatan Makroskopis Organ Reproduksi
Pengamatan makroskopis yang dilakukan meliputi pengamatan bentuk (morfologi), dan ukuran (morfometri) masing-masing bagian organ kelamin betina yang terdiri atas ovarium, tuba uterina, kornua uteri, korpus uteri, serviks uteri, dan vagina. Pengamatan morfologi dilakukan dengan mata telanjang dan dibantu dengan mikroskop stereo untuk bagian organ yang sangat kecil. Setelah pengamatan dilakukan, organ dipotret.
Pengukuran dilakukan dengan mengukur panjang masing-masing bagian saluran reproduksi. Pengukuran pada bagian organ yang berpasangan seperti kornua uteri, tuba uterina, dan ovarium, dilakukan pada masing-masing sisi. Khusus untuk ovarium, dilakukan penimbangan untuk mengetahui bobotnya.
2. Karakteristik Histologi Organ Reproduksi
Pengamatan karakteristik histologi organ reproduksi diawali dengan pembuatan preparat histologi. Preparat histologi yang dibuat berasal dari bagian-bagian sampel organ reproduksi yang terdiri dari vulva, vagina, serviks uteri, korpus uteri, kornua uteri, tuba uterina, dan ovarium.
Gambar 10 Skematis organ kelamin betina trenggiling Jawa yang menunjukkan bagian yang diambil sebagai sampel penelitian.
Bagian-bagian yang telah dipotong dengan menggunakan scapel dan pisau mikrotom, dimasukkan ke dalam basket. Kemudian dilakukan proses sesuai standar pembuatan preparat histologi sampai menjadi blok parafin (Kiernan 1990). Selanjutnya blok parafin dimotong dengan menggunakan mikrotom rotary dengan ketebalan 5μm. Hasil sayatan dikembangkan di atas permukaan air matang (30 ºC) lalu dipindahkan ke permukaan air (40 ºC) selama beberapa detik. Selanjutnya hasil sayatan diletakkan di atas
object glass yang telah dibersihkan dengan alkohol 70% dan diberi label sesuai dengan sediaan preparat. Preparat tersebut kemudian diinkubasi selama minimal 24 jam pada suhu 37-40 ºC.
Pewarnaan yang digunakan dalam pengamatan karakteristik histologi organ reproduksi adalah hematoksilin eosin (HE) dan pewarnaan Masson’s trichome. Pewarnaan HE merupakan pewarnaan yang digunakan untuk melihat struktur histologis organ secara umum sedangkan pewarnaan Masson’s trichome digunakan untuk melihat keberadaan jaringan ikat dalam organ. Proses pewarnaan HE dan Masson’s trichome dapat dilihat dalam Lampiran 2 dan 3. Pengamatan karakteristik histologi dilakukan dengan mengamati stuktur penyusun setiap organ.
A B C
G E
D F
B’ C’ D’ F’
A’
3. Karakteristik Histologi Perkembangan Folikel dalam Ovarium
Pengamatan karakteristik histologi perkembangan folikel ovarium dilakukan dengan pewarnaan hematoksilin eosin (Hamny 2006; Kiernan 1990). Pengamatan dilakukan dengan mengamati tahapan perkembangan folikel pada setiap tipe. Jumlah folikel dihitung dengan menggunakan metode estimasi (Candy et al. 1997) dengan mencari faktor pengali untuk masing-masing tipe folikel. Faktor pengali dihitung dengan cara menjumlahkan setiap tipe folikel pada 25 sayatan serial pertama, kemudian dibagi dengan jumlah folikel pada setiap kelipatan lima (Hamny 2006). Folikel yang dihitung adalah folikel yang memiliki nukleus dengan stuktur yang jelas untuk menghindari perhitungan ganda.
Faktor pengali = Jumlah folikel pada 25 sayatan pertama
Jumlah folikel pada sayatan ke-1, 5, 10, 15, 20, dan 25
Estimasi jumlah folikel pada setiap tahapan diketahui dari hasil perkalian faktor pengali dengan jumlah folikel pada setiap tahap yang ditemukan pada sayatan ke-1, 5, 10, 15, 20, dan 25 pada setiap ovarium. Hasil pengamatan dideskripsikan secara deskriptif.
4. Distribusi Karbohidrat dalam Perkembangan Folikel
HASIL
Struktur Makroskopis
Secara makroskopis, organ reproduksi betina trenggiling Jawa yang telah difiksasi dapat dibedakan menjadi organ reproduksi internal dan organ reproduksi eksternal. Organ reproduksi internal terdiri dari sepasang ovarium, sepasang tuba uterina, sepasang kornua uteri, korpus uteri, serviks uteri, dan vagina. Organ reproduksi eksternal terdiri dari vestibula dan vulva (Gambar 11).
Gambar 11 Gambaran makroskopis organ reproduksi betina trenggiling Jawa yang difiksasi dalam larutan Bouin. A. Trenggiling dengan kode MJ-1, B. Trenggiling dengan kode MJ-2, a. Vulva, b. Vestibula, c. Vagina, d. Vesika urinaria, e. Serviks uteri, f. Korpus uteri, g. Kornua uteri, h. Ovarium, i. Jaringan penggantung. Bar = 1 cm.
B
A
b c
a d
e f
g
h i
a b c d
g h
[image:40.595.109.469.163.779.2]Ovarium trenggiling Jawa memiliki bentuk oval menyerupai telur hingga lonjong. Ovarium dari kedua sampel trenggiling memiliki permukaan yang tidak rata (Gambar 12). Jaringan penggantung ovarium atau mesovarium, terletak di salah satu sisi ovarium yang mengadakan pertautan dengan mesosalphynx.
Hasil pengukuran ovarium yang telah difiksasi menunjukkan panjang dan lebar ovarium kiri trenggiling Jawa berturut-turut adalah 9.00-11.93 mm dan 6.43 mm, sedangkan pada ovarium kanan adalah 9.12-12.50 mm dan 6.50-8.63 mm. Ukuran tebal pada ovarium kiri 5.03-5.57 mm, sedangkan pada ovarium kanannya adalah 4.97-6.23 mm. Setelah dilakukan penimbangan dapat diketahui bahwa bobot ovarium kiri adalah 0.21-0.24 gram, dan bobot ovarium kanan adalah 0.23-0.24 gram (Tabel 1).
Berdasarkan Tabel 1, ovarium trenggiling Jawa memiliki ukuran yang lebih besar dibandingkan dengan ovarium kancil, dan lebih kecil jika dibandingkan dengan ovarium rusa. Ovarium kanan trenggiling Jawa memiliki ukuran lebih besar dibandingkan ovarium kiri.
Tabel 1 Pengukuran ovarium kanan dan kiri dari dua sampel organ reproduksi betina trenggiling Jawa*
Parameter MJ-1 MJ-2 Kancil
(Hamny 2006) Rusa (Rifqiyati 2006) Bentuk Kanan Kiri Oval Segitiga tumpul Lonjong Lonjong
Oval Oval
Panjang:
Kanan (mm) 9.12 12.50 7.53±0.90 37-40
Kiri (mm) 9.00 11.93 5.57±1.17 44-54
LeBar
Kanan (mm) 8.63 6.50 4.45±0.50 33-34
Kiri (mm) 6.43 6.43 3.55±0.50 38-46
Tebal:
Kanan (mm) 6.23 4.97 ** 17-26
Kiri (mm) 5.03 5.57 ** 30-33
Berat:
Kanan (g) 0.23 0.24 0.0570±0.0149 0.40-1.28 Kiri (g) 0.21 0.24 0.0364±0.0061 0.60-0.80 Keterangan: *ukuran organ setelah difiksasi dalam larutan Bouin, **tidak ada data yang
dilaporkan. MJ-1: sampel 1, MJ-2: sampel 2
Tabel 2 Pengukuran panjang saluran reproduksi betina trenggiling Jawa*
Bagian Organ Panjang
MJ-1 MJ-2 Kancil
(Hamny 2006)
Rusa (Rifqiyati 2006) Tuba Uterina:
Kanan (cm) 3.183 3.767 4.39±0.85
14.00-17.10 Kiri (cm) 3.567 3.583 3.95±0.94
Kornua Uteri:
Kanan (cm) 9.567 6.300 2.63±1.19
10.30-13.60 Kiri (cm) 7.867 6.167 1.83±1.28
Korpus uteri (cm) 1.863 0.477 2.56±0.61 1.20-1.60 Serviks uteri (cm) 1.193 0.783 3.87±1.36 4.50-5.60 Vagina (cm) 2.963 2.790 3.12±1.11 17.30-19.00 Keterangan: *Ukuran organ setelah difiksasi dalam larutan Boin. MJ-1: sampel 1, MJ-2: sampel 2.
Tuba uterina terdiri dari infundibulum, ampulla dan isthmus. Secara makroskopis, batas antara infundibulum dengan ampulla tidak dapat dibedakan dengan jelas. Kedua bagian ini membentuk lekukan yang kompleks. Lekukan satu dengan lainnya dihubungkan oleh mesosalphynx yang mengikat bagian tersebut pada kedua sisinya, baik di medial maupun lateral. Ujung infundibulum yang berbatasan dengan ovarium adalah fimbria. Fimbria trenggiling memiliki bentuk corong yang terdiri atas lipatan-lipatan tipis.
Gambar 12 Gambaran makroskopis ovarium dan tuba uterina trenggiling Jawa dengan kode MJ-1. a. ovarium, b. fimbrae, c. tuba uterina - bagian ampulla dan infundibulum, d. isthmus, e. kornua uteri, tanda panah: permukaan ovarium yang tidak rata. Bar = 2 mm.
a b
c d
Isthmus merupakan bagian tuba uterina yang memiliki diameter lebih kecil dibandingkan dengan infundibulum dan ampulla. Perbedaan ukuran antara bagian-bagian tersebut dapat dilihat dalam Gambar 12. Berbeda dengan dua bagian-bagian tuba uterina lainnya, isthmus tidak membentuk lekukan dan diikat oleh mesosalphynx hanya pada satu sisi. Terdapat perbedaan ukuran isthmus pada trenggiling MJ-2. Ukuran isthmus tersebut relatif sama dengan ampulla dan infundibulum.
Uterus trenggiling Jawa memiliki tipe bikornua. Uterus difiksir oleh jaringan penggantung di kedua sisi lateral. Jaringan penggantung ini merupakan jaringan ikat yang kemudian membungkus uterus hingga ke daerah vagina (Gambar 13). Jaringan penggantung uterus juga mengikat vesika urinaria dan bersatu dengan jaringan penggantung yang membungkus kolon pada organ pencernaan.
Kornua uteri berjalan ke arah kranial. Daerah di bagian kaudal kornua uteri kanan dan kiri dibungkus bersama-sama oleh jaringan ikat serosa sehingga bagian tersebut terlihat menyatu. Namun pada bagian dorsal, dapat terlihat adanya garis semu yang merupakan septum pemisah kornua kiri dengan kornua kanan. Setelah bercabang, kornua uteri berjalan ventrolaterocaudal, dan memiliki bentuk yang berlekuk.
Bagian interior korpus uteri membentuk lipatan mukosa longitudinal. Lipatan ini juga terdapat pada bagian kornua uteri, sehingga kedua bagian tersebut tidak dapat dibedakan berdasarkan pada lipatan mukosanya. Perbatasan antara kornua dan korpus uteri ditandai dengan adanya bagian yang menonjol dan lebih tebal (Gambar 13).
Serviks uteri merupakan bagian yang memiliki lumen yang rapat. Secara makroskopis dapat dilihat adanya jaringan otot yang lebih tebal dibandingkan dengan bagian uterus yang lainnya. Hal ini menyebabkan serviks uteri memiliki konsistensi lebih keras dan padat. Mukosa serviks uteri membentuk lipatan yang terdiri dari lipatan primer, sekunder, dan tersier, serta berukuran lebih kecil (Gambar 13). Batas antara serviks uteri dengan vagina ditandai dengan adanya fornix, yaitu penebalan bagian serviks uteri dan diverticulum yang merupakan celah di sekitar fornix.
Vagina merupakan daerah yang memiliki mukosa yang licin di bagian anterior dan berlipat transversal halus di daerah caudal. Vagina memiliki dinding penyusun yang lebih tipis dibandingkan dengan serviks uteri. Orificium urethralis externa menjadi batas antara vagina dengan vestibula. Vestibula memiliki mukosa yang berlipat yang bercabang seperti mukosa serviks di daerah dorsal dan mukosa berlipat tranversal seperti vagina di ventral.
Vulva merupakan organ reproduksi eksternal yang terletak ventral anus. Keunikan vulva trenggiling Jawa adalah lokasinya yang berada di dalam kantung yang sama dengan anus. Vulva yang telah difiksasi berbentuk kerutan yang melebar ke arah lateral. Labia mayor maupun minor tidak dapat dibedakan. Dari eksternal, klitoris tidak nampak. Permukaan vulva tidak ditutupi oleh rambut, namun di permukaan kantung tersebut terdapat rambut yang tersusun menyebar.
Karakteristik Histologi Saluran Reproduksi
Saluran reproduksi trenggiling terdiri dari tuba uterina, kornua uteri, korpus uteri, serviks uteri, vagina dan vestibula. Setiap bagian organ tersebut disusun oleh komponen-komponen yang memiliki karakteristik yang berbeda pada setiap bagiannya.
semakin sederhana ketika tuba uterina mendekati uterus. Pada bagian permukaan mukosa ditemukan secretory bulb yang merupakan sekreta dari sel epitel tuba uterina yang tidak memiliki kinosilia.
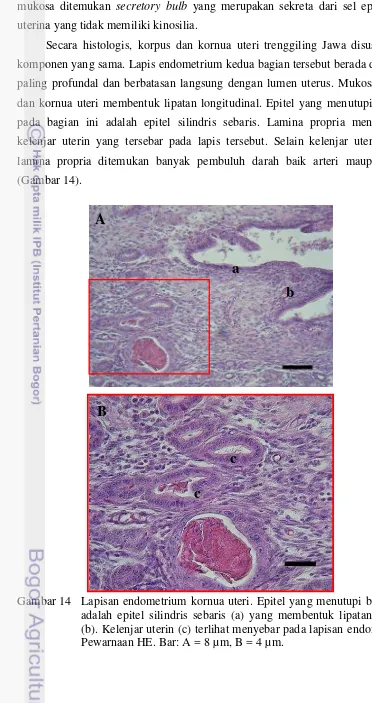
[image:45.595.96.468.105.808.2]Secara histologis, korpus dan kornua uteri trenggiling Jawa disusun oleh komponen yang sama. Lapis endometrium kedua bagian tersebut berada di bagian paling profundal dan berbatasan langsung dengan lumen uterus. Mukosa korpus dan kornua uteri membentuk lipatan longitudinal. Epitel yang menutupi mukosa pada bagian ini adalah epitel silindris sebaris. Lamina propria mengandung kelenjar uterin yang tersebar pada lapis tersebut. Selain kelenjar uterin, pada lamina propria ditemukan banyak pembuluh darah baik arteri maupun vena (Gambar 14).
Gambar 14 Lapisan endometrium kornua uteri. Epitel yang menutupi bagian ini adalah epitel silindris sebaris (a) yang membentuk lipatan mukosa (b). Kelenjar uterin (c) terlihat menyebar pada lapisan endometrium. Pewarnaan HE. Bar: A = 8 µm, B = 4 µm.
A
B
c
c
a
Miometrium merupakan lapis di bagian superfisial endometrium. Bagian ini disusun oleh otot polos yang terbagi menjadi lapisan dalam dan lapisan luar. Lapisan dalam merupakan otot polos yang tersusun secara sirkuler, sedangkan lapisan luar merupakan otot polos yang yang tersusun secara longitudinal. Stratum vasculare yang berisi pembuluh darah berada di lapis superfisial setelah kedua lapisan otot tersebut. Perimetrium merupakan lapisan paling superfisial. Lapisan ini terdiri dari jaringan ikat yang ditutupi oleh epitel pipih selapis di bagian superfisial.
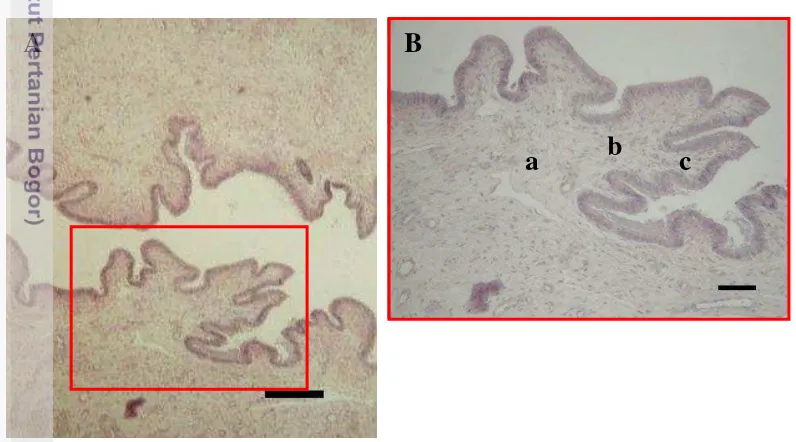
Serviks uteri memiliki beberapa perbedaan dengan kornua dan korpus uteri. Serviks memiliki lipatan mukosa yang terbagi menjadi lipatan primer, sekunder dan tersier (Gambar 15). Epitel yang menyusun mukosa serviks adalah epitel silindris sebaris bersilia. Beberapa sel goblet dapat ditemukan di sela-sela epitel tersebut sebagai massa yang berwarna lebih cerah. Lamina propria terdiri dari jaringan ikat kolagen yang sangat tebal. Pada lapis ini tidak ditemukan adanya kelenjar seperti pada bagian kornua dan korpus uteri. Vaskularisasi pada lamina propria didominasi oleh pembuluh darah vena.
Gambar 15 Gambaran mikroskopis serviks trenggiling Jawa. Mukosa serviks terbagi menjadi lipatan mukosa primer (a), sekunder (b), dan tersier (c). Pewarnaan HE. Bar: A = 20 µm, B = 10 µm.
A
B
c
b
[image:46.595.115.513.397.618.2]Tunika muskularis tersusun oleh otot polos. Bagian profundal merupakan lapis otot yang tersusun secara sirkuler, sedangkan lapis luarnya tersusun secara longitudinal. Vaskularisasi pada tunika muskularis didominasi oleh pembuluh darah arteri.
Epitel yang menyusun mukosa vagina adalah epitel pipih banyak lapis dengan permukaan yang memiliki keratin yang tipis. Lamina propria terdiri dari jaringan ikat tanpa kelenjar. Pembuluh darah dapat ditemukan pada lapisan ini. Tunika muskularis terdiri dari lapisan otot yang tersusun longitudinal di bagian dalam, dan sirkuler di bagian luar (Gambar 16).
Gambar 16 Gambaran mikroskopis vagina. a. Epitel pipih banyak lapis, b. Lamina propria. Pewarnaan HE. Bar = 8 µm.
Vestibula merupakan organ reproduksi eksternal yang menghubungkan vagina dengan vulva. Struktur vagina dan vestibula pada umumnya sama. Vertibula tersusun dari lapis mukosa, lamina propria, tunika muskularis, dan serosa. Mukosa vestibula membentuk lipatan menyerupai mukosa serviks di bagian dorsal, dan menyerupai mukosa vagina di bagian ventral. Epitel yang menyusun mukosanya adalah epitel pipih banyak lapis. Vulva disusun oleh epitel pipih banyak lapis di bagian eksternal.
Karakteristik Histologi Perkembangan Folikel dalam Ovarium
Struktur ovarium secara histologis yang diamati menggunakan pewarnaan
HE dan Masson’s trichome menunjukkan bahwa epitel yang membungkus
ovarium merupakan epitel pipih selapis dan disebut dengan germinal epithelium.
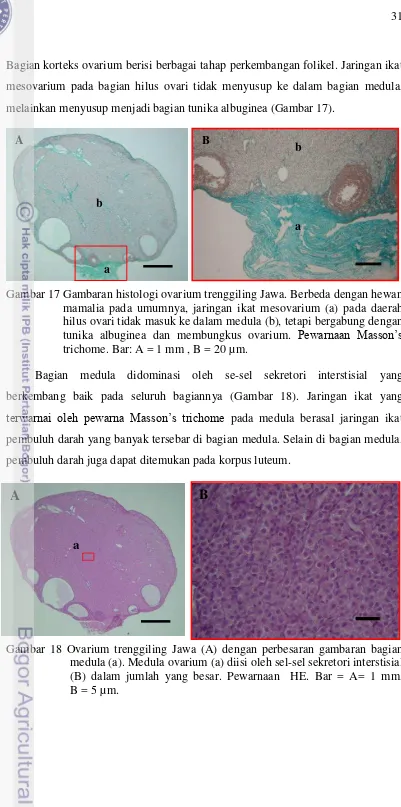
Bagian korteks ovarium berisi berbagai tahap perkembangan folikel. Jaringan ikat mesovarium pada bagian hilus ovari tidak menyusup ke dalam bagian medula, melainkan menyusup menjadi bagian tunika albuginea (Gambar 17).
[image:48.595.107.508.27.834.2]
Gambar 17 Gambaran histologi ovarium trenggiling Jawa. Berbeda dengan hewan mamalia pada umumnya, jaringan ikat mesovarium (a) pada daerah hilus ovari tidak masuk ke dalam medula (b), tetapi bergabung dengan tunika albuginea dan membungkus ovarium. Pewarnaan Masson’s trichome. Bar: A = 1 mm , B = 20 µm.
Bagian medula didominasi oleh se-sel sekretori interstisial yang berkembang baik pada seluruh bagiannya (Gambar 18). Jaringan ikat yang
terwarnai oleh pewarna Masson’s trichome pada medula berasal jaringan ikat pembuluh darah yang banyak tersebar di bagian medula. Selain di bagian medula, pembuluh darah juga dapat ditemukan pada korpus luteum.
Gambar 18 Ovarium trenggiling Jawa (A) dengan perbesaran gambaran bagian medula (a). Medula ovarium (a) diisi oleh sel-sel sekretori interstisial (B) dalam jumlah yang besar. Pewarnaan HE. Bar = A= 1 mm, B = 5 µm.
a
A B
a b
b
A
B
Korteks ovarium berisi berbagai tahap perkembangan folikel, yang terbagi menjadi 10 tahap perkembangan. Pengelompokan dilakukan berdasarkan pada bentuk dan lapisan sel granulosa pada folikel, ketebalan zona pelusida dan keberadaan antrum folikuli (Hamny 2006). Masing-masing tahap perkembangan diwakili oleh 1 tipe folikel yang memiliki karakteristik tersendiri.
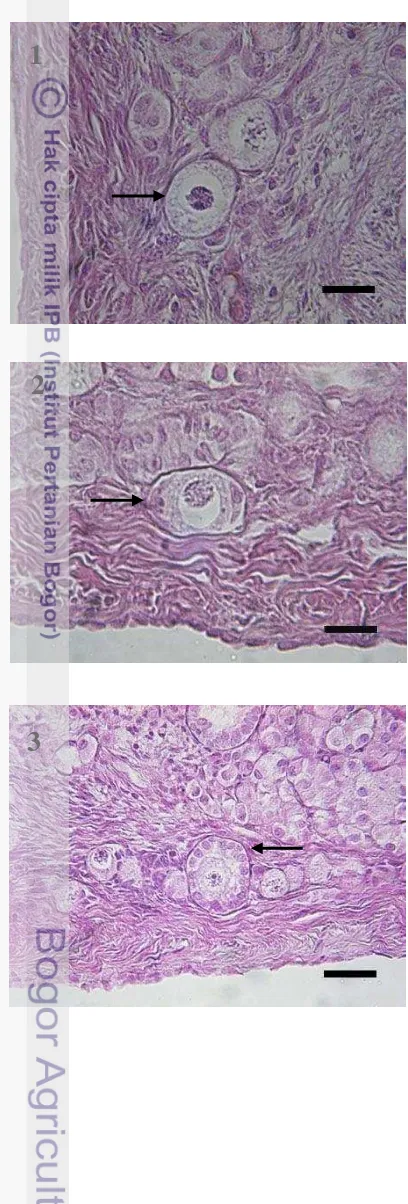
Gambar 19 Folikel tipe 1 dengan ciri oosit dikelilingi oleh satu lapis sel pregranulosa berbentuk pipih (tanda panah). Pewarnaan HE. Bar = 2 µm.
Gambar 20 Folikel tipe 2 dengan ciri oosit dikelilingi oleh satu lapis sel pregranulosa berbentuk transisi antara pipih dan kuboid (tanda panah). Pewarnaan HE. Bar = 2 µm.
Gambar 21 Folikel tipe 3 dengan ciri oosit dikelilingi oleh satu lapis sel granulosa berbentuk kuboid (tanda panah). Pewarnaan HE. Bar = 4 µm.
1
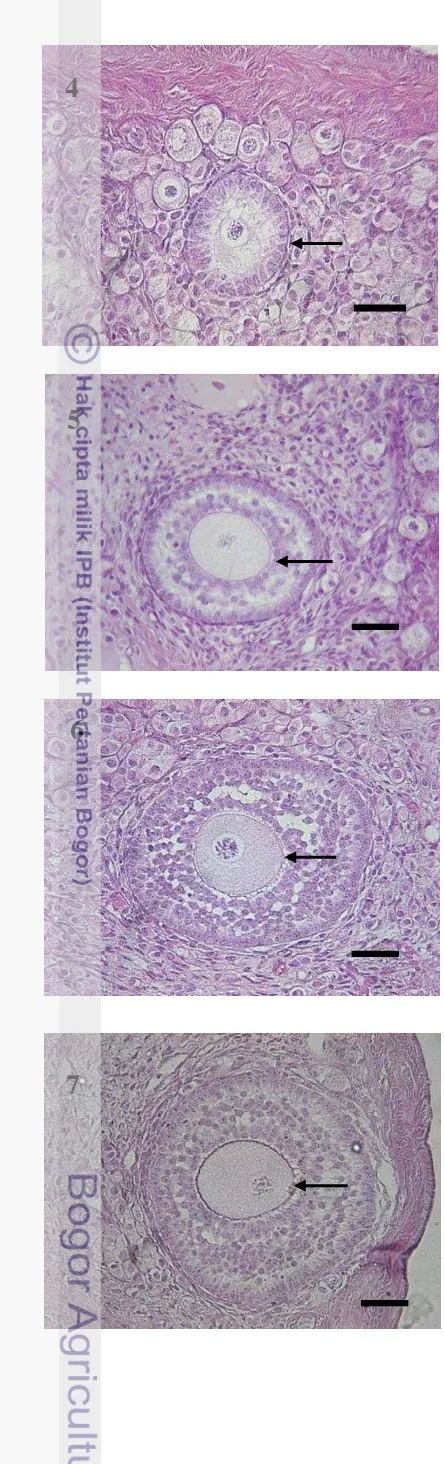
[image:49.595.107.311.190.792.2]Gambar 22 Folikel tipe 4 dengan ciri oosit dikelilingi oleh lebih dari 1 hingga 2 lapis sel granulosa berbentuk kuboid (tanda panah). Pewarnaan HE. Bar = 4 µm.
Gambar 23 Folikel tipe 5 dengan ciri oosit dikelilingi oleh 3-5 lapis sel granulosa. Zona pelusida (tanda panah) sudah mulai ditemukan sebagai lapisan tipis di sekitar oosit. Pewarnaan HE. Bar = 4 µm.
Gambar 24 Folikel tipe 6 dengan ciri oosit dikelilingi oleh lebih dari 5 lapis sel granulosa. Zona pelusida (tanda panah) sudah mulai teramati di sekitar oosit. Pewarnaan HE. Bar = 4 µm.
Gambar 25 Folikel tipe 7 dengan ciri oosit dikelilingi oleh lebih dari 5 lapis sel granulosa berbentuk kuboid. Zona pelusida (tanda panah) semakin menebal. Pewarnaan HE. Bar = 4 µm.
4
5
6
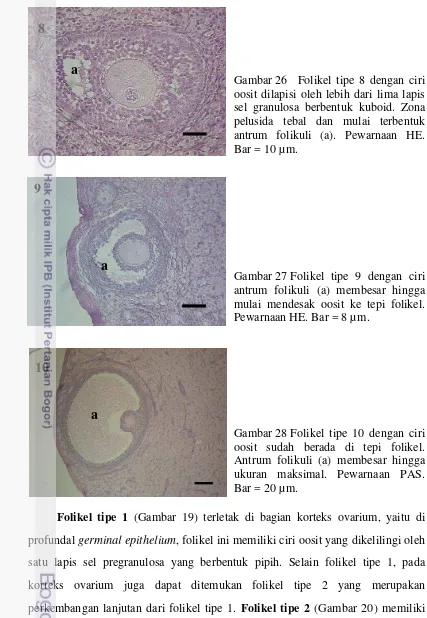
[image:50.595.91.313.67.799.2]Gambar 26 Folikel tipe 8 dengan ciri oosit dilapisi oleh lebih dari lima lapis sel granulosa berbentuk kuboid. Zona pelusida tebal dan mulai terbentuk antrum folikuli (a). Pewarnaan HE. Bar = 10 µm.
Gambar 27 Folikel tipe 9 dengan ciri antrum folikuli (a) membesar hingga mulai mendesak oosit ke tepi folikel. Pewarnaan HE. Bar = 8 µm.
Gambar 28 Folikel tipe 10 dengan ciri oosit sudah berada di tepi folikel. Antrum folikuli (a) membesar hingga ukuran maksimal. Pewarnaan PAS. Bar = 20 µm.
Folikel tipe 1 (Gambar 19) terletak di bagian korteks ovarium, yaitu di
profundal germinal epithelium, folikel ini memiliki ciri oosit yang dikelilingi oleh
satu lapis sel pregranulosa yang berbentuk pipih. Selain folikel tipe 1, pada
korteks ovarium juga dapat ditemukan folikel tipe 2 yang merupakan
perkembangan lanjutan dari folikel tipe 1. Folikel tipe 2 (Gambar 20) memiliki
karakteristik oosit yang dikelilingi oleh sel pregranulosa yang berbentuk peralihan
antara pipih dan kuboid. Folikel tipe 3 (Gambar 21) memiliki ciri oosit yang
8
a
9
a
[image:51.595.85.512.81.699.2]dikelilingi oleh satu lapis sel granulosa berbentuk kuboid. Folikel tipe 4
(Gambar 22) memiliki ciri oosit yang dikelilingi oleh satu sampai dua lapis sel
granulosa berbentuk kuboid.
Folikel tipe 5 (Gambar 23) memiliki ciri oosit yang dikelilingi oleh dua
sampai lima lapis sel granulosa. Pada folikel ini zona pelusida sudah mulai
terbentuk sebagai suatu lapisan tipis di sekeliling oosit. Folikel tipe 6
(Gambar 24) memiliki karakteristik yang tidak jauh berbeda dengan folikel tipe 5.
Perbedaan dengan folikel 5 terletak pada jumlah sel granulosa yang mengelilingi
oosit. Pada folikel 6 sel granulosa berkembang hingga mencapai 6-12 lapis. Selain
itu zona pelusida terlihat jelas sebagai lapisan tipis diantara oosit. Folikel tipe 6
berkembang menjadi folikel tipe 7 yang memiliki karakteristik yang hampir sama
dengan folikel tipe 6 (Gambar 25). Ciri khas folikel tipe 7 adalah zona pelusida
yang terlihat semakin menebal. Antrum folikuli mulai terbentuk pada folikel
tipe 8 (Gambar 26). Antrum folikuli tersebut semakin membesar sehingga folikel
berkembang menjadi folikel tipe 9 (Gambar 27). Oosit pada folikel tipe 9 mulai
bergerak ke tepi folikel. Folikel tipe 10 merupakan tahap akhir perkembangan
tipe folikel sebelum diovulasikan. Oosit pada folikel tipe 10 berada di tepi folikel
dengan antrum folikuli yang membesar (Gambar 28).
Berdasarkan perhitungan jumlah folikel pada setiap tahapan perkembangan,
folikel tipe 1 merupakan tipe folikel yang jumlahnya paling mendominasi dalam
ovarium dan lebih banyak ditemukan pada ovarium MJ-2. Selain itu, dapat dilihat
pula bahwa ovarium kiri trenggiling jawa pada umumnya memiliki persentase
perkembangan folikel yang lebih tinggi jika dibandingkan dengan ovarium kanan.
Folikel tipe 8 yang termasuk ke dalam folikel antral, dapat ditemukan pada sampel
Tabel 3 Jumlah folikel pada berbagai tahapan perkembangan folikel ovarium trenggiling Jawa
Tipe Folikel
Jumlah folikel MJ-1 (n) Jumlah folikel MJ-2 (n) Ovarium Kanan (%) Ovarium Kiri (%) Ovarium Kanan (%) Ovarium Kiri (%)
1 1122
66.19 854 63.97 4359 64.80 6098 74.02
2 522
30.80 397 29.74 2343 34.83 2070 25.12
3 31
1.83 23 1.722 26 0.38 41 0.50
4 15
0.88 34 2.54 0 0 6 0.07
5 0
0 9 0.67 0 0 9 0.11
6 0
0 5 0.37 0 0 3 0.04
7 0
0 0 0 0 0 0 0
8 6
0.35 12 0.90 0 0 12 0.15
9 0
0 0 0 0 0 0 0
10 0
0 1 0.07 0 0 0 0
Jumlah 1695 1335 6727 8238
Distribusi Karbohidrat dalam Perkembangan Folikel
Distribusi karbohidrat asam dan karbohidrat netral pada setiap tahap
perkembangan ovarium trenggiling Jawa disajikan dalam Tabel 4 dan Gambar
29-30. Distribusi karbohidrat yang diamati mencakup distribusi pada oosit,
matriks ekstraseluler, zona pelusida, dan cairan folikuli. Hasil pengamatan
memperlihatkan adanya perbedaan distribusi karbohidrat asam dan karbohidrat
netral pada setiap tahap perkembangan folikel.
Pewarnaan AB pH 2.5 menunjukkan hasil reaksi positif mulai dari folikel
tipe 5, yaitu pada zona pelusida dengan intensitas reaksi positif yang sangat lemah
(±). Hal ini menunjukkan bahwa karbohidrat asam sudah mulai ada pada folikel
tipe 5 dalam konsentrasi yang rendah. Reaksi positif terlihat pada oosit, matriks
[image:53.595.66.516.97.818.2]Tabel 4 Distribusi karbohidrat pada setiap tahap perkembangan folikel ovarium trenggiling Jawa dengan metode pewarnaan AB pH 2.5 dan PAS
Tipe Folikel
Jenis Folikel
(Erickson (2003) diacu dalam Hamny (2006))
Struktur KH asam (AB pH 2.5)
KH Netal (PAS)
1 Folikel primordial Oosit - -
2 Folikel primordial Oosit - -
3 Folikel primer Oosit - -
4 Folikel prime