KARAK
KTERISASI
F
I TEPUNG
UBI JALA
ANGE
FAKULTA
INSTIT
G DAN PAT
AR UNGU
SKRI
ELA OTTO
F2408
S TEKNOL
TUT PERT
BOG 201
TI DARI U
AYAMUR
IPSI
OLEN JUL
0116
LOGI PER
TANIAN BO
GOR12
BI JALAR
RASAKI
LITA
RTANIAN
OGOR
KARAKT
TERISASI T
TEPUNG D
JALAR
ANG
FAKULTA
INSTIT
DAN PATI D
R UNGU AY
SKRI
GELA OTTO
F2408
AS TEKNOL
TUT PERTA
BOG 201
DARI UBI
YAMURAS
IPSI
OLEN JULI
0116
LOGI PERT
ANIAN BO
GOR 12
JALAR CIL
SAKI
ITA
TANIAN
OGOR
CHARACTERIZATION OF STARCH AND FLOUR FROM CILEMBU AND
AYAMURASAKI PURPLE SWEET POTATO
Angela Ottolen Julita
1, Feri Kusnandar
1 1Department of Food Science and Technology,
Faculty of Agricultural Engineering and Technology, Bogor Agricultural University,
IPB Darmaga Campus, PO BOX 220, Bogor 16002, West Java, Indonesia
Phone: +62 878 7399 5460, Email: [email protected]
ABSTRACT
The objective of this study was to characterize starch and flour of Cilembu
and Ayamurasaki purple sweet potatoes in order to determine their potential
application in food processing. T-test statistical analysis showed that there were only
a few characteristics of flour and starch of Cilembu and Ayamurasaki purple sweet
potatoes indicating significant differences. For flour, the characteristics that are
significantly different were water content, protein content, carbohydrate content,
starch content, peak viscosity, setback viscosity, and breakdown viscocity.
Furthermore, the significantly different characteristics in their starch were moisture
content, ash content, protein content, carbohydrate content, gelatinization
temperature, maximum viscosity, breakdown viscosity, setback viscosity, swelling
power, and solubility.
Some characteristics that were proven to be statistically correlated among
others are fat and protein content with breakdown viscosity, fat and protein content
with water absorption, protein content with paste clarity, solubility and amylose
content, amylopectin content and oil absorption, amylose and amylopectin content
with starch content, bulk density with maximum viscosity and breakdown viscosity,
maximum viscosity and breakdown viscosity, maximum viscosity with swelling
power, paste clarity with maximum viscosity, breakdown viscosity with pH, and
swelling power with solubility.
ANGELA OTTOLEN JULITA. F24080116. Karakterisasi Tepung dan Pati dari
Ubi Jalar Cilembu dan Ubi Jalar Ungu Ayamurasaki. Di bawah bimbingan Feri
Kusnandar. 2012.
RINGKASAN
Ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki merupakan dua varietas ubi jalar unggul yang memiliki potensi untuk dimanfaatkan sebagai bahan baku pengganti terigu dan beras. Ubi jalar Cilembu dikenal sebagai ubi jalar yang unik karena rasanya manis seperti madu. Ubi jalar ungu Ayamurasaki merupakan varietas ubi jalar yang kaya antosianin dan dapat memberikan banyak manfaat bagi kesehatan tubuh. Dalam rangka meningkatkan nilai tambahnya, ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki baik untuk diolah menjadi tepung dan pati. Hal ini dikarenakan bentuk olahan tepung dan pati adalah produk antara yang dapat digunakan sebagai bahan baku industri dan bermanfaat dalam proses pengolahan pangan. Karakterisasi tepung dan pati dari ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki dilakukan untuk mengetahui potensi aplikasinya, sehingga dapat meningkatkan pemanfaatannya dalam industri pangan.
Penelitian ini terdiri dari tiga tahap, yaitu pembuatan tepung dan ekstraksi pati, analisis fisikokimia dan fungsional, dan analisis statistika. Analisis fisikokimia yang dilakukan antara lain densitas kamba, derajat putih, warna, bentuk granula, pH, proksimat, kadar pati, kadar amilosa, kadar amilopektin. Sedangkan sifat fungsional yang diamati antara lain pasting property, swelling power, kelarutan, kekuatan gel, absorbsi minyak dan air, dan kejernihan pasta. Sedangkan analisis statistiknya terdiri dari t-test dan analisis korelasi Pearson.
Hasil analisis fisik menunjukkan bahwa tepung ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki yang diamati memiliki rendemen 15.94% dan 21.99%, densitas kamba 0.4522 g/ml dan 0.5026 g/ml, unsur warna L 59.20 dan 45.82, unsur warna a +1.02 dan +7.46, unsur warna b +13.67 dan +4.10. Sedangkan, patinya memiliki rendemen 12.14% dan 18.71%, densitas kamba 0.5957g/ml dan 0.6132 g/ml, derajat putih 89.16% dan 78.37%, bentuk granula poligonal, dan ukuran granula 10-80μm. Hasil analisis kimia (berdasarkan berat kering) menunjukkan bahwa tepung ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki memiliki kadar air 6.11% dan 13.32%, kadar abu 2.44% dan 1.92%, kadar lemak 0.95% dan 1.18%, kadar protein 4.77% dan 3.26%, kadar karbohidrat 91.83% dan 93.64%, kadar pati 75.28% dan 83.08%, kadar amilosa 11.60% dan 13.16%, kadar amilopektin 63.68% dan 69.92%, nilai pH 6.26 dan 6.3. Pati ubi jalar Cilembu dan pati ubi jalar ungu memiliki kadar air 9.32% dan 7.73%, kadar abu 0.28% dan 0.39%, kadar lemak 0.48% dan 0.27%, kadar protein 1.63% dan 0.71%, kadar karbohidrat 97.60% dan 98.63%, kadar pati 88.96% dan 93.29%, kadar amilosa 24.55% dan 26.02%, kadar amilopektin 62.00% dan 65.25%, nilai pH 4.83 dan 4.37.
13.5937g/g dan 20.0660g/g, swelling power 90oC 17.2333 g/g dan 22.3951g/g, swelling power 95oC 21.1970g/g dan 21.1352g/g, kelarutan 60oC 2.4638% dan 1.9264%, kelarutan 70oC 3.7699% dan 6.8224%, kelarutan 80oC 8.3212% dan 11.5085%, kelarutan 90oC 10.7616% dan 19.9044%, kelarutan 95oC 15.4218% dan 27.6577%, absorbsi air 1.1876g/g dan 0.9781g/g, absorbsi minyak 1.4884g/g dan 1.2024g/g, kejernihan pasta 86.5%A dan 86.8%A.
Analisis statistika t-test menunjukkan bahwa hanya ada beberapa karakteristik dari tepung dan pati antara ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki yang menunjukkan perbedaan nyata. Untuk tepungnya, karakteristik yang menunjukkan perbedaan nyata adalah kadar air, kadar protein, kadar karbohidrat, kadar pati, viskositas maksimum, viskositas setback, dan viskositas breakdown. Selanjutnya, karakteristik yang berbeda nyata pada patinya adalah kadar air, kadar abu, kadar protein, kadar karbohidrat, suhu gelatinisasi, viskositas maksimum, viskositas breakdown, viskositas setback, swelling power, dan kelarutan.
KARAKTERISASI TEPUNG DAN PATI DARI UBI JALAR CILEMBU DAN UBI
JALAR UNGU AYAMURASAKI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
ANGELA OTTOLEN JULITA
F24080116
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul : Karakterisasi Tepung dan Pati dari Ubi Jalar Cilembu dan Ubi Jalar Ungu
Ayamurasaki
Nama : Angela Ottolen Julita
NRP :
F24080116
Menyetujui,
Dosen Pembimbing
Dr. Ir. Feri Kusnandar, M.Sc
NIP. 19680526 199303.1.004
Mengetahui,
Ketua Departemen,
Dr. Ir. Feri Kusnandar, M.Sc
NIP. 19680526 199303.1.004
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Karakterisasi Tepung dan Pati dari Ubi Jalar Cilembu dan Ubi Jalar Ungu Ayamurasaki adalah hasil karya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan atau tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2012 Yang membuat pernyataan
©Hak cipta milik Angela Ottolen Julita, tahun 2012
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
BIODATA PENULIS
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus yang telah memberikan anugerahNya selama masa perkuliahan hingga skripsi dengan judul “Karakterisasi Tepung dan Pati dari Ubi Jalar Cilembu dan Ubi Jalar Ungu Ayamurasaki” berhasil diselesaikan. Dengan terselesaikannya penelitian hingga tersusunnya skripsi ini, penulis ingin menyampaikan ucapan terima kasih kepada:
1. Bapak Dr. Ir. Feri Kusnandar, M.Sc sebagai dosen pembimbing yang telah memberikan arahan, nasihat, teguran, dan motivasi dalam pembuatan skripsi ini.
2. Kakak - kakak penulis (Putri, Yona, Gaby), kakek dan nenek, papa dan mama, Mama Erliana, Bude Endang, Tante Any, Om Budi.
3. Ibu Dr. Ir. Dede Robiatul Adawiyah, M.Si dan Ibu Dian Herawati, STP. M.Si atas
kesediaannya sebagai dosen penguji serta saran yang diberikan dalam proses pembuatan skripsi ini.
4. Segenap staf pengajar di Departemen Ilmu dan Teknologi Pangan yang telah membekali penulis dengan ilmu pengetahuan yang sangat berharga.
5. Seluruh teknisi laboratorium atas dukungan yang diberikan, Mbak Vera, Pak Jun, Pak Wahid, Ibu Rubiah, Pak Iyas, Pak Gatot, Pak Yahya.
6. Ati, Sarah, Tutut, Anggi, Harum, atas kebersamaannya selama masa perkuliahan.
7. Teman-teman Komisi Pelayanan Anak, Kopral, GBI Duber dan Lautan, Puyun, Dora,
Melisa, Vonika, Ellin, Monika, Ana, Cella, Gio, Suarno, Zega, Chastro, Hellen, Kak Nofa, Kak Bagus, Kak Isak, David, Kak Bensa, Kak Reni, Kak Leni, Kak Dial, Glory, Pak Daniel, Ibu Cindy, Kak Gerna, Kak Elia, Kak Yanuar, Gissel, Cindy. Adik layan penulis di KPA, Ana, Tari, Vidia, Darman, Alex.
8. Teman-teman English Madison Club, Miss Kitty, Sari, Daud, Maria, Natalia.
9. Teman-teman Rhema En Chara School Ma’am Jess, Ma’am Rachel, Ma’am Eve, Samuel, Steven. Anak murid penulis Clarissa, Avram, Michelle, Silvia, Timothy, Karenina, Marvel. 10. Teman-teman Green TV IPB, Haikal, Madun, Nuri, Ibu Yatri, Ibu Arnis.
11. Teman-teman semasa penelitian, Fiqa, Indra, Gita, Iqbal, Sarinah, Harum, Andika, Bangun, Mutia, Fiya, Ivan, Euis.
12. Kak Dati, Kak Septy, Kak Kevin, Kak Widy, Kak Wany atas dukungan dan perhatian yang diberikan penulis selama penyusunan skripsi berlangsung.
Akhir kata penulis berharap tulisan ini dapat bermanfaat bagi semua yang membaca dan menggunakannya.
Bogor, Agustus 2012
DAFTAR ISI
Halaman
KATA PENGANTAR...………...………... ii
DAFTAR ISI... iii
DAFTAR TABEL... iv
DAFTAR GAMBAR...………... v
DAFTAR LAMPIRAN...………... vi
I. PENDAHULUAN...………... 1
II. TINJAUAN PUSTAKA...………... 3
A. Ubi jalar ... 3
B. Karakteristik Fisikokimia... 9
C. Karakteristik Fungsional... 12
III. METODOLOGI PENELITIAN...………... 15
A. Alat dan Bahan... 15
B. Metode Penelitian... 15
IV.HASIL DAN PEMBAHASAN...………..……... 27
A. Rendemen ... 28
B. Karakteristik Fisik... 26
C. Karakterstik Kimia ... 30
D. Karakteristik Fungsional... 35
E. Analisis Korelasi... 44
V. SIMPULAN DAN SARAN... 45
DAFTAR PUSTAKA... 46
DAFTAR TABEL
Halaman
Tabel 1. Komposisi ubi jalar segar per 100 gram...………... 3
Tabel 2. Luas komoditi ubi jalar tahun 2010... 4
Tabel 3. Data realisasi penyebaran varietas dominan ubi jalar di Jawa Barat tahun 2010... 5
Tabel 4. Kandungan kimia dan karakter fisik ubi jalar ungu Ayamurasaki.………... 6
Tabel 5. Pemanfaatan Ubi jalar Cilembu dan ubi jalar ungu pada produk pangan... 7
Tabel 6. Sifat fisik, kimia, dan amilografi pati ubi jalar ………... 9
Tabel 7. Komposisi kimia tepung ubi jalar ………... 9
Tabel 8. Karakteristik gelatinisasi berbagai pati ………... 13
Tabel 9. Penentuan glukosa, fruktosa, dan gula ivert dalam suatu bahan pangan dengan metode Luff-Schoorl... 23
Tabel 10. Komposisi kimia tepung ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki... 33
Tabel 11. Komposisi kimia pati ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki... 33
DAFTAR GAMBAR
Halaman
Gambar 1. Ubi jalar Cilembu...………... 6
Gambar 2. Ubi jalar ungu Ayamurasaki... 7
Gambar 3. Struktur granula pati... 10
Gambar 4. Struktur amilosa ………... 11
Gambar 5. Struktur amilopektin... 11
Gambar 6. Diagram alir penelitian ………... 17
Gambar 7. Proses ekstraksi pati...………... 18
Gambar 8. Proses Pembuatan tepung...………... 19
Gambar 9. Tepung dan pati ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki... 27
Gambar 10. Granula pati ubi jalar Cilembu dan ubi ungu Ayamurasaki... 29
Gambar 11. Profil gelatinisasi pati ubi jalar Cilembu dan ungu Ayamurasaki... 36
Gambar 12. Profil gelatinisasi tepung ubi jalar Cilembu dan ungu Ayamurasaki... 36
Gambar 13. Swelling power pati ubi jalar Cilembu dan ungu Ayamurasaki... 40
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Rendemen... 55
Lampiran 2. Kadar air dan kadar abu... 56
Lampiran 3. Kadar protein dan kadar lemak... 57
Lampiran 4. Kadar karbohidrat dan pati... 58
Lampiran 5. Densitas kamba dan pH... 59
Lampiran 6. Kadar amilosa... 60
Lampiran 7. Derajat putih dan warna... 61
Lampiran 8. Profil gelatinisasi, swelling power, kelarutan... 62
Lampiran 9. Absorbsi air dan minyak... 63
Lampiran 10. Kejernihan pasta dan kekuatan gel... 64
Lampiran 11. Analisis t-test kadar air... 65
Lampiran 12. Analisis t-test kadar abu... 66
Lampiran 13. Analisis t-test kadar lemak... 67
Lampiran 14. Analisis t-test kadar protein... 68
Lampiran 15. Analisis t-test kadar karbohidrat... 69
Lampiran 16. Analisis t-test kadar pati... 70
Lampiran 17. Analisis t-test kadar amilosa... 71
Lampiran 18. Analisis t-test kadar amilopektin... 72
Lampiran 19. Analisis t-test absorbsi air... 73
Lampiran 20. Analisis t-test absorbsi minyak... 74
Lampiran 21. Analisis t-test densitas kamba... 75
Lampiran 22. Analisis t-test pH... 76
Lampiran 23. Analisis t-testswelling power dan kelarutan... 77
Lampiran 24. Analisis t-test kejernihan pasta dan kekuatan gel... 78
Lampiran 25. Analisis t-test derajat putih dan unsur warna L... 79
Lampiran 26. Analisis t-test unsur warna a dan b... 80
Lampiran 27. Analisis t-test suhu gelatinisasi... 81
Lampiran 28. Analisis t-test viskositas maksimum... 82
Lampiran 29. Analisis t-test viskositas breakdown... 83
Lampiran 30. Analisis t-test viskositas setback...……… 84
I.
PENDAHULUAN
A.
Latar Belakang
Indonesia adalah produsen beras terbesar ketiga di dunia setelah China dan India (USDA 2007). Kontribusi Indonesia terhadap produksi beras dunia sebesar 8.5% atau 51 juta ton. Selain sebagai produsen beras terbesar ketiga di dunia, Indonesia merupakan pemakan beras terbesar di duniadengan konsumsi 154 kg per orang per tahun. Angka ini cukup tinggi dibandingkan dengan rerata konsumsi di China yang hanya 90 kg, India 74 kg, Thailand 100 kg, dan Filipina 100 kg (IRRI 1999). Akan tetapi, produksi beras Indonesia belum dapat mencukupi kebutuhan penduduk. Akibatnya, Indonesia harus mengimpor beras dari negara lain seperti Thailand.
Selain beras, Indonesia juga tercatat sebagai pengimpor gandum terbesar kedua di dunia (USDA 2012). Sebenarnya, penanaman gandum di indonesia sudah dimulai sejak awal abad ke-20 di daerah Jawa (Pengalengan, Dieng, Tengger). Akan tetapi, luas tanaman ini tidak berkembang karena tidak pernah melampaui 2000 hektar per tahun. Bahkan, saat ini areal tanaman gandum hanya tersisa beberapa hektar saja (Suhendra 2012). Hal ini menimbulkan masalah karena penggunaan tepung terigu (bahan olahan gandum) di Indonesia yang sangat tinggi, antara lain sebagai bahan baku industri roti, cake, biskuit, cookies, wafer, mie, dan sebagainya.
Ubi jalar merupakan salah satu dari 7 (tujuh) komoditas utama tanaman pangan (padi, jagung, kedelai, kacang tanah, kacang hijau, ubi kayu, dan ubi jalar) yang perlu terus dikembangkan. Hal ini dikarenakan Indonesia merupakan negara ke-4 penghasil ubi jalar terbesar di dunia sejak tahun 1968. Sentra produksi ubi jalar adalah di Jawa Barat, Jawa Tengah, Jawa Timur, Papua, dan Sumatera Utara (Deptan 2009). Ubi jalar merupakan sumber karbohidrat penting yang dapat digunakan sebagai makanan pokok (staple food), bahan olahan (process food), bahan industri, dan bahan pakan (Zhang et al.2001). Oleh karena itu, ubi jalar dapat dijadikan salah satu alternatif untuk menggantikan beras dan gandum sebagai solusi ketahanan pangan.
Jawa Barat, yang merupakan salah satu sentra produksi ubi jalar, menghasilkan berbagai varietas ubi jalar yang cukup potensial untuk dimanfaatkan, contohnya adalah dua varietas unggul ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki. Ubi jalar Cilembu memiliki keunikan tersendiri, yaitu rasanya yang manis seperti madu. Selanjutnya, ubi jalar ungu Ayamurasaki merupakan ubi jalar yang cukup terkenal karena kandungan gizinya yang tinggi. Pigmen antosianin merupakan salah satu zat gizi yang menjadi keunggulan dari ubi jalar ini karena dapat memberikan efek fungsional bagi tubuh, antara lain sebagai antioksidan, antihipertensi, dan pencegah gangguan fungsi hati (Suda et al.2003).
B.
Tujuan Penelitian
1. Mempelajari karakteristik fisikokimia dan fungsional tepung dan pati dari ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki.
C.
Manfaat Penelitian
1. Menghasilkan data base karakteristik fisikokimia dan karakteristik fungsional tepung dan pati dari ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki.
2. Memberikan informasi kepada pelaku industri pangan tentang karakteristik tepung dan pati ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki serta potensi aplikasinya.
II.
TINJAUAN PUSTAKA
A.
Ubi Jalar
Ubi jalar (Ipomoea batatas (L) Lam.) merupakan tanaman dikotil yang masuk dalam famili Convolvulaceae (Onwueme 1988). Menurut para ahli botani dan pertanian, daerah asal tanaman ubi jalar adalah Selandia Baru, Polinesia, dan Amerika Tengah. Daerah yang paling ideal untuk mengembangkan ubi jalar adalah daerah bersuhu antara 21oC dan 27oC, yang mendapat sinar matahari 11-12 jam/hari, kelembapan udara (RH) 50-60%, dengan curah hujan 750-1500 mm/tahun. Ubi jalar dapat tumbuh sepanjang tahun di dataran rendah sampai pegunungan dengan ketinggian 1000 m (Soemartono 1984). Ubi jalar termasuk tanaman yang memiliki daya adaptasi tinggi terhadap kondisi lingkungan yang buruk seperti angin kencang dan musim kering yang panjang, sehingga telah terbukti peranannya pada musim paceklik dan bencana alam sebagai makanan alternatif. Tanaman ini dapat ditanam sepanjang tahun dan memiliki daya adaptasi yang luas dengan syarat kebutuhan airnya cukup pada awal pertumbuhan.
Ubi jalar (Ipomoea batatas (L) Lam.) merupakan salah satu komoditas tanaman pangan penghasil karbohidrat, protein, lemak, dan serat yang tinggi diantara umbi-umbian (Widodo 1989). Selain itu, ubi jalar juga kaya akan vitamin (B1, B2, C dan E), mineral (kalsium, potassium, magnesium, dan zink), dietary fiber serta karbohidrat bukan serat (Suda et al. 2003). Nilai gizi ubi jalar dalam 100 gram dapat dilihat pada Tabel 1. Komposisi ubi jalar dipengaruhi oleh varietas, lokasi penanaman, dan musim tanam. Pada musim kemarau, ubi jalar akan menghasilkan kadar tepung yang lebih tinggi daripada musim penghujan.
Tabel 1. Komposisi Ubi jalar segar per 100 gram
Komponen Jumlah
Kadar air (%) 72.84
Pati (%) 24.28
Protein (%) 1.65
Gula pereduksi (%) 0.85
Mineral (%) 0.95
Lemaka (%) 0.7
Asam askorbat (mg/100g) 22.7
K (mg/100g) 204
S (mg/100g) 28
Ca (mg/100g) 22
Mg (mg/100g) 10
Na (mg/100g) 13
Fe (mg/100g) 0.59
Mn (mg/100g) 0.355
Vitamin A (IU/100g) 20063
Energi (kJ/100g) 441
Sumber : Kotecha dan Kadam (1998) a
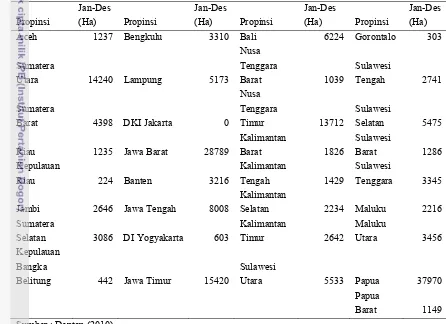
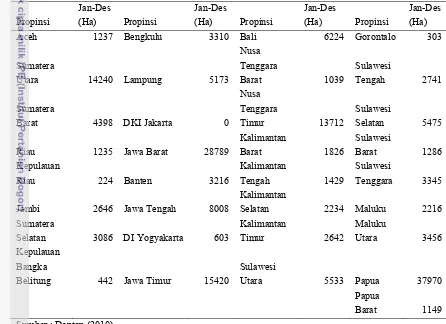
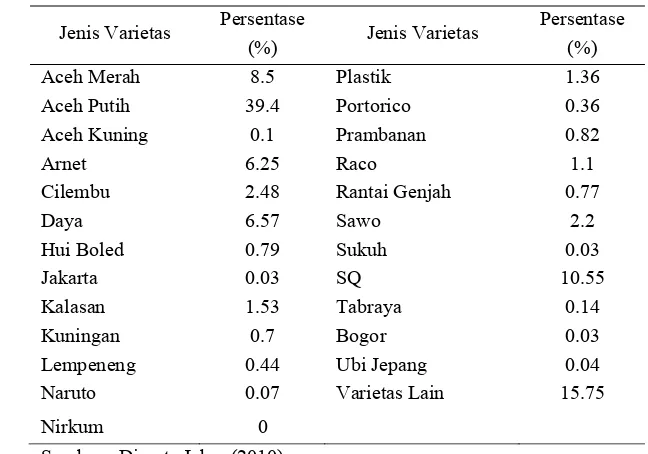
Masyarakat pada umumnya mengenal ubi jalar berdasarkan warna umbinya. Masyarakat masih jarang yang mengenal varietas ubi jalar yang ada di Indonesia. Dari 22 jenis varietas yang ditanam di Indonesia, sebagian besar (12 varietas) berumbi kuning dan bervariasi dari kuning muda sampai kuning tua, sebanyak enam varietas berumbi warna merah/jingga, dan tiga varietas berumbi putih. Varietas Kalasan memiliki umur panen terpendek, yaitu dua bulan dan mempunyai produktivitas tertinggi mencapai 40 ton/ha. Varietas Cilembu mempunyai umur tanam terpanjang, yaitu tujuh bulan dan produktivitas yang rendah hanya 20 ton/ha. Varietas Papua Solossa, Papua Pattipi dan Sawentar mempunyai rata-rata produktivitas 25 ton/ha (Puslitbang 2009). Berikut adalah luas komoditas ubi jalar tahun 2010 di Indonesia :
Tabel 2. Luas komoditi ubi jalar tahun 2010
Propinsi Jan-Des (Ha) Propinsi Jan-Des (Ha) Propinsi Jan-Des (Ha) Propinsi Jan-Des (Ha)
Aceh 1237 Bengkulu 3310 Bali 6224 Gorontalo 303
Sumatera
Utara 14240 Lampung 5173
Nusa Tenggara Barat 1039 Sulawesi Tengah 2741 Sumatera
Barat 4398 DKI Jakarta 0
Nusa Tenggara
Timur 13712 Sulawesi
Selatan 5475
Riau 1235 Jawa Barat 28789
Kalimantan
Barat 1826 Sulawesi
Barat 1286 Kepulauan
Riau 224 Banten 3216
Kalimantan
Tengah 1429 Sulawesi
Tenggara 3345
Jambi 2646 Jawa Tengah 8008
Kalimantan
Selatan 2234 Maluku 2216
Sumatera
Selatan 3086 DI Yogyakarta 603
Kalimantan Timur 2642 Maluku Utara 3456 Kepulauan Bangka
Belitung 442 Jawa Timur 15420
Sulawesi
Utara 5533 Papua 37970
Papua Barat 1149
Sumber : Deptan (2010)
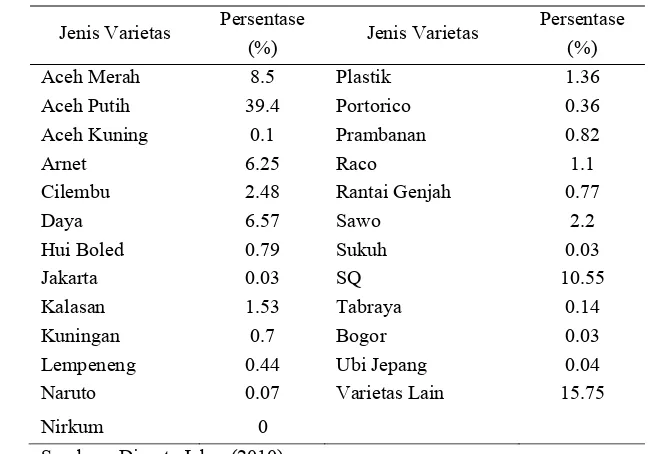
Tabel 3. Data realisasi penyebaran varietas dominan ubi jalar di Jawa Barat tahun 2010
Jenis Varietas Persentase
(%) Jenis Varietas
Persentase (%)
Aceh Merah 8.5 Plastik 1.36
Aceh Putih 39.4 Portorico 0.36
Aceh Kuning 0.1 Prambanan 0.82
Arnet 6.25 Raco 1.1
Cilembu 2.48 Rantai Genjah 0.77
Daya 6.57 Sawo 2.2
Hui Boled 0.79 Sukuh 0.03
Jakarta 0.03 SQ 10.55
Kalasan 1.53 Tabraya 0.14
Kuningan 0.7 Bogor 0.03
Lempeneng 0.44 Ubi Jepang 0.04
Naruto 0.07 Varietas Lain 15.75
Nirkum 0
Sumber : Diperta Jabar (2010)
1. Ubi Jalar Cilembu
Ubi jalar Cilembu merupakan salah satu ubi jalar yang paling populer. Nama lain ubi jalar Cilembu dalam bahasa sunda adalah huwi. Ubi jalar ini berasal dari Desa Cilembu di Kecamatan Tanjungsari, antara Bandung dan Sumedang (Suriawiria 2001). Nama varietas asli dari ubi jalar Cilembu adalah Neerkom dan Eno. Melalui SK Menteri Pertanian Nomor 1224/-Kpts/TP.240/2/2001, ubi Cilembu dikukuhkan sebagai varietas unggul.
Ubi jalar Cilembu memiliki keunggulan dibandingkan dengan ubi jalar lainnya karena jenis dan tempat penanamannya dan faktor genetika (Suriawiria 2001).Penanaman ubi Cilembu dilakukan dengan menyiapkan gundukan tanah sebagai tempat batang atau bagian ujung batang dari tanaman ubi Cilembu. Kemudian bibit ini dibiarkan selama beberapa minggu dan tunas akan terbentuk. Setelah berumur sekitar 1 bulan, batang menjalar akan tumbuh dan umbi akan terbentuk di bawah permukaan tanah (Suriawiria 2001). Agar tidak terlalu tua atau muda Ubi Cilembu dipanen 25 minggu setelah tanam.
Pemanenan dilakukan dengan cara pembabatan daun dan pencongkelan umbinya. Pemungutan umbi harus dilakukan dengan hati-hati agar umbi tidak lecet. Selanjutnya, umbi diletakkan di rak atau digantung. Rasanya yang manis seperti madu disebabkan oleh pemeraman paling sedikit selama 2 minggu setelah pemanenan. Pemeraman ini dilakukan di ruangan terbuka dengan suhu sekitar 27oC-30oC (Mayastuti 2002). Selama pemeraman akan terjadi perubahan pati menjadi gula.
Penyimpanan ubi Cilembu yang lama akan meningkatkan rasa manisnya setelah dipanggang atau dibakar. Bagian tengah umbi akan menghasilkan cairan yang sangat manis seperti madu (lelehan fruktosa). Lebih manisnya ubi jalar Cilembu disebabkan kadar gula ubi Cilembu lebih tinggi dari ubi jalar lainnya, yaitu ubi mentah mencapai 11-13% dan ubi masak 19-23% sehingga sangat digemari konsumen. Ubi Cilembu yang telah dipanggang bisa bertahan sampai satu minggu bila disimpan pada suhu 60oC (Mayastuti 2002).
Cilembu telah menjadi komoditas ekspor ke beberapa negara seperti Singapura, Korea, Malaysia, dan Jepang. Di Jepang, ubi ini digunakan sebagai bahan pembuatan etanol, kosmetik, dan sake. Bahkan, Jepang telah memulai untuk membudidayakan tanaman ini.
Ubi Cilembu memiliki kandungan vitamin A 7.100 IU (international unit), kalsium hingga 46 mg/100 gram, vitamin B-1 0.08 mg, vitamin B-2 0.05 mg dan niacin 0.9 mg, serta vitamin C 20 mg.
Gambar 1. Ubi jalar Cilembu
2. Ubi Jalar Ungu Ayamurasaki
Ubi jalar ungu varietas Ayamurasaki (Ipomoea batatas varietas Ayamurasaki) dikenal dengan sebutan blackie karena warna kulitnya yang ungu kehitaman (ungu pekat). Ubi jalar ungu Ayamurasaki merupakan jenis ubi jalar ungu yang ditanam di Jepang dan memiliki kandungan antosianin yang tinggi (Yamakawa et al. 1998). Pigmen antosianin yang terkandung dalam ubi ungu didominasi oleh sianidin dan peonidin dalam bentuk mono- atau diasilasinya (Kano et al. 2005). Ubi jalar ungu mengandung vitamin (A, B, B, C, dan E), mineral (kalsium, kalium, magnesium, tembaga, dan seng), serat pangan, serta karbohidrat bukan serat (Suda et al. 2003). Total kandungan antosianin ubi jalar varietas Ayamurasaki bervariasi pada setiap tanaman, yaitu berkisar antara 20 mg/100 g sampai 924 mg/100 g berat basah (Widjanarko 2008). Pigmennya lebih stabil dibandingkan dengan antosianin dari sumber lainnya, seperti kubis merah, eldeberi, dan jagung merah (Kano et al. 2005). Kandungan gizi ubi jalar ungu juga lebih tinggi dibandingkan dengan varietas lainnya, terutama kandungan lisin, Cu, Mg, K, Zn yang berjumlah rata-rata 20% (Widjanarko 2008). Tabel 4 menunjukkan kandungan kimia dan karakter fisik ubi jalar ungu.
Tabel 4. Kandungan kimia dan karakter fisik ubi jalar ungu varietas Ayamurasaki
Sifat Kimia dan Fisik Jumlah
Kadar air (%bb) 67.77
Kadar abu (%bk) 3.28
Kadar pati (%bk) 55.27
Gula reduksi (%bk) 1.79
Kadar lemak (%bk) 0.43
Kadar antosianin (mg/100g) 923.65 Aktivitas antosianin (%) 61.24
Warna (L) 37.5
Warna (a) 14.2
Warna (b) 11.5
Ubi jalar ungu dapat dimanfaatkan sebagai pewarna alami karena sifat antosianinnya lebih stabil dengan kandungan yang lebih tinggi (Kano et al. 2005). Industri pewarna dan minuman beralkohol menggunakan ubi jalar ungu Ayamurasaki sebagai bahan baku penghasil antosianin. Ubi jalar ungu juga telah dikembangkan dalam bentuk produk es krim, sirup, mie, pia, dan yoghurt. Ubi jalar ungu juga memiliki efek fungsional bagi tubuh, yaitu sebagai antioksidan, antikanker, antibakteri, perlindungan terhadap kerusakan hati, pencegah penyakit jantung dan stroke. Ubi jalar ungu dapat berfungsi sebagai antikanker karena mengandung zat aktif berupa selenium dan iodin yang jumlahnya dua puluh kali lebih tinggi dari ubi jalar jenis lainnya. Aktivitas antibakteri dan antioksidan ubi jalar ungu sekitar 3.2 kali dan 2.5 kali lebih tinggi daripada beberapa varietas bluberi. Ubi jalar ungu juga membantu dalam memperlancar peredaran darah (Kano et al. 2005).
Gambar 2. Ubi jalar ungu Ayamurasaki
Berikut adalah beberapa penelitian tentang pemanfaatan ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki :
Tabel 5. Pemanfaatan Ubi Jalar Cilembu dan Ubi Jalar Ungu Ayamurasaki Varietas
Ubi Jalar Penggunaan Sumber
Ubi jalar Cilembu
Optimasi Produk Selai dengan Bahan Baku Ubi Jalar Cilembu
Pengolahan Ubi Cilembu menjadi kue kering
Fatonah, Hida (2002) Rabby Radhiya, Esra Popi (Unpad 2011) Ubi Jalar
Ungu
Pemanfaatan Dua Varietas Ubi Jalar Ungu (Ipomoea batatas L.) pada Pembuatan Es Puter dan Karakteristik Es Puter
Djaufal, titiek F; Gardjito; Murdijan 2008)
Kajian Pembuatan Es Puter Ubi Jalar Ungu dan Analisis
Finansialnya Setiawan, Haris 2009
Kajian Pemanfaatan Tepung Ubi Jalar (Ipomoea batatas L.) dalam Pembuatan Spreads Ubi Jalar
Yahya, Jessica Andrea (2010)
Optimasi Proses Pembuatan Tepung Ubi Jalar Ungu (Ipomoea batatas L.) dan Aplikasinya dalam Pembuatan Kripik Simulasi
Karleen, Saffiera (2010)
Pembuatan Tepung Ubi Jalar Ungu (Ipmomea batatas L.) dan aplikasinya dalam Pembuatan Roti Tawar
3. Pati ubi jalar
Karbohidrat yang banyak terdapat di dalam ubi jalar adalah pati, gula, dan serat (Palmer 1982). Oleh karena itu, ubi jalar merupakan salah satu sumber pati yang potensial. Pati merupakan produk olahan yang diperoleh dengan memisahkan komponen-komponen non-pati, yaitu lemak, serat kasar, dan protein. Pemisahan komponen-komponen tersebut dilakukan dengan cara menghilangkan kulit, lembaga, dan protein terlarut. Pati ubi jalar memiliki sifat (viskositas dan karakteristik lain) yang berbeda dari pati kentang dan pati jagung atau pati tapioka. Granula pati ubi jalar berdiameter 2-25 μm dan berbentuk poligonal dengan kandungan amilosa dan amilopektin berturut-turut adalah 20% dan 80% (Swinkels1985). Pati ubi jalar memiliki derajat pembengkakan 20-27 ml/gram , kelarutan 15-35% dan tergelatinisasi pada suhu 75-88oC untuk granula berukuran kecil (Moorthy 2000). Rasio amilosa dan amilopektin pada pati ubi jalar secara umum adalah 1:3 atau 1:4. Perbandingan kandungan amilosa dan amilopektin ini akan mempengaruhi dalam pembentukan adonan. Menurut Winarno (1992), amilopektin yang tinggi dan amilosa yang rendah mengakibatkan produk lebih lekat.
Menurut Knight (1974) di dalam Suriani (2008), pati yang digunakan dalam industri pangan harus memenuhi syarat berikut: (1) Di dalam pengolahan pangan pati harus mudah dicampur dan menyatu dengan bahan-bahan lain tanpa menggumpal, viskositas harus stabil terhadap panas, efek mekanis maupun pengaruh bahan lain, viskositas panas dan viskositas dinginnya harus dalam batas-batas yang dikehendaki, pati harus menunjukkan penampakan yang baik pada pH yang diinginkan; (2) Di dalam penyimpanan, pasta pati tidak pecah karena variasi suhu atau karakteristik awalnya tidak mengalami perubahan; (3) Di dalam penyiapan produk, pati harus mudah dikonversikan menjadi panganan tertentu; (4) Pada produk akhirnya penampakan harus menarik dan memiliki konsistensi yang baik, tidak mempunyai rasa, memiliki sifat tekstur yang baik, tidak keras dan penggunaanya harus memenuhi undang-undang yang berlaku. Menurut Pomeranz (1985), pati dapat diaplikasikan pada produk pangan sebagai pengental (saos, sup krim, pengisi pie), penstabil (salad dressing), moisture retention (toping kue), pembentuk gel (gum), pengikat (wafer, es krim), penyalut (permen).
4. Tepung ubi jalar
Ubi jalar berpotensi dikembangkan menjadi tepung. Tepung ubi jalar dapat dibuat dengan dua cara. Pertama, ubi jalar dikupas, diiris tipis, disawut, kemudian dikeringkan. Kedua, ubi jalar diparut hingga membentuk pasta kemudian dikeringkan untuk menjadi tepung. Pengolahan ubi jalar menjadi tepung memberikan banyak manfaat antara lain, praktis, meningkatkan daya simpan, memberikan kemudahan dalam pengangkutan, dan dapat dimanfaatkan untuk berbagai macam produk makanan, seperti makanan bayi, roti, permen, saus, makanan sarapan, makanan ringan, biskuit, dan lain sebagainya.
Tabel 6. Sifat fisik, kimia, dan amilografi pati ubi jalar Bentul Komposisi kimia (%) Pati Ubi Jalar Bentul
Kadar air 12.45
Kadar abu 0.23
Kadar lemak 0.03
Kadar protein 0.18
Kadar karbohidrat 86.61
kadar pati 86.26
kadar amilosa 29.07
kadar amilopektin 57.19 Sumber : B.A.S. Santos et al.(1997)
Tabel 7. Komposisi kimia tepung ubi jalar
Komposisi Kimia Tepung Ubi Jalar
Putiha Kuningb Ungub
Air (%bb) 6.87-7.70 6.77 7
Abu (%) 2.79-2.94 4.71 5.31
Lemak (%) 0.71-0.81 0.91 0.81
Protein (%) 2.3-3.0 4.42 2.79
Serat Kasar (%) 2.83-3.90 5.54 4.72 Karbohidrat (%) 86.1-94.1 83.19 83.81
Pati (%bk) 66.7-70.7 - -
Total gula (%bk) 10.3-15.2 - -
Gula pereduksi (%bk) 3.80-10.35 - - Sumber : (a) Hamed et al (1973)
(b) Susilawati dan Medikasari (2008)
B.
Karakteristik Fisikokimia
1. Sifat fisik
Untuk mengetahui kebutuhan ruang, baik dalam pengemasan, penyimpanan, maupun pengangkutan bahan berbentuk tepung-tepungan, densitas kamba merupakan parameter yang penting untuk dianalisis. Densitas kamba (bulk density) merupakan massa partikel yang menempati suatu unit volume tertentu tanpa dipadatkan. Semakin tinggi densitas kamba, maka bahan tersebut semakin ringkas atau padat. Densitas kamba mempengaruhi jumlah bahan yang dapat dikonsumsi dan biaya produksi bahan tersebut (Ningrum 1999).
Berbeda dengan pati, tepung ubi jalar menghasilkan warna yang berbeda-beda sesuai dengan warna dagingnya sehingga dapat dianalisis unsur warnanya menggunakan sistem Hunter. Analisis warna menggunakan sistem Hunter melibatkan tiga parameter yaitu L, a, b. Sistem Hunter juga menyatakan tiga dimensi warna yaitu kecerahan (Brightness atau Lightness), Hue (proporsi merah, kuning, hijau, dan biru). Parameter L menunjukkan tingkat kecerahan, yaitu dengan nilai 0 (hitam) sampai 100 (putih). Selanjutnya, parameter a dan b merupakan koordinat-koordinat kromatisitas. Nilai a merupakan warna kromatik campuran merah-hijau dengan nilai +a dari 0 sampai +60 untuk warna merah dan −a dari 0 sampai −60 untuk warna hijau. Nilai b menunjukkan warna kromatik campuran kuning-biru dengan nilai +b dari 0 sampai +60 untuk warna kuning dan −b dari 0 sampai −60 untuk warna biru.
Pati merupakan kumpulan dari granula pati yang memiliki karakter yang berbeda-beda. Menurut Brautlecht (1953), bentuk granula pati bervariasi bergantung pada sumbernya. Sebagai contoh, bentuk granula dari pati jagung adalah poligon, sedangkan pati gandum berbentuk bulatan besar. Akan tetapi, bentuk granula pati pada umumnya adalah bulat. Di bawah mikroskop, granula pati akan memperlihatkan suatu struktur yang tersusun dari molekul-molekul yang konsentris. Demikian pula dengan ukuran granula pati, akan berbeda bergantung pada sumber tanamannya, yaitu antara ±1-150 μm. Ukuran granula pati juga mempunyai peranan yang sangat penting dalam penerapannya di industri pangan dan sangat berkaitan erat dengan suhu gelatinisasi. Kemudian menurut Taggart (2004), granula pati juga dapat merefleksikan cahaya terpolarisasi sehingga memperlihatkan pola ‘maltose cross’ (pola silang), yang dikenal dengan nama sifat birefringence.
Gambar 3. Struktur granula pati (Tester et al. 2004)
(A) Penyusunan mikrokristalin granula yang terpisah oleh pertumbuhan cincin amorphous (B) Perbesaran daerah amorphous dan kristalin
(C) Struktur helik ganda yang dibentuk dari cabang amilopektin yang meningkatkan lamella kristalin dimana titik percabangan berada pada daerah amorphous.
2. Sifat kimia
Rasio antara amilosa dan amilopektin berbeda dan bervariasi terhadap berbagai sumber pati (Tester et al. 2004). Penggunaan pati dengan komposisi tertentu sangat diperlukan dalam industri. Pati dengan kadar amilosa tinggi banyak digunakan untuk produk seperti pada biodegradable film yang berfungsi sebagai substrat enzim maupun sebagai pengikat pada pembuatan tablet. Sebaliknya, pati dengan kadar amilopektin tinggi sangat sesuai untuk bahan roti dan kue karena sifat amilopektin yang sangat berpengaruh terhadap swelling properties (sifat mengembang pada pati). Pati free amylose sangat diperlukan untuk bahan baku makanan bayi dan kertas film. Amilosa juga berfungsi sebagai pelindung terhadap dehidrasi maupun mengurangi penyerapan minyak yang terlalu banyak saat proses penggorengan seperti pada proses produksi keripik kentang.
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Rantai polimer glukosa pada granula pati bergabung satu sama lain melalui ikatan hidrogen membentuk misela atau kristalin (Swinkels 1985). Daerah renggang diantara misela disebut daerah amorf (Pomeranz 1985). Komponen penyusun utama daerah kristalin atau misela adalah amilopektin, sedangkan daerah amorf sebagian besar tersusun dari amilosa. Oleh karena itu, daerah amorf lebih mudah dimasuki air karena strukturnya yang lebih sederhana dan tidak beraturan (Kaletunc, Breslauer 2003). Amilopektin menyebabkan daerah kristalin menjadi resisten terhadap reaksi enzimatis, reaksi kimia, dan penetrasi oleh air daripada daerah amorf. Menurut Hoseney (1998), granula pati terdiri dari ±30% daerah kristalin. Dengan mengetahui kadar pati, maka kadar amilosa dan amilopektin pada bahan pangan dapat ditentukan. Rasio amilosa dan amilopektin ini yang akan menentukan karakteristik tekstur produk yang akan dihasilkan dari bahan tersebut.
Amilosa merupakan polimer glukosa rantai lurus dengan ikatan α-(1,4)-D-glukosa (Swinkles 1985). Umumnya amilosa yang menyusun pati adalah sekitar 17-21%. Perilaku amilosa dalam bahan pangan dipengaruhi oleh dua hal, yaitu interaksinya dengan polimer lain dan kemampuannya membentuk kristalin akibat interaksi molekular (Banks et al. 1973). Amilosa dapat membentuk kristal karena strukturnya yang cukup sederhana sehingga dapat terorientasi secara paralel membentuk suatu polimer yang dihubungkan dengan ikatan hidrogen (Taggart 2004). Asosiasi antar amilosa ini berperan dalam proses retrogradasi atau setback pati yang telah tergelatinisasi (Zobel 1984). Amilosa juga berperan dalam kestabilan kekentalan pasta pati karena afinitas amilosa dan air pada saat pendinginan akan berkurang sehingga pada konsentrasi rendah akan terbentuk endapan dan pada konsentrasi tinggi akan terbentuk gel (Wuzburg 1968).
Gambar 4. Ikatan α-1,4 yang menghubungkan α-D-glukopiranosa (Liu 2005)
2004). Menurut Kaletunc dan Breslauer (2003), amilopektin cenderung lemah dalam retrogradasi, dan sineresis karena struktur cabang yang dimilikinya. Kadar amilopektin yang tinggi meningkatkan daya hidrasi pati karena percabangan pada amilopektin sangat reaktif terhadap air (Panikulata 2008). Selain itu, percabangan amilopektin juga menyebabkan kemudahan dalam pengembangan dan pembentukan gel (Jane, Chen 1992 di dalam Uyarti 1997), sehingga amilopektin memiliki sifat viskositas yang tinggi (Powel 1973).
Gambar 5. Ikatan α-1,4 dan α-1,6 dalam amilopektin (Liu 2005)
C.
Karakteristik Fungsional
1. Sifat gelatinisasi pati
Pembengkakan granula pati yang irreversible karena pemanasan disebut dengan gelatinisasi pati. Granula pati tidak larut pada suhu dingin karena ikatan hidrogen intramolekul di dalam pati lebih kuat dibandingkan dengan ikatan hidrogen pati dengan air. Sebenarnya, granula pati pada suhu dingin juga mengalami pengembangan sekitar 10-15%. Akan tetapi, pengembangan ini bersifat reversible (bolak-balik), artinya apabila mengalami pengeringan granula pati akan kembali ke bentuk semula (Swinkels 1985). Pati dapat larut sempurna pada pemanasan dengan tekanan pada suhu 120-150oC. Kelarutan pati akan semakin tinggi dengan meningkatnya suhu dan menunjukkan pola yang khas pada setiap jenis pati.
Pada proses gelatinisasi pati, pengembangan akan terjadi pertama kali pada daerah amorf. Bagian amorf pada garnula pati dapat menyerap air sampai 30%. Ikatan hidrogen pada daerah ini akan terputus karena proses pemanasan sehingga granula pati terhidrasi. Kemudian granula pati akan terus mengembang sehingga viskositas akan meningkat sampai volume hidrasi maksimum yang dapat dicapai oleh pati. Fenomena ini dapat ditandai dengan hilangnya sifat birefringence dan meningkatnya viskositas (Swinkels 1985).
Gelatinisasi dipengaruhi oleh berbagai faktor antara lain pH, keberadaan komponen-komponen lain seperti asam. Pemasakan di bawah pH 5 dan diatas pH 7 akan menurunkan suhu gelatinisasi dan mempercepat proses pemasakan (Wurzburg 1968). Menurut Eliasson dan Gudmundsson (2006), pati akan mengalami cold gelatinization pada pH yang sangat tinggi dimana granula pati akan mengembang pada suhu ruang dan amilosa larut. Kondisi asam yang tinggi menyebabkan hidrolisis pada daerah amorf sehingga granula pati akan mengembang lebih cepat (Brautlecht 1953). Asam-asam yang ditambahkan seperti asam sitrat, asam malat, dan asam tartarat akan memutuskan ikatan hidrogen sehingga menyebabkan breakdown lebih cepat dan kekuatan gel rendah. Terputusnya ikatan hidrogen menyebabkan struktur heliks dari amilosa tidak stabil sehingga kurang dapat membuat kompleks.
Keberadaan komponen lain yang mempengaruhi gelatinisasi pati selain asam adalah gula sederhana dan lemak. Keberadaan gula sederhana dapat menghambat pengembanngan granula pati dan meningkatkan suhu gelatinisasi karena akan bersaing dengan pati dalam mengikat air (Mitolo 2006). Gula akan mempengaruhi gelatinisasi secara signifikan pada konsentrasi di atas 60%. Disakarida seperti sukrosa lebih mempengaruhi gelatinisasi pati dibandingkan dengan fruktosa karena lebih efektif dalam berkompetisi dengan air. Lemak dapat membentuk kompleks dengan amilosa sehingga amilosa akan sulit keluar dari granula pati. Akibatnya, energi yang diperlukan untuk melepaskan amilosa lebih tinggi sehingga suhu awal gelatinisasi yang dicapai akan lebih tinggi. Selain itu, lemak dapat diserap oleh permukaan granula sehingga membentuk lapisan hidrofobik yang dapat menghambat pengikatan air oleh granula pati. Jumlah air yang berkurang selama pengembangan granula pati menyebabkan kelekatan dan kekentalan pati berkurang (Collison 1968).
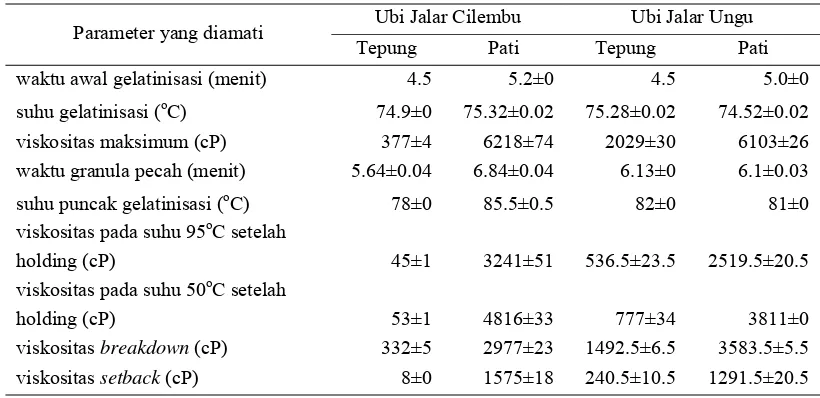
Proses gelatinisasi menyebabkan pati memiliki sifat mengalir, yaitu elastis dan viskoelastis. Sifat elastis dapat ditemukan setelah pati mengalami gelatinisasi, yaitu setelah berubah menjadi gel sehingga dapat diukur kekuatan gelnya. Viskositas merupakan karakteristik pati yang membuatnya aplikatif di banyak industri. Pengukuran profil gelatinisasi (pasting property) bertujuan untuk mengetahui karakteristik pati atau tepung dan viskositasnya.
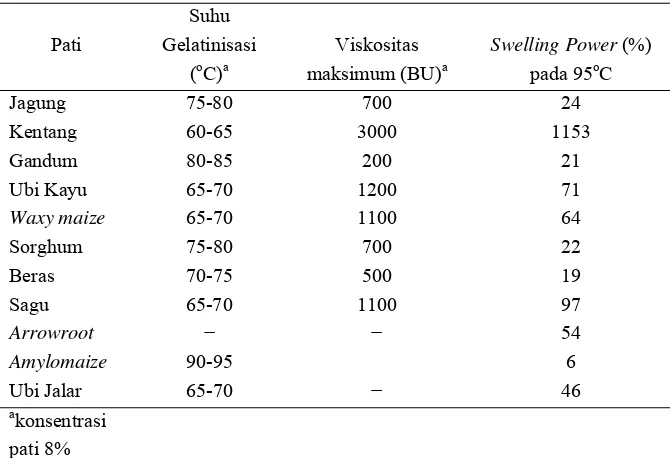
Tabel 8. Karakteristik Gelatinisasi Berbagai Pati
Pati
Suhu Gelatinisasi
(oC)a
Viskositas maksimum (BU)a
Swelling Power (%) pada 95oC
Jagung 75-80 700 24
Kentang 60-65 3000 1153
Gandum 80-85 200 21
Ubi Kayu 65-70 1200 71
Waxy maize 65-70 1100 64
Sorghum 75-80 700 22
Beras 70-75 500 19
Sagu 65-70 1100 97
Arrowroot − − 54
Amylomaize 90-95 6
Ubi Jalar 65-70 − 46
a
konsentrasi pati 8%
Pasting property ini berkaitan dengan pengukuran viskositas pati atau tepung selama pengadukan dan pemanasan.
Pasting property dapat diukur dengan alat Brabender Amilograph dan Rapid Visco Analyzer (RVA). Menurut Swinkels (1985), metode ini merupakan metode terbaik untuk mengamati perubahan viskositas pasta pati selama pengadukan dan pemanasan. Metode Rapid Visco Analyzer (RVA) memiliki prinsip yang sama dengan Brabenser Amilograph, tetapi membutuhkan waktu yang lebih singkat, yaitu sekitar 15-20 menit. Pasting property akan menunjukkan pola yang bervariasi bergantung pada karakteristik gelatinisasinya atau sumber patinya (Swinkels 1985).
Beberapa parameter yang dapat diukur adalah waktu awal pasting, waktu granula pecah, suhu pasting, suhu granula pecah, viskositas breakdown, viskositas setback, dan viskositas maksimum. Viskositas breakdown akan menentukan kestabilan pasta terhadap proses pemanasan. Viskositas setback akan menentukan tingkat kecenderungan proses retrogradasi pasta pati. Menurut Febriyanti (1990), suhu awal gelatinisasi pati adalah suhu ketika granula pati pertama kali mengalami pembengkakan irreversible dan ditandai dengan peningkatan viskositas.
2. Daya kembang pati (Swelling Power) dan kelarutan
Daya kembang pati atau swelling power merupakan derajat pengembangan granula pati saat proses gelatinisasi. Ketika terjadi gelatinisasi, daerah amorf akan terhidrasi dan menyebabkan pengembangan granula pati. Proses ini disertai dengan pemanasan sehingga ikatan hidrogen yang menghubungkan amilosa dan amilopektin (intramolekul) akan melemah, sedangkan energi kinetik air meningkat. Akibatnya, air mulai berpenetrasi ke dalam granula pati dan terjadi pengembangan. Kemudian, pengembangan akan berlanjut ke misela dan granula kehilangan polarisasinya. Pengembangan granula pati akan meningkat sering meningkatnya suhu dimana hidrasi akan terus terjadi di daerah amorf dan ikatan hidrogen di daerah kristalin mulai melemah (Swinkels 1985).
Pengembangan granula pati (swelling power) dihitung sebagai bobot granula yang mengembang per gram kering. Swelling power dan kelarutan pati diukur pada suhu sekitar 55-95oC pada interval 10oC. Kelarutan pati dihitung dari supernatan dari sisa pengukuran swelling power yang dikeringkan. Nilai swelling power semakin menurun seiring dengan meningkatnya kadar amilosa (Greenwood 1976). Ketika molekul pati mulai terhidrasi, maka molekul-molekul yang ada di dalamnya terutama amilosa akan menyebar ke media yang ada di luarnya (Fleche 1985). Semakin tinggi suhu, semakin banyak molekul pati yang pecah dan keluar.
3. Pembentukan gel
III.
METODOLOGI PENELITIAN
A.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki. Bahan-bahan kimia yang digunakan adalah akuades, K2SO4, HgO, H2SO4 pekat, H3BO3, indikator metil-merah biru, NaOH-Na2S2O3, HCl 0.02N, kapas, heksana, H2SO4 0.255N, NaOH 0.625N, K2SO4 10%, alkohol, HCl 25%, NaOH 25%, larutan Luff-Schrool, KI 20%, H2SO4 26.5%, Na2S2O3 0.1N, indikator pati, amilosa standar, NaOH 1 N, asam asetat 1N, larutan iod, dan minyak.
Alat-alat yang digunakan untuk proses pembuatan pati antara lain pisau, pemarut, pengepres atau penyaring, cabinet drier, blender, ayakan 100 mesh. Alat-alat untuk penepungan umbi antara lain pisau, penyawut, oven, disc mill, ayakan 100 mesh. Selanjutnya, alat-alat yang digunakan untuk analisis antara lain neraca analitik, Whiteness Meter, Polarized Light Microscope, oven, desikator, cawan aluminium, cawan porselen, labu Kjeldahl, Soxhlet, Spektrofotometer, Rapid Visco Analyzer (RVA), Texturized Analyzer, sentrifuse, erlenmeyer, gelas ukur, gelas piala, labu takar, sudip, gelas pengaduk, spatula, dan alat-alat gelas lainnya.
B.
Metode Penelitian
Penelitian ini terdiri dari 3 tahapan : 1) Pembuatan tepung dan pati ubi jalar Cilembu dan ubi jalar ungu Ayamurasaki; 2) Analisis fisikokimia dan fungsional; 3) Analisis statistika.
1.
Ekstraksi Pati Ubi Jalar
Pembuatan pati diawali dengan pembersihan ubi jalar dari kotoran dan tanah lalu dikupas dan diparut. Hasil parutan ditambah air dengan dengan perbandingan 1:5. Bubur ubi jalar kemudian disaring menggunakan mesin penyaring. Ampas dihancurkan, ditambah air, dan disaring lagi. Selanjutnya, seluruh cairan hasil penyaringan diendapkan. Setelah pati mengendap, air dibuang dan kemudian pati dicuci dengan air bersih 2-3 kali. Pati yang telah dipisahkan dari air kemudian dikeringkan menggunakan cabinet drier dengan suhu 60oC selama 10 jam sampai kering (kadar air ≤ 14%), dihancurkan menggunakan blender, dan diayak menggunakan ayakan 100 mesh.
2.
Pembuatan Tepung Ubi Jalar
Tepung ubi jalar dibuat dengan mengeringkan sawutan ubi yang telah dikupas dan dicuci menggunakan cabinet drier pada suhu 60oC selama 5 jam sampai kering (kadar air
3.
Analisis Fisikokimia dan Fungsional
i. Rendemen
Rendemen merupakan persen bobot sampel (pati atau tepung) terhadap ubi jalar segar yang telah dikupas.
% %
% % %
ii. Karakteristik fisik
a) Densitas kamba (Bulk density) (Wirakartakusumah et al 1992)
Densitas kamba adalah masa partikel yang menempati suatu volume tertentu. Densitas kamba ditentukan dengan cara menimbang sejumlah tertentu sampel dalam gelas ukur sampai volume 20 ml.
/
b) Derajat putih
Pengukuran derajat putih hanya dilakukan pada pati ubi jalar. Pengukuran ini menggunakan alat Whiteness Meter (Kett Electric Laboratory (C-100-3)). Sebelumnya, dilakukan kalibrasi menggunakan MgO dengan nilai derajat putih 100% (80.6). Sejumlah contoh dimasukkan ke dalam wadah khusus, lalu dimampatkan dan ditutup, kemudian dimasukkan ke dalam tempat pengukuran. Nilai derajat putih akan keluar pada layar (A).
% . %
Keterangan :
A = Nilai yang terbaca pada alat
c) Warna (Pomeranz dan Meloan 1978)
d) Bentuk dan ukuran granula pati
Alat yang digunakan untuk melihat bentuk dan intensitas birefrigence granula pati adalah Polarized Light Microscope (Olympus Optical Co. Ltd, Japan). Suspensi pati disiapkan dengan mencampurkan pati dan aquades (1%), kemudian dikocok. Suspensi diteteskan pada alat gelas objek dan ditutup dengan gelas penutup, preparat kemudian dipasang pada PLM. Pengamatan dilakukan dengan meneruskan cahaya terpolarisasi dengan perbesaran 400x. Polarized Light Microscope dapat mengamati ukuran granula pati. Mikroskop ini dilengkapi dengan semacam alat pengukur pada lensa okulernya, dimana skala terkecil bernilai 10 μm.
Gambar 6. Diagram alir penelitian Analisis statistika
Ubi jalar
Pati
Analisis fisikokimia dan fungsional : • Rendemen
• pH
• Densitas kamba • Warna
• Proksimat • Kadar pati • Kadar amilosa • Kadar amilopektin • Sifat gelatinisasi • Absorbsi air dan
minyak
Analisis fisikokimia dan fungsional : • Rendemen
• pH
• Densitas kamba • Derajat putih • Bentuk granula • Proksimat • Kadar pati • Kadar amilosa • Kadar amilopektin • Sifat gelatinisasi • Swelling power • Kelarutan • Kekuatan gel • Kejernihan pasta
Pembuatan tepung Ekstraksi pati
Gambar 7. Proses Ekstraksi Pati Ubi Jalar Pembersihan dan
pengupasan
Pemarutan
Penambahan air (1:5)
Penyaringan
Pemisahan cairan dan endapan pati Pengendapan (8-12
jam) Ubi jalar
Kulit
Cairan
Pengeringan ( 60oC, 10 jam)
Penghancuran
Pengayakan (100 mesh) Endapan
Gambar 8. Proses Pembuatan Tepung Ubi Jalar
iii. Karakteristik kimia
a) Kadar air metode oven (AOAC 1995)
Cawan aluminium dikeringkan dalam oven pada suhu 105oC selama 15 menit, lalu didinginkan dalam desikator selama 10 menit. Cawan ditimbang menggunakan neraca analitik. Sampel sebanyak 2-3 gram dimasukkan ke dalam cawan, kemudian cawan serta sampel ditimbang dengan neraca analitik. Cawan berisi sampel dikeringkan dalam oven pada suhu 105oC selama 1 malam (16 jam). Selanjutnya cawan berisi sampel didinginkan dalam desikator, kemudian ditimbang.
Pengayakan (100 mesh) Pembersihan dan
Pengupasan
Penyawutan
Pengeringan ( 600C, 5 jam ) Ubi jalar
Kulit
Sawut basah
Sawut kering
Penggilingan
% %
% %
Keterangan :
a = bobot sampel awal (g)
b = bobot sampel dan cawan setelah dikeringkan (g) c = bobot cawan kosong (g)
b) Kadar abu (AOAC 1995)
Cawan pengabuan dibakar dalam tanur, kemudian didinginkan dalam desikator, dan ditimbang. Sampel sebanyak 3-5 gram ditimbang dalam cawan tersebut, kemudian cawan berisi sampel dibakar sampai didapatkan abu berwarna abu-abu atau sampai bobotnya konstan. Cawan yang berisi sampel didinginkan dalam desikator, kemudian ditimbang dengan neraca analitik.
Catatan : sebelum masuk tanur, sampel yang ada dalam cawan dibakar dulu menggunakan hotplate sampai tidak mengeluarkan asap lagi.
% %
% % %
c) Kadar protein metode Mikro-Kjeldahl (AOAC 1995)
Sejumlah kecil sampel (kira-kira 100-250 mg) ditimbang, dipindahkan ke dalam labu Kjeldahl 30 ml. Setelah itu, ditambahkan 1.9 ± 0,1 gram K2SO4, 40 ± 10 mg HgO, dan 2.0 ± 0.1 ml H2SO4 ke dalam labu Kjeldahl yang berisi sampel. Jika sampel lebih dari 150 mg, ditambahkan 0.1 ml H2SO4 untuk setiap 10 mg bahan organik di atas 15 mg. Setelah itu, labu Kjeldahl yang berisi sampel didihkan selama 1-1.5 jam sampai cairan menjadi jernih. Setelah cairan jernih, labu Kjeldahl yang berisi sampel didinginkan dan ditambahkan sejumlah kecil air secara perlahan-lahan ke dalamnya, kemudian didinginkan kembali. Isi labu dipindahkan ke dalam alat destilasi dicuci dan dibilas 5-6 kali dengan 1-2 ml air, air cucian dipindahkan ke dalam alat destilasi.
% , %
% % ,
% % %
d) Kadar lemak metode soxhlet (AOAC 1995)
Sampel yang akan dianalisis ditimbang sebanyak 1-2 gram lalu dimasukkan ke dalam selongsong kertas lalu dikeringkan dalam oven pada suhu tidak lebih dari 80oC selama lebih kurang satu jam. Selongsong kemudian dimasukkan ke dalam alat Soxhlet yang telah dihubungkan dengan labu lemak yang berisi batu didih yang telah dikeringkan dan telah diketahui bobotnya. Sampel diekstrak dengan heksana atau pelarut lemak lainnya selama lebih kurang 6 jam. Pelarut kemudian disuling kembali dan hasil ekstraksi lemak dikeringkan dalam oven pengering pada suhu 105oC. Labu berisi lemak sampel kemudian didinginkan dalam desikator lalu ditimbang bobotnya. Pengeringan diulangi hingga didapat bobot yang tetap.
% %
% % %
Keterangan :
a = Bobot labu lemak setelah diekstraksi (g) b = Bobot labu lemak sebelum diekstraksi (g) c = Bobot sampel (g)
e) Kadar karbohidrat (by difference)
Kadar karbohidrat dihitung sebagai sisa dari kadar air, kadar abu, lemak, dan protein. Kadar karbohidrat dapat ditentukan sebagai berikut:
Kadar karbohidrat (%bb) = 100% - (kadar air + kadar abu + kadar lemak + kadar protein) (%bb)
% % %
f) Nilai pH (Apriyantono et al. 1989)
Larutan ini diendapkan selam 1 jam. Supernatan diambil untuk diukur pHnya menggunakan pHmeter terkalibrasi.
g) Kadar pati metode Luff-Schroorl (AOAC 1997)
• Pembuatan larutan Luff-Schoorl
Sebanyak 25 g CuSO4.5H2O sejauh mungkin bebas besi, dilarutkan dalam 100 ml air, 50 g asam sitrat dilarutkan dalam 50 ml air dan 388 g soda murni (Na2CO3.10H2O) dilarutkan dalam 300-400 ml air mendidih. Larutan asam sitrat dituangkan dalam larutan soda sambil dikocok hati-hati. Selanjutnya, ditambahkan larutan CuSO4. Sesudah dingin ditambahkan air sampai 1L. Bila terjadi kekeruhan, didiamkan kemudian disaring.
• Persiapan contoh
Sampel sebanyak 0.1 g ditimbang dalam erlenmeyer 300 ml, dan ditambah 50 ml akuades dan 5 ml HCl 25 %, kemudian dipanaskan pada suhu 100oC selama 3 jam. Setelah didinginkan, suspensi dinetralkan dengan NaOH 25 % sampai pH 7. Pindahkan secara kuantitatif dalam labu takar 100 ml, kemudian tepatkan sampai tanda tera dengan air destilata. Larutan ini kemudian disaring kembali dengan kertas saring.
• Analisis contoh
Sebanyak 25 ml filtrat dari persiapan contoh ditambah 25 ml larutan Luff-Schoorl dalam erlenmeyer. Dibuat pula perlakuan blanko yaitu 25 ml larutan Luff Schoorl dengan 25 ml akuades. Erlenmeyer dihubungkan dengan pendingin balik, kemudian dididihkan. Pendidihan larutan dipertahankan selama 10 menit. Selanjutnya, didinginkan secepatnya dan ditambah 15 ml KI 20 % dan dengan hati-hati ditambah 25 ml H2SO4 26.5%. Yodium yang dibebaskan dititrasi dengan larutan Na2SO3 0.1N memakai indikator pati sebanyak 2-3 ml. Untuk memperjelas perubahan warna pada akhir titrasi maka sebaiknya pati diberikan pada saat titrasi hampir berakhir.
• Perhitungan kadar pati
Dengan mengetahui selisih antara titrasi blanko dan titrasi contoh, kadar gula reduksi setelah inversi (setelah dihidrolisa dengan HCl 25 %) dalam bahan dapat dicari dengan menggunakan tabel 7 selisih kadar gula inverse dengan sebelum inverse dikalikan 0.9 merupakan kadar pati dalam bahan.
% % .
Tabel 7. Penentuan glukosa, fruktosa, dan gula invert dalam suatu bahan pangan dengan metode Luff-Schoorl
ml 0.1N Na2S2O3
glukosa, fruktosa, dan gula invert (mg C6H12O6) ∆
1 2.4 2.4 2 4.8 2.4 3 7.2 2.5 4 9.7 2.5 5 12.2 2.5 6 14.7 2.5 7 17.2 2.6 8 19.8 2.6 9 22.4 2.6 10 25 2.6 11 27.6 2.7 12 30.3 2.7 13 33 2.7 14 35.7 2.8 15 38.5 2.8 16 41.3 2.9 17 44.2 2.9 18 47.1 2.9 19 50 3 20 53 3 21 56 3.1 22 59.1 3.1
23 62.2 ₋
24 ₋ ₋
h) Kadar amilosa metode IRRI (Apriyantono et al. 1989 ) • Pembuatan kurva standar
• Analisis contoh
Sebanyak 100 mg contoh dimasukkan ke dalam tabung reaksi. Kemudian ke dalam tabung reaksi tersebut ditambah 1 ml etanol 95% dan 9 ml NaOH 1N. Tabung reaksi dipanaskan dalam air mendidih sekitar 10 menit untuk mengelatinisasi pati. Setelah didinginkan, campuran tersebut dipindahkan secara kuantitaif ke dalam labu takar 100 ml dan tepatkan sampai tanda tera. Sebanyak 5 ml larutan tersebut dipipet dan dipindahkan ke dalam labu takar. Ke dalam labu takar tersebut ditambahkan 1 ml asam asetat 1N, kemudian ditambah 2 ml larutan iod dan tepatkan dengan air sampai tanda tera. Setelah didiamkan selama 20 menit, ukur absorbansi dari intensitas warna biru yang terbentuk menggunakan spektrofotometer pada panjang gelombang 625 nm.
%
% % %
Keterangan :
C = Konsentrasi amilosa contoh dari kurva standar (mg/ml) V = Volume akhir contoh (ml)
FP = Faktor pengenceran W = Berat contoh (mg)
i) Kadar amilopektin metode IRRI (Apriyantono et al. 1989)
Pati terdiri dari amilosa dan amilopektin. Oleh karena itu, kadar amilopektin dapat dihitung dari selisih kadar pati dengan kadar amilosa.
% % %
iv. Karakteristik fungsional
a) Pasting property dengan Rapid Visco Analyzer (RVA) (AACC 2000 dengan
modifikasi)
b) Daya kembang (Swelling power) dan kelarutan (Solubility index) (Li dan Yeh 2001 dengan modifikasi)
Pati dengan konsentrasi 1% dipanaskan menggunakan waterbath dengan kisaran suhu 60oC, 70oC, 80oC, 90oC, dan 95oC masing-masing selama 30 menit kemudian disentrifuse dengan kecepatan 3000 rpm selama 30 menit. Supernatan hasil sentrifuse dipisahkan dari endapannya untuk mengukur kelarutan. Swelling power dihitung dengan cara membagi endapan hasil sentrifuse dengan bobot pati kering sebelum dipanaskan.
/
Keterangan :
X = bobot tabung dan endapan (g) Y = bobot tabung kosong (g) W= bobot sampel (g)
Supernatan yang didapatkan dari hasil sentrifuse kemudian dikeringkan dan dinyatakan sebagai kelarutan. Nilai kelarutan dapat dihitung sebagai presentase bobot pati hasil pengeringan supernatan dengan bobot sampel.
%
Keterangan :
X = bobot cawan dan endapan (g) Y = bobot cawan kosong (g)
W = bobot sampel (g)
c) Kekuatan gel (Wattanacjant et al. 2002 dengan modifikasi)
Karakteristik tekstur gel diukur dengan menggunakan alat Texturized Analyzer (TA-XT2). Pati dengan konsentrasi 20% dipanaskan dari suhu 30oC sampai suhu 95oC dan dipertahankan selama suhu 30 menit, kemudian didinginkan sampai suhu 50oC. Pasta ini dituangkan ke dalam tabung dengan diameter 4 cm dan tinggi 5 cm, lalu disimpan pada suhu -4 oC selama 24 jam. Sel ditekan dengan kecepatan penetrasi 2 mm/s dan jarak 15 mm.
d) Kejernihan pasta (Wattanachant et al. 2002)
Pasta pati (1%) dibuat dengan cara melarutkan 50 mg sampel dengan 5 ml air di dalam tabung berulir. Selanjutnya, tabung ini dimasukkan ke dalam air mendidih selama 30 menit dimana setiap 5 menit dilakukan pengadukan. Setelah didinginkan selama beberapa menit, sampel siap diukur absorbansinya dengan panjang gelombang 650 nm. Blanko untuk pengukuran ini menggunakan aquades.
e) Absorbsi air dan minyak (Sathe dan Salunke 1981)
/ /
Keterangan : a = bobot cairan (g) b = bobot supernatan (g) c = bobot sampel (g)
IV.
HASIL DAN PEMBAHASAN
A.
Rendemen
Rendemen tepung dan pati dihitung berdasarkan bobot umbi segar yang telah dikupas (Lampiran 1). Ubi jalar Cilembu menghasilkan tepung dengan rendemen sebesar 15.94%, sedangkan ubi jalar ungu adalah sebesar 21.99%. Hal ini menunjukkan ubi jalar ungu lebih potensial untuk dikembangkan menjadi tepung dibandingkan ubi jalar Cilembu. Rendemen tepung ubi jalar dapat mencapai 20-30% tergantung pada varietas ubi jalar (Heriyanto, et al. 2001). Komponen utama dari tepung adalah karbohidrat, sehingga faktor utama yang mempengaruhi rendemennya adalah kadar karbohidratnya. Hasil penelitian (Tabel 10) menunjukkan bahwa kadar karbohidrat tepung ubi jalar Cilembu lebih tinggi dibandingkan ubi jalar ungu. Akan tetapi, tingginya karbohidrat pada tepung ubi jalar Cilembu tidak mengakibatkan rendemennya lebih tinggi. Sebaliknya, rendemen tepung ubi jalar Cilembu lebih rendah dibandingkan tepung ubi jalar ungu. Hal ini dapat disebabkan oleh kadar air tepung ubi jalar ungu yang lebih tinggi dan lebih banyaknya kandungan gula pada tepung ubi jalar Cilembu. Berkurangnya rendemen tepung ubi jalar juga dapat disebabkan oleh sawutan ubi yang tersisa pada alat dan hilangnya partikel-partikel tepung saat penggilingan.
(a) (b)
(c) (d)
Gambar 9. (a) Tepung ubi jalar Cilembu (b) Tepung ubi jalar ungu (c) Pati ubi jalar Cilembu (d) Pati ubi jalar ungu
[image:42.595.169.492.405.637.2]minggu. Berkurangnya kadar pati dapat disebabkan oleh matriks tempat pati berada tidak hancur secara keseluruhan saat proses pemarutan, sehingga masih ada pati yang tersisa di dalamnya (<20%) (Sriroth et al. 2000). Selain itu, hilangnya pati selama pencucian dan penggilingan kering juga dapat mengurangi rendemen pati. Dilihat dari hasil rendemennya, ubi jalar ungu lebih potensial dibandingkan ubi jalar Cilembu untuk dikembangkan menjadi pati.
B.
Karakteristik Fisik
1. Densitas kamba
Nilai densitas dari berbagai makanan berbentuk bubuk atau tepung-tepungan umumnya berkisar antara 0.3-0.8 g/ml (Wirakartakusumah et al. 1992) atau sekitar 0.449 g/ml (Lewis 1996). Uji t (Lampiran 21) menunjukkan bahwa densitas kamba ubi jalar Cilembu dan ubi jalar ungu, baik tepung (0.4522 g/ml berbanding 0.5026 g/ml) maupun patinya (0.5957 g/ml berbanding 0.6132 g/ml) tidak berbeda nyata (P>0.05). Menurut Limonu (2008), densitas kamba memberikan informasi tentang porositas suatu bahan yaitu jumlah rongga yang terdapat diantara partikel bahan. Dari hasil penelitian ini dapat diketahui bahwa tepung ubi jalar Cilembu dan ubi jalar ungu memiliki porositas yang sama, demikian pula dengan patinya.
Menurut Ainah (2004), densitas kamba dipengaruhi oleh ukuran bahan dan kadar air dimana ukuran bahan akan mempengaruhi porositas dan kadar air akan meningkatkan densitas. Ukuran bahan keempat bahan ini sama, yaitu lolos pengayakan 100 mesh, sehingga tidak dapat diamati pengaruhnya terhadap densitas kamba. Kemudian kadar air tepung dan pati kedua ubi jalar ini (Tabel 10 dan 11) menunjukkan perbedaan nyata. Akan tetapi, perbedaan kadar air pada keempat bahan ini tidak menghasilkan perbedaan densitas kamba karena geometri, sifat-sifat permukaan partikel, serta sistem secara keseluruhan juga dapat mempengaruhi nilai densitas kamba (Wirakartakusumah et al. 1992). Dari nilai densitas kamba dapat disimpulkan bahwa tepung dan pati ubi jalar Cilembu dan ubi jalar ungu membutuhkan ruang yang sama selama penyimpanan, pengemasan, dan pengangkutan serta biaya produksi yang hampir setara karena jumlah bahan yang akan dikonsumsi hampir sama.
2. Derajat putih
Derajat putih merupakan daya memantulkan cahaya dari suatu bahan dibandingkan dengan standar MgO. Uji t (Lampiran 25) menunjukkan bahwa pati ubi jalar Cilembu memiliki nilai derajat putih lebih tinggi (87.13%) dibandingkan pati ubi jalar ungu (78.37%) (P<0.05). Pigmen antosianin yang dominan pada ubi jalar ungu menyebabkannya masih terbawa pada pati yang telah diekstrak. Selain itu, menurut Schoch (1945) di dalam Ropiq (1988), adanya protein dan lemak dapat menyebabkan granula pati berwarna lebih gelap. Hal ini sesuai dengan hasil penelitian (Tabel 11) dimana kadar protein pati ubi ungu lebih tinggi dari pati ubi Cilembu. Akan tetapi, kadar lemak kedua pati ini tidak berbeda nyata sehingga tidak dapat diamati pengaruhnya terhadap derajat putih.
jajanan pasar akan mempengaruhi penampakan akhir produk dan menurunkan penerimaan konsumen.
3. Warna
Menurut uji t (Lampiran 7), nilai L, a, dan b tepung ubi jalar Cilembu dan ubi jalar ungu berbeda signifikan (P<0.05). Tepung ubi Jalar Cilembu lebih cerah (L = 59.20) dibandingkan dengan tepung ubi jalar ungu (L = 45.84). Unsur warna merah (a) lebih dominan pada tepung ubi jalar ungu (+7.46 berbanding +1.02). Selanjutnya, tepung ubi jalar Cilembu mengandung unsur warna kuning lebih tinggi dibandingkan ubi jalar ungu (+13.67 berbanding +4.10). Warna kuning dan merah dari kedua tepung ini disebabkan oleh adanya pigmen karotenoid dan antosianin (Winarno 1995). Menurut Ningrum (1999), jumlah karotenoid dan
antosianin menurun drastis pada suhu 180-220oC. Oleh karena itu, suhu proses pengolahan
harus diperhatikan untuk mempertahankan warna kedua tepung ubi jalar ini pada produk akhir.
Suhu pengeringan pada pembuatan kedua tepung ubi jalar ini sekitar 60oC sehingga warna dari
pigmen karotenoid dan antosianinnya masih bertahan.
4. Bentuk dan ukuran granula pati
Di bawah mikroskop granula pati akan merefleksikan cahaya terpolarisasi dan
memperlihatkan pola ‘maltose cross’ (pola silang) yang terkenal dengan sifat birefringence
(Taggart 2004). Pola ini juga menghasilkan warna biru-kuning yang menunjukkan indeks refraksi dari granula pati. Menurut French (1984), indeks refraksi granula pati dipengaruhi oleh struktur heliks amilosa yang dapat menyerap sebagian cahaya yang melewati granula pati. Macam-macam bentuk granula pati pada umumnya adalah bulat, lonjong (bulat telur), ataupun bersegi banyak (Kerr 1950, Yoslyn 1970). Bentuk granula pati kedua ubi jalar ini sama, yaitu bulat dan bersegi banyak (poligonal).
(a) (b)
Gambar 10. Bentuk granula pati (a) Ubi jalar Cilembu (b) Ubi jalar ungu
Pati ubi jalar Cilembu dan ubi jalar ungu juga memiliki ukuran granula pati yang
sama, yaitu sekitar 10-80μm. Ukuran granula pati mempunyai peranan yang sangat penting
dalam penerapannya di industri pangan. Sebagai contoh, granula pati yang mempunyai ukuran
diameter 2.0μm dapat digunakan untuk subtitusi lemak karena mempunyai ukuran yang sama
dengan micell dari lipid (Kearsley and Dziedzic 1995). Ukuran granula pati berkaitan dengan
suhu gelatinisasi. Menurut Inatsu et al. (1983) dan Kearsley and Dziedzic (1995), pati dengan
C.
Karakteristik Kimia
1.
Proksimat
a. Kadar air
Uji t (Lampiran 11) menunjukkan bahwa kadar air tepung ubi jalar Cilembu (5.76%bb) lebih rendah dibandingkan kadar air tepung ubi jalar ungu (11.76%bb) (P<0.05). Kadar air pati dari ubi jalar Cilembu dan ubi jalar ungu juga menunjukkan perbedaan signifikan (P<0.05). Pati ubi jalar Cilembu lebih tinggi (8.52%bb) dibandingkan pati ubi jalar ungu (7.18%bb). Perbedaan kadar air ini dipengaruhi oleh derajat keterikatan air yang bervariasi bergantung pada sumber bahan (Fennema 1976). Kadar air dan aktivitas air berpengaruh besar terhadap laju pertumbuhan mikroba dalam bahan pangan yang pada akhirnya berpengaruh dalam menentukan mutu dan umur simpan produk pangan selama penyimpanan (deMan 2007). Oleh karena itu, tepung ubi ungu dan pati ubi Cilembu dapat diprediksi akan memiliki umur simpan yang lebih singkat.
Kadar air tepung ubi Cilembu dan ungu relatif lebih rendah dibandingkan persyaratan kadar air tepung terigu komersil. Menurut SII 0074-86 yang dikutip dalam Anonim (1986), persyaratan kadar air maksimum untuk tepung terigu adalah sebesar 14%. Hal ini menunjukkan kadar air tepung ubi Cilembu dan ubi ungu telah sesuai dengan standar persyaratan kadar air tepung SII. Demikian pula dengan pati kedua ubi jalar ini yang tidak lebih tinggi dari kadar air tapioka (15%bb) sesuai SNI.
b. Kadar abu
Uji t (Lampiran 12) menunjukkan bahwa kadar abu tepung ubi jalar Cilembu (2.44%bk) lebih tinggi dibandingkan kadar abu tepung ubi jalar ungu (1.92%bk) (P<0.05), artinya total mineral pada tepung ubi jalar Cilembu lebih tinggi dari tepung ubi jalar ungu. Nilai kadar abu kedua tepung ubi jalar ini jauh lebih tinggi dibandingkan dengan kadar abu tepung terigu untuk bahan makanan yang disyaratkan oleh SNI 01-3751-1995 yaitu maksimal 0.6% (bb). Kandungan mineral dalam ubi jalar pada umumnya cukup tinggi, yaitu sekitar 0.95%. Mineral-mineral yang terdapat dalam tepung ubi jalar per 100 g bahan adalah kalsium (152 mg), fosfor (150 mg), dan zat besi (2.4 mg) (Woolfe 1999).
Kadar abu pati ubi Cilembu dan ubi ungu tidak berbeda nyata (0.28%bk berbanding 0.38%bk) (P>0.05). Kadar abu yang dianalisis menunjukkan bahwa jumlah mineral dan garam organik yang terkandung dalam pati Cilembu dan ungu tidak jauh berbeda. Mineral yang terkandung dalam pati adalah komponen fosfor dalam jumlah kecil dalam bentuk fosfat esterifikasi dan phospholipid (Hizukuri et al. 2006). Kadar abu kedua pati ubi jalar ini lebih rendah dibandingkan kadar abu tapioka sesuai SNI (0.6%bb).
gelap pada produk. Semakin rendah kadar abu pada produk tepung maka semakin baik karena selain mempengaruhi penampakan akhir produk juga dapat mempengaruhi kestabilan adonan.
c. Kadar lemak
Uji t (Lampiran 13) menunjukkan bahwa kadar lemak tepung ubi jalar Cilembu dan ubi jalar ungu tidak berbeda nyata (0.95%bk berbanding 1.18%bk) (P>0.05). Kadar lemak kedua tepung ubi jalar ini lebih tinggi dibandingkan kadar lemak tepung ubi jalar di Indonesia yang rata-rata mencapai 0.75% (Ambarsari dan Choliq 2009). Lebih tingginya kadar lemak tepung ubi jalar Cilembu dan ubi jalar ungu kurang