PEMANFAATAN LIMBAH PADAT
NATA DE COCO
UNTUK PRODUKSI BIOETANOL OLEH
Saccharomyces cerevisiae
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pemanfaatan Limbah Padat Nata De Coco untuk Produksi Bioetanol oleh Saccharomyces cerevisiae
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Holiana
ABSTRAK
HOLIANA. Pemanfaatan Limbah Padat Nata De Coco untuk Produksi Bioetanol oleh Saccharomyces cerevisiae. Dibimbing oleh MUHAMMAD ROMLI
Dalam pengolahan nata de coco dihasilkan limbah padat berupa kulit ari, sisa potongan, dan bagian produk yang ukuran dan bentuknya tidak memenuhi spesifikasi produk yang dapat mencapai 10% dari total produksi. Limbah ini mengandung selulosa yang dapat dikonversi menjadi bioetanol. Penelitian ini bertujuan untuk mengevaluasi potensi pemanfaatan limbah padat nata de coco
untuk produksi bioetanol sebagai sumber energi alternatif. Hidrolisis nata
dilakukan secara enzimatis. Fermentasi dilakukan selama 72 jam dengan analisis produk setiap 12 jam. Dalam penelitian ini dievaluasi pengaruh penggunaan jenis inokulum, yaitu kultur murni Saccharomyces cerevisiae dan ragi komersial dan pengaruh penambahan urea untuk memperbaiki rasio C/N media. Hidrolisis menghasilkan hidrolisat sebesar 1.77 L/kg bahan dan meningkatkan gula pereduksi dari 0.08 g/L menjadi 6.8 g/L. Fermentasi dengan kadar gula pereduksi 6.95 g/L dan inokulum kultur murni Saccharomyces cerevisiae menghasilkan kadar etanol lebih tinggi, yaitu 0.33%(v/v) dengan yield 0.46g/g dibandingkan 0.20%(v/v) dengan yield 0.35g/g pada inokulum ragi komersial. Penambahan urea sebesar 2.9 g/L meningkatkan kadar etanol dari 0.20%(v/v) menjadi 0.25%(v/v) dengan yield 0.40 g/g pada jenis inokulum ragi komersial dan dari 0.33%(v/v) menjadi 0.37%(v/v) dengan yield 0.46g/g pada jenis inokulum kultur murni
Saccharomyces cerevisiae. Waktu optimum fermentasi menggunakan kultur murni Saccharomyces cerevisiae adalah 48 jam dengan tingkat penggunaan gula 83% dan 91%. Sedangkan waktu optimum fermentasi menggunakan ragi komersial adalah 60 jam dengan tingkat penggunaan gula 65% dan 68%. Hasil analisis kelayakan finansial menunjukkan bahwa produksi bioetanol mengalami kerugian sebesar Rp. 201 458, sedangkan melalui analisis penerimaan per biaya didapatkan hasil R-C ratio<1 yaitu 0.43 yang berarti produksi tidak menguntungkan.
Kata kunci: limbah padat nata de coco, hidrolisis, bioetanol, energi
ABSTRACT
HOLIANA. Utilization of Nata De Coco Solid Waste For Bioethanol Production by Saccharomyces cerevisiae. Supervised by MUHAMMAD ROMLI
and the influence of adding urea to improve the ratio of C/N media are investigated. Hydrolysis produced hydrolyzate at 1.77 L/kg of materials with increased reducing sugar from 0.08 g/L to 6.8 g/L. Fermentation with sugar content of 6.950 g/L with pure of Saccharomyces cerevisiae resulted in higher ethanol content, which was 0.33% with the yield 0.46g/g compared to 0.20% with yield 0.35 g/g in the case of commercial baker's yeast inoculum. The addition of urea at 2.9 g/L increased the ethanol content from 0.20% to 0.25% with yield 0.40 g/g in the case of commersial baker’s yeast inoculum and from 0.33% to 0.37% with yield 0.46 g/g in the case of pure culture Saccharomyces cerevisiae. The optimum fermentation time for pure cultures of Saccharomyces cerevisiae was 48
hours with the level of sugar consumption 83% and 91%, while that using baker’s
yeast was 60 hours with the level sugar consumption 65% and 68%. The result of a financial analysis shows that bioethanol production losses of Rp. 201 458, while the revenue cost through analysis of the result obtained RC ratio<1 is 0.43, which means production is not profitable.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PEMANFAATAN LIMBAH PADAT
NATA DE COCO
UNTUK PRODUKSI BIOETANOL OLEH
Saccharomyces cerevisiae
HOLIANA
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Pemanfaatan Limbah Padat Nata De Coco untuk Produksi Bioetanol oleh Saccharomyces cerevisiae
Nama : Holiana NIM : F34100117
Disetujui oleh
Prof. Dr. Ir. Muhammad Romli, MSc. St Pembimbing
Diketahui oleh
Prof. Dr. Ir. Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala Karunia – Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan adalah bioetanol, dengan judul Pemanfaatan Limbah Padat Nata De Coco untuk Produksi Bioetanol oleh Saccharomyces cerevisiae.
Terima kasih penulis ucapakan kepada Prof.Dr.Ir.Muhammad Romli, Msc.St selaku dosen pembimbing yang telah memberikan ilmu dan arahan selama penelitian dan penyusunan skripsi. Selain itu penulis juga mengucapkan terima kasih kepada Prof.Dr-Ing.Ir.Suprihatin dan Drs.Purwoko,M.Si selaku dosen penguji yang telah memberikan ilmu, arahan, dan saran selama penyusunan skripsi. Penulis juga mengucapkan terima kasih kepada Departemen Teknologi Industri Pertanian atas bantuan dana penelitian yang diberikan, para teknisi di seluruh Laboratorium Departemen Teknologi Industri Pertanian atas kesediaannya dalam membantu penulis selama melaksanakan penelitian. Tak lupa juga kepada rekan satu bimbingan yaitu Siti Puspitasari, Heldinnie Gusty Atiqah, dan Sapto Pujo, serta rekan – rekan TIN 47 atas semangat dan bantuan yang diberikan selama penulis menempuh pendidikan. Ungkapan terima kasih juga disampaikan kepada ayahanda Ho Kiun Nam, ibunda Soe Sui Fon, Holita, Holiansen, serta seluruh keluarga, atas doa, dukungan, dan kasih sayangnya.
Semoga skripsi ini bermanfaat bagi semua pihak.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Lingkup Penelitian 3
METODOLOGI 3
Bahan 3
Alat 3
Metode Penelitian 3
HASIL DAN PEMBAHASAN 5
Karakteristik Limbah Padat Nata de coco 5
Hasil Hidrolisis Limbah Padat Nata de coco 7
Perbandingan Hasil Fermentasi Semua Perlakuan 9
Hasil Fermentasi Perlakuan MS 14
Kinetika Fermentasi perlakuan MS 16
Analisis Kelayakan Finansial 17
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN 23
2
DAFTAR TABEL
1 Kombinasi perlakuan fermentasi 5
2 Hasil karakterisasi limbah padat nata de coco 6
3 Data hasil hidrolisis enzimatis limbah padat nata de coco 7 4 Hasil karakterisasi hidrolisat 30IU/ g serat kasar 8
5 Rincian penerimaan 18
6 Komponen biaya investasi 18
7 Rincian biaya mesin dan peralatan 19
8 Rincian biaya variabel operasional 19
9 Hasil keuntungan dan R-C ratio 20
DAFTAR GAMBAR
1 Reaksi konversi piruvat menjadi etanol 9
2 Pola pembentukan etanol selama fermentasi (a) percobaan pertama, (b)
percobaan kedua 10
3 Pola pertumbuhan biomassa selama fermentasi (a) percobaan pertama, (b)
percobaan kedua 12
4 Pola konsumsi gula pereduksi selama fermentasi (a) percobaan pertama
(b), percobaan kedua 14
5 Hasil fermentasi perlakuan MS 15
DAFTAR LAMPIRAN
1 Prosedur analisa total gula, gula pereduksi, dan pH 23 2 Prosedur karakterisai limbah padat nata de coco 25
3 Perhitungan rasio C/N media 26
4 Prosedur pengukuran aktivitas enzim 27
5 Prosedur perhitungan DE dan DP 27
6 Prosedur pengujian biomassa dan etanol 27
7 Perhitungan parameter fermentasi 28
8 Data hasil fermentasi semua perlakuan 28
9 Data hasil fermentasi perlakuan MS 29
1
PENDAHULUAN
Latar Belakang
Industri nata de coco adalah salah satu kegiatan agroindustri yang memproduksi produk menyerupai gel yang mengandung selulosa dengan bantuan bakteri. Dalam proses pengolahannya, selain dihasilkan produk juga dihasilkan produk samping berupa limbah padat nata de coco. Limbah padat yang dihasilkan biasanya berupa kulit ari, sisa potongan nata, dan bagian produk yang ukuran dan bentuknya tidak memenuhi spesifikasi produk. Limbah yang dihasilkan dapat mencapai 10% dari total nata de coco yang diproduksi (PT. Daya Agro Mitra Mandiri 2014). Limbah yang dihasilkan ini belum dimanfaatkan secara maksimal. Limbah padat nata de coco yang terakumulasi, jika tidak dikelola dapat menimbulkan masalah bagi lingkungan, seperti bau yang dapat menganggu lingkungan sekitar dan pencemaran air yang dapat mendatangkan sumber penyakit dan akan berdampak kepada kesehatan manusia. Oleh karena itu, perlu dilakukan pengelolaan dan pemanfaatan limbah padat nata de coco untuk mengurangi pencemaran lingkungan. Salah satu upaya untuk penanggulangan masalah pencemaran lingkungan oleh limbah padat nata de coco adalah dengan memanfaatkannya menjadi bioetanol sebagai sumber energi alternatif.
Bioetanol merupakan produk fermentasi yang dapat dibuat dari substrat yang mengandung karbohidrat (gula, pati, dan selulosa). Nata de coco merupakan produk yang mengandung selulosa sehingga dapat digunakan sebagai alternatif bahan baku untuk pembuatan etanol yang terlebih dahulu diubah menjadi gula sederhana. Salah satu mikroorganisme yang dapat digunakan untuk produksi bioetanol adalah khamir Saccharomyces cerevisiae. Khamir ini tersedia dalam bentuk kultur murni dan ragi komersial. Khamir ini juga digunakan dalam proses fermentasi alkohol karena tahan terhadap kadar alkohol yang tinggi hingga 12 – 18% (v/v), tahan terhadap kadar gula yang tinggi, dan tetap aktif melakukan fermentasi pada suhu 4 – 32oC (Harrison dan Graham 1970)
Kebutuhan dan konsumsi energi terus meningkat dari tahun ke tahun, sementara kebutuhan energi masih tergantung pada ketersediaan energi dari sumber daya alam yang tidak terbarukan seperti minyak bumi, gas, dan batu bara. Menurut Ditjen Migas (2012), cadangan minyak mentah di Indonesia hanya sekitar 3.7 milyar barrel dengan tingkat penggunaan mencapai 830 000 barrel per hari, sehingga diperkirakan akan habis dalam kurun waktu sekitar 12 tahun. Bioetanol merupakan energi alternatif yang berasal dari bahan terbarukan, memiliki karakteristik yang lebih baik dibandingkan dengan bensin karena dapat meningkatkan efisiensi pembakaran, dan energi yang ramah lingkungan dengan mengurangi emisi gas rumah kaca (Hambali et al 2007). Berdasarkan peraturan Kementerian Energi dan Sumber Daya Mineral No 32 Tahun 2008, pada tahun 2008 sampai 2010 etanol harus mensubtitusi premium sebanyak 3% untuk transportasi dan akan meningkat menjadi 5% di tahun 2015, 10% pada tahun 2020, dan 15% di tahun 2025 (Sutarto 2009).
2
menggunakan Saccharomyces cerevisiae. Penelitian dilakukan untuk mengevaluasi potensi pemanfaatan limbah padat nata de coco untuk produksi bioetanol sebagai sumber energi alternatif dengan sistem fermentasi yang sederhana menggunakan kultur murni Saccharomyces cerevisiae dan ragi komersial, serta penambahan nutrisi pada media.
Perumusan Masalah
Mengacu pada konteks dan fokus penelitian, masalah yang dapat dirumuskan adalah limbah padat nata de coco dapat dimanfaatkan menjadi bioetanol karena mengandung selulosa. Untuk melihat pengaruh kinerja fermentasi perlu dilakukan percobaan dengan perlakuan jenis inokulum yang berbeda yaitu kultur murni Saccharomyces cerevisiae dan ragi komersial, dan penambahan nutrisi. Dalam proses fermentasi mikroba mempunyai waktu optimum fermentasi dan yield yang dihasilkan sehingga perlu diuji lama waktu fermentasi optimum dan yield yang dihasilkan. Sedangkan untuk melihat kelayakan produksi bioetanol secara ekonomi perlu dianalisis kelayakan finansial.
Tujuan Penelitian
Penelitian ini bertujuan untuk memproduksi bioetanol dengan memanfaatkan limbah nata de coco sebagai sumber energi alternatif dengan berbagai perlakuan, yang secara rinci dijelaskan sebagai berikut:
1. Mengetahui potensi pemanfaatan limbah nata de coco untuk produksi bioetanol sebagai sumber energi.
2. Membandingkan kinerja fermentasi antara kultur murni Saccharomyces cerevisiae dan ragi komersial, dan penambahan nutrisi.
3. Mengetahui waktu optimum fermentasi dan yield kultur murni
Saccharomyces cerevisiae dan ragi komersial.
4. Mengetahui potensi bioetanol berdasarkan kelayakan finansial.
Manfaat Penelitian
Manfaat penelitian bioetanol dari limbah nata de coco oleh Saccharomyces cerevisiae antara lain:
1. Bagi peneliti
Menambah pengetahuan tentang produksi bioetanol dari limbah nata de coco dengan perbandingan Saccharomyces cerevisiae dan ragi komersial serta pengaturan nutrisi dan media apa adanya.
2. Bagi peneliti lanjutan
Sebagai informasi awal yang bisa dikembangkan untuk penelitian produksi bioetanol selanjutnya.
3. Bagi masyarakat
3 Lingkup Penelitian
Ruang lingkup yang menjadi batasan dalam penelitian ini ialah sebagai berikut:
1. Prosessecara enzimatis menggunakan enzim selulase.
2. Fermentasi menggunakan kultur murni Saccharomyces cerevisiae dan ragi komersial.
3. Fermentasi dilakukan selama 72 jam dengan analisis hasil fermentasi yaitu kadar etanol, biomassa, kadar gula pereduksi sisa yang diuji setiap 12 jam.
METODOLOGI
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah limbah padat
nata de coco dari PT. Daya Agro Mitra Mandiri. Enzim yang digunakan untuk keperluan hidrolisis nata de coco adalah enzim selulase komersial yang diperoleh dari Laboratorium Bioindustri, Teknologi Industri Pertanian, IPB. Mikroba yang digunakan dalam fermentasi untuk menghasilkan bioetanol adalah Saccharomyces cerevisiae ATCC 9763 yang diperoleh dari Laboratorium Kimia Pangan, Departemen Teknologi Pangan, FATETA IPB dan ragi komersial merk
“Fermipan” yang diperoleh dari pasar. Urea sebagai sumber nutrisi diperoleh dari pasar. Sedangkan bahan kimia yang digunakan untuk analisis antara lain akuades,
yeast extract, malt extract, peptone, glukosa, NaOH, etanol, fenol, HCL, indikator pp, asam 3,5 dinitrosalisilat, Na – K Tartarat, Na – Metebisulfit, glukosa standar, dan H2SO4.
Alat
Peralatan yang digunakan dalam penelitian ini diantaranya adalah fermentor berupa labu erlenmeyer skala 300 ml, leher angsa, erlenmeyer 1000 ml, inkubator, mikro pipet, blender, oven, tabung ulir, kapas, kertas saring whatman No.40, autoklaf, termometer, cawan alumunium, cawan porselen, tanur, hot plate, saringan, desikator, pipet volumetrik, penangas air, spektrofotometer HACH, timbangan analitik, pH meter, buret, alat distilasi etanol, sentrifuse, dan piknometer.
Metode Penelitian
1. Persiapan dan Karakterisasi Bahan
4
kadar protein, dan kadar karbohidrat (by different – kadar lemak), kadar total karbon, dan kadar total nitrogen. Prosedur karakterisasi limbah padat nata de coco
dapat dilihat pada Lampiran 2. Untuk mengetahui berapa jumlah nutrisi urea yang ditambahkan pada proses fermentasi berdasarkan rasio C/N media perlu dilakukan perhitungan. Perhitungan untuk rasio C/N media dapat dilihat pada Lampiran 3. 2. Hidrolisis Limbah Nata de coco Menjadi Gula
Hidolisis limbah padat nata de coco dilakukan secara enzimatis menggunakan enzim selulase. Enzim selulase yang digunakan sebelumnya dihitung aktivitasnya agar jumlah enzim yang digunakan sesuai dengan konsentrasi yang diperlukan. Prosedur pengukuran aktivitas enzim dapat dilihat pada Lampiran 4. Hidrolisis dilakukan pada kondisi pH 5 dan suhu 60 oC selama tiga hari dengan konsentrasi enzim adalah 10, 20, 30, 40, dan 50 IU/g serat kasar. Hasil hidrolisis berupa hidrolisat kemudian diuji kadar gula total dan kadar gula pereduksi. Selanjutnya dihitung dekstrosa ekivalen (DE) dan derajat polimerisasi (DP). Prosedur pengujian hidrolisat nata de coco berupa kadar gula total dan gula pereduksi sama dengan metode pada Lampiran 1, sedangkan perhitungan dekstrosa ekivalen (DE) dan derajat polimerisasi (DP) dapat dilihat pada Lampiran 5.
3. Penyiapan inokulum
3.1 Penyiapan Inokulum Saccharomyces cerevisiae
Kultur murni Saccharomyces cerevisiae dibiakan pada agar miring YMGP (Yeast Malt Glucose Peptone) selama 48 jam pada suhu 30oC sebelum diinokulasi pada media cair YGP (Yeast Glucose Peptone). Kultur hasil biakan pada YMGP selanjutnya dibiakan pada media YGP sebelum digunakan pada fermentasi. Pembiakan dilakukan dengan menginokulasi sebanyak satu jarum ose dalam 20 ml media YGP. Kemudian biakan di shaker pada kecepatan 125 rpm selama 24 jam pada suhu kamar. Hasil biakan digunakan sebagai inokulum pada fermentasi utama.
3.2 Penyiapan Inokulum Ragi komersial
Pembuatan inokulum fermentasi menggunakan ragi komersial dilakukan melarutkan0.1 g ragi komersial dalam 20 ml air hangat suhu 30oC. Hasil tersebut bisa langsung digunakan sebagai inokulum pada fermentasi utama. Berdasarkan penelitian Daulay (1999) dalam Suyandra (2007), melalui metode tersebut akan didapatkan jumlah sel inokulum yang sama dengan jumlah sel inokulum kultur murni Saccharomyces cerevisae.
4. Fermentasi dengan Perlakuan Jenis Inokulum dan Pengaturan Nutrisi Fermentasi dengan membandingkan perlakuan jenis inokulum (kultur murni
5 121oC selama 15 menit, setelah itu media didinginkan hingga 30oC. Selanjutnya inokulum kultur murni Saccharomyces cerevisiae dan ragi komersial yang telah disiapkan sebelumnya sebanyak 10% volume substrat ditambahkan pada media. Fermentasi berlangsung pada kondisi anaerobik. Fermentasi berlangsung pada suhu kamar dengan lama fermentasi 72 jam dengan analisa hasil setiap 12 jam. Analisa hasil dilakukan meliputi analisa kadar etanol, biomassa, dan kadar gula pereduksi. Prosedur analisis gula pereduksi sama dengan analisa hidrolisat nata de coco pada Lampiran 1. Prosedur pengukuran biomassa dan prosedur pengukuran kadar etanol dapat dilihat pada Lampiran 6. Fermentasi dilakukan dengan mengkombinasikan perlakuan jenis inokulum dan pengaturan nutrisi fermentasi. Adapun secara detail kombinasi perlakuan fermentasi disajikan pada Tabel 1.
Tabel 1 Kombinasi perlakuan fermentasi
Perlakuan Tanpa penambahan
nutrisi
Penambahan nutrisi urea
Ragi komersial OR MR
Kultur murni Saccharomyces cerevisiae OS MS
5. Analisis Kelayakan Finansial
Untuk melihat potensi produksi bioetanol dilakukan analisis kelayakan finansial. Analisis kelayakan finansial dihitung dari arus manfaat dan arus biaya. Arus manfaat meliputi penerimaan yang diperoleh dari penjualan bioetanol, ampas nata
sisa hidrolisat, dan biomassa hasil samping fermentasi. Arus biaya terdiri dari biaya investasi dan biaya operasional. Selanjutnya dilakukan perhitungan keuntungan dan analisis Revenue Cost Ratio (R-C ratio).
HASIL DAN PEMBAHASAN
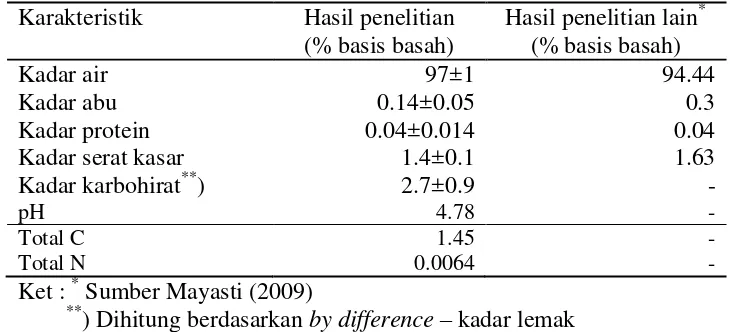
Karakteristik Limbah Padat Nata de coco
Nata de coco merupakan produk yang dihasilkan dari proses fermentasi merupakan sejenis polisakarida mikrobial yang tersusun oleh serat – serat selulosa yang dihasilkan oleh bakteri penghasil asam asetat yang biasa disebut selulosa bakterial (Buckle 1985). Polimer dari selulosa bakteri adalah polimer tidak bercabang dengan nanofibrils, terdiri dari ß-1,4-glikosidik unit glukosa terkait.
6
Tabel 2 Hasil karakterisasi limbah padat nata de coco
Karakteristik Hasil penelitian
Berdasarkan Tabel 2 dapat dilihat bahwa hasil karakterisasi yang dilakukan pada penelitian berbeda dengan karakterisasi yang dilakukan oleh Mayasti (2009). Perbedaan karakteristik ini dipengaruhi oleh faktor perbedaan tempat dan kondisi pengambilan sampel. Sampel yang uji pada penelitian Mayasti (2009) adalah lembaran nata de coco segar sehingga berbeda dengan karakteristik limbah padat yang diteliti. Limbah yang dihasilkan dari setiap produksi nata de coco juga memiliki karakteristik yang berbeda karena jenis limbah yang dihasilkan pada setiap kegiatan berbeda.
Kadar air limbah padat yang dihasilkan dalam penelitian ini adalah 97±1 %. Kadar air yang tinggi ini berpengaruh umur simpan nata yang rendah. Kadar air yang tinggi ini juga dapat memudahkan tumbuhnya mikroorganisme sehingga mudah mengalami kerusakan limbah. Hal ini membuat limbah padat nata de coco
harus segera diolah. Abu merupakan zat anorganik yang dihasilkan dari proses pembakaran bahan organik (Sudarmadji et al 1997). Kadar abu hasil penelitian mencapai 0.14±0.05%. Kadar abu ini digunakan untuk menghitung kadar total karbon yang terdapat pada limbah padat nata de coco untuk perhitungan rasio C/N dalam pengaturan media nutrisi. Total karbon yang terdapat dalam bahan yang diteliti adalah 1.45%.
Kadar protein hasil pengujian adalah 0.04±0.014%. Kadar protein yang terkandung dalam limbah padat nata de coco ini akan digunakan untuk perhitungan kadar nitrogen limbah untuk perhitungan rasio C/N dalam pengaturan media nutrisi. Total nitrogen yang terdapat bahan yang diteliti adalah 0.0064%.
Serat kasar adalah residu berupa bagian dari karbohidrat pada suatu bahan yang tidak dapat dihidrolisis dengan asam atau alkali mendidih (Gaman dan Sherrington 1981). Kadar serat kasar limbah padat nata mencapai 1.4±0.1%. Pada
7
nata mempunyai pH 4.78. Analisis pH awal bahan ini diperlukan untuk menyesuaikan kondisi media agar diperoleh kondisi optimum media fermentasi.
Hasil Hidrolisis Limbah Padat Nata de coco
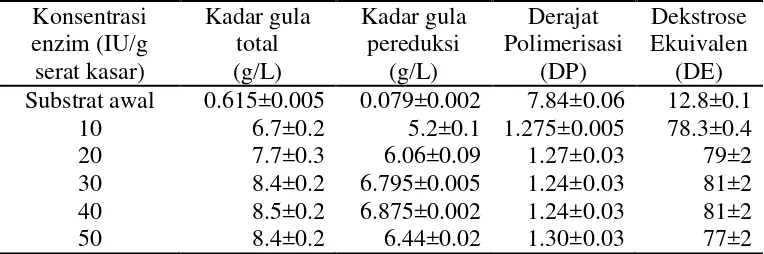
Hidrolisis selulosa adalah pengubahan atau konversi gula kompleks dalam selulosa menjadi gula sederhana. Jenis hidrolisis yang digunakan dalam penelitian ini adalah hidrolisis secara enzimatis oleh enzim selulase. Peranan enzim dalam hidrolisis enzimatis adalah sebagai katalisator untuk mempercepat reaksi. Hidrolisis secara enzimatis memiliki beberapa kelebihan, diantaranya kondisi reaksi lebih ringan, derajat konversi tinggi, kebutuhan energi yang rendah, kondisi operasi yang mudah dicapai, tidak menimbulkan korosi sehingga tidak terjadi reaksi samping yang berarti. Kelemahannya adalah harga enzim yang cukup mahal (Taherzadeh dan Karimi 2007). Pada penelitian ini dilakukan hidrolisis limbah padat nata de coco menggunakan enzim selulase komersial dengan konsentrasi 10, 20, 30, 40, dan 50 IU/g serat kasar. Enzim yang digunakan tahap hidrolisis mempunyai aktivitas 414.35 IU/ml. Aktivitas enzim selulase didefinisikan sebagai jumlah gula pereduksi yang dihasilkan dari hidrolisis selulosa oleh enzim per menit per milimeter filtrat enzim dengan satuan IU/menit.ml, dimana satu IU sama dengan satu mikromol glukosa (Darwis et al
1995). Jumlah ml enzim yang digunakan dalam proses hidrolisis juga ditentukan dari aktivitas enzim tersebut. Analisis yang dilakukan meliputi kadar gula pereduksi dan kadar total gula. Setelah itu dihitung dekstrosa ekivalen (DE) dan derajat polimerisasi (DP). Hasil hidrolisis secara enzimatis disajikan pada Tabel 3.
Tabel 3 Data hasil hidrolisis enzimatis limbah padat nata de coco
Konsentrasi Substrat awal 0.615±0.005 0.079±0.002 7.84±0.06 12.8±0.1
10 6.7±0.2 5.2±0.1 1.275±0.005 78.3±0.4
20 7.7±0.3 6.06±0.09 1.27±0.03 79±2
30 8.4±0.2 6.795±0.005 1.24±0.03 81±2
40 8.5±0.2 6.875±0.002 1.24±0.03 81±2
50 8.4±0.2 6.44±0.02 1.30±0.03 77±2
Kadar gula total menunjukkan jumlah keseluruhan komponen gula dalam bahan yang telah dihidrolisis, sedangkan gula pereduksi menunjukkan jumlah komponen gula yang ujung rantainya mengandung gugus aldehida atau keton bebas. Pada Tabel 3 dapat terlihat bahwa hidrolisis secara enzimatis dapat meningkatkan kadar gula total dan kadar gula pereduksi. Semakin banyak enzim yang ditambahkan, gula yang dihasilkan juga semakin tinggi dikarenakan adanya pemutusan ikatan ß-1,4-glikosidik yang ada pada selulosa.
8
(Tjokrodikoesoemo 1986). Pada Tabel 3 dapat dilihat bahwa Nilai DE yang diperoleh dari konsentrasi 30 IU/g serat kasar lebih tinggi dibandingkan dari konsentrasi lainnya yaitu sebesar 81±2%. Hasil ini sama dengan DE yang dihasilkan dari konsentrasi enzim 40 IU/g serat kasar yaitu sebesar 81±2. Nilai DE ini adalah nilai yang menggambarkan banyaknya selulosa yang dikonversi menjadi glukosa. Semakin tinggi nilai DE semakin banyak selulosa yang terkonversi menjadi glukosa (Palmer 1970). DP adalah rasio total gula dan gula pereduksi yang merupakan jumlah monomer pada substrat. Nilai DP yang semakin mendekati satu, enzim yang memutus rantai polimer juga semakin sempurna yang artinya menghasilkan gula pereduksi semakin banyak. Nilai DP terrendah didapatkan dari hidrolisis dengan konsentrasi enzim 30 IU/ g serat kasar dan 40 IU/ g serat kasar yaitu sebesar 1.24±0.03. Nilai DP ini menunjukkan gula yang dihasilkan tidak hanya gula pereduksi yaitu glukosa tetapi ada gula lain misalnya disakarida yang berupa selobiosa yang dihasilkan dari hidrolisis yang tidak sempurna sebelum membentuk glukosa.
Pemilihan konsentrasi enzim 30 IU/ g serat kasar dinilai efisien dengan memberikan hasil gula yang paling optimum yaitu dengan kadar gula pereduksi 6.795±0.005/L dan gula total 8.4±0.2. Konsentrasi 40 IU/ g serat kasar tidak dipilih karena semakin tinggi konsentrasi enzim yang digunakan semakin banyak pula volume enzim yang ditambahkan. Semakin banyak volume enzim yang ditambahkan akan semakin meningkatkan konversi gula namun akan semakin tinggi pula biaya yang akan dikeluarkan. Menurut Taberzadeh dan Karim (2007) banyaknya enzim yang ditambahkan pada substrat umumnya 5 – 35 IU/g substrat. Percobaan dengan konsentrasi enzim 50 IU/g serat kasar mengalami penurunan tingkat konversi gula. Hal ini dapat disebabkan perbandingan antara jumlah enzim dan substrat yang tidak seimbang. Terjadinya penghambatan oleh substrat tergantung pada rasio enzim terhadap substrat.
Setelah didapatkan konsentrasi yang memberikan hasil optimum yaitu 30 IU/g serat kasar, kemudian dilakukan perbanyakan hidrolisat. Hasil karakterisasi hidrolisat 30 IU g/ serat kasar dengan dua kali percobaan disajikan pada Tabel 4.
9 Perbandingan Hasil Fermentasi Semua Perlakuan
Fermentasi dilakukan dengan perlakuan jenis inokulum dan pengaturan nutrisi. Jenis inokulum terdiri dari kultur murni Saccharomyces cerevisiae dan ragi. Ragi yang dapat digunakan adalah ragi komersial. Ragi ini digunakan karena kemudahan dalam penyiapan inokulumnya. Urea yang ditambahkan dalam fermentasi ini dihitung untuk memperbaiki rasio C/N media. Penambahan urea ini dilakukan untuk mengetahui pengaruh kinerja fermentasi yang terjadi. Pemilihan urea disebabkan oleh faktor kemudahan dalam memperolehnya serta harganya yang relatif lebih murah. Rasio C/N media bedasarkan hasil analisa yang telah dilakukan adalah sebesar 226.56. Menurut Syamsu et al. (2002) dalam Haryani (2008), jumlah total C/N yang dibutuhkan sebagai media fermentasi etanol adalah sebesar 10, sehingga dibutuhkan 0.14% nitrogen atau 2.9 g/L urea yang harus ditambahkan kedalam media fermentasi. Fermentasi dilakukan dengan dua kali percobaan dengan kadar gula pereduksi yang berbeda yaitu 3.878 g/L dan 6.950 g/L. Analisis hasil fermentasi meliputi kadar etanol, kadar biomassa, dan kadar gula pereduksi.
a. Kadar Etanol
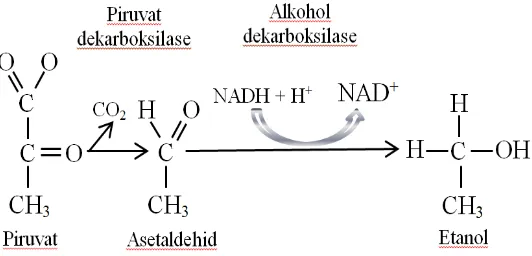
Selama proses metabolisme, mikroorganisme akan memanfaatkan sumber karbon menghasilkan asam piruvat melalui proses glikolisis. Pembentukan piruvat berlangsung melalui jalur glikolisis yang merupakan rangkaian reaksi – reaksi fosforilasi dan defosforilasi. Senyawa yang berperan sebagai donor dan akseptor fosfat dalam jalur glikolisis ialah ATP dan ADP (Crueger dan Anneliese 1984). Reaksi yang berlangsung adalah sebagai berikut.
C6H12O6 + 2ADP + 2NAD+ + 2Pi 2piruvat + 2ATP + 2(NADH+H+) Glukosa Adenosin Fosfat Adenosin
difosfat anorganik trifosfat
Selanjutnya, asam piruvat yang telah dihasilkan diubah menjadi asetaldehid oleh enzim piruvat dekarboksilase disertai pelepasan CO2. Asetaldehid selanjutnya diubah menjadi etanol oleh enzim alkohol dehidrogenase. Reaksi keseluruhan yang berlangsung disajikan pada Gambar 1.
10
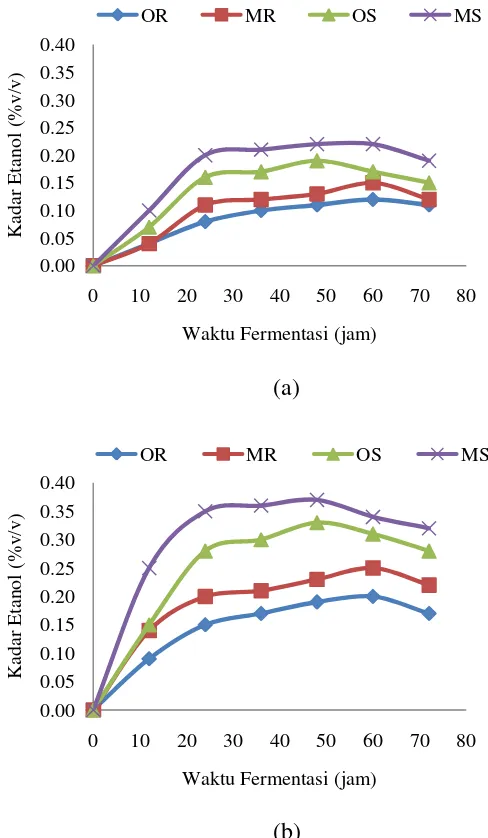
distilasi. Kemudian dihitung juga yield atau yang sama dengan nilai Yp/s yaitu nilai perbandingan pembentukan g etanol terhadap g substart gula yang dikonsumsi. Adapun pola pembentukan etanol selama fermentasi disajikan pada Gambar 2. Bagian (a) untuk percobaan pertama dan (b) untuk percobaan kedua.
(a)
(b)
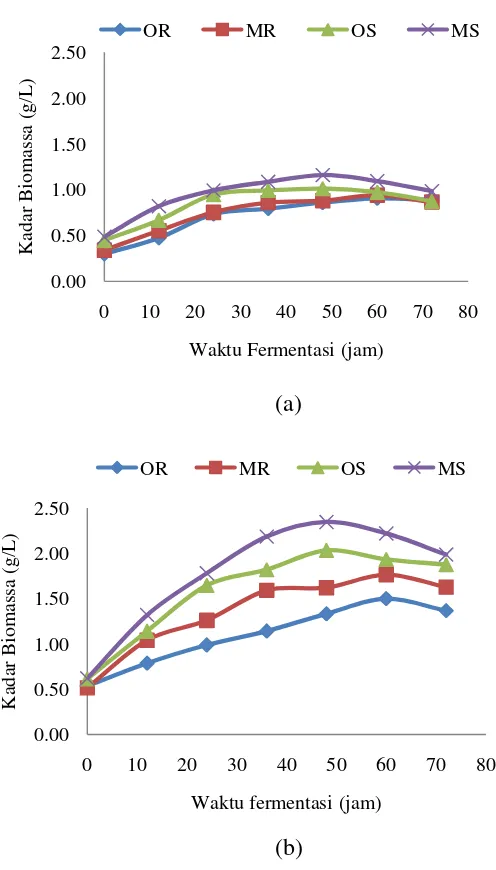
Gambar 2 Pola pembentukan etanol selama fermentasi (a) percobaan pertama (b) percobaan kedua
Pada percobaan pertama dengan kadar gula pereduksi 3.878 g/L dihasilkan kadar etanol yang bervariasi antara 0.04%(v/v) sampai 0.22%(v/v) pada waktu fermentasi setiap 12 jam selama 72 jam. Pada Gambar 2 dapat dilihat bahwa perlakuan dengan menggunakan kultur murni Saccharomyces cerevisiae (OS) menghasilkan kadar etanol yang lebih tinggi dibandingkan dengan kadar etanol yang dihasilkan dari jenis inokulum ragi komersial (OR). Kadar etanol maksimal yang dapat dicapai oleh kultur murni Saccharomyces cerevisiae(OS) adalah 0.19%(v/v) dengan yield 0.40g/g pada waktu fermentasi 48 jam, sedangkan kadar etanol maksimal yang dapat dihasilkan dengan menggunakan ragi komersial(OR)
11 adalah 0.12%(v/v) dengan yield 0.26g/g pada waktu fermentasi 60 jam. Pengaturan nutrisi pada fermentasi yaitu dengan menambahkan urea juga meningkatkan kadar etanol dari 0.12%(v/v) menjadi 0.15%(v/v) dengan yield 0.33g/g pada penggunaan jenis inokulum ragi komersial. Pada penggunaan inokulum kultur murni Saccharomyces cerevisiae juga menunjukkan bahwa penambahan nutrisi urea dapat meningkatkan kadar etanol 0.19%(v/v) menjadi 0.22%(v/v) dengan yield 0.46g/g. Adapun tabel hasil kadar etanol percobaan pertama yang dihasilkan selama fermentasi dapat dilihat pada Lampiran 8.
Pada Gambar 2 bagian (a) dapat dilihat kadar etanol percobaan kedua untuk kultur murni Saccharomyces cerevisiae (OS) juga menghasilkan kadar etanol yang lebih tinggi dibandingkan dengan kadar etanol yang dihasilkan dari jenis inokulum ragi komersial (OR). Kadar etanol maksimal yang dapat dicapai oleh kultur murni Saccharomyces cerevisiae (OS) adalah 0.33%(v/v) dengan yield 0.46g/g pada waktu fermentasi 48 jam, sedangkan kadar etanol maksimal yang dapat dihasilkan dengan menggunakan ragi komersial (OR) adalah 0.20%(v/v) dengan yield 0.35g/g pada waktu fermentasi 60 jam. Pengaturan nutrisi pada fermentasi percobaan kedua yaitu dengan menambahkan urea juga meningkatkan kadar etanol dari 0.20%(v/v) menjadi 0.25%(v/v) dengan yield 0.40g/g pada penggunaan jenis inokulum ragi komersial. Pada penggunaan inokulum kultur murni Saccharomyces cerevisiae juga menunjukkan bahwa penambahan nutrisi urea dapat meningkatkan kadar etanol 0.33%(v/v) menjadi 0.37%(v/v) dengan yield 0.46g/g. Adapun tabel hasil kadar etanol percobaan kedua yang dihasilkan selama fermentasi dapat dilihat pada Lampiran 8.
Perbedaan kadar etanol dari percobaan pertama dan kedua disebabkan oleh perbedaan konsentrasi gula pereduksi yang digunakan. Semakin tinggi konsentrasi gula pereduksi semakin tinggi kadar etanol yang dapat dihasilkan. Hal ini disebabkan karena semakin tinggi konsentrasi gula pereduksi semakin banyak sumber karbon yang dapat dikonsumsi. Tetapi biasanya terdapat kadar gula pereduksi minimal dan maksimal yang dapat menghambat pertumbuhan sel yaitu dibawah 1 g/L dan diatas 300 g/L (Rehm dan Reed 1983).
Hasil perbandingan antar perlakuan menggunakan inokulum kultur murni
Saccharomyces cerevisiae dan ragi komersial memperlihatkan bahwa inokulum kultur murni Saccharomyces cerevisiae menghasilkan kadar etanol yang lebih tinggi dibandingkan dengan menggunakan ragi komersial. Hal ini diduga disebabkan oleh adanya perbedaan antra galur Saccharomyces cerevisiae dan galur khamir yang digunakan pada ragi komersial. Menurut Retledge (2001) galur
Saccharomyces cerevisiae yang digunakan berbeda antara ragi komersial dan ragi untuk produksi alkohol. Penambahan nutrisi juga dapat meningkatkan kadar etanol. Nutrisi urea sebagai nitrogen ternyata berpengaruh karena urea sendiri adalah sumber nitrogen bagi khamir untuk mengoptimalkan pertumbuhan khamir sehingga dapat menghasilkan kadar etanol yang lebih tinggi.
b. Kadar Biomassa
12
(a)
(b)
Gambar 3 Pola pertumbuhan biomassa selama fermentasi (a) percobaan pertama (b) percobaan kedua
Pada Gambar 3 (a) dan (b) dapat dilihat adanya peningkatan biomassa yang dihasilkan selama fermentasi. Peningkatan biomassa ini menunjukkan adanya pertumbuhan sel. Pola pertumbuhan sel terdiri dari fase adaptasi (lag) yaitu fase penyesuaian khamir terhadap lingkungannya ketika dipindahkan dalam medium. Setelah fase adaptasi, perbanyakan sel mulai terjadi pada fase eksponensial yang mengakibatkan peningkatan jumlah sel dalam cairan fermentasi. Pada fase eksponensial ini laju pertumbuhan mengalami peningkatan. Fase stasioner merupakan fase dimana jumlah sel mati seimbang dengan jumlah sel yang tumbuh (sel baru) dan populasinya stabil. Ukuran sel pada fase ini menjadi lebih kecil karena sel tetap membelah meskipun zat-zat nutrisi sudah habis. Pada fase ini terjadi akumulasi zat – zat metabolik yang menghambat pertumbuhan (Stanbury dan Whitaker 1993). Fase kematian adalah dimana jumlah sel menurun karena nutrisi untuk pertumbuhan telah habis dikonsumsi.
13 Untuk inokulum kultur murni Saccharomyces cerevisiae, fase adaptasi terjadi sebelum jam ke-0 lama fermentasi, kemudian diikuti oleh fase eksponensial sampai jam ke-36. Setelah itu pola biomassa memperlihatkan fase stasioner dan pada akhirnya mengalami fase kematian pada jam ke-60. Untuk inokulum ragi komersial, fase adaptasi terjadi sampai jam ke-12 lama fermentasi, kemudian diikuti oleh fase eksponensial sampai jam ke-48. Setelah itu pola pertumbuhan biomassa memperlihatkan fase stasioner dan pada akhirnya mengalami fase kematian pada jam ke-72. Pada penelitian ini untuk jenis inokulum kultur murni Saccharomyces cerevisiae fase lag terjadi sebelum jam ke-0 fermentasi. Hal ini disebabkan karena inokulum yang diinokulasikan telah ditumbuhkan dalam media propagasi selama 24 jam sebelumnya, sehingga khamir berada pada fase ekponensial.
c. Kadar Gula Pereduksi Sisa
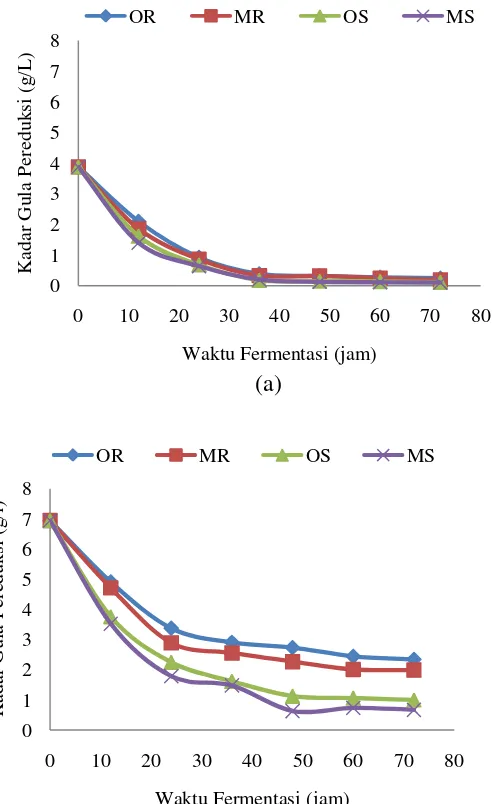
Pada proses fermentasi, sel akan mengkonversi sumber karbon menjadi biomassa dan produk. Hal ini ditandai dengan berkurangnya kadar gula yang digunakan sebagai sumber karbon. Kadar gula pereduksi akhir menunjukkan kadar gula pereduksi setelah didapatkan kadar etanol yang maksimum. Pola konsumsi substrat yaitu konsumsi kadar gula pereduksi selama fermentasi percobaan pertama disajikan pada Gambar 4 (a) untuk percobaan pertama dan (b) untuk percobaan kedua. Gula pereduksi pada percobaan pertama adalah 3.878 g/L, sedangkan untuk percobaan kedua adalah 6.950 g/L.
Hasil kadar gula pereduksi sisa yang didapat pada percobaan pertama berkisar antara 0.128 g/L sampai 0.279 g/L. Dari grafik pada Gambar 4 (a) dapat dilihat bahwa pada percobaan pertama dengan kadar gula pereduksi awal 3.878 g/L, kadar gula pereduksi akhir pada perlakuan kultur murni Saccharomyces cerevisiae lebih rendah yaitu 0.149 g/L dengan tingkat penggunaan gula 96.16% dibandingkan kadar gula pereduksi pada penggunaan inokulum ragi komersial yaitu 0.279 g/L dengan tingkat penggunaan gula 92.80%. Hal ini juga disebabkan karena kadar etanol yang dihasilkan kultur murni Saccharomyces cerevisiae juga lebih tinggi sehingga sumber karbon yang dikonsumsi juga semakin tinggi. Kadar gula pereduksi sisa dengan penambahan nutrisi juga menghasilkan kadar gula pereduksi sisa yang lebih rendah yaitu 0.245 g/L dengan tingkat penggunaan gula 93.69% daripada 0.279 g/L untuk ragi komersial roti, sedangkan untuk kultur murni Saccharomyces cerevisiae yaitu 0.128 g/L dengan tingkat penggunaan gula 96.71% dari pada 0.149 g/L.
Pada percobaan kedua dengan kadar gula pereduksi 6.950 g/L yang dapat dilihat pada Gambar 4 (b), kadar gula pereduksi akhir pada perlakuan kultur murni Saccharomyces cerevisiae lebih rendah yaitu 1.121 g/L dengan tingkat penggunaan gula 83.87% dibandingkan kadar gula pereduksi pada penggunaan inokulum ragi komersial yaitu 2.446 g/L dengan tingkat penggunaan gula 64.81%. Hal ini juga disebabkan karena kadar etanol yang dihasilkan kultur murni
14
Dapat dilihat pada percobaan pertama dan kedua bahwa semakin tinggi kadar etanol yang dihasilkan semakin tinggi tingkat penggunaan gula. Hal ini berarti substrat yang dikonsumsi juga semakin banyak untuk menghasilkan produk yaitu biomassa dan etanol.
(a)
(b)
Gambar 4 Pola konsumsi gula pereduksi selama fermentasi (a) percobaan pertama (b) percobaan kedua
Hasil Fermentasi Perlakuan MS
Setelah dilakukan dua kali percobaan, didapatkan perlakuan yang dapat menghasilkan kadar etanol yang maksimum yaitu fermentasi dengan perlakuan menggunakan kultur murni Saccharomyces cerevisiae dengan penambahan nutrisi urea. Selanjutnya dilakukan fermentasi pada percobaan ketiga secara duplo selama 72 jam dengan analisa yang dilakukan adalah kadar etanol, kadar biomassa, dan kadar gula pereduksi sisa yang dianalisa pada waktu fermentasi 0,
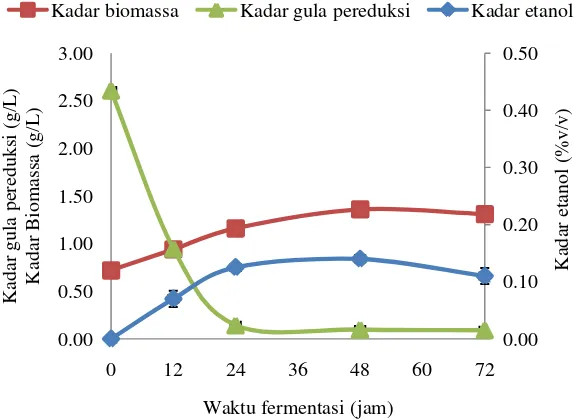
15 12, 24, 48, dan 72 jam. Hasil fermentasi yang dihasilkan pada perlakuan MS disajikan pada Gambar 8.
Gambar 5 Hasil fermentasi perlakuan MS
Gambar 8 untuk pola pembentukan biomassa menunjukkan fase adaptasi terjadi sebelum 0 jam waktu fermentasi pertama. Fase eksponensial terjadi dari jam ke-0 sampai jam ke-36. Kemudian, jam ke-36 sampai jam ke-60 merupakan fase stasioner dan mulai jam ke-60 sampai jam ke-72 dan selanjutnya terjadi fase kematian. Dari kurva pertumbuhan kultur murni Saccharomyces cerevisiae
tersebut dapat ditentukan lama fermentasi optimal yaitu 48 jam disebabkan karena lama fermentasi setelah 48 jam sudah mencapai fase kematian. Fase adaptasi terjadi sebelum jam ke-0 menunjukkan kultur telah menyesuaikan diri dalam media propagasi selama 24 jam sebelum inokulasi yang telah siapkan.
Pola kadar etanol pada Gambar 8 memperlihatkan bahwa kadar etanol yang dihasilkan meningkat selama fermentasi. Kadar etanol yang dianalisa kemudian dilakukan analisa sidik ragam yang menunjukkan bahwa waktu fermentasi berpengaruh nyata terhadap kadar etanol yang dihasilkan. Hasil uji Duncan dengan taraf kepercayaan 95% menunjukkan hasil kadar etanol yang dihasilkan antara waktu fermentasi 0, 12, 24 berbeda nyata, sedangkan waktu fermentasi 24 jam dan 48 jam mengalami kenaikan kadar etanol tetapi secara statistik tidak signifikan dan 72 jam mengalami penurunan kadar etanol tetapi secara statistik juga tidak signifikan.
Pembentukan etanol terjadi pada fase ekponensial atau berasosiasi dengan pertumbuhan (growth associated), yaitu etanol akan terbentuk seiring dengan pertumbuhan sel. Menurut Shuler dan Kargi (1992), pertumbuhan berasosiasi dengan pembentukan produk (growth associated) ini terjadi ketika laju pembentukan spesifik produk berbanding lurus dengan laju spesifik pertumbuhan. Pola pertumbuhan tersebut terjadi pada pembentukan produk metabolit primer, misalnya etanol. Pada fase eksponensial, biomassa yang dihasilkan juga meningkat yang ditandai juga dengan meningkatnya konsumsi substrat dengan sisa gula pereduksi yang semakin menurun. Hal ini mengindikasikan bahwa kondisi didalam media adalah anaerob atau sudah tidak terdapat oksigen dan
Kadar biomassa Kadar gula pereduksi Kadar etanol
16
kondisi lingkungan sudah sesuai, sehingga khamir siap melakukan fermentasi. Laju pembentukan etanol terus meningkat sampai pada jam ke-36, sedangkan laju pengunaan substrat menurun. Pada kondisi ini khamir memanfaatkan substrat untuk membentuk produk. Pada jam ke-36 sampai jam ke-48 laju pembentukan bioetanol berjalan lambat. Laju penggunaan substrat juga menurun dan dilihat tidak adanya penambahan biomassa. Hal ini diduga disebabkan karena sudah terbentuknya produk yang bisa menjadi inhibitor. Pada jam ke-48 kadar etanol yang dihasilkan adalah kadar etanol maksimum yaitu 0.14%±0(v/v). Dari pola dapat dilihat tidak ada penambahan biomassa, tidak adanya penambahan konsumsi substrat. Hal ini mengindikasikan bahwa fermentasi hanya berlangsung sampai jam ke-48. Hal ini sesuai dengan pernyataan Paturau (1981) yang menyatakan bahwa fermentasi etanol memakan waktu 30 – 72 jam.
Penurunan gula pereduksi menunjukkan penggunaan substrat oleh kultur murni Saccharomyces cerevisiae selama fermentasi. Pola penggunaan substrat selama fermentasi diperlihatkan pada Gambar 8 pada pola kadar gula pereduksi. Gambar 8 menunjukkan penurunan gula pereduksi pada hidrolisat nata de coco
selama fermentasi. Menurunnya jumlah substrat disebabkan oleh pemanfaatan hidrolisat selama fermentasi untuk pertumbuhan biomassa dan pembentukan produk (etanol). Semakin rendah gula pereduksi sisa semakin tinggi kadar etanol dan biomassa yang dihasilkan. Laju penurunan gula pereduksi oleh fermentasi etanol berlangsung sampai jam ke-48. Namun setelah jam ke-48 masih terjadi penurunan jumlah gula pereduksi dalam jumlah sedikit. Pada akhir fermentasi yaitu pada jam ke-48 masih tersisa gula pereduksi sebesar 0.098±0.008 g/L dengan tingkat penggunaan gula pada akhir fermentasi 96.24±0.32%. Dari informasi tersebut dapat dilihat bahwa masih terdapat komponen gula yang tidak dikonsumsi khamir. Hal ini disebabkan karena kandungan hidrolisat yang mengandung gula yang sulit dikonsumsi oleh khamir. Semakin sederhana gula yang terdapat dalam media fermentasi, semakin mudah gula dikonsumsi oleh khamir. Gula sederhana yang disukai oleh khamir adalah glukosa. Dari data analisa hidrolisat terlihat bahwa hidrolisat memiliki derajat polimerisasi 1.24 yang menunjukkan bahwa produk yang terbentuk tidak hanya glukosa tetapi ada gula lainnya.
Kinetika Fermentasi perlakuan MS
17 penelitian ini adalah 0.022 jam-1.Waktu pengandaan sel adalah waktu yang dibutuhkan mikroorganisme untuk memperbanyak diri dua kali jumlah semula. Hasil penelitian menunjukan waktu pengandaan sel khamir adalah 30.05 jam.
Parameter lainnya dalam kinetika fermentasi adalah nilai Yp/x, Yp/s, Yx/s yang merupakan parameter yang sangat penting dalam proses fermentasi. Yp/x adalah rendemen pembentukan produk terhadap sel. Yp/s adalah rendemen pemakaian substrat terhadap pembentukan produk. Yx/s adalah nilai rendemen pemakaian substrat untuk pembentukan sel.
Nilai – nilai yield ini berguna untuk menentukan jumlah substrat yang dibutuhkan untuk menghasilkan jumlah produk tertentu. Pertumbuhan dan pembentukan produk oleh mikroorganisme merupakan proses – proses biokonversi. Nutrient kimiawi yang diumpankan pada fermentasi dikonversi menjadi massa sel dan metabolit – metabolit. Setiap konversi dapat dikuantifikasikan oleh suatu koefisien hasil yang dinyatakan sebagai massa sel atau produk yang terbentuk per unit massa nutrien yang dikonsumsi. Informasi kinetika digunakan untuk meningkatkan efisiensi fermentasi. Hasil penelitian ini menghasilkan nilai Yp/x = 2.260±0.205 g produk/gram biomassa, Yp/s = 0.402±0.024 gram produk/gram substrat, Yx/s = 0.179±0.027 gram biomassa/gram substrat.
Fermentasi etanol terjadi pada kondisi anaerob dengan menggunakan khamir tertentu yang dapat mengubah glukosa menjadi etanol melalui tahap glukolisis (Embden-Meyerhof-Parnas Pathway). Secara teoritis, satu molekul gula diubah menjadi 2 molekul etanol dan 2 molekul CO2. Hal ini sesuai dengan persamaan berikut (Judoamidjojo 1990)
C6H12O6 2 C2H5OH + 2 CO2
(gula) (etanol) (karbondioksida)
Dari persamaan di atas dapat dijelaskan bahwa 51.1% gula diubah menjadi etanol dan 48.9% diubah menjadi karbondioksida. Akan tetapi hasil ini kebanyakan tidak dapat dicapai karena adanya hasil sampingan (Kunkee dan Amerine 1970). Pada penelitian ini digunakan substrat dengan kandungan gula pereduksi awal 2.6 g/L. Etanol yang dihasilkan adalah 0.14%±0(v/v) atau 1.11g/L, artinya sebanyak 44.09 % substrat diubah menjadi etanol, sisanya diubah menjadi karbondioksida dan produk samping. Produk samping yang dapat dihasilkan adalah asam – asam organik seperti asam laktat, asam piruvat, dan asam asetat.
Analisis Kelayakan Finansial
Analisis kelayakan finansial pengolahan bioetanol ini bertujuan untuk mengetahui atau mengestimasi penerimaan dan pengeluaran dari suatu proses produksi. Hal tersebut dijadikan sumber informasi mengenai kelayakan ekonomi suatu proses produksi yang ingin dijalankan. Analisis kelayakan finansial dihitung dari arus manfaat dan arus biaya.
a. Arus manfaat (Inflow)
18
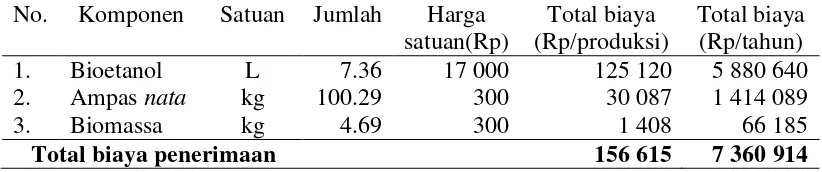
pengolahan bioetanol ini, manfaat yang diperoleh diasumsikan melalui hasil penjualan bioetanol, ampas nata, dan biomassa. Nilai penjualan diperoleh dari volume penjualan (kuantitas) dikalikan dengan harga jual. Total penerimaan penjualan sebesar Rp. 156 615.2 untuk satu kali produksi, sedangkan untuk pertahunnya dengan asumsi 47 kali produksi penerimaan yang dihasilkan sebesar 7 360 914.4. Adapun rincian biaya penerimaan disajikan pada Tabel 5.
Tabel 5 Rincian penerimaan
Arus biaya (outflow) merupakan pengeluaran-pengeluaran yang akan terjadi selama usaha berlangsung. Biaya terdiri dari biaya investasi dan biaya operasional. Sebelum dihitung biaya – biaya yang akan dikeluarkan, digunakan beberapa asumsi.
1. Asumsi perhitungan
Dalam perhitungan analisis finansial bioetanol limbah padat nata de coco
digunakan beberapa asumsi. Dalam satu kali proses produksi bioetanol dengan bahan baku limbah padat nata de coco sebanyak 1 ton menghasilkan hidrolisat sebanyak 2000 liter dengan kadar gula pereduksi 6.95 g/L. Tingkat penggunaan gula sebesar 90.98%. Yield yang digunakan adalah 0.46 g etanol/g substrat gula. Dalam satu kali produksi dihasilkan 7.36 liter bioetanol 90%. Hasil tersebut dijual dengan harga Rp.17 000/liter. Produksi dilakukan sebanyak 47 kali dalam satu tahun.
2. Biaya investasi
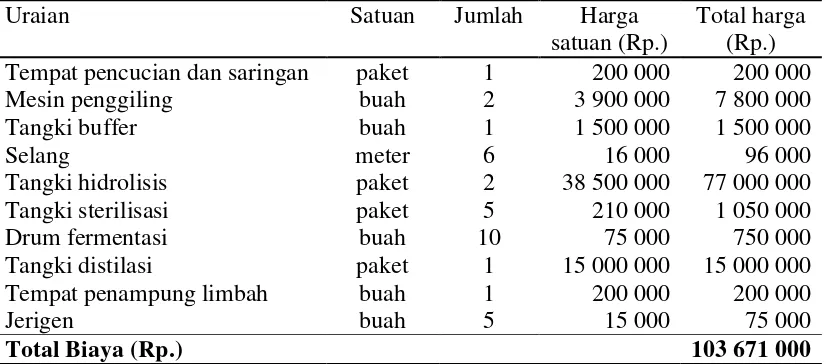
Biaya investasi merupakan modal awal yang diperlukan atau dikeluarkan pada awal umur usaha secara keseluruhan. Biaya investasi dalam proses produksi bioetanol ini adalah instalasi air dan listrik dan biaya pengadaan mesin dan peralatan untuk produksi bioetanol. Rincian biaya mesin dan peralatan disajikan pada Tabel 7. Total investasi yang diperlukan sebesar Rp. 107 181 000. Rincian biaya investasi disajikan pada Tabel 6.
Tabel 6 Komponen biaya investasi
Uraian Satuan Jumlah Harga
19 Tabel 7 Rincian biaya mesin dan peralatan
Uraian Satuan Jumlah Harga
Biaya operasional merupakan keseluruhan biaya yang berhubungan dengan kegiatan operasional (produksi) dari usaha bioetanol. Biaya ini terbagi menjadi dua, yaitu biaya tetap dan biaya variabel.
Biaya tetap merupakan biaya yang jumlahnya tetap dalam kisaran volume kegiatan tertentu pada usaha bioetanol. Dalam hal ini yang tergolong dalam biaya tetap adalah biaya tenaga kerja. Tenaga kerja yang dibutuhkan per produksi adalah 3 orang dengan gaji Rp. 80 000 perorang, sehingga jumlah biaya tetap yang dikeluarkan adalah Rp. 240 000 dalam satu kali proses produksi dan Rp. 11 280 000 dalam setahun.
Biaya variabel adalah biaya yang dikeluarkan dimana besar biaya tersebut sangat tergantung dari jumlah produk yang dihasilkan.
Tabel 8 Rincian biaya variabel operasional
Uraian Satuan Jumlah Harga
20
per tahun adalah Rp. 5 549 445. Rincian biaya variabel usaha bioetanol limbah padat nata de coco disajikan pada Tabel 8.
Keseluruhan biaya operasional yang dikeluarkan dalam satu kali proses produksi bioetanol sebesar Rp. 358 073, sedangkan dalam satu tahun sebesar Rp.16 829 445 yang dihitung dari jumlah biaya tetap dan biaya variabel dalam biaya operasional.
A. Keuntungan
Perhitungan keuntungan diketahui dengan menggunakan analisis Revenue Cost Ratio (R-C ratio). Nilai R-C ratio = 1 artinya usaha tidak untung/rugi, nilai R-C ratio > 1 berarti usaha menguntungkan/efisien, nilai R-C ratio < 1 berarti usaha merugikan/tidak efisien. R-C ratio dihitung dengan rumus sebagai berikut:
R-C ratio = Penerimaan
Biaya produksi
Adapun hasil keuntungan dan R-C ratio disajikan pada Tabel 10. Tabel 9 Hasil keuntungan dan R-C ratio
Variabel Nilai/produksi (Rp.) Nilai/tahun (Rp.)
Penerimaan 156 615 7 360 914
Biaya produksi 508 073 26 552 865
Keuntungan -201 458 -9 468 532
R-C ratio 0.43 0.43
Efisiensi pengolahan bioetanol secara finansial ditentukan dengan menghitung revenue per cost yaitu pembagian antara penerimaan dibagi dengan biaya produksi. Jumlah penerimaan diperoleh dari jumlah produksi dikalikan dengan harga jualnya, sedangkan biaya produksi adalah biaya tidak tetap (biaya variabel) yang dikeluarkan dalam proses produksi etanol. Selisih antara penerimaan dan biaya merupakan keuntungan usaha. R-C ratio merupakan perhitungan untuk melihat keefisienan produksi etanol. Suatu pengolahan dikatakan efisien apabila R-C ratio lebih besar dari satu (R – C > 1). Tetapi dalam perhitungan, nilai R-C ratio yang diperoleh sebesar 0.43. Ini berarti bahwa setiap pengeluaran dalam proses pengolahan sebesar satu rupiah diperoleh penerimaan sebesar 0.31 rupiah. Hal ini menunjukkan bahwa penerimaan yang diperoleh tidak sebanding dengan pengeluaran atau lebih kecil sehingga menurut perhitungan analisis R-C rasio tidak efisien karena mengalami kerugian.
21 dalam memanfaatkan limbah. Keuntungan yang dapat dihasilkan dari usaha bioetanol ini adalah terciptanya kesempatan atau lapangan pekerjaan bagi masyarakat sekitar sehingga dapat meningkatkan kualitas hidup masyarakat.
SIMPULAN DAN SARAN
Simpulan
Limbah padat nata de coco yang mengandung selulosa dapat dikonversi menjadi bioetanol yang sebelumnya harus dihidrolisis menggunakan enzim selulase untuk mengubah selulosa menjadi gula sederhana. Fermentasi dilakukan dengan dua kali percobaan dengan kadar gula pereduksi yang berbeda yaitu 3.88 g/L untuk percobaan pertama dan 6.95 g/L untuk percobaan kedua. Hasil fermentasi menunjukkan penggunaan jenis inokulum kultur murni Saccharomyces cerevisiae menghasilkan kadar etanol yang lebih tinggi, yaitu 0.19(v/v)% pada percobaan pertama dan 0.33%(v/v) untuk percobaan kedua dibandingkan dengan 0.12(v/v)% untuk percobaan pertama dan 0.20%(v/v) untuk percobaan kedua pada penggunaan jenis inokulum ragi roti komersial. Penambahan urea sebesar 2.9 g/L meningkatkan kadar etanol dari 0.12(v/v)% menjadi 0.15(v/v)% untuk percobaan pertama dan 0.20%(v/v) menjadi 0.25%(v/v) untuk percobaan kedua pada penggunaan jenis inokulum ragi roti komersial dan dari 0.19(v/v)% menjadi 0.22(v/v)% untuk percobaan pertama dan 0.33%(v/v) menjadi 0.37%(v/v) untuk percobaan kedua pada penggunaan jenis inokulum kultur murni Saccharomyces cerevisiae.
Waktu optimum fermentasi menggunakan kultur murni Saccharomyces cerevisiae adalah 48 jam dengan tingkat penggunaan gula 96% dan 97% pada percobaan pertama serta untuk percobaan kedua adalah 83% dan 91%, sedangkan waktu optimum fermentasi menggunakan ragi roti adalah 60 jam dengan tingkat penggunaan gula 93% dan 94% untuk percobaan pertama dan untuk percobaan kedua 65% dan 68%. Untuk perhitungan kelayakan secara finansial, produksi mengalami kerugian sebesar Rp. 201 458, sedangkan melalui analisis penerimaan per biaya didapatkan hasil R-C ratio < 1 yaitu 0.43 yang bearti produksi tidak menguntungkan.
Saran
22
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemistry. 1984. Official method of analysis of The association of official analytical chemistry. Washington DS (US) : AOAC International.
[AOAC] Association of Official Analytical Chemistry. 1995. Official method of analysis of The association of official analytical chemistry. Washington DS (US): AOAC International.
Buckle KA, Edwards RA, Fleet H, Wooton M. 1985. Ilmu Pangan. Purnomo dan Adiono, penerjemah. Jakarta (ID): UI Press.
Crueger W, Anneliese C. 1984. Biotechnology A Textbook of Industrial Microbiology. Madison (US): Svience Tech, Inc.
Darwis AA, Sailah I, Irawadi TT, dan Safriani. 1995. Kajian kondisi fermentasi produksi selulase dari limbah kelapa sawit (tandan kosong dan sabut) oleh
Neurospora sitophila. J Teknol. Ind. Pert:5(3): 199-207.
Derosya V. 2010. Sakarifikasi empulur sagu (Metroxylon sagu) dengan konsorsium enzim amilolitik dan holoselulolitik untuk produksi bioetanol [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ditjen MIGAS. 2012 Statistik minyak bumi [internet]. [diacu 2014 Juni 21]
Hambali E, Mujdalipah S, Tambunan AH, Pattiwiri AW, dan Hendroko R. 2007.
Teknologi Bioenergi. Jakarta (ID): Agromedia Pustaka.
Harrison JS dan Graham JCJ. 1970. Yeast in Distilery Practice. London: Academic Press.
Haryani S. 2008. Produksi bioetanol dari sirup glukosa ubi jalar (Ipomoea batatas L.) menggunakan Saccharomyces cerevisiae [skripsi]. Bogor (ID): Institut Pertanian Bogor.
[JICA]. Japan International Coorperation Agency. 1978. Methods of Soil Chemcial Analysisdokumen BARISTAN INDAG. Bogor: JICA.
Judoamidjojo RM. 1990. Teknologi Fermentasi. Bogor (ID): Pusat Antar Universitas Bioteknologi.
Mayasti Nur KI. 2009. Analisis kelayakan pasar, teknis dan finansial produksi
Nata De Cassava dari hasil samping industri pati tapioka, pundong bantul [skripsi]. Yogyakarta (ID): Universitas Gadjah Mada.
Miller GI. 1959. The use of dinitrosalicylic acid reagent for determination of reducing sugar. J Anal. Chem: 31(3) : 426 – 428.
Palmer TJ. 1970. Acid and Enzyme Hydrolysis of Starch. London (GB): Publishing Company Limited.
23 Pons A, Dussap CG, Gross JB. 1990. Xanthan bath fermentation: compared performance of A bubble coloumn and A stirred tank fermentor. Bioprocess Eng 5: 107 – 114.
Rehm HJ dan Reed G. 1981. Biotechnology Vol. I : Microbial Fundamental. Weiheim: Verlag Chemie Gmbh.
Ratledge C. 1991. Yeast physiology–a micro–synopsis. Bioprocess Engineering:6: 195 – 2013.
Shuler ML dan Kargi KF. 1992. Bioprocess Engineering Basic Concepts. New Jersey (US): Prentice Hall.
Stanbury PF dan Whitaker A. 1993. Principles of Fermentation Technology. New York (US): Pergamon Press.
Sutarto I. 2009. Challenges of biofuel industryr in indonesian. Naskah Seminar Nasional pada Dies Natalis Fakultas Teknologi Pertanian IPB, 16 Oktober 2009, Bogor.
Suyandra ID. 2007. Pemanfaatan hidrolisat pati sagu (Metroxylon sp.) sebagai sumber karbon pada fermentasi etanol oleh Saccharomyces cerevisae
[skripsi].Bogor (ID): Institut Pertanian Bogor.
Taherzadeh MJ dan Karimi K. 2007. Acid-Based Hydrolysis Processes for Ethanol From Lignocellulosic Material: A review, J Biores 2: 472-499. Tjokroadikoesoemo S. 1986. HFS dan Industri Ubi Kayu Lainnya. Jakarta:
Gramedia Pustaka Utama.
Wang NS, Cooney CL, Demain AL, Dunnil P, Humphrey AE, Lolly MD. 1979.
Fermentation and Enzyme Technology. New York (US): John Wiley & Sons.
LAMPIRAN
Lampiran 1 Prosedur analisa total gula, gula pereduksi, dan pH
1. Penetapan Total Gula Metode Fenol H2SO4 (Dubois et al. 1956)
24
Gambar 6 Kurva standar fenol sulfat 2. Penetapan Total Gula Pereduksi Metode DNS (Miller 1959)
Prinsip uji suasana alkali gula pereduksi akan mereduksi asam 3,5 – dinitrosolisilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
Tahapan prosesnya terdiri dari penyiapan pereaski DNS, penentuan kurva standar, dan penetapan total gula pereduksi. Pereaksi DNS dibuat dengan melarutkan 10,6 g asam 3,5 dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air. Setelah itu, ditambahkan 306 g Na – K Tartarat, 7,6 g fenol yang dicairkan pada suhu 50 oC, dan 8,3 g Na – Metebisulfit. Larutan ini diaduk rata. Kemudian, sebanyak 3 ml larutan ini dititrasi dengan HCL 0,1 N dengan indikator fenolftalein. Banyaknya titran berkisar 5 – 6 ml. Jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap ml kekurangan HCL 0,1 N.
Gambar 7 Kurva standar gula pereduksi metode DNS
Penentuan kurva standar dibuat dengan mengukur untuk mengetahui nilai gula pereduksi pada glukosa pada selang 0,2 – 0,5 mg/l. Kemudian nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam
25 grafik secara linier. Kurva standar gula pereduksi metode DNS disajikan pada Gambar 7 dibawah ini.
Pengujian gula pereduksi menggunakan kurva standar DNS adalah sebagai berikut : 1 ml sampel dimasukkan ke dalam tabung reaksi. Kemudian, ditambahkan 3 ml pereaksi DNS. Larutan tersebut ditempatkan dalam air mendidih selama 5 menit. Biarkan sampai dingin pada suhu ruang. Selanjutnya, diukur absorbansinya pada panjang gelombang 550 nm.
3. pH
Pengukuran pH dilakukan menggunakan alat pH meter. Lampiran 2 Prosedur karakterisai limbah padat nata de coco
1. Kadar Air (AOAC 1995)
Cawan alumunium yang telah dikeringkan dan diketahui bobotnya, diisi sebanyak 2-3 gram sampel lalu ditimbang (W1) kemudian dimasukkan kedalam oven suhu 105oC selama 1-2 jam. Cawan alumunium dan sampel yang telah dikeringkan dimasukkan ke dalam desikator kemudian ditimbang. Ulangi pemanasan sampai dihasilkan bobot konstan (W2). Sisa contoh dihitung sebagai total padatan dan air yang hilang sebagai kadar air.
Kadar air (%) = (�1−�2) Dalam keadaan panas disaring dengan kertas Whatman No.40 setelah diketahui bobot keringnya. Kertas saring yang digunakan dicuci berturut-turut dengan air panas, 25 ml H2SO4 dan etanol 95%. Kemudian dikeringkan di dalam oven bersuhu 100-110°C sampai bobotnya konstan. Kertas saring didinginkan dalam desikator dan ditimbang.
Kadar serat kasar (%) = bobot endapan kering (g)
bobot contoh (g) � 100%
3. Kadar Nitrogen dengan metode Kjedahl
Sebanyak 0.25 gam sampel dimasukkan ke dalam labu kjedahl dan ditambahkan 2.5 ml H2SO4 pekat dan 1 g katalis. Larutan tersebut kemudian didestruksi hingga jernih. Selanjutnya ditambahkan NaOH 40% ke dalam larutan dekstruksi dingin sebanyak 15 ml. Disipakan pula larutan penampung di dalam erlenmeyer 250 ml yang terdiri dari 19 ml H3BO3 4% dan indikator mensel 2-3 tetes. Setelah itu larutan sampel dimasukkan ke dalam labu destilasi. Destilasi dihentikan apabila tidak ada lagi terbentuk gelembung-gelembung yang keluar pada larutan penampung. Hasil destilasi kemudian dititrasi dengan H2SO4 0.02 N.
26
% kadar protein = %total x faktor konversi 4. Kandungan kabon (JICA 1978)
Perhitungan kadar karbon didefinisikan sebagai kadar abu dalam bahan. Penentuan kadar abu berdasar pada prinsip sisa mineral hasil pembakaran bahan organik pada suhu 550oC. Cawan porselen dikeringkan terlebih dahulu di dalam oven pada suhu 105oC selama 1 jam, kemudian didinginkan selama 30 menit didalam desikator dan ditimbang hingga diperoleh berat konstan (A). Lalu ditimbang contoh sebanyak 2 gam (B), dan dimasukkan ke dalam cawan porselin dan dipijarkan menggunakan pembakar Bunsen sampai tidak membentuk asap lagi. Kemudian dimasukkan ke dalam tanur listrik (furnace) pada suhu 550oC selama ± 12 jam. Selanjutnya cawan didinginkan selama 30 menit pada desikator, dan ditimbang hingga didapatkan berat konstan (C).
Kadar abu (%) = × 100%
Kadar C (%) = 100%−kadarair100% −kadarabu % −Kadarnitrogen (%) 1,82
5. Kadar Karbohidrat (by different)
Kadar karbohidrat total ditentukan dengan metode carbohydrate by difference yaitu :100% - (kadar air + abu + protein +lemak). Kadar karbohidrat N-free menunjukkan kandungan karbohidrat yang dapat dicerna dari suatu bahan pangan.Ditentukan dengan cara 100% - (kadar air+abu+protein+lemak+serat kasar).
Lampiran 3 Perhitungan rasio C/N media Rasio C/N media = 226.56
Rasio C/N media seharusnya 10 (Syamsu et al dalam Haryani 2008)
Tabel 3 Penghitungan kebutuhan urea (gram) dalam 100 ml substrat
Parameter Jumlah
Total C 1.45
Total N 0.0064
Total N yang dibutuhkan 10% x 1.45 = 0.145 Kekurangan N 0.145 – 0.0064 = 0.139 Urea yang ditambahkan 60
28 � 0.139 = 0.29 gram urea
27 Lampiran 4 Prosedur pengukuran aktivitas enzim (Derosya 2010)
Substrat CMC dibuat menjadi larutan 0.5% dalam buffer fosfat sitrat pada pH yang akan diujikan. Enzim juga diencerkan dengan buffer fosfat sitrat pada pH yang akan diujikan. Larutan substrat dan enzim kemudian dicampurkan dan diinkubasi pada suhu yang akan diujikan selama 30 menit. Tiap 10 menit, larutan dipipet sebanyak 2 ml kemudian ditambahkan pelarut DNS (dinitrosalisilat) sebanyak 6 ml untuk diukur gula pereduksi yang terbentuk. Sebagai kontrol, larutan substrat dan enzim pada waktu ke-0 juga diukur gula pereduksinya. Aktivitas enzim diperoleh dengan rumus berikut.
Aktivitas enzim(IU/ml)
=[(kadar gula sampel−kadar gula kontrol )µg /ml x 1000 x pengenceran
waktu x BM monosakarida
Lampiran 5 Prosedur perhitungan DE dan DP 1. Ekuivalen Dekstrosa (DE)
Ekuivalen dekstrosa diperoleh dengan membagi nilai gula pereduksi sampel dengan kadar gula total.
Ekuivalen Dekstrosa (DE) = Kadargula pereduksisampel
Kadargulatotal x100% 2. Derajat Polimerisasi (DP)
Derajat polimerisasi (DP) yaitu jumlah unit monomer dalam suatu polimer. Derajat polimerisasi diperoleh dengan membagi nilai total gula (fenol sulfat) dengan nilai pereduksi sampel.
Derajat Polimerisasi (DP) = kadargulatotal (fenolsulfat) kadargulapereduksi
Lampiran 6 Prosedur pengujian biomassa dan etanol 1. Prosedur pengukuran biomassa (Bosh et al 1986)
Sebanyak 1 ml sampel di sentrifuse dengan kecepatan 4000 rpm selama 30 menit. Selanjutnya sampel dikeringkan menggunakan oven pada suhu 50oC selama 24 jam. Sebelum ditimbang, biomassa disimpan terlebih dahulu di dalam desikator selama 1 jam.
Bobot sel kering (g/l) = bobotbiomassakering mlsampel x 1000
2. Prosedur pengukuran kadar etanol metode specific gravity (AOAC 1995) Sebanyak 25 ml contoh dimasukkan ke dalam labu distilasi sambil diukur suhunya, kemudian ditambahkan akuades dengan volume yang sama. Distilasi dihentikan setelah diperoleh distilat ±23 ml dan diatur suhunya agar sama dengan suhu pada saat pemipetan. Destilat tersebut kemudian dimasukkan ke dalam piknometer 25 ml yang telah diketahui bobotnya (P), selanjutnya ditepatkan hingga tanda tera dengan menambahkan akuades dan ditutup. Dinding piknometer dikeringkan kemudian ditimbang (D).
28
tabel hubungan antara bobot jenis dengan kadar etanol pada berbagai suhu. Rumus perhitungan bobot jenis adalah sebagai berikut.
Bobot jenis destilat = D−P W−P
Lampiran 7 Perhitungan parameter fermentasi
Rendemen etanol untuk setiap penggunaan substrat hidrolisat (yield) dihitung sebagai rasio antara konsentrasi etanol pada akhir fermentasi (Pf) terhadap selisih konsentrasi total gula awal (So) dan konsentrasi total gula akhir (Sf). Formula dari rendemen etanol adalah sebagai berikut.
Yield = So−�
Persen tingkat penggunaan gula nata de coco (%) dihitung sebagai rasio selisih kadar total gula awal (So) dan kadar total gula akhir (Sf) terhadap kadar total gula awal (So). Formula dari persen konversi adalah sebagai berikut.
Tingkat penggunaan gula (%) = So−�
So x100%
Lampiran 8 Data hasil fermentasi semua perlakuan 1. Kadar etanol (%v/v)
Tabel 11 Hasil uji kadar etanol percobaan pertama Faktor
Tabel 12 Hasil uji kadar etanol percobaan kedua Faktor
29
Tabel 14 Hasil uji kadar biomassa percobaan kedua Faktor
pengamatan
Pengamatan jam ke-
0 12 24 36 48 60 72
OR 0.533 0.787 0.987 1.140 1.333 1.500 1.367 MR 0.513 1.040 1.260 1.592 1.620 1.765 1.627 OS 0.613 1.140 1.647 1.820 2.033 1.934 1.876 MS 0.620 1.320 1.780 2.187 2.347 2.220 1.987 3. Kadar gula pereduksi (g/L)
Tabel 15 Hasil uji kadar gula pereduksi percobaan pertama Faktor
pengamatan
Pengamatan jam ke-
0 12 24 36 48 60 72
OR 3.878 2.100 0.925 0.384 0.319 0.279 0.244
MR 3.878 1.860 0.860 0.332 0.319 0.245 0.189
OS 3.878 1.620 0.683 0.179 0.149 0.139 0.117
MS 3.878 1.405 0.640 0.199 0.128 0.111 0.103
Tabel 15 Hasil uji kadar gula pereduksi percobaan kedua Faktor
pengamatan
Pengamatan jam ke-
0 12 24 36 48 60 72
OR 6.950 4.913 3.372 2.905 2.730 2.446 2.344
MR 6.950 4.713 2.891 2.553 2.266 2.006 1.987
OS 6.950 3.761 2.242 1.615 1.221 1.057 0.999
MS 6.950 3.525 1.786 1.478 0.627 0.734 0.667
Lampiran 9 Data hasil fermentasi perlakuan MS (kultur murni saccharmyces cerevisiae + nutrisi)
Tabel 16 Hasil uji kadar etanol (%v/v) perlakuan MS Faktor
pengamatan
Pengamatan jam ke-
0 12 24 48 72
MS_1 0 0.06 0.12 0.14 0.1
MS_2 0 0.08 0.13 0.14 0.12
Rata-rata 0 0.07 0.125 0.14 0.11
30
Tabel 17 Hasil uji kadar gula pereduksi (g/L) perlakuan MS Faktor
Tabel 18 Hasil uji kadar biomassa (g/L) perlakuan MS Faktor
Lampiran 10 Hasil uji statistik hubungan waktu dan kadar etanol perlakuan MS Tabel 19 Hasil analisis Anova Faktor Tunggal
Perlakuan
(jam) Ulangan Jumlah Rata-rata Varian
0 2 0 0 0
12 2 0.14 0.07 0.0002
24 2 0.35 0.125 0.00005
48 2 0.28 0.14 0
72 2 0.22 0.11 0.0002
Tabel 20 Hasil uji statistik hubungan waktu dan kadar etanol Sumber Waktu fermentasi 0.02524 4 0.00631 70.11111 5.192168
Error 0.000445 5 0.00009
Total 0.02569 9
Keterangan : F hitung > F tabel pada taraf 0.05
Waktu fermentasi yang diuji berbeda signifikan terhadap respon yang diamati yaitu kadar etanol. Kemudian dilanjutkan ke uji Duncan
p 2 3 4 5
31
Tabel 21 Hasil uji lanjut duncan
Rata-rata 0 jam 12 jam 24 jam 48 jam 72 jam RP antar perlakuan. Maka dapat dinyatakan bahwa :
0 jam – 12 jam berbeda
12 jam – 24 jam berbeda nyata 24 jam – 48 jam tidak berbeda nyata 48 jam – 72 jam tidak berbeda nyata
Lampiran 11 Hasil perhitungan kinetika fermentasi perlakuan MS