SINTESIS HIDROKSIAPATIT DAN SCAFFOLD
β
-TRIKALSIUM
FOSFAT DARI CANGKANG KERANG DARAH (Anadara
granosa) DENGAN MATRIKS ALGINAT
ELI AISAH SUGIARTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Sintesis Hidroksiapatit dan Scaffold β-Trikalsium Fosfat dari Cangkang Kerang Darah
(Anadara granosa) dengan Matriks Alginat adalah benar karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
Eli Aisah Sugiarti
RINGKASAN
ELI AISAH SUGIARTI. Sintesis Hidroksiapatit dan Scaffoldβ-Trikalsium Fosfat
dari Cangkang Kerang Darah (Anadara granosa) dengan Matriks Alginat.
Dibimbing oleh KIAGUS DAHLAN dan MERSI KURNIATI.
Sintesis hidroksiapatit (HA) dari cangkang kerang darah (Anadara granosa)
telah berhasil dibuat dengan metode wise drop (presipitasi). Ukuran kristal HA
berkisar 25.84 nm sampai dengan 47.98 nm. Fraksi volume diperoleh sebesar 87.9%. Parameter kisi HA memiliki struktur heksagonal dengan a = b = 9.432 Å dan c = 6.881 Å. Derajat kristalinitas diperoleh sebesar 85.1 %.
Melalui proses presipitasi wise dropjuga telah berhasil dibuat β-Trikalcium
Phosphate (β-TCP) antara kalsium oksida dari cangkang kerang dan H3PO4
dengan jumlah fraksi volume berkisar 87.4%. Fasa lain yang teridentifikasi adalah
β- calcium diphosphate 12.6%,. Ukuran rata-rata kristalin serbuk β-TCP berkisar
antara 4.6 nm sampai 13.9 nm dengan derajat kristalinitas sebesar 88.2 %. Gugus fungsi yang terdapat dalam serbuk β-TCP adalah PO4 3- , P2O74-.
Metode freeze-drying digunakan untuk mensintesis perancah β-TCP /alginat
dengan ukuran pori yang ideal. Fasa dalam perancah β -TCP/alginat tetap terdiri dari fasa serbuk β -TCP pada gugus PO4 3- , P2O7 4- dan alginat yang dicirikan
oleh gugus COO-. Penggunaan crosslink agent CaCl2 menyebabkan adanya
substitusi Ca ke dalam Na pada gugus COO-. Setelah digabungkan menjadi komposit gugus fungsi yang terdeteksi merupakan gabungan antara gugus fungsi dalam serbuk β-TCP dan alginat yaitu PO4 3- , P2O74- , COO- , dan OH-. Hasil μ
-CT scan dan SEM diketahui bahwa scaffoldβ -TCP /Alginat –TKA 82, TKA-73,
dan TKA-64 masingmasing memiliki ukuran pori rata-rata sebesar 62.38 μm, 155.83 μm dan 132.89 μm dengan porositas sebesar 57.28%, 67.29%, dan 66.7%. Ukuran pori dari seluruh scaffoldβ -TCP /Alginat yang disintesis dalam penelitian
ini tidak seragam dan sampel TKA-73 memiliki distribusi ukuran pori yang paling seragam dibandingkan lainnya.
SUMMARY
ELI AISAH SUGIARTI. Synthesis Hydroxyapatite and Scaffold β-Tricalsium Phosfate from Blood Cokle (Anadara granosa) with Alginate Matrics. Supervised
by KIAGUS DAHLAN and MERSI KURNIATI.
The hydroxyapatite (HA) has been synthesized by using the blood cokle waste through the wise drop method (precipitation) at volume fraction of 87.9%. HA crystal size ranging from 25.84 nm to 47.98 nm. The volume fraction of 87.9% was obtained. HA lattice parameter has a hexagonal structure with a = b = 9432 Å and c = 6,881 Å. The degree of crystallinity obtained for 85.1%.
The calcium oxide and H3PO4were synthesized as β-Tricalcium Phosphate
(β-TCP) powder with presipitation method at volume fraction of 87.4%. The other phase was β-Ca2P2O7 which was formed by imperfect transformation of
calcium during heating process. The crystal size of β-TCP powder are ranging 4.6 nm to 13.9 nm and its crystallinity is 88.2 %. The functional groups in the β-TCP powder is PO43- , P2O74- , and adsorbed water
The freeze-drying method was used to synthesize the ideal pore size of β -TCP /alginate scaffold. The β-TCP /alginate scaffold was composed by phase of β-TCP powder and alginate and characterized by COO-. The addition of CaCl2 as
cross-linking agent formed the calcium ion. It was substituted into COO- and replace the sodium ion. The scanning result μ-CT scan and SEM, showed that the average pore size of TKA -82,TKA -73 and TKA-64 were 62.38 μm, 155.83 μm dan 132.89 μm dengan porositas sebesar 57.28%, 67.29%, dan 66.7%. The pore size of all β-TCP/alginate scaffold are not uniform, however TKA-73 is the most homogeneous.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apapun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biofisika
SINTESIS HIDROKSIAPATIT DAN SCAFFOLD
β
-TRIKALSIUM
FOSFAT DARI CANGKANG KERANG DARAH (Anadara
granosa) DENGAN MATRIKS ALGINAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
@'@4D )>/>D /9?)>/>D /'<:2>/";"?/?D'"9D </2"4>/@7D:>*"?D '"</D
"7"D D
"9,2"9,D)<"9,D"<".D ')9,"9D"?=/2>D5,/9"?D D 4/D/>".D@,/$<?/D
/>)?A1@/D :5).D
:7/>/D)7%/7%/9,D
)?A"D
)?A"D<:-$7D?@(/D ">&">"0"9"D /:+>/3D
<D)<>/DB"?/D/D
"9,,"4D!1/"9 CD
<D)<>/D /D
9,,:?"D
/2)?#.@/D :4).D
"9,,"5D@4@>D
PRAKATA
Puji dan syukur kehadirat Allah Subhanahu wata’alla atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2014 ini adalah Sintesis Hidroksiapatit dan Scaffold β-Trikalsium Fosfat dari Cangkang Kerang Darah
(Anadara granosa) dengan Matriks Alginat.
Terima kasih tak terhingga penulis ucapkan kepada:
1. Bapak Dr. Kiagus Dahlan, Ibu Dr. Mersi Kurniati, dan Bapak Dr. Jajang Juansah selaku dosen pembimbing penelitian penulis, yang telah meluangkan waktunya membimbing dan memberikan saran yang terbaik untuk penulis.
2. Bapak Dr. Akhiruddin Maddu selaku Ketua Departemen Fisika FMIPA IPB yang telah memberikan pelayanan akademik.
3. Dr. Setyanto Tri Wahyudi, M.Si, selaku dosen penguji terima kasih sudah bersedia memberikan kritik dan saran untuk penulis.
4. Dr. Oman Zuas selaku Peneliti LIPI Kimia Serpong yang telah membantu dalam proses preparasi bahan.
5. Rekan Biomaterial : Fitri Afriani, Jayanti Dwi Hamdilla, Marliani, Liza, dan Nuraisyah yang telah bekerjasama dan membantu selama penelitian. 6. Rekan mahasiswa Biofisika 2013 : Nurma, Nina, Johan, Ade, Yeni serta
rekan yang telah memberikan semangat selama penelitian.
7. Bapak H.P.A. Sopandy, M.Pd selaku Kepala Sekolah SMAN 3 Tangerang Selatan yang telah banyak mengizinkan penulis untuk menyelesaikan kuliah dan penelitian.
8. Keluarga Masaruddin Saga : Ghifar, Aqiila, Filzah dan Tsabita untuk kerelaan waktunya.
DAFTAR ISI
Karakteristik β-Trikalsium Fosfat 15
DAFTAR TABEL
1 Kandungan mineral kerang darah 6
2 Kandungan CaO dan senyawa lain pada cangkang kerang darah 6
3 Jenis-jenis senyawa kalsium fosfat 8
4 Ukuran pori dan porositas komposit β-TCP/alginat 19
DAFTAR GAMBAR
1 Kerang darah (Anadara granosa) 5
2 Bagian lapisan cangkang kerang darah 6
3 Kalsinasi beberapa cangkang kerang 7
4 Pola hasil karakterisasi XRD CaO kerang darah 13 5 Pola difraksi hidroksiapatit cangkang kerang darah 15
6 Pola XRD untuk sampel β-TCP 16
7 Spektrum FTIR β-TCP 17
8 Pola difraksi XRD matriks Na-alginat 17
9 Spektrum FTIR hasil identifikasi gugus fungsi matriks Na-alginat 18 10 Pola difraksi XRD komposit β-TCP/alginat: (A) komposisi TKA 60/40
(B) komposisi TKA 70/30 (C) komposisi TKA 80/20 19 11 Karakterisasi scaffoldβ-TCP/alginat perbandingan: (A) 60/40 (B) 70/30
(C) 80/20 20
12 Struktur morfologi β-TCP/alginat dengan perbandingan: (a) 60/40
(b) 70/30 (c) 80/20 21
DAFTAR LAMPIRAN
1 Data Joint Commite on Powder Diffraction Standards (JCPDS) CaO dan Ca(OH)2 25
2 Data Joint Commite on Powder Diffraction Standards (JCPDS) Hidroksiapatit 26 3 Data Joint Commite on Powder Diffraction Standards (JCPDS) β-TCP 27
PENDAHULUAN
Latar Belakang
Perkembangan biomaterial pengganti tulang sudah sangat berkembang pesat seiring dengan kebutuhan implan tulang yang juga meningkat dikarenakan beberapa faktor pemicunya, diantaranya karena angka kecelakaan yang menyebabkan kecacatan pada tulang dan memerlukan rekonstruksi dan
remodeling tulang. Pada dasarnya, sel-sel tulang memiliki kemampuan
remodelling sendiri, namun membutuhkan waktu yang cukup lama. Proses
remodelling tulang tersebut dapat dipercepat melalui metode bone graft seperti
yang telah dilakukan oleh Nystrom Elizabeth dengan tingkat keberhasilan implan mencapai 74.6% pada tulang panggul (Nystorm 2009). Bone graft merupakan
alternatif yang baik untuk memperbaiki tulang yang rusak tersebut. Tulang sendiri termasuk jaringan keras yang tersusun dari sel aktif yang terintegrasi yang terdiri dari dua komposisi yaitu matrik yang kaya mineral 70% dan bahan-bahan organik 30% (Wang et al. 2010). Tulang juga merupakan komponen dalam
perlindungan, penyokongan, dan gerakan tubuh. Selain itu tulang juga merupakan sebuah lokasi perlindungan dan penghasil dari jaringan khusus seperti misalnya sistim pembentukan-darah, sumsum tulang dan juga melindungi organ vital seperti jantung, paru-paru, organ-organ dan struktur-struktur lainnya dalam dada yang dilindungi oleh tulang yang membentuk sangkar rusuk.
Beberapa biomaterial telah dicoba untuk mempercepat proses penyembuhan, dari material sintetis kemudian berkembang ke material yang berbahan dasar dari alam yang mempunyai sifat yang sama dengan materi sintesis yang biokompatibel,
tidak mengandung racun, serta sesuai dengan jaringan tubuh antara lain tidak merugikan sistem kinerja tubuh manusia. Selain itu harus mempunyai sifat mekanik yang baik yaitu bersifat elastis, daya tahan kuat, stabil, dan dapat menyesuaikan sesuai aplikasi yang diharapkan.
Material untuk merangsang proses remodeling tulang yang paling populer
adalah senyawa kalsium fosfat yang merupakan basis dari hidroksiapatit (HA; Ca10(PO4)6(OH)2) dan β-trikalsium fosfat (TCP; Ca3(PO4)2). Komposisi kimia
senyawa hidroksiapatit memiliki kaitan yang erat dengan mineral tulang (
calcium-deficient carbonated hydroxyapatite) seperti yang telah dilakukan Prabakaran
yang telah berhasil mensintesis HA dengan stokhiometri dengan Ca/P 1,67 (Prabakaran et al. 2005).Hidroksiapatit dan β-trikalsium fosfat merupakan bahan
yang sangat biocompatible karena bahan tersebut berkemampuan untuk
menyesuaikan dengan jaringan tubuh antara lain bersifat tahan terhadap korosi dan tidak menimbulkan reaksi penolakan terhadap jaringan tubuh. Pengujian ini dapat dilakukan dengan uji in vitro sel osteoblas atau sel punca ataupun dengan in vivo pada hewan (Jusiana 2012).
Pembuatan hidroksiapatit dapat dilakukan dengan menggunaan sumber kalsium alami maupun sintetik. Sumber kalsium alami yang sudah berhasil dilakukan untuk sintetik hidroksiapatit adalah kalsium dari cangkang telur ayam ras (Dahlan et al. 2009; Prabakaran 2005), dan yang berasal dari cangkang kerang
2
yang merupakan limbah yang dibuang oleh masyarakat dan banyak didapatkan di perairan Kepulauan Muna Sulawesi Tenggara. Selain itu, dikarenakan limbah cangkang kerang mengandung kalsium karbonat yang tinggi ~98% yang dapat dijadikan sumber kalsium pada sintesis hidroksiapatit (Mustakim et al. 2010).
Selama ini limbah cangkang kerang darah terbuang percuma, atau lebih banyak dimanfaatkan sebagai materi kerajinan. Pemanfaatan lain yang sudah dilakukan adalah menjadi bahan campuran pembuatan pakan ternak, menambah kekuatan beton seperti beberapa penelitian yang dilakukan oleh beberapa peneliti (Falade et al. 1995; Sugiyama et al. 2004; Yang et al. 2005). Semua penelitian tersebut
berbasis cangkang kerang untuk kegunaan pengeras beton, padahal dengan kandungan kalsium yang tinggi pada kerang sangat dimungkinkan produk bernilai ekonomi lebih tinggi. Berdasarkan alasan tersebut maka diperlukan suatu penelitian yang membuat cangkang kerang darah yang tersebar banyak diseluruh perairan Indonesia lebih bernilai ekonomi. Salah satu caranya dengan pembuatan sintetis hidroksiapatit dan β-trikalsium fosfat berbasis cangkang kerang darah.
Penelitian tentang HA dan TCP memang sudah banyak dilakukan karena aplikasinya sebagai biomaterial, katalis, pertukaran ion, konduktor ion oksidasi, dan material luminescent. Kemudian HA telah secara luas digunakan untuk
implant biomedis, operasi jaringan keras, regenerasi tulang, memperbaiki, mengisi,
memperluas dan merekonstruksi tulang rusak (Mustakimah et al. 2010). Akan
tetapi pengembangan dengan menggunakan sumber kalsium dari cangkang kerang darah dan dibuat berpori dengan porogen dari Na-alginat dan kolagen menjadi penelitian yang patut dikembangkan mengingat komposit HA dan β-TCP berpori sangat dibutuhkan tetapi masih sangat sedikit dikembangkan terutama dengan mengambil material dari limbah cangkang kerang darah.
Komposit HA dan TCP sendiri dibuat berpori karena HA yang cocok untuk rekonstruksi tulang adalah HA berpori. Pori yang terbentuk berfungsi sebagai media pembentukan jaringan sel tulang yang tumbuh. HA berpori umumnya dibuat melalui pembentukan komposi HA dengan polimer atau bahan organik, yang biasa disebut porogen, kemudian diteruskan dengan kalsinasi sehingga bahan organiknya hilang (Muntamah 2011). Beberapa penelitian telah dilakukan dengan mengkompositkan antara HA/kitosan, HA/Na-alginat, HA/kolagen (Jusiana 2012; Muntamah 2011; Mustakim et al. 2010; Tzaphlidou 2008; Wahl et al. 1992) dengan ukuran pori yang dihasilkan antara 100 - 700 μm. Hidroksiapatit
yang telah diteliti diantaranya dengan mengambil sumber Ca yang berasal dari tulang sapi, batu gamping dan cangkang telur dan sumber fosfat dalam sintesis hidroksiapatit yang telah digunakan adalah diamonium hidrogen fosfat ((NH4)2HPO4).
Pemilihan Na-alginat sebagai matriks dari HA yang dihasilkan dari suatu proses sintesis dapat berbentuk serbuk dan dapat pula berbentuk foam (matriks
berpori) dikarenakan alginat dan kitosan banyak dimanfaatkan sebagai material
scaffold dalam memperoleh komposit yang biodegradabel (Jusiana 2012). Bone
graft sintetis yang baik adalah bone graft yang secara struktur dan komposisi
mirip dengan tulang alami. Berdasarkan penelitian sebelumnya, persyaratan minimum untuk ukuran pori ~100 μm dikarenakan ukuran sel, persyaratan migrasi, dan transport sel. Akan tetapi dianjurkan ukuran pori >300 μm dikarenakan dapat meningkatkan pembentukan tulang baru dan pembentukan kapiler (Yang et al.
3
tetapi nilai yang lebih tinggi dari 50% dapat mengakibatkan hilangnya sifat mekanik biomaterial (Muthusamy 2012). Saat ditransplantasi, HA berpori memiliki ikatan yang kuat dengan jaringan tulang sehingga dapat mencegah pergeseran dan kehilangan implan yang sudah ditransplantasikan. Selain itu, pori HA yang dibentuk dapat berfungsi sebagai media pertumbuhan sel osteoblas
sehingga dapat mempercepat proses remodeling tulang (Sugiyama 2004).
Pori-pori dalam HA dapat dibentuk melalui berbagai metode dan bahan yang digunakan sebagai matriksnya. Metode yang pernah dilakukan diantaranya adalah metode replikasi polimer, gel casting (Gillissen et al. 2000), gas scaffolding (Steven et al. 2000), slip casting, fiber compacting (pemadatan serat), solid free
form fabrication (pembentukan padatan bebas), dan freeze casting (pembekuan).
Bahan matriks yang pernah digunakan diantaranya adalah polimer, keramik, logam, dan komposit-komposit lainnya. Sedangkan Kolagen (Jusiana 2012; Muntamah 2011; Mustakim et al. 2010; Margaret Tzaphlidou et al. 2008; Vassilis
Karageorgiou et al. 2005). Berdasarkan kebutuhan dan keuunggulan yang telah
disebutkan sebelumnya maka pada penelitian ini mengembangkan HA dan β-TCP dari cangkang kulit kerang darah yang mengandung ~98% CaCO3 (Mustakimah et al., 2010) dengan metode presipitasi wise drop. Sedangkan untuk membentuk pori
digunakan Na-alginat dan kolagen dengan metode freezee dry. HA dan β-TCP
sendiri memiliki keunggulan masing masing tergantung pada terapi tulang yang diperlukan, β-TCP lebih bersifat resorbable sehingga lebih memberi ruang untuk
tumbuh jaringan tulang baru (Nazir et al. 2012), sedangkan HA lebih bersifat
bioaktif.
Perumusan Masalah
Berdasarkan dari latar belakang diatas, maka rumusan masalah pada penelitian ini adalah :
1. Bagaimana cara membuat HA dan β-TCP dengan bahan dasar dari cangkang kerang darah dengan metode presipitsi wise drop.
2. Bagaimana pembuatan scaffold β-TCP dengan matriks Na-alginat agar
diperoleh komposisi yang baik dan ukuran pori yang seragam dan menyebar diseluruh permukaan sampel.
Tujuan Penelitian
1. Membuat suatu prototipe HA dan β-TCP dengan bahan dasar dari cangkang kerang darah (Anadara granosa) dengan metode wise drop.
4
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat terutama untuk pemanfaatan limbah cangkang kerang darah pada bidang medis sehingga lebih bernilai ekonomis tinggi dengan memberikan informasi bahwa cangkang kerang darah dapat disintesis menjadi HA dan β-TCP. Selain itu untuk memperoleh komposisi sintetis terbaik dari komposit β-TCP/ Alginat dengan beberapa komposisi yang dilakukan, sehingga dihasilkan ukuran pori yang sesuai dengan ukuran sel untuk kemudian dijadikan material substitusi tulang.
Ruang Lingkup Penelitian
Penelitian ini dilakukan dengan pembuatan HA dan scaffold β-TCP dengan
mengambil bahan dasar bioaktif calsium oksida (CaO) dan CaCO3 berasal dari
cangkang kerang darah dengan metode wise drop dibuat berpori dengan porogen
dari Na-alginat dan dikarakterisasi dengan XRD (X-Ray Drifractometer), FTIR
(Fourier Transform Infrared Spectroscopy), Micro-CT scan dan SEM (Scanning
5
TINJAUAN PUSTAKA
Biomaterial untuk Substitusi Tulang
Biomaterial pada dasarnya adalah material dari bahan hayati; setiap substansi (selain obat) atau kombinasi substansi, sintesis atau alami, yang dapat dipakai pada perioda waktu tertentu, sebagai bagian atau keseluruhan sistem yang memperlakukan, menggandakan, atau mengganti setiap jaringan, organ, ataupun fungsi tubuh material yang berasal dari bahan hayati maupun sintetis (Kunio 2009) . Biomaterial itu sendiri dapat berupa logam, polimer maupun keramik.
Respon sistem biologis ketika suatu material berinteraksi dengan material lain sangat ditentukan oleh komposisi kimia dan struktur fisik dari material tersebut dan dapat diklasifikasikan berdasarkan respon khusus material tersebut terhadap lingkungan biologisnya yaitu bersifat biotoleran (tanpa menimbulkan kerusakan
pada jaringan tubuh), bioinert (bertolenrasi baik dengan tulang tetapi tidak terjadi
formasi tulang), bioaktive (merangsang pertumbuhan tulang yang baru disekitar
implan) (Kunio 2009)
Kerang darah (Anadara granosa) merupakan kerang pada umumnya, kerang
darah merupakan jenis bivalvia yang hidup pada dasar perairan dan mempunyai ciri khas yaitu ditutupi oleh dua keping cangkang (valve) yang dapat dibuka dan
ditutup seperti pada Gambar 1.
Gambar 1. Kerang darah (Anadara granosa)
6
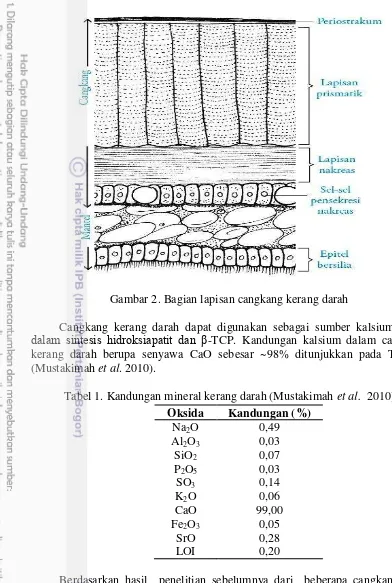
Gambar 2. Bagian lapisan cangkang kerang darah
Cangkang kerang darah dapat digunakan sebagai sumber kalsium alami dalam sintesis hidroksiapatit dan β-TCP. Kandungan kalsium dalam cangkang kerang darah berupa senyawa CaO sebesar ~98% ditunjukkan pada Tabel 1 (Mustakimah et al. 2010).
Tabel 1. Kandungan mineral kerang darah (Mustakimah et al. 2010)
Oksida Kandungan (%)
Na2O 0,49
Al2O3 0,03
SiO2 0,07
P2O5 0,03
SO3 0,14
K2O 0,06
CaO 99,00
Fe2O3 0,05
SrO 0,28
LOI 0,20
Berdasarkan hasil penelitian sebelumnya dari beberapa cangkang yang dikalsinasi untuk pengambilan CaO cangkang kerang darah mempunyai kadar CaO yang paling tinggi dibandingkan dengan cangkang yang lainnya (Buatsri
7
Gambar 2. Kalsinasi dari beberapa cangkang kerang (A) Cangkang kerang hijau (B) Cangkang kerang Darah (C) Cangkang kerang kampak (Buatsri
et.al 2013).
Unsur kalsium didapatkan dengan cara memanaskan cangkang kerang pada suhu sampai 1000 oC. Hasil yang didapat seperti pada Tabel 2 bahwa cangkang kerang darah mempunyai kandungan CaO paling tinggi ~ 99.7% diantara cangkang kerang hijau 98.37% dan kerang alam 97.529%. Hal tersebut untuk lebih menguatkan bahwa pengambilan cangkang kerang darah sebagai sumber kalsium juga sesuai dengan hasil penelitian sebelumnya yaitu berkisar ~98% (Mustakimah et al. 2010)
Tabel 2. Kandungan CaO dan senyawa lainnya pada cangkang kerang darah,kerang hijau dan kerang kampak (Buasri et.al 2013)
8
tulang manusia. Sedangkan untuk β TCP posfat diperoleh dari senyawa kalsium dengan asam fosfat.
Kalsium Fosfat
Kalsium fosfat merupakan keramik polikristal dari bahan yang mudah teroksidasi. Beberapa senyawa termasuk jenis ini yaitu tricalsium phospate (TCP)
dengan rumus molekul Ca3(PO4)2 dan Hydroksiapatite (HA) dengan rumus
molekul Ca10(PO4)6(OH)2. Kedua bahan tersebut biokompatible dan berikatan
langsung dengan tulang (Ramay. 2004) dan mempunyai struktur kimia
menyerupai tulang. HA pada umumnya telah banyak diaplikasikan dalam bidang
biomedis sebagai bahan pembuatan gigi, tulang dan sebagai bahan implan tubuh
manusia seperti pada kasus jantung cardiovaskuler.
Partikel HA merupakan suatu bahan biomaterial yang memiliki rumus kimia (Ca 10(PO4)6(OH)2). HA memiliki sifat biokompatibilitas dan bioaktivitas
yang baik. Selain itu, secara kristalografi dan sifat kimia dari HA mendekati struktur yang dimiliki oleh tulang dan gigi, dan HA dapat terikat secara langsung dengan jaringan dan dapat merangsang tumbuhnya jaringan. Hal ini menyebabkan HA dapat diaplikasikan dalam bidang biomedis, terutama untuk aplikasi tulang
dan gigi. HA termasuk ke dalam jenis biokeramik. Dalam dunia medis, bahan keramik dibagi menjadi dua golongan yaitu keramik bioinert dan keramik bioaktif.
Keramik bioinert merupakan keramik yang tidak berpengaruh dan berinteraksi
dengan jaringan tubuh, sedangkan keramik bioaktif merupakan keramik yang
dapat berikatan dengan jaringan tulang yang hidup seperti HA dan kalsium fosfat.
Dengan adanya fenomena bioaktivitas maka terjadi reaktivitas material dengan lingkungannya. Sedangkan fenomena bioinert memiliki kinetika reaksi yang
sangat lambat, kebalikannya. Keramik bioaktif memiliki kinetika reaksi yang
sangat cepat sehingga dapat bereaksi dengan cairan tubuh menghasilkan bahan tulang baru, oleh karena itu keramik bioaktif dapat digunakan untuk memperbaiki
bagian tulang, yaitu dengan cara mengganti bagian tulang yang rusak atau meregenerasi tulang. Berdasarkan sudut pandang strukturnya, keramik dibedakan menjadi tiga yaitu padatan kristal keramik, padatan glass amorf, serta padatan
amorf dengan inti kristal glass-keramik yang dapat dipertimbangkan sebagai
material inert. Beberapa senyawa kalsium fosfat dengan nilai perbandingan Ca/P
dapat dilihat pada Tabel 3.
Tabel 3. Jenis-jenis senyawa kalsium fosfat (Shi et al. 2004)
Nama mineral Nama kimia Formula kimia Ca/P
Monetite Dicalcium phosphate(DCP) CaHPO4 1,00
9
Sintesis hidroksiapatit sendiri bisa dilakukan melalui beberapa cara antara lain metode kering, metode basah, hidrolisis, dan hidrotermal. Metode kering adalah metode pereaksian raw material dalam bentuk serbuk secara langsung.
Metode basah adalah metode pereaksian dua larutan atau lebih dengan menambahkan apatit karbonat sebagai penyeimbang sifat hidroksiapatit yang keras dan padat. Apatit karbonat ini memiliki sifat mudah diserap oleh larutan tubuh sehingga memudahkan pertumbuhan tulang. Metode-metode yang disampaikannya pada dasarnya dapat memperoleh hidroksiapatit dalam bentuk padat, kristalin, atau senyawa lain dengan nisbah Ca/P tertentu. Cara-cara itu dikenal sebagai metode basah yaitu reaksi kimia untuk mengendapkan padatan dari larutannya, metode kering yaitu dengan memanfaatkan perubahan fase senyawa padatan, dan reaksi hidrotermal untuk memperoleh kristal-kristal tunggal. Namun, dari berbagai metode itu, yang paling umum adalah memperoleh padatan hidroksiapatit melalui pengendapan larutan bersuasana basa menurut reaksi kimia:
10Ca2+ + 6H2PO4- + 14OH- → Ca10(PO4)6(OH)2
Dalam proses basah, seperti terlihat dengan persamaan reaksi diatas ion kalsium dapat diperoleh dari senyawa garam klorisa atau nitrat, sedangkan ion fosfatnya dari garam potassium fosfat atau ammonium fosfat. Secara umum hidroksiapatit tidak akan langsung terbentuk melainkan diawali dengan terbentuknya serangkaian senyawa pendahulu seperti dikalsium fosfat dihidrat dan oktakalsium fosfat, atau mungkin senyawa kalsium fosfat amorf.
Perubahan senyawa itu untuk bisa menjadi hidroksiapatit berdasarkan jumlah total konsentrasi ion kalsium dan ion fosfat, pH dan suhu. Sifat mekanis merupakan faktor yang membatasi penggunaan HA sebagai implan pada bagian yang menanggung beban tinggi. HA yang memiliki sifat mekanis yang baik perlu diperluas lagi penggunaannya dalam bidang kedokteran di masa depan. Umumnya faktor yang mempengaruhi sifat mekanis HA adalah bentuk serbuk, pori-pori, besar butir dan juga metode fabrikasi. Serbuk HA yang memiliki stoikiometri yang tepat yaitu rasio molar Ca/P sebanyak 1.67 dapat menghasilkan sifat mekanis HA yang unggul (Yoshimura 1998).
Alginat
Alginat merupakan suatu polisakarida anionik yang diperoleh dari alga coklat yang merupakan suatu polimer yang terdiri dari β-D asam manuronat (M) dan α (1,4)-L asam guluronat (G). Polimer ini tidak bersifat toksik, tidak memberikan reaksi alergi dan dapat terurai dalam tubuh (Mambo 2010). Natrium alginat merupakan salah satu bentuk garam dari alginat yang mempunyai sifat membentuk gel dengan penambahan larutan garam kalsium seperti kalsium klorida. Selain sebagai pembentuk gel juga digunakan sebagai pengemulsi dan penstabil (Morris et al. 1980). Alginat mempunyai bentuk molekul rantai panjang
dengan banyak ion negatif (anion). Pada proses penambahan air, molekul-molekul alginat terhidrasi (pengikatan air ) (King AH 1982). Sifat lain dari asam alginat adalah tidak larut dalam air, tetapi hanya swelling (mengembang). Alginat yang
10
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2014 s.d. Mei 2015. Proses sintesis serbuk HA dan β-TCP serta preparasi scaffold berpori dilakukan di
Laboratorium Biofisika Material Departemen Fisika FMIPA IPB dan Laboratorium Advanced Material PUSLIT Kimia-LIPI. Proses freeze-drying
dilakukan di Laboratorium Freeze Dryer Balai Besar-Pascapanen. Karakterisasi
XRD dilakukan di Laboratorium Analisis Bahan Departemen Fisika FMIPA IPB dan Laboratorium Instrumen Analisis Teknik Kimia FTI ITB, karakterisasi FTIR dilakukan di Laboratorium Analisis Bahan UGM, karakterisasi SEM dilakukan di Laboratorium Pusat Survei Geologi-Bandung, dan untuk karakterisasi dengan μ -CT scan dilakukan di Laboratorium Micro--CT FMIPA ITB.
Bahan
Bahan yang digunakan pada penelitian ini adalah cangkang kerang darah
(Anadara granosa) dari Kabupaten Muna Sulawesi Tenggara. Diammonium
hydrogen phosphate ((NH4)2HPO4, >99%, Merck, USA), asam fosfat (H3PO4)
85%, Merck, USA), natrium alginat (C6H7O6Na, CV. Setia Guna, Indonesia),
aquabidest, dan kalsium klorida (CaCl2, >99%, Merck, USA).
Alat
Alat yang digunakan pada penelitian ini, yaitu: neraca analitik, furnace,
crussible, tabung Erlenmeyer, labu ukur, selang suntik, corong, kertas saring,
magnetic stirrer, multiwall plate 48-well, spatula, freeze-dryer (Sneijder
LY5FME), serta alat karakterisasi XRD (Bruker Advance D8), FTIR (Shimadzu IR Prestige DSR-8000), μ-CT scan (SkyScan 1173) dan SEM (JEOL JSM-360LA).
Prosedur Penelitian
Sintesis Hidroksiapatit (HA)
11
Sintesis hidroksiapatit pada penelitian ini menggunakan metode presipitasi, yaitu berupa wise drop. Pada metode wise drop, cangkang kerang darah yang
telah dikalsinasi dilarutkan kedalan aquades. Proses yang melibatkan reaksi antara asam fosfat (NH4)2HPO4) dan basa (Ca(OH)2). Dalam proses pembuatan
perbandingan antara biomaterial kalsium dan fospat adalah sebesar 1.67. Kemudian ditambahkan larutan (NH4)2HPO4 yang sudah dilarutkan kedalam
aquabidest. Massa cangkang kerang dan massa (NH4)2HPO4 yang dilarutkan
ditentukan berdasarkan hasil perhitungan stokiomateri sehingga menghasilkan rasio Ca/P sebesar 1.67 dengan konsentrasi 0.5 M untuk kalsium cangkang kerang darah dan 0.3 M untuk sumber fosfat. Metode presipitasi yang digunakan yaitu metode wise drop dengan waktu stirring selama 3 jam dengan kecepatan stiring
300 rpm. Setelah larutan menjadi homogen, larutan kemudian diendapkan selama 24 jam disuhu ruang. Sampel hasil presipitasi tersebut kemudian disaring dengan menggunakan kertas saring dan pompa vacuum agar mempercepat proses
penyaringan. Setelah proses penyaringan, sempel kemudian di keringkan pada suhu 110 oC selama 3 jam dan dilanjutkan proses sintering pada suhu 900 oC dengan waktu penahan 5 jam. Sampel kemudian dikarakterisasi menggunakan XRD dan FTIR.
Sintesis β-Trikalsium Fosfat (β-TCP)
Sumber kalsium adalah cangkang kerang darah yang telah dikalsinasi dan sumber fosfat dari H3PO4. Prosesnya hampir sama dengan pembuatan HA. Serbuk
kalsium dilarutkan dalam 100 ml aquabidest dan H3PO4 (asam posfat) yang telah
dilarutkan dalam 100 ml aquabidest. Presipitasi larutan kalsium dan larutan fosfat
dilakukan pada suhu 50 °C selama 120 menit dengan kecepatan 300 rpm.
Kemudian disaring menggunakan kertas saring dan dicuci menggunakan
aquabidest. Proses sintering pada suhu 1000 °C waktu penahanan 7 jam dilakukan
selanjutnya, sampel dikarakterisasi dengan XRD dan FTIR.
Sintesis Scaffoldβ-TCP/alginat
Scaffold β-TCP/alginat dipreparasi dengan rasio massa TKA 70/30, 80/20
dan 60/40 sebagai variasi.Komposisi tersebut mengikuti rasio tulang manusia yang merupakan komposit yang mengandung 70% mineral dan 30% matriks, penambahan crosslink CaCl2 yang berfungsi membantu ikatan silang antara β
-TCP dan alginat. Sintesis komposit tersebut dilakukan dengan metode freeze
drying atau teknik pengeringan beku. Pada penelitian ini proses pembekuan
dilakukan dengan menyimpan sampel didalam freezer selama overnight hingga
membentuk kristal es selanjutnya proses pengeringan menggunakan freeze dryer.
12
Analisis Data
Karakterisasi XRD
Karakterisasi XRD menggunakan XRD Brukker Advance D8 dilakukan dengan tujuan untuk mengindentifikasi fasa, parameter kisi, dan derajat kristalinitas yang terdapat dalam sampel. Fasa kalsium yang terbentuk diuji dengan teknik difraksi sinar-x yang dilakukan pada sudut 2θ dari 10o hingga 80o. Hasil analisis dibandingkan dengan data Joint Commite on Powder Diffraction
Standards (JCPDS).
Karakterisasi FTIR
Karakterisasi FTIR menggunakan mesin Shimadzu dilakukan untuk mengidentifikasi gugus-gugus fungsi pada sampel HA, β-TCP, HA/alginat, β -TCP/alginat. Dua miligram sampel dicampur dengan 100 mg KBr, dibuat pelet kemudian disinari dengan infrared dengan jangkauan bilangan gelombang
4000-400 cm-1. Latar belakang absorpsi dihilangkan dengan cara pelet KBr digabung jadi satu setiap pengukuran.
Karakterisasi Micro-CT Scan
Pemindaian dengan μ-CT scan bertujuan untuk mengetahui distribusi ukuran pori dan porositas dalam sampel berdasarkan analisis citra. Untuk melakukan rekonstruksi citra dalam penelitian ini digunakan software Nrecon
dengan pixel image size 23.17 μm. Karakterisasi SEM
Analisis morfologi dari scaffold β-TCP/alginat yang dihasilkan pada
13
HASIL DAN PEMBAHASAN
Karakteristik CaO
Proses kalsinasi pada cangkang kerang darah bertujuan untuk mengambil komponen kalsium dan membuang komponen lain yang tidak diperlukan dalam sintesis β-TCP. Cangkang kerang darah yang dipanaskan pada suhu 1000 0C selama 7 jam menghasilkan senyawa kalsium hidroksida Ca(OH)2 dan kalsium
oksida (CaO). Pola spektrum CaO yang terbentuk dianalisis dengan mencocokan hasil dengan data JCPDS (Lampiran 1). Pola hasil difraksi XRD pada Gambar 3 menunjukkan bahwa masih terbentuknya fasa Ca(OH)2. Hal tersebut kemungkinan
karena tidak sempurnanya proses perubahan fasa, saat proses kalsinasi. Suhu yang kurang lama atau temperatur yang kurang tinggi selama kalsinasi cangkang juga mengindikasikan tidak berubahnya CaCO3 seluruhnya menjadi CaO tetapi
bertranformasi menjadi Ca(OH)2. Fasa CaO yang terbentuk merupakan proses
yang sempurna pada saat pemanasan dengan berubahnya senyawa awal dari cangkang kerang CaCO3 melepaskan karbon dioksida. Pola difraksi dengan tiga
intensitas tinggi pada nilai 2θ: 34.125o Ca(OH)
2; 17.987o, 37.364o CaO.
Sedangkan munculnya fasa Ca(OH)2 karena pada proses pemanasan kemungkinan
masih adanya gugus OH yang terikat dengan Ca. Persamaan reaksi terbentuknya CaO dari calcite dapat dituliskan reaksinya sebagai berikut:
CaCO3→CaO+CO2
Gambar 3 Pola difraksi XRD hasil kalsinasi cangkang kerang darah pada suhu 1000°C selama 7 jam
14
membutuhkan waktu yang lebih lama untuk mendapatkan CaO dibandingkan dengan cangkang telur (Mumtanah 2011). Derajat kristalinitas dari CaO berdasarkan hasil karakterisasi XRD menunjukan bahwa kristalinitas dari sampel sebesar 80.6%, manandakan bahwa spektra CaO sudah terbentuk.
Karakteristik Hidroksiapatit
Hasil yang diperoleh pada penelitian ini berupa serbuk HA yang disintesa dengan metode presipitasi wise drop. Proses presipitasi HA, secara kimiawi
diinisiasi oleh pembentukan fasa kalsium fosfat amorf. Kemampuan kalsium fosfat amorf untuk mengabsorbsi ion-ion Ca2+ dan HPO42- mengarah ke
pembentukan defektif apatit. Perubahan terjadi terus dengan bertambahnya kandungan ion OH yanyang mengakibatkan terjadinya pembentukan fasa intermediat dikalsium fosfat anhidrat/monetite dengan Ca/P=1,00 meningkat terus sampai terbentuk HA dengan Ca/P=1,67 (Blumenthal NC et al 1981; Brown, et
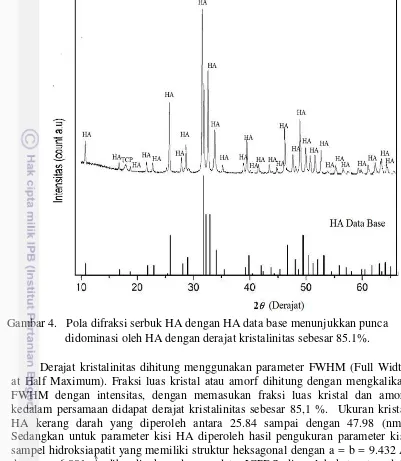
al.1979). Fasa kalsium fosfat berbeda dalam hal komposisi dan struktur kristal yang menentukan properti fisikokemikal. Berdasarkan komposisi dan struktur senyawa kalsium fosfat. HA bersifat paling stabil. Gambar 4 menunjukkan pola spektrum XRD hasil karakterisasi serbuk HA cangkang kerang darah. Serbuk HA hasil presipitasi wise drop mengidentifikasi fasa yang terbentuk, identifikasi fasa
sampel dilakukan dengan membandingkan pola difraksinya dengan database
JCPDS nomor 09-0432 tentang calcium phosphate hydroxide.
Pola difraksi sinar-x yang mengindikasikan fasa HA pada database JCPDS
ditunjukkan oleh adanya puncak-puncak yang tinggi pada sudut 2θ: 25.86º, 31.78º, 32.17º, 32.91, dan 49.45º. Hasil pencirian terhadap sampel yang diperoleh pada penelitian ini menunjukkan bahwa pola difraksi sinar-x yang terbentuk hampir sama dengan pola difraksi sinar-x untuk fasa HA pada database JCPDS
(Lampiran 3). Gambar 4 menunjukkan pola difraksi sinar-x untuk sampel HA hasil sintesis. Analisis dengan mengunakan Match! (COD-Inorg REV129424 2015.01.07) juga memberi informasi mengenai sistem kristal. Pada HA dimungkinkan terjadinya berbagai substitusi, namun struktur kristalografinya tidak mengalami perubahan (Legeros, 1980; Young, 1975). Pada struktur HA, ion OH- dan ion PO43- dapat disubstitusi oleh ion CO32-(karbonat). Substitusi juga
terjadi pada OH- oleh ion CO3 2- menghasilkan HA karbonasi tipe A, sedangkan
substitusi ion PO4 3- menghasilkan HA karbonasi tipe B (de Campos DDP,
Bertran CA, 2009; Doi et al ,1982). Kedua tipe substitusi dapat juga terjadi
15
Gambar 4. Pola difraksi serbuk HA dengan HA data base menunjukkan punca didominasi oleh HA dengan derajat kristalinitas sebesar 85.1%.
Derajat kristalinitas dihitung menggunakan parameter FWHM (Full Width at Half Maximum). Fraksi luas kristal atau amorf dihitung dengan mengkalikan FWHM dengan intensitas, dengan memasukan fraksi luas kristal dan amorf kedalam persamaan didapat derajat kristalinitas sebesar 85,1 %. Ukuran kristal HA kerang darah yang diperoleh antara 25.84 sampai dengan 47.98 (nm). Sedangkan untuk parameter kisi HA diperoleh hasil pengukuran parameter kisi sampel hidroksiapatit yang memiliki struktur heksagonal dengan a = b = 9.432 Å dan c = 6,881 Å dibandingkan dengan data JCPDS diperoleh ketepatan data sebesar 99,7 % hal ini sesuai dengan data pencocokan puncak-puncak maksimal sampel dengan data JCPDS yang menunjukan bahwa sampel didominasi oleh kristal apatit yang hadir dalam bentuk hidroksiapatit, meskipun masih ada fasa lain yng teridentifikasi yaitu fasa TCP tetapi persentasinya sangat kecil dan tidak menjadi kendala karena TCP juga masih merupakan senyawa kalsium fosfat yang aman untuk substitusi tulang karena tidak beracun.
Karakteristik β-Trikalsium Fosfat
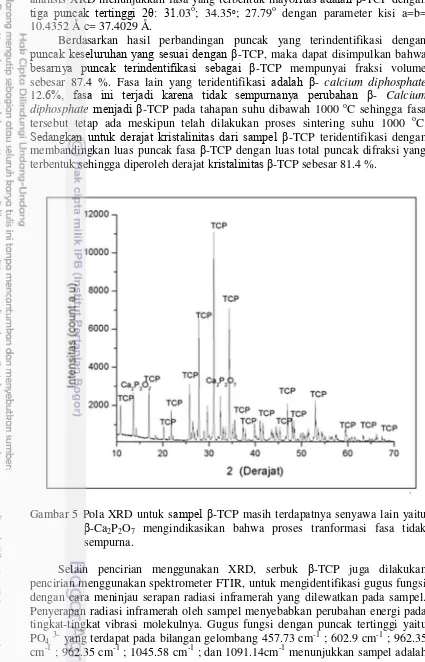
Hasil yang diperoleh pada penelitian ini berupa serbuk β-TCP yang disintesa dengan metode presipitasi wise drop. Gambar 5 menunjukkan pola
16
analisis XRD menunjukkan fasa yang terbentuk mayoritas adalah β-TCP dengan tiga puncak tertinggi 2θ: 31.03o; 34.35ο; 27.79o dengan parameter kisi a=b= 10.4352 Å c= 37.4029 Å.
Berdasarkan hasil perbandingan puncak yang terindentifikasi dengan puncak keseluruhan yang sesuai dengan β-TCP, maka dapat disimpulkan bahwa besarnya puncak terindentifikasi sebagai β-TCP mempunyai fraksi volume sebesar 87.4 %. Fasa lain yang teridentifikasi adalah β- calcium diphosphate
12.6%, fasa ini terjadi karena tidak sempurnanya perubahan β- Calcium
diphosphate menjadi β-TCP pada tahapan suhu dibawah 1000 oC sehingga fasa
tersebut tetap ada meskipun telah dilakukan proses sintering suhu 1000 oC. Sedangkan untuk derajat kristalinitas dari sampel β-TCP teridentifikasi dengan membandingkan luas puncak fasa β-TCP dengan luas total puncak difraksi yang terbentuk sehingga diperoleh derajat kristalinitas β-TCP sebesar 81.4 %.
Gambar 5 Pola XRD untuk sampel β-TCP masih terdapatnya senyawa lain yaitu β-Ca2P2O7 mengindikasikan bahwa proses tranformasi fasa tidak
sempurna.
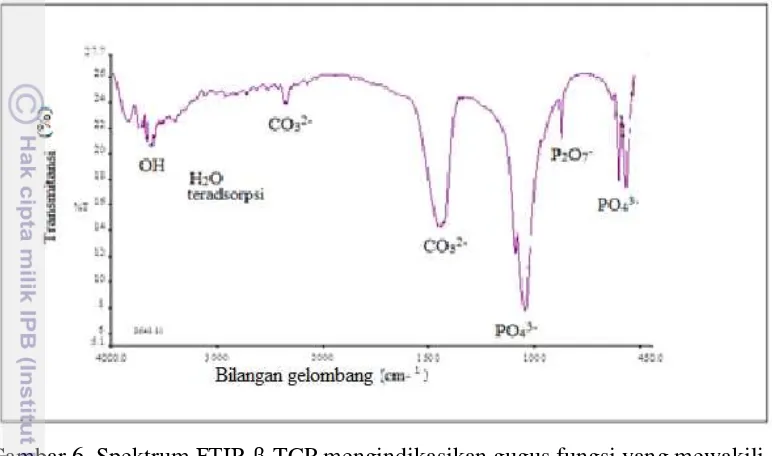
Selain pencirian menggunakan XRD, serbuk β-TCP juga dilakukan pencirian menggunakan spektrometer FTIR, untuk mengidentifikasi gugus fungsi dengan cara meninjau serapan radiasi inframerah yang dilewatkan pada sampel. Penyerapan radiasi inframerah oleh sampel menyebabkan perubahan energi pada tingkat-tingkat vibrasi molekulnya. Gugus fungsi dengan puncak tertinggi yaitu PO4 3- yang terdapat pada bilangan gelombang 457.73 cm-1 ; 602.9 cm-1 ; 962.35
17
β-TCP. Khusus untuk gugus fungsi dengan bilangan gelombang 962.35 cm-1 ; 1045.58 cm-1 disebut sebagai gugus fungsi PO43- khas β-TCP.Gugus fungsi yang
cukup tajam dan tidak berkaitan dengan fasa β-TCP adalah gugus P2O7 4- yang
terletak pada bilangan gelombang 712.91 cm-1. Apabila hasil tersebut dibandingkan dengan hasil analisis XRD maka dapat diketahui bahwa gugus fungsi P2O7 4- berkaitan dengan senyawa β-Ca2P2O7 yang diketahui akan
tersublimasi apabila dilakukan pemanasan diatas suhu 11000C.
Gambar 6 Spektrum FTIR β-TCP mengindikasikan gugus fungsi yang mewakili senyawa TCP
Karakteristik Matriks Na-alginat
Hasil analisis XRD alginat menunjukan bahwa pola difraksi alginat Gambar 7 puncak-puncaknya dan pada pola difraktogram sinar-X alginat terdapat indeks kristal yang sangat rendah. Difraktogram sinar-X kristal menghasilkan puncak-puncak yang tajam, sedangkan polimer amorf cenderung menghasilkan puncak-puncak yang melebar seperti yang terjadi pada alginat. Spektra yang terdeteksi sesuai dengan data base alginate.
18
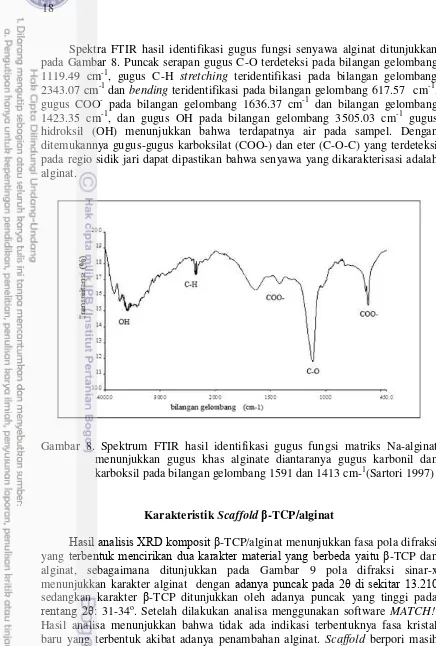
Spektra FTIR hasil identifikasi gugus fungsi senyawa alginat ditunjukkan pada Gambar 8. Puncak serapan gugus C-O terdeteksi pada bilangan gelombang 1119.49 cm-1, gugus C-H stretching teridentifikasi pada bilangan gelombang
2343.07 cm-1 dan bending teridentifikasi pada bilangan gelombang 617.57 cm-1,
gugus COO- pada bilangan gelombang 1636.37 cm-1 dan bilangan gelombang 1423.35 cm-1, dan gugus OH pada bilangan gelombang 3505.03 cm-1 gugus hidroksil (OH) menunjukkan bahwa terdapatnya air pada sampel. Dengan ditemukannya gugus-gugus karboksilat (COO-) dan eter (C-O-C) yang terdeteksi pada regio sidik jari dapat dipastikan bahwa senyawa yang dikarakterisasi adalah alginat.
Gambar 8. Spektrum FTIR hasil identifikasi gugus fungsi matriks Na-alginat menunjukkan gugus khas alginate diantaranya gugus karbonil dan karboksil pada bilangan gelombang 1591 dan 1413 cm-1(Sartori 1997)
Karakteristik Scaffoldβ-TCP/alginat
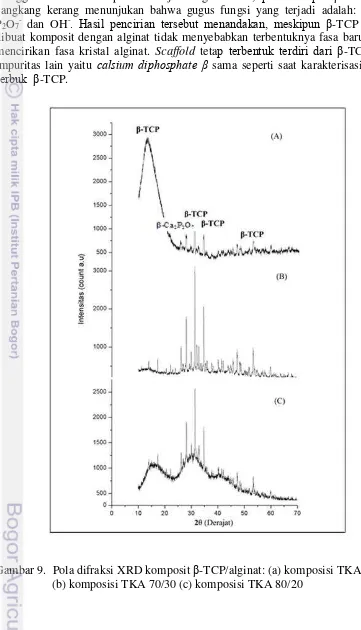
Hasil analisis XRD komposit β-TCP/alginat menunjukkan fasa pola difraksi yang terbentuk mencirikan dua karakter material yang berbeda yaitu β-TCP dan alginat, sebagaimana ditunjukkan pada Gambar 9 pola difraksi sinar-x menunjukkan karakter alginat dengan adanya puncak pada 2θ di sekitar 13.210 sedangkan karakter β-TCP ditunjukkan oleh adanya puncak yang tinggi pada rentang 2θ: 31-34o. Setelah dilakukan analisa menggunakan software MATCH!.
Hasil analisa menunjukkan bahwa tidak ada indikasi terbentuknya fasa kristal baru yang terbentuk akibat adanya penambahan alginat. Scaffold berpori masih
terdiri dari β-TCP dengan sedikit impuritas β calcium diphosphate, senyawa
19
Komposit β-TCP /alginat yang dihasilkan pada penelitian ini diidentifikasi gugus fungsi senyawanya menggunakan spektrometer FTIR. Proses identifikasi ini dilakukan untuk melihat perubahan serapan gugus fungsi senyawa β-TCP dan senyawa alginat. Berdasarkan hasil analisis gugus fungsi β-TCP dengan menggunakan FTIR seperti ditunjukan gambar 5, pada sampel β-TCP dari cangkang kerang menunjukan bahwa gugus fungsi yang terjadi adalah: PO4- ,
P2O7- dan OH-. Hasil pencirian tersebut menandakan, meskipun β-TCP sudah
dibuat komposit dengan alginat tidak menyebabkan terbentuknya fasa baru yang mencirikan fasa kristal alginat. Scaffold tetap terbentuk terdiri dari β-TCP dan
impuritas lain yaitu calsium diphosphate β sama seperti saat karakterisasi XRD serbuk β-TCP.
20
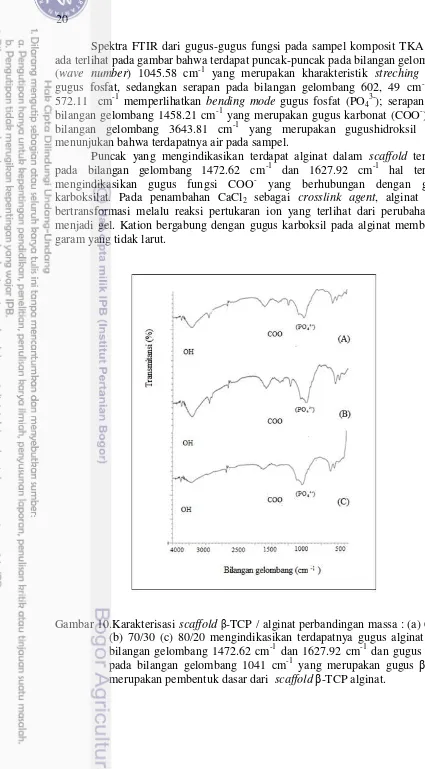
Spektra FTIR dari gugus-gugus fungsi pada sampel komposit TKA yang ada terlihat pada gambar bahwa terdapat puncak-puncak pada bilangan gelombang
(wave number) 1045.58 cm-1 yang merupakan kharakteristik streching mode
gugus fosfat, sedangkan serapan pada bilangan gelombang 602, 49 cm-1 dan 572.11 cm-1 memperlihatkan bending mode gugus fosfat (PO43-); serapan pada
bilangan gelombang 1458.21 cm-1 yang merupakan gugus karbonat (COO-); dan bilangan gelombang 3643.81 cm-1 yang merupakan gugushidroksil (OH) menunjukan bahwa terdapatnya air pada sampel.
Puncak yang mengindikasikan terdapat alginat dalam scaffold terdapat
pada bilangan gelombang 1472.62 cm-1 dan 1627.92 cm-1 hal tersebut mengindikasikan gugus fungsi COO- yang berhubungan dengan garam karboksilat. Pada penambahan CaCl2 sebagai crosslink agent, alginat dapat
bertransformasi melalu reaksi pertukaran ion yang terlihat dari perubahan sol menjadi gel. Kation bergabung dengan gugus karboksil pada alginat membentuk garam yang tidak larut.
Gambar 10.Karakterisasi scaffoldβ-TCP / alginat perbandingan massa : (a) 60/40
(b) 70/30 (c) 80/20 mengindikasikan terdapatnya gugus alginat pada bilangan gelombang 1472.62 cm-1 dan 1627.92 cm-1 dan gugus PO4
21
Analisis morfologi komposit β-TCP/alginat dilakukan dengan menggunakan SEM. Analisis morfologi difokuskan pada identifikasi ukuran pori dan struktur porositas. Hasil menunjukkan bahwa struktur porositas yang terlihat cukup teratur dengan ukuran pori yang hampir seragam, sebagaimana ditunjukkan pada Gambar 11. Berdasarkan Gambar 11 pada perbesaran 50x beberapa skala ukuran diameter pori yang terbentuk, rentang ukuran diameter pori yang terbentuk adalah antara 46.35 μm hingga 880.65 μm untuk perbandingan β-TCP/alginat TKA 60/40, 46.35 μm hingga 1019.7 μm untuk perbandingan β-TCP/alginat 70/30, dan 46.35 μm hingga 556.2 μm untuk perbandingan β-TCP/alginat 80/20. Hasil tersebut bisa dilihat dari Tabel 3 untuk rata rata ukuran pori.
22
Tabel 4. Ukuran pori dan porositas komposit β-TCP/Alginat
β-TCP Alginat Pori (µm) Porositas(%) meskipun ukuran pori tidak mempunyai ukuran yang merata, akan tetapi sebaran pori yang terjadi (porositas) dengan persentasi 66.77 % untuk TKA 60/40 67.29 % untuk TKA 70/30, 57.28 % untuk TKA 80/20 menandakan bahwa pori sudah tersebar merata di seluruh permukaan sampel Scaffold yang dipreparasi dengan
rasio β-TCP lebih besar cenderung menghasilkan ukuran poros yang lebih kecil, bahkan menghasilkan penutupan poros. Morfologi ini serupa dengan morfologi poros pada scaffold hasil studi Turco et al. (2008) yang menggunakan metode
preparasi scaffold yang sama. Berdasarkan hasil Micro-CT scan diperoleh bahwa
ukuran pori dan sebaran pori terbaik berada pada komposisi massa TCP/Alginat 70/30 dengan berdasarkan pada standar ukuran pori seharusnya yaitu berada antara 100 – 300 μm (Turco 2008)
SIMPULAN DAN SARAN
Simpulan
Sintesis β-TCP telah berhasil dibuat menggunakan prekusor dari cangkang kerang darah (Andara granosa) sebagai material kandidat bone graft dengan
metode presipitasi wise drop. Fasa lain yang teridentifikasi adalah β- Calcium
diphosphate. Scaffold β-TCP- alginat yang dihasilkan disintesis dengan metode
freeze drying. Hasil analisis XRD dan FTIR komposit β-TCP- alginat
menunnjukkan bahwa gugus fungsi yang terbentuk merupakan senyawa pembentuknya. Ukuran pori yang dihasilkan setelah dianalisis dengan mikro CT- scan memenuhi standar ukuran pori seharusnya agar tulang dapat tumbuh dengan baik.
Saran
Agar diperoleh serbuk HA dan β-TCP dengan fraksi volume yang lebih tinggi maka diperlukan adanya penelitian lebih lanjut. Berdasarkan ukuran pori yang telah sesuai dengan ukuran pori ideal scaffold maka diperlukan pengaruh
penggunaan scaffold β-TCP/alginat tersebut pada pertumbuhan sel tulang baik
23
DAFTAR PUSTAKA
Buddy D, Ratner AS, Hoffman FJ, Scohoen JL.2012. Biomaterials Science: An Introduction to Materials in Medicine.
Brown, W. E., L. W. Schroeder, and J. S. Ferris. 1979. Interlayering of crystalline octocalcium phosphate and hydroxyapatite. J. Phys. Chem. 83:1385–1388.
Buasri, Chaiyut N, Loryuenyong V, Worawanitchaphong P, Trongyong A. 2013. Calcium Oxide Derived from Waste Shells of Mussel, Cockle, and Scallop as the Heterogeneous Catalyst for Biodiesel Production. [Jurnal]. Handawi.
Chang RW, Hansen P, and Kraner EJ. 1992. Material science and technology
(comprehensive treatment), 14.
Dahlan K, Dewi SU, Nurlaila, Soejoko DS. 2012. Synthesis and Characterization of Calcium Phosphate/Chitosan Composites. International Journal of Basic
& Applied Sciences. 12(1):50-57.
Dahlan K. 2013. Potensi Kerang Ranga sebagai Sumber Kalsium dalam Sintesis Biomaterial Substitusi Tulang. Prosiding Semirata FMIPA Universitas
Lampung.
De Campos DDP, Bertran CA .2009. Synthesis of carbonated hydroxyapatite nanorods in liquid crystals. Mat Res 12(3)
Jusiana D. 2012. Komposit Hidroksiapatit Kalsinasi Suhu Rendah dengan Alginar Sargasum Duplicatm atau Sargassum Crassifolium sebagai Material
Scaffold untuk Pertumbuhan sel Punca Masenkimal [Tesis]. Depok (ID):
Universitas Indonesia.
Nyström E. 2009. Bone graft remodelling and implant success rate in the treatment of the severely resorbed maxilla: a 5-year longitudinal study
[Disertation]. Sweden : Umeå University
Falade F. 1995. An Investigation of Periwinkle Shells as Coarse Aggregate in Concrete: Building and Environment, 30(4):573-577.
Kunio O. 2009. Advanced Biomaterials: Fundamentals, Processing, and Applications. Jhon Willey and Son Inc. New Jersey. .
Kuboki Y, Takita H, Kobayashi D, Tsuruga E, Inoue M, Murata M. 1998. BMP-induced osteogenesis on the surface of hydroxyapatite with geometrically feasible and nonfeasible structures: topology of osteogenesis. J
BiomedMater Res. 39(2):190–199.
Lafon JP, Champion E, Bernache-Assollant D .2008. Processing of AB-type carbonated hydroxyapatite Ca10-x(PO4)6-x(OH)2-x-2y(CO3)y ceramics withcontrolled composition. Journal of the European Ceramic Society
28(1):139-147.
LeGeros RZ .2002. Properties of osteoconductive biomaterials: calcium phosphates. Clin Prthop Rel Res 395: 81-95
Lobo & Arinzeh. 2010. Biphasic Calcium Phosphate Ceramics for Bone
Regeneration and Tissue Engineering Applications. Department of
Morphology, Federal University of São Paulo, Rua Botucatu, 740, CEP 04023-900, São Paulo, SP, Brazil.
Muntamah. 2011. Sintesis dan Karakterisasi Hidroksiapatit dari Limbah
Cangkang Kerang Darah (Anadara granosa, Sp) [Tesis]. Bogor (ID):
24
Mustakim MM, Suzana Y. & Saikat M. 2010. Composition Study of Calcium Carbonate in Cockle Shell. 8th Conference on Advanced Processes
Materials, World Engineering Congress. 2010(1):16-20.
Muthusamy K. and Sabri N.A. 2012. Cockle Shell: A Potential Partial Coarse Aggregate Replacement in Concrete. International Journal of Science,
Environment Technology. 1(4):260-267.
Nazir NM.. 2012. Biocompatibility of in house β-tricalcium phosphate ceramics with normal human osteoblast cell. Journal of Engineering Science and
Technology. 7(2):169-176.
Prabakaran, K, Balamurugan, A, &RajeswariS. 2005. Development of calcium
Phosphate based apatite from hen’s eggshell. Bulletin Mater. Sci.
2005(1)115-119.
Sugiyama M. 2004. The Compressive Strength of Concrete Containing Tile Chips,
Crushed Scallop Shells & Crushed Roofing Tiles, edited by Limbachiya MC
& Roberts JJ. in Sustainable Waste Management & Recycling: Construction
Demolition Waste, London, Thomas Telford Publishing. 165-172.
Sartori C, Finch DS, Ralph B, and Gilding K. 1997. Determination of the cation content of alginate thin films by FTIR spectroscopy, Polymer, 38, pp. 43. Tzaphlidou M. 2008. Bone Architecture: Collagen Structure and
Calcium/Phosphorus Maps. [Jurnal]. Department of Medical Physics,
Medical School, Ioannina University, 45110, Ioannina, Greece.
Turco G, Eleonora M, Bellomo F, Semeraro S, Donati I, Brun F, Grandolfo M, Sccardo A, Paoletti S. 2000. Alginate/Hydroxyapatite Biocomposite for Bone Ingrowth: A Trabecular Structure with High and Isotropic Connectivity. Biomacromolecules 10(1):1575-1583.
Xiao Y, Wang, Yi, Huang, Xian-Deng Hou, and Yo-Ba. LI2 Comparative Study on Inorganic Composition and Crystallographic Properties of Cortical and
Cancellous Bonel [Thesis]. Sichuan (CN): Sichuan University
Yang EI, Yi ST, Leem YM.2005. Effect of Oyster Shell Substituted for Fine Aggregate on Concrete Characteristics: Part 1. Fundamental Properties:
Journal of Cement & Concrete Research. 35(1):2175-2182.
Yusof M, Ujai SJJ, Sahari F, Taib SNL, Noor MNH. 2011. Application of Clam (Lokan) Shell as Beach Retaining Wall. Proceeding of EnCon 2011: 4th
25
LAMPIRAN
Lampiran 1 Data Joint Commite on Powder Diffraction Standards (JCPDS) CaO
26
Lampiran 2 Data Joint Commite on Powder Diffraction Standards (JCPDS)
27
28
Lampiran 4 Gambar Micro CT Scan Scaffold TCP-Alginat
Scaffold TKA 60/40
Scaffold TKA 70/30
29
RIWAYAT HIDUP
Penulis dilahirkan di Garut Provinsi Jawa Barat pada tanggal 24 Juli 1973. Penulis merupakan anak ke enam dari tujuh bersaudara dari pasangan Maman B. Achdiat dan Siti Nafisah. Tahun 1991, penulis lulus dari Sekolah Menengah Atas Negeri 1 Ciamis Provinsi Jawa Barat. Pada tahun 1992, penulis menempuh pendidikan sarjana di Program Elektronika Komunikasi, Fakultas Teknologi dan Kejuruan, Universitas Pendidikan Indonesia (UPI) dan lulus pada tahun 1998.