(Elaeis guineensis Jacq.) PADA SISTEM PERENDAMAN SESAAT
CYNTHIA LENDRIA MAGDALENA MARBUN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Embriogenesis Somatik Kelapa Sawit (Elaeis guineensis Jacq.) pada Sistem Perendaman Sesaat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Cynthia Lendria Magdalena Marbun
CYNTHIA LENDRIA MAGDALENA MARBUN. Analisis Embriogenesis Somatik Kelapa Sawit (Elaeis guineensis Jacq.) pada Sistem Perendaman Sesaat. Dibimbing oleh UTUT WIDYASTUTI dan NURITA TORUAN-MATHIUS.
Perbanyakan kelapa sawit melalui embriogenesis somatik masih kurang efisien karena rendahnya persentase pembentukan embrio somatik dan perkecambahan embrio somatik. Tujuan penelitian ini adalah untuk mendapatkan (i) komposisi medium cair terbaik dengan teknik pengocokan, (ii) komposisi medium dan periode perendaman terbaik dengan sistem perendaman sesaat (SPS), (iii) identifikasi pembeda kalus embriogenik dan kalus non embriogenik menggunakan Scanning Electron Microscope (SEM), dan (iv) identifikasi perubahan genetik (off-type) secara in vitro embrio somatik umur 14 bulan menggunakan marka SSR. Bahan tanam yang digunakan adalah kalus embriogenik dari lini S15.355 dan S82.132. Dua jenis medium yang digunakan adalah MSK dan MSD digunakan pada teknik pengocokan, dengan penambahan beberapa vitamin dan asam amino dan kombinasi ZPT 2.4-D sebesar 0; 0.3; 0.6; 0.9 mg/L dengan NAA sebesar 0; 4.0; 8.0 mg/L. Medium MSD0 dan MSD2 digunakan di dalam SPS
dengan frekuensi perendaman setiap 1, 3, dan 6 jam sekali dan direndam selama 3 menit. Identifikasi kalus embriogenik dan kalus non embriogenik menggunakan SEM dan 20 primer mikrosatelit. Hasil penelitian menunjukkan bahwa medium MSD2
merupakan medium terbaik untuk meningkatkan persentase embriogenesis somatik dan pembesaran embrio somatik tanaman kelapa sawit. Selain itu, genotipe yang berbeda menghasilkan rataan proliferasi yang berbeda di dalam komposisi medium dan periode perendaman yang berbeda. Periode perendaman 1, 3, dan 6 jam sekali tidak berbeda nyata dalam rataan berat basah kalus embriogenik untuk lini S15.355 dan S82.132. Kalus embriogenik dan kalus non embriogenik dianalisis menggunakan SEM dan menunjukkan bahwa kalus embriogenik memiliki permukaan yang halus dan mengkilap dibandingkan dengan kalus non embriogenik. Tidak terjadi perubahan genetik (off-type) embrio somatik secara in vitro pada umur 14 bulan menggunakan marka SSR karena 20 primer yang digunakan menunjukkan pola pita dan ukuran pita yang sama antara embrio somatik yang berkecambah dan tidak dapat berkecambah umur 14 bulan
SUMMARY
CYNTHIA LENDRIA MAGDALENA MARBUN. Analysis of Somatic Embryogenesis of oil palm (Elaeis guineensis Jacq.) using Temporary Immersion System. Under direction of UTUT WIDYASTUTI and NURITA TORUAN-MATHIUS.
Micropropagation of oil palm through somatic emrbyogenesis is still not efficient because low percentage of somatic embryo formation and germinating somatic embryo. The objectives of these research are to obtain the best of (i) liquid medium used in shaker technique, (ii) medium and immersion time in Temporary Immersion System (TIS), (iii) to identify the marker of embryogenic callus with Scanning Electron Microscope (SEM) and (iv) to identify genetic changing in vitro (off-type) from 14 months of somatic embryo with Simple Sequence Repeats (SSR). The planting materials were embryogenic callus of embryoid-lines S15.355 and S82.132. Two types of medium consisted of MSK and MSD were tested in shaker technique, with the addition of several vitamines and combination of 0; 0.3; 0.6; 0.9 mg/L 2,4-D with 0; 4.0; 8.0 mg/L NAA. Medium MSD0 and MSD2 were used in TIS with every 1,
3, and 6 hours of immersion time and immersed in 3 minutes. Analysis marker for embryogenic and non embryogenic callus conducted by SEM and molecular marker by 20 microsatellite primers. The results showed that medium MSD2 is the best for
increasing the proliferation of embryogenic callus and enlarging the somatic embryo of oil palm. Besides, types of genotypes gave different proliferation rate in diferrent medium composition and immersion time. The immersion time of 1, 3, and 6 hour showed no significant difference in increasing rate of embryogenic callus fresh weight for embryoid-line S15.355 and S82.132, respectively. Embryogenic callus analysed by SEM showed that embryogenic callus had smoother and lighter surfaces compared with non embryogenic callus. The result of SSR analysis showed that only 10 primers gave polimorphic bands and the others gave monomorphic. There was no genetic changing in vitro (off-type) from 14 months of samples.
© Hak Cipta Milik IPB dan PT. SMART, Tbk., Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
(Elaeis guineensis Jacq.) PADA SISTEM PERENDAMAN SESAAT
CYNTHIA LENDRIA MAGDALENA MARBUN
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Jacq.) pada Sistem Perendaman Sesaat Nama : Cynthia Lendria Magdalena Marbun NRP : P051100041
Disetujui oleh
Komisi Pembimbing
Dr. Utut Widyastuti, M.S Dr. Nurita Toruan-Mathius, M.S, APU
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Bioteknologi
Prof. Dr. Ir. Suharsono, DEA Dr. Ir. Dahrul Syah, M.ScAgr
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2012 sampai bulan Desember 2012 ini ialah Analisis Embriogenesis Somatik Kelapa Sawit (Elaeis guineensis Jacq.) pada Sistem Perendaman Sesaat Menggunakan SEM dan Marka Mikrosatelit.
Terima kasih penulis ucapkan kepada Ibu Dr. Utut Widyastuti, MS selaku Ketua Komisi Pembimbing, Ibu Dr. Nurita Toruan-Mathius, MS selaku Anggota Komisi Pembimbing, Bapak Prof. Dr. Ir. Suharsono, DEA sebagai Ketua Program Studi Bioteknologi, dan Bapak Dr. Miftahudin sebagai Penguji Luar Komisi. Ungkapan terima kasih juga disampaikan kepada PT. SMART, Tbk. yang telah mendanai penelitian ini. Di samping itu, penghargaan penulis sampaikan kepada karyawan di Laboratorium Clonal Technology dan Laboratorium Genomic and Transcriptonomic, Department Biotechnology PT. SMART, Tbk. yang telah membantu penelitian dan pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah (Ir. S. Marbun, MS), ibu (E br Siahaan, BA), adik-adik (Cariny Marbun, SH; Cyrma Marbun, SE; Olny Sufrina, SE; dan Audy Banihara Marbun), seluruh keluarga, dan teman-teman (KPS: Vinha Simamora, Ardi Timbul Saragih, dan Derman Lubis, kos: Fransisca Dhani) atas segala doa, kasih sayang, dan bantuannya sehingga penulis dapat menyelesaikan tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2013
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Botani Kelapa Sawit 4
Perbanyakan Tanaman Kelapa Sawit dengan Teknik Kultur Jaringan 5 Embriogenesis Somatik dan Faktor-faktor yang Mempengaruhi 5 Sistem Perbanyakan Kelapa Sawit Menggunakan Sistem Perendaman Sesaat 8 Identifikasi Morfologi Embrio Somatik dengan SEM 9 Identifikasi Molekuler dengan Marka SSR 9
3 SELEKSI MEDIUM CAIR UNTUK PROLIFERASI KALUS EMBRIOGENIK DENGAN TEKNIK PENGOCOKAN
Pendahuluan 14
Bahan dan Metode 16
Hasil 17
Pembahasan 17
Simpulan 24
4 OPTIMASI TEKNIK SPS UNTUK PROLIFERASI KALUS EMBRIOGENIK TANAMAN KELAPA SAWIT (Elais guineensis Jacq.)
Pendahuluan 26
Bahan dan Metode 27
Hasil 28
Pembahasan 28
Simpulan 34
5 VALIDASI PEMBEDA KALUS EMBRIOGENIK DAN NON EMBRIOGENIK MENGGUNAKAN SCANNING ELECTRON MICROSCOPE (SEM)
Pendahuluan 36
Bahan dan Metode 37
Hasil 38
Pembahasan 38
SAWIT MENGGUNAKAN MARKA SSR
Pendahuluan 48
Bahan dan Metode 49
Hasil 50
Pembahasan 50
Simpulan 54
7 PEMBAHASAN UMUM 55
8 KESIMPULAN UMUM DAN SARAN 59
DAFTAR PUSTAKA 61
LAMPIRAN 63
1 Kombinasi perlakuan medium MSK dan MSD pada seleksi medium cair 15 2 Rataan berat basah kalus embriogenik pada berbagai perlakuan medium 16
DAFTAR GAMBAR
1 Tahapan kultur dan durasi di dalam medium padat dan cair 6
2 Jumlah embrio somatik ≥ 200 µm per 0.1 g pada medium MSK2 dan MSD2
pada pengamatan minggu ke-8 setelah dikulturkan 16 3 Histologi kalus embriogenik pada media MSK2 pada pengamatan minggu
ke-8 setelah dikulturkan 17 4 Histologis kalus embriogenik pada media MSD2 pada pengamatan
minggu ke-8 setelah dikulturkan 18 5 Morfologi koloni kalus embriogenik pada perlakuan medium MSK
menggunakan mikroskop cahaya pada pengamatan minggu ke-8 20 6 Morfologi koloni kalus embriogenik pada perlakuan medium MSD
menggunakan mikroskop cahaya pada pengamatan minggu ke-8 21 7 Rataan berat basah pada lini kalus embriogenik S15.355 dan S82.132
pada pengamatan minggu ke-8 setelah diinkubasi 24 8 Morfologi koloni lini embrioid S82.132 (a,b) dengan ukuran < 200 µm
dan lini embrioid S15.355 (c,d) dengan ukuran > 200 µm pada
pengamatan awal inkubasi 25 9 Rataan berat basah pada medium kontrol (MSK0), MSD0, dan MSD2
pada pengamatan minggu ke-8 26 10 Rataan berat basah pada frekuensi perendaman pada perlakuan kontrol (24 jam)
dan perlakuan SPS (1,3,6 jam) pada pengamatan minggu ke-8 26 11 Rataan berat basah kalus embriogenik pada pengamatan minggu ke-0, 4, dan 8 28 12 Morfologi koloni kalus embriogenik S82.132 berumur 8 minggu setelah
inkubasi di dalam medium MSK0 dan medium MSD0 28
13 Morfologi koloni kalus embriogenik S15.355 berumur 8 minggu setelah
inkubasi di dalam medium MSK0, dan medium MSD0 29
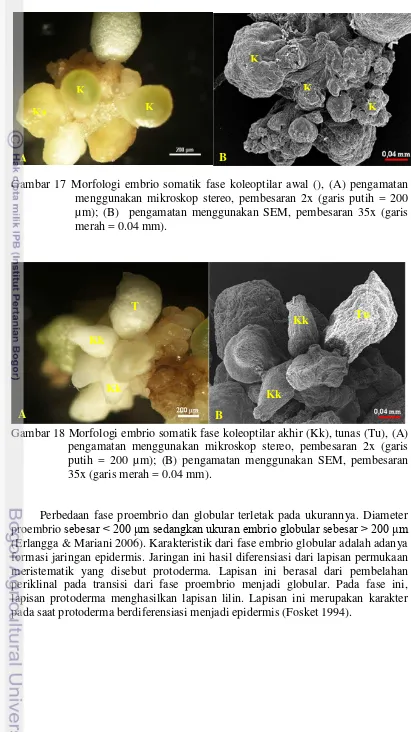
14 Morfologi kalus embriogenik fase nodular (N) 29 15 Morfologi embrio somatik fase globular (G), fase skutelar (SK) 34 16 Morfologi embrio somatik fase koleotilar awal (Ka) 34 17 Morfologi embrio somatik fase koleoptilar akhir (Kk), tunas (Tu) 35 18 Morfologi embrio bergeminasi menghasilkan tunas (Tu) 35 19 Morfologi koloni kalus embriogenik lini S82.132 menggunakan
mikroskop stereo dan SEM pada pengamatan minggu ke-8 setelah subkultur 36 20 Morfologi kalus embriogenik menggunakan SEM 38
21 Morfologi koloni embrio somatik dan embrio bertunas setelah 14 bulan
disubkultur ke dalam medium padat 39 22 Morfologi koloni embrio somatik dan embrio berkecambah 44 23 Pola pita monomorfik dan polimorfik yang terbentuk dari 20 primer
DAFTAR LAMPIRAN
1 Pendahuluan
Latar Belakang
Penyediaan benih kelapa sawit secara komersil dilakukan melalui produksi benih hibrida Tenera yang merupakan hasil persilangan tetua terpilih (betina-Dura dengan jantan-Pisifera). Sehubungan dengan tanaman kelapa sawit yang secara komersil diperbanyak menggunakan biji maka ditemukan keragaman sifat yang cukup besar, serta diperlukannya waktu persilangan yang cukup lama (15 s/d 20 tahun) untuk mendapatkan varietas unggul. Kendala tersebut dapat diatasi dengan menggunakan teknologi perbanyakan vegetatif secara klonal (Soh et al. 2006).
Teknologi perbanyakan vegetatif tanaman kelapa sawit dengan kultur jaringan untuk pertama kali dilakukan pada tahun 70-an (Jones 1974). Namun, sejauh ini produksi klonal kelapa sawit dengan kultur jaringan berbasis pembentukan kalus embriogenik umumnya sangat tidak efisien. Hal ini disebabkan perkembangan kalus menjadi kalus embriogenik dan persentase penggandaan embrioid relatif rendah. Keadaan ini menyebabkan produksi ramet juga rendah (Konan et al. 2006). Untuk meningkatkan efisiensi produksi embrio somatik telah dilaporkan hasil modifikasi komposisi medium, penggunaan berbagai jenis zat pengatur tumbuh, sumber eksplan, dan bentuk fisik medium dengan tujuan meningkatkan laju penggandaan embrio somatik. Namun, dilaporkan hasil yang diperoleh belum optimum untuk skala industri (Soh et al. 2009).
Tahap induksi kalus dan embriogenesis merupakan titik kritis dalam perbanyakan kelapa sawit melalui kultur jaringan. Rendahnya persentase embriogenesis somatik dan regenerasi embrio somatik menjadi ramet merupakan kendala utama dalam industri bibit klonal kelapa sawit (Rohani et al. 2000, Konan
et al. 2006). Hal ini menyebabkan produksi klonal kelapa sawit dengan kultur jaringan membutuhkan biaya yang tinggi. Untuk meningkatkan efisiensi produksi khususnya untuk penggandaan embrio somatik telah banyak dilakukan penelitian di antaranya modifikasi komposisi dan bentuk fisik medium, penggunaan berbagai jenis zat pengatur tumbuh dan sumber eksplan (Soh et al. 2009).
Teknologi perbanyakan tanaman kelapa sawit dengan kultur jaringan umumnya menggunakan medium padat. Penggunaan medium padat dianggap tidak efisien dalam hal tingkat produksi planlet, penggunaan tenaga kerja, dan pemakaian ruang (Soh et al. 2006). Salah satu cara untuk mengatasi kelemahan penggunaan medium padat adalah penggunaan medium cair (Aitken-Christie 1991). Sistem ini dapat menyediakan kondisi kultur yang lebih seragam, memudahkan penggantian medium, dan dapat menggunakan tempat yang lebih besar daripada medium padat. Namun, teknik kultur cair memiliki beberapa kelemahan di antaranya sel-sel mengalami kekurangan oksigen, dapat merusak sel, serta kemungkinan dapat menyebabkan vitrifikasi. Untuk mengatasi masalah tersebut telah dikembangkan Sistem Perendaman Sesaat (SPS) atau Temporary Immersion System (TIS) (Sumaryono et al. 2007).
waktu perendaman eksplan yang diinginkan. Keunggulan SPS adalah eksplan tidak mengalami kekurangan oksigen, terjadi pencampuran medium dan eksplan cukup merata, serta membatasi efek agitasi (Teisson et al. 1999). SPS juga telah dikembangkan untuk perbanyakan tanaman kelapa sawit (Sumaryono et al. 2007). Di samping bentuk fisik medium, yaitu medium padat dan medium cair, komponen penyusun medium juga berperan penting dalam induksi dan perkembangan kalus.
Secara visual umumnya akan mengalami kesulitan untuk membedakan kalus yang berpotensi berkembang menjadi kalus embriogenik dan kalus yang tidak memiliki kemampuan membentuk embrio somatik. Perkembangan embrio somatik dapat dipelajari secara visual dengan mengamati perubahan morfologi menggunakan Scanning Electron Microscope (SEM). Proses terbentuknya dinding sel pada proembrio kelapa sawit telah diamati menggunakan SEM, seperti tahapan terbentuknya dinding sel lama, sebelum dan setelah pengeluaran matriks ekstraselular, dan akhirnya terbentuk dinding yang baru. Protoderma dan kristal lilin yang terbentuk pada embrio somatik fase globular kelapa sawit. Bagian ini sangat penting dalam proses diferensiasi epidermis embrio (Erlangga & Mariani 2006).
Pendekatan lainnya dapat dilakukan dengan memanfaatkan teknik marka molekuler diantaranya mikrosatelit atau Single Sequence Repeat (SSR). Hatorangan et al. (2010) telah berhasil membangun sistem pendataan identitas seluruh ortet sumber eksplan dengan marka DNA berdasarkan mikrosatelit, di samping data-data fenotipik dari lapang. Primer mikrosatelit mampu mengidentifikasi kalus embriogenik dan embrio somatik pada berbagai umur kultur sehingga akan didapatkan data-data mengenai perubahan morfologi ( off-type) yang terjadi pada proses perbanyakan in vitro.
Sebanyak lebih dari 400 pasang primer mikrosatelit yang berkaitan dengan karakter-karakter agronomi penting pada tanaman kelapa sawit telah dipublikasikan (Billotte et al. 2001; Hairinsyah 2010; dan Nchu 2010). Keunggulan marka mikrosatelit di antaranya persentase polimorfik yang tinggi, bersifat kodominan, kemampuan diskriminatif, dan biaya yang kompetitif apabila dibandingkan dengan marka lainnya (Singh et al. 2007).
Tujuan Penelitian
Manfaat Penelitian
Manfaat dari hasil penelitian yang diperoleh adalah tersedianya teknik penggandaan embrio somatik dengan medium cair dan teknik SPS yang akan meningkatkan persentase terbentuknya embrio somatik. Hal ini akan meningkatkan efisiensi teknik kultur jaringan untuk menghasilkan embrio somatik pada tanaman kelapa sawit dan produksi ramet.
Dari hasil diperolehnya identifikasi morfologi kalus embriogenik dan kalus non embriogenik menggunakan SEM diharapkan akan meningkatkan efisiensi deteksi dini kalus embriogenik dan kalus non embriogenik serta identifikasi perubahan genetik embrio somatik umur 14 bulan tanaman kelapa sawit menggunakan marka mikrosatelit.
Bagan Alir Kegiatan Penelitian
I. I. Seleksi Medium Cair Untuk Proliferasi Kalus Embriogenik Tanaman Kelapa Sawit dengan Teknik Pengocokan
Tujuan: Memperoleh medium cair terbaik untuk proliferasi embrio somatik dengan teknik pengocokan
Output: Medium cair terbaik untuk proliferasi embrio somatik dengan teknik pengocokan
II. Optimasi Teknik SPS untuk Proliferasi Kalus Embriogenik Tanaman Kelapa sawit
Tujuan: Komposisi medium dan periode perendaman dengan teknik SPS untuk meningkatkan proliferasi kalus embrionik Output: Medium terbaik dan periode perendaman terbaik menggunakan SPS untuk proliferasi kalus embrionik
III. Identifikasi Pembeda Kalus Embriogenik dan Non Embriogenik Tanaman Kelapa Sawit Menggunakan SEM
Tujuan: Mendapatkan pembeda kalus embriogenik dan kalus non embriogenik secara morfologi
Output: Pembeda morfologi kalus embriogenik dan kalus non embriogenik
IV. Identifikasi Perubahan Genetik Embrio Somatik Tanaman Kelapa Sawit Menggunakan Marka SSR
Tujuan: identifikasi perubahan genetik (off-type) secara in vitro
2 TINJAUAN PUSTAKA
Botani Kelapa Sawit
Kelapa sawit (Elaeis guineensis Jacq.) berasal dari daerah yang terletak antara Guinea dan Angola di Afrika Barat. Elaeis berasal dari bahasa Yunani
elaion yang berarti minyak dan guineensis yang menunjukkan tempat asalnya, yaitu di pantai Guinea. Terdapat empat bibit kelapa sawit ditanam di Kebun Raya Bogor. Dua dari empat bibit tersebut diintroduksi dari Bourbon atau Mauritius pada Februari 1848 dan bibit lainnya diintroduksi dari Amsterdam pada Maret 1848 (Pamin 1998). Genus Elaeis memiliki empat spesies yang telah dideskripsikan, yaitu E. guineensis, E. oleifera, E. odora, dan E. madagascariensis. E. oleifera dan E. odora dapat dijumpai di Amerika Selatan, sedangkan E. guineensis dan E. madagascariensis berasal dari Afrika (Latiff 2000).
Kelapa sawit merupakan tanaman berumah satu, bunga jantan dan betina terpisah tetapi masih berada dalam satu pohon. Tanaman ini termasuk tanaman monokotil, akar terdiri dari akar primer, sekunder, tersier, dan kuarter. Akar merupakan akar serabut yang sebagian besar berada dekat tanah dengan kedalaman 15-30 cm. batangnya tegak tidak bercabang berdiameter 40-75 cm, tinggi batang dalam pembudidayaan tidak lebih dari 15-18 m. Daunnya majemuk dengan pelepah daun tersusun melingkari batang berbentuk spiral. Panjang pelepah daun mencapai 9 m, panjang helaian daun mencapai 1.2 m dengan jumlah 100-160 pasang (Hartley 1987). Klasifikasi kelapa sawit sebagai berikut:
Divisi : Spermatophyta Sub divisi : Angiospermae
Kelas : Monocotyledonae Keluarga : Palmaceae
Sub keluarga : Cocoideae Genus : Elaeis
Spesies : Elaeis quineensis Jacq.
Kelapa sawit tumbuh baik pada iklim tropis dengan rataan suhu minimum 20-23°C dan suhu maksimum 28-32°C, curah hujan sebanyak 2.000 mm/tahun, serta panjang penyinaran minimum lima jam perhari. Kelembaban atmosfir dan konsentrasi CO2 yang tinggi juga menjadi faktor penting untuk pertumbuhan kelapa sawit. Kelapa sawit dibudidayakan pada lahan dengan topografi datar pada ketinggian lahan 0-600 mdpl. Kelapa sawit dapat tumbuh pada rentang pH tanah 4.0-6.5 dengan pH optimum pada 5.0-5.5 (Henson & Chang 2000).
Ada tiga kelompok kelapa sawit komersial yang dikenal, yaitu Dura, Pisifera, dan Tenera. Pengelompokan ini didasarkan pada ketebalan cangkang biji yang merupakan pewarisan monogenik. Kelompok Dura memiliki cangkang tebal dengan ketebalan 2-8 mm, kandungan mesokarp rendah sampai menengah (35-55%), dan di bagian luar tidak terdapat lingkaran sabut. Tenera memiliki ketebalan cangkang 0,5-4,0 mm dengan kandungan mesokarp menengah sampai tinggi (60-96%), dan terdapat lingkaran sabut pada bagian luarnya. Kelompok Pisifera memiliki cangkang sangat tipis atau bahkan tidak ada, bunga betina steril, buah gugur premature, serta memiliki seks rasio (betina:jantan) lebih tinggi dibandingkan dengan Dura dan Tenera (Corley & Tinker 2003).
Tanaman kelapa sawit dapat diperbanyak secara generatif melalui benih maupun secara vegetatif melalui kultur jaringan. Pada umumnya kelapa sawit diperbanyak dengan benih yang berasal dari hasil penyerbukan Dura x Pisifera (DxP). Tetua Dura elit berasal dari populasi persilangan DxD, sedangkan tetua Pisifera diperoleh dari segregasi yang terjadi pada persilangan Tenera x Tenera (TxT) atau Tenera x Pisifera (TxP). Dura dan Tenera dipelihara dan diseleksi masing-masing berdasarkan skema seleksi silang balik (Kushairi & Rajanaidu 2000).
Perbanyakan Tanaman Kelapa Sawit dengan Teknik Kultur Jaringan
Proses produksi bibit klonal kelapa sawit melalui embriogenesis somatik terdiri dari lima tahapan, mencakup seleksi ortet dan penyiapan sumber eksplan, induksi kalus dari eksplan daun, embriogenesis somatik dan proliferasi embrio, induksi tunas dan akar, dan aklimatisasi ramet.
Tahapan seleksi ortet dilakukan di lapang dengan bantuan Departemen Pemuliaan kelapa sawit PT. SMART, Tbk. Seleksi dilakukan berdasarkan keunggulan sifat agronomis terutama daya hasil produksi minyak pada tingkat individu.
Inokulasi eksplan dilakukan menggunakan daun muda dan diinokulasi pada medium untuk induksi kalus. Eksplan dikulturkan di dalam ruang gelap sampai membentuk kalus dan embrio somatik. Suhu udara di ruang kultur dikontrol pada 28±20C dengan kelembaban udara di bawah 60% (Rohani 2001).
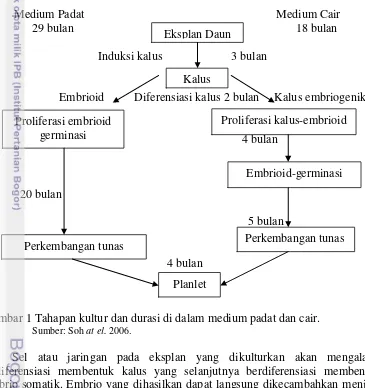
Menurut Soh et al. (2006), perbanyakan kelapa sawit dengan teknik kultur jaringan menggunakan medium padat selama 29 bulan dan medium cair selama 18 bulan (Gambar 1). Induksi kalus yang berasal dari eksplan daun selama 3 bulan dilanjutkan dengan diferensiasi kalus menjadi embrioid selama 2 bulan. Proliferasi embrioid di dalam medium padat sampai tahap perkembangan tunas selama 20 bulan sedangkan di dalam medium cair selama 9 bulan. Tahap selanjutnya adalah perkembangan tunas menjadi planlet selama 4 bulan kemudian ramet dipindahkan ke rumah kaca untuk aklimatisasi.
Embriogenesis Somatik dan Faktor-faktor yang Mempengaruhi
dapat dihasilkan melalui media padat dan cair. Keuntungan embriogenesis somatik yang digunakan untuk perbanyakan kelapa sawit telah terbukti berhasil (Jones 1974; Pierik 1997) dan dapat menghasilkan klon-klon homogen yang memiliki produktivitas yang homogen.
Embriogenesis somatik merupakan proses pembentukan embrio yang berasal dari sel-sel somatik. Embrio memiliki stuktur bipolar yang akan membentuk bagian atas menjadi calon tunas dan bagian bawah menjadi calon akar (Mariani et al. 1998). Proses ini juga melibatkan serangkaian perubahan morfologi dan biokimia sehingga membentuk stuktur embrio somatik dan dapat terjadi pada jaringan meristematik yang diinduksi dengan penambahan zat pengatur tumbuh pada konsentrasi tertentu ke dalam media kultur jaringan.
Medium Padat Medium Cair
Gambar 1 Tahapan kultur dan durasi di dalam medium padat dan cair. Sumber: Soh at el. 2006.
Sel atau jaringan pada eksplan yang dikulturkan akan mengalami dediferensiasi membentuk kalus yang selanjutnya berdiferensiasi membentuk embrio somatik. Embrio yang dihasilkan dapat langsung dikecambahkan menjadi planlet, ataupun digunakan sebagai eksplan untuk membentuk embrio somatik tambahan melalui embrio somatik sekunder. Produksi embrio somatik sekunder dapat diulang sampai beberapa kali, terutama untuk tanaman dengan persentasi embriogenesis rendah (Perez-nunez et al. 2006).
Embriogenesis diklasifikasikan menjadi dua jalur perkembangan, yaitu embriogenesis langsung dan tidak langsung. Pada jalur embriogenesis langsung, eksplan langsung membentuk embrio tanpa pembentukan kalus. Sedangkan pada jalur embriogenesis tidak langsung eksplan membentuk kalus lalu kalus akan
berdiferensiasi menjadi embrio somatik. Sel yang berdiferensiasi menjadi embrio somatik disebut sel embriogenik (Chawla 2002). Embriogenesis somatik dimulai dengan pembelahan sel-sel asimetrik yang memberikan perkembangan menjadi sebuah embrio polar yang memiliki sebuah sel basal yang lebih besar dan sel apikal yang lebih kecil. Embrio berkembang dari sel apikal, dan sel basal berkembang menjadi suspensor (Eckardt 2006).
Embriogenesis somatik pada tanaman monokotil berbeda dan lebih kompleks dibandingkan dengan tanaman dikotil. Morfologi dan perkembangan embrio somatik hampir sama dengan embrio zigotik. Pada tanaman monokotil, eksplan yang mengandung sel embriogenik dapat langsung berkembang menjadi struktur embrio melalui tahap perkembangan fase globular, skutelar berbentuk hati, dan kotiledon (Gocbole et al. 2002, Quiroz-Figueroa et al. 2006), sedangkan tahapan perkembangan embrio somatik tanaman dikotil mencakup tahap globular, hati, torpedo, dan kotiledon (Mandal & Gupta 2002).
Secara fenotipik kalus embriogenik kelapa sawit terdiri atas kelompok atau rumpun sel dengan perbedaan yang jelas pada struktur nodular atau granular, kompak, dan remah. Pengamatan histologi memperlihatkan adanya struktur proembrio pada jaringan ini. Proembrio memiliki sel dengan rasio inti/sitoplasma tinggi, inti utama besar, sitoplasma padat, dan pembelahan daerah internal terlihat jelas (Rohani et al. 2000).
Beberapa faktor yang mempengaruhi respon embriogenesis tanaman, yaitu kendali genetik, kondisi fisiologi tanaman donor, organ tanaman yang digunakan sebagai sumber eksplan, media kultur jaringan, zat pengatur tumbuh, dan interaksi faktor-faktor tersebut (Henry et al. 1994). Regenerasi kelapa sawit melalui embriogenesis somatik dipengaruhi oleh beberapa faktor, yaitu konsentrasi auksin 2,4-D, jenis dan konsentrasi bahan kimia osmotik dan perlakuan pelukaan (Chawla 2002).
Sumber eksplan merupakan faktor yang sangat penting dalam kultur jaringan tanaman. Beberapa sumber eksplan yang telah digunakan berupa daun muda (Te-chato et al. 1998), kalus embrio zigotik (Chehmalee dan Te-chato 2007), kecambah, akar, dan bunga (Teixeira et al. 1994). Umumnya perbanyakan tanaman palmae secara kultur jaringan menggunakan daun sebagai sumber eksplan (Rohani et al. 2000). Sel-sel dibagian daun bersifat meristematis dan memiliki tingkat diferensiasi jaringan paling kecil (Ruslan 1993). Eksplan daun juga memberikan persentase kloning lebih tinggi dibandingkan dengan eksplan dari bunga. Kalus dari daun juga lebih vigor dan embriogenik dibandingkan dengan kalus yang berasal dari akar (Rohani et al. 2000).
Persentase embriogenesis somatik pada tanaman kelapa sawit rendah. Hal ini kemungkinan dipengaruhi oleh faktor genotipe (Ruslan 1993). Walaupun hampir semua ortet mampu membentuk kalus namun rasio eksplan membentuk kalus berbeda nyata di antara klon. Perbedaan rasio pembentukan kalus ini juga terjadi dengan keragaman yang cukup tinggi dalam persilangan yang sama atau keragaman pada tingkat progeni (Rohani et al.2000).
28±2°C. Suhu yang lebih rendah dengan kisaran 15-20°C cenderung menghambat pertumbuhan dan multiplikasi embrio somatik (Rohani et al. 2000).
Sel-sel eksplan akan mencapai tahap kompeten untuk mengalami embriogenesis pada saat zat pengatur tumbuh serta senyawa biokimia endogen lainnya berada pada konsentrasi tertentu. Saat konsentrasi tersebut tercapai, sel-sel eksplan akan memperoleh kompetensi embriogenik yang selanjutnya akan cenderung mengarah ke proses morfogenesis embriogenik (Issali et al. 2010). Pengaruh suhu rendah pada tanaman gandum mengakibatkan penundaan sintesis IAA dan ABA pada tanaman donor yang kemudian dapat meningkatkan kapasitas embriogenesis (Hess & Carman 1998).
Sistem Perbanyakan Kelapa Sawit melalui Kultur Jaringan
Kultur jaringan merupakan teknik perbanyakan sel atau jaringan tanaman menggunakan media steril yang mengandung nutrisi dan zat pengatur tumbuh sehingga dapat bermultiplikasi dan berkembang menjadi tanaman utuh di dalam tabung steril. Perbanyakan tanaman kelapa sawit secara kultur jaringan terdiri dari beberapa tahapan, yaitu pemilihan dan perlakuan eksplan, induksi kalus, pembentukan dan proliferasi embrio, pembentukan tunas, induksi perakaran, aklimatisasi ramet (Lim et al. 1999; Ginting & Fatmawati 1996). Proses perbanyakan sampai dengan tahap pengakaran ramet memerlukan waktu sampai dengan 45 bulan (Rohani et al. 2000), dan umumnya dilakukan pada medium padat (Corley et al. 1977 dan Soh et al. 2006).
Penggunaan medium padat dianggap tidak efisien dalam hal tingkat produksi planlet, penggunaan tenaga kerja, dan pemakaian ruang (Soh et al. 2006). Kelemahan penggunaan medium padat tersebut dapat diatasi melalui penggunaan medium cair yang sangat ideal untuk mikropropagasi, terutama untuk menurunkan biaya produksi dan otomatisasi (Aitken-Christie 1991). Sistem ini dapat menyediakan kondisi kultur yang lebih seragam, memudahkan penggantian medium, dan dapat menggunakan wadah yang lebih besar daripada medium padat. Penelitian pada kelapa sawit menggunakan medium cair telah banyak dilakukan (de Touchet et al. 1991, Duval et al. 1993, Sumaryono et al. 1994, Teixeira et al. 1995, Ginting dan Fatmawati 1997; Tahardi 1998).
Penggunaan medium cair juga memiliki beberapa kelemahan, yaitu sel-sel mengalami kekurangan oksigen dan dapat rusak serta kemungkinan adanya vitrifikasi. Untuk dapat mengatasi masalah ini, mulai ditemukan teknik baru, yaitu
Temporary Immersion System (TIS) atau Sistem Perendaman Sesaat (SPS). Sistem ini mempunyai prinsip serupa dengan bioreaktor, yaitu kontak antara eksplan dengan medium terjadi secara periodik dan tidak terus-menerus. Kelebihan sistem ini, yaitu eksplan tidak mengalami kekurangan oksigen, terjadi pencampuran yang cukup merata, dan biaya relatif rendah (Teisson et al. 1999). Teknik ini telah dikembangkan pada banyak tanaman, seperti kopi (Berthouly et al. 1995), karet (Etienne et al. 1997), pisang (Alvard et al. 1993), jeruk (Cabasson
et al. 1997), nenas (Escalona et al. 1999), cokelat (Nicolas et al. 2005), sagu (Kasim & Sumaryono 2008), dan untuk kelapa sawit (Tahardi 1998; Sumaryono
periode perendaman 6 jam sekali dan waktu perendaman selama 3 menit (Sumaryono et al. 2007).
Identifikasi Morfologi Embrio Somatik dengan SEM
Observasi perkembangan embrio somatik menggunakan mikroskop stereo hanya memberikan informasi mengenai perubahan bentuk. Sedangkan observasi menggunakan SEM dapat menunjukkan informasi yang rinci mengenai perubahan permukaan embrio somatik selama perkembangannya (Mariani et al. 1998). Penggunaan SEM digunakan oleh Sato et al. (2001) untuk mengamati perubahan permukaan kalus padi yang diberi perlakuan enzim pendegradasi dinding sel.
Taylor et al. (1996) mengamati ultrastruktur dari perkembangan embrio somatik dari Pennisetum glaucum menggunakan SEM untuk membandingkan ultrastruktur embrio zigotik dari spesies yang sama. Erlangga dan Mariani (2006) menemukan bahwa terdapat lapisan protoderma dan lapisan lilin pada embrio somatik kelapa sawit yang sangat berhubungan dengan diferensiasi epidermis. Selain itu, terdapat juga suspensor yang tidak berkembang yang disebut jaringan supra embriogenik pada embrio somatik kelapa sawit fase globular.
Penelitian Yusoff et al. (2012) menemukan adanya struktur seperti fibrin pada lapisan epidermis dinding sel eksplan daun kelapa sawit pada pengamatan menggunakan mikroskop elektron. Struktur ini berasosiasi dengan matriks ekstraseluler atau matriks ekstraseluler jaringan permukaan.
Matriks ini hanya ditemukan pada beberapa kalus yang sedang berkembang. Matriks ini juga ditemukan pada kalus Cocos nucifera (Verdeil et al. 2001),
Brassica napus (Namasivayam et al. 2006), dan Triticum aestivum (Pilarska et al.
2007) dan adanya matriks ini berhubungan dengan kompetensi embriogenik dan morfogenik (Namasivayam 2007). Matriks ini dapat berupa protein arabinogalaktan, pektin, dan lipid. Komponen ini berperan dalam proliferasi selular, adhesi sel, dan komunikasi sel pada proses embriogenik dan perkembangan embrio (Namasivayam et al. 2006; Pilarska et al. 2007; Blehova et al. 2010).
Identifikasi Molekuler dengan Marka SSR
Marka molekuler dikenal sebagai sidik jari DNA karena mengacu pada pita polimorfisme yang berupa fragmen DNA. Keunggulan dari marka ini, adalah (i) keakuratan yang tinggi dan tidak dipengaruhi oleh lingkungan mempengaruhi ekspresi gen, (ii) dapat diuji pada semua tingkat perkembangan tanaman, (iii) pada pengujian ketahanan hama dan penyakit tidak bergantung pada organism penggangu tersebut, dan (iv) seleksi pada tingkat genotipe ini dapat mempercepat proses seleksi dan hemat pada pengujian selanjutnya di lapang (Kasim et al.
2004).
Pemulia menggunakan marka molekuler untuk mengidentifikasi genotipe, galur, varietas, dan kultivar untuk melihat kemurnian benih, memecahkan ketidakpastian tetua, juga untuk perlindungan varietas tanaman yang dikembangkan melalui identifikasi individu. Marka molekuler ini juga telah dikembangkan pada tanaman kelapa sawit, yaitu untuk identifikasi klon tanaman, khususnya untuk menentukan genotipe antara klon hasil kultur jaringan dengan ortet atau tanaman turunannya. Selain itu juga dapat digunakan sebagai kontrol kualitas untuk memastikan tidak terjadi percampuran klon yang dihasilkan di laboratorium saat harus memproduksi dalam jumlah banyak (Hairinsyah 2010).
Marka SSR atau disebut juga marka mikrosatelit merupakan sekuen DNA bermotif pendek dan berulang secara tandem. Pengulangan berulang dua, tiga, empat, dan lima unit nukleotida yang tersebar disepanjang genom eukariot (Powell et al. 1996). Variasi jumlah pengulangan untuk suatu batasan lokus di antara genotip yang berbeda dengan mudah dapat dideteksi dengan teknik PCR. Teknik PCR pada SSR hanya menggunakan DNA dalam jumlah kecil dengan daerah amplifikasi yang kecil, yaitu sekitar 100-300 pb dari genom. SSR juga dapat diaplikasikan tanpa merusak bahan tanaman karena hanya sedikit saja yang digunakan dalam ekstraksi DNA atau dapat menggunakan bagian lain, seperti biji atau serbuk sari.
Amplifikasi berdasarkan PCR menunjukkan bahwa SSR pada kelapa sawit memiliki tingkat polimorfisme yang tinggi sehingga marka ini memiliki kelebihan yang dapat diandalkan, dapat diulang, dan biaya kompetitif apabila dibandingkan dengan marka yang lain (Singh et al 2007). Marka ini juga dapat digunakan untuk studi genetik karena adanya kemudahan SSR dalam mengamplifikasi dan mendeteksi fragmen-fragmen DNA serta tingginya tingkat polimorfisme yang dihasilkan. Selain itu, marka SSR juga dapat diaplikasikan untuk mempelajari keragaman genetik, identifikasi plasma nutfah, studi evolusi, identifikasi kultivar, pengujian progeni, dan gene tagging (Billotte et al. 2005).
Sekuen SSR pendek sehingga secara efisien dapat diamplifikasi menggunakan PCR dengan sekuen pengapitnya sebagai primer. Variasi jumlah ulangan mikrosatelit dapat dideteksi menggunakan elektroforesis pada suatu gel dengan standar sekuen yang dapat memisahkan fragmen dengan perbedaan setara dengan satu nukleotida (Rohrer et al. 1994).
Deteksi perubahan genetik secara in vitro (off-type) digunakan untuk mengeliminasi variasi vegetatif pada tanaman klonal kelapa sawit yang ditanam di lapang. Teknik perbanyakan dengan kultur jaringan akan menghasilkan tanaman klonal yang secara genetik sama dengan induknya, baik secara in vitro maupun ex vitro. Tanaman klonal yang ditanam di lapang akan memiliki morfologi dan genetik yang seragam sehingga diharapkan tidak terjadi abnormalitas di lapang. Marka mikrosatelit dapat digunakan untuk menganalisis perubahan genetik kalus embriogenik dan embrio somatik berbagai umur tanam sehingga dapat digunakan sebagai deteksi dini kultur abnormalitas.
3 SELEKSI MEDIUM CAIR UNTUK PROLIFERASI
KALUS EMBRIOGENIK DENGAN TEKNIK PENGOCOKAN
Abstrak
Salah satu kendala yang dihadapi dalam pemanfaatan teknologi kultur jaringan pada tanaman kelapa sawit untuk skala industri adalah persentase pembentukan kalus embriogenik melalui kalus yang masih rendah. Tujuan penelitian ini adalah untuk mendapatkan medium yang mampu meningkatkan persentase kalus embriogenik, memperbesar kalus embriogenik, dan mempelajari histologis kalus embriogenik. Dicobakan medium MS (MSK) dan MS diperkaya (MSD) dengan biotin 0.2 mg/L, D-Ca-pantotenat 1.2 mg/L, asam askorbat 1.8 mg/L, kolin klorida 1.4 mg/L, L-sistein-HCL 19.0 mg/L, dan alanin 5.0 mg/L. Medium yang diuji ditambahkan 2.4-D dengan taraf 0.0; 0.3; 0.6 dan 0.9 mg/L masing-masing berkombinasi dengan NAA dengan taraf 0.0; 4.0 dan 8.0 mg/L pada sistem medium cair dengan pengocokan. Bahan tanam yang diuji adalah kalus embriogenik fase nodular lini S82.132. Secara histologis juga dipelajari struktur histologi kalus embriogenik dari medium kontrol dan medium terbaik. Hasil yang diperoleh menunjukkan bahwa medium MSD2 yang ditambahkan
2.4-D 0.9 mg/L dan NAA 4.0 mg/L dan diperkaya dengan vitamin dan alanin menghasilkan rataan berat basah kalus embriogenik tertinggi berdasarkan jumlah dan ukuran. Medium ini dapat memperbesar kalus embriogenik sampai ukuran 600 µm dan dapat meningkatkan persentase regenerasi kalus embriogenik.
Kata kunci: Elaeis guieensis Jaqc, kalus embriogenik, medium cair, 2.4-Dichloro phenoxy acetic acid, Naphtalenic Acetic Acid.
Abstract
calluses of S82.132 used as explants. Histology analysis had been used to study the histology of embryogenic callus from control and the best medium. The result showed that MSD2 medium with 0.9 mg/L 2.4-D and 4.0 mg/L NAA also
enriched with vitamins and alanine gave the highest rate of embryogenic callus fresh based on number and size of embryogenic callus. This medium can increase the size of embrogenic callus until 600 µm and increase the regeration percentage of embryogenic callus.
Key words: Elaeis guieensis Jaqc, embryogenic callus, liquid medium, 2.4-Dichlorophenoxy acetic acid, Naphtalene Acetic Acid.
Pendahuluan
Pemanfaatan kultur jaringan tanaman kelapa sawit ditujukan untuk meningkatkan produksi minyak yang dapat dibuktikan dengan meningkatnya produksi sampai 30% dibandingkan dengan produksi tanaman komersil Dura ×
Pisifera (D×P) dalam skala uji lapang (Cochard et al. 1999; Wahid et al. 2005). Perbanyakan kelapa sawit dengan kultur jaringan masih kurang efisien karena membutuhkan proses yang panjang dan waktu yang lama. Dari seluruh eksplan yang dikulturkan hanya 15% menghasilkan kalus dan dari kalus yang dihasilkan hanya 3% yang menghasilkan embrio somatik (Soh et al. 2006).
Pembentukan kalus dan embrio somatik masih merupakan masalah utama dalam kultur jaringan tanaman kelapa sawit. Laju pembentukan kalus pada eksplan tanaman kelapa sawit masih rendah, sekitar 19% (Corley 2003). Hal yang sama juga dilaporkan oleh Wooi (1995) bahwa rataan laju embriogenesis daun menjadi kalus berkisar antara 3% sampai 6%.
Kultur jaringan tanaman kelapa sawit umumnya diinisiasi dari daun muda dalam media induksi kalus. Kalus berbentuk nodular tampak di sepanjang bekas potongan yang menyebabkan terlukanya tulang daun (Rohani 2000). Sebagian kalus tetap kompak dan nodular kalus akan berkembang melalui embriogenesis (Rohani 2000; Kanchanapoom & Domyoas 1999).
Proses selanjutnya adalah pembentukan embrio somatik dan pendewasaan embrio, regenerasi tunas, perakaran, dan fase akhir pembentukan planlet baru. Namun, kalus juga dapat mengalami rediferensiasi membentuk kalus dengan struktur lunak, granular, jaringannya transparan, dan tidak mempunyai potensi embriogenik. Jaringan ini disebut kalus non embriogenik dan akan tetap sebagai kalus yang tidak mampu beregenerasi menjadi planlet baru (Kanchanapoom & Domyoas 1999).
Embriogenesis somatik (ES) adalah proses sel somatik dalam kondisi induksi menghasilkan sel embriogenik yang akan berkembang melalui beberapa tahap perubahan morfologi dan biokimia yang menghasilkan struktur bipolar tanpa adanya hubungan jaringan dengan jaringan asalnya (Quiróz-Figueroa et al. 2006).
sel-sel embriogenik, dan d) konversi embrio menjadi embrio dewasa yang memiliki kemampuan beregenerasi menjadi planlet.
Tahapan induksi, maturasi, dan germinasi embrio somatik dapat dipengaruhi oleh berbagai faktor, yaitu jenis media, vitamin, asam amino, zat pengatur tumbuh diantaranya auksin dan sitokinin (Vasanth et al. 2006; Asad et al. 2009). Pada tahap induksi kalus dan perkembangan kalus menjadi kalus embriogenik yang diikuti dengan perkecambahan embrio menjadi planlet umumnya dilakukan dalam medium padat.
Penggunaan medium padat dianggap kurang efisien untuk digunakan dalam perbanyakan skala komersil karena akan menghasilkan embrio somatik pada berbagai fase mulai dari fase nodular, globular, skutelar, bahkan koleotilar. Hal ini berhubungan dengan kontak embrio somatik dengan medium perlakuan. Hanya bagian bawah dari embrio somatik yang bersentuhan langsung dengan medium perlakuan. Medium padat masih kurang efisien dalam meningkatkan persentase kalus embriogenik. Untuk mengatasi masalah ini digunakan medium cair (Wong
et al. 1999).
Medium cair lebih efisien digunakan dalam perbanyakan skala komersil. Fase kalus embriogenik yang umumnya dikulturkan di dalam medium cair adalah fase nodular. Fase ini digunakan karena sel-selnya masih bersifat meristematik sehingga potensi pembelahan sel masih tinggi dan dapat meningkatkan persentase kalus embriogenik. Kalus embriogenik yang dikulturkan di dalam medium cair akan lebih seragam baik dalam ukuran maupun perkembangan embrio karena seluruh permukaan kalus embriogenik akan bersentuhan langsung dengan medium perlakuan yang mengandung auksin 2.4-D sehingga dapat meningkatkan persentase kalus embriogenik (Wong et al. 1999).
Medium cair juga digunakan dalam upaya meningkatkan produktivitas kultur tanaman kelapa sawit untuk tujuan komersil (de Touchet et al. 1991, Duval
et al. 1993, Sumaryono et al. 1994, Teixeira et al. 1995, Ginting & Fatmawati 1997, Tahardi 1998). Produktivitas penggunaan medium cair dapat ditingkatkan dengan penambahan asam amino.
Asam amino merupakan salah satu sumber nitrogen organik yang berperan dalam induksi pembentukan kalus, regenerasi tunas adventif, embriogenesis, dan androgenesis eksplan (Vasanth et al. 2006; Patil et al. 2009; Gantait et al. 2010). Beberapa jenis asam amino yang umum ditambahkan ke dalam medium, yaitu alanin, arginin, asparagin, sistein, glutamin, glisin, leusin, isoleusin, lisin, metionin, ornitin, fenilalanin, prolin, serin, teronin, triptofan, tirosin, dan valin (Ogita et al. 2001; Ashok-Kumar & Murthy 2004). Selain asam amino, penambahan vitamin juga mampu meningkatkan produktivitas kultur.
Pullman et al. (2005) menyatakan bahwa kombinasi MES, biotin, dan asam folat efektif meningkatkan inisiasi jaringan embriogenik pada tanaman Douglas Fir dan Pinus taeda. Vitamin B12, vitamin E, dan asam amino spesifik yang ditambahkan ke dalam medium dapat meningkatkan inisiasi dan multiplikasi embrio somatik tanaman konifer.
Tujuan penelitian adalah mendapatkan komposisi medium cair terbaik dengan teknik pengocokan yang dapat meningkatkan persentase penggandaan embrio somatik tanaman kelapa sawit, mendapatkan medium yang dapat memperbesar kalus embriogenik, dan histologis kalus embriogenik dari medium terbaik.
Bahan dan Metode
Bahan Tanaman
Bahan tanaman yang digunakan adalah kalus embriogenik lini S82.132 pada fase nodular, berukuran 0.2-1.0 mm.
Metode Penelitian
Penelitian terdiri dari dua kegiatan, yaitu (i) pengaruh medium cair terhadap kalus embriogenik, dan (ii) analisis histoligis kalus embriogenik.
Sebanyak 0.5 g kalus embriogenik dikulturkan ke dalam Erlenmeyer 100 mL berisi medium cair. Dua jenis medium cair yang diuji, yaitu medium MS kontrol (MSK) (Murashige & Skoog, 1962) dan MS diperkaya (MSD) dengan biotin 0.2 mg/L, D-Ca-pantotenat 1.2 mg/L, asam askorbat 1.8 mg/L, kolin klorida 1.4 mg/L, L-sistein-HCL 19.0 mg/L, dan alanin 5.0 mg/L. Ke dalam masing-masing medium yang diuji ditambahkan 2.4-D dengan taraf 0.0; 0.3; 0.6 dan 0.9 mg/L berkombinasi dengan NAA dengan taraf 0.0; 4.0 dan 8.0 mg/L. Kombinasi perlakuan disajikan dalam Tabel 1.
pH diatur menjadi pH 5.7 dengan menambahkan beberapa tetes 1 N NaOH ke dalam medium cair. Sebanyak 35 mL medium dituangkan ke dalam Erlenmeyer, kemudian ditutup dengan dua lapis aluminum foil. Medium dan seluruh peralatan yang akan digunakan disterilisasi dengan autoklaf pada 121 °C dan bertekanan 1.1 kg cm2 selama 20 min. Tabung Erlenmeyer yang berisi kultur diletakkan di atas mesin pengocok rotary berkecepatan 100 rpm dalam ruang gelap bersuhu 28 ± 2 °C dengan kelembaban udara di bawah 50 ± 10%.
Pengaruh medium terhadap pertumbuhan kalus diamati berdasarkan berat basah kalus embriogenik yang ditimbang pada minggu ke-0 (M0) dan ke-8 (M8).
Ukuran kalus ditentukan dengan cara sebanyak 0.5 g kalus embriogenik dari masing-masing perlakuan ditimbang dan disaring menggunakan saringan dengan ukuran 0.5-1.0 mm.
Rancangan Percobaan dan Analisis Data
Tabel 1 Kombinasi perlakuan medium MSK dan MSD pada seleksi medium cair No. Jenis media Media 2.4-D (mg/L) NAA (mg/L)
1 MSK0 MSK 0.0 0.0
2 MSK1 MSK 0.9 8.0
3 MSK2 MSK 0.9 4.0
4 MSK3 MSK 0.6 8.0
5 MSK4 MSK 0.6 4.0
6 MSK5 MSK 0.3 8.0
7 MSK6 MSK 0.3 4.0
8 MSD0 MSD 0.0 0.0
9 MSD1 MSD 0.9 8.0
10 MSD2 MSD 0.9 4.0
11 MSD3 MSD 0.6 8.0
12 MSD4 MSD 0.6 4.0
13 MSD5 MSD 0.3 8.0
14 MSD6 MSD 0.3 4.0
Keterangan: MSK adalah medium MS0 dan medium MSD adalah medium MS diperkaya biotin, D-Ca-pantotenat, kolin klorida, L-sistein-HCL, asam askorbat, dan alanin.
Analisis Histoligis Kalus Embriogenik.
Sebanyak 0.1 g kalus embriogenik dari medium MSK2 dan MSD2
ditimbang, dihitung jumlahnya, dan dilakukan analisis histologis. Preparat sayatan dari masing-masing perlakuandiukur masing-masing kalus embriogenik lalu data dianalisis menggunakan Uji T. Kalus embriogenik tersebut dianalisis secara histologi (Sass 1951) di laboratorium Anatomi Tanaman, LIPI, Cibinong. Komposisi media yang menunjukkan persentase proliferasi yang tinggi akan digunakan sebagai media untuk penelitian proliferasi embrio somatik menggunakan Sistem Perendaman Sesaat/SPS.
Hasil dan Pembahasan
Pengaruh Medium terhadap Kalus Embriogenik
Hasil yang diperoleh menunjukkan bahwa perlakuan medium memberikan pengaruh yang nyata terhadap rataan berat basah kalus embriogenik (Lampiran 1). Medium MSD2 menunjukkan rataan berat basah tertinggi, yaitu 1.04 g pada
pengamatan minggu ke-8. Medium MSK2 dan MSK3 tidak menunjukkan
perbedaan yang nyata. Medium MSK2 selanjutnya digunakan untuk analisis
histologis. Perbedaan histologis akan dipelajari pada kultur yang berada di dalam medium MSK2 dan MSD2 untuk mengetahui pengaruh penambahan vitamin
biotin, asam askorbat, D-kalsium pantotenat, dan kolin klorida, L-sistein-HCl, dan asam amino alanin.
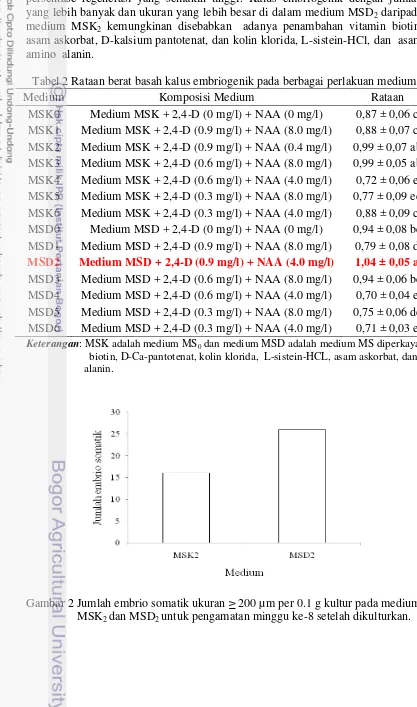
Hasil penimbangan 0.1 g kultur menghasilkan 26 kalus embriogenik pada medium MSD2 dan 16 kalus embriogenik pada medium MSK2 dengan ukuran ≥
Jumlah kalus embriogenik yang lebih banyak menunjukkan persentase proliferasi yang tinggi sedangkan ukuran kalus yang ≥ 200 µm menunjukkan persentase regenerasi yang semakin tinggi. Kalus embriogenik dengan jumlah yang lebih banyak dan ukuran yang lebih besar di dalam medium MSD2 daripada
medium MSK2 kemungkinan disebabkan adanya penambahan vitamin biotin,
asam askorbat, D-kalsium pantotenat, dan kolin klorida, L-sistein-HCl, dan asam amino alanin.
Tabel 2 Rataan berat basah kalus embriogenik pada berbagai perlakuan medium Medium Komposisi Medium Rataan
MSK0 Medium MSK + 2,4-D (0 mg/l) + NAA (0 mg/l) 0,87 ± 0,06 c MSK1 Medium MSK + 2,4-D (0.9 mg/l) + NAA (8.0 mg/l) 0,88 ± 0,07 c MSK2 Medium MSK + 2,4-D (0.9 mg/l) + NAA (0.4 mg/l) 0,99 ± 0,07 ab MSK3 Medium MSK + 2,4-D (0.6 mg/l) + NAA (8.0 mg/l) 0,99 ± 0,05 ab MSK4 Medium MSK + 2,4-D (0.6 mg/l) + NAA (4.0 mg/l) 0,72 ± 0,06 e MSK5 Medium MSK + 2,4-D (0.3 mg/l) + NAA (8.0 mg/l) 0,77 ± 0,09 ed MSK6 Medium MSK + 2,4-D (0.3 mg/l) + NAA (4.0 mg/l) 0,88 ± 0,09 c MSD0 Medium MSD + 2,4-D (0 mg/l) + NAA (0 mg/l) 0,94 ± 0,08 bc MSD1 Medium MSD + 2,4-D (0.9 mg/l) + NAA (8.0 mg/l) 0,79 ± 0,08 d
MSD2 Medium MSD + 2,4-D (0.9 mg/l) + NAA (4.0 mg/l) 1,04 ± 0,05 a
MSD3 Medium MSD + 2,4-D (0.6 mg/l) + NAA (8.0 mg/l) 0,94 ± 0,06 bc MSD4 Medium MSD + 2,4-D (0.6 mg/l) + NAA (4.0 mg/l) 0,70 ± 0,04 e MSD5 Medium MSD + 2,4-D (0.3 mg/l) + NAA (8.0 mg/l) 0,75 ± 0,06 de MSD6 Medium MSD + 2,4-D (0.3 mg/l) + NAA (4.0 mg/l) 0,71 ± 0,03 e
Keterangan: MSK adalah medium MS0 dan medium MSD adalah medium MS diperkaya biotin, D-Ca-pantotenat, kolin klorida, L-sistein-HCL, asam askorbat, dan alanin.
Menurut Baret et al (1997) dan (Stasolla et al. 2001) asam amino sebagai sumber nitrogen organik dapat mempengaruhi embriogenesis somatik tanaman. Asam amino eksogen yang masuk ke dalam sel dapat menstimulasi sintesis protein yang terakumulasi di dalam sel sehingga terjadi induksi pembelahan sel embriogenik. Hal ini dapat meningkatkan proliferasi sel yang dikulturkan.
Analisis Histologis Kalus Embrogenik
Analisis histologis kalus embriogenik menunjukkan adanya perbedaan ukuran sel embriogenik dari medium MSK2 dibandingkan dengan medium MSD2,
masing-masing tanpa dan yang diberivitamin dan alanin (Gambar 3 dan 4).
Gambar 3 Histologi kalus embriogenik pada media MSK2 pada pengamatan
minggu ke-8 setelah dikulturkan. Kalus embriogenik berbentuk (A) globular; (B) skutelar, ukuran kalus embriogenik 200-400 µm, perbesaran 10x ( 200 µm).
Perkembangan sel-sel embriogenik yang membentuk kalus embriogenik terdiri dari dua fase perkembangan, yaitu berbentuk (A) globular, dan (B) berbentuk skutelar. Ukuran kalus embriogenik pada medium MSK2 sekitar
200-400 µm sedangkan pada medium MSD2 sekitar 200-600 µm. Medium MSD2
dengan penambahan 0,9 mg/L 2,4-D dan 4.0 mg/L NAA mampu meningkatkan rataan berat basah kalus embriogenik sebesar 72%, MSD0 hanya mampu
meningkatkan rataan berat basah sebesar 58%, sedangkan medium kontrol MSK0
sebesar 50%. Hal ini kemungkinan disebabkan pertambahan ukuran kalus embriogenik yang juga berbeda antar ke dua medium tersebut.
Menurut Rohani (2000) kalus embriogenik berukuran lebih besar dari 200 µm sedangkan kalus non embriogenik berukuran kurang dari 200 µm. Pembesaran nukleotida sangat diperlukan dalam proliferasi sel secara cepat dan pertumbuhan jaringan embriogenik (Ashihara et al. 2001). Al-khayri (2001) melaporkan bahwa asam amino diantaranya tiamin dan biotin sangat penting untuk inisiasi dan induksi kalus embriogenik. Asam-asam organik yang ditambahkan ke dalam medium kultur jaringan merupakan bagian dari suplemen yang mengandung vitamin, asam amino, dan gula dan telah diuji secara individual. Trottier et al.
(1993) dan Dougall et al. (1980) menyatakan bahwa kultur cair untuk tanaman
A
A
B
wortel, kedelai, dan tembakau yang diberi penambahan asam-asam organik dan ammonium sebagai sumber nitrogen mendukung pertumbuhan sel in vitro.
Gambar 4 Histologis kalus embriogenik pada media MSD2 pada pengamatan
minggu ke-8 setelah dikulturkan. Kalus embriogenik berbentuk
(A) globular; (B) skutelar; ukuran kalus embriogenik 200-600 µm, perbesaran 10x ( = 200 µm).
Asam askorbat juga ditambahkan ke dalam medium MSD2. Menurut
Smirnoff et al. (2000) asam askorbat termasuk golongan vitamin C dan berfungsi di dalam tanaman sebagai antioksidan, kofaktor dalam reaksi biokimia, dan prekursor pembentukan asam oksalat dan tartarat Asam askorbat merupakan prekursor biosintesis asam oksalat. Asam askorbat akan mencapai titik tertinggi pada saat asam oksalat mulai terakumulasi (Wheeler et al. 1998). Asam oksalat mempunyau fungsi utama dalam regulasi kalsium, keseimbangan ion, proteksi tanaman, dan detoksifikasi logam toksik (Franceschi & Nakata 2005). Kalsium diregulasi oleh asam oksalat secara in vivo dan in vitro, maka penambahan asam oksalat ke dalam medium kultur dapat menstimulasi pertumbuhan embrio somatik tahap awal melalui kontrol ketersediaan kalsium. Asam oksalat sebanyak 0,34 mM dapat menginduksi pertumbuhan tanaman Pinus tadea (Pullman et al. 2006).
Asam askorbat berfungsi sebagai antioksidan dengan menghasilkan enzim askorbat oksidase dan dapat mencegah efek pencokelatan. Hal ini terlihat bahwa kalus-kalus embriogenik pada semua perlakuan medium berwarna kuning kecokelatan dan tidak terlihat adanya tingkat pencokelatan yang tinggi (Gambar 6). Asam askorbat juga berperan dalam pembelahan dan perkembangan dinding sel (Arrigoni 1994). Asam askorbat dapat meningkatkan pembelahan sel, melalui pengaruhnya terhadap konsentrasi DHA selama fase pembelahan sel G1. Hasilnya akan mempersingkat siklus pembelahan dan pemanjangan sel (Kato & Esaka 1999). Barth et al. (2006) mengasumsikan bahwa asam askorbat berhubungan dengan sinyal fitohormon selama transisi dari fase vegetatif ke fase generatif dan fase akhir perkembangan.
Asam askorbat berperan dalam metabolisme dinding sel. Keseimbangan antara asam askorbat dan tingkat H2O2 secara langsung dan tidak langsung
berpengaruh terhadap lignifikasi komponen dinding sel. Lignifikasi berasosiasi
A
B
A
dengan aktivitas peroksidase (POD) dan formasi H2O2 dalam dinding sel. POD
menggunakan H2O2 sebagai oksidan untuk membentuk radikal monolignol.
Reaksi ini dihambat oleh askorbat yang dapat mengurai radikal monolignol. Kombinasi askorbat di dalam apoplas dalam lignifikasi masih dapat menghambat POD (Mazid et al. 2011).
Auksin 2,4-D menstimulasi pembelahan sel dan menghambat pemanjangan sel sedangkan NAA berperan dalam meningkatkan pemanjangan sel pada saat terjadi penurunan pembelahan sel. Peran antagonis ini ada hubungannya dengan pola transportasi dari dua jenis auksin tersebut. 2,4-D lebih cepat terakumulasi di dalam sel (Delbarre et al. 1996). Reseptor Auxin Binding Protein (ABP1)
berikatan dengan NAA dan berfungsi dalam pemanjangan sel. Reseptor Rx yang tidak diketahui berikatan dengan 2,4-D dan mengaktifkan pembelahan sel melalui sinyal transduksi protein G. Toksin Pertussis yang dapat memblok protein G dan menghambat pembelahan sel oleh 2,4-D. Aluminium tetraflorida merupakan suatu aktivator protein G dapat menginduksi pembelahan oleh NAA (Campanoni & Nick 2005).
Auksin berperan dalam pembelahan dan pembesaran sel. Auksin dapat mengaktifkan lintasan sinyal transduksi (Yamagami et al. 2004). Proses pembelahan sel dan pemanjangan sel merupakan proses antagonis dalam tanaman tembakau. Stimulasi pembelahan sel berkorelasi dengan penghambatan pemanjangan sel, dan sebaliknya. Pemanjangan sel meningkat jika terjadi penurunan pada pembelahan sel. Hal ini terjadi karena adanya perbedaan kualitatif dari 2,4-D dan NAA.
Auksin alami (IAA) dan analog auksin sintesis (2,4-D dan NAA) menunjukkan aktivitas yang sama. Hal ini kemungkinan disebabkan auksin sintetis memiliki dua fungsi selama induksi embriogenesis somatik, satu yang berhubungan dengan signal auksin dan lainnya berfungsi pada komponen stress (Feher et al. 2003) yang dapat mengubah konsentrasi auksin endogen (Jimenez 2005).
Morfologi kalus embriogenik di dalam medium MSK2 dan MSD2 (Gambar
Gambar 5 Morfologi koloni kalus embriogenik pada perlakuan medium (A) MSK0; (B) MSK1; (C) MSK2; (D) MSK3; (D) MSK4; (E) MSK5; (F)
MSK6; (G) MSK7 menggunakan mikroskop cahaya pada pengamatan
minggu ke-8. Medium MSK2 adalah medium MS0 dengan auksin 2.4-D
dan NAA, --- =200 µm.
Gambar 6 Morfologi koloni kalus embriogenik pada perlakuan medium (A) MSD0; (B) MS1; (C) MSD2; (D) MSD3; (D) MSD4; (E) MSD5; (F)
MSD6; (G) MSD7 menggunakan mikroskop cahaya pada pengamatan
minggu ke-8. Medium MSK adalah medium MS0 dengan auksin 2.4-D
dan NAA, ---- =200 µm.
Simpulan
Medium MSD2, yaitu medium MS dengan penambahan biotin,
D-Ca-pantotenat, kolin klorida, L-sistein-HCL, asam askorbat, alanin, serta 2.4-D 0.9 mg/L dan NAA 4.0 mg/L adalah medium yang mampu menghasilkan rataan berat basah kalus tertinggi sebesar 72% dan kemungkinan dapat meningkatkan persentase regenerasi karena menghasilkan kalus embriogenik dengan ukuran yang lebih besar daripada medium MSK2.
A B C D
E F G
A B c D
E F G
A B C D
E F G
A B C D
4 OPTIMASI TEKNIK SPS UNTUK PROLIFERASI
KALUS EMBRIOGENIK TANAMAN
KELAPA SAWIT (Elais guineensis Jacq.)
Abstrak
Proliferasi kalus embriogenik pada kelapa sawit melalui teknik kultur jaringan umumnya dilakukan dalam medium cair, namun perolehan embrio somatik masih belum optimum. Teknik sistem perendaman sesaat (SPS) sejauh ini sudah digunakan pada beberapa tanaman untuk produksi embrio somatik dalam skala industri. Tujuan penelitian ini adalah untuk mendapatkan medium dan periode perendaman terbaik yang dapat meningkatkan proliferasi embrio somatik tanaman kelapa sawit dengan teknik SPS. Bahan tanam yang digunakan adalah kalus embriogenik lini S15.355 dan S.82.132 berukuran 1-2 mm dikulturkan di dalam media MSK0 (kontrol) di atas mesin pengocok, MSD0, dan MSD2. Teknik
SPS yang diuji menggunakan periode perendaman 1, 3, dan 6 jam sekali selama 3 menit. Hasil yang diperoleh menunjukkan bahwa rataan berat basah tertinggi adalah kalus embriogenik lini S15.355 dari medium cair MSD0 pada sistem
perendaman sesaat. Penelitian lanjutan untuk pengujian lama perendaman dan jenis medium masih perlu dilakukan.
Kata kunci : Sistem perendaman sesaat, embriogenesis somatik, kalus embryogenik, Elaeis guineensis Jacq., medium cair.
Abstract
Proliferation of embryogenic callus in oil palm with tissue culture using liquid medium commonly, but the results were still not optimum. Temporary immersion system as far has been used in production industry of many plants. The objectives of this research were to obtain the best medium and immersion frequence which can increase proliferation of oil palm somatic embryo with temporary immersion system. Embryogenic calluses from line S15.355 and S.82.132 with size 1-2 mm cultured in MSK0 medium (control), MSD0, and MSD2
medium which was MS medium enriced. Temporary immersion system using immersion frequence every 1, 3, and 6 hour immersed for 3 minutes. Liquid medium (MSK0) used as control and incubated on the shaker. The result showed
that the highest rate of embryogenic callus fresh weight got from line S15.355 in control medium (MSK0)and incubated on shakeralso immersed for 24 hours after
8 weeks after subcultured. Medium in temporary immersion system still did not give optimum results. The next research for immersion frequence and other mediums still need to do.
Pendahuluan
Basis perbanyakan kelapa sawit secara in vitro adalah melalui pembentukan kalus, dikuti dengan pembentukan kalus embriogenik, pendewasaan embrio, perakaran planlet, dan aklimatisasi ramet. Embrio somatik yang dibentuk pada tahap awal biasanya disubkultur ke dalam medum cair dengan tujuan meningkatkan laju penggandaan embrio somatik. Namun, sampai saat ini belum ditemukan medium yang optimum untuk medium cair.
Sistem medium cair mampu menyediakan kultur yang lebih seragam, mudah dalam penggantian medium, dan dapat menggunakan wadah kultur yang lebih besar. Medium cair ideal untuk mengurangi biaya produksi planlet karena dapat diotomatisasi (Aitken-Christie 1991). Namun terdapat kelemahan penggunaan medium cair diantaranya dapat menyebabkan vitrifikasi, sel-sel dapat rusak karena adanya perputaran medium pada mesin pengocok, dan sel-sel dapat mengalami kekurangan oksigen. Untuk mengurangi kelemahan ini, maka beberapa teknik telah dikembangkan di antaranya penggunaan penopang berupa jembatan kertas saring, menambahkan medium cair ke dalam medium padat, penggunaan bioreaktor berupa kultur suspensi.
Sistem perendaman sesaat (SPS) telah dikembangkan untuk perbanyakan tanaman secara in vitro berdasarkan prinsip bioreaktor. Sistem ini memungkinkan eksplan kontak dengan medium secara periodik. Periode dan waktu perendaman dikontrol secara otomatis oleh alat pengatur waktu. Sistem ini cukup baik dalam hal pertukaran oksigen, pencampuran eksplan dan medium, penurunan persentase kontaminasi, dan penurunan biaya produksi (Teisson et al. 1999; Etienne &
Berthouly 2002). Tahardi (1998) melaporkan bahwa produksi embrio somatik yang berasal dari kalus nodular lebih tinggi dengan menggunakan SPS, kultur lebih seragam dibandingkan dengan dalam media padat.
Teknik SPS telah digunakan untuk perbanyakan massal berbagai spesies tanaman dalam skala komersil, yang dapat diperbanyak melalui alur pembentukan somatik embrio. Perbanyakan tanaman secara in vitro melalui embriogenesis somatik telah dilaporkan pada tanaman karet (Etienne dan Berthouly 2002), kopi (Albarran et al. 2005; Etienne et al. 2006; Gatica-Arias 2008), pisang (Haq dan Dahot 2007), Theobroma (Niemenak et al. 2008). Di samping itu produksi embrio somatik tanaman secara in vitro juga digunakan untuk transformasi genetik. SPS juga telah digunakan untuk perbanyakan kelapa sawit secara in vitro (Sumaryono
et al. 2008); Camptotheca acuminata sejenis tanaman obat-obatan langka menggunakan medium MS dengan penambahan BAP 0,5 mg/L dengan perendaman setiap selang 6 jam dengan lama perendaman selama 1 menit (Sankar-Thomas et al. 2008), dan buah peach (Steinmacher et al. 2011).
Teknik SPS juga telah digunakan untuk penggandaan cepat secara komersil tanaman yang diperbanyak dengan kultur jaringan melalui alur organogenesis, diantaranya pisang (Roels et al. 2006), nenas (Scheidt et al. 2009), Casava acuminata (Sankar-Thomas et al. 2008), kurma (Fki et al. 2011) dan tebu (Yang
Jova et al. (2011) melaporkan bahwa persentase multiplikasi tanaman meningkat menggunakan SPS dibandingkan dengan perbanyakan pada medium padat. Namun, Hanhineva et al. (2005), Jo et al. (2008), Stanly et al. (2010) menyatakan bahwa tidak ada perbedaan persentase multiplikasi antara kedua teknik. Wu et al. (2007), Ross & Castillo (2009) melaporkan bahwa perendaman permanen di atas mesin pengocok menghasilkan multiplikasi tinggi pada anggrek dan blueberry.
Tujuan penelitian adalah mendapatkan komposisi medium dan periode perendaman terbaik yang dapat meningkatkan persentase lini kalus embriogenik S15.355 dan S82.132 menggunakan SPS.
Bahan dan Metode
Bahan Tanaman
Penelitian ini menggunakan dua lini kalus embriogenik fase nodular, yaitu lini kalus embriogenik S82.132 yang memiliki ukuran koloni <200 µm dan lini kalus embriogenik S15.355 yang memiliki ukuran koloni > 200 µm pada awal percobaan (Gambar 4). Keseragaman kalus nodular diperoleh melalui penyaringan menggunakan saringan berukuran 1-2 mm yang dilakukan secara steril di dalam
Laminar Air Flow. Koloni adalah kumpulan embrioid yang berjumlah kurang dari 5 sel embroid. akan digunakan disterilisasi di dalam autoklaf pada suhu 121°C dan bertekanan 1.1 kg cm-2 selama 20 min.
Medium MSD0 adalah medium MS diperkaya biotin, D-Ca-pantotenat, kolin
klorida, L-sistein-HCL, asam askorbat, dan alanin. Medium MSD2 adalah medium
MSD ditambah 2.4-D sebanyak 0.9 mg/L dan NAA sebanyak 4.0 mg/L. Medium MSK0 (medium MS tanpa vitamin, asam amino, dan ZPT) digunakan sebagai
kontrol dan menggunakan kalus embriogenik yang dikulturkan di dalam Erlenmeyer 100 mL di atas mesin pengocok.
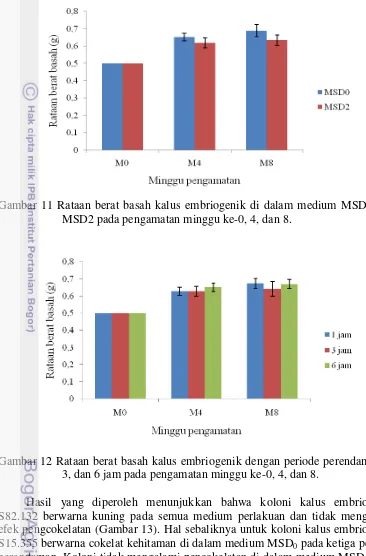
Kultur kontrol dikocok selama 24 jam di atas mesin pengocok arbitari dengan kecepatan pengocokan 100 rpm dan diinkubasi di dalam ruang gelap dengan suhu 28 ± 2 °C, kelembaban nisbi udara di bawah 50%. Untuk kultur dengan sistem SPS menggunakan tiga periode perendaman, yaitu 1, 3 dan 6 jam sekali selama 3 menit. Masing-masing perlakuan diulang sebanyak 10 kali. Kultur SPS diinkubasi di dalam ruang terang (16 jam terang, 8 jam gelap) bersuhu 28 ± 2 °C dengan kelembaban udara di bawah 50 ± 10%. Pengamatan pertumbuhan kalus berbasis berat basah dilakukan pada minggu ke-0 (M0), ke-4 (M4), dan ke-8
(M8) stelah inkubasi.