TENERA
TESIS
Oleh
TENGKU NILAYANDA MEILVANA
117030003
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS HISTOLOGI EMBRIOGENESIS SOMATIK DARI
APIKAL BUD KELAPA SAWIT (
Elaeis guineensis
Jacq.) var.
TENERA
TESIS
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar
Magister Sains dalam Program Studi Biologi pada Sekolah
Pascasarjana Fakutas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Oleh
TENGKU NILAYANDA MEILVANA
117030003
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN
Judul Tesis : Analisis Histologi Embriogenesis Somatik Dari Apikal Bud Kelapa Sawit (Elaeis guineensis Jacq.) var Tenera Nama Mahasiswa : Tengku Nilayanda Meilvana
NIM : 117030003
Program Studi : Magister Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Menyetujui, Komisi Pembimbing
(Dr. Suci Rahayu, M.Si) (Dr. Fauziyah Harahap, M.Si) NIP. 196506291992032002 NIP. 196607281991032002
Ketua Program Studi Dekan
ANALISIS HISTOLOGI EMBRIOGENESIS SOMATIK DARI APIKAL BUD KELAPA SAWIT (Elaeis guinensis Jacq) Var TENERA
TESIS
Dengan ini saya menyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar.
Medan, Oktober 2014
Tengku Nilayanda Meilvana
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan dibawah ini:
Nama : Tengku Nilayanda Meilvana NIM : 117030003
Program Studi : Magister Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Ekslusif (Non-exlusive Royalty Free Right) atas Tesis saya yang berjudul :
ANALISIS HISTOLOGI EMBRIOGENESIS SOMATIK DARI APIKAL BUD KELAPA SAWIT (Elaeis guineensis Jacq.) VAR TENERA
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Ekslusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini diperbuat dengan sebenarnya.
Medan, Oktober 2014
Telah diuji pada
Tanggal : 12 Februari 2014
PANITIA PENGUJI TESIS
Ketua : Dr. Suci Rahayu, M.Si
Anggota : 1. Dr. Fauziyah Harahap, M.Si
RIWAYAT HIDUP
DATA PRIBADI
Nama lengkap berikut gelar : Tengku Nilayanda Meilvana, S.Pd
Tempat dan Tanggal lahir : Medan, 09 Mei 1980
Alamat Rumah : Jl. Almunium I gg. Keluarga No 5 LK 13
Medan 20241
HP : +6282166020590
e-mail : [email protected]
Instansi Tempat Bekerja : SMA TAMAN SISWA MEDAN
DATA PENDIDIKAN
SD : Swasta Islam Azizi Medan Tamat : 1992
SMP : Negeri 10 Medan Tamat : 1995
SMA : SMAK Dharma Analitika Medan Tamat : 1998
Strata-1 : FMIPA UNIMED Tamat : 2005
yang memberikan kesehatan dan nikmat kepada penulis sehingga hasil penelitian ini dapat diselesaikan dengan waktu yang direncanakan.
Penelitian ini berjudul Analisis Histologi Embriogenesis Somatik dari
Apikal Bud kelapa sawit (Eleais guneensis Jacq.) var. Tenera. Dengan selesainya penelitian ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada Pemerintah Provinsi Sumatera Utara atas kesempatan untuk melanjutkan pendidikan yang diberikan kepada penulis melalui beasiswa Bapeda. Penulis juga berterima kasih yang tak terhingga kepada Ibu Dr. Suci Rahayu, M.Si selaku pembimbing I dan memberikan program dana hibah pasca dalam penelitian ini, dengan penuh perhatian telah memberikan dorongan dan bimbingan, demikian juga penulis ucapkan terima kasih yang tak terhingga kepada Ibu Dr. Fauziyah Harahap, M.Si selaku pembimbing II yang telah banyak memberikan bimbingan dan pengetahuan kepada penulis dalam penyusunan hasil penelitian. Ucapan terima kasih juga ditujukan kepada Bapak Prof. Dr. Syafruddin Ilyas, M.Biomed selaku penguji I dan Ketua Program Studi Magister Biologi serta ibu Dr. Saleha Hannum, M.Si selaku penguji II yang telah banyak memberikan saran dan arahan demi penyempurnaan tesis ini. Penulis juga mengucapkan terima kasih kepada seluruh staf pengajar Program studi Magister Biologi dan kepada Dekan FMIPA Universitas Sumatera Utara Dr. Sutarman, M.Sc.
Ucapan terima kasih yang mendalam penulis ucapkan kepada ayahanda Ir. Tengku Achmad Syafei dan Ibunda Rosnawaty serta ayahanda H. Jasmin SE dan Ibu Hj. Salbiah yang telah memberikan doa, nasehat, motivasi, dalam menyelesaikan penelitian ini. Kepada keluarga, suami Taufik S.Sos dan anak-anak tercinta Zulfikar Ali dan Shabrina Izzatunisa yang selalu memberikan doa dan dukungannya dalam menyelesaikan penelitian ini. Terima kasih atas segala pengorbanan baik berupa moril maupun materi, budi baik yang tidak dapat dibalas hanya Allah SWT yang dapat membalasnya.
Penulis menyadari masih banyak kekurangan dalam penyusunan hasil ini, untuk itu penulis mengharapkan kritik dan saran yang membangun dari semua pihak demi kesempurnaan hasil ini. Kiranya hasil penelitian ini bermanfaat dalam memperkaya khasanah ilmu pengetahuan.
ABSTRAK
Penelitian yang berjudul “Analisis Histologi Embriogenesis Somatik dari Apikal Bud
Kelapa sawit (Elaeis guineensis Jacq) var. Tenera telah dilakukan di laboratorium
Kultur Jaringan FMIPA USU dari bulan Juni sampai dengan bulan Desember 2013. Tujuan penelitian ini adalah mencari konsentrasi zat pengatur tumbuh terbaik dan posisi eksplan terbaik dari apikal bud kelapa sawit var Tenera dengan penambahan arang aktif sebanyak 2 g/L dalam medium Y3 mampu menginduksi kalus primer dan kalus embriogenik somatik. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) faktorial dengan faktor I taraf konsentrasi 2,4-D yaitu 110 mg/L, 120 mg/L, 130 mg/L dan faktor II posisi eksplan yang berbeda yaitu apikal, median, dan basal. Hasil penelitian menunjukkan bahwa konsentrasi 2,4-D terbaik dalam menginduksi kalus primer dan kalus embriogenik adalah konsentrasi 2,4-D 130 mg/L dan posisi eksplan terbaik dalam menginduksi kalus primer dan kalus embriogenik yang berasal dari posisi segmen basal. Dari analisis histologi ditemukan fase globular dengan karakteristik memiliki sel meristem yang menyebar, jaringan prokambial, dan protoderm terdiri dari satu lapisan yang tersusun secara teratur.
HISTOLOGICAL ANALYSIS OF SOMATIC EMBRYOGENESIS FROM APICAL BUD OF OIL PALM (Elaeis guineensis Jacq.) var. TENERA
ABSTRACT
A study of Histological Analysis of Somatic Embryogenesis from Apical Bud of Oil Palm (Elaeis guineensis Jacq.) var. Tenera has been conducted at Plant Tissue Culture Laboratory of FMIPA USU. The experimental design was completely randomized with three levels of 2,4-D concentrations: 110; 120; 130 mg/L and three position of explants: apical, median, and basal. The statistical analysis showed that 120 mg/L of 2,4-D significantly affected the primary and embryogenic calluses initiation. Explants from basal position gave the best presentation of callus formation (23,5%). The histological analysis showed that somatic embryos formed at globular phase with meristematic tissue, procambial tissue and 1 layer of protoderm tissue.
DAFTAR ISI
2.1 Klasifikasi Kelapa Sawit 6
3.4.3.6 Penempelan Sayatan Pada Gelas Objek 18
3.4.3.7 Penjernihan 18
3.4.3.8 Pewarnaan 19
3.5 Parameter Pengamatan 19
3.6 Analisis Data 20
BAB IV HASIL DAN PEMBAHASAN 21
4.1 Waktu Pembentukan Kalus Primer 21
4.2 Persentase Eksplan yang Membentuk Kalus (%) 22
4.3 Pengaruh Konsentrasi 2,4-D dan Posisi Eksplan pada Induksi Kalus Primer
23
4.4 Waktu Pembentukan Kalus Embriogenik 25
4.5 Persentase Kalus Embriogenik 27
4.6 Pengaruh Konsentrasi 2,4-D dan Posisi Eksplan pada Induksi Kalus Embriogenik
28
4.7 Berat Basah Kalus Embriogenik 29
4.8 Berat Kering Kalus Embriogenik 31
4.9 Morfologi Kalus Primer dan Kalus Embriogenik 33
4.10 Karakteristik Histologi Embriogenik 35
BAB V KESIMPULAN DAN SARAN 38
5.1 Kesimpulan 38
5.2 Saran 38
DAFTAR PUSTAKA 39
DAFTAR TABEL
Nomor Judul Halaman
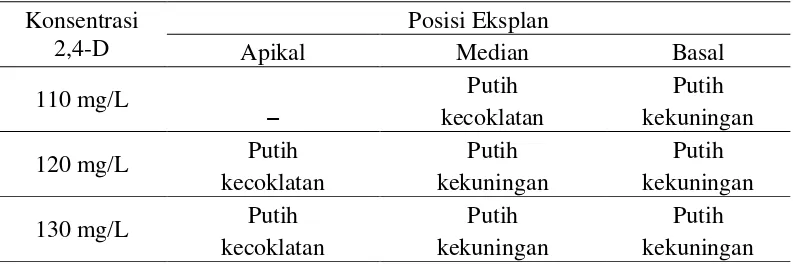
3.1. Rancangan Plot Perlakuan Posisi Eksplan dengan Konsentrasi Zat Pengatur Tumbuh
15
4.1. Rata-Rata Persentase Induksi Kalus Primer Kelapa Sawit pada Beberapa Tingkat Konsentrasi 2,4-D dan Posisi Eksplan.
25
4.2. Pengaruh Posisi Eksplan dan Konsentrasi 2,4-D Terhadap Persentase Induksi Kalus Embriogenik.
29
DAFTAR GAMBAR
Nomor Judul Halaman
4.1. Hubungan Rata-Rata Saat Terbentuknya Kalus Primer Pada Posisi Eksplan Dengan Zat Pengatur Tumbuh 2,4-D
22
4.2. Hubungan Rata-Rata Saat Terbentuknya Kalus
Embriogenik Pada Posisi Eksplan Dengan Zat Pengatur Tumbuh 2,4-D
27
4.3. Histogram Berat Basah Kalus pada Posisi Segmen Basal dengan Taraf Konsentrasi 2,4-D yang Berbeda
30
4.4. Histogram Berat Kering Kalus pada Posisi Segmen Basal dengan Taraf Konsentrasi 2,4-D yang berbeda
32
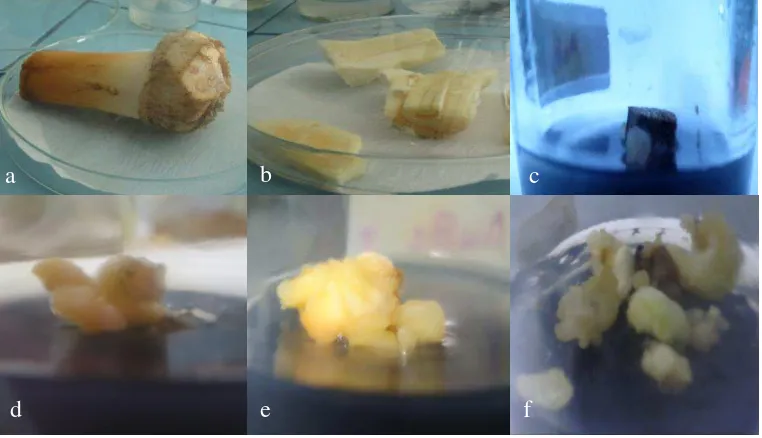
4.5. Proses Kultur Apikal Bud Kelapa Sawit 35
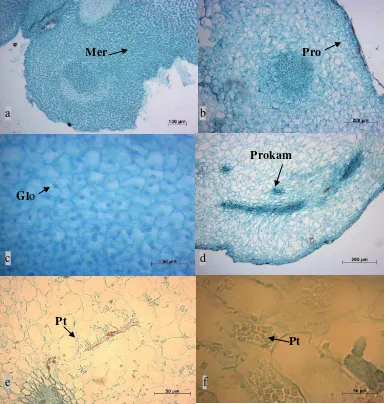
4.6. Analisis Histologi Embrio Somatik Dari Segmen Basal Apikal Bud Kelapa Sawit Fase Globular
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Peta Alir Penelitian L-1
2 Komposisi Medium Y3 L-2
3 Karekteristik Embrio Somatik secara Morfologi dan
Histologi L-3
4 Data Pengamatan Waktu Terbentuknya Kalus Primer (HST) L-4
5 Data Persentase Konsentrasi 2,4-D dengan Posisi Eksplan terhadap Induksi Kalus Primer
L-4
6 Data Pengamatan Waktu Terbentuknya Kalus Embriogenik L-5
7 Data Persentase Konsentrasi 2,4-D dengan Posisi Eksplan
terhadap Induksi Kalus Embriogenik L-5
8 Master Tabel SPSS Saat terbentuknya Kalus Primer L-6
9 Analisis Varian Hubungan Konsentrasi terhadap Posisi Eksplan
L-8
10 Uji Homogenitas Posisi Eksplan dengan Konsentrasi 2,4-D L-8
11 Uji Lanjut Post Hoc Induksi Kalus Primer L-9
12 Uji Lanjut Post Hoc Konsentrasi 2,4-D terhadap Induksi Kalus Primer
L-9
13 Uji Lanjut Post Hoc Posisi Eksplan terhadap Induksi Kalus Primer
L-10
14 MasterTabel SPSS saat Terbentuknya Kalus Embriogenik L-10
15 Analisis Sidik Ragam Kalus Embriogenik L-12
16 Uji Lanjut Post Hoc Kalus Embriogenik L-12
17 Data Berat Basah Kalus L-12
18 Analisis Sidik Ragam Berat Basah Kalus L-13
19 Data Berat Kering Kalus L-13
20 Analisis Sidik Ragam Berat Kering Kalus L-13
ABSTRAK
Penelitian yang berjudul “Analisis Histologi Embriogenesis Somatik dari Apikal Bud
Kelapa sawit (Elaeis guineensis Jacq) var. Tenera telah dilakukan di laboratorium
Kultur Jaringan FMIPA USU dari bulan Juni sampai dengan bulan Desember 2013. Tujuan penelitian ini adalah mencari konsentrasi zat pengatur tumbuh terbaik dan posisi eksplan terbaik dari apikal bud kelapa sawit var Tenera dengan penambahan arang aktif sebanyak 2 g/L dalam medium Y3 mampu menginduksi kalus primer dan kalus embriogenik somatik. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) faktorial dengan faktor I taraf konsentrasi 2,4-D yaitu 110 mg/L, 120 mg/L, 130 mg/L dan faktor II posisi eksplan yang berbeda yaitu apikal, median, dan basal. Hasil penelitian menunjukkan bahwa konsentrasi 2,4-D terbaik dalam menginduksi kalus primer dan kalus embriogenik adalah konsentrasi 2,4-D 130 mg/L dan posisi eksplan terbaik dalam menginduksi kalus primer dan kalus embriogenik yang berasal dari posisi segmen basal. Dari analisis histologi ditemukan fase globular dengan karakteristik memiliki sel meristem yang menyebar, jaringan prokambial, dan protoderm terdiri dari satu lapisan yang tersusun secara teratur.
HISTOLOGICAL ANALYSIS OF SOMATIC EMBRYOGENESIS FROM APICAL BUD OF OIL PALM (Elaeis guineensis Jacq.) var. TENERA
ABSTRACT
A study of Histological Analysis of Somatic Embryogenesis from Apical Bud of Oil Palm (Elaeis guineensis Jacq.) var. Tenera has been conducted at Plant Tissue Culture Laboratory of FMIPA USU. The experimental design was completely randomized with three levels of 2,4-D concentrations: 110; 120; 130 mg/L and three position of explants: apical, median, and basal. The statistical analysis showed that 120 mg/L of 2,4-D significantly affected the primary and embryogenic calluses initiation. Explants from basal position gave the best presentation of callus formation (23,5%). The histological analysis showed that somatic embryos formed at globular phase with meristematic tissue, procambial tissue and 1 layer of protoderm tissue.
1.1 Latar Belakang
Kelapa sawit merupakan tanaman utama perkebunan di Indonesia disamping
karet, the, coklat dan lain-lain. Kelapa sawit mempunyai masa depan yang cukup
cerah saat ini. Kelapa sawit ialah suatu jenis palma yang saat ini dikenal sebagai
tanaman penghasil minyak terbesar per hektar per satuan luas. Produksi minyak
yang tinggi masih menjadi fokus utama dalam program pemuliaan kelapa sawit.
Memenuhi kebutuhan itu semua adalah dengan pengadaan bibit bermutu, seragam
dan diperoleh dalam jumlah yang banyak.
Saat ini perbanyakan tanaman dapat dilakukan melalui organogenesis dan
embriogenesis dengan teknik kultur jaringan. Teknik kultur jaringan telah terbukti
dapat menyediakan bibit tanaman yang akan dieksploitasi secara luas karena dapat
diperbanyak setiap waktu sesuai kebutuhan (Purnamaningsih, 2002). Karakter
unggul varietas kelapa sawit dapat dilihat dari mutu genetik (potensi hasil benih),
mutu fisiologis (daya tumbuh), dan mutu morfologis (keseragaman dan higienitas
benih).
Berdasarkan ketebalan cangkang buah, kelapa sawit dapat dibedakan
menjadi Dura (bercangkang tebal), Pisifera (tanpa cangkang), Tenera
(bercangkang tipis). Saat ini jenis kelapa sawit yang banyak ditanam secara
komersil adalah jenis Tenera yang merupakan hibrida dari Dura x Pisifera (DxP).
Varietas Tenera lebih disukai untuk penanaman komersil karena kandungan
minyak dalam mesokarpnya lebih tinggi dari Dura. Tenera dapat menghasilkan
kadar minyak per tandannya berkisar 28% sedangkan jenis Dura hanya 18% per
tandannya (Kiswanto et al., 2008)
Embriogenesis somatik pada kelapa sawit menjanjikan rute regeneratif,
karena jalur morphogenetik dapat meningkatkan jumlah plantlet regenerasi
mendukung program pemuliaan tanaman penggunaan embrio somatik dapat
mempercepat keberhasilan dengan peluang transformasi yang lebih tinggi karena
embrio somatik dapat berasal dari satu sel somatik. Embrio somatik dianggap
bahan tanaman yang ideal untuk disimpan karena bila diregenerasikan dapat
membentuk bibit somatik (Purnamaningsih, 2002).
Dalam kultur jaringan penambahan zat pengatur tumbuh diberikan untuk
memperoleh efek pertumbuhan (Pandiangan, 2011). Pada induksi kalus
embriogenik, kultur umumnya ditumbuhkan di medium yang mengandung auksin
yang mempunyai aktifitas kuat. Salah satu mekanisme, auksin dapat mengatur
embriogenesis melalui asidifikasi pada sitoplasma dan dinding sel (Kutschera
1994). Konsentrasi auksin yang rendah akan meningkatkan akar adventif,
sedangkan auksin konsentasi tinggi akan merangsang pembentukan kalus dan
menekan morfogenesis (Smith, 1992).
Ada dua mekanisme yang penting dalam pembentukan sel embryogenesis
yaitu, pembelahan sel asimetrik dan pemanjangan sel kontrol (De Jong et
al.1993). Pembelahan sel asimetrik berkembang oleh zat pengatur tumbuh yang
mengubah polaritas sel melalui interfensi dengan gradien pH disekitar sel (Smith
& Krikorian 1990). Dari berbagai hasil penelitian menunjukkan 2,4
Dichlorophenoxyacetic acid merupakan auksin yang efektif untuk induksi kalus
embriogenik (Purnamaningsih, 2002). Pannetier et al., (1991) menyatakan untuk
menginduksi kalus yang embriogenik pada tanaman kelapa sawit dibutuhkan
konsentrasi 2,4-D 80 - 100 mg/l. Sedangkan pada penelitian Thuzar et al., (2012)
eksplan dari posisi yang berbeda pada segmen apikal, median, dan basal dari
regenerasi plantlet kelapa sawit dikultur pada medium N6 dengan konsentrasi 2,4
Dichlorophenoxyacetic acid 100, 120, dan 140 mg/L. Untuk menghasilkan kalus
embriogenik yaitu pada konsentrasi 2,4 Dichlorophenoxyacetic acid 120 mg/L
adalah yang paling efektif (62,53%) dalam menginduksi kalus embriogenik dari
segmen basal 5 bulan setelah inokulasi.
Analisis histologi dilakukan pada embrio somatik untuk melihat fase
globular, skutelar berbentuk hati pada jaringan prokambial dan protoderm yang
struktur yang diperoleh adalah normal atau dewasa, dan bagaimana sebenarnya
embrio terbentuk. jika dibandingkan dengan model referensi (ontogenesis zigotik
atau sistem terkontrol dengan baik mampu secara teratur menghasilkan embrio
somatik) (Schwendiman et al., 1992).
Calon tanaman untuk produksi benih sintetik dapat diklasifikasikan ke
dalam dua kategori yaitu 1) tanaman yang memiliki dasar teknologi yang kuat
seperti yang kualitas tinggi embrio somatik saat ini dapat diproduksi, dan 2)
tanaman dengan kuat dasar komersial (Redenbaugh et al., 1987). Kelapa sawit
memenuhi dua kategori diatas, karena tinggi kualitas minyak sawit dari
embriogenesis somatik yang telah berhasil dilakukan (de Touchet el al, 1991.,
Teixeira et al, 1993., 1995, Aberlenc-Bertossi et al., 1999) dan memiliki dasar
komersial yang kuat. Berdasarkan latar belakang diatas penelitian ini menyajikan
analisis histologi dari pembentukan dan perkembangan embrio somatik dari
eksplan apikal bud kelapa sawit jenis Tenera.
1.2Perumusan Masalah
Karakteristik biologis dari kelapa sawit tidak memungkinkan perbanyakan
vegetatif dengan cara hortikultura konvensional. Tingginya permintaan pasar akan
bibit kelapa sawit yang bermutu, seragam dan diperoleh dalam jumlah yang
banyak, maka salah satu cara untuk perbanyakan kelapa sawit adalah melalui
embriogenesis somatik. Kloning kelapa sawit (Elaeis guineensis Jacq ) dilakukan
dengan menginduksi embriogenesis somatik pada kalus yang berasal dari berbagai
sumber jaringan. Apikal bud digunakan sebagai sumber eksplan karena bersifat
meristematis, dimana sel-sel disegmen ini secara aktif membelah, sehingga
memiliki potensi lebih besar dan bersifat embriogenik (Thuzar et al., 2012).
Teknik kultur jaringan menggunakan jaringan meristem biasanya
dimanfaatkan untuk mendapatkan tanaman bebas virus. Menurut Schwabe
(1984), bebasnya jaringan meristem dari infeksi virus disebabkan oleh sedikitnya
vakuola yang dimiliki oleh sel-sel meristem, disamping terganggunya lintasan
vascular didalam jaringan tersebut. Bajaj (1990) dalam Zulkarnain (2011)
dan perubahan-perubahan pada tingkat inti dan ploidi yang disebabkan oleh
periode subkultur yang panjang. Hal itu dikarenakan sel-sel meristem secara
genetik bersifat stabil.
Perlu dilakukannya analisis histologi pada embrio somatik untuk melihat
fase globular, skutellar berbentuk hati pada jaringan prokambial dan protoderm
yang memiliki sel-sel meristematik dengan pendekatan ini, fenomena sitologi
yang terjadi selama eksplan kultur dan pembentukan kalus dan embrio mampu
berkecambah dapat diselidiki. Penelitian ini, akan mengamati gambaran histologi
eksplan apikal bud dalam menghasilkan kalus yang embriogenik dengan
perlakuan zat pengatur tumbuh 2,4 Dichlorophenoxyacetic acid (2,4-D).
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1) Mengetahui konsentrasi zat pengatur tumbuh 2,4 Dichlorophenxyacetic
acid (2,4-D) yang optimal dalam menginduksi kalus yang berasal dari
eksplan apikal bud kelapa sawit jenis Tenera.
2) Mengetahui pertumbuhan terbaik apikal bud kelapa sawit jenis Tenera
pada posisi eksplan yang berbeda untuk inisiasi kalus embriogenik.
3) Mengamati secara histologi kalus embriogenik pada apikal bud kelapa
kelapa sawit jenis Tenera.
1.4 Hipotesis Penelitian
1) Zat pengatur tumbuh 2,4 Dichlorophenxyacetic acid (2,4-D) pada
konsentrasi 130 mg/L efektif dalam menginduksi kalus yang berasal dari
eksplan apikal bud kelapa sawit jenis Tenera.
2) Posisi eksplan daerah basal berpengaruh terhadap pertumbuhan terbaik
untuk inisiasi kalus embriogenik.
3) Gambaran histologi kalus embriogenik dari eksplan apikal bud kelapa
1.5 Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan manfaat berupa :
1) Memberikan informasi tentang konsentrasi 2,4 Dichlorophenoxyacetic
acid (2,4-D) yang sesuai bagi eksplan apikal bud dalam proses
regenerasi tanaman kelapa sawit jenis Tenera.
2) Memberikan informasi tentang posisi eksplan apikal bud sebagai
sumber eksplan dalam proses regenerasi tanaman kelapa sawit jenis
Tenera.
3) Memberikan informasi tentang gambaran histologi kalus embriogenik
BAB II
TINJAUAN PUSTAKA
2.1Klasifikasi Tanaman Kelapa Sawit (Elaeis guineensis Jacq).
Kelapa sawit (Elaeis guineensis Jacq) asal kata Elaeis dari kata Elaion (yunani)
yang artinya minyak sedangkan Guineensis berasal dari kata Guinea (nama pantai
barat Afrika, tempat pertama sekali kelapa sawit ditemukan), dan Jacq berasal dari
nama penemunya Jacquin (botani Amerika). Genus Elaeis, yang termasuk family
Arecaceae, yang hanya terdiri dari 2 species tropikal. Elaeis guineensis Jacq.
berasal dari Afrika dan Elaeis oleifera berasal dari Amerika Latin. Hanya Elaeis
guineensis yang memiliki daya tarik ekonomi yang tinggi, karena tingginya
kandungan minyak, yang dihasilkan dari bagian mesokarp (minyak sawit) dan
kernel minyak sawit (Cochard et al.,2009).
Kelapa sawit (Elaeis guineensis Jacq) diketahui berasal dari Afrika. Secara
morfologi kelapa sawit dapat dibedakan menjadi tiga tipe, yakni Dura
(bercangkang tebal), Pisifera (tanpa cangkang), Tenera (bercangkang tipis).
Masing-masing tipe memiliki karekteristik buah yang berbeda, yang dijadikan
sebagai basis dalam pemuliaan kelapa sawit.
2.2 Syarat Tumbuh Kelapa Sawit
Kelapa sawit adalah tanaman hutan yang dibudidayakan. Tanaman ini sangat peka
terhadap kondisi lingkungan dan perlakuan yang diberikan. Agar dapat mencapai
produksi maksimal, kelapa sawit membutuhkan syarat tumbuh yang specifik.
Kondisi iklim dan tanah merupakan faktor utama disamping faktor genetis.
Tanah yang baik untuk pertumbuhan Kelapa sawit ialah tanah gembur,
subur, datar, berdrainase baik dan yang memiliki lapisan top soil yang dalam (80
cm) karena merupakan media yang baik bagi perkembangan akar sehingga
40%, tanah liat 20 – 50%. pH tanah sangat terkait dengan ketersediaan hara dalam
tanah, pH optimum untuk pertumbuhan kelapa sawit adalah 5 – 5,5. Jenis tanah
yang cocok untuk kelapa sawit adalah jenis tanah podsolik, latosol, hidromorfik
kelabu, regosol, andosol, organosol, dan aluvial. Tanah tuf vulkanik muda yang
berasal dari gunung berapi berstruktur remah, kosistensi lepas (teguh), kaya
humus dan unsur hara sangat baik untuk kelapa sawit seperti tanah di Aceh,
Sumatera Utara bagian Timur, dan Malaysia Barat.
Kelapa sawit tumbuh subur pada daerah beriklim tropis basah antara 120
LU – 120 LS pada ketinggian 0 – 500 m dpl. Beberapa unsur yang penting dan
saling mempengaruhi adalah curah hujan, suhu, kelembapan udara, sinar matahari,
dan kecepatan angin. Curah hujan optimum adalah 2000 – 2500 mm/thn, tidak
memiliki defisit air. Temperatur optimum adalah 24 – 28 0 C, kelembaban sekitar
80% dan intensitas penyinaran matahari sekitar 5 – 7 jam/hari. Kecepatan angin 5
– 6 km/jam sangat baik untuk membantu proses penyerbukan. (Kiswanto et al., 2008).
2.3Morfologi Kelapa Sawit
1. Kecambah
Jika mendapat air yang cukup, daging biji (endoscarp) akan mengembang
(swelling) kemudian lembaga akan berkecambah (germinating). Daging
biji mengandung persediaan makanan yang diperkirakan mencukupi
sampai akar mampu mencari makanan dan daun mampu melakukan
fotosintesis. Biji kelapa sawit dikelilingi oleh kulit biji (cangkang) yang
sangat keras sehingga lembaga dan daging biji sangat sulit mendapat air
untuk mengembang dan selanjutnya berkecambah.
Benih kelapa sawit sangat sulit berkecambah dan tidak dapat tumbuh
serempak, hal ini disebabkan karena benih kelapa sawit mempunyai sifat
domansi akibat endokarpnya yang tebal dan keras, bukan disebabkan oleh
embrionya yang dorman. Selain itu menurut penelitian Nurmailah (1999),
yaitu 65 - 70%. Hal ini yang mengakibatkan biji kelapa sawit sangat
lambat berkecambah.
2. Akar
Kelapa sawit adalah tanaman monokotil yang tentunya berakar serabut.
Struktur akar terdiri dari akar primer yang tumbuh vertikal ke bawah,
merupakan perkembangan lanjut dari radicula. Anatomi akar terdiri dari
induk akar (tap-root), single fibre root dan lateral root. Yang berhubungan
langsung dengan makan adalah lateral root sedangkan yang berhubungan
dengan pembuluh adalah tap root. Selain sebagai pencari makanan akar
juga berfungsi sebagai alat respirasi.
3. Batang
Batang kelapa sawit tumbuh vertikal ke atas (fototrofi) dibungkus oleh
pangkal pelepah daun. Batang berbentuk silinderis dengan diameter 0.5 m
pada tanaman dewasa. Meristem pucuk, terletak dekat ujung batang ,
dimana pertumbuhan batang sedikit membesar. Aktivitas meristem pucuk
hanya memberikan sedikit kontribusi terhadap jaringan batang karena
fungsi utamanya menghasilkan daun dan inflorescent bunga.
4. Daun
Daun kelapa sawit memiliki pangkal pelepah daun (petiole/axil) adalah
tempat duduknya helaian daun (leaf let), terdiri dari rachis (basis folli),
tangkai daun (petiole/petioles), duri (spine), helaian anak daun (lamina),
ujung daun (apex folli), tulang daun (vein), tepi daun (margo folli), dan
daging daun (intervenium). Fungsi utama daun adalah untuk fotosintesis
dan alat respirasi. Daun sawit normal berwarna hijau tua.
5. Bunga
Kelapa sawit merupakan tanaman berumah satu (monoecius), artinya
terdapat bunga jantan dan bunga betina pada satu pohon tetapi tidak pada
tandan yang sama. Jenis kelamin bunga dapat dikenali setelah bunga
menonjol di antara ketiak pelepah daun, sebelum seludang bunga terbuka.
Cirri-ciri bunga jantan adalah berbentuk ramping (lonjong) memanjang,
daripada bunga betina. Sedangkan bunga betina berbentuk bundar (oval),
ujung kelopak bunga agak rata dan diameter bunga lebih besar. Perbedaan
bentuk bunga sangat penting untuk diketahui dalam melakukan
penyerbukan buatan (assisted pollination).
6. Buah
Anatomi buah kelapa sawit terdiri dari :
a. Kulit buah licin dan keras (epikarp atau kutikula),
b. Daging buah (mesokarp) yang terbentuk dari serabut-serabut (fibre)
dan minyak,
c. Kulit biji (cangkang); tempurung berwarna hitam dan keras
(endocarp),
d. Daging biji (endosperm) berwarna putih yang mengandung minyak,
e. Lembaga (embrio).
Berdasarkan ketebalan cangkang buah, kelapa sawit dapat dibedakan
menjadi Dura (bercangkang tebal), Pisifera (tanpa cangkang), Tenera
(bercangkang tipis). Saat ini jenis kelapa sawit yang banyak ditanam
adalah jenis Tenera yang merupakan hibrida dari Dura x Pisifera (DxP).
2.4Kultur Jaringan
Kultur jaringan adalah suatu teknik atau metode untuk mengisolasi bagian dari
tanaman, seperti protoplasma, sel, kelompok sel, jaringan dan organ kemudian
menumbuhkan bagian tersebut pada media buatan yang mengandung kaya nutrisi
dan zat pengatur tumbuh dalam kondisi aseptik, sehingga bagian-bagian tersebut
dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap kembali.
Pertumbuhan dan perkembangan tanaman dalam kultur jaringan ditentukan oleh
sejumlah faktor antara lain :
a. Faktor genetik tanaman.
b. Nutrient, seprti makro dan mikro nutrient, air, gula, dan asam amino.
c. Faktor fisik, seperti cahaya, temperature, dan pH.
d. Beberapa substansi organik seperti zat pengatur tumbuh, vitamin, senyawa
e. Kandungan oksigen.
Manfaat utama dari tehnik kutur jaringan adalah perbanyakan klon atau
perbanyakan massal dari tanaman yang sifat genetiknya identik satu sama lain.
2.5Sumber Eksplan
Penggunaan eksplan yang bersifat meristematik umumnya memberikan
keberhasilan pembentukan embrio somatik yang lebih tinggi. Sifat-sifat genetik
jaringan meristem yang stabil, memungkinkan bagi dihasilkannya tanaman baru
dengan sifat-sifat genetik yang identik dengan induknya. Stabilitas meristem ini
ditentukan oleh sejumlah faktor diantaranya sel-sel meristem memiki mekanisme
penggandaan DNA yang lebih efisien daripada sel-sel pada jaringan yang belum
terorganisasi (misalnya kalus) sehingga kemungkinan terjadinya mutasi sangat
kecil (Stafford, 1991). Eksplan yang digunakan dapat berupa aksis embrio zigotik
muda dan dewasa, kotiledon, mata tunas, epikotil maupun hipokotil
(Purnamaningsih, 2002). Ujung tunas dan ujung meristem adalah bagian paling
popular sebagai sumber eksplan untuk inisiais kultur jaringan (Ahloowali, 2002).
2.6 Embriogenesis Somatik
Embriogenesis somatik adalah proses perkembangan dimana sel-sel somatik
melalui proses restruktur untuk menghasilkan sel-sel embriogenik. Sel-sel ini
kemudian melalui serangkaian perubahan biokimia dan morfologi yang
menghasilkan pembentukan embrio somatik atau non-zigotik yang dapat berperan
dalam regenerasi tanaman. Embriogenesis somatik mewakili lintasan
perkembangan yang unik, termasuk sejumlah karakteristik dediferensiasi sel,
aktivasi pembelahan sel, reprogram proses fisiologi sel, metabolisme dan pola
ekspresi gen (Yang & Zhang, 2010). Embriogenesis somatik adalah proses
perkembangan dimana sel-sel somatik berkembang menjadi struktur yang
menyerupai embrio zigotik melalui serangkaian tahap karekteristik embriologis
tanpa fusi gamet (Jimenez et al., 2001).
Teknik embrio somatik merupakan teknik perbanyakan secara in vitro
seleksi ini didapatkan kalus yang berpotensi berkembang menjadi planlet.
Keutamaan penggunaan embriogenesis somatik menguntungkan untuk
dibudidayakan massa, program perbaikan genetik dan produksi pada sintetis bibit
(Hartman et al., 1997) dalam Zulkarnain (2011).
Embriogenesis somatik adalah proses yang menakjubkan karena struktur
bipolar pengolahan pucuk dan akar menyerupai embrio zigotik, adalah dihasilkan
dari sel somatik (Mariani et al., 1998). Suatu keuntungan yang nyata dari
embriogenesis somatik adalah embrio-embrio somatik yang dihasilkan bersifat
bipolar, yakni memiliki ujung-ujung akar dan pucuk yang diperlukan bagi
pertumbuhan tanaman lengkap (Zulkarnain, 2011).
2.7Kalus
Kalus adalah suatu kumpulan sel amorphous yang terjadi dari sel-sel jaringan
yang membelah diri secara terus menerus. Secara in vivo, kalus pada umumnya
terbentuk pada bekas-bekas luka akibat serangan infeksi mikroorganisme seperti
Agrobacterium tumefaciens, gigitan atau tusukan serangga dan nematoda.
Tujuan kultur kalus adalah untuk memperoleh dari eksplan yang diisolasi
dan ditumbuhkan dalam lingkungan terkendali. Kalus diharapkan dapat
memperbanyak dirinya (massa sel) secara terus menerus. Kalus dapat diinisiasi
dari hampir semua bagian tanaman tetapi organ yang berbeda menunjukkan
kecepatan pembelahan sel yang berbeda pula. Bagian tanaman seperti embrio
muda, hipokotil, kotiledon dan batang muda merupakan bagian yang mudah untuk
dediferensiasi dan menghasilkan kalus.
Suatu sifat yang diamati dalam jaringan yang membentuk kalus adalah
bahwa pembelahan sel tidak terjadi pada semua sel dalam jaringan asal tetapi
hanya sel dilapisan perifer yang membelah terus menerus sedangkan sel yang
berada ditengah tetap quiescent. Faktor-faktor yang menyebabkan inisiasi
pembelahan sel hanya terbatas dilapisan luar dari jaringan kalus, adalah :
a. Ketersediaan oksigen yang lebih tinggi
b. Keluarnya gas CO2
d. Penghambat yang bersifat folatik lebih cepat menguap
e. Cahaya
Kalus embriogenik mengandung bagian sel-sel meristimatik yang
dilokasikan pada permukaan kalus. Pada bagian kalus yang meristimatik akan
cepat membentuk embrio somatik ke tahap globular (Kysely & Jacobsen, 1990).
Perkembangan embrio somatik pada tanaman dikotil melalui tahap globular, hati
(heart-shaped), torpedo, dan kotiledon (Jurgens et al., 1991), sedangkan pada
tanaman monokotil melalui tahap globular, hati skutelar dan kotiledon.
Kalus yang berbentuk lunak/lembut, granular dan jaringan translucent
dimana tidak mempunyai potensial embriogenik, jaringan ini ditentukan sebagai
kalus non embriogenik dan tidak dapat beregenerasi menjadi plantlet baru. (Low
et al.,2008). Kalus embriogenik dicirikan oleh sel yang berukuran kecil,
sitoplasma padat, inti besar, vakuola kecil-kecil dan mengandung butir pati
(Purnamaningsih, 2002).
2.8 Media
Kebutuhan nutrisi untuk pertumbuhan kultur in vitro yang optimal
bervariasi antar spesies ataupun antar varietas. Bahkan, jaringan yang berasal dari
bagian tanaman yang berbeda pun akan berbeda kebutuhan nutrisinya
(Zulkarnaian, 2011). Eeuwens (1976) melaporkan bahwa medium Eeuwens (Y3)
lebih baik daripada media murashige-skoog (MS) pada inisiasi kalus tanaman
kelapa (Cocos nucifera). Modifikasi medium Eeuwens (Y3) paling sesuai untuk
regenerasi langsung maupun embriogenesis somatik dari Elaeis guineensis Jacq
“Dura” (Muniran et al., 2008). Eeuwens (1976) menyatakan bahwa media Y3
lebih baik dari pada media MS untuk inisiasi kalus pada kelapa Media Eeuwens
(Y3) mengandung natrium dan iodin yang tinggi, tetapi mengandung amonium,
nitrogen dan nitrat yang rendah dibanding media murashige-skoog (MS).
2.9 Zat Pengatur Tumbuh 2,4-Dichlorophenoxyacetic acid ( 2,4-D )
Tanaman tingkat tinggi secara endogen menghasilkan fitohormon, senyawa ini
jaringan, dan organ tanaman menuju arah diferensiasi tertentu (Pierik, 1997).
Senyawa-senyawa lain yang memiliki karekteristik yang sama dengan hormon,
tetapi diproduksi secara eksogen, dikenal dengan nama zat pengatur tumbuh.
Kultur jaringan merupakan manipulasi pertumbuhan suatu tumbuhan dalam
kondisi yang terkontrol dengan baik dan penambahan zat pengatur tumbuh seperti
auksin serta sitokinin berperan penting dalam manipulasi ini. Kebanyakan eksplan
menghasilkan sejumlah (endogenus) auksin dan sitokinin.
Berdasarkan kebutuhan zat pengatur tumbuh untuk membentuk kalus,
jaringan tanaman digolongkan dalam empat kelompok: a) Jaringan tanaman yang
membutuhkan hanya auksin selain gula dan garam-garam mineral untuk dapat
membentuk kalus umbi artichoke. b) Jaringan yang memerlukan auksin dan
sitokinin selain gula dan garam mineral. c) Jaringan yang tidak perlu auksin dan
sitokinin, hanya gula dan garam mineral seperti jaringan kambium d) Jaringan
yang hanya membutuhkan sitokinin, gula dan garam mineral seperti parenkim
dan xylem akar turnip.
Didalam teknik kultur jaringan, kehadiran zat pengatur tumbuh sangat
nyata pengaruhnya (Zulkarnain, 2011). Pierik (1997) menyatakan bahwa pada
umumnya auksin meningkatkan pemanjangan sel, pembelahan sel, dan
pembentukan akar adventif. Auksin berpengaruh pula untuk menghambat
pembentukan tunas adventif dan tunas aksilar, namun kehadirannya dalam
medium kultur dibutuhkan untuk meningkatkan embriogenesis somatik pada
kultur suspensi sel. Konsentrasi auksin yang rendah akan meningkatkan akar
adventif, sedangkan auksin konsentasi tinggi akan merangsang pembentukan
kalus dan menekan morfogenesis (Smith, 1992). Pada induksi kalus embriogenik,
kultur umumnya ditumbuhkan di medium yang mengandung auksin yang
mempunyai aktifitas kuat. Dari berbagai hasil penelitian menunjukkan 2,4
Dichlorophenoxyacetic acid merupakan auksin yang efektif untuk induksi kalus
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilakukan di Laboratorium Kultur Jaringan Fakultas MIPA,
Universitas Sumatera Utara, Medan. Waktu penelitian dimulai bulan Juni hingga
bulan Desember 2013.
3.2 Bahan dan Alat
Eksplan yang dipakai adalah dari bagian apikal bud kelapa sawit Elaeis
guineensis Jacq. Var. Tenera yang berumur 8 bulan. Bibit kelapa sawit berasal
dari hasil zigotik di PPKS MARIHAT. Bahan kimia yang digunakan adalah
komponen penyusun media Eeuwens (Y3) , zat pengatur tumbuh 2,4
Dichlorophenoxyacetic acid (2,4-D). Larutan HCl 0,1 N dan NaOH 0,1 N
digunakan untuk mendapatkan pH 6. Untuk sterilisasi digunakan alkohol 70%,
Fungisida, Tween 20, Betadine, larutan Natrium hipoklorit 1,0% dan 0,5%.
Peralatan yang digunakan adalah autoklaf, laminar air flow,cawan petri, lampu
spiritus, gelas piala, pipet, pinset, tangkai skalpel dan pisau skalpel untuk
keperluan penanaman eksplan ke media.
3.3Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 2 faktorial,
yaitu:
Faktor 1 : Penambahan ZPT 2,4-D
A1 : Konsentrasi 110 mg/L
A2 : Konsentrasi 120 mg/L
Faktor 2 : Posisi Sumber Eksplan
A : Apeks
M : Median
B : Basal
Sehingga diperoleh kombinasi 9 perlakuan untuk masing-masing kelompok
percobaan dengan masing-masing ulangan sebanyak 8 kali (Tabel 3.1). Rincian
kombinasi perlakuan sebagai berikut:
A1A A1M A1B
A2A A2M A2B
A3A A3M A3B
Tabel 3.1. Rancangan Plot Perlakuan Posisi Eksplan dengan Konsentrasi Zat Pengatur Tumbuh.
beberapa titik pertumbuhan dan diberi angka pemetaan yaitu 1) apikal bud ujung
(Apex), 2) apikal bud tengah (middle), dan 3) apikal bud pangkal (Basal) dengan
3.4.1 Pembuatan media
Media yang digunakan adalah media Eeuwens (Y3), dimana
masing-masing unsur hara makro, mikro, vitamin dan zat pengatur tumbuh (komposisi
lengkap media Eeuwens (Y3) dapat dilihat pada Lampiran 2. Semua larutan stok
media yang akan dibuat dimasukkan kedalam labu takar, dilarutkan dengan
penambahan aquadest sebanyak 1 L, dan diberi penambahan zat pengatur tumbuh,
selanjutnya penambahan 30 g/L gula. Setelah semua unsur-unsur larut kemudian
dikalibrasi pada pH 6 dipanaskan sampai hampir mendidih selanjutnya diberi
penambahan bacto agar sebanyak 7 g/L aduk larutan selama 2-3 menit sampai
medium tampak bening, setelah itu diberi penambahan arang aktif sebanyak 2 g/L
aduk larutan hingga merata, tahap berikutnya larutan dimasukkan kedalam botol
kultur masing-masing sebanyak 10 ml, selanjutnya media disterilisasi
menggunakan autoklaf 1210C selama 15 menit. Setelah suhu media sama dengan
suhu kamar maka simpanlah media didalam ruangan stok. Pembuatan media
dilakukan satu minggu sebelum penanaman eksplan. (Eewuen, 1976)
3.4.2 Sterilisasi Eksplan
Sterilisasi eksplan menggunakan metode Zulkarnain (2009) yang
dimodifikasi. Eksplan berupa apical bud kelapa sawit dibersihkan dengan air
mengalir dan direndam dalam detergen selama + 10 menit, kemudian dibilas
dengan akuades steril hingga bersih. Eksplan dishaker dalam larutan fungisida
0,2% yang diberi 200 µL tween 80® selama 30 menit. Selanjutnya dibilas dengan
akuades steril. Eksplan direndam dalam larutan antibiotik (Betadine®) selama 10
menit dan dibilas dengan akuades steril. Bahan tanaman dimasukkan ke dalam
larutan Na-hipoklorit 1,0% selama 5 menit dan dibilas dengan akuades steril.
Tahap selanjutnya bahan tanaman direndam dalam larutan HgCl2 0,1% selama 30
menit, dan dibilas tiga kali dengan akuades steril masing-masing 5 menit. Eksplan
steril dikeringkan di atas cawan petri steril yang berisi kertas saring. Eksplan siap
3.4.3 Analisis Histologi
Kalus embriogenik yang terbentuk selanjutnya dilakukan analisis histologi
dengan menggunakan metode paraffin yang terdiri dari:
3.4.3.1 Fiksasi
Fiksasi dilakukan dengan cara setiap sampel direndam dalam larutan
Formalin 40%, Alkohol 70%, asam asetat glacial dengan perbandingan 1 : 8 : 1
(FAA) dengan komposisi 10 ml formalin, 80 ml alkohol, dan 10 ml asam asetat
glacial dalam setiap 100 ml larutan direndam minimal selama 24 jam dan
diletakkan dalam vaccum pump. Tujuan perendaman dengan FAA adalah untuk
mematikan sel pada sampel secara cepat akan tetapi seolah-olah sampel seperti
kondisi masih segar (masih hidup).
3.4.3.2 Dehidrasi
Tujuan dehidrasi untuk menghilangkan air yang ada dalam jaringan
tanaman, dilanjutkan dengan penghilangan alkohol. Dehidrasi dilakukan dengan
merendam sampel secara bertahap melalui seri alkohol bertingkat dari alkohol
70% kemudian alkohol 95% ( sampel masih didalam vaccum) lalu alkohol
absolute kemudian sampel dimasukkan kedalam campuran alkohol dan xylol
dengan perbandingan 3:1, 1:1, 1:3 secara berturut-turut kemudian sampel
dimasukkan ke dalam larutan xylol I dan xylol II. Masing-masing tahap dehidrasi
dilakukan selama minimal 3 jam.
3.4.3.2 Infiltrasi
Infiltasi adalah memasukan parafin secara perlahan-lahan kedalam
rongga-rongga yang kosong dalam jaringan tanaman agar tidak terjadi kerusakan sampel
pada saat penyayatan. Pada tahap ini, sampel yang telah direndam dalam xylol
diberi serbuk parafin secara perlahan-lahan sampai jenuh. Bahan yang digunakan
adalah xilol dan parafin yang sudah cair dengan perbandingan 3 : 1; 2 : 2; 1 : 3; 1 :
3 (vol/vol); berturut-turut sebanyak tiga kali selama 3 jam dan 0 : 4 (vol/vol)
550C setelah kegiatan tersebut selesai, semua parafin diganti dengan parafin murni
pada suhu 600C. perendaman dengan perafin murni dilakukan minimal selama
satu hari.
3.4.3.4 Embedding
Embedding adalah penanaman sampel yang sudah diproses sebelumnya
kedalam blok parafin untuk mempermudah penyayatan. Penanaman dilakukan
pada kotak dari cetakan kertas. Sampel yang sudah difiksasi dimasukkan kedalam
cetakan yang telah berisi parafin cair dengan menggunakan pinset. Setelah parafin
mengeras sampel dikeluarkan dari cetakan.
3.4.3.5 Penyayatan
Penyayatan dilakukan dengan menggunakan mikrotom manual. Blok
parafin yang sudah jadi dipasang pada pemegang yang terdapat pada mesin
mikrotom putar. Sisi horizontal dari permukaan parafin dibuat sejajar dengan
pisau penyayat. Pemegang dapat diatur dengan skrup sedemikian rupa sehingga
ketebalan sayatan sesuai dengan yang dikehendaki. Sayatan yang baik apabila
menghasilkan bentuk pita tipis yang lurus dan tidak terputus-putus.
3.4.3.6 Penempelan Sayatan Pada Objek Gelas
Sayatan yang baik ditempelkan pada objek gelas menggunakan zat perekat
putih telur Meyer (putih telur ditambah air dan gliserin dalam volume yang sama
dan Kristal thinol). Setelah penempelan dilakukan, objek gelas diletakkan pada
hot plate dengan suhu 400C agar sayatan melekat dengan baik, dan sebagian
parafin yang mengisi jaringan akan mencair untuk mempercepat proses
penjernihan.
3.4.3.7 Penjernihan
Penjernihan bertujuan untuk menghilangkan parafin dari jaringan dengan
dengan perbandingan 100% xilol, 1 : 1 xilol-alkohol, dan alkohol secara bertahap
100%, 95%, 70%, 50%, 30% dan aquades selama 3 menit.
3.4.3.8 Pewarnaan
Pewarnaan bertujuan agar bagian-bagian tertentu dari sel atau jaringan
menjadi lebih jelas sehingga mudah untuk diamati. Tahapan pewarnaan meliputi
preparat yang sudah jernih dimasukkan ke dalam larutan pewarna Safranin 1%
selama 12 jam. Selanjutnya preparat dicuci dengan aquadest sampai warna
benar-benar hilang. Dehidrasi pada 30%, 50%, 70%, dan 95% ,etanol 2-5 menit /
langkah. Kemudian preparat dimasukkan kedalam larutan etanol 95% ditambah
larutan Fast Green 2% selama 30 detik, bilas dengan etanol 100% sebanyak dua
kali masing-masing selama 2 menit. Selanjutnya preparat didalam larutan karbol
xilol atau campuran metal salisilat dan xilol ( 1:1 ) selama 5 detik untuk
melepaskan sisa-sisa air yang menempel pada preparat. Kemudian bilas dengan
xilol 100% sebanyak dua kali. Selanjutnya preparat ditutup dengan entellan atau
Canada balsm dan diamati dengan mikroskop.
3.5 Parameter yang diamati
Pada penelitian ini parameter yang akan diamati adalah sebagai berikut :
1. Saat terbentuk kalus primer ( hari setelah tanam / HST)
2. Persentase kultur membentuk kalus primer
Keterangan : a = jumlah eksplan yang menghasilkan kalus dimedium padat
b = jumlah seluruh eksplan
3. Saat terbentuknya kalus embriogenik ( hari setelah tanam / HST )
4. Persentase kalus embriogenik
Keterangan : a = jumlah seluruh kalus embriogenik yang terbentuk
b = jumlah seluruh eksplan
6. Berat kering kultur (gram)
7. Bagian dari apikal bud yang paling baik sebagai sumber kalus.
8. Morfologi kalus :
a) Embrionik : berwarna kuning, padat, nodular terdiri dari embrio
berwarna putih susu
b) Non embrionik : berwarna kuning kecoklatan, granular dan halus
9. Analisa histologi kalus
a) Kalus nodular padat
b) Sel-sel meristem yang berkembang
c) Karakteristik sel embriogenik
3.6 Analisis Data
Data yang telah diperoleh, dianalisis secara analisis deskriptif dan analisis
inferensial ANOVA ( analisis sidik ragam) dengan menggunakan SPSS
(Statistical Product and Service Solution) versi 19. Apabila ada perbedaan yang
nyata (p<0,05) maka dilanjutkan dengan uji DUNCAN.
Analisi data menggunakan rumus dibawah ini :
Yijk = μ + αi + βj + ( αβ ) ij + Ԑ
ijk
(αβ) ij = pengaruh interaksi taraf ke i dari faktor posisi ekplan yang berbeda dan taraf ke j dari faktor taraf konsentrasi yang berbeda
BAB IV
HASIL DAN PEMBAHASAN
4.1 Waktu Pembentukan Kalus Primer
Pada penelitian ini eksplan apikal bud dari berberapa segmen posisi yaitu apikal,
median dan basal dengan zat pengatur tumbuh 2,4-D dan penambahan arang aktif
sebanyak 2 gr/L dalam medium Y3 mampu menginduksi kalus primer. Arang
aktif digunakan karena memiliki pengaruh yang positif dalam meminimalkan
oksidasi dan adsorpsi senyawa toxin fenolik yang dilepaskan oleh eksplan, dan
sehingga mampu meningkatkan induksi kalus embriogenik dan embryogenesis
somatik (Thuxar et al., 2012).
Data pengamatan saat terbentuknya kalus dapat dilihat pada Lampiran 4.
Dari hasil pengamatan posisi segmen basal pada konsentrasi 2,4-D 130 mg/L
menunjukkan pertumbuhan kalusnya di hari ke 57 setelah inokulasi, sementara
dikonsentrasi yang sama tetapi pada posisi segmen median (130 mg/L 2,4-D)
pertumbuhan kalus dimulai pada hari ke 65, sedangkan di posisi segmen apikal
(130 mg/L 2,4-D) di hari ke 73. Pada konsentrasi 2,4-D 120 mg/L posisi segmen
basal lebih dahulu tumbuh kalus pada hari ke 67 dibandingkan pada segmen
median(120 mg/L 2,4-D) yang tumbuh pada hari ke 82 dan segmen apikal (120
mg/L 2,4-D) tumbuh kalus pada hari ke 86 setelah inokulasi. Sementara pada
konsentrasi 2,4-D 110 mg/L pertumbuhan kalus pada posisi segmen basal di hari
ke 71, pada posisi segmen median (110 mg/L 2,4-D) pertumbuhan kalus terjadi di
hari ke 96 dan pada posisi apikal (110 mg/L 2,4-D) tidak menunjukkan
pertumbuhan kalus. Dibutuhkan waktu dan zat pengatur tumbuh dalam
menginduksi kalus. Hasil penelitian menunjukkan konsentrasi 2,4-D 130 mg/L
kalus primer. Hubungan rata-rata saat terbentuknya kalus pada posisi eksplan
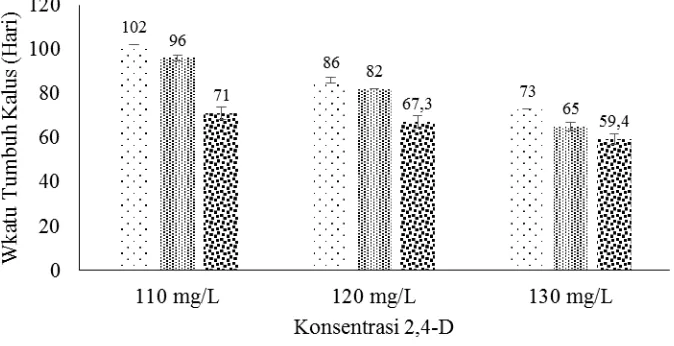
dengan pengaruh zat pengatur tumbuh dapat dilihat pada Gambar 4.1.
Gambar 4.1. Hubungan Rata-Rata Saat Terbentuknya Kalus Primer Pada Posisi Eksplan Dengan Zat Pengatur Tumbuh 2,4-D
Perkembangan pembentukan kalus primer pada eksplan apikal bud terlihat
tidak merata antar posisi eksplan. Pada posisi segmen basal terlihat lebih cepat
membentuk kalus dibandingkan pada segmen median dan segmen apikal. Dari
hasil penelitian ini menunjukkan bahwa zat pengatur tumbuh yang diberikan pada
tiap-tiap posisi eksplan yang berbeda mempengaruhi terhadap saat terbentuknya
kalus. Zat pengatur tumbuh juga menstimulasi pembelahan dan perkembangan sel,
kadang-kadang jaringan atau eksplan dapat memproduksi zat pengatur tumbuh
sendiri (endogen), tetapi biasanya zat pengatur tumbuh harus ditambahkan dari
luar ke medium kultur jaringan untuk pertumbuhan dan perkembangan dari kultur
(Beyl, 2005). Efek dari zat pengatur tumbuh sangat tergantung pada jenis dan
kosentrasi yang digunakan dan jaringan target (Beyl, 2005). Auksin berperan pada
proses perkembangan tanaman, merangsang pemanjangan dan pembesaran sel,
dominan apikal, induksi akar dan embrio somatik (Beyl, 2005).
Dari persentase eksplan membentuk kalus adalah sebesar 23,61% yaitu sebanyak
17 botol dari 72 botol, dimana pembentukan kalus rata-rata terjadi pada
minggu ke 8 setelah penanaman / pengkulturan. Hasil pengamatan menunjukkan
bahwa zat pengatur tumbuh 2,4-D yang diberikan mempengaruhi lama waktu /
kecepatan terbentuknya kalus. Dengan adanya rangsangan dan zat pengatur
tumbuh endogen atau eksogen menyebabkan metabolisme sel menjadi aktif
sehingga terbentuk kalus.
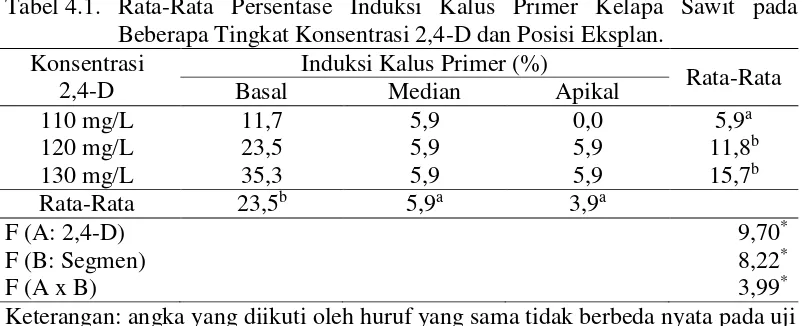
Berdasarkan data pengamatan terhadap saat terbentuknya kalus dari setiap
posisi segmen eksplan terlihat pada Lampiran 4. Pada posisi segmen basal
eksplan, hasil penelitian menunjukkan persentase induksi kalus primer tertinggi
dengan nilai rata-rata sebesar 23,5% jika dibandingkan pada segmen median dan
apikal dengan persentase berturut-turut sebesar 5,9% dan 3,9%. Hasil
menunjukkan perbedaan persentase sangat jauh, hal tersebut dikarenakan pada
segmen basal terdiri dari jaringan meristem dimana pada jaringan ini selalu
mengalami pembelahan secara terus menerus untuk menambah jumlah sel. Bagian
meristem biasanya terletak pada bagian dalam dan terlindung oleh pelepah yang
telah tua pada ujung batang. Umumnya bagian tanaman yang digunakan sebagai
eksplan adalah jaringan muda yang sedang tumbuh aktif dan mempunyai daya
generasi lebih tinggi, sel-selnya masih aktif membelah diri dan relatif lebih bersih
(Yusnita2003). Pertumbuhan kalus dicerminkan oleh pertambahan berat basah dan
berat kering kalus. Rata-rata bobot basah kalus dan bobot kering kalus tertinggi
pada perlakuan 130mg/l 2,4-D pada posisi segmen basal.
4.3 Pengaruh Konsentrasi 2,4-D dan Posisi Eksplan pada Induksi Kalus Primer
Dari hasil pengamatan interaksi antara tingkat konsentrasi zat pengatur tumbuh
2,4-D terhadap posisi eksplan dapat dilihat pada Lampiran . Dari hasil
pengamatan pembentukan kalus primer pada tingkat konsentrasi 2,4-D 130 mg/L
memberikan hasil tertinggi terhadap induksi kalus primer dengan nilai
konsentrasi 2,4-D 120 mg/L dan 2,4-D 110 mg/L dengan nilai persentase rata-rata
sebesar 11,8% dan 5,9% dalam menginduksi kalus primer.
Dari Analisis sidik ragam dapat dijelaskan bahwa tingkat konsentrasi zat
pengatur tumbuh mempengaruhi secara nyata terhadap terbentuknya kalus primer
yaitu dengan nilai sig. 0.006 < 0.001 atau p < 0.001 dengan nilai F hitung 3.991.
Sehingga terdapat interaksi antara konsentrasi zat pengatur tumbuh 2,4-D (faktor
A) dengan posisi eksplan (faktor B) terhadap terbentuknya kalus primer.
Berdasarkan hasil uji DMRT (Duncan Multiple Range Test) saat
terbentuknya induksi kalus primer terhadap konsentrasi 2,4-D diperoleh hasil
yaitu pada konsentrasi 2,4-D 120 mg/L dan 130 mg/L memberikan pengaruh yang
sama terhadap induksi kalus primer, tetapi konsentrasi 2,4-D 110 mg/L berbeda
nyata dengan konsentrasi 120 mg/l dan 130 mg/L. Pada konsentrasi 2,4-D 110
mg/L memberikan pengaruh yang paling kecil terhadap induksi kalus primer.
Sedangkan, konsentrasi 2,4-D 130 mg/L memberikan pengaruh paling baik untuk
induksi kalus primer. Hal ini sesuai dengan pernyataan Zulkarnaen (2011) yang
menyatakan didalam teknik kultur jaringan, kehadiran zat pengatur tumbuh sangat
nyata pengaruhnya. Bahkan, Pierik (1997) menyatakan bahwa sangat sulit untuk
menerapkan teknik kutur jaringan pada upaya perpanyakan tanaman tanpa
melibatkan zat pengatur tumbuh. Kontribusi 2,4-D secara signifikan mempercepat
dalam menginduksi kalus dan kalus embriogenik pada kelapa sawit (Abdullah et
al., 2005, Eeuwens et al., 2002). Terlebih lagi, 2,4-D mempunyai dua efek dalam
kultur in vitro dengan bertindak secara langsung sebagai auksin dan sebagai faktor
tekanan (Feher et al., 2003).
Berdasarkan hasil Uji DMRT (Duncan Multiple Range Test) saat
terbentuknya induksi kalus primer terhadap posisi eksplan diperoleh hasil yaitu
posisi segmen apikal dan segmen median memberikan pengaruh yang sama
terhadap induksi kalus primer, tetapi posisi segmen basal memberikan pengaruh
yang berbeda nyata terhadap segmen median dan segmen apikal. Daerah basal
memberikan pengaruh yang paling baik terhadap induksi kalus primer. Hal ini
disebabkan pada segmen basal terdiri dari jaringan meristem dimana
menambah jumlah sel. Bagian meristem biasanya terletak pada bagian dalam pada
ujung batang dan ujung akar. Hal yang sama pada penelitian Thuzhar et al.,
(2012) menyatakan segmen basal terdiri dari meristem apikal dan jaringan daun
termuda, sel-sel disegmen ini secara aktif membelah, sehingga mereka memiliki
potensi yang lebih besar untuk memperoleh kemampuan embriogenik.
Penggunaan jaringan meristem dalam kultur jaringan sering digunakan untuk
mendapatkan tanaman yang bebas virus, bebasnya jaringan meristem dari infeksi
virus disebabkan sedikitnya vakuola yang dimiliki oleh sel-sel meristem
(Zulkarnain, 2011). Sifat-sifat genetik jaringan meristem yang stabil,
memungkinkan dihasilkannya tanaman baru dengan sifat-sifat genetik yang
identik dengan induknya, alasan inilah yang membuat kultur jaringan meristem
penting dalam upaya perbanyakan tanaman secara in vitro.
Tabel 4.1. Rata-Rata Persentase Induksi Kalus Primer Kelapa Sawit pada Beberapa Tingkat Konsentrasi 2,4-D dan Posisi Eksplan.
Konsentrasi
Keterangan: angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada uji p< 0,05 (DMRT). * = berbeda nyata
4.4 Waktu Pembentukan Kalus Embriogenik
Perbanyakan tanaman kelapa sawit dengan kultur jaringan meliputi beberapa
tahap, yaitu inisiasi kalus embriogenik (EC), proliferasi dari kalus embriogenik
(EG), dan pembentukan tunas dan akar. Inisiasi kalus embriogenik yang
berlangsung kira-kira tiga bulan, kemudian disubkultur agar terjadi proliferasi dari
kalus embriogenik tersebut. Setelah terjadi proliferasi embriogenik, dilanjutkan
yang selanjutnya disubkultur pada media padat untuk pembentukan tunas dan
perakaran sehingga terbentuk plantlet (Wong et al., 1999).
Terdapat dua macam kalus yang terbentuk dalam kultur in vitro suatu
tanaman, yaitu (1) kalus embriogenik dan (2) kalus non embriogenik. Kalus
embriogenik adalah kalus yang mempunyai potensi untuk beregenerasi menjadi
tanaman melalui organogenesis atau embriogenesis. Sedangkan kalus non
embriogenik adalah kalus yang mempunyai kemampuan sedikit atau tidak
mempunyai kemampuan untuk beregenerasi menjadi tanaman. Kalus embriogenik
yang mempunyai struktur kompak, tidak tembus cahaya dan pertumbuhan relatif
lambat merupakan tipe yang dikehendaki dalam seleksi in vitro tanaman.
Kemampuan regenerasi kalus umumnya menurun sesuai lamanya jaringan
dikulturkan, namun beberapa kultur kalus kemampuan regenerasinya dapat
bertahan dalam jangka waktu relatif panjang. Kalus embriogenik dicirikan oleh sel
yang berukuran kecil, sitoplasma padat, inti besar, vakuola kecil-kecil dan
mengandung butir pati (Purnamaningsih, 2002).
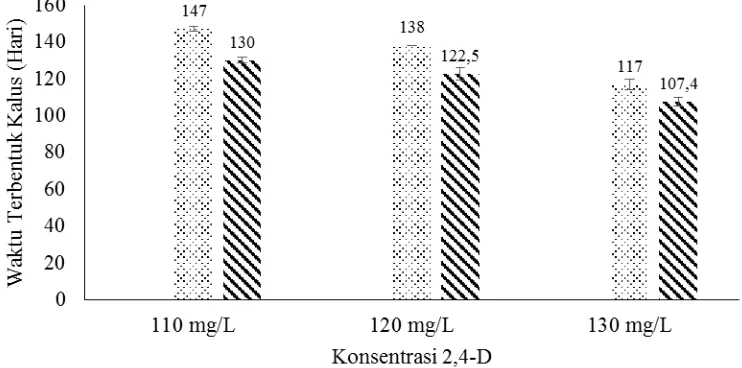
Data pengamatan saat terbentuknya kalus embriogenik dapat dilihat pada
Lampiran 7. Hasil pengamatan posisi basal pada konsentrasi 2,4-D 130 mg/L
menunjukkan pertumbuhan kalus embriogenik di hari ke 107 setelah inokulasi,
sementara dikonsentrasi yang sama tetapi pada posisi median tumbuhnya kalus
embriogenik dimulai pada hari ke 115, sedangkan di posisi segmen apikal tidak
mengalami pertumbuhan kalus embriogenik. Pada konsentrasi 2,4-D 120 mg/L
posisi segmen basal lebih dahulu tumbuh kalus embriognik pada hari ke 118
dibandingkan pada segmen median yang tumbuh pada hari ke 138 setelah
inokulasi dan apikal tidak tumbuh kalus embriogenik. Sementara pada konsentrasi
2,4-D 110 mg/L pertumbuhan kalus pada posisi basal di hari ke 128 setelah
inokulasi. Pada posisi segmen apikal tidak menunjukkan pertumbuhan kalus
dimungkinkan akibat rusaknya meristem sewaktu diisolasi atau dikarenakan
perbedaan kemampuan jaringan menyerap unsur hara dan zat pengatur tumbuh
dalam media inisiasi. Hubungan rata-rata saat terbentuknya kalus embriogenik
pada posisi eksplan terhadap pengaruh zat pengatur tumbuh dapat dilihat pada
Gambar 4.2. Hubungan Rata-Rata Saat Terbentuknya Kalus Embriogenik Pada Posisi Eksplan Dengan Zat Pengatur Tumbuh 2,4-D
Embrio somatik terbentuk dari perkembangan kalus primer segmen basal
yang sebelumnya telah mengalami subkultur sebanyak 3 kali dengan
menggunakan medium Y3 yang sama. Kasi dan Sumaryono., (2008) menyatakan
proliferasi pada kalus embriogenik sangat baik dilakukan pada interval waktu 4
minggu, hampir seluruh kalus embriogenik berkembang menjadi embrio somatik
setelah terjadi tiga kali subkultur dengan menggunakan medium inisiasi kalus
embriogenik yang sama.
4.5 Persentase Kalus Embriogenik (%)
Dari data pengamatan terhadap saat terbentuknya kalus embriogenik pada
Lampiran 7. Berdasarkan hasil pengamatan yang dilakukan, persentase kultur
yang membentuk kalus embriogenik adalah sebesar 18,05% yaitu sebanyak 13
botol dari 72 botol. Pengamatan perkembangan pembentukan kalus embriogenik
pada eksplan apikal bud pada segmen basal dan segmen median terlihat
membentuk kalus embriogenik dibandingkan pada segmen apikal yang tidak
membentuk kalus embriogenik. Pada posisi eksplan, hasil penelitian menunjukkan
eksplan apikal bud, sedangkan pada posisi segmen median sebesar 7,7%
(Lampiran 7). Hal ini dapat disebabkan pada segmen basal dan median merupakan
bagian yang meristematis.
Secara histologi segmen basal bersifat meristem yang tandai dengan ruang
antar sel lebih rapat, mempunyai inti yang jelas, menyerap warna kuat dapat
dilihat pada Gambar 4.6 a. Dibutuhkan konsentrasi yang tepat untuk segmen
apikal dikarenakan perbedaan kemampuan jaringan menyerap unsur hara dan zat
pengatur tumbuh dalam media inisiasi. sehingga kalus yang dihasilkan tidak
embriogenik yang ditandai dengan tekstur kalus yang cenderung kompak (Ibrahim
et al., 2010). Pembentukan kalus merupakan salah satu indikator adanya
pertumbuhan dalam kultur in vitro, lama atau tidaknya eksplan membentuk kalus
tergantung dari bagian tanaman yang dipakai sebagai eksplan serta komposisi
media induksi yang digunakan (Lizawati, 2012). Pada kultur jaringan, sumber dan
umur eksplan merupakan faktor yang sangat penting dalam menentukan
kemampuan kalus menghasilkan embrio somatik (Stone et al., 2002).
4.6 Pengaruh Konsentrasi 2,4-D Terhadap Induksi Kalus Embriogenik
Induksi kalus embriogenik yang dipengaruhi zat pengatur tumbuh 2,4 D yang
diuji pada konsentrasi 110 mg/ L pada medium Y3 menghasilkan 5,1% dalam
menginduksi kalus embriogenik, untuk konsentrasi 120 mg/L 2,4-D menghasilkan
12,8% dan respon terbaik pada konsentrasi 130 mg/L 2,4-D menghasilkan 15,4%
dalam menginduksi kalus embriogenik yang berasal dari segmen basal eksplan
apikal bud kelapa sawit jenis Tenera.
Berdasarkan analisis sidik ragam dapat dijelaskan bahwa tingkat
konsentrasi zat pengatur tumbuh mempengaruhi secara nyata terhadap
terbentuknya kalus embriogenik yaitu dengan nilai sig. 0.000 < 0.001 atau p <
0.001 dengan nilai F hitung 11.261. Pada induksi kalus embriogenik, kultur
umumnya ditumbuhkan di medium yang mengandung auksin yang mempunyai
aktifitas kuat. Dari berbagai hasil penelitian menunjukkan 2,4
Dichlorophenoxyacetic acid (2,4-D) merupakan auksin yang efektif untuk induksi
embriogenik yang di proliferasi menjadi embrio somatik diperlukan zat pengatur
tumbuh 2,4-D. Berdasarkan hasil uji DMRT (Duncan Multiple Range Test) saat
terbentuknya kalus embriogenik terhadap konsentrasi 2,4-D diperoleh hasil yaitu
konsentrasi 120 mg/L dan 130 mg/L memberikan pengaruh yang sama terhadap
induksi kalus embriogenik, tetapi berpengaruh berbeda nyata dengan konsentrasi
2,4-D 110 mg/L. Pada konsentrasi 2,4-D 120 mg/L dan 130 mg/L memberikan
pengaruh paling baik terhadap induksi kalus embriogenik. Sedangkan pada
konsentrasi 2,4-D 110 mg/L memberikan pengaruh paling kecil terhadap induksi
kalus embriogenik.
Tabel 4.2. Pengaruh Posisi Eksplan dan Konsentrasi 2,4-D Terhadap Persentase Induksi Kalus Embriogenik.
Keterangan: angka yang diikuti oleh huruf yang sama tidak berbeda nyata pada uji p< 0,05 (DMRT)
4.7 Berat Basah Kalus Embriogenik
Hasil penelitian menunjukkan bahwa berat basah kultur kalus embriogenik
menunjukkan respon yang beragam. Data pengamatan berat basah kalus dapat
dilihat pada Lampiran 17 dapat dilihat bahwa perlakuan zat pengatur tumbuh
2,4-D memberikan pengaruh yang berbeda nyata terhadap berat basah kalus
embriogenik. Untuk hasil uji rata-rata berat basah kalus embriogenik dengan
kombinasi zat pengatur tumbuh 2,4-D yang berbeda konsentrasi dapat dilihat dari
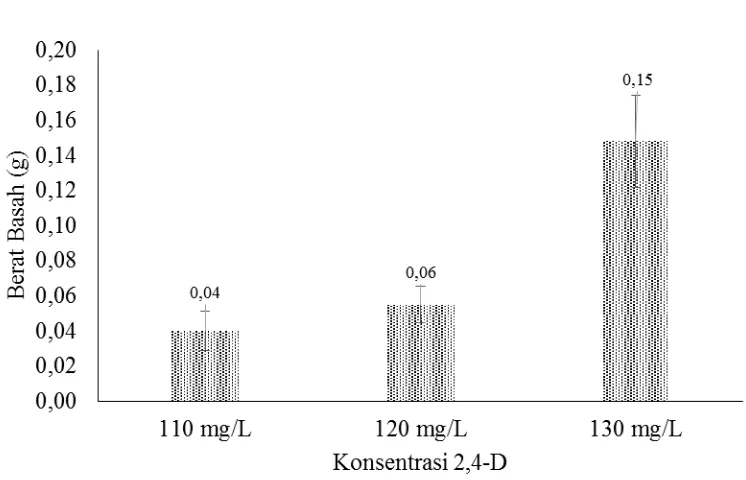
Gambar 4.3. Histogram Berat Basah Kalus pada Posisi Segmen Basal dengan Taraf Konsentrasi 2,4-D yang Berbeda
Dari Gambar diatas dapat dilihat bahwa perlakuan posisi segmen basal
dengan konsentrasi 2,4-D 130 mg/L memberikan hasil tertinggi dengan nilai
rata-rata berat basah kalus sebesar 0,148 g sedangkan perlakuan posisi segmen basal
dengan konsentrasi 2,4-D 110 mg/L memberikan hasil terendah dengan nilai
rata-rata berat basah kalus sebesar 0,04 g. Hasil pengamatan tersebut dapat dilihat pada
hasil uji analisis sidik ragam pada Lampiran 18.
Berdasarkan analisis sidik ragam dapat dijelaskan bahwa tingkat
konsentrasi 2,4-D berpengaruh nyata terhadap berat basah kalus yaitu dengan
nilai sig .000 < 0.001 atau p < 0.001 dengan nilai F hitung 96,452. Pada
konsentrasi 2,4-D 130 mg/L memberikan hasil tertinggi terhadap berat basah
kultur kalus embriogenik hal ini disebabkan konsentrasi zat pengatur tumbuh yang
sesuai dan tepat dalam memacu pembesaran dan perbanyakan sel sehingga berat
kultur menjadi meningkat. Selain itu tekanan turgor menyebabkan pemanjangan
dan pembesaran sel. Hal inilah yang menyebabkan perbedaan peningkatan berat
basah kalus, sebab respon setiap sel (berupa tekanan turgor) terhadap kondisi